Method Article
Aislamiento, cultivo y caracterización de células primarias de Schwann, queratinocitos y fibroblastos del prepucio humano
En este artículo
Resumen
El estudio de la cicatrización de heridas asociada con la lesión musculoesquelética a menudo requiere la evaluación de las interacciones in vitro entre las células de Schwann (SC), los queratinocitos y los fibroblastos. Este protocolo describe el aislamiento, cultivo y caracterización de estas células primarias del prepucio humano.
Resumen
Este protocolo describe los métodos de aislamiento, las condiciones de cultivo y la caracterización de células primarias humanas con alto rendimiento y viabilidad utilizando la disociación enzimática rápida de la piel. Los queratinocitos primarios, los fibroblastos y las células de Schwann se extraen del prepucio del recién nacido humano, que está disponible siguiendo los procedimientos estándar de atención. La piel extraída se desinfecta y la grasa subcutánea y el músculo se eliminan con un bisturí. El método consiste en la separación enzimática y mecánica de las capas epidérmicas y dérmicas, seguida de una digestión enzimática adicional para obtener suspensiones unicelulares de cada una de estas capas de la piel. Finalmente, las células individuales se cultivan en medios de cultivo celular apropiados siguiendo los protocolos estándar de cultivo celular para mantener el crecimiento y la viabilidad durante semanas. Juntos, este protocolo simple permite el aislamiento, el cultivo y la caracterización de los tres tipos de células a partir de una sola pieza de piel para la evaluación in vitro de modelos de nervios de la piel. Además, estas células se pueden usar juntas en cocultivos para medir sus efectos entre sí y sus respuestas al trauma in vitro en forma de arañazos realizados robóticamente en el cultivo asociado con la cicatrización de heridas.
Introducción
Las células primarias derivadas de tejido vivo y cultivadas en condiciones in vitro se asemejan mucho al estado fisiológico1, lo que las convierte en un modelo ideal para investigar procesos fisiológicos y fisiopatológicos. La piel contiene múltiples tipos de células, incluyendo queratinocitos, fibroblastos, sebocitos, melanocitos y células de Schwann (SC), que pueden aislarse y cultivarse para experimentos in vitro . No se han descrito métodos para aislar y cultivar queratinocitos, fibroblastos y SC, a partir de una sola pieza de piel. El objetivo de este protocolo es doble: 1) establecer un método confiable y reproducible para el aislamiento y cultivo de SC dérmicos y 2) utilizar un método eficiente y robusto para el aislamiento de queratinocitos, fibroblastos y SC de un solo prepucio humano.
En la actualidad, existen protocolos establecidos para aislar queratinocitos cutáneos 2,3,4 y fibroblastos 5,6. Estos estudios describen el aislamiento de queratinocitos, fibroblastos o ambos de la piel, pero ningún protocolo aborda cómo establecer cultivos de SC primarios de piel humana. Estudios recientes sugieren que los SC neuronales modulan los procesos celulares de queratinocitos y fibroblastos y regulan las funciones fisiológicas normales de la piel7. Por lo tanto, los SC son críticos para la homeostasis de la piel y contribuyen sustancialmente a la fisiología reguladora que influye en el comportamiento de los tipos de células de la piel vecinas presentes8. Por lo tanto, un protocolo que permita el aislamiento de cada uno de estos tipos de células es ideal para experimentos in vitro que involucren la comunicación célula-célula o la diafonía entre tipos de células.
Este protocolo describe el establecimiento de cultivos celulares individuales de células primarias a partir de una sola pieza de piel. Este protocolo es particularmente útil cuando la cantidad de tejido disponible es limitada. Además, el aislamiento de los tres tipos de células de un solo donante permite comparaciones sólidas entre tipos de células o experimentos de cocultivo, al tiempo que mitiga la influencia de la genética durante el experimento deseado.
Protocolo
La adquisición y el uso de tejido del prepucio humano no identificado con fines de investigación fue revisado y recibió la determinación de "investigación no humana" por la Junta de Revisión Institucional de la Facultad de Medicina de Penn State (IRB # 17574).
NOTA: Siguiendo el siguiente protocolo, se obtienen 2,4 x 106 queratinocitos, 4,4 x 106 fibroblastos y 1,1 x 106 SC de un solo prepucio. En general, estas células primarias se pueden utilizar para 3 pasajes, dependiendo de las condiciones experimentales.
1. Aislamiento de células primarias y condiciones de cultivo
- Procedimiento de separación de epidermis y dermis
- Adquirir prepucio neonatal después de los procedimientos estándar de atención por un médico bajo protocolos regulatorios hospitalarios aprobados. El médico determina el momento de la circuncisión después del nacimiento y la cantidad de piel extraída.
- Coloque el prepucio extirpado en un tubo de microcentrífuga que contenga 8-10 ml de medio basal Modified Eagle Medium (DMEM) de Dulbecco helado y transporte inmediatamente el prepucio al laboratorio de cultivo celular para el aislamiento celular. Enjuague la piel dos veces con 20-25 ml de solución salina tamponada con fosfato (DPBS) de 1x Dulbecco que contenga 1 antibiótico / antimicótico.
NOTA: Para obtener la máxima viabilidad celular, el prepucio extirpado debe colocarse a 4 °C hasta el procesamiento, y las células deben cosecharse dentro de las 24 h. - Después de enjuagar con DPBS/antibióticos, remoje el prepucio en 25-30 ml de medio basal DMEM helado durante 10-15 min en un plato de cultivo de tejidos de 10 cm. Realice todos los pasos de procesamiento en una campana de cultivo de tejidos utilizando una técnica estéril.
- Con un bisturí, corte cuidadosamente el prepucio abierto y exponga la dermis y el tejido adiposo subcutáneo.
- Retire el tejido adiposo subcutáneo con fórceps, cuchilla de bisturí y tijeras, según sea necesario. Deseche el tejido adiposo. Corte el prepucio limpio en tres a cinco trozos más pequeños.
- Transfiera las piezas de piel a un tubo cónico estéril que contenga 16-20 ml de medio dispasa-I/DMEM (4 mg/ml en medio basal DMEM).
- Mezclar las piezas de piel en el tubo cónico por inversión, intermitentemente, durante los primeros 30 min de incubación con dispasa-I. A continuación, coloque el tubo cónico a 4 °C durante 16-18 h, teniendo en cuenta sumergir las piezas de la piel en dispase-I/media.
NOTA: La solución de Dispasa-I debe prepararse justo antes de la adición utilizando medio basal DMEM frío, filtrarse con un colador de 0,22 μm y mantenerse a 4 °C. - Después de la digestión nocturna con dispase-I, retire los trozos de piel y colóquelos en un plato de cultivo seco y estéril. Desenrolle cada pedazo de piel para que la capa epidérmica externa toque el plato de cultivo.
- Usando dos juegos de fórceps, separe cuidadosamente la epidermis de la dermis. Comience en el borde del tejido y despegue la epidermis lejos de la dermis.
NOTA: Si la capa de la epidermis es difícil de separar de la dermis, la digestión dispasa-I no fue suficiente. Opciones de solución de problemas: 1) devolver las piezas de piel a la solución dispase-I/DMEM e incubarlas durante 2-3 h adicionales a 4 °C; 2) colocar los trozos de piel en dispasa fresca-I/DMEM e incubar a 4 °C durante 2-3 h más. - Use la epidermis y la dermis separadas para aislar queratinocitos (epidermis) y fibroblastos y células de Schwann (dermis).
NOTA: Siga los pasos a continuación para condiciones específicas de aislamiento y cultivo de tipos de células.
- Aislamiento de queratinocitos de la epidermis
- Agregue 5 ml de solución salina tampón HEPES (HBS) a un plato de cultivo de 10 cm y agregue los fragmentos separados de la epidermis. Incubar a temperatura ambiente (RT) durante 10 min.
- Después de la incubación de HBS, recoja la solución de HBS en un tubo cónico de 50 ml. Agregue 5 ml de tampón de neutralización de tripsina (TNB) (Tabla de materiales) en un tubo cónico de 50 ml y reserve.
- Agregue 3 ml de solución de tripsina a los fragmentos epidérmicos. Incubar a 37 °C durante 10 min.
- Agitar suavemente los fragmentos epidérmicos usando fórceps hasta que la solución de tripsina se vuelva turbia.
- Añadir la solución de tripsina/queratinocitos al tubo que contiene HBS y TNB en el paso 1.2.2.
- Para cualquier fragmento epidérmico restante que no se haya disuelto en la digestión inicial de tripsina, agregue 3 ml de tripsina al 0.25% / ácido etilendiaminatetraacético (EDTA). Incubar a 37 °C durante 10 min y repetir los pasos 1.2.4 y 1.2.5.
- Añadir 2 ml de suero fetal bovino (FBS) a la solución de tripsina/EDTA que contiene tubos de solución de HBS y TNB.
- Centrifugar el tubo de recogida que contiene HBS/TNB/tripsina y queratinocitos a 870 x g durante 5 min a 4 °C.
- Aspirar el sobrenadante y resuspendir el pellet celular en 3 mL de medio de crecimiento completo de queratinocitos (Tabla de Materiales).
- Filtre la suspensión celular con un filtro estéril de 100 μM en un tubo cónico estéril de 50 ml para eliminar los desechos.
- Cuantificar el número de celdas y la viabilidad celular.
NOTA: Aquí, se utilizó un dispositivo especializado de muestreo y tinción celular (Tabla de Materiales) para cuantificar el número de células y la viabilidad siguiendo las instrucciones del fabricante. - Placas de cultivo de semillas según sea necesario para los experimentos. La densidad de siembra recomendada es de ~45.000 células/cm2.
- Coloque las placas de cultivo en una incubadora a 37 °C en 5% de CO2 durante 2 días para permitir que los queratinocitos se adhieran al plato.
- Después de 2 días, aspire las células no adheridas. Refresque los medios de cultivo celular cada dos días hasta que los queratinocitos alcancen la confluencia deseada para experimentos de paso o aguas abajo (50% -80% de confluencia).
- Aislamiento de células de Schwann (SC) y fibroblastos de la dermis
- Matraces T25 pre-recubiertos con poli-L-lisina (PLL, 0,01 μg/μL) utilizando 5 mL de 1x DPBS. Coloque los matraces precubiertos a 37 °C durante 3 h. Lave la matriz de recubrimiento PLL dos veces con 1x DPBS (5 mL).
NOTA: Los matraces T25 se pueden preparar con anticipación. - Enjuague las piezas aisladas de la dermis con 5 ml de medio basal DMEM.
- Picar la dermis en trozos pequeños con tijeras o un bisturí.
- Digerir la dermis picada con 5 ml de colagenasa (2 mg/ml en medio basal DMEM) a 37 °C durante 2,5 h. Tritura suavemente la dermis picada con una punta de pipeta cada 30 minutos hasta que la dermis se disocie por completo.
- Filtre la suspensión celular con un colador celular de 70 μM. Es necesario aplicar fuerza mecánica utilizando una jeringa de 1 ml para filtrar completamente la suspensión.
- Diluir la suspensión celular filtrada con 5 mL de medio DMEM completo (medio basal DMEM + 5% FBS + 1x de antibiótico) para detener la actividad enzimática de la colagenasa.
- Centrifugar la suspensión celular a 870 x g durante 5 min a RT para granular las células.
- De este pellet celular se obtendrán tanto fibroblastos como SC. Resuspend el pellet celular en 2 mL de medio completo DMEM para dividir las células (1 mL de suspensión/tubo celular) y centrifugar a 870 x g durante 5 min a RT.
- Para el cultivo de SC, siga los pasos 1.3.10-1.3.17 y para el cultivo de fibroblastos, siga los pasos 1.3.18-1.3.22.
- A partir del paso 1.3.8, aspire el sobrenadante. Resuspendir el pellet celular en 5 mL de medio completo DMEM fresco.
- Cuantificar el número de celdas y la viabilidad.
NOTA: Aquí, se utilizó un dispositivo especializado de muestreo y tinción celular (Tabla de Materiales) para cuantificar el número de células y la viabilidad siguiendo las instrucciones del fabricante. - Sembrar los matraces T25 pre-recubiertos con 5 mL de células resuspendidas a una densidad 4.0 x 103 células/mL. Incubar el matraz a 37 °C en presencia de 5% de CO2 durante la noche (~12-16 h de incubación).
- Después de 16 h, confirme la adhesión celular por microscopía (Tabla de Materiales) a un aumento de 10x.
- Retire las células no adherentes y lave el matraz 3x con 5 ml de 1x DPBS.
- Añadir 5 ml de 10 μM de citosina arabinósido (agente antimitótico, mata los fibroblastos) en medio completo DMEM. Incubar el matraz a 37 °C en presencia de 5% de CO2 durante 24 h.
- Aspire el medio que contiene citosina arabinósido del matraz. Enjuague el matraz 3x con 5 mL de 1x DPBS.
- Rellenar el matraz de cultivo con 5 mL de medio de cultivo completo scs (Tabla de Materiales) e incubar a 37 °C en presencia de 5% de CO2 durante 48 h. Actualice el medio de cultivo completo SC cada dos días hasta que los SC alcancen el 80% de confluencia.
- Aspirar el sobrenadante de la capa dérmica disociada (paso 1.3.8) y resuspendir el pellet celular con 5 mL de medio completo de fibroblastos (medio basal de fibroblastos + 5% FBS + 1x antibiótico).
- Cuantificar el número de células y la viabilidad celular.
NOTA: Aquí, se utilizó un dispositivo especializado de muestreo y tinción celular (Tabla de Materiales) para cuantificar el número de células y la viabilidad siguiendo las instrucciones del fabricante. - Placa los fibroblastos a una densidad celular de 4,0 x 103 células/ml en matraces de cultivo T25 (no pre-recubiertos) utilizando 5 mL de medio completo de fibroblastos. Incubar a 37 °C en presencia de 5% de CO2 durante la noche (~12-16 h de incubación).
- Después de 16-24 h, confirme la adhesión celular por microscopía (Tabla de Materiales) a un aumento de 10x. Aspire las células no adherentes del matraz y lave el matraz dos veces con 5 ml de 1x DPBS.
- Añadir 5 ml de medio completo de fibroblastos frescos e incubar a 37 °C en presencia de 5% de CO2 durante 48 h. Refresque el medio de cultivo cada dos días hasta que los fibroblastos alcancen la confluencia deseada para los ensayos de paso o aguas abajo (50% -80% de confluencia).
- Matraces T25 pre-recubiertos con poli-L-lisina (PLL, 0,01 μg/μL) utilizando 5 mL de 1x DPBS. Coloque los matraces precubiertos a 37 °C durante 3 h. Lave la matriz de recubrimiento PLL dos veces con 1x DPBS (5 mL).
2. Verificación de queratinocitos epidérmicos, SC dérmicos y marcadores proteicos de fibroblastos por inmunofluorescencia
- Día 1- Cubra los portaobjetos de vidrio de la cámara y separe las celdas
- Pre-recubrir portaobjetos de vidrio de cámara de 4 pocillos con colágeno-I para queratinocitos, o PLL para SC o, solo 1x DPBS para fibroblastos (0.5 mL cada pozo). Asegúrese de recubrir toda la superficie. Incubar diapositivas de cámara a 37 °C durante 2 h. Durante la incubación, prepare las células.
- Después de que las células cultivadas alcancen una confluencia del 50% al 80%, lave los matraces con 1x DPBS 3x (1 ml por cada pocillo).
- Separe las células adheridas con 5 ml de solución de tripsina-EDTA (TE) al 0,25% incubando a 37 °C en presencia de 5% de CO2 durante 2 min, hasta que las células comiencen a ser redondas. Visualice el desprendimiento celular con microscopía (Tabla de Materiales) a un aumento de 10x.
- Después de la incubación, transfiera la solución de TE que contiene células a un tubo cónico con 5 ml de suero fetal bovino (FBS).
- Agregue 5 ml de tampón de neutralización de tripsina (TNB) al matraz de cultivo y luego transfiera el contenido al tubo de centrífuga mencionado anteriormente (células con TE y FBS). Visualice el desprendimiento celular con microscopía (Tabla de Materiales) a un aumento de 10x.
NOTA: TNB o FBS o ambos se pueden usar para neutralizar la actividad de la tripsina. - Centrifugar el tubo cónico que contiene células/TE/TNB a 870 x g durante 5 min. Transfiera el sobrenadante a otro tubo y vuelva a suspender el pellet celular en el medio de cultivo completo correspondiente. Mida la viabilidad celular como se menciona en el paso 1.2.11.
- Enjuague los portaobjetos de vidrio de cámara pre-recubiertos (paso 2.1.1) con 1x DPBS (1 mL por cada pozo) 3x.
- Semiseque los portaobjetos dentro de la campana de cultivo de tejidos y queratinocitos de semillas, SC o fibroblastos a una densidad adecuada (30,000 células / 0.5 ml / cámara) en un medio de cultivo celular completo apropiado.
- Incubar los portaobjetos de la cámara a 37 °C durante la noche para permitir que las células se adhieran.
- Día 2- Bloqueo del portaobjetos de vidrio de la cámara con albúmina sérica bovina (BSA) e incubación de anticuerpos primarios
- Aspire los medios celulares de las diapositivas de la cámara y lave 3x con 1 mL de 1x DPBS.
- Fije las células adheridas con paraformaldehído al 4% en 1x DPBS (1 ml por cada pocillo) e incube durante 15 minutos a RT dentro de la campana de cultivo de tejidos.
- Aspire paraformaldehído al 4% de los portaobjetos de la cámara y lave los portaobjetos de la cámara 3x con 1x DPBS (1 ml para cada pocillo).
- Permeabilizar las membranas celulares con 1% tritonX-100 en 1x DPBS (1 mL por cada pocillo) e incubar durante 15 min a RT.
- Aspire la solución de bloqueo de los portaobjetos de la cámara, lave 3x con 1x DPBS (1 ml por cada pozo) durante 30 s y luego aspire 1x DPBS desde el pozo.
- Bloquee los portaobjetos de la cámara con BSA al 5% (0,5 ml para cada pozo) e incube durante 45 min a RT.
- Aspire la solución de bloqueo de los portaobjetos de la cámara, lave 3x con 1x DPBS (1 ml por cada pozo) durante 30 s cada uno y luego aspire 1x DPBS del pozo.
- Diluir los anticuerpos primarios con BSA al 5% (0,2 ml para cada pocillo) (Diluciones de anticuerpos primarios: queratinocitos: anticuerpo 14 de citoqueratina de ratón (1:100) y anticuerpo de citoqueratina 10 (1:100); Células de Schwann: anticuerpo S100 de ratón (1:200) y anticuerpo del receptor del factor de crecimiento nervioso de conejo (p75-NTR) (1:500); Fibroblastos: anticuerpo de vimentina de conejo (1:200) y anticuerpo de actina alfa-lisa de ratón (α-SMA) (1:200)).
- Agregue los anticuerpos primarios a las células correspondientes en el portaobjetos de vidrio de la cámara e incube durante aproximadamente 15-16 h (durante la noche) a 4 ° C en una cámara humidificada.
- Aspire los anticuerpos primarios de los portaobjetos de la cámara, lave 3 veces con 1x DPBS (1 ml por cada pozo) durante 30 s cada uno y luego aspire 1x DPBS del pozo.
- Diluir los anticuerpos secundarios (Cabra anti-conejo IgG Anticuerpo Secundario-Alexa Fluor 488 (1:500) y Cabra anti-Ratón IgG Anticuerpo Secundario-Alexa Fluor 594 (1:500)) con 0,5% BSA. Agregue el anticuerpo secundario apropiado a cada pocillo (0,2 ml para cada pocillo). Incubar durante 45 min en RT.
- Aspire el anticuerpo secundario de los portaobjetos de la cámara, lave 3x con 1x DPBS (1 ml por cada pozo) durante 30 s cada uno y luego aspire 1x DBPS del pozo.
- Retire la junta de la corredera de la cámara de 4 pocillos con el removedor de juntas. Trate de no dejar ningún adhesivo en la diapositiva, ya que esto interfiere con la aplicación de la cubierta. Agregue una gota de medio de montaje con 4',6-diamidino-2-fenilindol (DAPI). Alternativamente, contramanche los pozos con DAPI y use un medio de montaje que no contenga etiquetas.
- Coloque con cuidado la funda en el portaobjetos de vidrio evitando las burbujas de aire y selle el extremo de la cubierta con pegamento. Observe los patrones de tinción de inmunofluorescencia por microscopía (Tabla de Materiales) a un aumento de 10x y / o 20x.
Resultados
Se utilizó el prepucio neonatal normal para el aislamiento de queratinocitos epidérmicos primarios y SC y fibroblastos dérmicos. Las células primarias aisladas se cultivaron en los respectivos medios de cultivo celular que contenían factores de crecimiento. Después de la siembra de SC y fibroblastos en matraces de cultivo, la mayoría de las células se adhirieron al fondo del matraz dentro de las 2 h. En el caso de los queratinocitos, la mayoría de los queratinocitos se adhirieron por 24 h. Los queratinocitos primarios epidérmicos aislados alcanzaron el 85% de confluencia en el día 7 y exhibieron una morfología celular característica (forma de adoquín) (Figura 1A). Los SC alcanzaron el 95% de confluencia en el día 5 y aparecieron de forma bipolar o tripolar (Figura 1B). Los cultivos de fibroblastos alcanzaron el 95% de confluencia en el día 4 y la mayoría de las células exhibieron una morfología en forma de huso (Figura 1C). La expresión de proteínas específicas de tipo celular se confirmó en estos cultivos mediante tinción de inmunofluorescencia. Los queratinocitos fueron positivos para las proteínas K10 (marcador de diferenciación) y K14 (marcador de proliferación) (Figura 2A); del mismo modo, los SC fueron positivos para S100 y p75-NTR (Figura 2C). Los fibroblastos expresaron positivamente vimentina, pero no expresaron el marcador de miofibroblastos, actina del músculo liso alfa (α-SMA) (Figura 2E).
Las imágenes combinadas de inmunofluorescencia de queratina y tinción nuclear DAPI (Figura 2A) indicaron que el 97,8% de las células en los cultivos eran queratinocitos (Figura 2B). Las células de Schwann dobles S100 y p75-NTR positivas sugieren una pureza de SC del 95,2% en cultivo siguiendo el protocolo (Figura 2C,D). Del mismo modo, el 97,2% de las células en cultivos de fibroblastos expresaron positivamente vimentina (Figura 2E, F). Por lo tanto, la expresión característica de proteínas se encuentra en los respectivos tipos de células, y el protocolo permite el aislamiento de poblaciones relativamente puras de células.
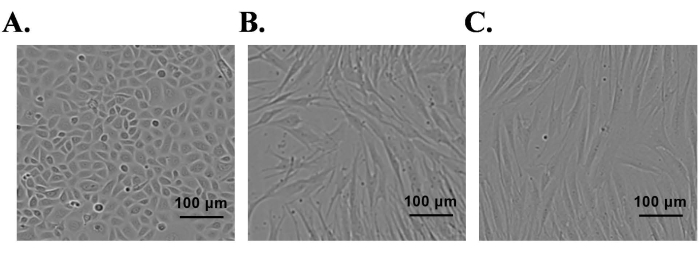
Figura 1: Aislamiento de queratinocitos primarios derivados del prepucio humano, células de Schwann y fibroblastos. (A) Queratinocitos, (B) células de Schwann y (C) fibroblastos bajo microscopio de contraste de fase; barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
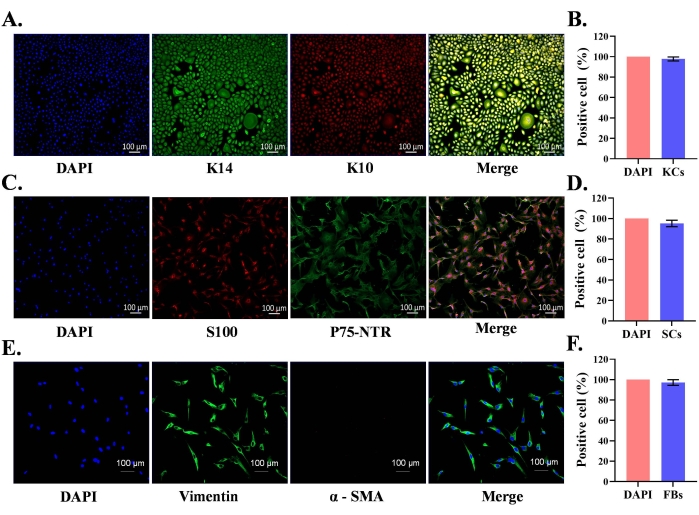
Figura 2: Caracterización de queratinocitos primarios derivados del prepucio humano, células de Schwann y fibroblastos. (A) Los queratinocitos se identificaron utilizando queratina 14 (K14, queratinocitos proliferativos) y K10 (queratina 10, marcador de diferenciación de queratinocitos); barra de escala = 100 μm. (B) Análisis estadístico de la pureza de queratinocitos cultivados utilizando inmunofluorescencias de células teñidas dobles. (C) Las células de Schwann se identificaron utilizando S100 y p75-NTR (receptor del factor de crecimiento nervioso); barra de escala = 100 μm. (D) Análisis estadístico de la pureza de los SC cultivados utilizando inmunofluorescencias de células de doble teñida. (E) Los fibroblastos se identificaron utilizando vimentina (fibroblasto) y actina del músculo α liso (diferenciación de fibroblastos, miofibroblasto); barra de escala = 100 μm. (F) Análisis estadístico de la pureza de fibroblastos cultivados utilizando células teñidas con inmunofluorescencias vimentina. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe un método para aislar tres poblaciones celulares distintas de una sola pieza del prepucio, a saber, queratinocitos, fibroblastos y células de Schwann. Existen algunos protocolos de aislamiento disponibles para aislar queratinocitos y fibroblastos 2,3,5,6, pero ninguno describe el aislamiento SC. Además de las células estructurales clave en la piel, los queratinocitos y los fibroblastos, la piel también está altamente inervada por estructuras aferentes sensoriales y eferentes autónomas. Las aferencias sensoriales juegan un papel importante en la transmisión del tacto ligero, la vibración, el dolor, la picazón y las sensaciones de calor y frío. Las eferentes autónomas inervan las glándulas sudoríparas y los músculos arrector pili9. Cada axón nervioso está envuelto por un SC, las células gliales del sistema nervioso periférico. La investigación y los intereses clínicos en los SC han aumentado considerablemente a medida que los SC apoyan la regeneración axonal10,11. Los nervios de la piel son importantes reguladores de la fisiología de la piel y la patología de la enfermedad a través de señales de comunicación (neuromoduladores/neuromediadores) a las células no neurales 12,13,14.
A pesar de la amplia distribución de los SC nerviosos en la piel, existe información limitada sobre el papel específico de los SC en la fisiología de la piel. ¿Cómo interactúan los SC en la piel con otras células no neuronales en la piel? Responder a esta pregunta se ha visto obstaculizado por la falta de modelos confiables de cultivo celular in vitro . Por lo tanto, con este protocolo, el análisis de cada célula individual y sus interacciones con células del mismo tejido puede revelar con precisión los rasgos característicos de los roles de las células de Schwann en la homeostasis de la piel y la fisiopatología.
Una de las ventajas clave de este protocolo es un procedimiento experimental simple y económico para establecer tres células primarias (SC, queratinocitos y fibroblastos) a partir de un solo prepucio humano. También tiene la ventaja de que los tres tipos de células se aíslan del mismo tejido, mitigando así las diferencias genéticas en las comparaciones celulares y optimizando los aislamientos celulares cuando el tejido está en suministro limitado. Este protocolo tarda 2 días en realizarse y simplifica el procedimiento de aislamiento para tres células primarias del tejido de la piel y las condiciones de cultivo. Este protocolo produce de manera confiable un alto número de células viables, y los pasajes iniciales de estas células alcanzaron ~ 90% de confluencia en 4-7 días después del recubrimiento inicial. Hemos utilizado queratinocitos durante al menos 3 pasajes (~ 21 días) y las células de fibroblastos y Schwann se pueden usar durante 5-6 pasajes (~ 40 días en cultivo).
Este protocolo no está exento de desafíos técnicos. La eliminación suficiente del tejido adiposo subyacente y la separación epidérmica / dérmica eficiente antes de la digestión enzimática son clave para obtener poblaciones relativamente puras de células de cada capa de la piel. Los SC dérmicos son más difíciles de aislar de la piel debido a su prevalencia relativamente baja en la piel en comparación con los fibroblastos más numerosos. Cualquier arrastre de fibroblastos en cultivos SC superará rápidamente a los SC15. Para mejorar la adherencia al SC, optamos por pre-recubrir los artículos de cultivo de tejidos con PLL, ya que esto aumenta la adhesión de los SC16. Para mitigar aún más la contaminación por fibroblastos, se agregó arabinósido de citosina (agente antimitótico) después de que las células se hubieran adherido durante un corto período de tiempo para eliminar los fibroblastos que se dividen rápidamente de los cultivos de SC. Sin embargo, una exposición más prolongada al arabinósido de citosina también puede ser perjudicial para los SC.
La adopción del protocolo descrito anteriormente permite aislar cultivos individuales de SC de piel, queratinocitos y fibroblastos para experimentos in vitro . Estas poblaciones celulares distintas se pueden usar para investigar SC, queratinocitos y fibroblastos individualmente o en combinación durante la fisiología normal de la piel, la cicatrización de heridas o en condiciones que imitan un entorno de enfermedad.
Divulgaciones
Todos los demás autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Nos gustaría agradecer a la Dra. Fadia Kamal y al Dr. Reyad Elbarbary por permitirnos utilizar instrumentos de laboratorio y soporte técnico. Este trabajo fue apoyado por subvenciones de los NIH (K08 AR060164-01A) y el DOD (W81XWH-16-1-0725) a J. C. E., además del apoyo institucional del Centro Médico Hershey de la Universidad Estatal de Pensilvania.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µM sterile filters (Millex-GP Syringe Filter Unit,polyethersulfone) | MilliporeSigma | SLGPR33RS | |
| 70 µM cell strainers | CELLTREAT | 229483 | |
| 100 µM cell strainers | CELLTREAT | 229485 | |
| 1 mL disposable syringes | BD Luer-Lok | BD-309659 | |
| 5 mL disposable syringes (Syringe sterile, single use) | BD Luer-Lok | BD309646 | |
| 10 mL disposable syringes | BD Luer-Lok | BD305462 | |
| 1% TritonX-100 | Sigma | X100-1L | Prepared at the time of use |
| 4% paraformaldehyde solution | ThermoFisher Scientific | J19943.K2 | Ready to use and store at 4 °C |
| 5% BSA | Sigma | A7906-100G | Prepared at the time of use |
| 70% ethanol | Pharmco | 111000200 | |
| Antibiotic | ScienCell Research | 503 | |
| Chemometec Vial1-Cassette | Fisher Scientific | NC1420193 | |
| Collagenase | Gibco | 17018-029 | |
| Coverslip | Fisherbrand | 12544D 22*50-1.5 | |
| Dispase I | Sigma-Aldrich | D46693 | |
| DMEM basal medium | ScienCell Research | 9221 | |
| Dulbecco's phosphate-buffered saline free from Ca2+ and Mg2+ (DPBS) | Corning | 21-031-CV) | |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339653 | |
| 1.5 mL micro-centrifuge tubes | Fisherbrand | 02-681-5 | |
| Fetal bovine serum (FBS) | ThermoFisher Scientific | 10082147 | |
| Fibroblast complete medium | ScienCell Research | 2331 | |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Invitrogen | A11032 | Dilution (1:500) |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A11008 | Dilution (1:500) |
| Hanks' Buffered Saline Solution (HBSS buffer) | Lonza | CC-5022 | |
| Human foreskin | De-identified human foreskin tissue for research purposes (Institutional Review Board- IRB #17574). | ||
| KGM-GOLD keratinocyte medium (KGM gold and supplements) | Lonza | 00192151 and 00192152 | |
| Mouse alpha-smooth muscle actin antibody | ThermoFisher Scientific | 14-9760-82 | Dilution (1:200) |
| Mouse Cytokeratin14 antibody | Abcam | ab7800 | Dilution (1:100) |
| Mouse S100 antibody | ThermoFisher Scientific | MA5-12969 | Dilution (1:200) |
| Multi chambered (4 well glass slide) | Tab-Tek | 154526 | |
| NucleoCounter -Via1-Cassette | Chemometec | 941-0012 | |
| Poly-L-Lysisne (PLL) | ScienCell Research | 32503 | |
| ProLong Gold Anti-fade Mountant with DAPI | Invitrogen | P36935 | |
| Rabbit K10 antibody | Sigma-Aldrich | SAB4501656 | Dilution (1:100) |
| Rabbit p75-NTR antibody | Millipore | AB1554 | Dilution (1:500) |
| Rabbit vimentin | ProteinTech | 10366-1-AP | Dilution (1:200) |
| Schwann cell culture medium | ScienCell Research | 1701 | |
| Precision tweezers DUMONT straight with extra fine tips Dumostar, 5 | ROTH | LH75.1 | Sterilize with 70% alcohol before use |
| IRIS Scissors, sharp/sharp. Length 4–3/8"(111mm) | Codman | 54-6500 | Sterilize with 70% alcohol before use |
| Sterilized surgical - sharp blade (Duro Edge Economy Single Edge Blades) | Razor blade company | 94-0120 | Sterilize with 70% alcohol before use |
| T25 culture flask | Corning | 353109 | |
| Trypsin neutralization buffer (TNS) | Lonza | CC-5002 | |
| Trypsin/EDTA | Lonza | CC-5012 | |
| Inverted microscope | ZEISS | Axio Observer 7- Axiocam 506 mono – Apotome.2 microscope | For immunofluorescence of chamber slide containing stained cells |
| Inverted microscope | ZEISS | Primovert | For visulaizing/observing cell attachment or detachment |
Referencias
- Hawksworth, G. M. Advantages and disadvantages of using human cells for pharmacological and toxicological studies. Human & Experimental Toxicology. 13 (8), 568-573 (1994).
- Green, H., Kehinde, O., Thomas, J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting. Proceedings of the National Academy of Sciences of the United States of America. 76 (11), 5665-5668 (1979).
- Fuchs, E., Green, H. Changes in keratin gene expression during terminal differentiation of the keratinocyte. Cell. 19 (4), 1033-1042 (1980).
- Aasen, T., Izpisua Belmonte, J. C. Isolation and cultivation of human keratinocytes from skin or plucked hair for the generation of induced pluripotent stem cells. Nature Protocols. 5 (2), 371-382 (2010).
- Seluanov, A., Vaidya, A., Gorbunova, V. Establishing primary adult fibroblast cultures from rodents. Journal of Visualized Experiments: JoVE. (44), e2033(2010).
- Belviso, I., et al. Isolation of adult human dermal fibroblasts from abdominal skin and generation of induced pluripotent stem cells using a non-integrating method. Journal of Visualized Experiments: JoVE. (155), e60629(2020).
- Silva, W. N., et al. Role of Schwann cells in cutaneous wound healing. Wound Repair and Regeneration. 26 (5), 392-397 (2018).
- Bray, E. R., Cheret, J., Yosipovitch, G., Paus, R. Schwann cells as underestimated, major players in human skin physiology and pathology. Experimental Dermatology. 29 (1), 93-101 (2020).
- Laverdet, B., et al. Skin innervation: important roles during normal and pathological cutaneous repair. Histology and Histopathology. 30 (8), 875-892 (2015).
- Jessen, K. R., Mirsky, R., Lloyd, A. C. Schwann cells: Development and role in nerve repair. Cold Spring Harbor Perspectives in Biology. 7 (7), 020487(2015).
- Bentley, C. A., Lee, K. F. p75 is important for axon growth and Schwann cell migration during development. The Journal of Neuroscience. 20 (20), 7706-7715 (2000).
- Rutkowski, J. L., et al. Signals for proinflammatory cytokine secretion by human Schwann cells. Journal of Neuroimmunology. 101 (1), 47-60 (1999).
- Kumar, A., Brockes, J. P. Nerve dependence in tissue, organ, and appendage regeneration. Trends in Neurosciences. 35 (11), 691-699 (2012).
- Balakrishnan, A., et al. Insights into the role and potential of Schwann cells for peripheral nerve repair from studies of development and injury. Frontiers in Molecular Neuroscience. 13, 608442(2020).
- Gresset, A., et al. Boundary caps give rise to neurogenic stem cells and terminal glia in the skin. Stem Cell Reports. 5 (2), 278-290 (2015).
- Stratton, J. A., et al. Purification and characterization of Schwann cells from adult human skin and nerve. eNeuro. 4 (3), (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados