Method Article
Светоиндуцированная электронная микроскопия in situ transmission для наблюдения взаимодействия жидкости и мягкой материи
В этой статье
Резюме
Настоящий протокол описывает модификации просвечивающего электронного микроскопа (ТЭМ) с системой светового освещения, изготовление жидких клеток и наблюдения IN SITU TEM за светоиндуцированными взаимодействиями между бактериальными клетками и фотосенсибилизатором. Также обсуждаются методы подготовки образцов, электронно-лучевые повреждения и визуализация.
Аннотация
Текущий протокол описывает модификации установки просвечивающего электронного микроскопа (ТЭМ) для наблюдений in situ , индуцированных светом. Стеклянное оптическое волокно, вставленное в электронную колонну над полюсом объектива, и лазер, регулируемый источник света, использовались для изготовления устройства. После калибровки осветителя с помощью внешней измерительной системы он позволяет регулировать интенсивность освещения в соответствии с потребностями наблюдаемого процесса. Эта система освещения была использована для изображения явлений антимикробной фотодинамической терапии, которые в настоящее время являются предметом интенсивных исследований. Образец готовили путем обнаружения суспензии бактерий на подложке из углерода, графена или нитрида кремния, промокания избыточного раствора, обнаружения раствора фотосенсибилизатора, повторного промокания избыточной жидкости, а затем сборки жидкой ячейки со второй подложкой или графеновой пленкой. Сам процесс визуализационного эксперимента включает в себя выбор правильного места для наблюдения с использованием малого увеличения и минимальной дозы электронов, а затем циклическую активацию источника света для захвата последующих изображений через заданные промежутки времени с минимальным необходимым количеством электронов. Электронная доза каждого воздействия, а также время и интенсивность используемого освещения должны быть тщательно записаны из-за сложности наблюдаемых явлений, поскольку в то же время процесс управляется как светом, так и электронами. После проведения собственно эксперимента необходимо провести дополнительные контрольные наблюдения, в которых используются те же дозы электронов, но без дополнительного светового воздействия, а для более высоких доз света используются меньшие дозы электронов. Это позволяет отличить световые микроструктурные эффекты от эффектов, вызванных электронами как в области жизни, так и в области материаловедения.
Введение
Световые явления в высоком разрешении интересны во многих областях, таких как наноинженерия 1,2,3, катализ 4,5 и биофотоника 6. Некоторые оригинальные конструкции, позволяющие проводить подобные эксперименты, можно найти в литературе, в том числе модификации образцов держателей 1,4,7,8,9 и оптического волокна, прикрепленного к микроскопу 10,11.
Сочетание светового освещения, жидкой среды и просвечивающей электронной микроскопии (ТЭМ) дает прекрасную возможность для детальных, динамических исследований фотоиндуцированных процессов. Однако состояние высокого вакуума внутри микроскопа довольно неблагоприятно для многих жидкостей, особенно водных растворов. Жидкая инкапсуляция, которая защищает его от окружающей среды, может быть достигнута с использованием нескольких методов, основанных главным образом на графене12, нитриде кремния13 или подложках углерода14. В дополнение к исследованиям в области материаловедения2, так называемые жидкие клетки предлагают возможности для проведения нетрадиционных микроскопических наблюдений за биологическими образцами вблизи ихродных условий 15. Такие наблюдения чрезвычайно требовательны, особенно для живых микроорганизмов, таких как бактериальные клетки. Электронный пучок как ионизирующее излучение вызывает необратимые повреждения гидратированных образцов, поэтому доза электронов должна быть указана16. Это необходимо, чтобы минимизировать неблагоприятные последствия, контролировать ущерб и избегать путаницы артефактов. Оптимальная максимальная доза электронов, которая позволяет наблюдать за живыми клетками, по-прежнему является сомнительной темой16, но доза 30 e−/нм2, по-видимому, является пороговым значением, по крайней мере, для бактерий17.
Некоторые из предметов, представляющих интерес для таких микроскопических исследований, являются процессами во время антимикробной фотодинамической терапии (APDT)18. Короче говоря, терапия протекает следующим образом. Бактериальные клетки окружены светочувствительной жидкостью, называемой фотосенсибилизатором. Когда световое освещение дается на определенной длине волны, цитотоксические активные формы кислорода (АФК) генерируются из энергии или передачи заряда от возбужденных молекул фотосенсибилизатора к кислороду, естественно присутствующему в растворе. Патогены, подвергшиеся воздействию АФК, быстро инактивируются с очень высокой эффективностью, без побочных эффектов19. Реакция на терапию варьируется для разных микробов – например, воздействие одного и того же фотосенсибилизатора может быть совершенно разным для грамположительных и грамотрицательных бактерий20. В целом установлено, что основной мишенью АФК являются внешние структуры клеток, где повреждение приводит к функциональным нарушениям клеточной мембраны и, следовательно, приводит к гибелибактерий 21,22. Однако повреждение нуклеиновых кислот и белков также может считаться причиной инактивации18, поэтому до сих пор неизвестно, какие клеточные структуры являются основными мишенями во время этого процесса19. Более глубокое понимание разрушительных процессов может помочь улучшить эту окончательную терапию. По сравнению с методами световой микроскопии, используемыми в исследовании APDT23, методы TEM дают больше возможностей для изучения механизма APDT с более высоким разрешением и увеличением24. ТЭМ уже успешно используется для наблюдения за клетками во время проводимой терапии, что позволило детально изучить грамположительные повреждения бактерий и подробно описать изменения, происходящие внутри клеточной стенки 6,25.
Текущий протокол представляет собой подходящую экспериментальную установку для визуализации с высоким разрешением инактивации светоиндуцированных бактерий с использованием ТЭМ, что требует надлежащей системы освещения света, инкапсуляции клеток жидкостью и строгого контроля дозы электронов. Бактериями, использованными для наблюдения, был золотистый стафилококк, а в качестве фотосенсибилизатора использовался раствор метиленового синего. Специальная установка светового освещения содержит перестраиваемый полупроводниковый лазер, подключенный непосредственно к колонке микроскопа с помощью светового волокна. Такая конструкция обеспечивает равномерное облучение по всему образцу из-за почти параллельного размещения оптического волокна к оси микроскопа. Монохроматический свет высокой интенсивности, генерируемый лазером, затем может быть использован для изучения различных фотохимических эффектов. Свет, используемый в эксперименте, имел длину волны, равную 660 нм, потому что в видимой области метиленовый синий имеет пики поглощения при 613 нм и 664 нм26. Протокол инкапсуляции жидкости основан на углеродных субстратах, что делает процедуру быстрой и несложной. Наконец, представлен метод наблюдения за клетками в жидкости в низких дозах IN situ TEM. Обсуждаются трудности, связанные с подготовкой образца, воздействием дозы электронов на чувствительный образец и разумной интерпретацией изображения.
протокол
1. Модификация просвечивающего электронного микроскопа
- Модифицируйте просвечивающий электронный микроскоп, подключив оптическое волокно (см. Таблицу материалов) к колонке микроскопа в верхней части объектива. Оставьте несколько сантиметров пространства между объективом и объективом конденсатора, а также свободный слот для аксессуаров.
ПРИМЕЧАНИЕ: Также может быть использован специальный держатель образца4 или держатель для катодолуминесцентных наблюдений в обратной конфигурации1 . - Проверьте систему на наличие утечек с помощью грубых вакуумных насосов. Если система не показывает утечку вакуума, протестируйте систему при высоком вакууме.
- Убедитесь, что приведение в действие вакуумной системы не отклоняется от стандартного запуска вентилируемого микроскопа. В случае возникновения проблем с выполнением, сборкой или вводом в эксплуатацию модуля, обратитесь к авторизованному сервисному персоналу или производителю устройства.
ПРИМЕЧАНИЕ: Правильно сделанный и установленный осветитель не заслонит электронный пучок. Если луч последовательно смещается во время работы микроскопа, непроводящее оптическое волокно не будет достаточно покрыто металлическим экраном и будет накапливать электрический заряд. В этом случае проведите оптическое волокно вглубь проводящей оболочки.
- Убедитесь, что приведение в действие вакуумной системы не отклоняется от стандартного запуска вентилируемого микроскопа. В случае возникновения проблем с выполнением, сборкой или вводом в эксплуатацию модуля, обратитесь к авторизованному сервисному персоналу или производителю устройства.
- Измерьте интенсивность света с помощью фотодиодного датчика мощности (см. Таблицу материалов). Если пространство между полюсными частями объектива не позволяет проводить измерения внутри микроскопа, измерьте геометрию образца и осветителя и воспроизведите эти условия во внешней измерительной установке.
- Если микроскоп не оснащен системой измерения дозы электронов, выполните калибровку, измерив ток пучка с помощью чашки Фарадея (см. Таблицу материалов) и численно рассчитав плотность электронов, попадающих на образец27.
2. Инкапсуляция бактерий фотосенсибилизатором
- Поместите две необработанные решетки ТЕА, покрытые аморфным углеродом, между двумя скрещенными пинцетами, обращенными к стороне с углеродным покрытием сверху. Держите сетки как можно ближе к краю.
ПРИМЕЧАНИЕ: Для определенных комбинаций подложки, раствора и образца может быть полезно использовать тлеющий разряд на одной или обеих сетках для удаления заводских примесей и получения максимальной гидрофильной поверхности28. На примере бактерий S. aureus и раствора метиленового синего было определено, что наилучшие и наиболее воспроизводимые результаты получены на новом, необработанном углероде на медных решетках без дополнительного тлеющего разряда или плазменной очистки6. - Нанесите 4 мкл раствора бактерий на одну из сеток. Оптическая плотность образца должна находиться в пределах 5-10.
ПРИМЕЧАНИЕ: Бактерии, использованные в исследовании, были очищены от культуры и диспергированы в буфере PBS. Настоятельно рекомендуется проверять концентрацию бактерий в свежем образце каждый раз с его использованием, например, с использованием методов отрицательного окрашивания, следуя установленным протоколам, доступным 29,30,31. - Подождите 60 с и тщательно промойте жидкость с помощью фильтровальной бумаги. Постарайтесь распределить жидкость по всей поверхности сетки во время этого процесса.
- Поместите 4 мкл фотосенсибилизатора на ту же сетку.
ПРИМЕЧАНИЕ: Метиленовый синий в концентрации 2 мкг/мл использовался в качестве фотосенсибилизатора для настоящего исследования. - Через 5 с промойте жидкость. Оставьте очень тонкий слой жидкости на подложке.
- Быстро поместите сухую сетку поверх той, которая покрыта жидкостью.
- Аккуратно переместите верхнюю сетку к краю второй и сожмите подложки по краям пинцетом.
ПРИМЕЧАНИЕ: На этом этапе из образца может вытечь некоторое количество жидкости, что означает, что было слито недостаточно. Однако это не обязательно означает, что образование жидкой клетки будет неудачным. - Осторожно повторите сжатие.
ПРИМЕЧАНИЕ: Этот шаг легче выполнить, повернув пинцет на 90° так, чтобы он лежал перпендикулярно столу и кончики обоих пинцетов оставались на одной высоте, не завися от открытого/закрытого положения. - Оставьте жидкую клетку между пинцетом на 1 мин.
- Вставьте образец в держатель ТЕА сразу после завершения подготовки.
ПРИМЕЧАНИЕ: Натяжение монтажной пластины/кольца держателя поможет подложкам прилипать и удерживать жидкость внутри.- Если возможно, закачивайте держатель образца во внешнюю насосную станцию, чтобы уменьшить загрязнение микроскопа путем испарения жидкости.
3. Наблюдения IN situ TEM за бактериальными клетками в эффекте жидкостно-электронной дозы
- Вставьте образец в микроскоп.
- Начните наблюдения в режиме малого увеличения, чтобы найти подходящую область наблюдения.
ПРИМЕЧАНИЕ: Более темные области, скорее всего, будут жидкими из-за рассеяния электронного пучка.- Во время наблюдений держите электронную дозу как можно ниже. Увеличьте время экспозиции (до 2 с при ускоряющем напряжении 150 кВ и увеличении в 5000 раз). Увеличение в 5000x для камеры с нижним креплением (приблизительное поле зрения составляет 10 мкм) достаточно для изображения бактерий диаметром ~1 мкм.
ПРИМЕЧАНИЕ: Иногда нелегко отличить жидкость, поэтому в начале наблюдений полезно сфокусировать электронный пучок там, где он, вероятно, будет жидким. Жидкость должна двигаться по сфокусированному электронному пучку, и пузырьки появятся. После этой проверки необходимо найти другую область для дальнейших наблюдений.
- Во время наблюдений держите электронную дозу как можно ниже. Увеличьте время экспозиции (до 2 с при ускоряющем напряжении 150 кВ и увеличении в 5000 раз). Увеличение в 5000x для камеры с нижним креплением (приблизительное поле зрения составляет 10 мкм) достаточно для изображения бактерий диаметром ~1 мкм.
- Найдите ячейки, окруженные жидкостью, при соответствующем увеличении с увеличенным временем экспозиции и немедленно захватите первое изображение. Держите электронную дозу постоянной и собирайте изображения каждые 30 с, чтобы наблюдать за изменениями.
- Внимательно изучите изображения и рассчитайте суммарную дозу электронов27 , которая соответствует первым видимым изменениям в клетках.
4. Наблюдения IN situ TEM за светоиндуцированными процессами между бактериальными клетками и фотосенсибилизатором
- Перед началом эксперимента установите интенсивность лазерного света, отрегулировав текущее значение. Выберите подходящую длину волны в соответствии со спектром поглощения фотосенсибилизатора. Согласно предыдущему калибровочному графику (шаг 1.4.), выберите текущее значение, соответствующее наименьшей интенсивности света.
ПРИМЕЧАНИЕ: Длина волны света, использованная в этом исследовании, составляла 660 нм. - Вставьте образец в микроскоп и найдите область наблюдения после шага 3.2. в предыдущем разделе.
- Захватите первое изображение ячейки перед началом освещения образца и используйте пучковый заготовитель, чтобы отключить электронный пучок, чтобы избежать эффектов электронного облучения.
- Включите лазер. Начните с короткого времени освещения (здесь 30 с), так как лазерный свет имеет относительно высокую интенсивность. По истечении этого времени выключите источник света.
- Выключите заглушку луча и немедленно захватите изображение. Если возможно, используйте автоматический алгоритм для предоставления образца только в течение времени, необходимого для получения изображения. Тщательно измерьте время облучения электронов, чтобы рассчитать дозу электронов27, используемую для визуализации.
- Повторите шаг 4.4. и шаг 4.5. для получения ожидаемого времени освещения света.
Результаты
Экспериментальная установка была разработана для наблюдения за световыми процессами, происходящими в жидкости с высоким разрешением. Конкурентный анализ изображений позволил отличить повреждения, вызванные электронным пучком, от изменений, связанных с фотохимической реакцией. Влияние электронного пучка на чувствительный образец (в данном случае на клетки, инкапсулированные жидкостью) было видно по всей облученной области, поскольку электроны проникали через нее равномерно. Конечно, эффект зависит от дозы электрона, поэтому более значительные изменения в морфологии образца можно наблюдать быстрее для более сфокусированного пучка. По сравнению с этим тяжелым повреждением, фактические разрушительные эффекты фотодинамической инактивации происходили в определенных частях клеток только в областях, окруженных освещенным фотосенсибилизатором.
В примере визуализации бактерий и согласно литературе доза 30 e−/нм2, по-видимому, является смертельным пороговым значением для бактерий17, которое было значительно превышено в предыдущих исследованиях авторов 6,25. Однако видимые изменения в клетке не были замечены до достижения электронной дозы 6000 e−/нм2. Результаты показали заметную деградацию внешнего слоя клетки, вызванную активными формами кислорода, генерируемыми световым облучением фотосенсибилизатора через 1 мин (рисунок 1). Дальнейшее световое освещение сделало изменения более заметными (рисунок 1D,G).
Инкапсуляция клеток между углеродными субстратами была достаточной для выполнения постоянных наблюдений в течение не менее 1 ч. Правильные пятна наблюдения с достаточным количеством жидкости можно легко найти при небольшом увеличении, так как эти области кажутся более темными и размытыми (обозначены кадрами на рисунке 2A). Бактерии, покрытые жидкостью, менее заметны, чем сухие, но их все же можно различить (рисунок 2B). Полезно смотреть на границу жидкости во время визуализации, и ее движение может быть легко обнаружено, что означает, что выбранная область может быть неподходящей и нестабильной (рисунок 3). Другой проблемой во время наблюдений является испарение воды и осаждение раствора, которые могут происходить в случайных областях образца, включая области, окружающие бактерии (рисунок 3B, C).

Рисунок 1: Примерные результаты фотодинамической обработки бактерий. (А) Схема жидкой клетки, содержащей бактериальные клетки и метиленовый синий. (B) Ячейка перед световым освещением. (C) Ячейка после освещения в течение 1 мин. (D) Ячейка после освещения в течение 10 мин. (E-G) Увеличенные участки от (B-D). Доза электронов была равна 1600 e−/нм2, 2500 e−/нм2 и 6000 e−/нм2 соответственно. Рисунок воспроизводится из Żak et al.25. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Изображения TEM S. aureus , инкапсулированные метиленовым синим между двумя углеродными пленками. (A) Изображение с низким увеличением представляет как области с большим количеством жидкости (обозначено желтыми рамками), так и сухие пятна. Быстрый осмотр образца при этом увеличении дает информацию о том, была ли инкапсуляция успешной или нет. (Б) Граница жидкости хорошо видна в увеличенной области, и можно различить бактерии, покрытые фотосенсибилизатором. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Изображения ТЭМ неблагоприятных эффектов, которые могут возникнуть во время визуализации. (А) Вначале клетка была равномерно окружена жидкостью, которая покрывала большую часть области наблюдения. (B) На основе постоянного электронно-лучевого облучения можно заметить движение и испарение жидкости и начало осаждения из раствора. (C) Продолжение процессов приводит к необратимому перемещению, вспениванию и распаду фотосенсибилизатора, что делает дальнейшие наблюдения невозможными. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
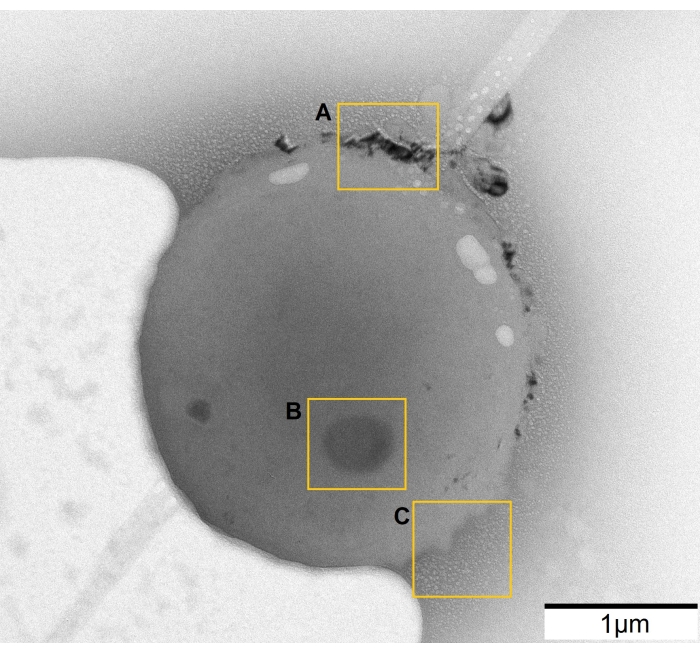
Рисунок 4: Неблагоприятные эффекты, приводящие к неправильным выводам. (А) Кристаллизованная жидкость. (B) Загрязнение поселилось на камере. (C) Вспенивание, вызванное электронным пучком. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Установка и ввод в эксплуатацию осветителя требуют базовых сервисных знаний и могут повредить микроскоп. Самый простой способ ввести свет в микроскоп - это подключить оптическое волокно с верхней части объектива, где обычно есть место для катушек отклонения ТЭМ и дополнительных детекторов. Больше свободного пространства также можно ожидать от более старых устройств верхнего входа, где в том же месте находится вакуумный замок образца и механизм установки образца. Эта конфигурация широко описана в предыдущем отчете25, который содержит примерную конструкцию осветителя. Если внутренняя часть микроскопа не позволяет установить оптическое волокно над объективом, осветитель может быть установлен внутри полюса объектива со стороны32. Другие решения предполагают использование специального держателя образца4 или обратное использование держателя для катодолуминесцентных наблюдений1.
В целом подготовка жидких проб для ТЕА сложна и требует опыта и ручных навыков. Критическим этапом подготовки жидких клеток является этап 2.6. протокола. Вторую сетку важно быстро разместить, чтобы избежать испарения жидкости. Метод, представленный здесь, прост и не требует необычных материалов; однако он может не подходить для всех жидкостей. В некоторых случаях полезно очищать субстрат плазмой для повышения его гидрофильности. Для жидких образцов, особенно водных растворов, которые не содержат каких-либо частиц и/или ячеек, которые могли бы служить распоркой между углеродными пленками, инкапсуляция может быть неудачной, поскольку вся жидкость может вытекать между плоскими поверхностями. Использование графеновой жидкой ячейки, приготовленной с использованием дырявой подложки, которая создает небольшие «карманы» для жидкости, может быть более подходящим33.
Наблюдения ТЕА, выполненные в жидкости, могут быть нарушены несколькими факторами, связанными с пробоподготовкой, и неблагоприятными эффектами, вызванными электронным пучком. Первый включает в себя отслоение подложек и движение жидкости, часто сопровождаемое разрушением углеродной пленки, что происходит для больших объемов жидкости в области и /или при электронном облучении. Этого можно избежать, минимизировав объем жидкости на этапе 2.5. протокола.
Облучение высокоэнергетическими электронами приводит к переносу энергии, что приводит к нагреву или радиолизу. После взаимодействия с излучением вода разлагается на радикалы (H· и OH·),H2 и сольватированные электроны. Эти виды участвуют в дальнейших реакциях, тем самым генерируя различные продукты и нанося ущерб образцу34. Поэтому очень важно поддерживать низкую дозу электронов во время наблюдений (шаг 3.2.), особенно для чувствительных образцов, таких как клетки. Другими эффектами, вызванными электронным пучком, являются осаждение из раствора (рисунок 4А) и вспенивание жидкости (рисунок 4C). Снижение дозы электронов помогает избежать этих двух негативных эффектов, но иногда устранить их не удается. Также может быть некоторое радиационно-чувствительное загрязнение в растворе, которое оседает на ячейке (рисунок 4B) и изменяется под воздействием электронного пучка. Это неблагоприятно, так как примесь может быть принята как часть клетки, которая повреждается при световом облучении, что приводит к неправильным выводам. Лучший способ получить надежные изображения — найти незагрязненную область и сохранить дозу электронов как можно ниже.
Надежные исследования фотореаций IN SITU TEM требуют хорошего сравнения процессов, индуцированных светом, с процессами, вызванными электронным пучком. За исключением снижения дозы электронов, описанной на этапе 3.2., полезно выключить источник электронов на время освещения света, чтобы можно было наблюдать ненарушенные результаты, как подчеркивается на этапе 4.3. протокола.
Настоящий протокол может быть использован для наблюдения световых реакций (особенно в жидкости), например, света на металлических нанокластерах2, светоиндуцированных процессов катализа1 и влияния света на биологические образцы (например, клетки с фотосенсибилизатором, хлоропласты).
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Исследование было поддержано грантом Miniatura (2019/03/X/NZ3/02100, Национальный научный центр, Польша).
Материалы
| Name | Company | Catalog Number | Comments |
| Carbon film on 200 mesh copper grid | Agar Scientific | AGS160 | The standard TEM grids for observations and liquid cell preparation |
| Crossover Tweezers | Dumont | N5 | The tweezers are neecesarry for liquid cell preparation |
| Photodiode Power Sensor | ThorLabs | S130C | The sensor used for light intensity measurement |
| Polyimide-Coated Multimode Fiber | Thorlabs | FG400UEP | Must be built into the microscope using the on-site built adapter, according to the 10.1016/j.ultramic.2021.113388 |
| Transmission Electron Microscope | Hitachi | H-800 | Can be replaced with any side-entry microscope, available for modification |
| Tuneable Diode Laser | CNI | MRL-III-660D | The light wavelength must be chosen basing on photosensitizer's absorption spectrum |
Ссылки
- Vadai, M., Angell, D. K., Hayee, F., Sytwu, K., Dionne, J. A. In-situ observation of plasmon-controlled photocatalytic dehydrogenation of individual palladium nanoparticles. Nature Communications. 9 (1), 1-8 (2018).
- Weng, B., et al. Visualizing light-induced dynamic structural transformations of Au clusters-based photocatalyst via in situ TEM. Nano Research. 12 (1), 1-5 (2021).
- Cao, K., et al. In situ TEM investigation on ultrafast reversible lithiation and delithiation cycling of Sn@C yolk-shell nanoparticles as anodes for lithium ion batteries. Nano Energy. 40, 187-194 (2017).
- Cavalca, F., et al. In situ transmission electron microscopy of light-induced photocatalytic reactions. Nanotechnology. 23 (7), 075705 (2012).
- Tung, C. -. W., et al. Light-induced activation of adaptive junction for efficient solar-driven oxygen evolution: In situ unraveling the interfacial metal-silicon junction. Advanced Energy Materials. 9 (31), 1901308 (2019).
- Żak, A. M., Kaczmarczyk, O., Piksa, M., Matczyszyn, K. Light-induced in situ transmission electron microscopy: Novel approach for antimicrobial photodynamic therapy imaging. Photodiagnosis and Photodynamic Therapy. 35, 102463 (2021).
- Shindo, D., et al. Development of a multifunctional TEM specimen holder equipped with a piezodriving probe and a laser irradiation port. Journal of Electron Microscopy. 58 (4), 245-249 (2009).
- Zhang, C., et al. Photosensing performance of branched CdS/ZnO heterostructures as revealed by in situ TEM and photodetector tests. Nanoscale. 6 (14), 8084-8090 (2014).
- Zhang, C., et al. Statistically analyzed photoresponse of elastically bent CdS nanowires probed by light-compatible in situ high-resolution TEM. Nano Letters. 16 (10), 6008-6013 (2016).
- Yoshida, K., Yamasaki, J., Tanaka, N. In situ high-resolution transmission electron microscopy observation of photodecomposition process of poly-hydrocarbons on catalytic TiO2 films. Applied Physics Letters. 84 (14), 2542-2544 (2004).
- Yoshida, K., Nozaki, T., Hirayama, T., Tanaka, N. In situ high-resolution transmission electron microscopy of photocatalytic reactions by excited electrons in ionic liquid. Journal of Electron Microscopy. 56 (5), 177-180 (2007).
- Textor, M., De Jonge, N. Strategies for preparing graphene liquid cells for transmission electron microscopy. Nano Letters. 18 (6), 3313-3321 (2018).
- Ring, E. A., De Jonge, N. Microfluidic system for transmission electron microscopy. Microscopy and Microanalysis. 16 (5), 622-629 (2010).
- Inayoshi, Y., Minoda, H. A carbon sandwich environmental cell for wet specimens. Journal of Electron Microscopy. 62 (6), 623-628 (2013).
- Koo, K., Dae, K. S., Hahn, Y. K., Yuk, J. M. Live cell electron microscopy using graphene veils. Nano Letters. 20 (6), 4708-4713 (2020).
- De Jonge, N., Peckys, D. B. Live cell electron microscopy is probably impossible. ACS Nano. 10 (10), 9061-9063 (2016).
- Kennedy, E., Nelson, E. M., Damiano, J., Timp, G. Gene expression in electron-beam-irradiated bacteria in reply to "live cell electron microscopy is probably impossible.". ACS Nano. 11 (1), 3-7 (2017).
- Alves, E., et al. An insight on bacterial cellular targets of photodynamic inactivation. Future Medicinal Chemistry. 6 (2), 141-164 (2014).
- Cieplik, F., et al. Antimicrobial photodynamic therapy-What we know and what we don't. Critical Reviews in Microbiology. 44 (5), 571-589 (2018).
- Huang, L., et al. Type I and Type II mechanisms of antimicrobial photodynamic therapy: An in vitro study on gram-negative and gram-positive bacteria. Lasers in Surgery and Medicine. 44 (6), 490-499 (2012).
- Caminos, D. A., Spesia, M. B., Pons, P., Durantini, E. N. Mechanisms of Escherichia coli photodynamic inactivation by an amphiphilic tricationic porphyrin and 5,10,15,20-tetra(4-N,N,N-trimethylammoniumphenyl) porphyrin. Photochemical and Photobiological Sciences. 7 (9), 1071-1078 (2008).
- Chu, J. C. H., Chin, M. L., Wong, C. T. T., Hui, M., Lo, P. C., Ng, D. K. P. One-pot synthesis of a cyclic antimicrobial peptide-conjugated phthalocyanine for synergistic chemo-photodynamic killing of multidrug-resistant bacteria. Advanced Therapeutics. 4 (3), 1-10 (2021).
- Rogers, S., Honma, K., Mang, T. S. Confocal fluorescence imaging to evaluate the effect of antimicrobial photodynamic therapy depth on P. gingivalis and T. denticola biofilms. Photodiagnosis and Photodynamic Therapy. 23, 18-24 (2018).
- Maldonado-Carmona, N., et al. Porphyrin-loaded lignin nanoparticles against bacteria: A photodynamic antimicrobial chemotherapy application. Frontiers in Microbiology. 11, 606185 (2020).
- Żak, A. M., Kaczmarczyk, O., Piksa, M., Grzęda, J., Matczyszyn, K. Fiber-optic sample illuminator design for the observation of light induced phenomena with transmission electron microscopy in situ: Antimicrobial photodynamic therapy. Ultramicroscopy. 230, 113388 (2021).
- Dinh, V. P., et al. Insight into the adsorption mechanisms of methylene blue and chromium(III) from aqueous solution onto pomelo fruit peel. RSC Advances. 9 (44), 25847-25860 (2019).
- Żak, A. Guide to controlling the electron dose to improve low-dose imaging of sensitive samples. Micron. 145, 103058 (2021).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Section D. 74 (6), 560-571 (2018).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadaza, M. G. Variations on negative stain electron microscopy methods: Tools for tackling challenging systems. Journal of Visualized Experiments. (132), (2018).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: From grid preparation to image acquisition. Journal of Visualized Experiments. (58), (2011).
- Rames, M., Yu, Y., Ren, G. Optimized negative staining: A high-throughput protocol for examining small and asymmetric protein structure by electron microscopy. Journal of Visualized Experiments. (90), e51087 (2014).
- Miller, B. K., Crozier, P. A. System for in situ UV-visible illumination of environmental transmission electron microscopy samples. Microscopy and Microanalysis. 19 (2), 461-469 (2013).
- Yuk, J. M., et al. High-resolution EM of colloidal nanocrystal growth using graphene liquid cells. Science. 336 (6077), 61-64 (2012).
- Schneider, N. M., et al. Electron-Water interactions and implications for liquid cell electron microscopy. Journal of Physical Chemistry C. 118 (38), 22373-22382 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены