Method Article
液体-ソフトマター相互作用観察のための光誘起 In situ 透過型電子顕微鏡
要約
本プロトコルは、光照明システムによる透過型電子顕微鏡(TEM)の修飾、液体細胞の作製、および細菌細胞と光増感剤との間の光誘起相互作用の in situTEM 観察について説明する。サンプル調製方法、電子線損傷、およびイメージングについても説明します。
要約
現在のプロトコルは、 in situ 光誘起観察のための透過型電子顕微鏡(TEM)セットアップの変更を説明しています。対物レンズポールピースの上の電子柱にガラス光ファイバーを挿入し、調整可能な光源であるレーザーを使用してデバイスを作製しました。照明器が外部測定システムを使用して校正された後、観察されたプロセスのニーズに合わせて照明の強度を調整することができます。この照明システムは、現在熱心に研究されている抗菌光線力学療法現象を画像化するために利用されました。サンプルは、炭素、グラフェン、または窒化ケイ素基板上に細菌の懸濁液をスポットし、余分な溶液を吸い取り、光増感剤溶液をスポットし、余分な液体を再度吸い取り、次に液体セルを組み立てることによって調製されました第2の基板またはグラフェン膜。イメージング実験自体のプロセスには、低倍率および最小量の電子を使用して観察に適した場所を選択し、次に光源を周期的に活性化して、必要な最小限の電子量で指定された間隔で後続の画像をキャプチャすることが含まれます。各露光の電子線量と使用される照明の時間と強度は、観察された現象の複雑さのために注意深く記録する必要があり、同時にプロセスは光と電子の両方駆動です。実際の実験が行われた後、同じ線量の電子が使用されるが、追加の光の影響がなく、より小さな線量の電子がより高い線量の光に使用される追加の制御観察が行われる必要がある。これにより、生命科学と材料科学の両分野において、光誘起微細構造効果と電子による構造効果を区別することができます。
概要
高分解能の光誘起現象は、ナノエンジニアリング1,2,3、触媒4,5、バイオフォトニクス6など多くの分野で興味深いものです。そのような実験を可能にするいくつかのオリジナルの設計は、サンプルホルダー1、4、7、8、9および顕微鏡10、11に取り付けられた光ファイバの変更を含む文献に見出すことができる。
光照明、液体環境、透過型電子顕微鏡(TEM)の組み合わせは、光誘起プロセスの詳細な動的研究のための絶好の機会を提供します。しかしながら、顕微鏡内部の高真空条件は、多くの液体、特に水溶液にとってかなり不利である。環境から保護する液体カプセル化は、主にグラフェン12、窒化ケイ素13、または炭素14基板に基づくいくつかの技術を使用して達成できます。材料科学2の研究に加えて、いわゆる液体セルは、本来の状態に近い生物試料の従来とは異なる顕微鏡観察を行う可能性を提供します15。このような観察は、特に細菌細胞などの生きている微生物にとって非常に要求が厳しいものです。電離放射線としての電子ビームは、水和した試料に不可逆的な損傷を引き起こすため、電子線量を指定する必要があります16。これは、好ましくない影響を最小限に抑え、損傷を制御し、混乱を招くアーティファクトを回避するために必要です。生細胞の観察を可能にする最適な最大電子線量は依然として疑わしいトピック16ですが、少なくとも細菌17では、30 e−/nm2の線量が閾値であるように思われます。
このような顕微鏡研究の対象となる主題のいくつかは、抗菌光線力学療法(APDT)18中のプロセスです。要するに、治療は次のように進行する。細菌細胞は、光増感剤と呼ばれる感光性液体に囲まれています。特定の波長で光照射が行われると、励起された光増感剤分子から溶液中に自然に存在する酸素へのエネルギーまたは電荷移動から細胞傷害性活性酸素種(ROS)が生成されます。ROSにさらされた病原体は、副作用なしに非常に高い効率で迅速に不活化されます19。治療に対する反応は微生物によって異なり、例えば、グラム陽性菌とグラム陰性菌では同じ光増感剤の影響がかなり異なる可能性があります20。一般に、ROSの主な標的は細胞の外部構造であり、損傷は細胞膜の機能障害をもたらし、その結果、細菌の死につながることが確立されています21,22。しかし、核酸とプロテインスキャンの損傷も不活性化の原因と考えられているため18、このプロセス中にどの細胞構造が主な標的であるかはまだ不明です19。有害なプロセスをより深く理解することは、この根治的な治療法を改善するのに役立つ可能性があります。APDT研究23で使用される光学顕微鏡法と比較して、TEM技術は、より高い解像度と倍率でAPDTメカニズムを見るためのより多くの可能性を提供します24。TEMはすでに進行中の治療中の細胞観察にうまく使用されており、グラム陽性細菌を研究することができました損傷と変化を説明する細胞壁内で発生する6,25。
現在のプロトコルは、適切な光照明システム、液体による細胞のカプセル化、および厳密な電子線量制御を必要とするTEMを使用した光誘発細菌不活性化の高解像度イメージングに適した実験セットアップを提供します。観察に用いた細菌は 黄色ブドウ球菌で、メチレンブルー溶液を光増感剤として使用した。特殊な光照明セットアップは、光ファイバーを使用して顕微鏡カラムに直接接続された調整可能な半導体レーザーで構成されています。この設計は、光ファイバーが顕微鏡軸に対してほぼ平行に配置されているため、サンプル全体に均一な照射を提供します。レーザーによって生成された高強度の単色光を使用して、さまざまな光化学的効果を研究することができます。実験で使用した光は、可視領域において、メチレンブルーが613nmおよび664nmに吸収ピークを有するため、波長は660nmに等しい26であった。液体カプセル化のプロトコルは炭素基質に基づいているため、手順が迅速かつ複雑になりません。最後に、液体中の細胞の低線量 in situTEM 観察の方法を紹介します。サンプル調製の難しさ、敏感な標本に対する電子線量の影響、および合理的な画像解釈について説明します。
プロトコル
1. 透過型電子顕微鏡の修正
- 対物レンズ上部の顕微鏡カラムに光ファイバ( 材料表を参照)を接続して、透過型電子顕微鏡を変更します。対物レンズとコンデンサーレンズの間に数センチのスペースを確保し、さらにアクセサリー用の空きスロットを確保します。
注:専用のサンプルホルダー4 または逆構成1 のカソードルミネッセンス観察用のホルダーも使用できます。 - 粗い真空ポンプを使用してシステムに漏れがないか確認してください。システムに真空漏れが見られない場合は、高真空下でシステムをテストします。
- 真空システムの作動が標準の通気顕微鏡始動から逸脱していないことを確認してください。モジュールの実行、組み立て、または試運転に問題がある場合は、認定サービス担当者またはデバイスの製造元に連絡してください。
注意: 正しく作成および取り付けられたイルミネーターは、電子ビームを覆い隠すことはありません。顕微鏡の動作中にビームが連続してシフトすると、非導電性の光ファイバが金属シールドで十分に覆われず、電荷が蓄積されます。この場合、光ファイバを導電性ジャケットの奥深くまでスライドさせます。
- 真空システムの作動が標準の通気顕微鏡始動から逸脱していないことを確認してください。モジュールの実行、組み立て、または試運転に問題がある場合は、認定サービス担当者またはデバイスの製造元に連絡してください。
- フォトダイオードパワーセンサーを使用して光強度を測定し ます(材料の表を参照)。対物レンズのポールピース間のスペースで顕微鏡内で測定できない場合は、サンプルとイルミネーターの形状を測定し、外部測定セットアップでこれらの条件を再現します。
- 顕微鏡に電子線量測定システムが装備されていない場合は、ファラデーカップ( 材料表参照)でビーム電流を測定し、試料27に当たる電子の密度を数値的に計算して校正を行う。
2.光増感剤による細菌のカプセル化
- アモルファスカーボンで覆われた2つの未処理のTEMグリッドを、カーボンコーティングされた側を上に向けて2つの交差したピンセットの間に配置します。グリッドをできるだけ端に近づけます。
注:特定の基板、溶液、およびサンプルの組み合わせでは、一方または両方のメッシュでグロー放電を使用して、工場の不純物を除去し、最大の親水性表面28を得ることが有益な場合があります。 黄色ブドウ球菌 とメチレンブルー溶液の例を使用して、追加のグロー放電またはプラズマ洗浄なしで、銅グリッド上の新しい未処理カーボンで最良かつ最も再現性のある結果が得られると判断されました6。 - グリッドの1つに4μLの細菌溶液を置きます。サンプルの光学密度は5〜10の範囲でなければなりません。
注:研究で使用した細菌は培養物から精製され、PBSバッファーに分散されました。利用可能な確立されたプロトコルに従って、例えば陰性染色法を使用して、新鮮なサンプルを使用するたびに新鮮なサンプル中の細菌の濃度をチェックすることを強くお勧めします29,30,31。 - 60秒待ち、ろ紙を使用して液体を慎重に吸い取ります。このプロセス中は、グリッド表面全体に液体を広げてみてください。
- 同じグリッドに4μLの光増感剤を置きます。
注:2μg/mLの濃度のメチレンブルーを本研究の光増感剤として使用しました。 - 5秒後、液体を吸い取ります。基板上に非常に薄い液体の層を残します。
- 乾いたグリッドを液体で覆われたものの上にすばやく置きます。
- 上のグリッドを2番目のグリッドの端にそっと移動し、ピンセットを使用して端の基板を絞ります。
注:この段階でサンプルから液体が流出する可能性があるため、十分に排出されていません。しかしながら、これは必ずしも液体セルの形成が失敗することを意味するわけではない。 - 慎重に絞りを繰り返します。
注意: ピンセットを90°回転させてテーブルに垂直になり、両方のピンセットの先端が開閉位置に依存しない同じ高さのままになるようにすることで、この手順を実行する方が簡単です。 - ピンセットの間に液体セルを1分間置いておきます。
- 試料作製が終了した直後にサンプルをTEMホルダーに挿入します。
注意: ホルダー取り付けプレート/リングの張力は、基板が付着し、液体を内部に保つのに役立ちます。- 可能であれば、試料ホルダーを外部ポンプステーションにポンプで送り、液体を蒸発させて顕微鏡の汚染を減らします。
3. 液体電子線量効果による細菌細胞の その場 TEM観察
- サンプルを顕微鏡に挿入します。
- 低倍率モードで観測を開始し、適切な観測エリアを見つけます。
注:暗い領域は、電子ビーム散乱のために液体である可能性が最も高いです。- 観測中は、電子線量をできるだけ低く保ってください。露光時間を拡大します(加速電圧150kV、倍率5,000倍で最大2秒)。ボトムマウントカメラの倍率5,000倍(視野は約10μm)で、直径1~1μmの細菌を撮像するのに十分です。
注:液体を区別するのは簡単ではない場合があるため、観測の開始時に、電子ビームを液体である可能性が高い場所に集束させると便利です。液体は集束された電子ビーム上を移動する必要があり、気泡が現れます。この検証の後、さらなる観察のために別の領域を見つける必要があります。
- 観測中は、電子線量をできるだけ低く保ってください。露光時間を拡大します(加速電圧150kV、倍率5,000倍で最大2秒)。ボトムマウントカメラの倍率5,000倍(視野は約10μm)で、直径1~1μmの細菌を撮像するのに十分です。
- 液体に囲まれた細胞を適切な倍率で長時間露光して見つけ、最初の画像をすぐにキャプチャします。電子線量を一定に保ち、30秒ごとに画像を収集して変化を観察します。
- 画像を注意深く調べ、細胞内の最初の目に見える変化に対応する総電子線量27 を計算します。
4. 菌体と光増感剤間の光誘起過程の その場 TEM観察
- 実験を開始する前に、電流値を調整してレーザー光の強度を設定してください。光増感剤の吸収スペクトルに応じて適切な波長を選択してください。前のキャリブレーションプロット(ステップ1.4)に従って、最低光強度に対応する現在の値を選択します。
注:この研究で使用された光の波長は660nmでした。 - サンプルを顕微鏡に挿入し、ステップ3.2に従って観察領域を見つけます。前のセクションで。
- サンプルの照射を開始する前に細胞の最初の画像をキャプチャし、ビームブランカーを使用して電子ビームをオフにして、電子照射の影響を回避します。
- レーザーをオンにします。レーザー光は比較的強度が高いため、短い照明時間(ここでは30秒)から始めます。その後、光源をオフにします。
- ビームブランカーをオフにして、すぐに画像をキャプチャします。可能であれば、自動アルゴリズムを使用して、画像の撮影に必要な時間だけサンプルを公開します。電子照射時間を注意深く測定し、撮像に用いる電子線量27 を算出する。
- 手順 4.4 を繰り返します。およびステップ4.5。をクリックして、予想される光の照明時間を取得します。
結果
実験セットアップは、液体中で発生する光誘起プロセスを高解像度で観察するように設計されました。画像の競合分析により、電子ビームによる損傷と光化学反応に関連する変化を区別することができました。敏感な試料(この場合、液体でカプセル化された細胞)に対する電子ビームの影響は、電子が均一に透過するため、照射領域のいたるところに見られました。もちろん、効果は電子線量に依存するため、より集束されたビームでは、サンプル形態のより重要な変化をより早く観察できます。この深刻な損傷と比較して、光力学的不活性化の実際の破壊的影響は、照射された光増感剤に囲まれた領域でのみ細胞の特定の部分で発生しました。
細菌イメージングの例では、文献によると、30 e−/nm2の線量は細菌17の致死閾値であるように思われ、著者の以前の研究で大幅に超えていました6,25。しかしながら、6000 e−/nm2の電子線量に達する前に、細胞内の目に見える変化は気づかなかった。結果は、1分後の光増感剤の光照射により発生する活性酸素種に起因する細胞の外層の劣化が顕著であることを示した(図1)。さらに光を照射すると、変化がより見やすくなりました(図1D、G)。
炭素基質間の細胞のカプセル化は、少なくとも1時間にわたって一定の観察を行うのに十分であった。十分な液体を含む適切な観察スポットは、これらの領域がより暗くぼやけて見えるため、低倍率で簡単に見つけることができます( 図2Aのフレームで示されています)。液体で覆われた細菌は、乾燥した細菌よりも目立ちませんが、それでも区別できます(図2B)。イメージング中に液体の境界を見ると便利であり、その動きを簡単に検出できるため、選択した領域が不適切で不安定である可能性があることを意味します(図3)。観察中の別の問題は、水の蒸発と溶液の沈殿であり、これは細菌の周囲の領域を含むサンプルのランダムな領域で発生する可能性があります(図3B、C)。

図1:細菌の光力学的処理の例示的な結果。 (a)細菌細胞とメチレンブルーを含む液体細胞のスキーム。(b)光照射前のセル。(C)1分間照射後の細胞(D)10分間照射後の細胞(E-G)(B-D)から拡大した領域。電子線量は、それぞれ1600 e−/nm 2、2500 e−/nm 2、および6000 e−/nm 2に等しかった。この図はŻakら25から再現されています。この図の拡大版を表示するには、ここをクリックしてください。

図2:2つの炭素膜の間にメチレンブルーを封入した黄色ブドウ球菌のTEM画像。 (A)低倍率画像は、両方の領域に大量の液体(黄色の枠で示されている)と乾燥した斑点を示します。この倍率でサンプルをすばやく調べると、カプセル化が成功したかどうかに関する情報が得られます。 (B)拡大された領域に液体の境界がはっきりと見え、光増感剤で覆われた細菌を区別できます。この図の拡大版を表示するには、ここをクリックしてください。

図3:イメージング中に発生する可能性のある好ましくない影響のTEM画像 。 (A)当初、細胞は液体に均一に囲まれており、観察領域の大部分を覆っていました。(b)一定の電子線照射に基づいて、液体の移動と蒸発、および溶液からの沈殿の開始に気付くことができます。(C)プロセスの継続は、光増感剤の不可逆的な動き、発泡、および崩壊をもたらし、それ以上の観察を不可能にします。 この図の拡大版を表示するには、ここをクリックしてください。
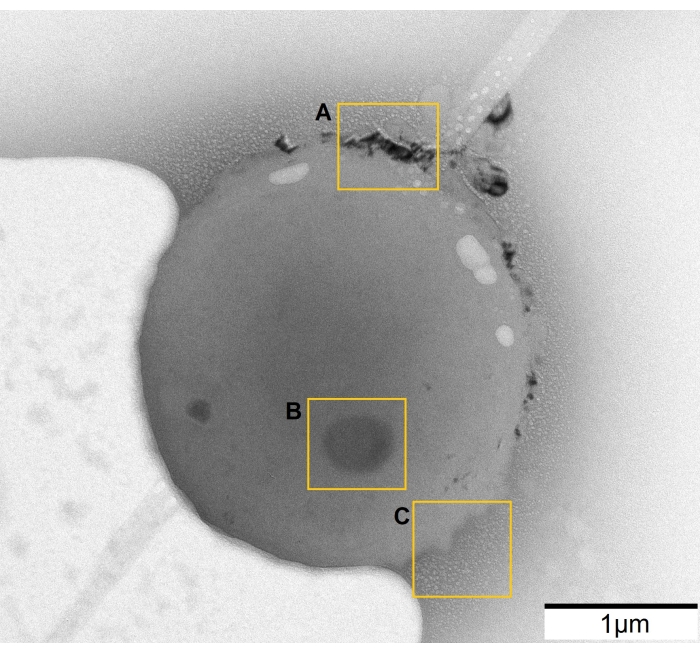
図4:間違った結論につながる好ましくない影響 。 (a)結晶化した液体。(B)汚染が細胞に落ち着いた。(c)電子線による発泡。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
照明器の設置と試運転には基本的なサービス知識が必要であり、顕微鏡を損傷する可能性があります。顕微鏡に光を導入する最も簡単な方法は、通常TEM偏向コイルと追加の検出器のためのスペースがある対物レンズの上部から光ファイバーを接続することです。同じ場所にサンプル真空ロックとサンプル設置メカニズムを収容する古いトップエントリーデバイスからは、より多くの空きスペースも期待できます。この構成は、例示的な照明器設計を含む以前のレポート25に広く記載されている。顕微鏡の内部が対物レンズの上方に光ファイバの設置を許可しない場合、照明器は側面32から対物レンズポールピースの内部に設置されてもよい。他の解決策は、専用のサンプルホルダー4 を使用するか、またはカソードルミネッセンス観察1のためのホルダーの逆の使用を想定しています。
一般に、TEM用の液体サンプルの調製は複雑であり、経験と手動のスキルが必要です。液体セル調製の重要なステップはステップ2.6です。プロトコルの。液体の蒸発を避けるために、2番目のグリッドをすばやく配置することが重要です。ここで紹介する方法は簡単で、珍しい材料を必要としません。ただし、すべての液体に適しているとは限りません。場合によっては、親水性を高めるためにプラズマで基板を洗浄することが有益です。液体サンプル、特に炭素膜間のスペーサーとして機能する可能性のある粒子やセルを含まない水溶液の場合、すべての液体が平らな表面の間から流出する可能性があるため、カプセル化が失敗する可能性があります。液体用の小さな「ポケット」を作成する穴のある基板を使用して調製されたグラフェン液体セルを使用することがより適している可能性があります33。
液体中で行われるTEM観察は、サンプル調製に関連するいくつかの要因と電子ビームによって引き起こされる好ましくない影響によって妨げられる可能性があります。1つ目は、基板の剥離と液体の移動を含み、多くの場合、その領域および/または電子照射時に大量の液体に対して発生する炭素膜の破壊が続きます。これは、ステップ2.5で液体量を最小化することで回避できます。プロトコルの。
高エネルギーの電子を照射すると、エネルギー移動が起こり、加熱や放射線分解が起こります。放射線との相互作用の後、水はラジカル(H・およびOH・)、H2、および溶媒和電子に分解する。これらの種はさらなる反応に関与し、したがって異なる生成物を生成し、試料34に損傷を引き起こす。したがって、観察中(ステップ3.2)の間、特に細胞のような敏感な標本では、電子線量を低く保つことが非常に重要です。電子ビームによって引き起こされる他の影響は、溶液からの沈殿(図4A)および液体の発泡(図4C)である。電子線量を下げることは、これら2つの悪影響を回避するのに役立ちますが、時にはそれらを排除することが不可能である。また、溶液中に放射線に敏感な汚染が存在する可能性があり、それは細胞に落ち着き(図4B)、電子線の影響で変化します。これは、不純物が細胞の一部として取り込まれ、光照射時に損傷を受け、誤った結論につながる可能性があるため、好ましくありません。信頼性の高い画像を得る最良の方法は、汚染されていない領域を見つけ、電子線量をできるだけ低く保つことです。
光反応の信頼性の高い in situTEM 研究では、光によって誘発されるプロセスと電子線によって引き起こされるプロセスとの良好な比較が必要です。ステップ3.2で説明した電子線量を下げることを除いて、ステップ4.3で強調したように、邪魔されない結果を観察できるように、光照明の時間の間電子源をオフにすることは有用です。プロトコルの。
本プロトコルは、光誘起反応(特に液体中)、例えば、金属ナノクラスター2上の光、光誘起触媒プロセス1、および生物学的試料(例えば、光増感剤を有する細胞、葉緑体)に対する光の影響を観察するために使用することができる。
開示事項
著者は開示するものは何もありません。
謝辞
本研究は、Miniatura助成金(2019/03/X/NZ3/02100、ポーランド国立科学センター)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Carbon film on 200 mesh copper grid | Agar Scientific | AGS160 | The standard TEM grids for observations and liquid cell preparation |
| Crossover Tweezers | Dumont | N5 | The tweezers are neecesarry for liquid cell preparation |
| Photodiode Power Sensor | ThorLabs | S130C | The sensor used for light intensity measurement |
| Polyimide-Coated Multimode Fiber | Thorlabs | FG400UEP | Must be built into the microscope using the on-site built adapter, according to the 10.1016/j.ultramic.2021.113388 |
| Transmission Electron Microscope | Hitachi | H-800 | Can be replaced with any side-entry microscope, available for modification |
| Tuneable Diode Laser | CNI | MRL-III-660D | The light wavelength must be chosen basing on photosensitizer's absorption spectrum |
参考文献
- Vadai, M., Angell, D. K., Hayee, F., Sytwu, K., Dionne, J. A. In-situ observation of plasmon-controlled photocatalytic dehydrogenation of individual palladium nanoparticles. Nature Communications. 9 (1), 1-8 (2018).
- Weng, B., et al. Visualizing light-induced dynamic structural transformations of Au clusters-based photocatalyst via in situ TEM. Nano Research. 12 (1), 1-5 (2021).
- Cao, K., et al. In situ TEM investigation on ultrafast reversible lithiation and delithiation cycling of Sn@C yolk-shell nanoparticles as anodes for lithium ion batteries. Nano Energy. 40, 187-194 (2017).
- Cavalca, F., et al. In situ transmission electron microscopy of light-induced photocatalytic reactions. Nanotechnology. 23 (7), 075705 (2012).
- Tung, C. -. W., et al. Light-induced activation of adaptive junction for efficient solar-driven oxygen evolution: In situ unraveling the interfacial metal-silicon junction. Advanced Energy Materials. 9 (31), 1901308 (2019).
- Żak, A. M., Kaczmarczyk, O., Piksa, M., Matczyszyn, K. Light-induced in situ transmission electron microscopy: Novel approach for antimicrobial photodynamic therapy imaging. Photodiagnosis and Photodynamic Therapy. 35, 102463 (2021).
- Shindo, D., et al. Development of a multifunctional TEM specimen holder equipped with a piezodriving probe and a laser irradiation port. Journal of Electron Microscopy. 58 (4), 245-249 (2009).
- Zhang, C., et al. Photosensing performance of branched CdS/ZnO heterostructures as revealed by in situ TEM and photodetector tests. Nanoscale. 6 (14), 8084-8090 (2014).
- Zhang, C., et al. Statistically analyzed photoresponse of elastically bent CdS nanowires probed by light-compatible in situ high-resolution TEM. Nano Letters. 16 (10), 6008-6013 (2016).
- Yoshida, K., Yamasaki, J., Tanaka, N. In situ high-resolution transmission electron microscopy observation of photodecomposition process of poly-hydrocarbons on catalytic TiO2 films. Applied Physics Letters. 84 (14), 2542-2544 (2004).
- Yoshida, K., Nozaki, T., Hirayama, T., Tanaka, N. In situ high-resolution transmission electron microscopy of photocatalytic reactions by excited electrons in ionic liquid. Journal of Electron Microscopy. 56 (5), 177-180 (2007).
- Textor, M., De Jonge, N. Strategies for preparing graphene liquid cells for transmission electron microscopy. Nano Letters. 18 (6), 3313-3321 (2018).
- Ring, E. A., De Jonge, N. Microfluidic system for transmission electron microscopy. Microscopy and Microanalysis. 16 (5), 622-629 (2010).
- Inayoshi, Y., Minoda, H. A carbon sandwich environmental cell for wet specimens. Journal of Electron Microscopy. 62 (6), 623-628 (2013).
- Koo, K., Dae, K. S., Hahn, Y. K., Yuk, J. M. Live cell electron microscopy using graphene veils. Nano Letters. 20 (6), 4708-4713 (2020).
- De Jonge, N., Peckys, D. B. Live cell electron microscopy is probably impossible. ACS Nano. 10 (10), 9061-9063 (2016).
- Kennedy, E., Nelson, E. M., Damiano, J., Timp, G. Gene expression in electron-beam-irradiated bacteria in reply to "live cell electron microscopy is probably impossible.". ACS Nano. 11 (1), 3-7 (2017).
- Alves, E., et al. An insight on bacterial cellular targets of photodynamic inactivation. Future Medicinal Chemistry. 6 (2), 141-164 (2014).
- Cieplik, F., et al. Antimicrobial photodynamic therapy-What we know and what we don't. Critical Reviews in Microbiology. 44 (5), 571-589 (2018).
- Huang, L., et al. Type I and Type II mechanisms of antimicrobial photodynamic therapy: An in vitro study on gram-negative and gram-positive bacteria. Lasers in Surgery and Medicine. 44 (6), 490-499 (2012).
- Caminos, D. A., Spesia, M. B., Pons, P., Durantini, E. N. Mechanisms of Escherichia coli photodynamic inactivation by an amphiphilic tricationic porphyrin and 5,10,15,20-tetra(4-N,N,N-trimethylammoniumphenyl) porphyrin. Photochemical and Photobiological Sciences. 7 (9), 1071-1078 (2008).
- Chu, J. C. H., Chin, M. L., Wong, C. T. T., Hui, M., Lo, P. C., Ng, D. K. P. One-pot synthesis of a cyclic antimicrobial peptide-conjugated phthalocyanine for synergistic chemo-photodynamic killing of multidrug-resistant bacteria. Advanced Therapeutics. 4 (3), 1-10 (2021).
- Rogers, S., Honma, K., Mang, T. S. Confocal fluorescence imaging to evaluate the effect of antimicrobial photodynamic therapy depth on P. gingivalis and T. denticola biofilms. Photodiagnosis and Photodynamic Therapy. 23, 18-24 (2018).
- Maldonado-Carmona, N., et al. Porphyrin-loaded lignin nanoparticles against bacteria: A photodynamic antimicrobial chemotherapy application. Frontiers in Microbiology. 11, 606185 (2020).
- Żak, A. M., Kaczmarczyk, O., Piksa, M., Grzęda, J., Matczyszyn, K. Fiber-optic sample illuminator design for the observation of light induced phenomena with transmission electron microscopy in situ: Antimicrobial photodynamic therapy. Ultramicroscopy. 230, 113388 (2021).
- Dinh, V. P., et al. Insight into the adsorption mechanisms of methylene blue and chromium(III) from aqueous solution onto pomelo fruit peel. RSC Advances. 9 (44), 25847-25860 (2019).
- Żak, A. Guide to controlling the electron dose to improve low-dose imaging of sensitive samples. Micron. 145, 103058 (2021).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Section D. 74 (6), 560-571 (2018).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadaza, M. G. Variations on negative stain electron microscopy methods: Tools for tackling challenging systems. Journal of Visualized Experiments. (132), (2018).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: From grid preparation to image acquisition. Journal of Visualized Experiments. (58), (2011).
- Rames, M., Yu, Y., Ren, G. Optimized negative staining: A high-throughput protocol for examining small and asymmetric protein structure by electron microscopy. Journal of Visualized Experiments. (90), e51087 (2014).
- Miller, B. K., Crozier, P. A. System for in situ UV-visible illumination of environmental transmission electron microscopy samples. Microscopy and Microanalysis. 19 (2), 461-469 (2013).
- Yuk, J. M., et al. High-resolution EM of colloidal nanocrystal growth using graphene liquid cells. Science. 336 (6077), 61-64 (2012).
- Schneider, N. M., et al. Electron-Water interactions and implications for liquid cell electron microscopy. Journal of Physical Chemistry C. 118 (38), 22373-22382 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved