Method Article
מיקרוסקופיית אלקטרונים המושרה על ידי אור באתרו לתצפית על אינטראקציית החומר הנוזלי-רך
In This Article
Summary
הפרוטוקול הנוכחי מתאר שינויים במיקרוסקופ אלקטרונים (TEM) עם מערכת תאורת אור, ייצור תאים נוזליים, ותצפיות in situ TEM של אינטראקציות הנגרמות על ידי אור בין תאי חיידקים לבין פוטוסנסיטייזר. כמו כן נדונו שיטות הכנת הדגימה, נזק לקרן אלקטרונים והדמיה.
Abstract
הפרוטוקול הנוכחי מתאר את השינויים במערך מיקרוסקופ האלקטרונים (TEM) עבור תצפיות הנגרמות על ידי אור באתרו . סיב אופטי מזכוכית שהוכנס לעמוד האלקטרונים מעל קוטב העדשה האובייקטיבית, ולייזר, מקור אור מתכוונן, שימש לייצור המכשיר. לאחר שהתאורה כוילה באמצעות מערכת מדידה חיצונית, היא מאפשרת להתאים את עוצמת התאורה לצרכי התהליך הנצפה. מערכת תאורה זו נוצלה כדי לדמות תופעות של טיפול פוטודינמי אנטי-מיקרוביאלי, שהן כיום נושא למחקר אינטנסיבי. הדגימה הוכנה על ידי איתור תרחיף של חיידקים על מצע פחמן, גרפן או סיליקון ניטריד, הכתמת התמיסה העודפת, איתור תמיסת הפוטוסנסיטייזר, הכתמת הנוזל העודף, ולאחר מכן הרכבת התא הנוזלי עם מצע שני או סרט גרפן. תהליך ניסוי ההדמיה עצמו כולל בחירת המקום הנכון לתצפית תוך שימוש בהגדלה נמוכה ומינון מינימלי של אלקטרונים, ולאחר מכן הפעלה מחזורית של מקור האור כדי ללכוד תמונות עוקבות במרווחים מוגדרים עם כמות האלקטרונים המינימלית הדרושה. מינון האלקטרונים של כל חשיפה וזמן ועוצמת התאורה המשמשים צריכים להיות מתועדים בקפידה בשל המורכבות של התופעות הנצפות, שכן יחד עם זאת, התהליך הוא גם מונחה אור וגם אלקטרונים. לאחר ביצוע הניסוי בפועל, יש לבצע תצפיות בקרה נוספות, שבהן נעשה שימוש במינונים זהים של אלקטרונים אך ללא השפעת אור נוספת ומינונים קטנים יותר של אלקטרונים משמשים למינונים גבוהים יותר של אור. זה מאפשר להבחין בין השפעות מיקרו-סטרוקטורליות הנגרמות על ידי אור לבין אלה הנגרמות על ידי אלקטרונים הן בתחומי החיים והן בתחומי מדע החומרים.
Introduction
תופעות הנגרמות על ידי אור ברזולוציה גבוהה מעניינות בתחומים רבים כגון ננו-הנדסה 1,2,3, קטליזה 4,5 וביו-פוטוניקה6. כמה עיצובים מקוריים המאפשרים ניסויים כאלה ניתן למצוא בספרות, כולל שינויים של מחזיקי המדגם 1,4,7,8,9 והסיבים האופטיים המחוברים למיקרוסקופ 10,11.
השילוב של תאורת אור, סביבה נוזלית ומיקרוסקופיית אלקטרונים (TEM) מעניק הזדמנות מצוינת למחקרים דינמיים מפורטים של תהליכים המושרים על ידי פוטו. עם זאת, מצב הוואקום הגבוה בתוך המיקרוסקופ הוא שלילי למדי עבור נוזלים רבים, במיוחד פתרונות מים. אנקפסולציה נוזלית, המגנה עליו מפני הסביבה, יכולה להיות מושגת באמצעות כמה טכניקות המבוססות בעיקר על גרפן12, סיליקון ניטריד 13, או מצעי פחמן14. בנוסף למחקר במדע החומרים2, מה שמכונה תאים נוזליים מציעים אפשרויות לביצוע תצפיות מיקרוסקופיות לא קונבנציונליות על דגימות ביולוגיות בקרבת התנאים הטבעיים שלהם15. תצפיות כאלה הן תובעניות ביותר, במיוחד עבור מיקרואורגניזמים חיים כגון תאי חיידקים. קרן האלקטרונים כקרינה מייננת גורמת נזק בלתי הפיך לדגימות הלחות, ולכן יש לציין את מינון האלקטרונים16. זה הכרחי כדי למזער השפעות שליליות, לשלוט על הנזק, ולמנוע ממצאים מבלבלים. מינון האלקטרונים המרבי האופטימלי המאפשר תצפיות על תאים חיים הוא עדיין נושא מפוקפק16, אך נראה כי המינון של 30 e−/nm2 הוא ערך הסף, לפחות עבור חיידקים17.
חלק מהנושאים שמעניינים מחקרים מיקרוסקופיים כאלה הם תהליכים במהלך טיפול פוטודינמי אנטי-מיקרוביאלי (APDT)18. בקיצור, הטיפול ממשיך כדלקמן. תאי החיידקים מוקפים בנוזל רגיש לאור הנקרא פוטוסנסיטייזר. כאשר תאורת אור ניתנת באורך גל מסוים, מיני החמצן הריאקטיבי הציטוטוקסי (ROS) נוצרים מהעברת אנרגיה או מטען ממולקולות הפוטוסנסיטייזר המעוררות אל החמצן שנמצא באופן טבעי בתמיסה. פתוגנים שנחשפו ל- ROS מושתקים במהירות ביעילות גבוהה מאוד, ללא תופעות לוואי19. התגובה לטיפול משתנה עבור מיקרובים שונים – לדוגמה, ההשפעה של אותו פוטוסנסיטייזר עשויה להיות שונה לגמרי עבור חיידקים גראם חיוביים וגראם שליליים20. באופן כללי, נקבע כי המטרה העיקרית של ROS היא המבנים החיצוניים של התאים, שם נזק גורם להפרעות תפקודיות של קרום התא, וכתוצאה מכך, להוביל למוות של חיידקים21,22. עם זאת, נזק חומצות גרעין וחלבוניםיכול גם להיחשב גורם של השבתה18, ולכן עדיין לא ידוע אילו מבנים התא הם המטרות העיקריות במהלך תהליך זה19. הבנה מעמיקה יותר של התהליכים המזיקים עשויה לסייע בשיפור הטיפול הסופי הזה. בהשוואה לשיטות מיקרוסקופיית האור המשמשות במחקר APDT23, טכניקות TEM נותנות אפשרויות רבות יותר להסתכל על מנגנון APDT עם רזולוציה והגדלהגבוהות יותר 24. TEM כבר שימש בהצלחה לתצפית תאים במהלך טיפול מתמשך, מה שאיפשר לנו לחקור חיידקים גראם-חיוביים ולתאר את השינויים המתרחשים בתוך דופן התא בפירוט 6,25.
הפרוטוקול הנוכחי מציג מערך ניסויי מתאים להדמיה ברזולוציה גבוהה של השבתת חיידקים הנגרמים על ידי אור באמצעות TEM, הדורשת מערכת תאורת אור תקינה, עטיפת תאים עם נוזל ובקרת מינון אלקטרונים קפדנית. החיידק ששימש לתצפית היה סטפילוקוקוס אאורוס, ותמיסת מתילן כחולה שימשה כפוטוסנסיטייזר. מערך תאורת האור המיוחד כולל לייזר מוליך למחצה הניתן לכוונון המחובר ישירות לעמוד המיקרוסקופ באמצעות סיבי האור. תכנון זה מספק הקרנה אחידה לאורך כל הדגימה בגלל המיקום הכמעט מקביל של הסיב האופטי לציר המיקרוסקופ. אור מונוכרומטי בעוצמה גבוהה שנוצר על ידי הלייזר יכול לשמש לאחר מכן כדי לחקור השפעות פוטוכימיות שונות. לאור ששימש בניסוי היה אורך גל השווה ל-660 ננומטר מכיוון שבאזור הנראה, למתילן כחול יש שיאי בליעה ב-613 ננומטר ו-664 ננומטר26. הפרוטוקול לאנקפסולציה נוזלית מבוסס על מצעי פחמן, מה שהופך את ההליך למהיר ולא מסובך. לבסוף, מוצגת שיטה לתצפית במינון נמוך באתרה TEM של תאים בנוזל . נדונים הקשיים לגבי הכנת הדגימה, השפעות מינון האלקטרונים על הדגימה הרגישה ופענוח תמונה סביר.
Protocol
1. שינוי מיקרוסקופ אלקטרונים הילוכים
- שנה את מיקרוסקופ האלקטרונים המעביר על-ידי חיבור הסיב האופטי (ראו טבלת חומרים) לעמודת המיקרוסקופ בחלק העליון של העדשה האובייקטיבית. אפשר מרווח של כמה סנטימטרים בין העדשה האובייקטיבית לעדשת המעבה, בתוספת חריץ פנוי לאביזרים.
הערה: ניתן להשתמש גם במחזיק מדגםייעודי 4 או מחזיק לתצפיות קתודולומינסנטיות בתצורה הפוכה1 . - בדוק את המערכת עבור דליפות באמצעות משאבות ואקום גס. אם המערכת אינה מציגה דליפת ואקום, בדוק את המערכת תחת ואקום גבוה.
- בדוק כי ההפעלה של מערכת הוואקום אינה חורגת מהתחלת המיקרוסקופ האוורור הסטנדרטי. במקרה של בעיות בביצוע, בהרכבה או בהזמנה של המודול, פנה לאנשי שירות מורשים או ליצרן ההתקן.
הערה: התאורה המיוצרת והמותקנת כהלכה לא תסתיר את קרן האלקטרונים. אם הקרן תזוז ברצף במהלך פעולת המיקרוסקופ, הסיב האופטי הלא מוליך לא יכוסה מספיק במגן מתכת ויצבור מטען חשמלי. במקרה זה, החלק את הסיב האופטי עמוק לתוך המעיל המוליך.
- בדוק כי ההפעלה של מערכת הוואקום אינה חורגת מהתחלת המיקרוסקופ האוורור הסטנדרטי. במקרה של בעיות בביצוע, בהרכבה או בהזמנה של המודול, פנה לאנשי שירות מורשים או ליצרן ההתקן.
- מדוד את עוצמת האור באמצעות חיישן הכוח פוטודיודה (ראה טבלת חומרים). אם הרווח בין חלקי הקוטב של העדשה האובייקטיבית אינו מאפשר מדידה בתוך המיקרוסקופ, מדוד את הגיאומטריה של הדגימה והמאיר ושחזר תנאים אלה במערך מדידה חיצוני.
- אם המיקרוסקופ אינו מצויד במערכת מדידת מינון אלקטרונים, בצע את הכיול על ידי מדידת זרם הקרן באמצעות פאראדיי (ראו טבלת חומרים) וחישוב מספרי של צפיפות האלקטרונים הפוגעים בדגימה27.
2. אנקפסולציה של חיידקים עם פוטוסנסיטייזר
- הניחו שתי רשתות TEM לא מטופלות המכוסות בפחמן אמורפי בין שתי פינצטות חצויות הפונות לצד המצופה פחמן למעלה. החזק את הרשתות קרוב ככל האפשר לקצה.
הערה: עבור שילובי מצע, תמיסה ודגימות מסוימים, ייתכן שיהיה מועיל להשתמש בפריקת זוהר על רשת אחת או על שתיהן כדי להסיר זיהומים במפעל ולקבל משטח הידרופילי מרבי28. באמצעות הדוגמה של חיידקי S. aureus ותמיסת מתילן כחולה, נקבע כי התוצאות הטובות ביותר והניתנות לשחזור ביותר הושגו על פחמן חדש, שאינו מטופל ברשתות נחושת ללא פריקת זוהר נוספת או ניקוי פלזמה6. - שים 4 μL של תמיסת חיידקים על אחת הרשתות. הצפיפות האופטית של המדגם חייבת להיות בטווח של 5-10.
הערה: החיידקים ששימשו במחקר טוהרו מהתרבית והתפזרו במאגר PBS. מומלץ מאוד לבדוק את ריכוז החיידקים בדגימה הטרייה בכל פעם שמשתמשים בה, למשל בשיטות צביעה שלילית, בהתאם לפרוטוקולים שנקבעו 29,30,31. - המתן 60 שניות והכתים בזהירות את הנוזל באמצעות נייר סינון. נסו לפזר את הנוזל על פני כל משטח הרשת במהלך תהליך זה.
- שים 4 μL של פוטוסנסיטייזר על אותה רשת.
הערה: מתילן כחול בריכוז של 2 מיקרוגרם/מ"ל שימש כרגישות לאור במחקר הנוכחי. - לאחר 5 שניות, כתם את הנוזל. השאירו שכבה דקה מאוד של נוזל על המצע.
- הניחו במהירות את הרשת היבשה על גבי זו המכוסה בנוזל.
- הזיזו בעדינות את הרשת העליונה לקצה הרשת השנייה וסחטו את המצעים בקצוות באמצעות פינצטה.
הערה: חלק מהנוזלים עשויים לזרום אל מחוץ לדגימה בשלב זה, מה שאומר שלא נוקז מספיק. עם זאת, אין זה אומר בהכרח כי היווצרות של התא הנוזלי יהיה מוצלח. - חזרו בזהירות על הסחיטה.
הערה: קל יותר לבצע שלב זה על ידי סיבוב הפינצטה ב-90° כך שהן מונחות בניצב לשולחן וקצות הפינצטה נשארים באותו גובה, לא בהתאם למצב הפתיחה/סגירה. - השאירו את התא הנוזלי בין הפינצטה למשך דקה אחת.
- הכנס את הדגימה למחזיק ה- TEM מיד לאחר סיום ההכנה.
הערה: המתח של הצלחת/טבעת ההרכבה של המחזיק יעזור למצעים להיצמד ולשמור על הנוזל בפנים.- במידת האפשר, יש לשאוב את מחזיק הדגימה לתחנת שאיבה חיצונית כדי להפחית את זיהום המיקרוסקופ על ידי אידוי נוזלים.
3. תצפיות In situ TEM של תאי חיידקים באפקט מינון אלקטרון נוזלי
- הכנס את הדגימה למיקרוסקופ.
- התחל את התצפיות במצב הגדלה נמוכה כדי למצוא אזור תצפית מתאים.
הערה: אזורים כהים יותר נוטים להיות נוזליים בגלל פיזור קרן אלקטרונים.- במהלך התצפיות, שמור על מינון אלקטרונים נמוך ככל האפשר. הרחב את זמן החשיפה (עד 2 שניות למתח מואץ של 150 קילו-וולט והגדלה של פי 5,000). ההגדלה של 5,000x עבור המצלמה המותקנת בתחתית (שדה הראייה המשוער הוא 10 מיקרומטר) מספיקה כדי לצלם חיידקים בקוטר של ~1 מיקרומטר.
הערה: לפעמים, לא קל להבחין בין הנוזל, ולכן, בתחילת התצפיות, כדאי למקד את קרן האלקטרונים במקום שבו סביר להניח שהוא נוזלי. הנוזל צריך לנוע על קרן אלקטרונים ממוקדת, והבועות יופיעו. לאחר אימות זה, יש צורך למצוא אזור אחר לתצפיות נוספות.
- במהלך התצפיות, שמור על מינון אלקטרונים נמוך ככל האפשר. הרחב את זמן החשיפה (עד 2 שניות למתח מואץ של 150 קילו-וולט והגדלה של פי 5,000). ההגדלה של 5,000x עבור המצלמה המותקנת בתחתית (שדה הראייה המשוער הוא 10 מיקרומטר) מספיקה כדי לצלם חיידקים בקוטר של ~1 מיקרומטר.
- מצא את התאים המוקפים בנוזל בהגדלה המתאימה עם זמן חשיפה ממושך ולכוד את התמונה הראשונה באופן מיידי. הקפידו על מינון אלקטרונים קבוע ואספו תמונות כל 30 שניות כדי לצפות בשינויים.
- בחן היטב את התמונות וחשב את מינון האלקטרונים הכולל27 המתאים לשינויים הגלויים הראשונים בתאים.
4. תצפיות In situ TEM של תהליכים המושרים באור בין תאי חיידקים לבין פוטוסנסיטייזר
- לפני תחילת הניסוי, הגדר את עוצמת אור הלייזר על ידי התאמת הערך הנוכחי. בחר את אורך הגל המתאים בהתאם לספקטרום הקליטה של הפוטוסנסיטייזר. על פי עלילת הכיול הקודמת (שלב 1.4.), בחר את הערך הנוכחי המתאים לעוצמת האור הנמוכה ביותר.
הערה: אורך גל האור ששימש במחקר זה היה 660 ננומטר. - הכנס את הדגימה למיקרוסקופ ומצא את אזור התצפית לאחר שלב 3.2. בסעיף הקודם.
- צלם את התמונה הראשונה של התא לפני תחילת ההארה של הדגימה והשתמש באלומה הריקה כדי לכבות את קרן האלקטרונים כדי למנוע את ההשפעות של הקרנת אלקטרונים.
- הפעל את הלייזר. התחל עם זמן הארה קצר (כאן 30 שניות) מכיוון שאור הלייזר הוא בעל עוצמה גבוהה יחסית. לאחר מכן, כבה את מקור האור.
- כבה את הקורה הריקה ולכוד את התמונה באופן מיידי. במידת האפשר, השתמש באלגוריתם אוטומטי כדי לחשוף את הדגימה רק למשך הזמן הדרוש לצילום התמונה. מדוד בזהירות את זמן קרינת האלקטרונים כדי לחשב את מינון האלקטרונים27 המשמש להדמיה.
- חזור על שלב 4.4. ושלב 4.5. כדי להשיג את זמן תאורת האור הצפוי.
תוצאות
מערך הניסוי נועד לצפות בתהליכים הנגרמים על ידי אור המתרחשים בנוזל בעל רזולוציה גבוהה. הניתוח התחרותי של התמונות איפשר לנו להבחין בין הנזק שנגרם על ידי קרן האלקטרונים לבין שינויים הקשורים לתגובה הפוטוכימית. ההשפעה של קרן האלקטרונים על הדגימה הרגישה (במקרה זה, התאים העטופים בנוזל) נראתה בכל רחבי האזור המוקרן כאשר האלקטרונים חדרו דרכה באופן אחיד. כמובן, ההשפעה תלויה במינון האלקטרונים, כך שניתן לראות שינויים משמעותיים יותר במורפולוגיה של המדגם מהר יותר עבור קרן ממוקדת יותר. בהשוואה לנזק חמור זה, ההשפעות ההרסניות בפועל של השבתה פוטודינמית התרחשו בחלקים ספציפיים של תאים רק באזורים המוקפים בפוטוסנסיטייזר המואר.
בדוגמה של הדמיית חיידקים, ועל פי הספרות, נראה כי המינון של 30 e−/nm2 הוא ערך הסף הקטלני לחיידקים17, שעבר מאוד במחקרים קודמים של המחברים 6,25. עם זאת, השינויים הנראים לעין בתא לא הבחינו לפני שהגיעו למינון האלקטרונים של 6000 e−/nm2. התוצאות הראו התדרדרות ניכרת של השכבה החיצונית של התא שנגרמה על-ידי מיני החמצן הריאקטיבי שנוצר על-ידי קרינת אור של הפוטו-סנסיטייזר לאחר דקה אחת (איור 1). הארת אור נוספת הפכה את השינויים לנראים יותר לעין (איור 1D,G).
האנקפסולציה של התאים בין מצעי הפחמן הספיקה לביצוע תצפיות קבועות במשך שעה אחת לפחות. ניתן למצוא בקלות כתמי תצפית נאותים עם כמות מספקת של נוזלים בהגדלה נמוכה, מכיוון שהאזורים האלה נראים כהים ומטושטשים יותר (מסומנים על-ידי המסגרות באיור 2A). החיידקים המכוסים בנוזל נראים פחות מהחיידקים היבשים, אך עדיין ניתן להבחין ביניהם (איור 2B). כדאי להסתכל על הגבול הנוזלי במהלך ההדמיה, וניתן לזהות את התנועה שלו בקלות, מה שמרמז על כך שהאזור שנבחר עשוי להיות לא מתאים ולא יציב (איור 3). בעיה נוספת במהלך תצפיות היא אידוי המים ומשקעים של התמיסה, שיכולים להתרחש באזורים אקראיים של הדגימה, כולל האזורים המקיפים את החיידקים (איור 3B,C).

איור 1: תוצאות מופת של הטיפול הפוטודינמי בחיידקים. (A) ערכת התא הנוזלי המכיל תאי חיידקים ומתילן כחול. (B) התא לפני הארת האור. (C) התא לאחר ההארה למשך דקה אחת (D) התא לאחר ההארה למשך 10 דקות (E-G) האזורים המוגדלים מ-(B-D). מינון האלקטרונים היה שווה ל-1600 e−/nm 2, 2500 e−/nm 2 ו-6000 e−/nm 2, בהתאמה. הדמות מועתקת מ-Żak et al.25. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: תמונות TEM של S. aureus עטופות בכחול מתילן בין שני סרטי פחמן . (A) תמונה בהגדלה נמוכה מציגה את שני האזורים עם כמות גבוהה של נוזל (מסומן על-ידי המסגרות הצהובות) וכתמים יבשים. בדיקה מהירה של הדגימה בהגדלה זו נותנת מידע אם האנקפסולציה הצליחה או לא. (B) הגבול הנוזלי נראה בבירור באזור המוגדל, וניתן להבחין בין החיידקים המכוסים בפוטוסנסיטייזר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: תמונות TEM של השפעות שליליות שעלולות להתרחש במהלך הדמיה . (A) בהתחלה, התא היה מוקף באופן אחיד בנוזל, שכיסה את רוב שטח התצפית. (B) בהתבסס על קרינת קרן האלקטרונים הקבועה, ניתן להבחין בתנועה ובאידוי של הנוזל ותחילת המשקעים מהתמיסה. (C) המשך התהליכים מוביל לתנועה בלתי הפיכה, הקצפה והתפוררות של הפוטוסנסיטייזר, מה שהופך תצפיות נוספות לבלתי אפשריות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
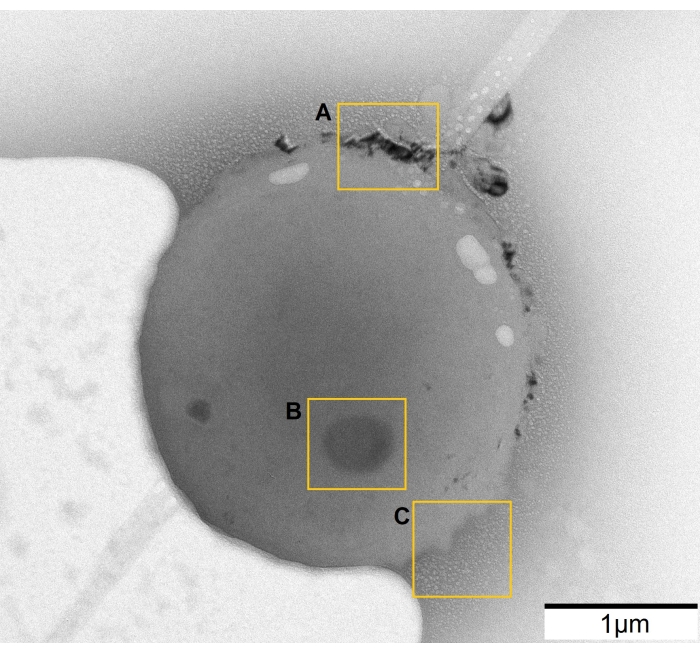
איור 4: ההשפעות השליליות המובילות למסקנות שגויות . (A) הנוזל המגובש. (B) הזיהום התיישב על התא. (C) קצף הנגרם על ידי קרן האלקטרונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
ההתקנה וההפעלה של התאורה דורשות ידע בסיסי בשירות ועלולות לפגוע במיקרוסקופ. הדרך הפשוטה ביותר להכניס את האור למיקרוסקופ היא לחבר את הסיב האופטי מהחלק העליון של העדשה האובייקטיבית, שם בדרך כלל יש מקום לסלילי ההטיה של TEM ולגלאים נוספים. ניתן לצפות ליותר מקום פנוי גם ממכשירי כניסה עליונים ישנים יותר, שבהם באותו מיקום נמצא מנעול הוואקום לדוגמה ומנגנון התקנת הדוגמאות. תצורה זו מתוארת בהרחבה בדו"ח הקודם25, המכיל עיצוב תאורה למופת. אם פנים המיקרוסקופ אינו מאפשר התקנה של הסיב האופטי מעל העדשה האובייקטיבית, ניתן להתקין את המאיר בתוך מוט העדשה האובייקטיבית מהצד32. פתרונות אחרים מניחים שימוש במחזיק מדגם ייעודי4 או שימוש הפוך של המחזיק לתצפיות קתודולומינסנטיות1.
באופן כללי, הכנת דגימות נוזליות עבור TEM היא מסובכת ודורשת ניסיון ומיומנויות ידניות. השלב הקריטי בהכנת תאים נוזליים הוא שלב 2.6. של הפרוטוקול. חשוב למקם את הרשת השנייה במהירות כדי למנוע אידוי של הנוזל. השיטה המוצגת כאן היא פשוטה ואינה דורשת חומרים נדירים; עם זאת, ייתכן שהוא לא יתאים לכל הנוזלים. במקרים מסוימים, זה מועיל לנקות את המצע עם פלזמה כדי להגדיל את ההידרופיליות שלה. עבור דגימות נוזלים, במיוחד תמיסות מים, שאינן מכילות חלקיקים ו/או תאים שיכולים לשמש כמרווח בין יריעות הפחמן, האנקפסולציה עלולה להיות לא מוצלחת מכיוון שכל הנוזל עשוי לזרום החוצה מבין המשטחים השטוחים. שימוש בתא נוזלי גרפן שהוכן באמצעות מצע חורי, היוצר "כיסים" קטנים לנוזל, עשוי להיות מתאים יותר33.
תצפיות TEM המבוצעות בנוזל יכולות להיות מוטרדות על ידי כמה גורמים הקשורים להכנת הדגימה וההשפעות השליליות הנגרמות על ידי קרן האלקטרונים. הראשון כולל ניתוק של מצעים ותנועת הנוזל, שלעתים קרובות מלווה בשבירת שכבת הפחמן, המתרחשת בנפחי נוזל גבוהים באזור ו/או בעת הקרנת אלקטרונים. ניתן להימנע מכך על ידי מזעור נפח הנוזל בשלב 2.5. של הפרוטוקול.
ההקרנה עם אלקטרונים אנרגטיים מאוד מובילה להעברת אנרגיה, וכתוצאה מכך חימום או רדיוליזה. לאחר אינטראקציה עם קרינה, המים מתפרקים לרדיקלים (H· ו-OH·), H2 ואלקטרונים מסולקים. מינים אלה משתתפים בתגובות נוספות, ובכך מייצרים מוצרים שונים וגורמים נזק לדגימה34. לכן, חשוב מאוד לשמור על מינון אלקטרונים נמוך במהלך התצפיות (שלב 3.2.), במיוחד עבור דגימות רגישות כמו תאים. השפעות אחרות הנגרמות על-ידי קרן האלקטרונים הן משקעים מהתמיסה (איור 4A) וקצף של הנוזל (איור 4C). הורדת מינון האלקטרונים מסייעת למנוע את שתי ההשפעות השליליות הללו, אך לפעמים לא ניתן לחסל אותן. ייתכן גם שיש זיהום רגיש לקרינה בתמיסה, שמתיישב על התא (איור 4B) ומשתנה עם השפעת קרן האלקטרונים. זה שלילי מכיוון שהטומאה עלולה להילקח כחלק מהתא, שנפגע עם קרינת האור, מה שמוביל למסקנות שגויות. הדרך הטובה ביותר להשיג תמונות אמינות היא למצוא אזור לא מזוהם ולשמור על מינון אלקטרונים נמוך ככל האפשר.
מחקרי in situ TEM אמינים של פוטו-תגובות דורשים השוואה טובה בין התהליכים המושרים על ידי האור לבין אלה הנגרמים על ידי קרן האלקטרונים. למעט הורדת מינון האלקטרונים המתואר בשלב 3.2., כדאי לכבות את מקור האלקטרונים לזמן הארת האור כך שניתן יהיה לראות את התוצאות ללא הפרעה, כפי שהודגש בשלב 4.3. של הפרוטוקול.
הפרוטוקול הנוכחי יכול לשמש לצפייה בתגובות המושרות על ידי אור (במיוחד בנוזל), לדוגמה, אור על ננו-קלסתרים מתכתיים2, תהליכי קטליזה המושרים על ידי אור1, והשפעת אור על דגימות ביולוגיות (למשל, תאים עם פוטו-סנסיטייזר, כלורופלסטים).
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחקר נתמך על ידי מענק Miniatura (2019/03/X/NZ3/02100, המרכז הלאומי למדע, פולין).
Materials
| Name | Company | Catalog Number | Comments |
| Carbon film on 200 mesh copper grid | Agar Scientific | AGS160 | The standard TEM grids for observations and liquid cell preparation |
| Crossover Tweezers | Dumont | N5 | The tweezers are neecesarry for liquid cell preparation |
| Photodiode Power Sensor | ThorLabs | S130C | The sensor used for light intensity measurement |
| Polyimide-Coated Multimode Fiber | Thorlabs | FG400UEP | Must be built into the microscope using the on-site built adapter, according to the 10.1016/j.ultramic.2021.113388 |
| Transmission Electron Microscope | Hitachi | H-800 | Can be replaced with any side-entry microscope, available for modification |
| Tuneable Diode Laser | CNI | MRL-III-660D | The light wavelength must be chosen basing on photosensitizer's absorption spectrum |
References
- Vadai, M., Angell, D. K., Hayee, F., Sytwu, K., Dionne, J. A. In-situ observation of plasmon-controlled photocatalytic dehydrogenation of individual palladium nanoparticles. Nature Communications. 9 (1), 1-8 (2018).
- Weng, B., et al. Visualizing light-induced dynamic structural transformations of Au clusters-based photocatalyst via in situ TEM. Nano Research. 12 (1), 1-5 (2021).
- Cao, K., et al. In situ TEM investigation on ultrafast reversible lithiation and delithiation cycling of Sn@C yolk-shell nanoparticles as anodes for lithium ion batteries. Nano Energy. 40, 187-194 (2017).
- Cavalca, F., et al. In situ transmission electron microscopy of light-induced photocatalytic reactions. Nanotechnology. 23 (7), 075705 (2012).
- Tung, C. -. W., et al. Light-induced activation of adaptive junction for efficient solar-driven oxygen evolution: In situ unraveling the interfacial metal-silicon junction. Advanced Energy Materials. 9 (31), 1901308 (2019).
- Żak, A. M., Kaczmarczyk, O., Piksa, M., Matczyszyn, K. Light-induced in situ transmission electron microscopy: Novel approach for antimicrobial photodynamic therapy imaging. Photodiagnosis and Photodynamic Therapy. 35, 102463 (2021).
- Shindo, D., et al. Development of a multifunctional TEM specimen holder equipped with a piezodriving probe and a laser irradiation port. Journal of Electron Microscopy. 58 (4), 245-249 (2009).
- Zhang, C., et al. Photosensing performance of branched CdS/ZnO heterostructures as revealed by in situ TEM and photodetector tests. Nanoscale. 6 (14), 8084-8090 (2014).
- Zhang, C., et al. Statistically analyzed photoresponse of elastically bent CdS nanowires probed by light-compatible in situ high-resolution TEM. Nano Letters. 16 (10), 6008-6013 (2016).
- Yoshida, K., Yamasaki, J., Tanaka, N. In situ high-resolution transmission electron microscopy observation of photodecomposition process of poly-hydrocarbons on catalytic TiO2 films. Applied Physics Letters. 84 (14), 2542-2544 (2004).
- Yoshida, K., Nozaki, T., Hirayama, T., Tanaka, N. In situ high-resolution transmission electron microscopy of photocatalytic reactions by excited electrons in ionic liquid. Journal of Electron Microscopy. 56 (5), 177-180 (2007).
- Textor, M., De Jonge, N. Strategies for preparing graphene liquid cells for transmission electron microscopy. Nano Letters. 18 (6), 3313-3321 (2018).
- Ring, E. A., De Jonge, N. Microfluidic system for transmission electron microscopy. Microscopy and Microanalysis. 16 (5), 622-629 (2010).
- Inayoshi, Y., Minoda, H. A carbon sandwich environmental cell for wet specimens. Journal of Electron Microscopy. 62 (6), 623-628 (2013).
- Koo, K., Dae, K. S., Hahn, Y. K., Yuk, J. M. Live cell electron microscopy using graphene veils. Nano Letters. 20 (6), 4708-4713 (2020).
- De Jonge, N., Peckys, D. B. Live cell electron microscopy is probably impossible. ACS Nano. 10 (10), 9061-9063 (2016).
- Kennedy, E., Nelson, E. M., Damiano, J., Timp, G. Gene expression in electron-beam-irradiated bacteria in reply to "live cell electron microscopy is probably impossible.". ACS Nano. 11 (1), 3-7 (2017).
- Alves, E., et al. An insight on bacterial cellular targets of photodynamic inactivation. Future Medicinal Chemistry. 6 (2), 141-164 (2014).
- Cieplik, F., et al. Antimicrobial photodynamic therapy-What we know and what we don't. Critical Reviews in Microbiology. 44 (5), 571-589 (2018).
- Huang, L., et al. Type I and Type II mechanisms of antimicrobial photodynamic therapy: An in vitro study on gram-negative and gram-positive bacteria. Lasers in Surgery and Medicine. 44 (6), 490-499 (2012).
- Caminos, D. A., Spesia, M. B., Pons, P., Durantini, E. N. Mechanisms of Escherichia coli photodynamic inactivation by an amphiphilic tricationic porphyrin and 5,10,15,20-tetra(4-N,N,N-trimethylammoniumphenyl) porphyrin. Photochemical and Photobiological Sciences. 7 (9), 1071-1078 (2008).
- Chu, J. C. H., Chin, M. L., Wong, C. T. T., Hui, M., Lo, P. C., Ng, D. K. P. One-pot synthesis of a cyclic antimicrobial peptide-conjugated phthalocyanine for synergistic chemo-photodynamic killing of multidrug-resistant bacteria. Advanced Therapeutics. 4 (3), 1-10 (2021).
- Rogers, S., Honma, K., Mang, T. S. Confocal fluorescence imaging to evaluate the effect of antimicrobial photodynamic therapy depth on P. gingivalis and T. denticola biofilms. Photodiagnosis and Photodynamic Therapy. 23, 18-24 (2018).
- Maldonado-Carmona, N., et al. Porphyrin-loaded lignin nanoparticles against bacteria: A photodynamic antimicrobial chemotherapy application. Frontiers in Microbiology. 11, 606185 (2020).
- Żak, A. M., Kaczmarczyk, O., Piksa, M., Grzęda, J., Matczyszyn, K. Fiber-optic sample illuminator design for the observation of light induced phenomena with transmission electron microscopy in situ: Antimicrobial photodynamic therapy. Ultramicroscopy. 230, 113388 (2021).
- Dinh, V. P., et al. Insight into the adsorption mechanisms of methylene blue and chromium(III) from aqueous solution onto pomelo fruit peel. RSC Advances. 9 (44), 25847-25860 (2019).
- Żak, A. Guide to controlling the electron dose to improve low-dose imaging of sensitive samples. Micron. 145, 103058 (2021).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Section D. 74 (6), 560-571 (2018).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadaza, M. G. Variations on negative stain electron microscopy methods: Tools for tackling challenging systems. Journal of Visualized Experiments. (132), (2018).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: From grid preparation to image acquisition. Journal of Visualized Experiments. (58), (2011).
- Rames, M., Yu, Y., Ren, G. Optimized negative staining: A high-throughput protocol for examining small and asymmetric protein structure by electron microscopy. Journal of Visualized Experiments. (90), e51087 (2014).
- Miller, B. K., Crozier, P. A. System for in situ UV-visible illumination of environmental transmission electron microscopy samples. Microscopy and Microanalysis. 19 (2), 461-469 (2013).
- Yuk, J. M., et al. High-resolution EM of colloidal nanocrystal growth using graphene liquid cells. Science. 336 (6077), 61-64 (2012).
- Schneider, N. M., et al. Electron-Water interactions and implications for liquid cell electron microscopy. Journal of Physical Chemistry C. 118 (38), 22373-22382 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved