Method Article
Анализ взаимодействия флуоресцентно-меченых белков с искусственными фосфолипидными микровезикулами с помощью количественной проточной цитометрии
В этой статье
Резюме
Здесь описан набор методов характеристики взаимодействия белков с мембранами клеток или микровезикулами.
Аннотация
В организме человека большинство основных физиологических реакций, участвующих в иммунном ответе и свертывании крови, протекают на мембранах клеток. Важным первым шагом в любой мембранозависимой реакции является связывание белка на фосфолипидной мембране. Разработан подход к изучению взаимодействия белков с липидными мембранами с использованием флуоресцентно меченых белков и проточной цитометрии. Этот метод позволяет изучать белково-мембранные взаимодействия с использованием живых клеток и природных или искусственных фосфолипидных везикул. Преимуществом данного метода является простота и доступность реагентов и оборудования. В этом методе белки маркируются с помощью флуоресцентных красителей. Тем не менее, могут использоваться как самодельные, так и коммерчески доступные, флуоресцентно меченые белки. После конъюгации с флуоресцентным красителем белки инкубируют с источником фосфолипидной мембраны (микровезикулами или клетками), а образцы анализируют методом проточной цитометрии. Полученные данные могут быть использованы для расчета кинетических констант и равновесия Kd. Кроме того, можно оценить приблизительное количество сайтов связывания белка на фосфолипидной мембране с помощью специальных калибровочных шариков.
Введение
Биомембраны разделяют внутреннее содержимое клеток животных и внеклеточное пространство. Обратите внимание, что мембраны также окружают микровезикулы, образующиеся в течение жизненного цикла клетки, и органеллы. Клеточная мембрана преимущественно состоит из липидов и белков. Мембранные белки выполняют сигнальные, структурные, транспортные и адгезивные функции. Однако липидный бислой также необходим для взаимосвязи животной клетки с внеклеточным пространством. В данной работе предложен метод исследования периферического взаимодействия внешних белков с липидной мембраной.
Наиболее ярким примером реакций, происходящих на внешнем мембранном слое животной клетки, является реакция свертывания крови. Важной особенностью свертывания крови является то, что все основные реакции протекают на фосфолипидных мембранах клеток и микровезикул, возникающих из этих клеток, а не в плазме 1,2,3. К мембранозависимым реакциям относят процесс запуска коагуляции (на клеточных мембранах субэндотелия, воспаленный эндотелий или активированные иммунные клетки, при участии тканевого фактора), все реакции основного каскада - активация факторов IX, X, протромбина; активация фактора XI тромбином (на мембранах активированных тромбоцитов, эритроцитов, липопротеинов, микровезикул); реакции белкового пути С; инактивация ферментов свертывания (на мембранах эндотелиальных клеток с участием тромбомодулиновых кофакторов, рецептора эндотелиального белка С, гепарансульфата); и реакции контактного пути (на мембранах тромбоцитов и некоторых микровезикул с участием неизвестных кофакторов). Таким образом, невозможно исследовать свертываемость крови без изучения взаимодействия различных белков плазмы с мембраной клеток крови.
В данной работе описан метод на основе проточной цитометрии для характеристики взаимодействия белков с липидными мембранами клеток или микровезикул. Такой подход изначально предлагался для изучения взаимодействия плазмы крови с тромбоцитами и искусственными фосфолипидными везикулами. Более того, большинство исследуемых белков взаимодействуют непосредственно с отрицательно заряженными мембранными фосфолипидами, в частности с фосфатидилсерином 4,5. Дополнительно существуют белки, взаимодействие которых с мембраной опосредовано специальными рецепторами6.
Важной способностью проточной цитометрии является различение свободных и связанных лигандов без дополнительного разделения. Эта особенность цитометрии позволяет изучать равновесное связывание лигандов в конечной точке и помогает выполнять непрерывные кинетические измерения. Методика бессложна и не требует сложной пробоподготовки. Проточная цитометрия активно используется для количественного изучения динамики взаимодействия флуоресцентных пептидов, рецепторов и G-белков в интактных и детергентно-проницаемых нейтрофилах7. Этот подход также применим для изучения белково-ДНК-взаимодействий и кинетики активности эндонуклеазы в режиме реального времени8. Со временем этот метод был использован для количественного изучения высокоаффинных белково-белковых взаимодействий с очищенными липидными везикулами9 или, в более общем плане, с мембранными белками, экспрессируемыми в высокоэффективной системе экспрессии клеток Sf910. Также описаны количественные методы характеристики белково-липосомных взаимодействий с использованием проточной цитометрии трансмембранных белков11.
В этом методе используются самодельные калибровочные бусины, чтобы избежать использования коммерчески доступных бусин7. Калибровочные шарики, используемые ранее7 , предназначались для работы с флуоресцеином, который существенно ограничивал ассортимент доступных флуоресцентных лигандов на белках. Кроме того, в этой статье предлагается новый способ получения и анализа кинетических данных для разумного разрешения времени. Хотя этот способ описан для искусственных фосфолипидных везикул, нет очевидных ограничений его приспособляемости к клеткам, природным везикулам или искусственным фосфолипидным везикулам с другим липидным составом. Способ, описанный в настоящем описании, позволяет оценить параметры взаимодействия (kon, koff) и равновесия (Kd) и облегчает количественную характеристику числа сайтов связывания белка на мембране. Обратите внимание, что этот метод дает приблизительную оценку количества сайтов связывания. Преимуществами метода являются его относительная простота, доступность и приспособляемость к нативным клеткам и природным и искусственным микровезикулам.
протокол
1. Флуоресцентная маркировка белка
- Подготовка материала
- Приготовьте 1 М буфера бикарбоната натрия, рН 9,0, храните его при 4 °C и используйте в течение одной недели.
- Готовят 1,5 М гидроксиламина гидрохлоридного буфера, рН 8,5, непосредственно перед использованием.
- Готовят 10 мг/мл раствора флуоресцентного красителя (см. Таблицу материалов) в диметилсульфоксиде.
ПРИМЕЧАНИЕ: Этот раствор можно хранить в течение месяца при -20 °C в темноте. - Готовят растворы очищенных антител или других белков по 1-10 мг/мл.
ПРИМЕЧАНИЕ: Избегайте буферов, содержащих ионы аммония или первичные амины. Замените буферы, содержащие трис или глицерин, фосфат-буферным физиологическим раствором (PBS) путем диализа. Ни азид натрия (≤3 мМ), ни тимеросал (≤1 мМ) существенно не влияют на реакцию конъюгации. - Инкубировать гелевую фильтрующую среду (см. Таблицу материалов) для очистки белка в PBS ночью при комнатной температуре или в течение 2 ч при 60 °C. Нанесите гелевую фильтрующую среду на спиновые колонны с мембранами 0,2 мкм.
- Рассчитайте количество реакционноспособного красителя, которое будет использоваться для каждой реакции, в соответствии с концентрацией белка, подлежащего маркировке с помощью Eq (1).
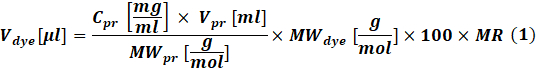
Где Vкраситель - объем раствора запаса красителя; Cpr, Vpr и MWpr - концентрация, объем и молярная масса белка; MW краситель - это молярная масса красителя; 100 — коэффициент пересчета единиц измерения; MR - молярное отношение красителя к белку в реакционной смеси.
ПРИМЕЧАНИЕ: Для реакций маркировки IgG рекомендуются следующие МНО: MR = 40, если антитело находится на уровне 1-3 мг / мл или MR = 30, если антитело находится на уровне 4-10 мг / мл. Для факторов свертывания обычно используется MR = 5. - Реакция сопряжения
- В реакционной трубке смешайте белковый раствор с 10-кратным меньшим объемом 1 М раствора бикарбоната.
- Добавьте необходимое количество флуоресцентного красителя (см. этап 1.2) при непрерывном перемешивании.
- Инкубируют реакционную смесь при комнатной температуре в течение приблизительно 1 ч, защищенной от света и с непрерывным перемешиванием.
- На каждые 200 мкл белкового раствора добавляют 5 мкл 1,5 М гидроксиламина гидрохлорида.
- Инкубируют реакционную смесь при комнатной температуре в течение приблизительно 30 мин, защищенные от света и с непрерывным перемешиванием.
- Подготовьте столбец спина.
- Добавьте в колонку 500 мкл гелевой фильтрующей среды для очистки белка. Центрифугировать колонну в течение 3 мин при 1000 × г.
- Удалите буфер из коллекционной трубки. Если колонка не заполнена, добавляют еще гелевую фильтрующую среду и центрифугируют колонку в течение 3 мин при 1000 × г. Повторяйте этот шаг до тех пор, пока столбец не будет заполнен.
- Очистка
- Центрифугируют реакционную смесь (со стадии 1.3.5) в течение 5 мин при 17 000 × г и удаляют осадок.
- Перенесите супернатант в спиновую колонну с гелевой фильтрующей средой. Дайте раствору впитаться в гелевое ложе.
- Используйте пустую сборную трубку для отжимной колонны и центрифугируйте ее в течение 5 мин при 1000 × г. После центрифугирования соберите меченый белок из сборной трубки.
- Определение степени маркировки
- Корректировать вклад красителя в абсорбцию при А280 путем измерения абсорбции свободного красителя при 280 нм (А280) и λмакс для красителя (А макс.) (см. Экв (2)).
 (2)
(2) - Измерьте поглощение конъюгата белок-краситель при 280 нм (A280) и λmax для красителя (Amax) и рассчитайте консетрацию белка с помощью Eq (3).
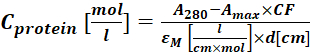 (3)
(3)
Где εM — коэффициент молярного вымирания белка при 280 нм; d - длина оптического пути при измерении поглощения; CF - это вклад красителя в поглощение при А280 (этап 1.6.1). - Рассчитайте степень маркировки (DOL) с помощью Eq (4).
 (4)
(4)
Где εМ краситель - коэффициент молярного затухания красителя при λmax нм; d - длина оптического пути при измерении поглощения; С-белок представляет собой концентрацию белка (стадия 1.6.2).
- Корректировать вклад красителя в абсорбцию при А280 путем измерения абсорбции свободного красителя при 280 нм (А280) и λмакс для красителя (А макс.) (см. Экв (2)).
2. Приготовление фосфолипидных везикул
- Приготовление и хранение липидной смеси
- Объедините липиды в соответствующем соотношении (фосфатидилсерин/фосфатидилхолин в соотношении от 20 моль% до 80 моль%).
- Высушите липидную смесь после лиофилизации или испарения и храните ее в инертной атмосфере в стеклянных ампулах.
- Производство липидных пленок
- Откройте ампулу и повторно суспендируйте липидную смесь в небольшом количестве (~100 мкл) хлороформа.
ПРИМЕЧАНИЕ: Не используйте слишком много хлороформа, так как он не испаряется полностью. - Добавьте DiIC16(3) в этанол при 0,2 моль%. Переложите липидную смесь в колбу с круглым дном. Распределите смесь тонко по бокам колбы, вращая ее. Высушите липидную смесь в течение 30 мин под струйкой аргона.
- Откройте ампулу и повторно суспендируйте липидную смесь в небольшом количестве (~100 мкл) хлороформа.
- Гидратация липидной смеси
- Добавьте в колбу с липидной пленкой достаточно теплый (~55 °C) водный буфер (HEPES 20 мМ, NaCl 140 мМ, рН 7,4) в объеме, соответствующем ожидаемой концентрации липидов. Инкубировать смесь с вихрем при 55 °С в течение 30 мин для полного увлажнения.
- Поместите пробирку в морозильную камеру или теплый термостат, чтобы липидная суспензия прошла 3-5 циклов замораживания-оттаивания.
- Образование липидных пузырьков путем экструзии
- Подготовьте экструдер в соответствии с инструкциями производителя. Разогрейте все компоненты экструдера до температуры фазового перехода липидной смеси.
- Наполните один из шприцев экструдера гидратированной липидной смесью. Подождите 5-10 мин, пока температура липидной суспензии не уравновесится с температурой экструдера.
- Выдавливают липидную смесь через мембрану не менее 10 раз. Для окончательной экструзии поместите липидную суспензию в альтернативный шприц и обратите внимание на изменение внешнего вида от слегка туманного до прозрачного раствора.
- Хранить полученную смесь липидных везикул при 4°С, предпочтительно в инертной атмосфере аргона или азота, в течение 3-4 дней. Не замораживать.
3. Выделение тромбоцитов из цельной крови
- Собирайте цельную кровь у здоровых доноров в пробирки, содержащие 3,2% цитрата натрия.
- Добавляют в кровь простагландин Е1 (PGE1) (1 мкМ) и апиразу (0,1 Ед/мл) с последующим центрифугированием при комнатной температуре при 100 × г в течение 8 мин.
- После центрифугирования берут обогащенную тромбоцитами плазму и добавляют раствор цитрата натрия (106 мМ, рН 5,5) к соотношению плазма/цитрат 3:1. Центрифугируют плазму при комнатной температуре при 400 × г в течение 5 мин.
- Удалите супернатант и повторно суспендируйте гранулу в 300 мкл буфера Тирода без BSA (20 мМ HEPES, 150 мМ NaCl, 2,7 мМ KCl, 1 мМ MgCl2, 0,4 мМ2PO4, 2,5 мМ CaCl2, 5 мМ глюкозы, рН 7,4). Очищают тромбоциты от белков плазмы методом гель-хроматографии на гелевой фильтрующей среде для очистки тромбоцитов (см. Таблицу материалов).
4. Обнаружение белково-липидного взаимодействия методом проточной цитометрии
- Эксперименты по кинетическому связыванию
- Разбавляют фосфолипидные везикулы (со стадии 2.4.4) в буфере Тирода (20 мМ HEPES, 150 мМ NaCl, 2,7 мМ KCl, 1 мМ MgCl2, 0,4 мМ2PO4, 2,5 мМ CaCl2, 5 мМ глюкозы, 0,5% BSA, рН 7,4) до концентрации 1 мкМ и общего объема 250 мкл.
- Смешайте флуоресцентный меченый фактор свертывания X (fX-fd) со стадии 1 в концентрации 500 нМ с фосфолипидными везикулами со стадии 4.1.1 в соотношении 1:1 (конечная концентрация пузырьков 0,5 мкМ, концентрация fX-fd составляет 250 нМ fX) до общего объема 500 мкл.
- Немедленно введите 500 мкл смешанной суспензии (~20 мин для анализа с низкой скоростью потока) в проточный цитометр. Используйте низкий расход и убедитесь, что порог для канала FL2 (эксситация 488 нм, эмиссионный фильтр 585/42 нм) равен значению 200. Измерить среднюю флуоресценцию в канале FL4 (эксцитация 633 нм, эмиссионный фильтр 660/20) для флуоресцентного красителя из Таблицы материалов.
ПРИМЕЧАНИЕ: Выберите цитометр без автопробоотборника. Это ускорит процесс впрыска образца в измерительную ячейку. - Когда достигается насыщение связывания (при отсутствии значительного увеличения флуоресценции в течение 5 мин) быстро разбавляют образец в 20 раз буфером Тирода и контролируют диссоциацию до тех пор, пока не будет достигнута исходная флуоресценция (полная диссоциация) или пока не будет достигнуто плато (нет значительного снижения флуоресценции в течение 5 мин).
ПРИМЕЧАНИЕ: В качестве контроля добавьте 10 мкМ ЭДТА и контролируйте полную диссоциацию в течение 5 мин.
- Эксперименты по связыванию равновесия
ПРИМЕЧАНИЕ: Используйте кинетическую кривую связывания для определения времени достижения насыщения; время насыщения для fX-fd и искусственных везикул составляет 20 мин.- Инкубировать искусственные фосфолипидные везикулы (5 мкМ) для связывающего анализа с различными концентрациями fX-fd (от 0 до 1000 нМ) в буфере Тирода в течение 20 мин.
- Разбавьте каждый образец с этапа 4.2.1 на 20x до конечного объема 200 мкл с буфером Tyrode. Немедленно проанализируйте разбавленный образец методом проточной цитометрии в течение 30 с. Используйте параметры из шага 4.1.3.
ПРИМЕЧАНИЕ: В качестве контроля для неспецифического связывания используйте аналогичные образцы с ЭДТА (10 мкМ) и инкубируйте их в течение 5 мин.
5. Анализ данных проточной цитометрии
- Экспорт экспериментов в формате FSC из программного обеспечения для сбора данных цитометрии в программное обеспечение цитометра для анализа данных (см. Таблицу материалов). Выберите | файлов Экспорт | Файлы FCS. Открывайте файлы FSC в программном обеспечении цитометра для анализа данных, выбирая файлы на компьютере и перетаскивая их в рабочее пространство программы.
- Для определения микровезикул идентифицируют область микровезикул по флуоресценции липофильного красителя DiIC16(3). Используйте команды меню или кнопку построения на листе для создания точечной диаграммы SSC из FL2 (краситель DilC16(3)) в координатах журнала. Нажмите кнопку Прямоугольные ворота, чтобы нарисовать область затвора, чтобы события из образца без пузырьков не включались в эту область (рисунок 1B, C).
- Проанализируйте кинетические эксперименты.
- Создайте точечную диаграмму, используя координаты флуоресценции (FL4) с течением времени для области везикул (дважды щелкните в области везикул на шаге 5.2)
- Экспорт данных об изменении флуоресценции с течением времени в формате csv. Выберите пример | Щелкните правой кнопкой мыши | Экспорт | Выберите FL4 и время в параметрах | Выберите каталог для сохранения | Выберите формат CSV | Экспорт.
- Откройте CSV-файл в любом статистическом программном обеспечении (см. Таблицу материалов). Рассчитайте простую скользящую среднюю флуоресценции и времени для каждых 1000 событий.
- Аппроксимировать график зависимости простой флуоресценции скользящей средней от времени при допущении экспоненциальной зависимости (Analysis > Fitting >Нелинейная кривая Fit) и использовать его для вычисления константы кинетической ассоциации с помощью Eq (5).
 (5)
(5)
где [XB] - концентрация связанного фактора в каждый момент времени (определяемые пользователем единицы) в соответствии с простой скользящей средней от шага 5.3.3; [X] - концентрация добавленного фактора; [X]max - максимальная концентрация связанного фактора; k — константа ассоциации; t — время. - Повторите тот же набор действий (5.3.1-5.3.4), чтобы вычислить константу кинетической диссоциации с помощью Eq (6).
 (6)
(6)
Где [XB] - концентрация связанного фактора в каждый момент времени; [X]0 — концентрация связанного фактора в начальный момент времени; k — константа диссоциации; t — время.
- Анализ равновесного связывания
- Определить среднюю флуоресценцию fX-fd в области везикул для каждой выбранной концентрации fX-fd.
- Приближение зависимости флуоресценции связанного фактора от концентрации добавленного фактора в предположении о простой односайтовой связывании. Рассчитайте средние параметры привязки, используя Eq (7) из трех независимых повторов как минимум.
 (7)
(7)
Где [XB] - концентрация связанного фактора; [X] - концентрация добавленного фактора; nx - кажущееся число сайтов связывания на пузырь; Kd — постоянная кажущейся диссоциации.
6. Преобразование интенсивности флуоресценции в среднее число сайтов связывания
- Подготовьте калиброванные бусины.
- Инкубировать гелефильтрованные тромбоциты (см. стадию 3.3) с A23187 (10 мкМ) в присутствии CaCl2 (2,5 мМ) в течение 10 мин при комнатной температуре.
- Добавьте к активированным тромбоцитам различные концентрации fX-fd (от 0 до 1000 нМ). Добавляют 2% v/v формальдегида и инкубируют в течение 1 ч. Остановить реакцию путем инкубации тромбоцитов с 3 М глицином и 5% BSA в течение 30 мин при комнатной температуре.
- Очистите смесь от непрореагировавшего красителя. Центрифугируйте тромбоциты в течение 5 мин при 400 × г, удалите супернатант и повторно суспендируйте гранулу в буфере Tyrode (содержащем 0,5% BSA).
ПРИМЕЧАНИЕ: Повторите шаг 6.1.3 три раза.
- Измерьте уровень флуоресценции калибровочных шариков в каждом образце сначала с помощью спектрофлуорометра (для флуоресцентного красителя из Таблицы материалов возбуждение 633 нм, излучение 670 нм), а затем с помощью проточного цитометра (в канале FL4: возбуждение 633 нм, эмиссионный фильтр 660/20). С помощью счетчика ячеек определите количество бусин в каждом образце.
- Преобразуйте интенсивность флуоресценции каждого соответствующего образца шарика в концентрацию растворимого флуоресцентного красителя с помощью спектрофлуорометра. Перерасчет концентрации флуоресцентного красителя для количества молекул флуорофора с помощью Eq (8).
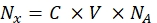 (8)
(8)
Где Nx — количество молекул флуорофора; C - концентрация флуоресцентного красителя; NA — постоянная Авогадро; NA = 6,02214076×1023 моль -1. - Создайте график зависимости средней флуоресценции шариков в проточном цитометре (шаг 6.2) от количества молекул флуорофора (см. шаг 6.3) для каждого образца с помощью любого статистического программного обеспечения (см. Таблицу материалов). Аппроксимация этой зависимости по линейной пропорциональности (Анализ | Монтажные | Подгонка линейная). Из аппроксимации в Eq (9) вычислите коэффициент преобразования средней флуоресценции в сайты связывания.
 (9)
(9)
Где MF - средняя флуоресценция шариков методом проточной цитометрии; Nx — количество молекул флуорофора на шарик; CF представляет собой коэффициент преобразования средней флуоресценции в сайты связывания. CF и b получаются из результатов подгонки графика линейной пропорциональностью. - Рассчитайте кажущееся количество сайтов связывания на интересующее везикулу с помощью Eq (10).
 (10)
(10)
Где nx - кажущееся число сайтов связывания на интересующее везикулу; MF - средняя флуоресценция интересующих везикул методом проточной цитометрии; CF и b являются коэффициентами пересчета из Eq (8).
Результаты
Способ проточной цитометрии, описанный в настоящем описании, используется для характеристики связывания белков плазменной коагуляции с активированными тромбоцитами. Кроме того, в качестве модельной системы применялись фосфолипидные везикулы PS:PC 20:80. Эта статья в основном фокусируется на искусственных фосфолипидных везикулах в качестве примера. Параметры цитометра, в частности, напряжение фотоумножителя (ПМТ) и компенсация должны быть подобраны для каждого конкретного прибора, объекта исследования (клеток, искусственных или природных микровезикул) и используемых красителей. На рисунке 1B,C показан пример покрытия искусственных фосфолипидных везикул размером ~1 мкм с включенным липофильным флуоресцентным красителем DiIC16 (3). Большой размер пузырьков и липофильный флуоресцентный краситель помогли обнаружить везикулы с помощью цитометра. Ворота были установлены на основе образца, содержащего искусственные липидные везикулы того же размера, но без флуоресцентного красителя (рисунок 1B). В анализе использовались только события внутри этих ворот.
На первом этапе проанализирована кинетика связывания белка с везикулами. Образец для этого собирался непрерывно, как описано в шаге 4.1. Типичный точечный график показан на рисунке 1D-F. Полученные данные были проанализированы с помощью программного обеспечения проточной цитометрии. Результирующая кривая показана на рисунке 1G. Сплошные линии показывают кривые аппроксимации, из которых получены кинетические константы ассоциации (kon) и диссоциации (koff). Поскольку фактор X связывается с фосфолипидными везикулами обратимо и Ca2+ -зависимо, образцы с ЭДТА контролировали специфичность и обратимость этого связывания. Результирующие константы показаны в таблице 1.
Исходя из кинетики связывания, для дальнейших равновесных экспериментов было выбрано время в 20 мин, чтобы точно описать насыщение связывания. Впоследствии определяли среднюю интенсивность флуоресценции фактора в области везикул. Каждый образец анализировался при наличии и отсутствии ЭДТА. Интенсивность флуоресценции в присутствии ЭДТА была взята за фон и вычтена из общего сигнала, поскольку связывание fX с мембраной в отсутствие ионов Ca2+ считается неспецифическим. Полученную флуоресценцию преобразовывали в количество сайтов связывания на везикулу с помощью калибровочных шариков.

Рисунок 1: Специфическое связывание fX с искусственными фосфолипидными везикулами. (А) Схема эксперимента. (В, С) Типичные точечные участки фосфолипидных везикул без (B) или с (C) липофильным флуоресцентным красителем DiIC16 (3). (Д-Ф) Типичные точечные графики взаимодействия фактора Х с фосфолипидными везикулами до (D) или после (E) 20-кратного разбавления и в присутствии ЭДТА (F). (G) Кинетика связывания и диссоциации FX (250 нМ) с фосфолипидными везикулами. (H) Равновесное взаимодействие фактора X с фосфолипидными везикулами. Результаты представляют собой средства ±SD для n=3 различных выборок. Сокращения: FX = Фактор X; Ph везикулы = фосфолипидные везикулы; SSC = боковой разброс; a.u. = произвольная единица). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Кажущаяся Kd ± SEM (nM) | kна ± SEM (мкМ-1 с-1) | Koff ± SEM (s-1) | Кажущееся количество сайтов связывания на везикулу ± SEM |
| 400 ± 80 | 0.371 ± 0.012 | 0,019 ± 0,004 | 8 000 ± 800 |
Таблица 1: Параметры взаимодействия fX с искусственными фосфолипидными везикулами. Параметры определялись по кривым (см. рис. 1F,G). Результаты представляют собой среднюю ± SEM для n = 3.
Обсуждение
Предложенный способ может быть адаптирован для грубой характеристики взаимодействия белков с фосфолипидными мембранами из различных источников и композиций. Описанная здесь количественная проточная цитометрия уступает поверхностному плазмонному резонансу (SPR) по нескольким параметрам. В частности, он имеет более низкую чувствительность и временное разрешение и требует флуоресцентной маркировки белков. Флуоресцентная маркировка может привести к изменению конформации и потере активности для многих белков и поэтому требует тщательного контроля. Однако эта методика имеет значительные преимущества перед другими. Этот метод дает возможность исследовать взаимодействие белков с нативной клеточной мембраной, которое нелегко реализовать с помощью SPR. Кроме того, подход позволяет оценить количество сайтов связывания белка на поверхности мембраны и может быть эффективным для некоторых задач анализа.
Коммерчески доступные бусины доступны для некоторых флуоресцентных красителей для подсчета мест связывания. Однако для многих широко используемых красителей таких бусин нет. Следовательно, самодельные бусины являются лучшим способом решить эту проблему. Для приготовления этих бусин использовались те же клетки, что и для всех других экспериментов. Однако, поскольку бусины требуют высоких скоростей центрифугирования во время стирки, фосфолипидные везикулы не могут быть использованы. Однако клетки или везикулы могут быть заменены шариками с аминореактивными группами, которые могут быть конъюгированы с выбранным красителем. Последовательность действий будет аналогична описанной в шаге 6.1.
Ограничения данного метода количественной проточной цитометрии связаны с техническими возможностями используемого цитометра. Три различные модели проточных цитометров (с переменными лазерами, детекторами, насосами) были применены для воспроизведения этой техники без каких-либо осложнений. Однако выбор флуоресцентной этикетки, подходящей для используемого цитометра, должен быть тщательно продуман, поскольку набор лазеров, детекторов и оптических фильтров отличается от устройства к устройству, даже в пределах одной модели. Необходимо ориентироваться на способность цитометра измерять микрочастицы определенного диаметра; не все приборы одинаково способны обнаруживать частицы при разрешении ниже 200 нм (для определения этого используйте калибровочные шарики фиксированного размера, поставляемые производителем прибора). Кроме того, некоторые проточные цитометры, которые отбираются с помощью шприцевого насоса, в принципе не могут измерить кинетику непрерывного связывания. При этом кинетику можно регистрировать только пункт за пунктом, беря отдельные образцы для измерения в определенные моменты времени 4,6.
Проточная цитометрия используется для исследования экспрессии антигенов на различных клетках - наличия/отсутствия антигена и процента клеточных популяций, экспрессирующих и не экспрессирующих этот антиген. Способность проточной цитометрии одновременно различать свободные и связанные лиганды без дополнительных процедур разделения также дает возможность количественной оценки динамики связывания лигандов. Способ, предложенный в настоящем описании, описывает получение самодельных калибровочных шариков для количественной оценки связывания флуоресцентного лиганда с искусственными фосфолипидными везикулами. Такой подход не ограничивает выбор коммерчески доступных флуорофоров. Кроме того, описанный здесь метод сбора и анализа кинетических данных позволяет улучшить разрешение времени. Таким образом, способ, описанный в настоящем описании, может быть использован отдельно в качестве первого шага в характеристике белково-мембранных взаимодействий или в комбинации с другими способами (например, SPR или микроскопией) для повышения точности измерения.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Авторов поддержал грант Российского научного фонда 20-74-00133.
Материалы
| Name | Company | Catalog Number | Comments |
| A23187 | Sigma Aldrich | C7522-10MG | |
| Alexa Fluor 647 NHS Ester (Succinimidyl Ester) | Thermo Fisher Scientific | A37573 | fluorescent dye |
| Apyrase from potatoes | Sigma Aldrich | A2230 | |
| BD FACSCantoII | BD Bioscience | ||
| bovine serum albumin | VWR Life Science AMRESCO | Am-O332-0.1 | |
| Calcium chloride, anhydrous, powder, ≥97% | Sigma Aldrich | C4901-100G | |
| Cary Eclipse Fluorescence Spectrometer | Agilent | ||
| D-(+)-Glucose | Sigma Aldrich | G7528-1KG | |
| DiIC16(3) (1,1'-Dihexadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Thermo Fisher Scientific | D384 | |
| DMSO | Sigma Aldrich | D8418 | |
| EDTA disodium salt | VWR Life Science AMRESCO | Am-O105B-0.1 | |
| FACSDiva | BD Bioscience | cytometry data acquisition software | |
| FlowJo | Tree Star | cytometer software for data analysis | |
| HEPES | Sigma Aldrich | H4034-500G | |
| Human Factor X | Enzyme research | HFX 1010 | |
| Hydroxylamine hydrochloride | Panreac | 141914.1209 | |
| L-α-phosphatidylcholine (Brain, Porcine) | Avanti Polar Lipids | 840053P | |
| L-α-phosphatidylserine (Brain, Porcine) (sodium salt) | Avanti Polar Lipids | 840032P | |
| Magnesium chloride | Sigma Aldrich | M8266-100G | |
| Mini-Extruder | Avanti Polar Lipids | 610020-1EA | |
| OriginPro 8 SR4 v8.0951 | OriginLab Corporation | Statistical software | |
| Phosphate Buffered Saline (PBS) Tablets, Biotechnology Grade | VWR Life Science AMRESCO | 97062-732 | |
| Potassium chloride | Sigma Aldrich | P9541-500G | |
| Prostaglandin E1 | Cayman Chemical | 13010 | |
| Sephadex G25 | GE Healthcare | GE17-0033-01 | gel filtration medium for protein purification |
| Sepharose CL-2B | Sigma Aldrich | CL2B300-500ML | gel filtration medium for platelet purification |
| Sodium bicarbonate | Corning | 61-065-RO | |
| Sodium chloride | Sigma Aldrich | S3014-500G | |
| Sodium phosphate monobasic | Sigma Aldrich | S3139-250G | |
| Spin collumns with membrane 0.2 µm | Sartorius | VS0171 | |
| Trisodium citrate dihydrate | Sigma Aldrich | S1804-1KG |
Ссылки
- Hoffman, M., Monroe, D. M. A cell-based model of hemostasis. Thrombosis and haemostasis. 85 (6), 958-965 (2001).
- Roberts, H. R., Hoffman, M., Monroe, D. M. A cell-based model of thrombin generation. Seminars in Thrombosis and Hemostasis. 32, Suppl 1 32-38 (2006).
- Panteleev, M. A., Dashkevich, N. M., Ataullakhanov, F. I. Hemostasis and thrombosis beyond biochemistry: roles of geometry, flow and diffusion. Thrombosis Research. 136 (4), 699-711 (2015).
- Podoplelova, N. A., et al. Hysteresis-like binding of coagulation factors X/Xa to procoagulant activated platelets and phospholipids results from multistep association and membrane-dependent multimerization. Biochimica et Biophysica Acta. 1858 (6), 1216-1227 (2016).
- Panteleev, M. A., Ananyeva, N. M., Greco, N. J., Ataullakhanov, F. I., Saenko, E. L. Two subpopulations of thrombin-activated platelets differ in their binding of the components of the intrinsic factor X-activating complex. Journal of Thrombosis and Haemostasis. 3 (11), 2545-2553 (2005).
- Kotova, Y., et al. Binding of coagulation factor XIII zymogen to activated platelet subpopulations: roles of integrin αIIbβ3 and fibrinogen. Thrombosis and Haemostasis. 119 (6), 906-915 (2019).
- Fay, S. P., Posner, R. G., Swann, W. N., Sklar, L. A. Real-time analysis of the assembly of ligand, receptor, and G protein by quantitative fluorescence flow cytometry. Biochemistry. 30 (20), 5066-5075 (2002).
- Nolan, J. P., Shen, B., Park, M. S., Sklar, L. A. Kinetic analysis of human flap endonuclease-1 by flow cytometry. Biochemistry. 35 (36), 11668-11676 (1996).
- Sarvazyan, N. A., Lim, W. K., Neubig, R. R. Fluorescence analysis of receptor−G protein interactions in cell membranes. Biochemistry. 41 (42), 12858-12867 (2002).
- Sarvazyan, N. A., Neubig, R. R. Analysis of molecular assemblies by flow cytometry: determinants of Gi1 and by binding. Advances in Optical Biophysics. 3256, 122-131 (1998).
- De Franceschi, N., et al. ProLIF - Quantitative integrin protein-protein interactions and synergistic membrane effects on proteoliposomes. Journal of Cell Science. 132 (4), (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены