Method Article
Analisando a Interação de Proteínas Fluorescentes com Microvesculas Fosfolipísicas Artificiais usando Citometria de Fluxo Quantitativo
Neste Artigo
Resumo
Aqui, descrevemos um conjunto de métodos para caracterizar a interação de proteínas com membranas de células ou microvesculas.
Resumo
No corpo humano, a maioria das principais reações fisiológicas envolvidas na resposta imune e coagulação sanguínea prosseguem nas membranas das células. Um primeiro passo importante em qualquer reação dependente da membrana é a ligação de proteína na membrana fosfolipítida. Uma abordagem para estudar a interação proteica com membranas lipídicas foi desenvolvida usando proteínas fluorescentes rotuladas e citometria de fluxo. Este método permite o estudo de interações proteína-membrana utilizando células vivas e vesículas fosfolipítias naturais ou artificiais. A vantagem deste método é a simplicidade e disponibilidade de reagentes e equipamentos. Neste método, as proteínas são rotuladas usando corantes fluorescentes. No entanto, tanto proteínas auto-fabricadas quanto comercialmente disponíveis, podem ser usadas proteínas fluorescentes. Após a conjugação com um corante fluorescente, as proteínas são incubadas com uma fonte da membrana fosfolipítida (microvesculas ou células), e as amostras são analisadas por citometria de fluxo. Os dados obtidos podem ser usados para calcular as constantes cinéticas e o equilíbrio Kd. Além disso, é possível estimar o número aproximado de locais de ligação de proteínas na membrana fosfolipídida usando contas especiais de calibração.
Introdução
Os biomembranos separam o conteúdo interno das células animais e do espaço extracelular. Note que as membranas também circundam microvesículos formados durante o ciclo de vida da célula e organelas. A membrana celular é predominantemente composta de lipídios e proteínas. As proteínas da membrana realizam funções de sinalização, estrutural, transporte e adesivo. No entanto, o bicamador lipída também é essencial para a inter-relação da célula animal com o espaço extracelular. Este artigo propõe um método para estudar a interação periférica de proteínas externas com a membrana lipídica.
O exemplo mais marcante de reações ocorrendo na camada de membrana externa de uma célula animal é a reação de coagulação sanguínea. Uma característica importante da coagulação sanguínea é que todas as principais reações procedem nas membranas fosfolipítidas das células e microvesculas decorrentes dessas células e não no plasma 1,2,3. Reações dependentes de membrana incluem o processo de inicialidade da coagulação (nas membranas celulares do subendotélio, endotélio inflamado ou células imunes ativadas, com a participação de um fator tecidual), todas as reações da principal cascata-ativação dos fatores IX, X, protrombina; ativação do fator XI por trombina (nas membranas de plaquetas ativadas, eritrócitos, lipoproteínas e microvesculas); reações da via da proteína C; inativação de enzimas de coagulação (nas membranas das células endoteliais com a participação de cofatores trombomodulinas, receptor de proteína endotelial C, sulfato heparano); e reações de via de contato (em membranas de plaquetas e algumas microvesculas com a participação de cofatores desconhecidos). Assim, é impossível investigar a coagulação sanguínea sem estudar a interação de várias proteínas plasmáticas com a membrana das células sanguíneas.
Este artigo descreve um método baseado em fluxo-citometria para caracterizar a interação de proteínas com membranas lipídicas de células ou microvesculas. Esta abordagem foi inicialmente proposta para estudar a interação do plasma de sangue com plaquetas e vesículas fosfolipítias artificiais. Além disso, a maioria das proteínas estudadas interagem diretamente com fosfolipídios de membrana carregados negativamente, particularmente com fosfatidylserina 4,5. Além disso, existem proteínas cuja interação com a membrana é mediada por receptores especiais6.
Uma importante habilidade de citometria de fluxo é discriminar entre ligantes livres e vinculados sem separação adicional. Esta característica da citometria permite o estudo da ligação de ligantes no ponto final e ajuda a realizar medições cinéticas contínuas. A técnica não é sofisticada e não requer preparação complexa da amostra. A citometria de fluxo é usada ativamente para estudar quantitativamente a dinâmica de interação entre peptídeos fluorescentes, receptores e proteínas G em neutrófilos intactos e permeáveisdetergentes 7. Essa abordagem também é aplicável para explorar interações proteína-DNA e a cinética da atividade endonuclease em tempo real8. Com o tempo, este método foi utilizado para estudar quantitativamente interações proteína-proteína de alta afinidade com vesículas lipídicaspurificadas 9, ou, mais geralmente, com proteínas de membrana expressas em um sistema de expressão celular Sf9 altamente eficiente10. Métodos quantitativos também foram descritos para caracterizar interações proteína-lipossomo utilizando citometria de fluxo para proteínas transmembranas11.
Esta técnica usa contas de calibração auto-feitas para evitar o uso de contas disponíveis comercialmente7. As contas de calibração utilizadas anteriormente7 destinavam-se a trabalhar com fluoresceína, o que restringiu substantivamente a variedade de ligantes fluorescentes acessíveis nas proteínas. Além disso, este artigo oferece uma nova maneira de adquirir e analisar dados cinéticos para resolução de tempo razoável. Embora este método seja descrito para vesículas fosfolipídicas artificiais, não há limitações óbvias para sua adaptabilidade às células, vesículas naturais ou vesículas fosfolipídicas artificiais com uma composição lipídica diferente. O método aqui descrito permite a estimativa dos parâmetros de interação (kon, koff) e equilíbrio (Kd) e facilita a caracterização quantitativa do número de sítios de ligação proteica na membrana. Observe que esta técnica fornece uma estimativa aproximada do número de locais de ligação. As vantagens do método são sua relativa simplicidade, acessibilidade e adaptabilidade às células nativas e microvesculas naturais e artificiais.
Protocolo
1. Rotulagem de proteínas fluorescentes
- Preparação do material
- Prepare 1 M tampão de bicarbonato de sódio, pH 9.0, armazene-o a 4 °C e use-o dentro de uma semana.
- Prepare 1,5 M de tampão de cloridrato de hidroxilamina, pH 8,5, imediatamente antes de usar.
- Prepare uma solução de 10 mg/mL de corante fluorescente (ver a Tabela de Materiais) em dimetilsulfoxida.
NOTA: Esta solução pode ser armazenada por um mês a -20 °C no escuro. - Prepare soluções de anticorpos purificados ou outras proteínas a 1-10 mg/mL.
NOTA: Evite tampões contendo íons de amônio ou aminas primárias. Substitua os tampões que contêm Tris ou glicerol por soro fisiológico tamponado por diálise. Nem o azida de sódio (≤3 mM) nem o thimerosal (≤1 mM) afetarão significativamente a reação de conjugação. - Incubar o meio de filtragem de gel (ver a Tabela de Materiais) para purificação de proteínas em PBS durante a noite a temperatura ambiente ou por 2 h a 60 °C. Aplique o meio de filtragem de gel em colunas de giro com membranas de 0,2 μm.
- Calcule a quantidade de corante reativo a ser utilizado para cada reação de acordo com a concentração de proteína a ser rotulada usando Eq (1).
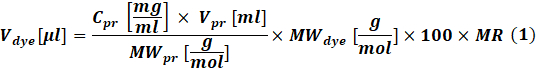
Ondeo corante V é o volume da solução de estoque de corante; Cpr, Vpr e MWpr é a concentração, volume e peso molar da proteína; Mwcorante é o peso molar de corante; 100 é um fator de conversão unitária; Mr é a razão molar de corante para proteína na mistura de reação.
NOTA: Recomenda-se o seguinte MRs para reações de rotulagem de IgG: MR = 40 se o anticorpo estiver em 1-3 mg/mL ou MR = 30 se o anticorpo estiver em 4-10 mg/mL. Para fatores de coagulação, mr = 5 é geralmente usado. - Reação de conjugação
- Em um tubo de reação, misture a solução proteica com um volume 10x menor de 1 M de solução de bicarbonato.
- Adicione a quantidade necessária de corante fluorescente (ver passo 1.2) com agitação contínua.
- Incubar a mistura de reação à temperatura ambiente por aproximadamente 1h, protegido da luz e com agitação contínua.
- Para cada 200 μL de solução proteica, adicione 5 μL de 1,5 M de cloridrato de hidroxilamina.
- Incubar a mistura de reação à temperatura ambiente por aproximadamente 30 minutos, protegido da luz e com agitação contínua.
- Prepare a coluna de giro.
- Adicione 500 μL de meio de filtragem de gel para purificação de proteínas a uma coluna. Centrifugar a coluna por 3 min a 1.000 × g.
- Descarte o tampão do tubo de coleta. Se a coluna não estiver cheia, adicione mais meio de filtragem de gel e centrifugar a coluna por 3 minutos a 1.000 × g. Repita esta etapa até que a coluna esteja cheia.
- Purificação
- Centrifugar a mistura de reação (a partir do passo 1.3.5) por 5 min a 17.000 × g e remover o precipitado.
- Transfira o supernatante para a coluna de giro com meio de filtragem de gel. Deixe a solução absorver na cama de gel.
- Use um tubo de coleta vazio para a coluna de giro e centrífuga por 5 min a 1.000 × g. Após a centrifugação, colete a proteína rotulada do tubo de coleta.
- Determinação do grau de rotulagem
- Corrija para a contribuição do corante para a absorvância em A280 medindo a absorvência de corante livre a 280 nm (A280) e o λmax para o corante (Amax) (ver Eq (2)).
 (2)
(2) - Meça a absorvância do conjugado de proteína-corante a 280 nm (A280) e o λmax para o corante (Amax) e calcule a concetração proteica usando Eq (3).
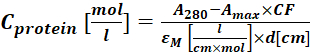 (3)
(3)
Onde εM é o coeficiente de extinção molar da proteína a 280 nm; d é o comprimento do caminho óptico durante a medição da absorvância; CF é a contribuição do corante para a absorvância em A280 (etapa 1.6.1). - Calcule o grau de rotulagem (DOL) utilizando Eq (4).
 (4)
(4)
Onde ε corante M é o coeficiente de extinção molar do corante a λmax nm; d é o comprimento do caminho óptico durante a medição da absorvância; Aproteína C é a concentração da proteína (passo 1.6.2).
- Corrija para a contribuição do corante para a absorvância em A280 medindo a absorvência de corante livre a 280 nm (A280) e o λmax para o corante (Amax) (ver Eq (2)).
2. Preparação de vesículas fosfolipísides
- Preparação e armazenamento da mistura lipídica
- Combine os lipídios na razão apropriada (fosfaticdylserine/fosphatidylcholina a uma proporção de 20 mol% a 80 mol%).
- Seque a mistura lipídica após a liofilização ou evaporação e armazene-a sob uma atmosfera inerte em ampolas de vidro.
- Produção de filmes lipídes
- Abra a ampola e resuspenque a mistura lipídica em uma pequena quantidade (~100 μL) de clorofórmio.
NOTA: Não use muito clorofórmio, pois não evapora completamente. - Adicionar DiIC16(3) no etanol em 0,2 mol%. Transfira a mistura lipídica para um frasco fundo redondo. Espalhe a mistura finamente sobre os lados do frasco girando-a. Seque a mistura lipídica por 30 minutos sob um córrego de argônio.
- Abra a ampola e resuspenque a mistura lipídica em uma pequena quantidade (~100 μL) de clorofórmio.
- Hidratação da mistura lipídica
- Adicione um tampão aquoso adequadamente quente (~55 °C) (HEPES 20 mM, NaCl 140 mM, pH 7.4) em um volume correspondente à concentração lipídica esperada ao frasco com o filme lipídeca. Incubar a mistura com vórtice a 55 °С por 30 min para hidratação completa.
- Colocar o tubo de amostra em um congelador ou termostato quente para fazer com que a suspensão lipídica passe por ciclos de congelamento de 3-5.
- Formação de vesículas lipídicas por extrusão
- Prepare a extrusora de acordo com as instruções do fabricante. Aqueça todos os componentes extrusoras à temperatura de transição de fase da mistura lipídica.
- Encha uma das seringas extrusoras com a mistura lipídica hidratada. Aguarde de 5 a 10 minutos para que a temperatura da suspensão lipídica se equilibre com a temperatura da extrusora.
- Extrude a mistura lipídica através da membrana pelo menos 10 vezes. Para a extrusão final, coloque a suspensão lipídica na seringa alternativa e procure uma mudança na aparência de uma solução ligeiramente nebulosa para uma solução clara.
- Armazene a mistura resultante de vesículas lipídicas a 4 °C, de preferência em uma atmosfera inerte de argônio ou nitrogênio, por 3-4 dias. Não congele.
3. Isolamento de plaquetas de sangue inteiro
- Coletar sangue inteiro de doadores saudáveis em tubos contendo 3,2% de citrato de sódio.
- Adicione prostaglandina E1 (PGE1) (1 μM) e apirágua (0,1 U/mL) ao sangue, seguida de centrifugação à temperatura ambiente a 100 × g por 8 min.
- Após a centrifugação, pegue o plasma rico em plaquetas e adicione a solução de citrato de sódio (106 mM, pH 5.5) a uma razão plasma/citrato de 3:1. Centrifugar o plasma à temperatura ambiente a 400 × g por 5 min.
- Remova o supernasciente e resuspenque a pelota em 300 μL do buffer de Tyrode sem BSA (HEPES de 20 mM, 150 mM NaCl, 2,7 mM KCl, 1 mM MgCl2, 0,4 mM NaH2PO4, 2,5 mM CaCl2, 5 mM de glicose, pH 7.4). Purifique as plaquetas de proteínas plasmáticas por cromatografia de gel no meio de filtragem de gel para purificação de plaquetas (ver a Tabela de Materiais).
4. Detecção de proteína - interação lipídica por citometria de fluxo
- Experimentos de ligação cinética
- Vesículas fosfolipítidas diluídas (a partir do passo 2.4.4) no buffer de Tyrode (20 mM HEPES, 150 mM NaCl, 2,7 mM KCl, 1 mM MgCl2, 0,4 mM NaH2PO4, 2,5 mM CaCl2, 5 mM de glicose, 0,5% BSA, pH 7,4) a uma concentração de 1 μM e volume total de 250 μL.
- Misture o fator de coagulação com rótulo fluorescente X (fX-fd) do passo 1 a uma concentração de 500 nM com as vesículas fosfolipídidas da etapa 4.1.1 em uma razão de 1:1 (concentração vesícula final 0,5 μM, a concentração fX-fd é de 250 nM de fX) para um volume total de 500 ΜL.
- Injete imediatamente os 500 μL da suspensão mista (~20 min para análise com baixa vazão) no citômetro de fluxo. Use uma baixa taxa de fluxo e certifique-se de que o limite para o canal FL2 (exсitation 488 nm, filtro de emissão 585/42 nm) é o valor 200. Meça a fluorescência média no canal FL4 (exсitação 633 nm, filtro de emissão 660/20) para o corante de fluorescência da Tabela de Materiais.
NOTA: Escolha um cítômetro sem um autosampler. Isso acelerará o processo de injeção da amostra na célula de medição. - Quando a saturação da ligação for alcançada (nenhum aumento significativo da fluorescência dentro de 5 min), dilui rapidamente a amostra 20 vezes com o tampão de Tyrode, e monitora a dissociação até que a fluorescência da linha de base seja atingida (dissociação completa) ou até que um platô seja atingido (nenhuma diminuição significativa da fluorescência dentro de 5 min).
NOTA: Como controle, adicione 10 μM EDTA e monitore a dissociação completa por 5 minutos.
- Experimentos de vinculação de equilíbrio
NOTA: Utilize a curva cinética de ligação para determinar o tempo para alcançar a saturação; o tempo para saturação para fX-fd e vesículas artificiais é de 20 min.- Incubar vesículas fosfolipícidas artificiais (5 μM) para o ensaio de ligação com diferentes concentrações de fX-fd (de 0 a 1.000 nM) no buffer de Tyrode por 20 minutos.
- Diluir cada amostra da etapa 4.2.1 por 20x para um volume final de 200 μL com o buffer de Tyrode. Analise imediatamente a amostra diluída por citometria de fluxo dentro dos 30 s. Use as configurações do passo 4.1.3.
NOTA: Como controle para ligação inespecífica, use amostras semelhantes com EDTA (10 μM) e incuba-as por 5 minutos.
5. Análise dos dados de citometria de fluxo
- Experimentos de exportação em formato FSC do software de aquisição de dados de citometria ao software de citógrafo para análise de dados (ver a Tabela de Materiais). Escolha | de arquivos | de exportação Arquivos FCS. Abra arquivos FSC em software de citômetro para análise de dados selecionando os arquivos no computador e arrastando-os para o espaço de trabalho do programa.
- Para a gating dos microvesículos, identifique a região dos microvesículos pela fluorescência do corante lipofílico DiIC16(3). Use comandos de menu ou botão plot na planilha para criar ssc de gráfico de ponto a partir de FL2 (corante DilC16(3)) nas coordenadas de log. Escolha o botão Portão Retangular para desenhar uma região de gating para que eventos de uma amostra sem vesículas não sejam incluídos nesta região (Figura 1B,C).
- Analise os experimentos cinéticos.
- Crie um gráfico de pontos usando as coordenadas da fluorescência (FL4) ao longo do tempo para a região das vesículas (clique duas vezes na região de vesículas na etapa 5.2)
- Exporte os dados sobre a alteração da fluorescência ao longo do tempo no formato csv. Escolha | de amostra | com o botão direito do clique | de exportação Escolha FL4 e Time in Parameters | Selecione diretório para salvar | Selecione | de formato CSV Exportar.
- Abra o arquivo CSV em qualquer software estatístico (consulte a Tabela de Materiais). Calcule uma simples média móvel de fluorescência e tempo para cada 1.000 eventos.
- Aproxime-se de um gráfico da dependência da fluorescência média móvel simples no tempo sob a suposição de dependência exponencial (Análise > Montagem >Nonlinear Curve Fit) e use-o para calcular a constante associação cinética usando Eq (5).
 (5)
(5)
Onde [XB] é a concentração do fator vinculado em cada momento (unidades definidas pelo usuário) de acordo com a média móvel simples da etapa 5.3.3; [X] é a concentração de fator adicionado; [X]max é a concentração máxima do fator vinculado; k é a constante de associação; T é a hora. - Repita o mesmo conjunto de ações (5.3.1-5.3.4) para calcular a constante de dissociação cinética usando Eq (6).
 (6)
(6)
Onde [XB] é a concentração do fator vinculado em cada momento do tempo; [X]0 é a concentração do fator vinculado no momento inicial do tempo; k é a constante de dissociação; T é a hora.
- Ensaio de ligação de equilíbrio
- Determine a fluorescência média de fX-fd na região das vesículas para cada concentração selecionada de fX-fd.
- Aproximar a dependência da fluorescência fator limite da concentração do fator adicionado na suposição de simples vinculação de um único local. Calcule os parâmetros de ligação média usando Eq (7) a partir de três repetições independentes no mínimo.
 (7)
(7)
Onde [XB] é a concentração do fator vinculado; [X] é a concentração de fator adicionado; nx é o número aparente de sites de vinculação por vesícula; Kd é a aparente constante de dissociação.
6. Conversão da intensidade da fluorescência para o número médio de locais de ligação
- Prepare contas calibradas.
- Incubar plaquetas filtradas em gel (ver passo 3.3) com A23187 (10 μM) na presença de CaCl2 (2,5 mM) por 10 minutos à temperatura ambiente.
- Adicione às plaquetas ativadas as várias concentrações de fX-fd (0 a 1.000 nM). Adicione 2% v/v de formaldeído e incubar por 1h. Pare a reação incubando as plaquetas com 3 M de glicecina e 5% de BSA por 30 min a temperatura ambiente.
- Purificar a mistura do corante não redigido. Centrifugar as plaquetas por 5 min a 400 × g, remover o supernascimento e resuspensar a pelota no tampão de Tyrode (contendo 0,5% de BSA).
NOTA: Repita o passo 6.1.3 três vezes.
- Meça o nível de fluorescência das contas de calibração em cada amostra primeiro usando um espectrômetro (para corante fluorescente da Tabela de Materiais, excitação 633 nm, emissão de 670 nm) e, em seguida, usando o citómetro de fluxo (no canal FL4: excitação 633 nm, filtro de emissão 660/20). Usando um contador de células, determine o número de contas em cada amostra.
- Converta a intensidade de fluorescência de cada amostra de contas respectiva para a concentração de corante fluorescente solúvel usando um espectrofluorômetro. Recalcular a concentração de corante fluorescente para o número de moléculas de fluorforeiro usando Eq (8).
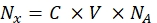 (8)
(8)
Onde Nx é o número de moléculas de fluoróforo; C é a concentração de corante fluorescente; NA é a constante de Avogadro; NA = 6,02214076×1023 mol -1. - Crie um gráfico de dependência da fluorescência média das contas em um citômetro de fluxo (passo 6.2) sobre o número de moléculas fluorforas (ver passo 6.3) para cada amostra usando qualquer software estatístico (ver a Tabela de Materiais). Aproxima essa dependência por proporcionalidade de linha (Análise | Montagem | Ajuste linear). A partir da aproximação em Eq (9), calcule o fator de conversão da fluorescência média para locais de vinculação.
 (9)
(9)
Onde MF é a fluorescência média das contas por citometria de fluxo; Nx é o número de moléculas de fluoróforo por conta; A CF representa o fator de conversão da fluorescência média para locais de vinculação. CF e b são obtidos a partir dos resultados da montagem do gráfico por proporcionalidade linear. - Calcule o número aparente de sites vinculantes por vesícula de interesse usando Eq (10).
 (10)
(10)
Onde nx é o número aparente de sites vinculativos por vesícula de interesse; MF é a fluorescência média das vesículas de interesse por citometria de fluxo; CF e b são fatores de conversão do Eq (8).
Resultados
O método de citometria de fluxo descrito aqui é usado para caracterizar a ligação de proteínas de coagulação plasmática a plaquetas ativadas. Além disso, as vesículas fosfolipídidas PS:PC 20:80 foram aplicadas como um sistema de modelo. Este artigo se concentra principalmente em vesículas fosfolipísides artificiais como exemplo. Os parâmetros do citómetro, em particular, a tensão do tubo fotomultiplier (PMT) e a compensação devem ser selecionados para cada dispositivo específico, o objeto de estudo (células, microvesculas artificiais ou naturais) e os corantes utilizados. Figura 1B,C mostram um exemplo de vesículas fosfolipídicas artificiais que têm ~1 μm de tamanho com o corante fluorescente lipofílico incorporado DiIC16 (3). Grande tamanho de vesícula e corante fluorescente lipofílico ajudaram a detectar vesículas usando um citômetro. O portão foi definido com base em uma amostra contendo as vesículas lipídicas artificiais do mesmo tamanho, mas sem o corante fluorescente (Figura 1B). Apenas eventos dentro deste portão foram utilizados na análise.
A cinética da proteína que liga às vesículas foi analisada no primeiro estágio. A amostra para isso foi coletada continuamente conforme descrito na etapa 4.1. Um típico gráfico de pontos é mostrado na Figura 1D-F. Os dados obtidos foram analisados utilizando-se o software de citometria de fluxo. A curva resultante é mostrada na Figura 1G. Linhas sólidas mostram as curvas de aproximação, das quais foram obtidas as constantes cinéticas de associação (kon) e dissociação (koff). À medida que o fator X se liga às vesículas fosfolipídidas reversivelmente e ca2+-dependently, amostras com EDTA controlaram a especificidade e reversibilidade dessa ligação. As constantes resultantes são mostradas na Tabela 1.
Com base na cinética da vinculação, um tempo de 20 min foi escolhido para mais experimentos de equilíbrio para descrever a saturação em vinculação com precisão. A intensidade média de fluorescência do fator foi posteriormente determinada na região das vesículas. Cada amostra foi analisada na presença e ausência de EDTA. A intensidade de fluorescência na presença de EDTA foi tomada como pano de fundo e subtraída do sinal total, pois a ligação de fX à membrana na ausência de íons Ca2+ é considerada inespecífica. A fluorescência resultante foi convertida para o número de locais de ligação por vesícula usando as contas de calibração.

Figura 1: Ligação específica de fX a vesículas fosfolipídidas artificiais. (A) Esquema de experimento. (B, C) Gráficos típicos de pontos de vesículas fosfolipídicas sem (B) ou com (C) corante fluorescente lipofílico DiIC16 (3). (D-F) Gráficos típicos de pontos da interação fator X com vesículas fosfolipítidas antes (D) ou depois (E) diluição de 20 vezes e na presença EDTA (F). (G) Cinética de fx (250 nM) vinculação e dissociação para vesículas fosfolipídas. (H) Interação de equilíbrio do fator X com vesículas fosfolipídas. Os resultados são os meios ±SD para n=3 amostras diferentes. Abreviaturas: FX = Fator X; Vesículas de ph = vesículas fosfolipídas; SSC = dispersão lateral; a.u. = unidade arbitrária). Clique aqui para ver uma versão maior desta figura.
| Aparente Kd ± SEM (nM) | kno ± SEM (μM-1 s-1) | Koff ± SEM (s-1) | Número aparente de sites de vinculação por vesícula ± SEM |
| 400 ± 80 | 0,371 ± 0,012 | 0.019 ± 0,004 | 8.000 ± 800 |
Tabela 1: Parâmetros da interação fX com vesículas fosfolipídicas artificiais. Os parâmetros foram determinados a partir das curvas (ver Figura 1F,G). Os resultados são a média ± SEM para n = 3.
Discussão
O método proposto pode ser adaptado para uma caracterização áspera da interação de proteínas com membranas fosfolipítidas de várias fontes e composições. A citometria quantitativa de fluxo descrita aqui concede ressonância plasmon superficial (SPR) em vários parâmetros. Em particular, tem menor sensibilidade e resolução de tempo e requer rotulagem fluorescente de proteínas. A rotulagem fluorescente pode levar a uma mudança na conformação e perda de atividade para muitas proteínas e, portanto, requer um controle cuidadoso. No entanto, essa técnica tem vantagens significativas em relação às outras. Este método oferece uma oportunidade de explorar a interação das proteínas com a membrana celular nativa, que não é facilmente implementada usando SPR. Além disso, a abordagem permite a estimativa do número de sítios de ligação proteica na superfície da membrana e pode ser eficiente para algumas tarefas de análise.
Contas disponíveis comercialmente estão disponíveis para alguns corantes fluorescentes para contar locais de vinculação. No entanto, não existem tais contas para muitos corantes amplamente utilizados. Por isso, contas auto-feitas são a melhor maneira de resolver isso. As mesmas células foram usadas para preparar essas contas como para todos os outros experimentos. No entanto, como as contas requerem altas velocidades de centrifugação durante a lavagem, vesículas fosfolipítias não podem ser usadas. No entanto, as células ou vesículas podem ser substituídas por contas por grupos amino-reativos, que podem ser conjugados ao corante escolhido. A sequência de ações será semelhante à descrita na etapa 6.1.
As limitações deste método de citometria de fluxo quantitativo estão relacionadas às capacidades técnicas do címetro usado. Três modelos diferentes de citómetros de fluxo (com os lasers variáveis, detectores, bombas) foram aplicados para reproduzir essa técnica sem qualquer complicação. No entanto, a seleção de um rótulo fluorescente adequado para o citômetro utilizado deve ser cuidadosamente considerada porque o conjunto de lasers, detectores e filtros ópticos diferem de dispositivo para dispositivo, mesmo dentro do mesmo modelo. É necessário focar na capacidade do cítmetro de medir micropartículas de um diâmetro específico; nem todos os instrumentos são igualmente capazes de detectar partículas em resoluções abaixo de 200 nm (para determinar isso, use as contas de calibração de tamanho fixo fornecidas pelo fabricante do instrumento). Além disso, alguns citómetros de fluxo, que são amostrados usando uma bomba de seringa, não podem medir a cinética de ligação contínua em princípio. Neste caso, a cinética pode ser registrada apenas ponto a ponto, coletando amostras separadas para medição em determinados pontos no tempo 4,6.
A citometria de fluxo é usada para investigar a expressão de antígenos em várias células - a presença/ausência de um antígeno e a porcentagem de populações celulares expressando e não expressando este antígeno. A capacidade da citometria de fluxo de discriminar simultaneamente ligantes livres e vinculados sem procedimentos adicionais de separação também oferece a oportunidade de avaliação quantitativa da dinâmica vinculante de ligantes. O método aqui proposto descreve a preparação de contas de calibração auto-feitas para quantificar a vinculação de um ligante fluorescente a vesículas fosfolipídas artificiais. Esta abordagem não limita a escolha de fluoroforos disponíveis comercialmente. Além disso, a técnica aqui descrita para aquisição e análise de dados cinéticos permite uma melhor resolução de tempo. Assim, o método aqui descrito pode ser usado sozinho como um primeiro passo na caracterização de interações proteína-membrana ou em combinação com outros métodos (por exemplo, SPR ou microscopia) para melhorar a precisão da medição.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Os autores foram apoiados por uma bolsa da Fundação Russa de Ciência 20-74-00133.
Materiais
| Name | Company | Catalog Number | Comments |
| A23187 | Sigma Aldrich | C7522-10MG | |
| Alexa Fluor 647 NHS Ester (Succinimidyl Ester) | Thermo Fisher Scientific | A37573 | fluorescent dye |
| Apyrase from potatoes | Sigma Aldrich | A2230 | |
| BD FACSCantoII | BD Bioscience | ||
| bovine serum albumin | VWR Life Science AMRESCO | Am-O332-0.1 | |
| Calcium chloride, anhydrous, powder, ≥97% | Sigma Aldrich | C4901-100G | |
| Cary Eclipse Fluorescence Spectrometer | Agilent | ||
| D-(+)-Glucose | Sigma Aldrich | G7528-1KG | |
| DiIC16(3) (1,1'-Dihexadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Thermo Fisher Scientific | D384 | |
| DMSO | Sigma Aldrich | D8418 | |
| EDTA disodium salt | VWR Life Science AMRESCO | Am-O105B-0.1 | |
| FACSDiva | BD Bioscience | cytometry data acquisition software | |
| FlowJo | Tree Star | cytometer software for data analysis | |
| HEPES | Sigma Aldrich | H4034-500G | |
| Human Factor X | Enzyme research | HFX 1010 | |
| Hydroxylamine hydrochloride | Panreac | 141914.1209 | |
| L-α-phosphatidylcholine (Brain, Porcine) | Avanti Polar Lipids | 840053P | |
| L-α-phosphatidylserine (Brain, Porcine) (sodium salt) | Avanti Polar Lipids | 840032P | |
| Magnesium chloride | Sigma Aldrich | M8266-100G | |
| Mini-Extruder | Avanti Polar Lipids | 610020-1EA | |
| OriginPro 8 SR4 v8.0951 | OriginLab Corporation | Statistical software | |
| Phosphate Buffered Saline (PBS) Tablets, Biotechnology Grade | VWR Life Science AMRESCO | 97062-732 | |
| Potassium chloride | Sigma Aldrich | P9541-500G | |
| Prostaglandin E1 | Cayman Chemical | 13010 | |
| Sephadex G25 | GE Healthcare | GE17-0033-01 | gel filtration medium for protein purification |
| Sepharose CL-2B | Sigma Aldrich | CL2B300-500ML | gel filtration medium for platelet purification |
| Sodium bicarbonate | Corning | 61-065-RO | |
| Sodium chloride | Sigma Aldrich | S3014-500G | |
| Sodium phosphate monobasic | Sigma Aldrich | S3139-250G | |
| Spin collumns with membrane 0.2 µm | Sartorius | VS0171 | |
| Trisodium citrate dihydrate | Sigma Aldrich | S1804-1KG |
Referências
- Hoffman, M., Monroe, D. M. A cell-based model of hemostasis. Thrombosis and haemostasis. 85 (6), 958-965 (2001).
- Roberts, H. R., Hoffman, M., Monroe, D. M. A cell-based model of thrombin generation. Seminars in Thrombosis and Hemostasis. 32, Suppl 1 32-38 (2006).
- Panteleev, M. A., Dashkevich, N. M., Ataullakhanov, F. I. Hemostasis and thrombosis beyond biochemistry: roles of geometry, flow and diffusion. Thrombosis Research. 136 (4), 699-711 (2015).
- Podoplelova, N. A., et al. Hysteresis-like binding of coagulation factors X/Xa to procoagulant activated platelets and phospholipids results from multistep association and membrane-dependent multimerization. Biochimica et Biophysica Acta. 1858 (6), 1216-1227 (2016).
- Panteleev, M. A., Ananyeva, N. M., Greco, N. J., Ataullakhanov, F. I., Saenko, E. L. Two subpopulations of thrombin-activated platelets differ in their binding of the components of the intrinsic factor X-activating complex. Journal of Thrombosis and Haemostasis. 3 (11), 2545-2553 (2005).
- Kotova, Y., et al. Binding of coagulation factor XIII zymogen to activated platelet subpopulations: roles of integrin αIIbβ3 and fibrinogen. Thrombosis and Haemostasis. 119 (6), 906-915 (2019).
- Fay, S. P., Posner, R. G., Swann, W. N., Sklar, L. A. Real-time analysis of the assembly of ligand, receptor, and G protein by quantitative fluorescence flow cytometry. Biochemistry. 30 (20), 5066-5075 (2002).
- Nolan, J. P., Shen, B., Park, M. S., Sklar, L. A. Kinetic analysis of human flap endonuclease-1 by flow cytometry. Biochemistry. 35 (36), 11668-11676 (1996).
- Sarvazyan, N. A., Lim, W. K., Neubig, R. R. Fluorescence analysis of receptor−G protein interactions in cell membranes. Biochemistry. 41 (42), 12858-12867 (2002).
- Sarvazyan, N. A., Neubig, R. R. Analysis of molecular assemblies by flow cytometry: determinants of Gi1 and by binding. Advances in Optical Biophysics. 3256, 122-131 (1998).
- De Franceschi, N., et al. ProLIF - Quantitative integrin protein-protein interactions and synergistic membrane effects on proteoliposomes. Journal of Cell Science. 132 (4), (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados