Method Article
Analisi dell'interazione di proteine marcate fluorescenti con microvescicole fosfolipidiche artificiali utilizzando la citometria a flusso quantitativa
In questo articolo
Riepilogo
Qui, descriviamo una serie di metodi per caratterizzare l'interazione delle proteine con membrane di cellule o microvescicole.
Abstract
Nel corpo umano, la maggior parte delle principali reazioni fisiologiche coinvolte nella risposta immunitaria e nella coagulazione del sangue procedono sulle membrane delle cellule. Un primo passo importante in qualsiasi reazione dipendente dalla membrana è il legame delle proteine sulla membrana fosfolipidica. Un approccio allo studio dell'interazione proteica con le membrane lipidiche è stato sviluppato utilizzando proteine marcate fluorescentemente e citometria a flusso. Questo metodo consente lo studio delle interazioni proteina-membrana utilizzando cellule vive e vescicole fosfolipidiche naturali o artificiali. Il vantaggio di questo metodo è la semplicità e la disponibilità di reagenti e attrezzature. In questo metodo, le proteine sono etichettate utilizzando coloranti fluorescenti. Tuttavia, possono essere utilizzate sia proteine autoprodotte che disponibili in commercio, etichettate in modo fluorescente. Dopo la coniugazione con un colorante fluorescente, le proteine vengono incubate con una fonte della membrana fosfolipidica (microvescicole o cellule) e i campioni vengono analizzati mediante citometria a flusso. I dati ottenuti possono essere utilizzati per calcolare le costanti cinetiche e l'equilibrio Kd. Inoltre, è possibile stimare il numero approssimativo di siti di legame proteico sulla membrana fosfolipidica utilizzando speciali perle di calibrazione.
Introduzione
Le biomembrane separano il contenuto interno delle cellule animali e lo spazio extracellulare. Si noti che le membrane circondano anche le microvescicole formate durante il ciclo di vita della cellula e gli organelli. La membrana cellulare è prevalentemente composta da lipidi e proteine. Le proteine di membrana svolgono funzioni di segnalazione, strutturali, di trasporto e adesive. Tuttavia, il doppio strato lipidico è anche essenziale per l'interrelazione della cellula animale con lo spazio extracellulare. Questo documento propone un metodo per studiare l'interazione periferica delle proteine esterne con la membrana lipidica.
L'esempio più eclatante di reazioni che si verificano sullo strato esterno della membrana di una cellula animale è la reazione di coagulazione del sangue. Una caratteristica importante della coagulazione del sangue è che tutte le principali reazioni procedono sulle membrane fosfolipidiche delle cellule e delle microvescicole derivanti da queste cellule e non nel plasma 1,2,3. Le reazioni dipendenti dalla membrana includono il processo di coagulazione iniziale (sulle membrane cellulari del subendotelio, dell'endotelio infiammato o delle cellule immunitarie attivate, con la partecipazione di un fattore tissutale), tutte le reazioni della principale attivazione a cascata dei fattori IX, X, protrombina; attivazione del fattore XI da parte della trombina (sulle membrane di piastrine attivate, eritrociti, lipoproteine e microvescicole); reazioni della via della proteina C; inattivazione degli enzimi della coagulazione (sulle membrane delle cellule endoteliali con la partecipazione di cofattori di trombomodulina, recettore C della proteina endoteliale, eparan solfato); e reazioni alle vie di contatto (su membrane di piastrine e alcune microvescicole con la partecipazione di cofattori sconosciuti). Pertanto, è impossibile indagare sulla coagulazione del sangue senza studiare l'interazione di varie proteine plasmatiche con la membrana delle cellule del sangue.
Questo articolo descrive un metodo basato sulla citometria a flusso per caratterizzare l'interazione delle proteine con le membrane lipidiche delle cellule o delle microvescicole. Questo approccio è stato inizialmente proposto per studiare l'interazione del plasma sanguigno con piastrine e vescicole fosfolipidiche artificiali. Inoltre, la maggior parte delle proteine studiate interagisce direttamente con i fosfolipidi di membrana caricati negativamente, in particolare con la fosfatidilserina 4,5. Inoltre, ci sono proteine la cui interazione con la membrana è mediata da speciali recettori6.
Un'importante capacità della citometria a flusso è la discriminazione tra ligandi liberi e legati senza separazione aggiuntiva. Questa caratteristica della citometria consente lo studio del legame di equilibrio del ligando all'endpoint e aiuta a eseguire misurazioni cinetiche continue. La tecnica non è sofisticata e non richiede una preparazione complessa del campione. La citometria a flusso viene utilizzata attivamente per studiare quantitativamente la dinamica di interazione tra peptidi fluorescenti, recettori e proteine G in neutrofili intatti e permeabili ai detergenti7. Questo approccio è applicabile anche per esplorare le interazioni proteina-DNA e la cinetica dell'attività dell'endonucleasi in tempo reale8. Nel corso del tempo, questo metodo è stato utilizzato per studiare quantitativamente le interazioni proteina-proteina ad alta affinità con le vescicole lipidiche purificate9 o, più in generale, con le proteine di membrana espresse in un sistema di espressione cellulare Sf9 altamente efficiente10. Sono stati descritti anche metodi quantitativi per caratterizzare le interazioni proteina-liposoma utilizzando la citometria a flusso per le proteine transmembrana11.
Questa tecnica utilizza perline di calibrazione autoprodotte per evitare l'uso di perline7 disponibili in commercio. Le perle di calibrazione utilizzate in precedenza7 erano destinate a funzionare con la fluoresceina, che limitava sostanzialmente l'assortimento di ligandi fluorescenti accessibili sulle proteine. Inoltre, questo documento offre un nuovo modo per acquisire e analizzare i dati cinetici per una risoluzione temporale ragionevole. Sebbene questo metodo sia descritto per le vescicole fosfolipidiche artificiali, non ci sono limitazioni evidenti per la sua adattabilità a cellule, vescicole naturali o vescicole fosfolipidiche artificiali con una diversa composizione lipidica. Il metodo qui descritto consente la stima dei parametri di interazione (kon, koff) ed equilibrio (Kd) e facilita la caratterizzazione quantitativa del numero di siti di legame proteico sulla membrana. Si noti che questa tecnica fornisce una stima approssimativa del numero di siti di associazione. I vantaggi del metodo sono la sua relativa semplicità, accessibilità e adattabilità alle cellule native e alle microvescicole naturali e artificiali.
Protocollo
1. Etichettatura delle proteine fluorescenti
- Preparazione del materiale
- Preparare il tampone di bicarbonato di sodio 1 M, pH 9,0, conservarlo a 4 °C e utilizzarlo entro una settimana.
- Preparare il tampone idrossilammina cloridrato da 1,5 M, pH 8,5, immediatamente prima dell'uso.
- Preparare una soluzione da 10 mg/mL di colorante fluorescente (vedere la Tabella dei materiali) in dimetilsolfossido.
NOTA: questa soluzione può essere conservata per un mese a -20 °C al buio. - Preparare soluzioni di anticorpi purificati o altre proteine a 1-10 mg/ml.
NOTA: Evitare tamponi contenenti ioni ammonio o ammine primarie. Sostituire i tamponi contenenti Tris o glicerolo con soluzione salina tamponata con fosfato (PBS) mediante dialisi. Né l'azide di sodio (≤3 mM) né il thimerosal (≤1 mM) influenzeranno significativamente la reazione di coniugazione. - Incubare il mezzo filtrante in gel (vedi tabella dei materiali) per la purificazione delle proteine in PBS durante la notte a temperatura ambiente o per 2 ore a 60 °C. Applicare il mezzo filtrante in gel su colonne di centrifuga con membrane da 0,2 μm.
- Calcolare la quantità di colorante reattivo da utilizzare per ogni reazione in base alla concentrazione di proteine da etichettare utilizzando Eq (1).
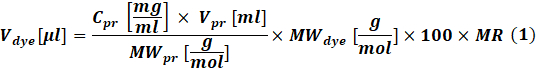
Dove ilcolorante V è il volume della soluzione madre colorante; Cpr, Vpr e MWpr sono la concentrazione, il volume e il peso molare della proteina; Ilcolorante MW è il peso molare del colorante; 100 è un fattore di conversione unitario; MR è il rapporto molare tra colorante e proteine nella miscela di reazione.
NOTA: Le seguenti RM sono raccomandate per le reazioni di marcatura delle IgG: MR = 40 se l'anticorpo è a 1-3 mg/mL o MR = 30 se l'anticorpo è a 4-10 mg/mL. Per i fattori della coagulazione, di solito viene utilizzato MR = 5. - Reazione coniugale
- In un tubo di reazione, mescolare la soluzione proteica con un volume 10 volte inferiore di 1 M di soluzione di bicarbonato.
- Aggiungere la quantità necessaria di colorante fluorescente (vedere il punto 1.2) mescolando continuamente.
- Incubare la miscela di reazione a temperatura ambiente per circa 1 ora, al riparo dalla luce e con agitazione continua.
- Per ogni 200 μL di soluzione proteica, aggiungere 5 μL di 1,5 M di idrossilammina cloridrato.
- Incubare la miscela di reazione a temperatura ambiente per circa 30 minuti, al riparo dalla luce e con agitazione continua.
- Preparare la colonna di rotazione.
- Aggiungere 500 μL di mezzo filtrante in gel per la purificazione delle proteine a una colonna. Centrifugare la colonna per 3 minuti a 1.000 × g.
- Eliminare il buffer dal tubo di raccolta. Se la colonna non è piena, aggiungere più mezzo filtrante in gel e centrifugare la colonna per 3 minuti a 1.000 × g. Ripetere questo passaggio fino a quando la colonna non è piena.
- Purificazione
- Centrifugare la miscela di reazione (dal punto 1.3.5) per 5 minuti a 17.000 × g e rimuovere il precipitato.
- Trasferire il surnatante sulla colonna di spin con mezzo filtrante in gel. Lasciare che la soluzione si assorba nel letto di gel.
- Utilizzare un tubo di raccolta vuoto per la colonna di centrifuga e centrifugarlo per 5 minuti a 1.000 × g. Dopo la centrifugazione, raccogliere la proteina etichettata dal tubo di raccolta.
- Determinazione del grado di etichettatura
- Correggere il contributo del colorante all'assorbanza a A280 misurando l'assorbanza del colorante libero a 280 nm (A280) e il massimo λ per il colorante (Amax) (vedi Eq (2)).
 (2)
(2) - Misurare l'assorbanza del coniugato proteina-colorante a 280 nm (A280) e il massimo λ per il colorante (Amax) e calcolare la concetrazione proteica utilizzando Eq (3).
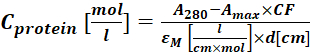 (3)
(3)
Dove εM è il coefficiente di estinzione molare della proteina a 280 nm; d è la lunghezza del percorso ottico durante la misurazione dell'assorbanza; CF è il contributo del colorante all'assorbanza a A280 (fase 1.6.1). - Calcolare il grado di etichettatura (DOL) utilizzando Eq (4).
 (4)
(4)
Dove ε coloranteM è il coefficiente di estinzione molare del colorante a λmax nm; d è la lunghezza del percorso ottico durante la misurazione dell'assorbanza; Laproteina C è la concentrazione della proteina (fase 1.6.2).
- Correggere il contributo del colorante all'assorbanza a A280 misurando l'assorbanza del colorante libero a 280 nm (A280) e il massimo λ per il colorante (Amax) (vedi Eq (2)).
2. Preparazione delle vescicole fosfolipidiche
- Preparazione e conservazione della miscela lipidica
- Combinare i lipidi nel rapporto appropriato (fosfatidilserina/fosfatidilcolina in un rapporto tra il 20 mol% e l'80 mol%).
- Asciugare la miscela lipidica dopo liofilizzazione o evaporazione e conservarla in atmosfera inerte in fiale di vetro.
- Produzione di film lipidici
- Aprire la fiala e risospesere la miscela lipidica in una piccola quantità (~ 100 μL) di cloroformio.
NOTA: Non usare troppo cloroformio in quanto non evapora completamente. - Aggiungere DiIC16(3) in etanolo allo 0,2 mol%. Trasferire la miscela lipidica in un matraccio a fondo tondo. Stendere il composto sottilmente sui lati del matraccio ruotandolo. Asciugare la miscela lipidica per 30 minuti sotto un flusso di argon.
- Aprire la fiala e risospesere la miscela lipidica in una piccola quantità (~ 100 μL) di cloroformio.
- Idratazione della miscela lipidica
- Aggiungere un tampone acquoso opportunamente caldo (~55 °C) (HEPES 20 mM, NaCl 140 mM, pH 7,4) in un volume corrispondente alla concentrazione lipidica prevista al matraccio con il film lipidico. Incubare la miscela con vortice a 55 ° С per 30 minuti per un'idratazione completa.
- Posizionare la provetta del campione in un congelatore o in un termostato caldo per sottoporre la sospensione lipidica a 3-5 cicli di congelamento-scongelamento.
- Formazione di vescicole lipidiche per estrusione
- Preparare l'estrusore secondo le istruzioni del produttore. Riscaldare tutti i componenti dell'estrusore alla temperatura di transizione di fase della miscela lipidica.
- Riempire una delle siringhe dell'estrusore con la miscela lipidica idratata. Attendere 5-10 minuti affinché la temperatura della sospensione lipidica si equilibri con la temperatura dell'estrusore.
- Estrudere la miscela lipidica attraverso la membrana almeno 10 volte. Per l'estrusione finale, posizionare la sospensione lipidica nella siringa alternativa e cercare un cambiamento nell'aspetto da una soluzione leggermente nebulosa a una soluzione chiara.
- Conservare la miscela risultante di vescicole lipidiche a 4 °C, preferibilmente in atmosfera inerte di argon o azoto, per 3-4 giorni. Non congelare.
3. Isolamento delle piastrine dal sangue intero
- Raccogliere sangue intero da donatori sani in provette contenenti il 3,2% di citrato di sodio.
- Aggiungere al sangue la prostaglandina E1 (PGE1) (1 μM) e l'apirasi (0,1 U/mL), seguite da centrifugazione a temperatura ambiente a 100 × g per 8 min.
- Dopo la centrifugazione, prendere il plasma ricco di piastrine e aggiungere la soluzione di citrato di sodio (106 mM, pH 5,5) ad un rapporto plasma/citrato di 3:1. Centrifugare il plasma a temperatura ambiente a 400 × g per 5 min.
- Rimuovere il surnatante e risospesciare il pellet in 300 μL del tampone di Tyrode senza BSA (20 mM HEPES, 150 mM NaCl, 2,7 mM KCl, 1 mM MgCl2, 0,4 mM NaH2PO4, 2,5 mM CaCl2, 5 mM glucosio, pH 7,4). Purificare le piastrine dalle proteine plasmatiche mediante cromatografia su gel sul mezzo filtrante gel per la purificazione piastrinica (vedi Tabella dei materiali).
4. Rilevazione dell'interazione proteina-lipidi mediante citometria a flusso
- Esperimenti di legame cinetico
- Vescicole fosfolipidiche diluite (dal passo 2.4.4) nel tampone di Tyrode (20 mM HEPES, 150 mM NaCl, 2,7 mM KCl, 1 mM MgCl2, 0,4 mM NaH2PO4, 2,5 mM CaCl2, 5 mM glucosio, 0,5% BSA, pH 7,4) ad una concentrazione di 1 μM e volume totale di 250 μL.
- Mescolare il fattore X della coagulazione marcato fluorescente (fX-fd) dallo stadio 1 a una concentrazione di 500 nM con le vescicole fosfolipidiche dal punto 4.1.1 in un rapporto 1:1 (concentrazione finale della vescicola 0,5 μM, la concentrazione fX-fd è 250 nM di fX) a un volume totale di 500 μL.
- Iniettare immediatamente i 500 μL della sospensione mista (~ 20 minuti per l'analisi con una bassa velocità di flusso) nel citometro a flusso. Utilizzare una portata bassa e assicurarsi che la soglia per il canale FL2 (exсitation 488 nm, filtro di emissione 585/42 nm) sia pari al valore 200. Misurare la fluorescenza media nel canale FL4 (exсitation 633 nm, filtro di emissione 660/20) per il colorante a fluorescenza dalla Tabella dei materiali.
NOTA: Scegliere un citometro senza autocampionatore. Ciò accelererà il processo di iniezione del campione nella cella di misurazione. - Quando si raggiunge la saturazione del legame (nessun aumento significativo della fluorescenza entro 5 minuti), diluire rapidamente il campione di 20 volte con il tampone di Tyrode e monitorare la dissociazione fino al raggiungimento della fluorescenza basale (dissociazione completa) o fino al raggiungimento di un plateau (nessuna diminuzione significativa della fluorescenza entro 5 minuti).
NOTA: come controllo, aggiungere 10 μM EDTA e monitorare la dissociazione completa per 5 minuti.
- Esperimenti di legame all'equilibrio
NOTA: utilizzare la curva cinetica di legame per determinare il tempo necessario per raggiungere la saturazione; il tempo di saturazione per fX-fd e vescicole artificiali è di 20 min.- Incubare vescicole fosfolipidiche artificiali (5 μM) per il saggio di legame con diverse concentrazioni di fX-fd (da 0 a 1.000 nM) nel tampone di Tyrode per 20 min.
- Diluire ogni campione dal punto 4.2.1 di 20x a un volume finale di 200 μL con il tampone di Tyrode. Analizzare immediatamente il campione diluito mediante citometria a flusso entro 30 s. Utilizzare le impostazioni del passaggio 4.1.3.
NOTA: come controllo per il legame non specifico, utilizzare campioni simili con EDTA (10 μM) e incubarli per 5 minuti.
5. Analisi dei dati della citometria a flusso
- Esportare esperimenti in formato FSC dal software di acquisizione dati di citometria al software di citometro per l'analisi dei dati (vedere la Tabella dei materiali). Scegli file | Esporta | FCS. Apri i file FSC nel software cytometer per l'analisi dei dati selezionando i file sul computer e trascinandoli nell'area di lavoro del programma.
- Per il gating delle microvescicole, identificare la regione delle microvescicole mediante la fluorescenza del colorante lipofilo DiIC16(3). Utilizzare i comandi di menu o il pulsante di stampa nel foglio di lavoro per creare SSC dot plot da FL2 (dye DilC16(3)) nelle coordinate di registro. Scegliere il pulsante Porta rettangolare per disegnare una regione di gating in modo che gli eventi di un campione senza vescicole non siano inclusi in questa regione (Figura 1B,C).
- Analizzare gli esperimenti cinetici.
- Creare un dot-plot utilizzando le coordinate di fluorescenza (FL4) nel tempo per la regione delle vescicole (fare doppio clic nella regione delle vescicole nel passaggio 5.2)
- Esporta i dati sulla variazione di fluorescenza nel tempo in formato csv. Scegli | di esempio Fare clic con il pulsante destro del mouse su | Esporta | Scegli FL4 e Tempo nei parametri | Selezionare la directory per il salvataggio di | Seleziona il formato CSV | Esportazione.
- Apri il file CSV in qualsiasi software statistico (vedi la Tabella dei materiali). Calcola una semplice media mobile di fluorescenza e tempo per ogni 1.000 eventi.
- Approssimare un grafico della dipendenza della fluorescenza della media mobile semplice nel tempo sotto l'ipotesi della dipendenza esponenziale (Analysis > Fitting >Nonlinear Curve Fit) e usarlo per calcolare la costante di associazione cinetica usando Eq (5).
 (5)
(5)
Dove [XB] è la concentrazione del fattore legato in ogni momento del tempo (unità definite dall'utente) secondo la media mobile semplice dal passo 5.3.3; [X] è la concentrazione del fattore aggiunto; [X]max è la concentrazione massima del fattore limite; k è la costante di associazione; t è il tempo. - Ripetere lo stesso insieme di azioni (5.3.1-5.3.4) per calcolare la costante di dissociazione cinetica usando Eq (6).
 (6)
(6)
Dove [XB] è la concentrazione del fattore legato in ogni momento del tempo; [X]0 è la concentrazione del fattore legato al momento iniziale del tempo; k è la costante di dissociazione; t è il tempo.
- Saggio di legame di equilibrio
- Determinare la fluorescenza media di fX-fd nella regione delle vescicole per ogni concentrazione selezionata di fX-fd.
- Approssimare la dipendenza della fluorescenza del fattore legato dalla concentrazione del fattore aggiunto nell'assunzione di un semplice legame a sito singolo. Calcola i parametri di legame medi utilizzando Eq (7) da almeno tre ripetizioni indipendenti.
 (7)
(7)
Dove [XB] è la concentrazione del fattore legato; [X] è la concentrazione del fattore aggiunto; nx è il numero apparente di siti di legame per vescicola; Kd è la costante di dissociazione apparente.
6. Conversione dell'intensità di fluorescenza nel numero medio di siti di legame
- Preparare perline calibrate.
- Incubare piastrine filtrate in gel (vedere fase 3.3) con A23187 (10 μM) in presenza di CaCl2 (2,5 mM) per 10 minuti a temperatura ambiente.
- Aggiungere alle piastrine attivate le varie concentrazioni di fX-fd (da 0 a 1.000 nM). Aggiungere il 2% di formaldeide v/v e incubare per 1 ora. Interrompere la reazione incubando le piastrine con glicina 3 M e BSA al 5% per 30 minuti a temperatura ambiente.
- Purificare la miscela dal colorante non reagito. Centrifugare le piastrine per 5 minuti a 400 × g, rimuovere il surnatante e risospese il pellet nel tampone di Tyrode (contenente lo 0,5% di BSA).
NOTA: ripetere il passaggio 6.1.3 tre volte.
- Misurare il livello di fluorescenza delle perle di taratura in ciascun campione prima utilizzando uno spettrofluorometro (per colorante fluorescente dalla Tavola dei Materiali, eccitazione 633 nm, emissione 670 nm) e poi utilizzando il citometro a flusso (nel canale FL4: eccitazione 633 nm, filtro di emissione 660/20). Utilizzando un contatore di celle, determinare il numero di perline in ciascun campione.
- Convertire l'intensità di fluorescenza di ciascun rispettivo campione di perline nella concentrazione di colorante fluorescente solubile utilizzando uno spettrofluorometro. Ricalcolare la concentrazione di colorante fluorescente per il numero di molecole fluorofore utilizzando Eq (8).
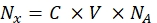 (8)
(8)
Dove Nx è il numero di molecole fluorofore; C è la concentrazione di colorante fluorescente; NA è la costante di Avogadro; NA = 6,02214076×1023 mol -1. - Creare un grafico di dipendenza della fluorescenza media delle perline in un citometro a flusso (passo 6.2) sul numero di molecole di fluoroforo (vedi passo 6.3) per ciascun campione utilizzando qualsiasi software statistico (vedi la Tabella dei materiali). Approssimare questa dipendenza in base alla proporzionalità di linea (Analisi | Raccordo | Adatta lineare). Dall'approssimazione in Eq (9), calcolare il fattore di conversione della fluorescenza media ai siti di legame.
 (9)
(9)
Dove MF è la fluorescenza media delle perline mediante citometria a flusso; Nx è il numero di molecole di fluoroforo per tallone; CF rappresenta il fattore di conversione della fluorescenza media in siti di legame. CF e b sono ottenuti dai risultati del montaggio del grafico per proporzionalità lineare. - Calcolare il numero apparente di siti di legame per vescicola di interesse utilizzando Eq (10).
 (10)
(10)
dove nx è il numero apparente di siti di legame per vescicola di interesse; MF è la fluorescenza media delle vescicole di interesse mediante citometria a flusso; CF e b sono fattori di conversione dell'Eq (8).
Risultati
Il metodo di citometria a flusso qui descritto viene utilizzato per caratterizzare il legame delle proteine della coagulazione plasmatica alle piastrine attivate. Inoltre, le vescicole di fosfolipidi PS:PC 20:80 sono state applicate come sistema modello. Questo documento si concentra principalmente sulle vescicole fosfolipidiche artificiali come esempio. I parametri del citometro, in particolare la tensione del tubo fotomoltiplicatore (PMT) e la compensazione devono essere selezionati per ogni dispositivo specifico, l'oggetto di studio (cellule, microvescicole artificiali o naturali) e i coloranti utilizzati. La Figura 1B,C mostra un esempio di vescicole fosfolipidiche artificiali che hanno una dimensione di ~ 1 μm con il colorante fluorescente lipofilo incorporato DiIC16 (3). Le grandi dimensioni delle vescicole e il colorante fluorescente lipofilo hanno aiutato a rilevare le vescicole usando un citometro. Il gate è stato impostato sulla base di un campione contenente le vescicole lipidiche artificiali della stessa dimensione ma senza il colorante fluorescente (Figura 1B). Solo gli eventi all'interno di questo cancello sono stati utilizzati nell'analisi.
La cinetica del legame proteico alle vescicole è stata analizzata nella prima fase. Il campione per questo è stato raccolto continuamente come descritto nel passaggio 4.1. Un tipico dot-plot è mostrato nella Figura 1D-F. I dati ottenuti sono stati analizzati utilizzando il software di citometria a flusso. La curva risultante è mostrata nella Figura 1G. Le linee solide mostrano le curve di approssimazione, da cui sono state ottenute le costanti cinetiche di associazione (kon) e dissociazione (koff). Poiché il fattore X si lega alle vescicole fosfolipidiche in modo reversibile e Ca2+ dipendente, i campioni con EDTA controllavano la specificità e la reversibilità di questo legame. Le costanti risultanti sono mostrate nella Tabella 1.
Sulla base della cinetica del legame, è stato scelto un tempo di 20 minuti per ulteriori esperimenti di equilibrio per descrivere accuratamente la saturazione nel legame. L'intensità media di fluorescenza del fattore è stata successivamente determinata nella regione delle vescicole. Ogni campione è stato analizzato in presenza e assenza di EDTA. L'intensità di fluorescenza in presenza di EDTA è stata presa come sfondo e sottratta dal segnale totale in quanto il legame di fX alla membrana in assenza di ioni Ca2+ è considerato non specifico. La fluorescenza risultante è stata convertita nel numero di siti di legame per vescicola utilizzando le perle di calibrazione.

Figura 1: Legame specifico di fX alle vescicole artificiali di fosfolipidi. (A) Schema di esperimento. (B, C) Tipici dot plot di vescicole fosfolipidiche senza (B) o con (C) colorante fluorescente lipofilo DiIC16 (3). (D-F) Tipici dot plot dell'interazione del fattore X con vescicole fosfolipidiche prima (D) o dopo (E) diluizione 20 volte e in presenza di EDTA (F). (G) Cinetica del legame e della dissociazione fx (250 nM) alle vescicole fosfolipidiche. (H) Interazione di equilibrio del fattore X con le vescicole fosfolipidiche. I risultati sono i mezzi ±SD per n = 3 campioni diversi. Abbreviazioni: FX = Fattore X; Vescicole Ph = vescicole fosfolipidiche; SSC = dispersione laterale; a.u. = unità arbitraria). Fare clic qui per visualizzare una versione più grande di questa figura.
| Apparente Kd ± SEM (nM) | ksu ± SEM (μM-1 s-1) | Koff ± SEM (s-1) | Numero apparente di siti di legame per vescicola ± SEM |
| 400 ± 80 | 0,371 ± 0,012 | 0,019 ± 0,004 | 8.000 ± 800 |
Tabella 1: Parametri di interazione fX con vescicole fosfolipidiche artificiali. I parametri sono stati determinati dalle curve (vedi Figura 1F,G). I risultati sono la media ± SEM per n = 3.
Discussione
Il metodo proposto può essere adattato per una caratterizzazione approssimativa dell'interazione delle proteine con membrane fosfolipidiche provenienti da varie fonti e composizioni. La citometria quantitativa a flusso qui descritta concede alla risonanza plasmonica di superficie (SPR) in diversi parametri. In particolare, ha una sensibilità e una risoluzione temporale inferiori e richiede l'etichettatura fluorescente delle proteine. L'etichettatura fluorescente può portare a un cambiamento nella conformazione e alla perdita di attività per molte proteine e quindi richiede un attento controllo. Tuttavia, questa tecnica ha vantaggi significativi rispetto ad altre. Questo metodo offre l'opportunità di esplorare l'interazione delle proteine con la membrana cellulare nativa, che non è prontamente implementata utilizzando SPR. Inoltre, l'approccio consente la stima del numero di siti di legame proteico sulla superficie della membrana e può essere efficiente per alcune attività di analisi.
Perline disponibili in commercio sono disponibili per alcuni coloranti fluorescenti per contare i siti di legame. Tuttavia, non ci sono tali perline per molti coloranti ampiamente usati. Quindi, le perle fatte da sé sono il modo migliore per risolvere questo problema. Le stesse cellule sono state utilizzate per preparare queste perle come per tutti gli altri esperimenti. Tuttavia, poiché le perline richiedono elevate velocità di centrifugazione durante il lavaggio, le vescicole fosfolipidiche non possono essere utilizzate. Tuttavia, le cellule o le vescicole possono essere sostituite con perline con gruppi amino-reattivi, che possono essere coniugati al colorante scelto. La sequenza di azioni sarà simile a quelle descritte nel passaggio 6.1.
I limiti di questo metodo quantitativo di citometria a flusso sono legati alle capacità tecniche del citometro utilizzato. Tre diversi modelli di citometri a flusso (con laser variabili, rivelatori, pompe) sono stati applicati per riprodurre questa tecnica senza alcuna complicazione. Tuttavia, la scelta di un'etichetta fluorescente adatta al citometro utilizzato deve essere attentamente considerata perché l'insieme di laser, rivelatori e filtri ottici differisce da dispositivo a dispositivo, anche all'interno dello stesso modello. È necessario concentrarsi sulla capacità del citometro di misurare microparticelle di un diametro specifico; non tutti gli strumenti sono ugualmente in grado di rilevare particelle a risoluzioni inferiori a 200 nm (per determinarlo, utilizzare le perle di calibrazione a dimensione fissa fornite dal produttore dello strumento). Inoltre, alcuni citometri a flusso, che vengono campionati utilizzando una pompa a siringa, non possono misurare in linea di principio la cinetica di legame continuo. In questo caso, la cinetica può essere registrata solo punto per punto, prelevando campioni separati per la misurazione in determinati punti nel tempo 4,6.
La citometria a flusso viene utilizzata per studiare l'espressione di antigeni su varie cellule: la presenza / assenza di un antigene e la percentuale di popolazioni cellulari che esprimono e non esprimono questo antigene. La capacità della citometria a flusso di discriminare contemporaneamente ligandi liberi e legati senza ulteriori procedure di separazione offre anche l'opportunità di una valutazione quantitativa delle dinamiche leganti. Il metodo qui proposto descrive la preparazione di perle di calibrazione autoprodotte per quantificare il legame di un ligando fluorescente alle vescicole fosfolipidiche artificiali. Questo approccio non limita la scelta dei fluorofori disponibili in commercio. Oltre a ciò, la tecnica qui descritta per l'acquisizione e l'analisi dei dati cinetici consente una migliore risoluzione temporale. Pertanto, il metodo qui descritto può essere utilizzato da solo come primo passo nella caratterizzazione delle interazioni proteina-membrana o in combinazione con altri metodi (ad esempio, SPR o microscopia) per migliorare l'accuratezza della misurazione.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Gli autori sono stati supportati da una sovvenzione della Russian Science Foundation 20-74-00133.
Materiali
| Name | Company | Catalog Number | Comments |
| A23187 | Sigma Aldrich | C7522-10MG | |
| Alexa Fluor 647 NHS Ester (Succinimidyl Ester) | Thermo Fisher Scientific | A37573 | fluorescent dye |
| Apyrase from potatoes | Sigma Aldrich | A2230 | |
| BD FACSCantoII | BD Bioscience | ||
| bovine serum albumin | VWR Life Science AMRESCO | Am-O332-0.1 | |
| Calcium chloride, anhydrous, powder, ≥97% | Sigma Aldrich | C4901-100G | |
| Cary Eclipse Fluorescence Spectrometer | Agilent | ||
| D-(+)-Glucose | Sigma Aldrich | G7528-1KG | |
| DiIC16(3) (1,1'-Dihexadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Thermo Fisher Scientific | D384 | |
| DMSO | Sigma Aldrich | D8418 | |
| EDTA disodium salt | VWR Life Science AMRESCO | Am-O105B-0.1 | |
| FACSDiva | BD Bioscience | cytometry data acquisition software | |
| FlowJo | Tree Star | cytometer software for data analysis | |
| HEPES | Sigma Aldrich | H4034-500G | |
| Human Factor X | Enzyme research | HFX 1010 | |
| Hydroxylamine hydrochloride | Panreac | 141914.1209 | |
| L-α-phosphatidylcholine (Brain, Porcine) | Avanti Polar Lipids | 840053P | |
| L-α-phosphatidylserine (Brain, Porcine) (sodium salt) | Avanti Polar Lipids | 840032P | |
| Magnesium chloride | Sigma Aldrich | M8266-100G | |
| Mini-Extruder | Avanti Polar Lipids | 610020-1EA | |
| OriginPro 8 SR4 v8.0951 | OriginLab Corporation | Statistical software | |
| Phosphate Buffered Saline (PBS) Tablets, Biotechnology Grade | VWR Life Science AMRESCO | 97062-732 | |
| Potassium chloride | Sigma Aldrich | P9541-500G | |
| Prostaglandin E1 | Cayman Chemical | 13010 | |
| Sephadex G25 | GE Healthcare | GE17-0033-01 | gel filtration medium for protein purification |
| Sepharose CL-2B | Sigma Aldrich | CL2B300-500ML | gel filtration medium for platelet purification |
| Sodium bicarbonate | Corning | 61-065-RO | |
| Sodium chloride | Sigma Aldrich | S3014-500G | |
| Sodium phosphate monobasic | Sigma Aldrich | S3139-250G | |
| Spin collumns with membrane 0.2 µm | Sartorius | VS0171 | |
| Trisodium citrate dihydrate | Sigma Aldrich | S1804-1KG |
Riferimenti
- Hoffman, M., Monroe, D. M. A cell-based model of hemostasis. Thrombosis and haemostasis. 85 (6), 958-965 (2001).
- Roberts, H. R., Hoffman, M., Monroe, D. M. A cell-based model of thrombin generation. Seminars in Thrombosis and Hemostasis. 32, Suppl 1 32-38 (2006).
- Panteleev, M. A., Dashkevich, N. M., Ataullakhanov, F. I. Hemostasis and thrombosis beyond biochemistry: roles of geometry, flow and diffusion. Thrombosis Research. 136 (4), 699-711 (2015).
- Podoplelova, N. A., et al. Hysteresis-like binding of coagulation factors X/Xa to procoagulant activated platelets and phospholipids results from multistep association and membrane-dependent multimerization. Biochimica et Biophysica Acta. 1858 (6), 1216-1227 (2016).
- Panteleev, M. A., Ananyeva, N. M., Greco, N. J., Ataullakhanov, F. I., Saenko, E. L. Two subpopulations of thrombin-activated platelets differ in their binding of the components of the intrinsic factor X-activating complex. Journal of Thrombosis and Haemostasis. 3 (11), 2545-2553 (2005).
- Kotova, Y., et al. Binding of coagulation factor XIII zymogen to activated platelet subpopulations: roles of integrin αIIbβ3 and fibrinogen. Thrombosis and Haemostasis. 119 (6), 906-915 (2019).
- Fay, S. P., Posner, R. G., Swann, W. N., Sklar, L. A. Real-time analysis of the assembly of ligand, receptor, and G protein by quantitative fluorescence flow cytometry. Biochemistry. 30 (20), 5066-5075 (2002).
- Nolan, J. P., Shen, B., Park, M. S., Sklar, L. A. Kinetic analysis of human flap endonuclease-1 by flow cytometry. Biochemistry. 35 (36), 11668-11676 (1996).
- Sarvazyan, N. A., Lim, W. K., Neubig, R. R. Fluorescence analysis of receptor−G protein interactions in cell membranes. Biochemistry. 41 (42), 12858-12867 (2002).
- Sarvazyan, N. A., Neubig, R. R. Analysis of molecular assemblies by flow cytometry: determinants of Gi1 and by binding. Advances in Optical Biophysics. 3256, 122-131 (1998).
- De Franceschi, N., et al. ProLIF - Quantitative integrin protein-protein interactions and synergistic membrane effects on proteoliposomes. Journal of Cell Science. 132 (4), (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon