Method Article
Анализ объема лимфатических узлов с помощью ультравысокочастотной ультразвуковой визуализации в генно-инженерной мышиной модели меланомы Braf/Pten
В этой статье
Резюме
Меланома – очень агрессивное заболевание, которое быстро распространяется на другие органы. Этот протокол описывает применение ультравысокочастотной ультразвуковой визуализации в сочетании с 3D-рендерингом для мониторинга объема паховых лимфатических узлов в мышиной модели метастатической меланомы Брафа / Птена.
Аннотация
Tyr::CreER+,BrafCA/+,Ptenlox/lox генетически модифицированные мыши (мыши Braf/Pten) широко используются в качестве модели in vivo метастатической меланомы. После того, как первичная опухоль была индуцирована лечением тамоксифеном, увеличение метастатической нагрузки наблюдается в течение 4-6 недель после индукции. В этой статье показано, как ультравысокочастотная ультразвуковая (UHFUS) визуализация может быть использована для мониторинга увеличения метастатического поражения паховых лимфатических узлов путем измерения увеличения их объема.
Система UHFUS используется для сканирования обезболенных мышей с помощью линейного зонда UHFUS (22-55 МГц, осевое разрешение 40 мкм). Изображения B-режима из паховых лимфатических узлов (как с левой, так и с правой стороны) получаются в виде с короткой осью, позиционируя животных в дорсальной лежачем положении. Ультразвуковые записи приобретаются с использованием шага размером 44 мкм на моторизованной механической руке. После этого двухмерные (2D) B-режимы импортируются в программную платформу для постобработки ультразвуковых изображений, а паховые лимфатические узлы идентифицируются и сегментируются полуавтоматически в полученных поперечных 2D-изображениях. Наконец, автоматически получается полная реконструкция трехмерного (3D) объема вместе с визуализацией объема лимфатического узла, что также выражается в виде абсолютного измерения.
Этот неинвазивный метод in vivo очень хорошо переносится и позволяет планировать несколько сеансов визуализации на одном и том же экспериментальном животном в течение 2 недель. Поэтому идеально оценивать влияние фармакологического лечения на метастатическое заболевание.
Введение
Меланома является агрессивной формой рака кожи, которая часто распространяется на другие участки кожи (подкожные метастазы), а также на лимфатические узлы, легкие, печень, мозг и кости1. В последнее десятилетие в клиническую практику были введены новые препараты, которые способствовали улучшению продолжительности жизни пациентов с метастатической меланомой. Тем не менее, ограничения остаются, включая переменное время и степень реакции, серьезные побочные эффекты и рост приобретенной резистентности1. Поэтому крайне важно обнаружить метастатическое распространение на ранних стадиях, т. е. когда оно попадает в местные лимфатические узлы.
Биопсия местных лимфатических узлов (сторожевых лимфатических узлов) обычно проводится для проверки наличия клеток меланомы. Тем не менее, ультразвуковая визуализация закрепляется как неинвазивный метод обнаружения метастатического поражения, поскольку она превосходит клиническую оценку и может помочь избежать ненужной биопсии2,3,4. Кроме того, ультразвуковая визуализация представляется подходящей для наблюдения за лимфатическими узлами, особенно в случае пожилого возраста и / или сопутствующих заболеваний5,6. Признаки, которые выявляются ультразвуковым анализом и позволяют дифференцировать нормальные и метастатические лимфатические узлы, включают увеличение размера (объема), изменение формы от овала до круглого, неправильное краевое, измененный эхогенный рисунок и измененную (повышенную) васкуляризацию7.
Tyr::CreER+,BrafCA/+,Ptenlox/lox генетически модифицированные мыши (мыши Braf/Pten) недавно стали доступны научному сообществу в качестве тканеспецифической и индуцируемой модели метастатической меланомы8. В этой животной модели первичные опухоли развиваются очень быстро: они становятся видимыми в течение 2-3 недель после индукции перехода с брафа дикого типа (wt) на BrafV600E и потери Pten, при этом они достигают объема 50-100 мм3 в течение 4 недель. В последующие 2 недели рост первичной опухоли сопровождается прогрессирующим увеличением метастатической нагрузки на другие участки кожи, лимфатические узлы, легкие.
Мыши Braf/Pten широко использовались для различных целей, включая рассечение сигнальных путей, участвующих в меланомагенезе9,10, идентификацию клеток меланомы происхождения11,12,13 и тестирование новых терапевтических вариантов с точки зрения как таргетной терапии, так и иммунотерапии8,14,15,16 . В частности, мы использовали мышей Braf / Pten, чтобы продемонстрировать, что ослабленный Listeria monocytogenes (Lmat) работает как вакцина против меланомы. При систематическом введении в терапевтических условиях Lmat не связан с общей токсичностью, поскольку он избирательно накапливается в опухолевых участках. Кроме того, это вызывает заметное снижение массы первичной меланомы и снижение метастатической нагрузки в лимфатических узлах и легких. На молекулярном уровне Lmat вызывает апоптотическое уничтожение клеток меланомы, что обусловлено, по крайней мере частично, неэлементно-автономной деятельностью (рекрутирование на месте CD4+ и CD8+ Т-лимфоцитов)16.
Когда мыши Braf / Pten используются для моделирования меланомы, рост первичных опухолей и подкожных метастазов может контролироваться с помощью измерений суппорта. Тем не менее, вовлечение лимфатических узлов и легких должно быть исследовано с использованием альтернативной техники, возможно, неинвазивной, которая позволяет исследователям следить за одним и тем же животным с течением времени. В данной работе описано использование ультразвуковой визуализации (рисунок 1) в сочетании с последующим 3D объемным анализом полученных данных, для продольного мониторинга увеличения размеров (объема) паховых лимфатических узлов.
протокол
Все методы, описанные здесь, были одобрены Министерством здравоохранения Италии (протоколы для животных #754/2015-PR и #684/2018-PR).
1. Индукция меланомы
ПРИМЕЧАНИЕ: В этом исследовании использовались шестинедельные мыши Tyr::CreER+,BrafCA/+,Ptenlox/lox [B6.Cg-Braftm1Mmcm Ptentm1Hwu Tg(Tyr-cre/ERT2)13Bos/BosJ (Braf/Pten)] (см. Таблицу материалов).
- Обрабатывайте мышей 4-гидрокситамоксифеном (4-HT), нанося 3 мкл 5 мМ 4-HT на ~1 см2 бритой кожи верхней части спины, как описано ранее11,16,17, в течение 3 дней подряд.
ПРИМЕЧАНИЕ: Это активирует фермент Cre и вызовет переключение с wt Braf на BrafV600E и потерю Pten. Этих двух попаданий достаточно, чтобы вызвать образование меланомы. - Наблюдают, что первичные опухоли развиваются в месте окрашивания кожи через 2-3 недели и достигают объема 50-100 мм3 через 4 недели. Кроме того, наблюдайте метастазы в другие участки кожи, лимфатические узлы и легкие в этот момент времени (t0).
- Используйте суппорты для измерения объема первичной опухоли и подкожных метастазов, а ультразвуковую визуализацию для измерения объема паховых лимфатических узлов. Повторяют эти измерения через одну неделю (t1, 5 недель после покраски кожи) и через две недели (t2, 6 недель после окрашивания кожи).
- В последний момент времени усыпляют мышей путем передозировки газообразным севораном.
- Анализируют первичную опухоль и лимфатические узлы путем визуального осмотра, затем иссекают их для гистологических исследований, о чем сообщается в 16.
2. Процедура визуализации
- Поместите мышь в индукционную камеру для газовой анестезии и подайте 3% изофлурана в чистый кислород до тех пор, пока животное не будет полностью обезболено. Проверьте глубину анестезии по отсутствию реакции на ущемление лапы.
- Переведите животное на подогреваемую доску - составную часть станции визуализации UHFUS - удерживая животное в лежачем положении. Используйте ректальный зонд, смазанный вазелином, для измерения температуры тела. Отрегулируйте температуру доски, чтобы поддерживать температуру тела мыши в физиологическом диапазоне (36 ± 1°C).
- Смочите глаза мыши ветеринарной мазью, чтобы предотвратить сухость во время анестезии. Подайте наркотический газ (1,5% изофлурана в чистом кислороде) через маску носа мыши. Отрегулируйте процентное содержание изофлурана для поддержания правильной глубины анестезии.
- Покройте передние и задние лапы проводящей пастой и приклейте их к электродам пластины ЭКГ, встроенным в доску. Убедитесь, что физиологические параметры (частота сердечных сокращений, сигнал дыхания и температура тела ядра) правильно получены и отображены.
- Удалите волосы с обеих паховых областей, нанеся средство для депиляции и покрывайте их акустической связующей средой.
- Зажмите линейный зонд UHFUS (центральная частота 40 МГц) в специализированный 3D-двигатель, встроенный в станцию визуализации UHFUS, что позволит автоматизировать и ступенчато перемещать зонд.
- Правильно сориентируйте и отрегулируйте положение ультразвукового зонда для получения короткоосевых изображений пахового лимфатического узла (слева / справа) и поместите интересующую область в фокальную зону.
- Сканируйте весь объем пахового лимфатического узла в виде последовательности 2D B-режимных изображений, как описано ранее18. Получение изображений на нескольких уровнях лимфатического узла путем линейного движения датчика с размерами шагов в микрометровом масштабе для получения 3D-данных с точки зрения автоматических циркулей дыхания и сердца.
- Установите запись изображения со следующими параметрами: расстояние сканирования в диапазоне от 2 до 5 мм (в зависимости от размера лимфатических узлов); размер шага 44 мкм, с результатом 46-114 шагов сканирования / срезов лимфатических узлов и временем сбора 1-3 мин на животное. Цифровое хранение полученных изображений в необработанном формате (DICOM) для дальнейшего автономного анализа.
- В конце сеанса визуализации прекратите газовую анестезию и позвольте животному восстановиться на нагревательной доске в грудинном лежачем положении. Заботьтесь о животном до тех пор, пока оно не придет в достаточное сознание, чтобы сохранить положение лежа.
3. Постобработка ультразвуковых изображений
- Откройте набор данных DICOM 3D изображений левого/правого пахового лимфатического узла в программной платформе для постобработки ультразвукового изображения.
- Сегментация:
- Выберите «Многосрезовый метод», чтобы визуализировать как текущие кадры, так и миниатюры всех кадров, соответствующих каждому изображению, снятому во время 3D-съемки.
- Выберите эскиз первого кадра, чтобы загрузить его в контурное представление. В контурном виде щелкните левой кнопкой мыши, чтобы сбросить точки вдоль границы лимфатического узла. После установки нужного количества точек (диапазон 10-15) щелкните правой кнопкой мыши, чтобы завершить контур.
- После завершения первого контура используйте представление эскизов, чтобы выбрать следующее изображение для контурирования. При необходимости пропустите несколько изображений (в среднем 3 кадра) между контурами, чтобы уменьшить количество ручных трассировок, необходимых для каждого 3D-тома.
ПРИМЕЧАНИЕ: Программная платформа для постобработки ультразвукового изображения будет автоматически генерировать контуры между ручными следами, тем самым сокращая время анализа. - Повторяйте этот процесс до тех пор, пока не будет выделен весь том. После завершения нажмите кнопку Готово.
- Генерация 3D каркаса и измерения объема:
- Находясь в рабочем пространстве окна 3D-режима , щелкните значок измерения громкости под областью отображения изображения, чтобы активировать вид поверхности.
ПРИМЕЧАНИЕ: Представление поверхности создает представление компиляции, которое сопоставляет созданный пользователем том с полученным изображением. Вид поверхности можно повернуть в любое желаемое положение. - Обратите внимание на измерение объема, указанное в левом нижнем углу представления куба.
ПРИМЕЧАНИЕ: Сегментация и генерация 3D-объемов также могут быть получены с использованием специально разработанного программного обеспечения и/или свободно доступного/коммерческого программного обеспечения для общей обработки изображений. Начиная с ручной сегментации, программное обеспечение должно предоставлять математическое и/или пиксельное описание контуров лимфатических узлов. Эти контуры будут объединены в 3D-пространстве для визуализации внешней поверхности лимфатических узлов. Все этапы, описанные в процедуре визуализации и последующей обработки ультразвуковых изображений, обобщены на рисунке 2.
- Находясь в рабочем пространстве окна 3D-режима , щелкните значок измерения громкости под областью отображения изображения, чтобы активировать вид поверхности.
Результаты
После окраски кожи Мышей Tyr::CreER+,BrafCA/+,Ptenlox/lox с 4-HT индуцируется активность Cre, из-за чего происходит переключение на геномном уровне с wt Braf на BrafV600E, при этом Pten теряется (рисунок 3A). Через 2-3 недели у мышей развиваются первичные опухоли на месте со 100% пенетрантностью. Через четыре недели после лечения 4-НТ (t0) первичные опухоли достигают объема 50-100 мм3, а их рост можно измерить суппортами в течение дополнительных 2 недель ((t1 и t2; Рисунок 3B, верхние панели). Более поздние временные точки не могут быть достигнуты, потому что опухоль становится настолько большой, что мышам требуется эвтаназия.
Что касается метастатической нагрузки, то постепенное увеличение пигментации наблюдается в паховых лимфатических узлах в течение 4-6 недель после лечения 4-НТ (рисунок 3В, нижние панели). Такое увеличение пигментации обусловлено наличием отложений меланина, что может быть подтверждено окрашиванием гематоксилином и эозином, выполненным без удаления меланина. В свою очередь, отложения меланина неизменно обусловлены наличием метастазированных клеток меланомы, что подтверждается иммуногистохимическим (IHC) окрашиванием антигена меланомы MLANA и BRAFV600E (рисунок 3C).
Накопление пигментированных клеток меланомы внутри паховых лимфатических узлов сопровождается прогрессирующим увеличением их объема, о чем свидетельствует визуальный осмотр (рис. 3В, нижние панели). Ультразвуковая визуализация дает уникальную возможность количественно оценить такое увеличение продольно, у каждой экспериментальной мыши, как описано ранее16. Объемные измерения, результаты сегментации и 3D-рендеринг, относящиеся к репрезентативному случаю, показаны на рисунке 4. Объем каждого лимфатического узла получается путем ручной сегментации осевых срезов, полученных в ходе 3D-сканирования.
В конце фазы сегментации все участки показывают наложение внешнего контура лимфатического узла (рисунок 4А). Эти контуры соединяются кадр за кадром в фазе рендеринга, а внешняя поверхность всего лимфатического узла проецируется в 3D-пространстве. В качестве репрезентативного примера 3D-рендеринг правого пахового лимфатического узла, проанализированного при t0, t1 и t2 , показан на рисунке 4B, рисунке 4C и рисунке 4D соответственно. График на рисунке 4E количественно определяет увеличение объема, отображаемого левым и правым паховыми лимфатическими узлами одного и того же животного с течением времени.

Рисунок 1: Система ультразвуковой визуализации, используемая для мониторинга увеличения объема паховых лимфатических узлов в генно-инженерной мышиной модели меланомы Braf/Pten. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Пошаговое резюме процедуры визуализации и последующей обработки ультразвуковых изображений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Визуальный осмотр и гистологический анализ паховых лимфатических узлов в тканеспецифической и индуцируемой модели метастатической меланомы Braf/Pten у мышей. (A) Фермент Cre вызывает переключение wt Braf в BrafV600E и потерю Pten (иссечение экзонов 4 и 5). Эта система является меланоцит-специфичной, потому что экспрессия фермента Cre находится под контролем промотора тирозиназы, фермента, участвующего в синтезе меланина. Поэтому два онкогенных попадания ограничены меланоцитарной линией. Эта система также индуцируема, потому что Cre экспрессируется в виде белка слияния с рецептором эстрогена и требует окрашивания кожи 4-HT для перемещения в ядро, где он может выполнять свою функцию. (B) Появление опухолей первичной меланомы (верхние снимки) и паховых лимфатических узлов (нижние снимки) через 4, 5 и 6 недель после лечения 4-НТ (t0, t1 и t2 соответственно). В лимфатических узлах увеличение накопления и размеров меланина выявляется при визуальном осмотре. Шкала полос = 0,5 см (верхние рисунки); 0,2 см (нижние рисунки). (C) Гистологические анализы паховых лимфатических узлов, через 6 недель после лечения 4-НТ. (вверху слева) Окрашивание H&E: отложения меланина удаляются путем инкубации ломтиков с 1% KOH и 3% H2O2. (вверху справа) Обнаружение меланина выполняется окрашиванием H&E без 1% KOH и 3% H2O2. (внизу слева) Обнаружение MLANA путем окрашивания иммунопероксидазой (СУБСТРАТ хромогена DAB и контрокрашивание гематоксилина). (внизу справа) Обнаружение BRAFV600E путем окрашивания иммунопероксидазой (СУБСТРАТ хромогена DAB и контрокрашивание гематоксилина). Для всех панелей оригинальное увеличение: 40x; шкала стержней = 20 мкм. Сокращения: wks = недели; wt = дикий тип; 4-НТ = 4-гидрокситамоксифен; H&E = гематоксилин и эозин; DAB = 3,3'-диаминобензидин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
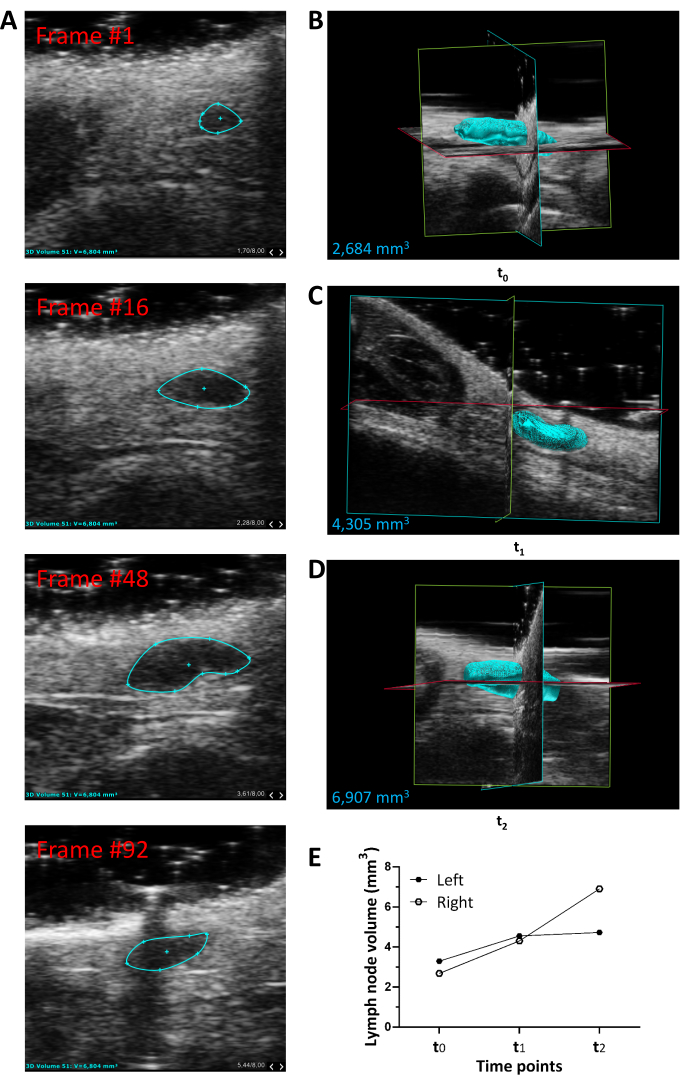
Рисунок 4: Измерения, сегментация и 3D-рендеринг объема паховых лимфатических узлов в тканеспецифической и индуцируемой модели метастатической меланомы Брафа/Птена у мыши. (А) Наложение внешних контуров правого пахового лимфатического узла на 4 репрезентативных сканированных участка, полученных методом ручной сегментации. (Б-Д) Рендеринг 3D-объема правого пахового лимфатического узла, измеренного через 4, 5 и 6 недель после лечения 4-НТ (временные точки t0, t1 и t2 соответственно). Также сообщается числовое значение объема (в мм3). (E) Объем левого (черный круг) и правого (белый круг) пахового лимфатического узла одного и того же животного в точках времени t0, t1 и t2. Сокращения: 3D = трехмерный; 4-HT = 4-гидрокситамоксифен. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Данные, полученные в этом исследовании, свидетельствуют о способности ультразвуковой визуализации контролировать метастатическое вовлечение паховых лимфатических узлов мышиной модели метастатической меланомы Брафа/Птена. Как показано ранее16, данная методика особенно полезна для оценки эффективности медикаментозного лечения. Это связано с тем, что он позволяет контролировать изменение объема лимфатических узлов у одного и того же животного с течением времени, сравнивая измерения, собранные при t1 иt2 , с измерениями, собранными при t0. Это, в свою очередь, способствует повышению достоверности полученных результатов, поскольку учитывается межмышечная изменчивость и другие факторы, которые могут повлиять на размер базальных лимфатических узлов. Кроме того, ультразвуковая визуализация позволяет соблюдать принцип 3R за счет уменьшения количества животных на экспериментальную группу.
У мышей Braf/Pten не только паховые, но и плечевые и подмышечные лимфатические узлы являются местами метастатического распространения. Однако желательно сосредоточиться на паховых лимфатических узлах, поскольку остальные находятся слишком близко к первичному участку опухоли, что обычно изменяет их локализацию и морфологию во время развития самой первичной опухоли. Альтернативно, плечевые и подмышечные лимфатические узлы могут стать пригодными для ультразвуковой визуализации, если выбран другой участок индукции опухоли, такой как уши или лапы8. Что касается других метастатических участков, легкие не могут быть изучены с помощью ультразвуковой визуализации из-за наличия воздуха в ткани. Теоретически, только поверхностные легочные метастазы, достигающие плеврального интерфейса, могут быть визуализированы с помощью этой техники. Хотя вместо этого можно использовать микрокомпьютерную томографию / позитронно-эмиссионную томографию (КТ / ПЭТ), этот подход имеет несколько недостатков, включая высокую стоимость и ограниченную доступность. Кроме того, будучи основанным на ионизирующих излучениях, микро КТ/ПЭТ вряд ли совместима с продольными измерениями в нескольких временных точках. И наоборот, ультразвуковая визуализация может быть легко применена для исследования подкожных метастазов и позволяет измерять как объем, так и васкуляризацию16.
Если 2-недельный период времени слишком короток, чтобы оценить эффекты исследуемого препарата, можно выбрать более периферический индукционный сайт (например, кончик хвоста9,11) или менее склонный к опухолям генотип (Tyr::CreER+,BrafCA/+, Ptenlox/+ мыши вместо Tyr::CreER+, BrafCA/+, Ptenlox/lox mice)9 . В обоих случаях рост первичной опухоли, как ожидается, будет намного медленнее, что позволяет контролировать метастазирование в течение гораздо более 6 недель после индукции с 4-НТ.
С более технической точки зрения важно отметить, что 2D-сегментация ультразвуковых изображений является наиболее важным шагом в этом протоколе, поскольку она может повлиять на измерение 3D-объема. К счастью, в животной модели Брафа / Птена контраст между лимфатическими узлами и окружающими тканями довольно заметен, так что очерчивание границ лимфатических узлов с помощью ручной сегментации относительно просто. Однако процессу сегментации должно способствовать высокое качество ультразвуковых изображений, полученных сонографистом, который, в свою очередь, должен быть очень опытным и сосредоточенным на получении одной и той же ультразвуковой проекции лимфатического узла даже в сеансах сканирования, выполняемых в разные моменты времени.
Ультразвуковая визуализация в B-режиме не может выделять раковые клетки напрямую; вместо этого он позволяет сделать вывод об их наличии из увеличения объема паховых лимфатических узлов. В свете этой информации рекомендуется, чтобы ультразвуковая визуализация сочеталась с соответствующим окрашиванием IHC лимфатических узлов, чтобы наличие раковых клеток могло быть подтверждено на молекулярном уровне. Однако увеличение лимфатических узлов, наблюдаемое у индуцированной мыши Braf/Pten, обычно связано с распространением рака, а не с какой-либо другой причиной, например, продолжающейся инфекцией. Вероятно, это связано с тем, что экспериментальные мыши, используемые для ультразвуковой визуализации, разводятся в контролируемых условиях и регулярно подвергаются санитарному скринингу, так что болезнь быстро обнаруживается и лечится.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить С. Буркьелли (FTGM, Пиза) за ее помощь в процедурах для животных. Эта работа была поддержана ISPRO-Istituto per lo Studio la Prevenzione e la Rete Oncologica институциональное финансирование LP; MFAG #17095 присужден AIRC-Associazione Italiana Ricerca sul Cancro LP.
Материалы
| Name | Company | Catalog Number | Comments |
| 4-hydroxytamoxifen | Merck | H6278 | drug used for tumor induction |
| B6.Cg-Braftm1Mmcm Ptentm1Hwu Tg(Tyr-cre/ERT2)13Bos/BosJ (Braf/Pten) mice | The Jackson Laboratory | 013590 | |
| Blu gel | Sooft Ialia | ophthalmic solution gel | |
| BRAFV600E antibody | Spring Bioscience Corporation | E19290 | |
| IsoFlo (isoflorane) | Zoetis | liquid for gaseous anaesthesia | |
| MLANA antibody | Thermo Fisher Scientific | M2-7C10 | |
| Sigma gel | Parker | electrode gel | |
| Transonic gel clear | Telic SAU | ultrasound gel | |
| Veet | Reckitt Benckiser IT | depilatory cream | |
| Compact Dual Anesthesia System | Fujifilm, Visualsonics Inc. | Isoflurane-based anesthesia system equipped with nose cone and induction chamber | |
| MX550S | Fujifilm, Visualsonics Inc. | UHFUS linear probe | |
| Vevo 3100 | Fujifilm, Visualsonics Inc. | UHFUS system | |
| Vevo Imaging Station | Fujifilm, Visualsonics Inc. | UHFUS imaging station and Advancing Physiological Monitoring Unit endowed with heated board | |
| Vevo Lab | Fujifilm, Visualsonics Inc. | software platform for ultrasound image post-processing |
Ссылки
- Schvartsman, G., et al. Management of metastatic cutaneous melanoma: updates in clinical practice. Therapeutic Advances in Medical Oncology. 11, 1758835919851663(2019).
- Blum, A., et al. Ultrasound examination of regional lymph nodes significantly improves early detection of locoregional metastases during the follow-up of patients with cutaneous melanoma - Results of a prospective study of 1288 patients. Cancer. 88 (11), 2534-2539 (2000).
- Olmedo, D., et al. Use of lymph node ultrasound prior to sentinel lymph node biopsy in 384 patients with melanoma: a cost-effectiveness analysis. Actas Dermo-Sifiliograficas. 108 (10), 931-938 (2017).
- Voit, C., et al. Ultrasound morphology criteria predict metastatic disease of the sentinel nodes in patients with melanoma. Journal of Clinical Oncology. 28 (5), 847-852 (2010).
- Hayes, A. J., et al. Prospective cohort study of ultrasound surveillance of regional lymph nodes in patients with intermediate-risk cutaneous melanoma. British Journal of Surgery. 106 (6), 729-734 (2019).
- Ipenburg, N. A., Thompson, J. F., Uren, R. F., Chung, D., Nieweg, O. E. Focused ultrasound surveillance of lymph nodes following lymphoscintigraphy without sentinel node biopsy: a useful and safe strategy in elderly or frail melanoma patients. Annals of Surgical Oncology. 26 (9), 2855-2863 (2019).
- Jayapal, N., et al. Differentiation between benign and metastatic cervical lymph nodes using ultrasound. Journal of Pharmacy and Bioallied Sciences. 11, Suppl 2 338-346 (2019).
- Dankort, D., et al. Braf(V600E) cooperates with Pten loss to induce metastatic melanoma. Nature Genetics. 41 (5), 544-552 (2009).
- Damsky, W. E., et al. β-catenin signaling controls metastasis in Braf-activated Pten-deficient melanomas. Cancer Cell. 20 (6), 741-754 (2011).
- Xie, X., Koh, J. Y., Price, S., White, E., Mehnert, J. M. Atg7 overcomes senescence and promotes growth of BrafV600E-driven melanoma. Cancer Discovery. 5 (4), 410-423 (2015).
- Kohler, C., et al. Mouse cutaneous melanoma induced by mutant BRaf arises from expansion and dedifferentiation of mature pigmented melanocytes. Cell Stem Cell. 21 (5), 679-693 (2017).
- Yuan, P., et al. Phenformin enhances the therapeutic benefit of BRAF(V600E) inhibition in melanoma. Proceedings of the National Academy of Sciences of the United States of America. 110 (45), 18226-18231 (2013).
- Marsh Durban, V., Deuker, M. M., Bosenberg, M. W., Phillips, W., McMahon, M. Differential AKT dependency displayed by mouse models of BRAFV600E-initiated melanoma. Journal of Clinical Investigation. 123 (12), 5104-5118 (2013).
- Hooijkaas, A. I., Gadiot, J., vander Valk, M., Mooi, W. J., Blank, C. U. Targeting BRAFV600E in an inducible murine model of melanoma. American Journal of Pathology. 181 (3), 785-794 (2012).
- Steinberg, S. M., et al. BRAF inhibition alleviates immune suppression in murine autochthonous melanoma. Cancer Immunology Research. 2 (11), 1044-1050 (2014).
- Vitiello, M., et al. Antitumoral effects of attenuated Listeria monocytogenes in a genetically engineered mouse model of melanoma. Oncogene. 38 (19), 3756-3762 (2019).
- Moon, H., et al. Melanocyte stem cell activation and translocation initiate cutaneous melanoma in response to UV exposure. Cell Stem Cell. 21 (5), 665-678 (2017).
- Zhao, L., Zhan, Y. T., Rutkowski, J. L., Feuerstein, G. Z., Wang, X. K. Correlation between 2-and 3-dimensional assessment of tumor volume and vascular density by ultrasonography in a transgenic mouse model of mammary carcinoma. Journal of Ultrasound in Medicine. 29 (4), 587-595 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены