Method Article
CcCIPK14 Анализ функции генов для выявления эффективной корневой трансгенной системы
* Эти авторы внесли равный вклад
В этой статье
Резюме
В качестве примера мы представляем эффективную и стабильную трансформационную систему для функционального анализа гена CcCIPK14, обеспечивающую техническую основу для изучения метаболизма немодельных растений.
Аннотация
Эффективная и стабильная система трансформации имеет основополагающее значение для изучения функций генов и молекулярной селекции растений. В данной статье мы описываем использование системы трансформации, опосредованной Agrobacterium rhizogenes , на голубином горохе. Стебель заражен A. rhizogenes , несущим бинарный вектор, который индуцировал каллус через 7 дней и придаточные корни через 14 дней. Сгенерированный трансгенный волосатый корень был идентифицирован с помощью морфологического анализа и репортерного гена GFP. Чтобы дополнительно проиллюстрировать область применения этой системы, CcCIPK14 (Calcineurin B-like protein-interintering protein kinases) был преобразован в голубиный горох с использованием этого метода трансформации. Трансгенные растения обрабатывали жасмоновой кислотой (JA) и абсцизионной кислотой (ABA) соответственно с целью проверки того, реагирует ли CcCIPK14 на эти гормоны. Результаты показали, что (1) экзогенные гормоны могут значительно повышать уровеньэкспрессии CcCIPK14, особенно в растениях с сверхэкспрессией (OE) CcCIPK14 ; (2) содержание генистеина в линиях CcCIPK14-OE было значительно выше, чем в контроле; (3) уровень экспрессии двух нижележащих ключевых генов флавоноидсинтазы, CcHIDH1 и CcHIDH2, был повышен в линиях CcCIPK14-OE; и (4) трансгенная система волосистого корня может быть использована для изучения метаболически функциональных генов у немодельных растений.
Введение
Трансформация является основным инструментом оценки экспрессии экзогенных генов 1,2. Многие биологические аспекты ресурсных растений являются общими для всех растений; таким образом, функциональные исследования определенных генов могут быть проведены на модельных растениях (таких как Arabidopsis)3. Тем не менее, многие гены у растений уникальны по своим функциям и паттернам экспрессии, что требует исследований на их собственных или близкородственных видах, особенно для ресурсных растений 3,4. Растительные клетки могут воспринимать различные сигналы, которые позволяют растениям проявлять специфические изменения в экспрессии генов, метаболизме и физиологии в ответ на различные условия стресса окружающей среды 5,6,7. Флавоноиды играют ключевую роль в сигнальном процессе растений, которые реагируют на стрессы окружающей среды 5,8,9. Кроме того, содержание флавоноидов в садовых и лекарственных растениях также является важным показателем для оценки качества10. Идентификация генов, участвующих в регуляции синтеза флавоноидов в ответ на внешние сигналы, имеет решающее значение для понимания механизма синтеза флавоноидов в растениях. Несколько исследований показали, что применение экзогенных гормонов может способствовать накоплению флавоноидов 6,11. Стабильная система трансформации и метод валидации функций генов необходимы для демонстрации функции генов и понимания вторичного метаболизма в растениях.
Агробактериально-опосредованная трансформация широко используется при вставке ДНК 5,8,9. Агробактерия tumefacient может переносить кольцевые гены в хромосомы растительных клеток, а экзогенные фитогормоны индуцируют одну или несколько клеток-хозяев, которые могут регенерировать растения для получения стабильных трансформантов 12,13,14. Методы трансформации, опосредованные тумефациантом, более применимы к видам растений, пригодным для манипуляций in vitro, в то время как большинство многолетних древесных растений ограничивают применение этого метода из-за их трудности регенерации 4,15. A. rhizogenes также способен модифицировать геном клеток-хозяев16. В настоящем исследовании мы разработали эффективную и стабильную процедуру трансформации, опосредованную A. rhizogenes. A. rhizogenes содержит вторую бинарную плазмиду, несущую неестественный ген Т-ДНК в дополнение к плазмиде R. Растение-хозяин заражено, и можно получить сложное растение с трансгенными волосистыми корнями, выходящими из побега дикого типа 16,17. Системы трансформации, опосредованные A. rhizogenes, подходят для применения в исследованиях древесных растений благодаря их быстрой, низкой стоимости и отсутствию необходимости в регенерации растений. Более 160 видов растений успешно индуцируют волосистые корни, и большинство из них относятся к семействам Solanaceae, Compositae, Cruciferae, Convolvulaceae, Umbelliferae, Leguminosae, Caryophyllaceae и Polygonaceae18,19. По сравнению с A. tumefaciens, A. rhizogenes показал более высокую эффективность в опосредованном преобразовании голубиного гороха17,20.
В данном исследовании голубиный горох был использован в качестве примера для представления процесса трансформации, опосредованного A. rhizogenes. От прививки до укоренения эксперименты длились 5 недель. Мы идентифицировали трансформацию придаточного корня через морфологию и репортерный ген GFP, и эффективность трансформации составила до 75%. Кроме того, мы обрабатывали композитную установку JA и ABA, а также обнаруживали транскрипты и вторичные метаболиты с помощью количественной реальной ПЦР и ВЭЖХ (высокоэффективной жидкостной хроматографии). Подтверждено, что уровень экспрессии CcCIPK14 реагирует не только на JA и ABA, но и влияет на биосинтез флавоноидов. Эта система достаточна для изучения функции генов, связанных с вторичным метаболизмом. Также предложен новый подход к изучению немодельных растений при отсутствии достаточной устойчивой системы трансформации 17,21,22.
протокол
ПРИМЕЧАНИЕ: Голубиный горох является диплоидной бобовой культурой, которая принадлежит к семейству Fabaceae. Семена голубиного гороха, использованные в этом эксперименте, получены из Северо-восточного университета лесного хозяйства Китая и имеют код 87119. Основные шаги этого протокола проиллюстрированы на рисунке 1A. Инкубацию рассады проводили в условиях высокой влажности воздуха при температуре 25 °С при люминесцентных лампах со скоростью 50 моль/м-2 с-1 в течение 16-часового фотопериода. Штаммы A. rhizogenes K599 (NCPPB2659) были сохранены в лабораторных условиях. Их хранили в среде дрожжевого маннита (YEP) с 15% глицерина при температуре -80 °C. Протокол, описанный в данной работе, был основан на протоколе Meng et al.21.
ВНИМАНИЕ: Поместите все генетически модифицированные бактерии и растения в соответствующий контейнер для отходов. Используйте все опасные химические вещества в вытяжном шкафу и утилизируйте их в контейнере для опасных отходов.
1. Подготовка рассады голубиного гороха
- Выбирайте пухлые и неповрежденные семена голубиного гороха (рис. 1А), которые хранились менее 1 года.
- Замочите семена в дистиллированной воде на 24 ч (рис. 1В). Переложите набухшие семена в лоток для семян и поместите их в теплицу.
- Семена начинают прорастать через 1-2 дня. Когда эпикотиль достигнет 1,5 см, пересадите рассаду в горшки размером 10 см (диаметр) х 9 см (высота) с землей и песком в соотношении объема 3:1.
ПРИМЕЧАНИЕ: Почва состоит из смеси питательной почвы, вермикулита и перлита в соотношении 2:1:1. - Выращивайте рассаду в теплице.
2. Активация A. rhizogenes
Примечание: Штаммом, используемым для преобразования A. rhizogenes , был K599, сохраненный при -80 °C. Бинарный вектор pROK2 (pBIN438; http://www.biovector.net/product/428388.html) содержит зеленый флуоресцентный белок (GFP) в качестве индикаторного гена и ген устойчивости к канамицину в качестве селективного маркера для трансформации A. rhizogenes.
- Разморозьте A. rhizogenes на льду.
- Опустите бактерии и равномерно выложите их на дрожжевую среду маннита (YEP) с добавлением 8 г/л порошка агара, 25 мг/л рифампицина и 25 мг/л канамицина (YRK, pH 7,0).
- Выдерживать при температуре 28 °C в течение 16 часов.
- Выберите моноклональные колонии. Культивируют их в пробирке объемом 50 мл, содержащей 10 мл среды YEB с добавлением 25 мг/л рифампицина и 25 мг/л канамицина (YRK, pH 7,0). Поместите центрифужную пробирку на встряхивающий инкубатор с радиусом вращения 10 см, при температуре 28 °C и 200 об/мин на 16 часов.
3. Трансформация растений с помощью A. rhizogenes
ПРИМЕЧАНИЕ: Выберите здоровые растения для заражения A. rhizogenes с помощью следующей процедуры инъекции. Результатом этой процедуры является преображение волосатых корней. Для анализа функции гена CcCIPK14 необходим контроль. Растворы A. rhizogenes с пустым вектором или плазмидами CcCIPK14-pROK2 вводили в рассаду для индуцирования волосистых корней.
- Инокулировать A. rhizogenes
- Выбирайте рассаду голубиного гороха с одинаковым статусом роста.
- Слейте воздух из шприца объемом 1 мл и аспирируйте 0,3 мл бактериальной жидкости. Медленно нажимаем на толкатель, чтобы наполнить иглу шприца бактериальной жидкостью21.
- Сначала зафиксируйте стебель рассады голубиного гороха пинцетом, а затем воткните иглу шприца в стебель на 1 см.
- При извлечении шприца полностью погрузите кончик иглы в стебель. Медленно нажмите на толкатель, чтобы откачать бактериальную жидкость из проникающей раны.
ПРИМЕЧАНИЕ: Присоединение остаточной бактериальной жидкости к ране в виде бактериальных капель может улучшить инфекцию и эффективность трансформации.
- Управление рассадой
ПРИМЕЧАНИЕ: Высокая температура и влажность могут повысить эффективность инфекции A. rhizogenes.- Поместите рассаду, инокулированную A. rhizogenes, в поддон (30 см x 60 см x 6 см) с 1 л воды. Используйте прозрачную пластиковую крышку (30 см х 60 см х 30 см) в качестве крышки для поддержания температуры и влажности внутренней среды.
- Периодически удаляйте опавшие листья и хлопьевидные гифы, прикрепленные к кончикам листьев и опавшим листьям.
- Через неделю в ране начинает появляться мозоль. После этого держите пластиковую крышку полуоткрытой.
- Через 4-5 недель большая часть каллусной ткани дифференцировалась в придаточные корни. Снимите пластиковую крышку.
- Добавляйте 1 л воды в поддон каждые 3 дня, чтобы почва оставалась влажной.
ПРИМЕЧАНИЕ: Голубиный горох является засухоустойчивым растением; Слишком много воды может затормозить рост растений.
4. Выявление трансформированных волосистых корней
ПРИМЕЧАНИЕ: Трансформированные волосистые корни могут быть идентифицированы на основе морфологии и генного уровня. Эта процедура в первую очередь направлена на анализ идентификации репортерного гена (GFP).
- Соберите кончики корней волосистого корня и отметьте оставшуюся часть.
- Оцените, есть ли зеленая флуоресценция под конфокальным лазерным сканирующим микроскопом.
- 0,1 г волосистых корней с сильным сигналом флуоресценции измельчить в мелкий порошок в жидком азоте.
- В соответствии с инструкциями производителя набора геномной ДНК растений получить геномную ДНК независимых трансгенных линий голубиного гороха методом модифицированного цетилтриметиламмония бромида (CTAB)23.
- Используйте 500 нг матрицы геномной ДНК и праймеры для ПЦР. Капсюли приведены в таблице 1.
- Выполняют следующий цикл амплификации: предварительную денатурацию при 94 °C в течение 5 мин, денатурацию при 94 °C в течение 30 с, отжиг грунтов при 55 °C в течение 30 с и удлинение праймера при 72 °C в течение 30 с. После 36 циклов и заключительного продления в течение 10 минут при температуре 72 °C проанализируйте усиленные продукты на 1% агарозном геле.
- Окрашивайте гели с помощью окрашивания нуклеиновыми кислотами и визуализируйте их под воздействием ультрафиолета.
5. Лечение экзогенными гормонами
Примечание: Растения с положительным результатом были обработаны экзогенными гормонами для изучения влияния CcCIPK14 на метаболические вещества. Составные растения, индуцированные A. rhizogenes , были разделены на три группы: группа обработки JA, группа обработки ABA и контрольная группа (рис. 3A).
- Уменьшите полив за 3 дня до лечения экзогенными гормонами.
- Приготовьте растворы JA и ABA в концентрации 5 мг/л.
ПРИМЕЧАНИЕ: Порошок JA и ABA сначала растворяют в этиловом спирте, а затем заполняют дистиллированной водой до целевого объема. - С помощью пульверизатора равномерно распылите растворы JA и ABA на листья растений. Обработайте контрольную группу водой.
ПРИМЕЧАНИЕ: На каждый саженец распыляли в среднем 10 мл раствора. - Накрыть пластиковой крышкой сразу после обработки распылением. Поставьте его обратно в теплицу с искусственным климатом.
6. Сбор и сохранение образцов
Примечание: После 3 ч обработки экзогенными гормонами был собран растительный материал из различных групп лечения.
- Удалите рыжевато-коричневые и загрязненные волосатые корни и выберите те, которые имеют белый вид. Соберите эти волосатые корни и обсушите их впитывающей бумагой.
- Собранные с каждого саженца волосистые корни разделите на две части. Положите одну часть в пронумерованную пробирку и оберните ее маркированной фольгой.
- Лиофилизируйте фольгу в жидком азоте, а затем храните всю собранную фольгу при температуре -80 °C для дальнейшего исследования.
Результаты
A. rhizogenes -опосредованное преобразование волосистого корня на голубином горохе
В этом исследовании описаны пошаговые протоколы генетической трансформации волосистых корней при посредничестве A. rhizogenes, которая имеет значение в области растительных молекул. Потребовалось около 5 недель, чтобы получить волосатые корни из корней голубиного гороха, зараженных A. rhizogenes. На рисунке 1А представлен обзор всего процесса трансформации, начиная с инъекции A. rhizogenes и заканчивая получением сложных растений с волосистыми корнями. Пролиферация тканей наблюдалась примерно через 1 неделю после заражения, а ее дифференцировка до придаточных корней наблюдалась примерно через 2 недели, а большое количество волосатых корней было получено через 35 дней (рис. 1B). Этот GFP позволил отличить генетически модифицированные волосистые корни от нетрансгенных волосистых корней с помощью флуоресценции. На рисунке 2 трансформированные волосистые корни с GFP-pROK2 были визуализированы под конфокальным зеленым флуоресцентным белковым каналом. Индукция волосистых корней A. rhizogenes с пустым вектором не показала зеленой флуоресценции (рис. 2А). Сгенерированные придаточные корни были идентифицированы по морфологии и репортерному гену GFP; Результаты подтвердили, что K599 может успешно инфицировать и трансформировать голубиный горох (Рисунок 2). Геномную ДНК растений готовили (метод CTAB) для проведения ПЦР-анализа. GFP присутствовал только в волосистых корнях, индуцированных A. rhizogenes, несущими плазмиду GFP-pROK2; не присутствовали ни нетрансформированные растительные ткани, ни корни, индуцированные A. rhizogenes с пустыми векторами (рис. 2B, C). Эти результаты показали, что бинарный вектор был успешно преобразован в придаточный корневой геном16,21.
Для повышения эффективности трансформации A. rhizogenes протокол был оптимизирован. ЗаражениеA. rhizogenes вызывало аномальный рост нормальных корней и листьев растения-хозяина и даже приводило к гибели. Существует несколько возможных объяснений такого результата. На ранней стадии вегетативного роста спонтанное размножение и трансформация клеток хозяина потребляли большое количество питательных веществ, что, возможно, является основной причиной торможения развития рассады и даже вызывает гибель растений24,25. Кроме того, механические повреждения, вызванные прививкой, могли затронуть и рассаду 24,26,27. Между тем, статус роста рассады определяет эффективность дифференцировки каллюса. Прививку лучше всего проводить, когда сеянцам исполнилось 7 дней и стебли рассады не полностью одревеснели (рисунок 1А). При этом условии эффективность каллуса, опосредованного A. rhizogenes, составила 76%. Результаты этих исследований свидетельствуют о том, что относительная влажность может влиять на размножение каллуса. Пролиферация и дифференцировка пролиферирующих тканей, а также рост придаточных корней должны поддерживать высокую относительную влажность воздуха. Многие корни были созданы в течение 4-5 недель после прививки и начали проникать в почву. Общая эффективность преобразования в этом эксперименте может достигать 72%. Эффективность трансформации (%) = (количество положительных растений / количество зараженных растений) x 100.
Оценка функции гена CcCIPK14 у голубиного гороха с использованием трансгенной волосистой корневой системы
Волосатые корни линий CcCIPK14-OE были получены с использованием вышеупомянутого протокола индукции волосистых корней. Волосатые корни могут прикрепляться к точкам инфекции на стеблях, образуя сложное растение. Поскольку в композитных растениях генетически модифицируются только волосистые корни, они также могут быть использованы для изучения передачи сигнала между корнями и надземной частью. Растворы фитогормонов (JA и ABA) равномерно распыляли на листья сложных растений, а волосистые корни собирали через 3 ч (рис. 3А). Функция CcCIPK14 в трансгенных корнях была верифицирована с помощью анализа экспрессии генов и определения метаболитов. Результаты показали, что уровень экспрессии CcCIPK14 повышался после лечения JA и ABA. Кроме того, были повышены уровни экспрессии двух ключевых ферментов для синтеза генистеина в линии CcCIPK14-OE, CcHIDH1 и CcHIDH2 . По сравнению с контрольной группой содержание генистеина в трансгенных корнях увеличилось до 0,060 мг/г ТС. Мы сравнили фенотипы до и после того, как трансгенные растения были обработаны JA/ABA, и разница в морфологии при сравнении была незначительной (рис. 3B). CcCIPK14, ключевой функциональный ген в метаболическом пути флавоноидов, может реагировать на гормональные сигналы и участвовать в биосинтезе генистеина в голубином горохе.

Рисунок 1: Индукция растения, опосредованного A. rhizogenes . (А) Блок-схема системы трансформации волосистых корней, включая активацию A. rhizogenes, выращивание рассады, инокуляцию агробактерий , управление рассадой и получение сложных растений. Репрезентативное изображение, показывающее ключевые этапы. (Б) Три основные стадии образования придаточных корней в месте инокуляции: появление каллуса, размножение каллуса и дифференцировка. Масштабные линейки составляют 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 2: Анализ трансгенных волосатых корней. (A) Сигнал GFP в трансгенных волосистых корнях с контролем пустого векторного раствора агробактерий . Масштабные линейки представляют собой 50 мкм. (B,C) ПЦР-амплификация генов (GFP) из геномной ДНК, выделенной из корней и стеблей дикого типа, листьев и трансгенных корней сложных растений. CK: Empty Vector #1-4: плазмида (бинарный вектор pROK2, несущий GFP) в качестве положительного контроля. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
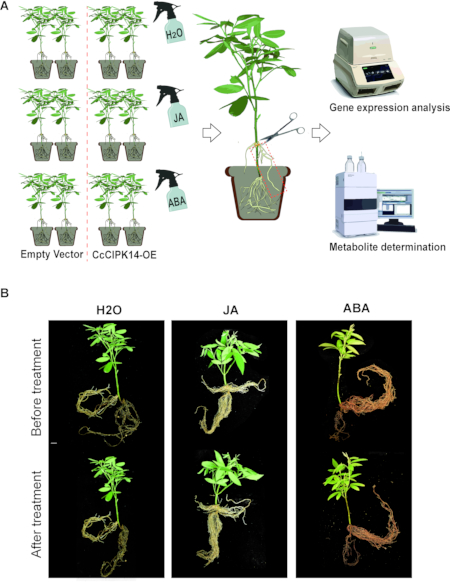
Рисунок 3: Анализ функции CIPK14 методом волосистого корня и гормональной обработкой. (A) Технологическая схема для проверки и анализа функции генов через сложные растения. (B) Фенотипические изменения сложных растений до и после обработки JA, ABA и H2O. Масштабные линейки составляют 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Уровень экспрессии генов и содержание вторичных метаболитов волосистых корней с пустым вектором и плазмидой CcCIPK14-pROK2 (бинарный вектор pROK2 с CcCIPK14). Уровень экспрессии CcCIPK14 (А), содержание вторичных метаболитов в трансгенных волосатых корнях (В) и уровни экспрессии CcHIDH1 и CcHIDH2 в волосатых корнях после гормонального лечения (D). Относительный уровень экспрессии нормализовался по отношению к актиновому контролю. Данные представлены в виде среднего значения ± стандартного отклонения (n = 3)*, что указывает на значимую разницу (P < 0,05) между CcCIPK14-OE и контрольной группой (пустые векторные линии) с использованием t-критерия Стьюдента. (В) Путь биосинтеза генистеина. Фермент катализирует реакцию HIDH, 2-гидроксиизофлаванондегидратазы, CIPK14 (кальциневрин В-подобные белкиназы, взаимодействующие с белками). Лечение одними и теми же буквами существенно не отличалось на основе сравнения среднего по критерию Дункана при p < 0,05. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Букварь | Последовательность (5'-3') |
| CcCIPK14-q-F | GAGACCAACATTGATGTGGAAGC |
| CcCIPK14-q-R | CATTCATTGGTGTGTGTGTGGCTGCTTC |
| CcHIDH1-q-F | GAGGCTGTGCTGGAGTCAAT |
| CcHIDH1-q-R | AGCTCAGCTAATCTGGTGGC |
| CcHIDH2-q-F | AGCCCCTATCTCTGTTGGGT |
| CcHIDH2-q-R | ACTGCTGCAAGTGGCTTACT |
| ГФП-Ф | CCACAAGTTCAGCGTGTCCG |
| GFP-R | AAGTTCACCTTGATGCCGTTC |
Таблица 1: Праймеры, использованные в данном исследовании.
Обсуждение
Быстрая характеристика функции генов является общей целью при изучении большинства видов, и она особенно важна для развития ресурсных растений. Трансформация, опосредованная A. rhizogenes, широко используется в культуре волосистых корней. Культура волосистых корней (HRC), как уникальный источник производства метаболитов, играет ключевую роль в метаболической инженерии18,28. Применение этой технологии в основном ограничивается функцией генов in vivo21. В данной работе мы предлагаем базовый метод изучения функции генов, основанный на предыдущей системе трансформации, опосредованной A. rhizogenes. Этот метод может быть использован для проверки различных функций генов, таких как реакция на стресс окружающей среды и экзогенные гормоны. Линия CcCIPK14-OE показала, что CcCIPK14 может способствовать накоплению метаболитов флавоноидов и реагировать на экзогенные гормоны JA и ABA. CcHIDH1 и CcHIDH2 являются двумя основными генами флавоноидсинтазы, которые были значительно повышены в линии CcCIPK14-OE. Эти результаты указывают на то, что метод может быть использован в качестве эффективного инструмента для оценки функции генов и вторичных метаболитов.
Эффективная система генетической трансформации является предпосылкой для верификации и анализа функции генов29,30. A. rhizogenes — бактерия с естественным эволюционным механизмом31. Он содержит корнеиндуцирующую (Ri) плазмиду, которая содержит гены корневого локуса (rol) в области Т-ДНК, включая rolA, rolB, rolC и rolD, которые могут индуцировать волосистые корни из раневой поверхности эксплантов27,32. Система преобразований, опосредованная A. rhizogenes, имеет много преимуществ33. Во-первых, у большинства видов Ri-трансформированные клетки растения-хозяина могут спонтанно дифференцироваться в корни с нормальным фенотипом33. При использовании дополнительных бинарных векторов для интеграции экзогенной ДНК плазмиды Ri могут обеспечить возможность получения трансформированных волосистых корней без использования экзогенно применяемых растительных гормонов для органогенеза34. Во-вторых, Ri-трансформированные корни генетически стабильны, поскольку предполагается, что эти трансформированные корни развились из одной трансформированной клетки17,33. Более того, эти волосатые корни могут поддерживать прикрепление к ветвям дикого типа, в результате чего образуются сложные растения16,20. Ri-трансформированные корни могут имитировать нормальные корни, предоставляя экспериментальные материалы для верификации ианализа функций генов. Такая система трансформации подходит для растений, которые трудно поддаются регенерации, таких как голубиный горох, который имеет низкую частоту регенерации 36,37. Однако, поскольку трансгенными являются только волосатые корни, функция генов на всем растительном уровне не может быть оценена, а трансгенные признаки также не могут передаваться потомству через половое размножение.
В этой схеме A. rhizogenes, несущие бинарные векторы, могут индуцировать трансгенные волосатые корни с помощью эффективного и стабильного протокола. Основные этапы метода преобразования изложены в виде блок-схемы (рис. 1А). Через 1 неделю после посева A. rhizogenes на ранках стебля наблюдались мозоли. Через 3 недели мозоли дифференцировались в волосистые корни (рис. 1В). Этот метод имеет значение, поскольку он не требует культивирования in vitro , поэтому волосистые корни были получены в течение 5 недель (Рисунок 1). Мэн и др. провели серию подобных экспериментов с использованием этого метода на разных растениях, и результаты показали, что большинство растений могут получить трансгенные корни с целевым геном в течение21 месяца. Голубиный горох, богатый белком сирота, растет в полузасушливых тропических регионах37. Жаркая и влажная среда культивирования влияет на рост голубиного гороха, и может возникнуть лиственный фенотип21; Фенотип можно восстановить, сняв пластиковую крышку.
Во время этих экспериментов необходимо тщательно учитывать множество факторов, чтобы быстро получить преобразованные корни. Состояние здоровья рассады после прививки является ключом к успеху этого эксперимента21. Предыдущие исследования показали, что A. rhizogenes может индуцировать волосистые корни в точке инокуляции на несколькихстадиях роста рассады. Однако состояние роста посевов непосредственно влияет на эффективность трансформации26. Преждевременная инокуляция A. rhizogenes может подавлять рост рассады и даже вызывать гибель рассады39,40. Для получения максимальной эффективности трансформации A. rhizogene обычно прививают на 7-дневную рассаду. Кроме того, влажность воздуха также является основным фактором, влияющим на размножение каллуса. Преждевременное удаление пластика после инокуляции A.rhizogenes может привести к побурению каллюса и отмиранию придаточных корней. В этом исследовании использовались два различных метода подтверждения для идентификации положительных трансгенных корней: ПЦР-амплификация вставленного гена и обнаружение флуоресценции GFP. Результаты тестирования подтвердили успешную конверсию. Эффективность преобразования достигает 75%.
Раскрытие информации
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, описанную в этой статье.
Благодарности
Авторы выражают признательность за финансовую поддержку Национальному фонду естественных наук Китая (31800509, 31922058), Фонду выдающихся молодых талантов Пекинского университета лесного хозяйства» (2019JQ03009), Фондам фундаментальных исследований для центральных университетов (2021ZY16), Пекинскому муниципальному фонду естественных наук (6212023) и Национальной ключевой программе исследований и разработок Китая (2018YFD1000602,2019YFD1000605-1) и Пекинскому передовому инновационному центру селекции деревьев методом молекулярного дизайна. Я хотел бы поблагодарить Чжэнъяна Хоу за его руководство при написании статьи и профессора Мэн Дуна за его руководство по идее статьи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.1 mL qPCR 8-strip tube (with optical caps) | KIRGEN, Shanghai, China | KJ2541 | |
| ABA | Solarbio Life Science, Beijing, China | A8060 | |
| Agar powder | Solarbio Life Science, Beijing, China | A8190 | |
| Centrifuge | Osterode am Harz, Germany | d37520 | |
| CFX Connect TW Optics Module | Bio-rad, US | 1855200 | |
| constant temperature incubator | Shanghai Boxun Industry & Commerce Co., Ltd, Shanghai,China | BPX-82 | |
| Diposable Petri dish | Corning, US | ||
| Dry Bath | Gingko Bioscience Company/Coyote bioscience, China | H2H3-100C | |
| Eastep Total RNA Extraction Kit50 | Promega, Beijing, China | LS1030 | |
| Electronic balance | Tianjin, China | TD50020 | |
| Filter pape | Hangzhou wohua Filter Paper Co., Ltd, China | ||
| FiveEasy Plus | Mettler Toledo, Shanghai, China | 30254105 | |
| Flowerpot 9*9 | China | ||
| JA | Solarbio Life Science, Beijing, China | J8070 | |
| Kan | Solarbio Life Science, Beijing, China | K8020 | |
| MagicSYBR Mixture | CWBIO, Beijing, China | CW3008M | |
| Mini Microcentrifuge | Scilogex, Beijing, China | S1010E | |
| NaCl | Solarbio Life Science, Beijing, China | S8210 | |
| NanPhotometer N50 Touch | IMPLEN GMBH, Germany | T51082 | |
| Purelab untra | |||
| Rifampicin | Solarbio Life Science, Beijing, China | R8010 | |
| Seedling box 30*200 | China | ||
| Thermal Cycler PCR | Bio-rad, US | T100 | |
| Thermostatic oscillator | Beijing donglian Har lnstrument Manufacture Co.,Ltd,China | DLHE-Q200 | |
| Tomy Autoclave | Tomy, Japan | SX-500 | |
| Tryptone | Solarbio Life Science, Beijing, China | LP0042 | |
| UEIris II RT-PCR System for First-Strand cDNA Synthesis( with dsDNase) | US Everbright INC, Jiangsu, China | R2028 | |
| Yeast Extract powder | Solarbio Life Science, Beijing, China | LP0021 |
Ссылки
- Poland, J. A., Rife, T. W. Genotyping-by-sequencing for plant breeding and genetics. The Plant Genome. 5 (3), (2012).
- Barabaschi, D., et al. Next generation breeding. Plant Science. 242, 3-13 (2016).
- Petri, C., Webb, K., Hily, J. -M., Dardick, C., Scorza, R. High transformation efficiency in plum (Prunus domestica L.): a new tool for functional genomics studies in Prunus spp. Molecular Breeding. 22 (4), 581-591 (2008).
- Tang, H., Ren, Z., Reustle, G., Krczal, G. Plant regeneration from leaves of sweet and sour cherry cultivars. Scientia Horticulturae. 93 (3-4), 235-244 (2002).
- Yang, L., et al. Response of plant secondary metabolites to environmental factors. Molecules. 23 (4), 762(2018).
- Ross, J. J., Weston, D. E., Davidson, S. E., Reid, J. B. Plant hormone interactions: how complex are they. Physiologia Plantarum. 141 (4), 299-309 (2011).
- Meng, D., et al. The pigeon pea CcCIPK14-CcCBL1 pair positively modulates drought tolerance by enhancing flavonoid biosynthesis. The Plant Journal. , (2021).
- Wen, W., Alseekh, S., Fernie, A. R. Conservation and diversification of flavonoid metabolism in the plant kingdom. Current Opinion in Plant Biology. 55, 100-108 (2020).
- Shah, A., Smith, D. L. Flavonoids in agriculture: Chemistry and roles in, biotic and abiotic stress responses, and microbial associations. Agronomy. 10 (8), 1209(2020).
- Zhang, W., Jiang, W. UV treatment improved the quality of postharvest fruits and vegetables by inducing resistance. Trends in Food Science & Technology. 92, 71-80 (2019).
- Koyama, R., et al. Exogenous abscisic acid promotes anthocyanin biosynthesis and increased expression of flavonoid synthesis genes in Vitis vinifera× Vitis labrusca table grapes in a subtropical region. Frontiers in Plant Science. 9, 323(2018).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- Veena, V., Taylor, C. G. Agrobacterium rhizogenes: recent developments and promising applications. In Vitro Cellular & Developmental Biology-Plant. 43 (5), 383-403 (2007).
- Lacroix, B., Citovsky, V. Pathways of DNA transfer to plants from Agrobacterium tumefaciens and related bacterial species. Annual Review of Phytopathology. 57, 231-251 (2019).
- Guan, Y., Li, S. -G., Fan, X. -F., Su, Z. -H. Application of somatic embryogenesis in woody plants. Frontiers in Plant Science. 7, 938(2016).
- Alpizar, E., et al. Efficient production of Agrobacterium rhizogenes-transformed roots and composite plants for studying gene expression in coffee roots. Plant Cell Reports. 25 (9), 959-967 (2006).
- Hwang, H. -H., Yu, M., Lai, E. -M. Agrobacterium-mediated plant transformation: biology and applications. The Arabidopsis Book. 15, (2017).
- Srivastava, S., Srivastava, A. K. Hairy root culture for mass-production of high-value secondary metabolites. Critical Reviews in Biotechnology. 27 (1), 29-43 (2007).
- Porter, J. R., Flores, H. Host range and implications of plant infection by Agrobacterium rhizogenes. Critical Reviews in Plant Sciences. 10 (4), 387-421 (1991).
- Fan, Y. -l, et al. One-step generation of composite soybean plants with transgenic roots by Agrobacterium rhizogenes-mediated transformation. BMC Plant Biology. 20, 1-11 (2020).
- Meng, D., et al. Development of an efficient root transgenic system for pigeon pea and its application to other important economically plants. Plant Biotechnology Journal. 17 (9), 1804-1813 (2019).
- Ma, R., et al. Agrobacterium-Mediated genetic transformation of the medicinal plant Veratrum dahuricum. Plants. 9 (2), 191(2020).
- Mi, Y., et al. Inducing hairy roots by Agrobacterium rhizogenes-mediated transformation in tartary buckwheat (Fagopyrum tataricum). Journal of Visualized Experoments: JoVE. (157), (2020).
- Cordovez, V., et al. Plant phenotypic and transcriptional changes induced by volatiles from the fungal root pathogen Rhizoctonia solani. Frontiers in Plant Science. 8, 1262(2017).
- Trovato, M., Mattioli, R., Costantino, P. From A. rhizogenes RolD to plant P5CS: exploiting proline to control plant development. Plants. 7 (4), 108(2018).
- Van Altvorst, A. C., et al. Effects of the introduction of Agrobacterium rhizogenes rol genes on tomato plant and flower development. Plant Science. 83 (1), 77-85 (1992).
- Bahramnejad, B., Naji, M., Bose, R., Jha, S. A critical review on use of Agrobacterium rhizogenes and their associated binary vectors for plant transformation. Biotechnology Advances. 37 (7), 107405(2019).
- Gutierrez-Valdes, N., et al. Hairy root cultures-a versatile tool with multiple applications. Frontiers in Plant Science. 11, (2020).
- Che, P., et al. Developing a flexible, high-efficiency Agrobacterium-mediated sorghum transformation system with broad application. Plant Biotechnology Journal. 16 (7), 1388-1395 (2018).
- Keshavareddy, G., Kumar, A., Ramu, V. S. Methods of plant transformation-a review. International Journal of Current Microbiology and Applied Sciences. 7 (7), 2656-2668 (2018).
- Lacroix, B., Citovsky, V. Beyond Agrobacterium-mediated transformation: horizontal gene transfer from bacteria to eukaryotes. Agrobacterium Biology. , 443-462 (2018).
- Sarkar, S., Ghosh, I., Roychowdhury, D., Jha, S. Biotechnological approaches for medicinal and aromatic plants. , Springer. 27-51 (2018).
- Singh, R. S., et al. Biotechnological Approaches for Medicinal and Aromatic Plants. , Springer. 235-250 (2018).
- Bahramnejad, B., Naji, M., Bose, R., Jha, S. A critical review on use of Agrobacterium rhizogenes and their associated binary vectors for plant transformation. Biotechnology Advances. 37 (7), 107405(2019).
- Meng, D., et al. Development of an efficient root transgenic system for pigeon pea and its application to other important economically plants. Plant Biotechnology Journal. 17 (9), 1804-1813 (2019).
- Surekha, C., et al. Agrobacterium-mediated genetic transformation of pigeon pea (Cajanus cajan (L.) Millsp.) using embryonal segments and development of transgenic plants for resistance against Spodoptera. Plant Science. 169 (6), 1074-1080 (2005).
- Saxena, K. Genetic improvement of pigeon pea-a review. Tropical Plant Biology. 1 (2), 159-178 (2008).
- Hada, A., et al. Improved Agrobacterium tumefaciens-mediated transformation of soybean [Glycine max (L.) Merr.] following optimization of culture conditions and mechanical techniques. In Vitro Cellular & Developmental Biology-Plant. 54 (6), 672-688 (2018).
- Foti, C., Pavli, O. High-efficiency Agrobacterium rhizogenes-mediated transgenic hairy root induction of lens culinaris. Agronomy. 10 (8), 1170(2020).
- Bhattacharya, A., Sood, P., Citovsky, V. The roles of plant phenolics in defence and communication during Agrobacterium and Rhizobium infection. Molecular Plant Pathology. 11 (5), 705-719 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены