Method Article
CcCIPK14 Análisis de la función génica para iluminar el eficiente sistema transgénico de raíces
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí presentamos un sistema de transformación eficiente y estable para el análisis funcional del gen CcCIPK14 como ejemplo, proporcionando una base técnica para estudiar el metabolismo de plantas no modelo.
Resumen
Un sistema de transformación eficiente y estable es fundamental para el estudio de la función génica y la mejora molecular de las plantas. Aquí, describimos el uso de un sistema de transformación mediada por Agrobacterium rhizogenes en gandul. El tallo está infectado con A. rhizogenes portador de un vector binario, que induce callo a los 7 días y raíces adventicias a los 14 días. La raíz pilosa transgénica generada se identificó mediante análisis morfológico y un gen reportero de GFP. Para ilustrar aún más el rango de aplicación de este sistema, CcCIPK14 (proteínas quinasas que interactúan con proteínas similares a la calcineurina B) se transformó en gandul utilizando este método de transformación. Las plantas transgénicas fueron tratadas con ácido jasmónico (JA) y ácido abscísico (ABA), respectivamente, con el fin de probar si CcCIPK14 responde a esas hormonas. Los resultados demostraron que (1) las hormonas exógenas podrían aumentar significativamente el nivelde expresión de CcCIPK14, especialmente en plantas con sobreexpresión (OE) de CcCIPK14 ; (2) el contenido de genisteína en las líneas CcCIPK14-OE fue significativamente mayor que el control; (3) el nivel de expresión de dos genes de flavonoide sintasa clave aguas abajo, CcHIDH1 y CcHIDH2, se reguló al alza en las líneas CcCIPK14-OE; y (4) el sistema transgénico de la raíz pilosa se puede utilizar para estudiar genes metabólicamente funcionales en plantas no modelo.
Introducción
La transformación es una herramienta básica para evaluar la expresión de genes exógenos 1,2. Muchos aspectos biológicos de las plantas de recursos son comunes a todas las plantas; por lo tanto, se pueden realizar estudios funcionales de ciertos genes en plantas modelo (como Arabidopsis)3. Sin embargo, muchos genes de las plantas son únicos en sus patrones de función y expresión, lo que requiere estudios en especies propias o estrechamente relacionadas, especialmente en el caso de las plantas de recursos 3,4. Las células vegetales pueden detectar varias señales que permiten a las plantas mostrar cambios específicos en la expresión génica, el metabolismo y la fisiología en respuesta a diferentes condiciones de estrés ambiental 5,6,7. Los flavonoides son actores cruciales en el proceso de señalización de las plantas que responden al estrés ambiental 5,8,9. Además, el contenido de flavonoides en las plantas hortícolas y medicinales también es un indicador importante para la evaluación de la calidad10. La identificación de los genes implicados en la regulación de la síntesis de flavonoides en respuesta a señales externas es crucial para comprender el mecanismo de la síntesis de flavonoides en las plantas. Varios estudios han revelado que la aplicación de hormonas exógenas puede promover la acumulación de flavonoides 6,11. Un sistema de transformación estable y un método de validación de la función génica son esenciales para demostrar la función de los genes y comprender el metabolismo secundario en las plantas.
La transformación mediada por agrobacterias es ampliamente utilizada en la inserción de ADN 5,8,9. Agrobacterium tumefacient puede transferir genes de anillo a los cromosomas de las células vegetales, y las fitohormonas exógenas inducen una o pocas células huésped que pueden regenerar plantas para obtener transformantes estables 12,13,14. Los métodos de transformación mediados por Agrobacterium tumefacient son más aplicables a especies vegetales aptas para la manipulación in vitro, mientras que la mayoría de las plantas leñosas perennes limitan la aplicación de este método debido a su dificultad de regeneración 4,15. A. rhizogenes también es capaz de modificar el genoma de las células huésped16. En el presente estudio, hemos desarrollado un procedimiento de transformación eficiente y estable mediado por A. rizogenes. A. rizogenes contiene un segundo plásmido binario portador de ADN T de gen no natural además del plásmido Ri. La planta huésped está infectada y se puede obtener una planta compuesta con raíces peludas transgénicas que emergen del brote de tipo silvestre 16,17. Los sistemas de transformación mediados por A. rizogenes son adecuados para su aplicación en la investigación de plantas leñosas debido a su regeneración rápida, de bajo costo y no requerida para la planta. Más de 160 tipos de plantas han inducido con éxito raíces peludas, y la mayoría de las cuales se encuentran en Solanaceae, Compositae, Cruciferae, Convolvulaceae, Umbelliferae, Leguminosae, Caryophyllaceae y Polygonaceae18,19. En comparación con A. tumefaciens, A. rhizogenes mostró mayor eficiencia en la transformación mediada del gandul17,20.
En este estudio, se utilizó el gandul como ejemplo para introducir el proceso de transformación mediado por A. rhizogenes. Desde la inoculación hasta el enraizamiento, los experimentos duraron 5 semanas. Identificamos la transformación de la raíz adventicia a través de la morfología y el gen reportero GFP, y la eficiencia de transformación fue de hasta 75%. Además, tratamos la planta de composite con JA y ABA, así como detectamos transcripciones y metabolitos secundarios mediante PCR real cuantitativa y HPLC (cromatografía líquida de alta resolución). Se confirma que el nivel de expresión de CcCIPK14 responde no solo a JA y ABA, sino que también afecta a la biosíntesis de flavonoides. Este sistema es adecuado para estudiar la función de los genes asociados con el metabolismo secundario. También proporciona un nuevo enfoque para el estudio de plantas no modelo en falta de un sistema de transformación suficientemente estable 17,21,22.
Protocolo
NOTA: El gandul es un cultivo de leguminosas diploide que pertenece a la familia Fabaceae. Las semillas de gandul utilizadas en este experimento son de la Universidad Forestal del Noreste de China y están codificadas como 87119. Los pasos principales de este protocolo se ilustran en la Figura 1A. La incubación de las plántulas se realizó en un ambiente de alta humedad a 25 °C bajo luces fluorescentes a 50 μmol de fotones por m-2 s-1 en un fotoperiodo de 16 h. Las cepas de A. rhizogenes K599 (NCPPB2659) se conservaron en el laboratorio. Se almacenaron en medio manitol de levadura (YEP) con glicerol al 15% a -80 °C. El protocolo descrito en este trabajo se basó en el protocolo de Meng et al.21.
ATENCIÓN: Deposite todas las bacterias y plantas modificadas genéticamente en el contenedor de residuos adecuado. Utilice todos los productos químicos peligrosos en una campana extractora y deséchelos en el contenedor de residuos peligrosos.
1. Preparación de plántulas de gandul.
- Elija semillas de gandul regordetas y sin daños (Figura 1A) que se hayan almacenado durante menos de 1 año.
- Remoje las semillas en agua destilada durante 24 h (Figura 1B). Transfiera las semillas hinchadas a una bandeja de semillas y colóquelas en el invernadero.
- Las semillas comienzan a germinar después de 1-2 días. Cuando el epicótilo alcance 1,5 cm, trasplante las plántulas a macetas de 10 cm (diámetro) x 9 cm (altura) que contengan tierra y arena en una proporción de volumen de 3:1.
NOTA: El suelo consiste en una mezcla de tierra nutritiva, vermiculita y perlita en una proporción de 2:1:1. - Cultiva la plántula en un invernadero.
2. Activación de A. rhizogenes
NOTA: La cepa utilizada para la transformación de A. rhizogenes fue la K599 conservada a -80 °C. El vector binario pROK2 (pBIN438; http://www.biovector.net/product/428388.html) contiene proteína verde fluorescente (GFP) como gen indicador y un gen de resistencia a la kanamicina como marcador seleccionable para transformar A. rhizogenes.
- Descongele A. rhizogenes en hielo.
- Sumerja las bacterias y cúbralas uniformemente sobre el medio de manitol de levadura (YEP) suplementado con 8 g/L de polvo de agar, 25 mg/L de rifampicina y 25 mg/L de kanamicina (YRK, pH 7.0).
- Incubar a 28 °C durante 16 h.
- Seleccionar colonias monoclonales. Cultivarlos en un tubo de 50 mL que contenga 10 mL de medio YEB suplementado con 25 mg/L de rifampicina y 25 mg/L de kanamicina (YRK, pH 7.0). Coloque el tubo de centrífuga en una incubadora agitadora con un radio de rotación de 10 cm, a 28 °C y 200 rpm durante 16 h.
3. Transformación de plantas con A. rhizogenes
NOTA: Seleccione plantas sanas para infectar A . rhizogenes utilizando el siguiente procedimiento de inyección. Este procedimiento da como resultado raíces pilosas transformadas. Para analizar la función génica de CcCIPK14, es necesario un control. Se inyectaron soluciones de A. rhizogenes con vector vacío o plásmidosCc CIPK14-pROK2 en plántulas para inducir raíces pilosas.
- Inocular A. rhizogenes
- Elija plántulas de gandul con el mismo estado de crecimiento.
- Vacíe el aire de la jeringa de 1 mL y aspire 0,3 mL de líquido bacteriano. Empuje lentamente la varilla de empuje para llenar la aguja de la jeringa con líquido bacteriano21.
- Primero fije el tallo de la plántula de gandul con pinzas y luego pinche la aguja de la jeringa en el tallo a 1 cm.
- Al retirar la jeringa, sumerja completamente la punta de la aguja en el vástago. Empuje lentamente la varilla de empuje para bombear el líquido bacteriano fuera de la herida penetrante.
NOTA: La unión del líquido bacteriano residual a la herida en gotitas de bacterias puede mejorar la infección y la eficiencia de la transformación.
- Manejo de plántulas
NOTA: Las altas temperaturas y humedad pueden mejorar la eficiencia de la infección de A. rhizogenes.- Coloque las plántulas inoculadas con A. rhizogenes en una bandeja (30 cm x 60 cm x 6 cm) con 1 L de agua. Utilice una tapa de plástico transparente (30 cm x 60 cm x 30 cm) como cubierta para mantener la temperatura y la humedad del ambiente interno.
- Retire periódicamente las hojas caídas y las hifas floculantes adheridas a las puntas de las hojas y las hojas caídas.
- Después de una semana, el callo comienza a aparecer en la herida. Posteriormente, mantenga la tapa de plástico entreabierta.
- Después de 4-5 semanas, la mayor parte del tejido del callo se diferenció en raíces adventicias. Retire la tapa de plástico.
- Añade 1 L de agua a la bandeja cada 3 días para mantener la tierra húmeda.
NOTA: El gandul es una planta tolerante a la sequía; Demasiada agua puede inhibir el crecimiento de las plantas.
4. Identificación de raíces pilosas transformadas
NOTA: Las raíces pilosas transformadas se pueden identificar en función de la morfología y el nivel genético. Este procedimiento se centra principalmente en el ensayo de identificación de genes reporteros (GFP).
- Recoja las puntas de la raíz pilosa y marque la parte restante.
- Evalúe si hay fluorescencia verde bajo un microscopio de escaneo láser confocal.
- Triturar 0,1 g de raíces pilosas con una fuerte señal de fluorescencia hasta convertirlas en polvo fino en nitrógeno líquido.
- De acuerdo con las instrucciones del fabricante del kit de ADN genómico de plantas, prepare el ADN genómico de líneas transgénicas independientes de gandules mediante el método de bromuro de cetiltrimetilamonio modificado (CTAB)23.
- Utilice 500 ng de plantilla de ADN genómico y cebadores para PCR. Los cebadores se muestran en la Tabla 1.
- Realice el siguiente ciclo de amplificación: predesnaturalización a 94 °C durante 5 min, desnaturalización a 94 °C durante 30 s, recocido de cebadores a 55 °C durante 30 s y extensión del cebador a 72 °C durante 30 s. Después de 36 ciclos y una extensión final de 10 min a 72 °C, analice los productos amplificados en un gel de agarosa al 1%.
- Tiñe los geles con tinción de ácido nucleico y visualízalos bajo luz ultravioleta.
5. Tratamiento hormonal exógeno
NOTA: Las plantas compuestas positivas se trataron con hormonas exógenas para estudiar el efecto de CcCIPK14 sobre el metabolismo. Las plantas compuestas inducidas por A. rhizogenes se dividieron en tres grupos: grupo de tratamiento con JA, grupo de tratamiento con ABA y grupo control (Figura 3A).
- Reducir el riego 3 días antes del tratamiento hormonal exógeno.
- Prepare las soluciones de JA y ABA a una concentración de 5 mg/L.
NOTA: El polvo de JA y ABA se disuelve primero en alcohol etílico y luego se llena hasta el volumen objetivo con agua destilada. - Con una botella rociadora, rocíe soluciones de JA y ABA de manera uniforme sobre las hojas de las plantas. Trate el grupo de control con agua.
NOTA: Se roció un promedio de 10 mL de solución en cada plántula. - Cubra con la tapa de plástico inmediatamente después del tratamiento de pulverización. Vuelva a colocarlo en el invernadero de clima artificial.
6. Recogida y conservación de muestras
NOTA: Después de 3 h de tratamiento hormonal exógeno, se recolectaron materiales vegetales de diferentes grupos de tratamiento.
- Retire las raíces pilosas leonadas y contaminadas y seleccione aquellas con apariencia blanca. Recoge estas raíces peludas y sécalas con papel absorbente.
- Divida las raíces peludas recolectadas de cada plántula en dos partes. Coloque una parte en un tubo de ensayo numerado y envuélvalo con papel de aluminio marcado.
- Liofilizar el papel de aluminio en nitrógeno líquido y, a continuación, almacenar todo el papel de aluminio cosechado a -80 °C para su posterior investigación.
Resultados
Transformación de la raíz pilosa mediada por A. rhizogenes en el gandul
Este estudio describió los protocolos paso a paso para la transformación genética de raíces pilosas mediadas por A. rhizogenes, que tiene importancia en el campo de las moléculas vegetales. Se necesitaron unas 5 semanas para obtener raíces pilosas de las raíces de un gandul infectado por A. rhizogenes. La Figura 1A muestra una visión general de todo el proceso de transformación, desde la inyección de A. rhizogenes hasta la obtención de plantas compuestas con raíces peludas. Los tejidos proliferantes se observaron alrededor de 1 semana después de la infección, y su diferenciación a raíces adventicias se observó alrededor de las 2 semanas, y se produjo una gran cantidad de raíces pilosas a los 35 días (Figura 1B). Este GFP permitió distinguir las raíces pilosas modificadas genéticamente de las raíces pilosas no transgénicas a través de la fluorescencia. En la Figura 2, se visualizaron las raíces pilosas transformadas con GFP-pROK2 bajo el canal de proteína fluorescente verde confocal. La inducción de raíces pilosas por A. rhizogenes con el vector vacío no mostró fluorescencia verde (Figura 2A). Las raíces adventicias generadas se identificaron por morfología y gen reportero de GFP; los resultados confirmaron que K599 podía infectar y transformar con éxito el gandul (Figura 2). Se preparó el ADN genómico de la planta (método CTAB) para el análisis por PCR. La GFP estuvo presente solo en raíces pilosas inducidas por A. rhizogenes portadores del plásmido GFP-pROK2; ni los tejidos vegetales no transformados ni las raíces inducidas por A. rhizogenes con vectores vacíos estaban presentes (Figura 2B, C). Estos resultados indicaron que el vector binario se había transformado con éxito en el genoma de la raíz adventicia16,21.
Para mejorar la eficiencia de transformación de A. rhizogenes, se optimizó el protocolo. La infección porA. rhizogenes causó un crecimiento anormal de las raíces y hojas normales de la planta huésped e incluso provocó la muerte. Hay varias explicaciones posibles para este resultado. En la etapa temprana de crecimiento vegetativo, la propagación y transformación espontánea de las células huésped consumió grandes cantidades de nutrientes, lo que puede ser la razón principal para inhibir el desarrollo de las plántulas e incluso causar la muerte de la planta24,25. Además, el daño mecánico causado por la inoculación también puede haber afectado a las plántulas 24,26,27. Mientras tanto, el estado de crecimiento de las plántulas determina la eficiencia de diferenciación del callo. La inoculación se realiza mejor cuando las plántulas tienen 7 días de edad y los tallos de las plántulas están incompletamente lignificados (Figura 1A). Bajo esta condición, la eficiencia de la producción de callos mediados por A. rizogenes fue del 76%. Los hallazgos de estos estudios sugieren que la humedad relativa puede afectar la proliferación de callos. La proliferación y diferenciación de los tejidos proliferantes y el crecimiento de las raíces adventicias necesitan mantener una alta humedad relativa del aire. Muchas raíces se crearon dentro de las 4 a 5 semanas posteriores a la inoculación y han comenzado a penetrar en el suelo. La eficiencia de transformación general de este experimento puede ser tan alta como el 72%. Eficiencia de transformación (%) = (número de plantas compuestas positivas / número de plantas infectadas) x 100.
Evaluación de la función del gen CcCIPK14 en gandul utilizando el sistema radicular piloso transgénico
Las raíces pilosas de las líneas CcCIPK14-OE se obtuvieron utilizando el protocolo de inducción de raíces pilosas mencionado anteriormente. Las raíces peludas podrían adherirse a los puntos de infección en los tallos para formar una planta compuesta. Como solo las raíces peludas se modifican genéticamente en las plantas compuestas, también se pueden usar para estudiar la transducción de señales entre las raíces y la parte aérea. Las soluciones de fitohormonas (JA y ABA) se rociaron uniformemente sobre las hojas de las plantas compuestas, y las raíces pilosas se recolectaron después de 3 h (Figura 3A). La función de CcCIPK14 en raíces transgénicas se verificó mediante análisis de expresión génica y determinación de metabolitos. Los resultados mostraron que el nivel de expresión de CcCIPK14 se reguló al alza después del tratamiento con AJ y ABA. Además, se aumentaron los niveles de expresión de dos enzimas clave para la síntesis de genisteína en la línea CcCIPK14-OE, CcHIDH1 y CcHIDH2 . En comparación con el grupo control, el contenido de genisteína en las raíces transgénicas aumentó a 0,060 mg/g de PV. Comparamos los fenotipos antes y después de que las plantas transgénicas fueran tratadas con JA/ABA, y hubo poca diferencia en la morfología a través de la comparación (Figura 3B). CcCIPK14, un gen funcional clave en la vía metabólica de los flavonoides, puede responder a las señales hormonales y participar en la biosíntesis de genisteína en el gandul.

Figura 1: Inducción de la planta compuesta mediada por A. rhizogenes . (A) Diagrama de flujo del sistema de transformación de raíces pilosas, incluida la activación de A. rhizogenes, el cultivo de plántulas, la inoculación de agrobacterias , el manejo de plántulas y la obtención de plantas compuestas. Una imagen representativa que muestra las etapas clave. (B) Las tres etapas principales de la formación de raíces adventicias en el sitio de inoculación: aparece callo, el callo prolifera y se diferencia. Las barras de escala son de 1 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Análisis de raíces pilosas transgénicas. (A) Señal de GFP en raíces pilosas transgénicas, con control de solución de Agrobacterium que contiene vectores vacíos. Las barras de escala son de 50 μm. (B,C) Amplificación de genes (GFP) por PCR a partir de ADN genómico aislado de raíces y tallos de tipo silvestre, hojas y raíces transgénicas de plantas compuestas. CK: Vector vacío #1-4: plásmido (vector binario pROK2 portador de GFP) como control positivo. Haga clic aquí para ver una versión más grande de esta figura.
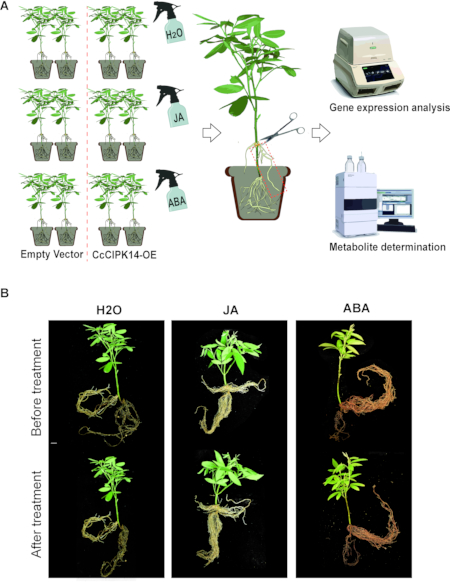
Figura 3: Análisis de la función de CIPK14 por el método de la raíz pilosa y el tratamiento hormonal. (A) Diagrama de flujo del proceso para la verificación y el análisis de la función de los genes a través de plantas compuestas. (B) Cambios fenotípicos de plantas compuestas antes y después del tratamiento con JA, ABA y H2O. Las barras de escala son de 1 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Nivel de expresión génica y contenido de metabolitos secundarios de raíces pilosas con vector vacío y plásmido CcCIPK14-pROK2 (vector binario pROK2 con CcCIPK14). Nivel de expresión de CcCIPK14 (A), contenido de metabolitos secundarios en raíces pilosas transgénicas (B) y niveles de expresión de CcHIDH1 y CcHIDH2 en raíces pilosas después del tratamiento hormonal (D). El nivel de expresión relativa se normalizó al del control de actina. Los datos se presentan como media ± desviación estándar (n = 3),* indica una diferencia significativa (P < 0,05) entre CcCIPK14-OE y los controles (líneas vectoriales vacías) utilizando la prueba t de Student. (C) La vía de biosíntesis de la genisteína. La reacción catalizadora de enzimas HIDH, 2-hidroxiiso flavanona deshidratasa, CIPK14 (proteínas quinasas que interactúan con proteínas similares a la calcineurina B). Los tratamientos con las mismas letras no fueron significativamente diferentes en base a la comparación de medias por la prueba de Duncan a p < 0,05. Haga clic aquí para ver una versión más grande de esta figura.
| Cebador | Secuencia (5'-3') |
| CcCIPK14-q-F | GAGACCAACATTGATGATGTGGAAGC |
| CcCIPK14-q-R | CATTCATTGGTGTGTGTGTGTGTGTTC |
| CcHIDH1-q-F | GAGGCTGTGCTGGAGTCAAT |
| CcHIDH1-q-R | AGCTCAGCTAATCTGGTGGC |
| CcHIDH2-q-F | AGCCCCTCTCTCTGTTGGGT |
| CcHIDH2-q-R | ACTGCTGCAAGTGGCTTACT |
| GFP-F | CCACAAGTTCAGCGTGTCCG |
| GFP-R | AAGTTCACCTTGATGCCGTTC |
Tabla 1: Imprimaciones utilizadas en este estudio.
Discusión
La caracterización rápida de la función génica es el objetivo común en el estudio de la mayoría de las especies, y es particularmente importante para el desarrollo de las plantas de recursos. La transformación mediada por A. rizogenes ha sido ampliamente utilizada en el cultivo de raíces pilosas. El cultivo de raíces pilosas (HRC), como fuente única de producción de metabolitos, desempeña un papel fundamental en la ingeniería metabólica18,28. La aplicación de esta tecnología se limita principalmente a la función de los genes in vivo21. Aquí, proporcionamos un método básico para estudiar la función de los genes basado en el sistema de transformación mediado por A. rhizogenes previo. Este método se puede utilizar para verificar una variedad de funciones genéticas, como la respuesta al estrés ambiental y las hormonas exógenas. La línea CcCIPK14-OE demostró que CcCIPK14 podía promover la acumulación de metabolitos flavonoides y responder a las hormonas exógenas JA y ABA. CcHIDH1 y CcHIDH2 son dos genes flavonoide sintasa esenciales, que fueron significativamente regulados al alza en la línea CcCIPK14-OE. Estos resultados indican que el método puede utilizarse como una herramienta eficaz para evaluar la función de los genes y los metabolitos secundarios.
Un sistema de transformación genética eficaz es un requisito previo para la verificación y el análisis de la función de los genes29,30. A. rhizogenes es una bacteria con un mecanismo evolutivo natural31. Contiene un plásmido inductor de raíces (Ri) que contiene genes del locus de la raíz (rol) en la región del ADN-T, incluidos rolA, rolB, rolC y rolD, que pueden inducir raíces pilosas desde la superficie de la herida de los explantes27,32. El sistema de transformación mediada por A. rhizogenes tiene muchas ventajas33. En primer lugar, en la mayoría de las especies, las células transformadas en Ri de la planta huésped pueden diferenciarse espontáneamente en raíces con fenotipos normales33. Cuando se utilizan vectores binarios adicionales para integrar ADN exógeno, los plásmidos Ri pueden proporcionar la posibilidad de obtener raíces pilosas transformadas sin utilizar hormonas vegetales aplicadas exógenamente para la organogénesis34. En segundo lugar, las raíces transformadas en Ri son genéticamente estables, ya que se especula que estas raíces transformadas se desarrollan a partir de una sola célula transformada17,33. Además, estas raíces peludas pueden mantener la unión a las ramas de tipo silvestre, lo que da como resultado plantas compuestas16,20. Las raíces transformadas en ri pueden simular raíces normales, proporcionando materiales experimentales para la verificación y el análisis de las funciones de los genes35. Este sistema de transformación es adecuado para plantas difíciles de regenerar, como el gandul, que tiene una baja frecuencia de regeneración36,37. Sin embargo, dado que solo las raíces pilosas son transgénicas, no se puede evaluar la función de los genes en todo el nivel de la planta, y los rasgos transgénicos tampoco se pueden transmitir a la descendencia a través de la reproducción sexual.
En este esquema, A. rhizogenes portadores de vectores binarios puede inducir raíces pilosas transgénicas mediante un protocolo eficiente y estable. Los pasos básicos del método de transformación se han descrito en forma de diagrama de flujo (Figura 1A). Después de 1 semana de inoculación con A. rhizogenes, se observaron callos en las heridas del tallo. Después de 3 semanas, los callos se diferenciaron a raíces pilosas (Figura 1B). Este método es importante porque no requiere cultivo in vitro , por lo que las raíces pilosas se obtuvieron en 5 semanas (Figura 1). Meng et al. llevaron a cabo una serie de experimentos similares con este método en diferentes plantas, y los resultados mostraron que la mayoría de las plantas podían obtener raíces transgénicas con el gen objetivo en 2 meses21. El gandul, un huérfano rico en proteínas, crece en las regiones tropicales semiáridas37. El ambiente de cultivo cálido y húmedo afecta el crecimiento del gandul, y puede ocurrir el fenotipocaducifolio 21; El fenotipo se puede restaurar quitando la cubierta de plástico.
Durante estos experimentos, se deben considerar cuidadosamente muchos factores para obtener rápidamente raíces transformadas. El estado de salud de las plántulas después de la inoculación es la clave del éxito de este experimento21. Estudios previos han demostrado que A. rhizogenes puede inducir raíces pilosas en el punto de inoculación durante múltiples etapas del crecimiento de las plántulas38. Sin embargo, el estado de crecimiento de las siembras afecta directamente la eficiencia de la transformación26. La inoculación precoz de A. rhizogenes puede inhibir el crecimiento de las plántulas e incluso causar la muerte de las plántulas39,40. Para obtener la máxima eficiencia de transformación, A. rhizogene generalmente se inocula en plántulas de 7 días de edad. Además, la humedad del aire también es un factor importante que afecta a la proliferación de callos. La eliminación prematura del plástico después de la inoculación con A. rizogenes puede provocar el pardeamiento del callo y la muerte regresiva de las raíces adventicias. En este estudio se utilizaron dos métodos de confirmación diferentes para identificar las raíces transgénicas positivas: la amplificación por PCR del gen insertado y la detección por fluorescencia GFP. Los resultados de la prueba confirmaron que la conversión se había realizado correctamente. La eficiencia de conversión es tan alta como el 75%.
Divulgaciones
Los autores declaran que no tienen intereses financieros o relaciones personales contrapuestas que puedan haber influido en el trabajo reportado en este artículo.
Agradecimientos
Los autores agradecen el apoyo financiero de la Fundación Nacional de Ciencias Naturales de China (31800509, 31922058), el Fondo de Jóvenes Talentos Sobresalientes de la Universidad Forestal de Beijing (2019JQ03009), los Fondos de Investigación Fundamental para las Universidades Centrales (2021ZY16), la Fundación Municipal de Ciencias Naturales de Beijing (6212023) y el Programa Nacional Clave de Investigación y Desarrollo de China (2018YFD1000602,2019YFD1000605-1) y el Centro de Innovación Avanzada de Beijing para el Mejoramiento de Árboles por Diseño Molecular. Deseo agradecer a Zhengyang Hou por su orientación en la redacción del artículo y al profesor Meng Dong por su orientación en la idea del artículo.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.1 mL qPCR 8-strip tube (with optical caps) | KIRGEN, Shanghai, China | KJ2541 | |
| ABA | Solarbio Life Science, Beijing, China | A8060 | |
| Agar powder | Solarbio Life Science, Beijing, China | A8190 | |
| Centrifuge | Osterode am Harz, Germany | d37520 | |
| CFX Connect TW Optics Module | Bio-rad, US | 1855200 | |
| constant temperature incubator | Shanghai Boxun Industry & Commerce Co., Ltd, Shanghai,China | BPX-82 | |
| Diposable Petri dish | Corning, US | ||
| Dry Bath | Gingko Bioscience Company/Coyote bioscience, China | H2H3-100C | |
| Eastep Total RNA Extraction Kit50 | Promega, Beijing, China | LS1030 | |
| Electronic balance | Tianjin, China | TD50020 | |
| Filter pape | Hangzhou wohua Filter Paper Co., Ltd, China | ||
| FiveEasy Plus | Mettler Toledo, Shanghai, China | 30254105 | |
| Flowerpot 9*9 | China | ||
| JA | Solarbio Life Science, Beijing, China | J8070 | |
| Kan | Solarbio Life Science, Beijing, China | K8020 | |
| MagicSYBR Mixture | CWBIO, Beijing, China | CW3008M | |
| Mini Microcentrifuge | Scilogex, Beijing, China | S1010E | |
| NaCl | Solarbio Life Science, Beijing, China | S8210 | |
| NanPhotometer N50 Touch | IMPLEN GMBH, Germany | T51082 | |
| Purelab untra | |||
| Rifampicin | Solarbio Life Science, Beijing, China | R8010 | |
| Seedling box 30*200 | China | ||
| Thermal Cycler PCR | Bio-rad, US | T100 | |
| Thermostatic oscillator | Beijing donglian Har lnstrument Manufacture Co.,Ltd,China | DLHE-Q200 | |
| Tomy Autoclave | Tomy, Japan | SX-500 | |
| Tryptone | Solarbio Life Science, Beijing, China | LP0042 | |
| UEIris II RT-PCR System for First-Strand cDNA Synthesis( with dsDNase) | US Everbright INC, Jiangsu, China | R2028 | |
| Yeast Extract powder | Solarbio Life Science, Beijing, China | LP0021 |
Referencias
- Poland, J. A., Rife, T. W. Genotyping-by-sequencing for plant breeding and genetics. The Plant Genome. 5 (3), (2012).
- Barabaschi, D., et al. Next generation breeding. Plant Science. 242, 3-13 (2016).
- Petri, C., Webb, K., Hily, J. -. M., Dardick, C., Scorza, R. High transformation efficiency in plum (Prunus domestica L.): a new tool for functional genomics studies in Prunus spp. Molecular Breeding. 22 (4), 581-591 (2008).
- Tang, H., Ren, Z., Reustle, G., Krczal, G. Plant regeneration from leaves of sweet and sour cherry cultivars. Scientia Horticulturae. 93 (3-4), 235-244 (2002).
- Yang, L., et al. Response of plant secondary metabolites to environmental factors. Molecules. 23 (4), 762 (2018).
- Ross, J. J., Weston, D. E., Davidson, S. E., Reid, J. B. Plant hormone interactions: how complex are they. Physiologia Plantarum. 141 (4), 299-309 (2011).
- Meng, D., et al. The pigeon pea CcCIPK14-CcCBL1 pair positively modulates drought tolerance by enhancing flavonoid biosynthesis. The Plant Journal. , (2021).
- Wen, W., Alseekh, S., Fernie, A. R. Conservation and diversification of flavonoid metabolism in the plant kingdom. Current Opinion in Plant Biology. 55, 100-108 (2020).
- Shah, A., Smith, D. L. Flavonoids in agriculture: Chemistry and roles in, biotic and abiotic stress responses, and microbial associations. Agronomy. 10 (8), 1209 (2020).
- Zhang, W., Jiang, W. UV treatment improved the quality of postharvest fruits and vegetables by inducing resistance. Trends in Food Science & Technology. 92, 71-80 (2019).
- Koyama, R., et al. Exogenous abscisic acid promotes anthocyanin biosynthesis and increased expression of flavonoid synthesis genes in Vitis vinifera× Vitis labrusca table grapes in a subtropical region. Frontiers in Plant Science. 9, 323 (2018).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- Veena, V., Taylor, C. G. Agrobacterium rhizogenes: recent developments and promising applications. In Vitro Cellular & Developmental Biology-Plant. 43 (5), 383-403 (2007).
- Lacroix, B., Citovsky, V. Pathways of DNA transfer to plants from Agrobacterium tumefaciens and related bacterial species. Annual Review of Phytopathology. 57, 231-251 (2019).
- Guan, Y., Li, S. -. G., Fan, X. -. F., Su, Z. -. H. Application of somatic embryogenesis in woody plants. Frontiers in Plant Science. 7, 938 (2016).
- Alpizar, E., et al. Efficient production of Agrobacterium rhizogenes-transformed roots and composite plants for studying gene expression in coffee roots. Plant Cell Reports. 25 (9), 959-967 (2006).
- Hwang, H. -. H., Yu, M., Lai, E. -. M. Agrobacterium-mediated plant transformation: biology and applications. The Arabidopsis Book. 15, (2017).
- Srivastava, S., Srivastava, A. K. Hairy root culture for mass-production of high-value secondary metabolites. Critical Reviews in Biotechnology. 27 (1), 29-43 (2007).
- Porter, J. R., Flores, H. Host range and implications of plant infection by Agrobacterium rhizogenes. Critical Reviews in Plant Sciences. 10 (4), 387-421 (1991).
- Fan, Y. -. l., et al. One-step generation of composite soybean plants with transgenic roots by Agrobacterium rhizogenes-mediated transformation. BMC Plant Biology. 20, 1-11 (2020).
- Meng, D., et al. Development of an efficient root transgenic system for pigeon pea and its application to other important economically plants. Plant Biotechnology Journal. 17 (9), 1804-1813 (2019).
- Ma, R., et al. Agrobacterium-Mediated genetic transformation of the medicinal plant Veratrum dahuricum. Plants. 9 (2), 191 (2020).
- Mi, Y., et al. Inducing hairy roots by Agrobacterium rhizogenes-mediated transformation in tartary buckwheat (Fagopyrum tataricum). Journal of Visualized Experoments: JoVE. (157), (2020).
- Cordovez, V., et al. Plant phenotypic and transcriptional changes induced by volatiles from the fungal root pathogen Rhizoctonia solani. Frontiers in Plant Science. 8, 1262 (2017).
- Trovato, M., Mattioli, R., Costantino, P. From A. rhizogenes RolD to plant P5CS: exploiting proline to control plant development. Plants. 7 (4), 108 (2018).
- Van Altvorst, A. C., et al. Effects of the introduction of Agrobacterium rhizogenes rol genes on tomato plant and flower development. Plant Science. 83 (1), 77-85 (1992).
- Bahramnejad, B., Naji, M., Bose, R., Jha, S. A critical review on use of Agrobacterium rhizogenes and their associated binary vectors for plant transformation. Biotechnology Advances. 37 (7), 107405 (2019).
- Gutierrez-Valdes, N., et al. Hairy root cultures-a versatile tool with multiple applications. Frontiers in Plant Science. 11, (2020).
- Che, P., et al. Developing a flexible, high-efficiency Agrobacterium-mediated sorghum transformation system with broad application. Plant Biotechnology Journal. 16 (7), 1388-1395 (2018).
- Keshavareddy, G., Kumar, A., Ramu, V. S. Methods of plant transformation-a review. International Journal of Current Microbiology and Applied Sciences. 7 (7), 2656-2668 (2018).
- Lacroix, B., Citovsky, V. Beyond Agrobacterium-mediated transformation: horizontal gene transfer from bacteria to eukaryotes. Agrobacterium Biology. , 443-462 (2018).
- Sarkar, S., Ghosh, I., Roychowdhury, D., Jha, S. . Biotechnological approaches for medicinal and aromatic plants. , 27-51 (2018).
- Singh, R. S., et al. . Biotechnological Approaches for Medicinal and Aromatic Plants. , 235-250 (2018).
- Bahramnejad, B., Naji, M., Bose, R., Jha, S. A critical review on use of Agrobacterium rhizogenes and their associated binary vectors for plant transformation. Biotechnology Advances. 37 (7), 107405 (2019).
- Meng, D., et al. Development of an efficient root transgenic system for pigeon pea and its application to other important economically plants. Plant Biotechnology Journal. 17 (9), 1804-1813 (2019).
- Surekha, C., et al. Agrobacterium-mediated genetic transformation of pigeon pea (Cajanus cajan (L.) Millsp.) using embryonal segments and development of transgenic plants for resistance against Spodoptera. Plant Science. 169 (6), 1074-1080 (2005).
- Saxena, K. Genetic improvement of pigeon pea-a review. Tropical Plant Biology. 1 (2), 159-178 (2008).
- Hada, A., et al. Improved Agrobacterium tumefaciens-mediated transformation of soybean [Glycine max (L.) Merr.] following optimization of culture conditions and mechanical techniques. In Vitro Cellular & Developmental Biology-Plant. 54 (6), 672-688 (2018).
- Foti, C., Pavli, O. High-efficiency Agrobacterium rhizogenes-mediated transgenic hairy root induction of lens culinaris. Agronomy. 10 (8), 1170 (2020).
- Bhattacharya, A., Sood, P., Citovsky, V. The roles of plant phenolics in defence and communication during Agrobacterium and Rhizobium infection. Molecular Plant Pathology. 11 (5), 705-719 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ISSN 2578-6326
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.