Method Article
CcCIPK14 Análise da função gênica para iluminar o sistema transgênico radicular eficiente
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui apresentamos um sistema de transformação eficiente e estável para a análise funcional do gene CcCIPK14 como exemplo, fornecendo uma base técnica para o estudo do metabolismo de plantas não-modelo.
Resumo
Um sistema de transformação eficiente e estável é fundamental para o estudo da função gênica e melhoramento molecular de plantas. Aqui, descrevemos o uso de um sistema de transformação mediado por Agrobacterium rhizogenes em guandu. O caule está infectado com A. rhizogenes carregando um vetor binário, que induziu calos após 7 dias e raízes adventícias 14 dias depois. A raiz pilosa transgênica gerada foi identificada por análise morfológica e um gene repórter GFP. Para ilustrar ainda mais a faixa de aplicação deste sistema, CcCIPK14 (proteínas quinases de interação com proteínas semelhantes à calcineurina B) foi transformado em feijão bóer usando este método de transformação. As plantas transgênicas foram tratadas com ácido jasmônico (JA) e ácido abscísico (ABA), respectivamente, com o objetivo de testar se o CcCIPK14 responde a esses hormônios. Os resultados demonstraram que (1) hormônios exógenos podem regular significativamente o nívelde expressão de CcCIPK14, especialmente em plantas de superexpressão (OE) de CcCIPK14 ; (2) o teor de genisteína nas linhagens CcCIPK14-OE foi significativamente maior do que o controle; (3) o nível de expressão de dois genes-chave da flavonóide sintase a jusante, CcHIDH1 e CcHIDH2, foi regulado positivamente nas linhagens CcCIPK14-OE; e (4) o sistema transgênico de raiz pilosa pode ser usado para estudar genes metabolicamente funcionais em plantas não modelo.
Introdução
A transformação é uma ferramenta básica para avaliar a expressão de genes exógenos 1,2. Muitos aspectos biológicos das plantas de recursos são comuns a todas as plantas; portanto, estudos funcionais de certos genes podem ser realizados em plantas modelo (como Arabidopsis)3. No entanto, muitos genes em plantas são únicos em sua função e padrões de expressão, exigindo estudos em espécies próprias ou intimamente relacionadas, especialmente para plantas de recursos 3,4. As células vegetais podem detectar vários sinais que permitem que as plantas mostrem mudanças específicas na expressão gênica, metabolismo e fisiologia em resposta a diferentes condições de estresse ambiental 5,6,7. Os flavonóides são atores cruciais no processo de sinalização das plantas que responde a estresses ambientais 5,8,9. Além disso, o teor de flavonóides em plantas hortícolas e medicinais também é um indicador importante para a avaliação da qualidade10. A identificação de genes envolvidos na regulação da síntese de flavonoides em resposta a sinais externos é crucial para a compreensão do mecanismo de síntese de flavonoides em plantas. Vários estudos têm revelado que a aplicação de hormônios exógenos pode promover o acúmulo de flavonoides 6,11. Um sistema de transformação estável e um método de validação da função gênica são essenciais para demonstrar a função dos genes e entender o metabolismo secundário nas plantas.
A transformação mediada por agrobactérias é amplamente utilizada na inserção de DNA 5,8,9. Agrobacterium tumefacient pode transferir genes de anel para os cromossomos das células vegetais, e os fitohormônios exógenos induzem uma ou poucas células hospedeiras que podem regenerar plantas para obter transformantes estáveis 12,13,14. Os métodos de transformação mediados por Agrobacterium tumefacient são mais aplicáveis a espécies vegetais adequadas para manipulação in vitro, enquanto a maioria das plantas lenhosas perenes limita a aplicação desse método devido à sua dificuldade de regeneração 4,15. A. rhizogenes também é capaz de modificar o genoma das células hospedeiras16. No presente estudo, desenvolvemos um procedimento de transformação mediado por A. rhizogenes eficiente e estável. A. rhizogenes contém um segundo plasmídeo binário carregando o gene T-DNA não natural, além do plasmídeo Ri. A planta hospedeira está infectada e uma planta composta pode ser obtida com raízes peludas transgênicas emergindo do broto do tipo selvagem16,17. Os sistemas de transformação mediados por A. rhizogenes são adequados para aplicação em pesquisas com plantas lenhosas devido à sua regeneração de plantas rápida, de baixo custo e não necessária. Mais de 160 tipos de plantas induziram com sucesso raízes peludas, e a maioria das quais está em Solanaceae, Compositae, Cruciferae, Convolvulaceae, Umbelliferae, Leguminosae, Caryophyllaceae e Polygonaceae18,19. Em comparação com A. tumefaciens, A. rhizogenes apresentou maior eficiência na transformação mediada do guandu17,20.
Neste estudo, o guandu foi utilizado como exemplo para introduzir o processo de transformação mediado por A. rhizogenes. Da inoculação ao enraizamento, os experimentos tiveram duração de 5 semanas. Identificamos a transformação da raiz adventícia por meio da morfologia e do gene repórter GFP, e a eficiência de transformação foi de até 75%. Além disso, tratamos a planta composta com JA e ABA, bem como detectamos transcritos e metabólitos secundários por PCR real quantitativo e HPLC (cromatografia líquida de alta eficiência). Confirma-se que o nível de expressão de CcCIPK14 responde não apenas a JA e ABA, mas também afeta a biossíntese de flavonóides. Este sistema é adequado para estudar genes de função associados ao metabolismo secundário. Também fornece uma nova abordagem para estudar plantas não modelo na falta de um sistema de transformação estável suficiente 17,21,22.
Protocolo
NOTA: O feijão bóer é uma leguminosa diplóide que pertence à família Fabaceae. As sementes de feijão bóer usadas neste experimento são da Universidade Florestal do Nordeste da China e são codificadas como 87119. As etapas principais deste protocolo são ilustradas na Figura 1A. A incubação das mudas foi realizada em ambiente de alta umidade a 25 °C sob luz fluorescente a 50 μmol fótons por m-2 s-1 em fotoperíodo de 16 h. As cepas K599 (NCPPB2659) de A. rhizogenes foram preservadas em laboratório. Eles foram armazenados em meio manitol de levedura (YEP) com glicerol a 15% a -80 °C. O protocolo descrito neste trabalho foi baseado no protocolo de Meng et al.21.
CUIDADO: Deposite todas as bactérias e plantas geneticamente modificadas no recipiente de lixo apropriado. Use todos os produtos químicos perigosos em uma capela e descarte-os no recipiente de resíduos perigosos.
1. Preparação de mudas de feijão bóer
- Escolha sementes de feijão bóer rechonchudas e não danificadas (Figura 1A) que tenham sido armazenadas por menos de 1 ano.
- Mergulhe as sementes em água destilada por 24 h (Figura 1B). Transfira as sementes inchadas para uma bandeja de sementes e coloque-as na estufa.
- As sementes começam a germinar após 1-2 dias. Quando o epicótilo atingir 1,5 cm, transplante as mudas para vasos de 10 cm (diâmetro) x 9 cm (altura) contendo terra e areia em uma proporção de volume de 3:1.
NOTA: O solo consiste em uma mistura de solo nutritivo, vermiculita e perlita na proporção de 2:1:1. - Cultive a muda em uma estufa.
2. Ativação de A. rhizogenes
NOTA: A cepa usada para a transformação de A. rhizogenes foi a K599 preservada a -80 ° C. O vetor binário pROK2 (pBIN438; http://www.biovector.net/product/428388.html) contém proteína fluorescente verde (GFP) como um gene indicador e um gene de resistência à canamicina como um marcador selecionável para transformar A. rhizogenes.
- Descongele A. rhizogenes no gelo.
- Mergulhe as bactérias e alinhe-as uniformemente em meio de manitol de levedura (YEP) suplementado com 8 g/L de ágar pó, 25 mg/L de rifampicina e 25 mg/L de canamicina (YRK, pH 7,0).
- Incubar a 28 °C durante 16 h.
- Selecione colônias monoclonais. Cultive-os em um tubo de 50 mL contendo 10 mL de meio YEB suplementado com 25 mg/L de rifampicina e 25 mg/L de canamicina (YRK, pH 7,0). Colocar o tubo de centrifugação numa incubadora agitável com um raio de rotação de 10 cm, a 28 °C e 200 rpm durante 16 h.
3. Transformação de plantas usando A. rhizogenes
NOTA: Selecione plantas saudáveis para infectar A. rhizogenes usando o seguinte procedimento de injeção. Este procedimento resulta em raízes pilosas transformadas. Para analisar a função gênica do CcCIPK14, é necessário um controle. Soluções de A. rhizogenes com vetor vazio ou plasmídeos CcCIPK14-pROK2 foram injetadas em plântulas para induzir raízes pilosas.
- Inocular A. rhizogenes
- Escolha mudas de feijão bóer com o mesmo status de crescimento.
- Esvazie o ar da seringa de 1 mL e aspire 0,3 mL de líquido bacteriano. Empurre lentamente a haste para encher a agulha da seringa com líquido bacteriano21.
- Primeiro fixe o caule da muda de feijão bóer com uma pinça e, em seguida, pique a agulha da seringa no caule a 1 cm.
- Ao retirar a seringa, mergulhe completamente a ponta da agulha na haste. Empurre lentamente a haste para bombear o líquido bacteriano para fora da ferida penetrante.
NOTA: A fixação de líquido bacteriano residual à ferida em gotículas de bactérias pode melhorar a eficiência da infecção e da transformação.
- Manejo de mudas
NOTA: Alta temperatura e umidade podem melhorar a eficiência da infecção de A. rhizogenes.- Coloque as mudas inoculadas com A. rhizogenes em uma bandeja (30 cm x 60 cm x 6 cm) com 1 L de água. Use uma tampa de plástico transparente (30 cm x 60 cm x 30 cm) como cobertura para manter a temperatura e a umidade do ambiente interno.
- Remova periodicamente as folhas caídas e hifas floculantes presas às pontas das folhas e folhas caídas.
- Depois de uma semana, o calo começa a aparecer na ferida. Em seguida, mantenha a tampa de plástico entreaberta.
- Após 4-5 semanas, a maior parte do tecido caloso se diferenciou em raízes adventícias. Remova a tampa de plástico.
- Adicione 1 L de água à bandeja a cada 3 dias para manter o solo úmido.
NOTA: O feijão bóer é uma planta tolerante à seca; Muita água pode inibir o crescimento das plantas.
4. Identificação de raízes pilosas transformadas
NOTA: As raízes pilosas transformadas podem ser identificadas com base na morfologia e no nível do gene. Este procedimento se concentra principalmente no ensaio de identificação do gene repórter (GFP).
- Colete as pontas da raiz peluda e marque a parte restante.
- Avalie se há fluorescência verde sob um microscópio confocal de varredura a laser.
- Triturar 0,1 g de raízes peludas com forte sinal de fluorescência em pó fino em nitrogênio líquido.
- De acordo com as instruções do fabricante do kit de DNA genômico vegetal, prepare o DNA genômico de linhagens transgênicas independentes de feijão bóer pelo método de brometo de cetiltrimetilamônio modificado (CTAB)23.
- Use 500 ng de molde de DNA genômico e primers para PCR. Os primers são mostrados na Tabela 1.
- Execute o seguinte ciclo de amplificação: pré-desnaturação a 94 ° C por 5 min, desnaturação a 94 ° C por 30 s, recozimento de primers a 55 ° C por 30 s e extensão do primer a 72 ° C por 30 s. Após 36 ciclos e uma extensão final de 10 min a 72 °C, analise os produtos amplificados em gel de agarose a 1%.
- Pinte os géis com coloração de ácido nucleico e visualize-os sob luz ultravioleta.
5. Tratamento hormonal exógeno
NOTA: As plantas compostas positivas foram tratadas com hormônios exógenos para estudar o efeito do CcCIPK14 no metabolismo. As plantas compostas induzidas por A. rhizogenes foram divididas em três grupos: grupo de tratamento JA, grupo de tratamento ABA e grupo controle (Figura 3A).
- Reduza a rega 3 dias antes do tratamento com hormônios exógenos.
- Preparar as soluções JA e ABA a uma concentração de 5 mg/l.
NOTA: O pó JA e ABA é primeiro dissolvido em álcool etílico e, em seguida, enchido até o volume alvo com água destilada. - Usando um borrifador, borrife as soluções JA e ABA uniformemente nas folhas das plantas. Trate o grupo de controle com água.
NOTA: Uma média de 10 mL de solução foi pulverizada em cada muda. - Cubra com a tampa de plástico imediatamente após o tratamento de pulverização. Coloque-o de volta na estufa de clima artificial.
6. Coleta e preservação de amostras
NOTA: Após 3 h de tratamento com hormônio exógeno, foram coletados materiais vegetais de diferentes grupos de tratamento.
- Remova as raízes peludas fulvas e contaminadas e selecione aquelas com aparência branca. Colete essas raízes peludas e seque-as com papel absorvente.
- Divida as raízes peludas coletadas de cada muda em duas partes. Coloque uma peça em um tubo de ensaio numerado e embrulhe-o usando papel alumínio marcado.
- Liofilize o papel alumínio em nitrogênio líquido e, em seguida, armazene todo o papel alumínio colhido a -80 °C para uma investigação mais aprofundada.
Resultados
Transformação de raiz peluda mediada por A. rhizogenes em guandu
Este estudo descreveu os protocolos passo a passo para a transformação genética de raízes pilosas mediadas por A. rhizogenes, que tem significado no campo das moléculas vegetais. Demorou cerca de 5 semanas para obter raízes peludas das raízes do feijão bóer infectado por A. rhizogenes. A Figura 1A mostrou uma visão geral de todo o processo de transformação, desde a injeção de A. rhizogenes até a obtenção de plantas compostas com raízes peludas. Tecidos proliferativos foram observados cerca de 1 semana após a infecção, e sua diferenciação para raízes adventícias foi observada em torno de 2 semanas, e um grande número de raízes pilosas foi produzido em 35 dias (Figura 1B). Esta GFP tornou possível distinguir raízes pilosas geneticamente modificadas de raízes pilosas não transgênicas por meio de fluorescência. Na Figura 2, as raízes pilosas transformadas com GFP-pROK2 foram visualizadas sob o canal confocal de proteína fluorescente verde. A indução de raízes pilosas por A. rhizogenes com o vetor vazio não mostrou fluorescência verde (Figura 2A). As raízes adventícias geradas foram identificadas pela morfologia e gene repórter GFP; os resultados confirmaram que o K599 poderia infectar e transformar com sucesso o guandu (Figura 2). O DNA genômico da planta foi preparado (método CTAB) para análise por PCR. A GFP estava presente apenas em raízes pilosas induzidas por A. rhizogenes portadoras do plasmídeo GFP-pROK2; nem os tecidos vegetais não transformados nem as raízes induzidas por A. rhizogenes com vetores vazios estavam presentes (Figura 2B, C). Esses resultados indicaram que o vetor binário foi transformado com sucesso no genoma da raiz adventícia 16,21.
Para melhorar a eficiência de transformação de A. rhizogenes, o protocolo foi otimizado. A infecção porA. rhizogenes causou crescimento anormal de raízes e folhas normais da planta hospedeira e até levou à morte. Existem várias explicações possíveis para esse resultado. No estágio inicial de crescimento vegetativo, a propagação espontânea e a transformação das células hospedeiras consumiram grandes quantidades de nutrientes, o que talvez seja o principal motivo para inibir o desenvolvimento das plântulas e até mesmo causar a morte das plantas24,25. Além disso, os danos mecânicos causados pela inoculação também podem ter afetado as plântulas 24,26,27. Enquanto isso, o status de crescimento das mudas determina a eficiência de diferenciação do calo. A inoculação é melhor realizada quando as mudas têm 7 dias de idade e os caules das mudas estão incompletamente lignificados (Figura 1A). Nessa condição, a eficiência da produção de calos mediada por A. rhizogenes foi de 76%. Os resultados desses estudos sugerem que a umidade relativa pode afetar a proliferação de calos. A proliferação e diferenciação de tecidos em proliferação e o crescimento de raízes adventícias precisam manter uma alta umidade relativa do ar. Muitas raízes foram criadas dentro de 4 a 5 semanas após a inoculação e começaram a penetrar no solo. A eficiência geral de transformação deste experimento pode chegar a 72%. Eficiência de transformação (%) = (número de plantas compostas positivas / número de plantas infectadas) x 100.
Avaliação da função do gene CcCIPK14 em guandu utilizando o sistema radicular piloso transgênico
As raízes pilosas das linhagens de CcCIPK14-OE foram obtidas usando o protocolo de indução de raízes pilosas mencionado acima. As raízes peludas podem se prender aos pontos de infecção nos caules para formar uma planta composta. Como apenas as raízes peludas são geneticamente modificadas em plantas compostas, elas também podem ser usadas para estudar a transdução de sinal entre as raízes e a parte acima do solo. As soluções fitohormonais (JA e ABA) foram pulverizadas uniformemente nas folhas das plantas compostas, e as raízes pilosas foram coletadas após 3 h (Figura 3A). A função de CcCIPK14 em raízes transgênicas foi verificada por análise de expressão gênica e determinação de metabólitos. Os resultados mostraram que o nível de expressão de CcCIPK14 foi regulado positivamente após o tratamento com JA e ABA. Além disso, os níveis de expressão de duas enzimas chave para a síntese de genisteína na linhagem CcCIPK14-OE, CcHIDH1 e CcHIDH2 foram regulados positivamente. Em comparação com o grupo controle, o teor de genisteína nas raízes transgênicas aumentou para 0,060 mg/g de FW. Comparamos os fenótipos antes e depois que as plantas transgênicas foram tratadas com JA/ABA, e houve pouca diferença na morfologia por meio da comparação (Figura 3B). CcCIPK14, um gene funcional chave na via metabólica dos flavonóides, pode responder a sinais hormonais e participar da biossíntese de genisteína no feijão bóer.

Figura 1: Indução da planta composta mediada por A. rhizogenes . (A) Fluxograma do sistema de transformação de raízes pilosas, incluindo ativação de A. rhizogenes, cultivo de mudas, inoculação de Agrobacterium , manejo de mudas e obtenção de plantas compostas. Uma imagem representativa mostrando os principais estágios. (B) Os três estágios principais da formação de raízes adventícias no local da inoculação: o calo aparece, o calo prolifera e se diferencia. As barras de escala são de 1 cm. Clique aqui para ver uma versão maior desta figura.

Figura 2: Análise de raízes pilosas transgênicas. (A) Sinal GFP em raízes pilosas transgênicas, com controle de solução de Agrobacterium contendo vetor vazio. As barras de escala são de 50 μm. (B,C) Amplificação por PCR de genes (GFP) de DNA genômico isolado de raízes e caules de tipo selvagem, folhas e raízes transgênicas de plantas compostas. CK: Vetor vazio # 1-4: plasmídeo (vetor binário pROK2 carregando GFP) como controle positivo. Clique aqui para ver uma versão maior desta figura.
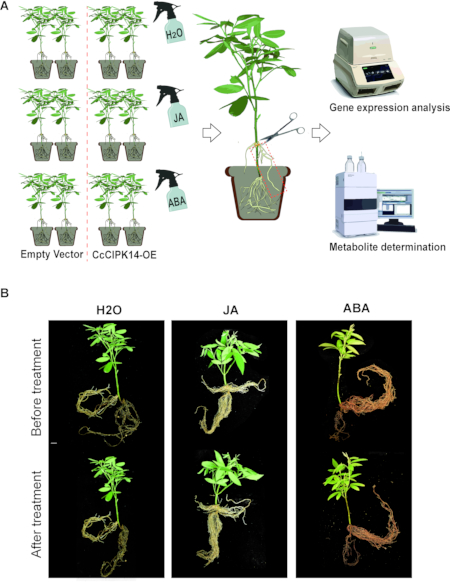
Figura 3: Análise da função CIPK14 pelo método da raiz pilosa e tratamento hormonal. (A) Fluxograma do processo para verificação e análise da função gênica através de plantas compostas. (B) Alterações fenotípicas de plantas compostas antes e depois do tratamento com JA, ABA e H2O. As barras de escala são de 1 cm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Nível de expressão gênica e conteúdo de metabólitos secundários de raízes pilosas com vetor vazio e plasmídeo CcCIPK14-pROK2 (vetor binário pROK2 com CcCIPK14). Nível de expressão de CcCIPK14 (A), conteúdo de metabólitos secundários em raízes pilosas transgênicas (B) e níveis de expressão de CcHIDH1 e CcHIDH2 em raízes pilosas após tratamento hormonal (D). O nível de expressão relativa foi normalizado para o controle de actina. Os dados são apresentados como média ± desvio padrão (n = 3),* indica uma diferença significativa (P < 0,05) entre CcCIPK14-OE e os controles (linhas vetoriais vazias) usando o teste t de Student. (C) A via de biossíntese da genisteína. A reação catalisadora enzimática HIDH, 2-hidroxiiso flavanona desidratase, CIPK14 (proteínas quinases de interação com proteínas semelhantes à calcineurina B). Os tratamentos com as mesmas letras não foram significativamente diferentes com base na comparação média pelo teste de Duncan em p < 0,05. Clique aqui para ver uma versão maior desta figura.
| Cartilha | Sequência (5'-3') |
| CcCIPK14-q-F | GAGACCAACATTGATGATGTGGAAGC |
| CcCIPK14-q-R | CATTCATTGGTGTGTTGGCTGCTCTCTTC |
| CcHIDH1-q-F | GAGGCTGTGCTGGAGTCAAT |
| CcHIDH1-q-R | AGCTCAGCTAATCTGGTGGC |
| CcHIDH2-q-F | AGCCCCTATCTCTGTTGGGT |
| CcHIDH2-q-R | ACTGCTGCAAGTGGCTTACT |
| GFP-F | CCACAAGTTCAGCGTGTCCG |
| GFP-R | AAGTTCACCTTGATGCCGTTC |
Tabela 1: Primers usados neste estudo.
Discussão
A rápida caracterização da função gênica é o objetivo comum no estudo da maioria das espécies e é particularmente importante para o desenvolvimento de plantas de recursos. A transformação mediada por A. rhizogenes tem sido amplamente utilizada na cultura de raízes pilosas. A cultura de raízes pilosas (HRC), como fonte única de produção de metabólitos, desempenha um papel fundamental na engenharia metabólica18,28. A aplicação dessa tecnologia é limitada principalmente à função de genes in vivo21. Aqui, fornecemos um método básico para estudar a função do gene com base no sistema de transformação mediado por A. rhizogenes anterior. Este método pode ser usado para verificar uma variedade de funções gênicas, como resposta ao estresse ambiental e hormônios exógenos. A linhagem CcCIPK14-OE mostrou que o CcCIPK14 pode promover o acúmulo de metabólitos flavonoides e responder aos hormônios exógenos JA e ABA. CcHIDH1 e CcHIDH2 são dois genes essenciais da flavonóide sintase, que foram significativamente regulados positivamente na linhagem CcCIPK14-OE. Esses resultados indicam que o método pode ser usado como uma ferramenta eficaz para avaliar a função gênica e metabólitos secundários.
Um sistema de transformação genética eficaz é um pré-requisito para a verificação e análise da função gênica 29,30. A. rhizogenes é uma bactéria com mecanismo evolutivo natural31. Ele contém um plasmídeo indutor de raiz (Ri) que contém genes de locus radicular (rol) na região T-DNA, incluindo rolA, rolB, rolC e rolD, que podem induzir raízes pilosas da superfície da ferida dos explantes27,32. O sistema de transformação mediado por A. rhizogenes tem muitas vantagens33. Primeiro, na maioria das espécies, as células transformadas em Ri da planta hospedeira podem se diferenciar espontaneamente em raízes com fenótipos normais33. Quando vetores binários adicionais são usados para integrar DNA exógeno, os plasmídeos Ri podem fornecer a possibilidade de obter raízes pilosas transformadas sem usar hormônios vegetais aplicados exogenamente para organogênese34. Em segundo lugar, as raízes transformadas em Ri são geneticamente estáveis, porque se especula que essas raízes transformadas são desenvolvidas a partir de uma única célula transformada17,33. Além disso, essas raízes peludas podem manter a fixação a ramos do tipo selvagem, resultando em plantas compostas16,20. As raízes transformadas em Ri podem simular raízes normais, fornecendo materiais experimentais para verificação e análise das funções gênicas35. Esse sistema de transformação é indicado para plantas de difícil regeneração, como o guandu, que apresenta baixa frequência de regeneração36,37. No entanto, como apenas as raízes peludas são transgênicas, a função dos genes em todo o nível da planta não pode ser avaliada, e as características transgênicas também não podem ser transmitidas à prole por meio da reprodução sexuada.
Nesse esquema, A. rhizogenes portadores de vetores binários podem induzir raízes pilosas transgênicas por meio de um protocolo eficiente e estável. As etapas básicas do método de transformação foram descritas na forma de um fluxograma (Figura 1A). Após 1 semana de inoculação com A. rhizogenes, foram observados calos nas feridas do caule. Após 3 semanas, os calos se diferenciaram em raízes pilosas (Figura 1B). Este método é significativo porque não requer cultura in vitro , portanto, raízes pilosas foram obtidas em 5 semanas (Figura 1). Meng et al. conduziram uma série de experimentos semelhantes com este método em diferentes plantas, e os resultados mostraram que a maioria das plantas poderia obter raízes transgênicas com o gene alvo dentro de 2 meses21. O feijão bóer, um órfão rico em proteínas, está crescendo nas regiões dos trópicos semiáridos37. O ambiente de cultura quente e úmido afeta o crescimento do guandu, podendo ocorrer fenótipodecíduo 21; O fenótipo pode ser restaurado removendo a tampa de plástico.
Durante esses experimentos, muitos fatores devem ser cuidadosamente considerados para obter raízes transformadas rapidamente. O estado sanitário das mudas após a inoculação é a chave para o sucesso deste experimento21. Estudos anteriores mostraram que A. rhizogenes pode induzir raízes pilosas no ponto de inoculação durante vários estágios de crescimento das mudas38. No entanto, o status de crescimento das semeaduras afeta diretamente a eficiência da transformação26. A inoculação prematura de A. rhizogenes pode inibir o crescimento de plântulas e até causar a morte de plântulas39,40. Para obter a máxima eficiência de transformação, A. rhizogene é geralmente inoculado em mudas com 7 dias de idade. Além disso, a umidade do ar também é um fator importante que afeta a proliferação de calos. A remoção prematura do plástico após a inoculação com A.rhizogenes pode levar ao escurecimento do calo e à morte das raízes adventícias. Este estudo utilizou dois métodos de confirmação diferentes para identificar raízes transgênicas positivas: amplificação por PCR do gene inserido e detecção de fluorescência GFP. Os resultados do teste confirmaram a conversão bem-sucedida. A eficiência de conversão é tão alta quanto 75%.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes conhecidos ou relacionamentos pessoais que possam ter influenciado o trabalho relatado neste artigo.
Agradecimentos
Os autores agradecem o apoio financeiro da Fundação Nacional de Ciências Naturais da China (31800509, 31922058), Fundo de Jovens Talentos de Destaque na Universidade Florestal de Pequim" (2019JQ03009), os Fundos de Pesquisa Fundamental para as Universidades Centrais (2021ZY16), Fundação Municipal de Ciências Naturais de Pequim (6212023) e Programa Nacional de P&D da China (2018YFD1000602,2019YFD1000605-1) e Centro de Inovação Avançada de Pequim para Melhoramento de Árvores por Design Molecular. Gostaria de agradecer a Zhengyang Hou por sua orientação ao escrever o artigo e ao professor Meng Dong por sua orientação sobre a ideia do artigo.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.1 mL qPCR 8-strip tube (with optical caps) | KIRGEN, Shanghai, China | KJ2541 | |
| ABA | Solarbio Life Science, Beijing, China | A8060 | |
| Agar powder | Solarbio Life Science, Beijing, China | A8190 | |
| Centrifuge | Osterode am Harz, Germany | d37520 | |
| CFX Connect TW Optics Module | Bio-rad, US | 1855200 | |
| constant temperature incubator | Shanghai Boxun Industry & Commerce Co., Ltd, Shanghai,China | BPX-82 | |
| Diposable Petri dish | Corning, US | ||
| Dry Bath | Gingko Bioscience Company/Coyote bioscience, China | H2H3-100C | |
| Eastep Total RNA Extraction Kit50 | Promega, Beijing, China | LS1030 | |
| Electronic balance | Tianjin, China | TD50020 | |
| Filter pape | Hangzhou wohua Filter Paper Co., Ltd, China | ||
| FiveEasy Plus | Mettler Toledo, Shanghai, China | 30254105 | |
| Flowerpot 9*9 | China | ||
| JA | Solarbio Life Science, Beijing, China | J8070 | |
| Kan | Solarbio Life Science, Beijing, China | K8020 | |
| MagicSYBR Mixture | CWBIO, Beijing, China | CW3008M | |
| Mini Microcentrifuge | Scilogex, Beijing, China | S1010E | |
| NaCl | Solarbio Life Science, Beijing, China | S8210 | |
| NanPhotometer N50 Touch | IMPLEN GMBH, Germany | T51082 | |
| Purelab untra | |||
| Rifampicin | Solarbio Life Science, Beijing, China | R8010 | |
| Seedling box 30*200 | China | ||
| Thermal Cycler PCR | Bio-rad, US | T100 | |
| Thermostatic oscillator | Beijing donglian Har lnstrument Manufacture Co.,Ltd,China | DLHE-Q200 | |
| Tomy Autoclave | Tomy, Japan | SX-500 | |
| Tryptone | Solarbio Life Science, Beijing, China | LP0042 | |
| UEIris II RT-PCR System for First-Strand cDNA Synthesis( with dsDNase) | US Everbright INC, Jiangsu, China | R2028 | |
| Yeast Extract powder | Solarbio Life Science, Beijing, China | LP0021 |
Referências
- Poland, J. A., Rife, T. W. Genotyping-by-sequencing for plant breeding and genetics. The Plant Genome. 5 (3), (2012).
- Barabaschi, D., et al. Next generation breeding. Plant Science. 242, 3-13 (2016).
- Petri, C., Webb, K., Hily, J. -M., Dardick, C., Scorza, R. High transformation efficiency in plum (Prunus domestica L.): a new tool for functional genomics studies in Prunus spp. Molecular Breeding. 22 (4), 581-591 (2008).
- Tang, H., Ren, Z., Reustle, G., Krczal, G. Plant regeneration from leaves of sweet and sour cherry cultivars. Scientia Horticulturae. 93 (3-4), 235-244 (2002).
- Yang, L., et al. Response of plant secondary metabolites to environmental factors. Molecules. 23 (4), 762(2018).
- Ross, J. J., Weston, D. E., Davidson, S. E., Reid, J. B. Plant hormone interactions: how complex are they. Physiologia Plantarum. 141 (4), 299-309 (2011).
- Meng, D., et al. The pigeon pea CcCIPK14-CcCBL1 pair positively modulates drought tolerance by enhancing flavonoid biosynthesis. The Plant Journal. , (2021).
- Wen, W., Alseekh, S., Fernie, A. R. Conservation and diversification of flavonoid metabolism in the plant kingdom. Current Opinion in Plant Biology. 55, 100-108 (2020).
- Shah, A., Smith, D. L. Flavonoids in agriculture: Chemistry and roles in, biotic and abiotic stress responses, and microbial associations. Agronomy. 10 (8), 1209(2020).
- Zhang, W., Jiang, W. UV treatment improved the quality of postharvest fruits and vegetables by inducing resistance. Trends in Food Science & Technology. 92, 71-80 (2019).
- Koyama, R., et al. Exogenous abscisic acid promotes anthocyanin biosynthesis and increased expression of flavonoid synthesis genes in Vitis vinifera× Vitis labrusca table grapes in a subtropical region. Frontiers in Plant Science. 9, 323(2018).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- Veena, V., Taylor, C. G. Agrobacterium rhizogenes: recent developments and promising applications. In Vitro Cellular & Developmental Biology-Plant. 43 (5), 383-403 (2007).
- Lacroix, B., Citovsky, V. Pathways of DNA transfer to plants from Agrobacterium tumefaciens and related bacterial species. Annual Review of Phytopathology. 57, 231-251 (2019).
- Guan, Y., Li, S. -G., Fan, X. -F., Su, Z. -H. Application of somatic embryogenesis in woody plants. Frontiers in Plant Science. 7, 938(2016).
- Alpizar, E., et al. Efficient production of Agrobacterium rhizogenes-transformed roots and composite plants for studying gene expression in coffee roots. Plant Cell Reports. 25 (9), 959-967 (2006).
- Hwang, H. -H., Yu, M., Lai, E. -M. Agrobacterium-mediated plant transformation: biology and applications. The Arabidopsis Book. 15, (2017).
- Srivastava, S., Srivastava, A. K. Hairy root culture for mass-production of high-value secondary metabolites. Critical Reviews in Biotechnology. 27 (1), 29-43 (2007).
- Porter, J. R., Flores, H. Host range and implications of plant infection by Agrobacterium rhizogenes. Critical Reviews in Plant Sciences. 10 (4), 387-421 (1991).
- Fan, Y. -l, et al. One-step generation of composite soybean plants with transgenic roots by Agrobacterium rhizogenes-mediated transformation. BMC Plant Biology. 20, 1-11 (2020).
- Meng, D., et al. Development of an efficient root transgenic system for pigeon pea and its application to other important economically plants. Plant Biotechnology Journal. 17 (9), 1804-1813 (2019).
- Ma, R., et al. Agrobacterium-Mediated genetic transformation of the medicinal plant Veratrum dahuricum. Plants. 9 (2), 191(2020).
- Mi, Y., et al. Inducing hairy roots by Agrobacterium rhizogenes-mediated transformation in tartary buckwheat (Fagopyrum tataricum). Journal of Visualized Experoments: JoVE. (157), (2020).
- Cordovez, V., et al. Plant phenotypic and transcriptional changes induced by volatiles from the fungal root pathogen Rhizoctonia solani. Frontiers in Plant Science. 8, 1262(2017).
- Trovato, M., Mattioli, R., Costantino, P. From A. rhizogenes RolD to plant P5CS: exploiting proline to control plant development. Plants. 7 (4), 108(2018).
- Van Altvorst, A. C., et al. Effects of the introduction of Agrobacterium rhizogenes rol genes on tomato plant and flower development. Plant Science. 83 (1), 77-85 (1992).
- Bahramnejad, B., Naji, M., Bose, R., Jha, S. A critical review on use of Agrobacterium rhizogenes and their associated binary vectors for plant transformation. Biotechnology Advances. 37 (7), 107405(2019).
- Gutierrez-Valdes, N., et al. Hairy root cultures-a versatile tool with multiple applications. Frontiers in Plant Science. 11, (2020).
- Che, P., et al. Developing a flexible, high-efficiency Agrobacterium-mediated sorghum transformation system with broad application. Plant Biotechnology Journal. 16 (7), 1388-1395 (2018).
- Keshavareddy, G., Kumar, A., Ramu, V. S. Methods of plant transformation-a review. International Journal of Current Microbiology and Applied Sciences. 7 (7), 2656-2668 (2018).
- Lacroix, B., Citovsky, V. Beyond Agrobacterium-mediated transformation: horizontal gene transfer from bacteria to eukaryotes. Agrobacterium Biology. , 443-462 (2018).
- Sarkar, S., Ghosh, I., Roychowdhury, D., Jha, S. Biotechnological approaches for medicinal and aromatic plants. , Springer. 27-51 (2018).
- Singh, R. S., et al. Biotechnological Approaches for Medicinal and Aromatic Plants. , Springer. 235-250 (2018).
- Bahramnejad, B., Naji, M., Bose, R., Jha, S. A critical review on use of Agrobacterium rhizogenes and their associated binary vectors for plant transformation. Biotechnology Advances. 37 (7), 107405(2019).
- Meng, D., et al. Development of an efficient root transgenic system for pigeon pea and its application to other important economically plants. Plant Biotechnology Journal. 17 (9), 1804-1813 (2019).
- Surekha, C., et al. Agrobacterium-mediated genetic transformation of pigeon pea (Cajanus cajan (L.) Millsp.) using embryonal segments and development of transgenic plants for resistance against Spodoptera. Plant Science. 169 (6), 1074-1080 (2005).
- Saxena, K. Genetic improvement of pigeon pea-a review. Tropical Plant Biology. 1 (2), 159-178 (2008).
- Hada, A., et al. Improved Agrobacterium tumefaciens-mediated transformation of soybean [Glycine max (L.) Merr.] following optimization of culture conditions and mechanical techniques. In Vitro Cellular & Developmental Biology-Plant. 54 (6), 672-688 (2018).
- Foti, C., Pavli, O. High-efficiency Agrobacterium rhizogenes-mediated transgenic hairy root induction of lens culinaris. Agronomy. 10 (8), 1170(2020).
- Bhattacharya, A., Sood, P., Citovsky, V. The roles of plant phenolics in defence and communication during Agrobacterium and Rhizobium infection. Molecular Plant Pathology. 11 (5), 705-719 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados