Method Article
Обнаружение накопления амилоидного β с помощью иммунофлуоресцентного окрашивания на мышиной модели болезни Альцгеймера
* Эти авторы внесли равный вклад
В этой статье
Резюме
В невропатологии болезни Альцгеймера одной из наиболее важных характеристик является отложение амилоид-β. В данном протоколе мы описываем метод иммунофлуоресцентного окрашивания у трансгенных мышей с 5×FAD для выявления накопления амилоидного β в бляшках. Процесс перфузии, криосекции, окрашивания и количественной оценки будет подробно описан.
Аннотация
Болезнь Альцгеймера (БА) — это нейродегенеративное заболевание, которое способствует развитию 60-70% деменции во всем мире. Одним из признаков болезни Альцгеймера, несомненно, является накопление амилоид-β (Aβ) в мозге. Aβ образуется в результате протеолитического расщепления белка-предшественника бета-амилоида (APP) β-секретазой и γ-секретазой. В патологических условиях повышенное β-расщепление АПП приводит к гиперпродукции Aβ, которая агрегируется в Aβ-бляшки. Поскольку бляшки Aβ являются характерной чертой патологии БА, обнаружение количества Aβ очень важно в исследованиях БА. В этом протоколе мы представляем метод иммунофлуоресцентного окрашивания для визуализации осаждения Aβ. Мышиная модель, используемая в наших экспериментах, — 5×FAD, которая несет пять мутаций, обнаруженных в семейной болезни Альцгеймера человека. Невропатологический и поведенческий дефицит мышей 5xFAD хорошо задокументирован, что делает его хорошей моделью для изучения патологии Aβ на животных. Мы внедрим процедуру, включающую транскардиальную перфузию, криосекцию, иммунофлуоресцентное окрашивание и количественную оценку для выявления накопления Aβ у мышей 5×FAD. С помощью этого протокола исследователи могут исследовать патологию Aβ на мышиной модели с болезнью Альцгеймера.
Введение
Болезнь Альцгеймера (БА) – это нейродегенеративное заболевание, которое вызывает 60-70% деменции во всем мире и требует больших социальных ресурсов1. Хорошо известно, что накопление амилоид-β (Aβ) является патологическим признаком болезни Альцгеймера. Белок-предшественник амилоида (APP) — это интегральный мембранный белок, который существует во многих тканях. Аβ-пептид, состоящий из 36-42аминокислот2, продуцируется последующим расщеплением β- и γ-секретазы в APP 3,4. Изменения в расщеплении APP и мутации в гене APP приводят к гиперпродукции Aβ. Молекулы Aβ могут агрегировать с образованием олигомеров или фибрилл, которые считаются нейротоксичными 5,6. В предыдущих исследованиях было продемонстрировано, что накопление Aβ коррелирует с гибелью нейронов приБА 7,8,9.
Трансгенные мыши 5×FAD (C57BL/6J) содержат 3 мутации в APP и 2 мутации в PSEN1. Накопление внутриклеточного Aβ начинается уже в возрасте 1,5 месяца. Внеклеточное накопление Aβ было обнаружено примерно через 2 месяца в коре головного мозга и гиппокампе. Накопление быстро увеличивалось с10 годами. Хорошо задокументированная патология Aβ делает его хорошей моделью на животных для нашего протокола.
Целью описанного метода окрашивания является визуализация и количественная оценка отложения Aβ в мозге модели мышей с болезнью Альцгеймера. Будет введена процедура, включающая транскардиальную параформальдегидную перфузию, криосекцию, иммунофлуоресцентное окрашивание и количественное определение для выявления накопления Aβ у мышей 5×FAD. Этот протокол является надежным и простым методом исследования патологии Aβ на мышиной модели БА.
протокол
Все экспериментальные процедуры были проведены с одобрения Комитета по уходу за животными и их использованию Медицинского университета Сюйчжоу и в соответствии с руководящими принципами китайского правительства по уходу и использованию лабораторных животных.
1. Перфузия мышей
ПРИМЕЧАНИЕ: Более подробную информацию о процедуре перфузии можно найти в видео из лаборатории Вильяма Шейна 11.
- Обезболить трансгенных мышей 5×FAD (C57BL/6J) 1% пентобарбитала натрия (50 мг/кг массы тела) путем внутрибрюшинного введения12,13. Потеря реакции на щипывание задних лап свидетельствует о правильной анестезии. Не приступайте к перфузии до тех пор, пока мышь не будет должным образом обезболиваена.
- С помощью четырех штифтов закрепите конечности на пенопластовой доске. Поместите брюшную полость мыши, находящейся под наркозом, вверх, при этом ее конечности должны быть адекватно вытянуты. С помощью ножниц для радужной оболочки глаза сделайте разрез на мечевидном отростке. Тогда диафрагма будет оголена.
- Хирургическими ножницами сделайте разрез на диафрагме, и осторожно продолжайте разрез диафрагмы до верхней границы грудной клетки. Разрежьте ребра и грудные мышцы, рассеките прикрепленные ткани, чтобы обнажить сердце.
- Найдите подходящий атриум мыши. Разрежьте правое предсердие с помощью ножниц для ирисов.
- Введите 20 мл PBS 37 °C (0,01 М, pH 7,2-7,4) из левого желудочка сердца для промывания крови. Затем медленно введите 20 мл 4% PFA комнатной температуры из левого желудочка для фиксации тканей. Скорость инъекции PBS и 4% PFA составляет около 5 мл/мин. Фиксирующий тремор должен наблюдаться в течение нескольких секунд.
ВНИМАНИЕ: 4% PFA может раздражать глаза и дыхательные пути, а также может спровоцировать аллергические реакции. Этот шаг следует делать в проветриваемых местах, а оператор должен быть одет в защитные очки и маски для лица. - С помощью хирургических ножниц отрежьте голову, а затем аккуратно удалите черепную коробку, используйте рассекающие щипцы и извлеките мозг. Затем погрузите мозг в 4 мл 4% PFA в пластиковую пробирку объемом 5 мл на 12-24 часа при 4 °C.
2. Встраивание и криосекция
- После фиксации в 4% PFA перенесите мозг в 4 мл 15% сахарозы в пластиковой пробирке объемом 5 мл при температуре 4 °C. Через 12-24 ч мозг должен опуститься на дно.
- Перенесите мозг в 4 мл 30% сахарозы в пластиковую пробирку объемом 5 мл при температуре 4 °C в течение 12-24 часов. Затем мозг готов к встраиванию. Целью ступенчатого замачивания 15% и 30% сахарозы является обезвоживание мозга, что позволяет избежать образования кристаллов льда внутри клеток во время встраивания и криосекции. Обезвоженный мозг может храниться при температуре 4°C в течение одной недели.
- Оставьте примерно 1 мл сахарозы вместе с мозгом в трубке. Затем добавьте в трубку такой же объем состава оптимальной температуры резки (OCT) и хорошенько перемешайте. Это помогает ОКТ-соединению более адекватно оборачивать мозг.
- Нанесите толстый слой ОКТ-соединения на поверхность ручки и заморозьте при -21 °C перед криосекцией. Разрежьте мозг сагиттально от середины; Используйте обе половины для разрезания в криостате.
- После того как ОКТ-соединение застынет, установите ручку на головку образца и вдавите ее в поверхность платформы. Положите одну половину мозга на обрезанную поверхность средней стороной вниз.
- Наденьте кольцо из фольги вокруг мозга, чтобы избежать утечки соединения ОКТ, а затем заполните кольцо соединением ОКТ до тех пор, пока мозг не будет погружен в воду. Когда закладка OCT компаунда затвердевает, она готова к резке.
- Установите толщину сечения равной 20 мкм. Установите температуру камеры на -21 °C, а температуру головки образца на -19 °C. Разрез мозга от рострального конца до каудального конца.
- Нанесите немного PBS на предметные стекла. Предварительно покройте стекла полилизином, чтобы предотвратить отслаивание секций. Прикрепите секцию к предметному стеклу. Если секция сложена, используйте мягкую щетку, чтобы развернуть секции с помощью PBS.
- Просушите срезы в течение ночи при комнатной температуре и храните при температуре -20 °C. Срезы можно хранить при температуре -20 °C в течение одного месяца до окрашивания Aβ.
3. Процедура окрашивания Aβ
- Прогрейте срезы при комнатной температуре, высушите поверхность предметного стекла и с помощью гидрофобной ручки нарисуйте круг вокруг среза для инкубации антител.
- Замочите предметное стекло в PBS в пластиковой коробке для окрашивания объемом 30 мл, чтобы смыть ОКТ-соединение. Используйте не менее 20 мл PBS.
- Добавьте на предметное стекло 100 мкл 1x раствора для извлечения антигена для замороженных срезов. Выдерживать 5 минут при комнатной температуре.
- Промыть раствор для извлечения не менее чем 20 мл PBS комнатной температуры 3 раза (по 5 минут на каждый).
- Разбавленное первичное антитело (6E10) добавить на срезы и инкубировать при 4 °C в течение 16-24 ч во влажном темном боксе (раствор для разведения первичного антитела: 1% BSA, 0,3% Triton X-100, 0,01% азид натрия в PBS, разведение 1:500). BSA функционирует как блокирующий агент.
- Промойте секции PBS 3 раза, каждый раз по 5 минут.
ПРИМЕЧАНИЕ: Выполняйте шаги 3.7, 3.8 и 3.9 в темном месте. - Инкубируйте срезы во вторичном растворе антител (Goat anti-Mouse IgG (H+L) Alexa Flour 594, разбавленном PBS 1:200) в течение 1 ч при комнатной температуре во влажной темной коробке.
- Смойте вторичное антитело со срезов не менее чем 20 мл PBS в течение 3 раз, каждый раз по 5 минут.
ПРИМЕЧАНИЕ: Не наливайте PBS на секции во время стирки, чтобы предотвратить отклеивание секций. Следите за тем, чтобы секции были влажными. - Впитайте жидкость вокруг секций и добавьте каплю монтажного материала на каждую секцию. Загерметизируйте секции покровным стеклом, не допуская образования пузырей.
- Рассмотрите окрашенные срезы с помощью флуоресцентного микроскопа. Поддерживайте неизменность параметров изображения, чтобы избежать деривации. Храните предметные стекла при температуре 4°C в темном месте. Анализируйте срезы в течение одной недели, так как окрашивание со временем потускнеет.
4. Визуализация и количественная оценка накопления Aβ с помощью ImageJ
- Получение изображений с помощью флуоресцентного микроскопа, подключенного к цифровой камере и программному обеспечению для обработки изображений. Мы использовали программное обеспечение Image Pro Plus, и параметр визуализации был установлен следующим образом: Exp Pvw: 450 мс, Exp Acq: 450 мс; Pvw: 1 × 1, Acq: 1 × 1; Разрешение Pvw: ширина 1 × высота 1, разрешение acq: ширина 1 × высота 1; Глубина захвата: 8-битное моно; Усиление: Pvw: 13, Acq: 13, Gamma: Pvw: 1, ACQ: 1, Offse: Pvw: -700, ACQ: -700.
- В ImageJ Fiji 2.0.0 (https://imagej.net/Fiji) выберите Плагины | Сшивание | MosaicJ в меню. Затем выберите Файлы | Откройте Image Sequence , чтобы открыть изображения, которые нужно сшить (Рисунок 1A).
- Все выбранные изображения будут отображаться внизу. После сшивания изображений вручную выберите Файл | Создайте мозаику (рисунок 1B, C, D).
- Выбрать изображение | Настройка | Яркость/Контрастность ..., и отрегулируйте яркость и контрастность изображения (рис. 3A). После этого изображение можно сохранить (рис. 1E).
- Чтобы количественно оценить накопление Aβ, откройте изображение через Файл | Открытый... в меню (рисунок 2A).
- Выбрать изображение | Тип | 8-бит для настройки изображения до 8-бит. Затем выберите область, которую необходимо подсчитать, с помощью выделения полигона (Рисунок 2B).
- Выбрать изображение | Настройка | Threshold для выбора правильного порога сигналов. Порог можно настроить с помощью перетаскивания полос прокрутки или изменить числа непосредственно в текстовом поле (максимум: 255, минимум: 0). Когда все сигналы Aβ в разделе стали красными, порог подходит для измерения (Рисунок 2C). Убедитесь, что установлен флажок «Темный фон».
- Выбор команды «Анализ» | Установите мерку... В меню выбрать параметры, которые будут отображаться в результатах. Убедитесь, что выбраны параметры Интегрированная плотность и предел порогового значения . Целью измерения является интегральная плотность (общая интенсивность) (рисунок 2D).
- Выберите «Анализ» | Измерьте , чтобы получить результаты. Результаты будут отображены и готовы к статистическому анализу (Рисунок 2E).
Результаты
С помощью описанных выше процедур иммунофлуоресцентного окрашивания мы исследовали отложение накопления Aβ у мышей разного возраста с 5×FAD. На рисунке 3 представлены типичные и неоптимальные результаты с использованием нашего протокола. Срезы мозга 5×месячных и 8-месячных гетерозиготных трансгенных мышей 5FAD и 4-6-месячного контроля дикого типа окрашивали антителами 6E10 и детектировали под флуоресцентным микроскопом. На рисунке 3А показано накопление Aβ в бляшках в сагиттальном отделе мозга мыши. Они в основном откладываются в коре головного мозга и гиппокампе, с наибольшей плотностью в субикулуме гиппокампа, что согласуется с предыдущимисследованием 10. Как видно на изображении, накопление Aβ было четко обнаружено антителом у мышей 5×FAD. Интегральная плотность (интегрированная плотность = Площадь × Среднее. Интегральная плотность: сумма интенсивности флуоресценции этой области; Средняя: средняя интенсивность флуоресценции на определенной территории; Площадь: площадь положительного флуоресцентного сигнала на изображении) накопления Aβ у мышей с 5 м 5×FAD была достоверно выше, чем у мышей с 5 м 5×FAD (t-критерий непарных студентов, p = 0,0071), что свидетельствует о том, что накопление Aβ будет постепенно увеличиваться с возрастом. Кроме того, в контроле дикого типа не наблюдалось сигнала Aβ, что свидетельствует о специфичности антитела к 6E10. Некоторые неоптимальные результаты (8-месячная гетерозиготная трансгенная мышь 5×FAD и 8-месячная контрольная мышь дикого типа) также показаны на рисунке 3C. К недостаткам относятся ломотка ломтиков и закрученный край. О том, как не допустить такой ситуации, пойдет речь. В целом, иммунофлуоресцентное окрашивание с использованием антител 6E10 против Aβ является специфическим методом, который позволяет легко количественно оценить накопление Aβ у мышей 5×FAD.
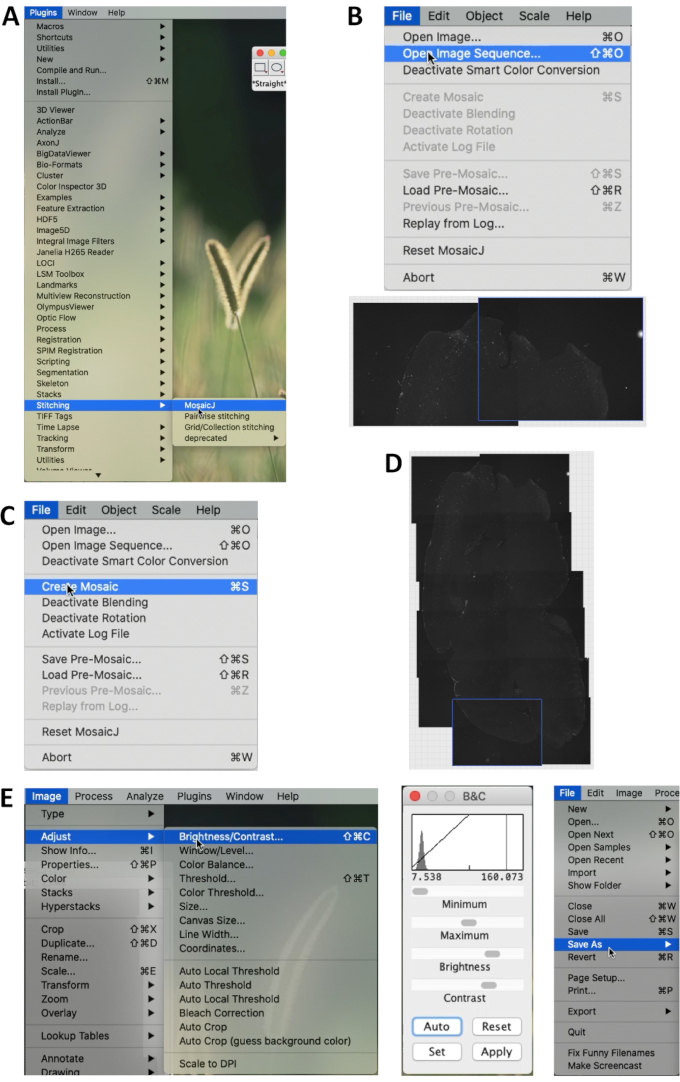
Рисунок 1. Сшивание изображений срезов мозга с помощью ImageJ. (A) В меню ImageJ/Fiji выберите Плагины | Сшивание | MosaicJ начать сшивание. (b) Выберите файл | Откройте Последовательность изображений и выберите изображения для сшивания. Сшивайте изображения вручную в соответствии с анатомическими структурами разреза. (C) После сшивания выберите Файл | Создайте мозаику, чтобы создать полное изображение раздела. (D) Пример сшитого изображения. (e) Выбрать изображение | Настройка | Яркость/контрастность... для регулировки яркости и контрастности всего изображения. На средней панели отображается меню настройки. Выбрать файл | Сохранить как... , чтобы сохранить изображение в формате Tiff или другом формате. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
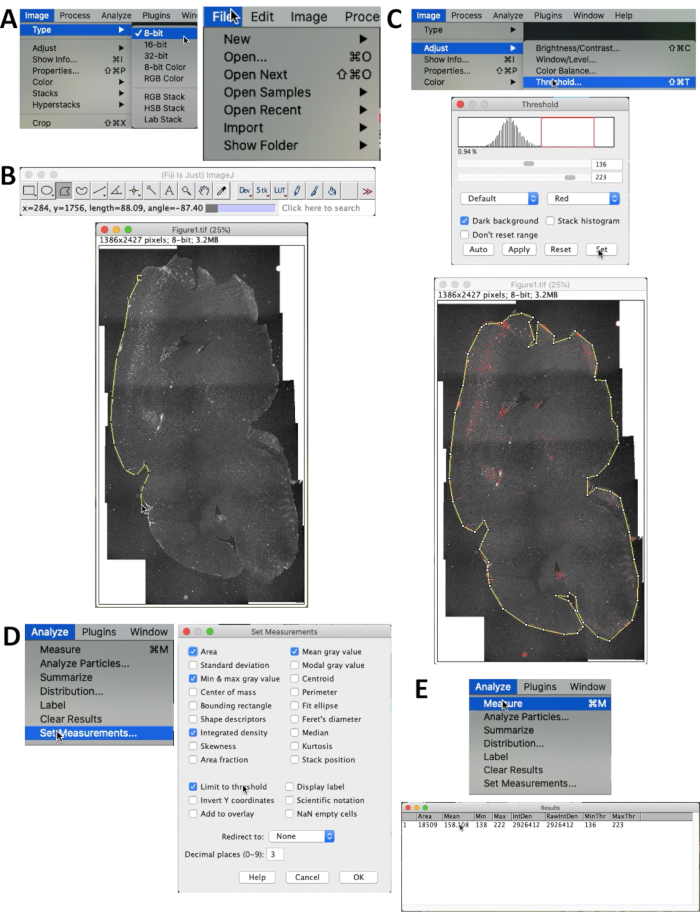
Рисунок 2. Метод количественного определения флуоресценции Aβ. (A) Установите тип изображения как 8-битный, выбрав Image | Тип | 8-битный. (B) Используйте выделение «Многоугольник » в меню ImageJ и изобразите контур всего мозга. (c) Выбрать изображение | Настройка | Порог... для исключения фонового шума. Убедитесь, что установлен флажок Темный фон . Перетащите красные линии или полосы прокрутки, пока флуоресценция Aβ не будет должным образом выделена. (d) Использование функции «Анализ» | Установите Измерения , чтобы выбрать, что будет представлено в таблице результатов, и задайте метод подсчета. Отображается меню Установить измерения. Убедитесь, что выбраны Интегрированная плотность и Предел порогового значения . (e) Выберите «Анализировать » | Измерьте , чтобы получить результаты. Интегральная плотность (отображается как IntDen) представляет собой общую интенсивность флуоресценции Aβ (Интегрированная плотность = Средняя площадь ×). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3. Репрезентативные результаты иммунофлуоресцентного окрашивания отложения Aβ у мышей 5×FAD. (A) Иммуноокрашивание отложения Aβ в сагиттальном отделе 5×месячных и 8-месячных трансгенных мышей с 5FAD и 4-6-месячных мышей дикого типа с использованием антител к Aβ 6E10. Изображения были получены с помощью флуоресцентного микроскопа с объективом 4x или 20x. Верхняя панель, сшиты целые изображения мозга в нижнем увеличении. Нижняя панель, кора изображения в большем увеличении. Как видно из белых стрелок, признаки цветения отложения Aβ отчетливо наблюдались в группах 5×FAD, но сигнал Aβ не наблюдался в группе дикого типа. (B) Гистограмма показывает количественный анализ общей интенсивности (интегрированная плотность = площадь × среднее) флуоресценции Aβ в мозге 5×месячных и 8-месячных трансгенных мышей с 5FAD. t-критерий непарных студентов: **, p < 0,01 (n = 3 для каждой группы). (C) Случаи субоптимальных срезов при иммунофлуоресцентном окрашивании, представляющие 8-месячную трансгенную мышь 5×FAD и 8-месячную контрольную мышь дикого типа. Слева, разрыв секции; Правый, загнутый край участка. Масштабная линейка, 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Иммунофлуоресцентное окрашивание с использованием антител 6E10 может специфически обнаруживать накопление Aβ в мозге, которое легко количественно определить с помощью изображения J. Стоит отметить, что некоторые важные шаги в этом протоколе могут повлиять на результаты.
Чтобы предотвратить отслаивание или поломку срезов, показанных на рисунке 3C, следует обратить внимание на несколько ключевых моментов. Перфузия должна протекать быстро после выполнения разреза на диафрагме из-за необратимых патофизиологических эффектов, вызванных гипоксией. Эти эффекты могут оказать глубокое влияние на результаты11. Перед криосекцией мозговая ткань должна быть правильно зафиксирована и обезвожена. Для криостата должна быть правильно установлена температура (камера -21 °C, головка образца -19 °C), а также необходимо проверить положение режущего лезвия и пластины для предотвращения крена. На режущем лезвии или пластине защиты от крена не должно быть пыли или инея, и они должны быть расположены правильно. Секции также должны быть правильно выровнены перед прикреплением. Кроме того, предметные стекла должны быть предварительно покрыты, чтобы предотвратить отслоение срезов во время окрашивания. К популярным методам относится полилизиновое или желатиновое покрытие. Адгезивные стекла микроскопа с полилизиновым покрытием можно купить в компаниях.
Некоторые этапы процесса окрашивания также повлияют на результаты. Перед инкубацией на срезы следует нанести раствор для извлечения антигена, чтобы обеспечить полное воздействие антигена. Для того чтобы предотвратить испарение первичного антитела во время инкубации, срезы следует инкубировать во влажном боксе. Кроме того, после инкубации вторичных антител срезы следует хранить в темноте, чтобы избежать гашения флуоресценции. Для обнаружения Aβ было разработано несколько методов окрашивания, таких как окрашивание тиофлавином-S, окрашивание Congo Red и окрашивание серебром Gallyas, но иммунофлуоресцентное окрашивание с использованием антител 6E10 имеет уникальные преимущества. Тиофлавин-S и Congo Red могут связываться со всеми β-листами, содержащими белки, поэтому эти химические красители менее специфичны для обнаружения Aβ14,15. По сравнению с химическим окрашиванием, иммунофлуоресцентное окрашивание является более специфичным. Моноклональное антитело 6E10 против Aβ является специфически реакционноспособным к аминокислотным остаткам 4-10 Aβ, согласно предыдущему картированию высокого разрешения16. Предыдущие исследования также показали, что иммуноокрашивание с использованием антител 6E10 может обнаружить большее отложение бляшек, чем окрашивание серебром по шкале Галлиаса и окрашивание тиофлавином-S, что указывает на то, что обнаружение Aβ с использованием антител может быть более чувствительным,чем химические методы окрашивания. Тем не менее, критическим ограничением окрашивания 6E10 является то, что это антитело все еще может распознавать полноразмерный APP и другие расщепленные пептиды, содержащие эпитоп 6E10, но сигнал флуоресценции за пределами бляшек Aβ очень слаб у мышей 5xFAD. Предыдущие исследования показали, что антитела 6E10 связываются с пептидами Aβ как конформационным, так и секвенционно-зависимым способами16. Несмотря на ограничения, этот протокол по-прежнему является практичным и специфическим методом, который может помочь исследователям исследовать Aβ-патологию болезни Альцгеймера.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано общим проектом Фонда естественных наук Китая (номер гранта: 81974157) от Фонда естественных наук Китая, специальной назначенной профессорской должностью Цзянсу (до C.L.) от Департамента образования Цзянсу, программой инновационных и предпринимательских команд провинции Цзянсу (для H.Z., A. L., W.W., C.L. и Y.S.), стартовым грантом для выдающихся талантов (D2019025) и Программой обучения инновациям и предпринимательству (201910313038Z до Z.S., Y.X., M.Z. и J.D.) в Медицинском университете Сюйчжоу. Это исследование также было поддержано Национальным демонстрационным центром экспериментального базового медицинского образования (Медицинский университет Сюйчжоу).
Материалы
| Name | Company | Catalog Number | Comments |
| Anesthetia | |||
| Injection syringe | KLMEDICAL | 1 mL | |
| Pentobarbitual sodium | Sigma-Aldrich | P3761 | 1% in saline for i.p. injection |
| Thoracotomy: | |||
| IRIS-Fine Straight iris scissors (~11.5 cm) | RWD | S12010-11 | |
| Sharp curved surgical scissors(11.5 cm) | RWD | S14016-11 | |
| Straight dissecting forceps (~10.5 cm) | RWD | F12010-10 | |
| Perfusion | |||
| Centrifugal tube (5 mL) | Biosharp | ||
| Injection syringe | KLMEDICAL | 20 mL | |
| Paraformaldehyde | Vicmed | VIH100 | |
| PBS 0.01M (PH7.2-7.4) powder | Vicmed | VC2001P | Add deionized water to make solution |
| Fixation, Dehydration and Cryosectioning | |||
| Adhesion microscope slides | CITOTEST | 188105 | 76.2 mm × 25.4 mm |
| Microtome Cryostat | LEICA | CM1950 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| Sucrose | VETEC | V900116 | |
| Immunofluorescence staining | |||
| Fluorescence microscope | OLYMPUS | IX-81 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Thermo Fisher Scientific | A-11005 | 200X |
| Image-Pro Plus 7.0C | Media Cybernetics | Scientific graphing and data analysis software | |
| Immunohistochemical Wet Box (black) | Sinylab | Customized | 300 mm × 100 mm × 38 mm, groove depth 27 mm, can contain 10 standard slides |
| Pipet | Thermo Scientific | ||
| Pipette tips | Well-offer | ||
| Plastic staining box | Sinylab | Customized | 30 mL, can contain 5 standard slides |
| Primary Antibody Dilution Buffer | made in our lab | 1% BSA 1g, 0.3% Triton X-100 300ul, 0.01% sodium azide 10mg in 100ml PBS | |
| Purified anti beta amyloid,1-16 antibody (6E10) | Biolegend | SIG-39320 | 500X |
| Quick Antigen Retrieval Solution for Frozen Sections | KeyGEN BioTECH | KGIHC005 | 5X |
| Quantification | |||
| Graphpad Prism 8.0.1 | Graphpad | Medical mapping software | |
| Image J Fiji 2.0.0 | National Institute of Health | Scientific graphing and data analysis software |
Ссылки
- Burns, A., Iliffe, S. Alzheimer's disease. BMJ. 338, 158 (2009).
- Leong, Y. Q., Ng, K. Y., Chye, S. M., Ling, A. P. K., Koh, R. Y. Mechanisms of action of amyloid-beta and its precursor protein in neuronal cell death. Metabolic Brain Disease. 35 (1), 11-30 (2020).
- Tiwari, S., Atluri, V., Kaushik, A., Yndart, A., Nair, M. Alzheimer's disease: pathogenesis, diagnostics, and therapeutics. International Journal of Nanomedicine. 14, 5541-5554 (2019).
- Murphy, M. P., LeVine, H. Alzheimer's disease and the amyloid-beta peptide. Journal of Alzheimer's Disease. 19 (1), 311-323 (2010).
- Hardy, J. A., Higgins, G. A. Alzheimer's disease: the amyloid cascade hypothesis. Science. 256 (5054), 184-185 (1992).
- Reitz, C. Alzheimer's disease and the amyloid cascade hypothesis: a critical review. International Journal of Alzheimer's Disease. 2012, 369808 (2012).
- Bozyczko-Coyne, D., et al. CEP-1347/KT-7515, an inhibitor of SAPK/JNK pathway activation, promotes survival and blocks multiple events associated with Abeta-induced cortical neuron apoptosis. Journal of Neurochemistry. 77 (3), 849-863 (2001).
- Canevari, L., Abramov, A. Y., Duchen, M. R. Toxicity of amyloid beta peptide: tales of calcium, mitochondria, and oxidative stress. Neurochemical Research. 29 (3), 637-650 (2004).
- Zhu, X., et al. Oxidative stress signalling in Alzheimer's disease. Brain Research. 1000 (1-2), 32-39 (2004).
- Oakley, H., et al. Intraneuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer's disease mutations: potential factors in amyloid plaque formation. Journal of Neuroscience. 26 (40), 10129-10140 (2006).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- An, S., et al. Medial septum glutamatergic neurons control wakefulness through a septo-hypothalamic circuit. Current Biology. , (2021).
- Cao, J. L., et al. Activation of peripheral ephrinBs/EphBs signaling induces hyperalgesia through a MAPKs-mediated mechanism in mice. Pain. 139 (3), 617-631 (2008).
- Ly, P. T., Cai, F., Song, W. Detection of neuritic plaques in Alzheimer's disease mouse model. Journal of Visualized Experiments. (53), e2831 (2011).
- Klunk, W. E., Jacob, R. F., Mason, R. P. Quantifying amyloid beta-peptide (Abeta) aggregation using the Congo red-Abeta (CR-abeta) spectrophotometric assay. Analytical Biochemistry. 266 (1), 66-76 (1999).
- Hatami, A., Albay, R., Monjazeb, S., Milton, S., Glabe, C. Monoclonal antibodies against Abeta42 fibrils distinguish multiple aggregation state polymorphisms in vitro and in Alzheimer disease brain. Journal of Biological Chemistry. 289 (46), 32131-32143 (2014).
- Shi, X. Z., Wei, X., Sha, L. Z., Xu, Q. Comparison of beta-Amyloid Plaque Labeling Methods: Antibody Staining, Gallyas Silver Staining, and Thioflavin-S Staining. Chinese Medical Sciences Journal. 33 (3), 167-173 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
ISSN 1940-087X
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.