Method Article
الكشف عن تراكم β الأميلويد عن طريق تلطيخ الفلورسنت المناعي في نموذج فأر لمرض الزهايمر
* These authors contributed equally
In This Article
Summary
في علم الأمراض العصبية لمرض الزهايمر ، تتمثل إحدى أهم الخصائص في ترسب β الأميلويد. في هذا البروتوكول ، نصف طريقة تلطيخ الفلورسنت المناعي في الفأر المعدل وراثيا 5×FAD للكشف عن تراكم β الأميلويد في اللويحات. سيتم وصف عملية التروية والتشريح بالتبريد والتلوين والقياس الكمي بالتفصيل.
Abstract
مرض الزهايمر (AD) هو مرض تنكسي عصبي يساهم في 60-70٪ من الخرف في جميع أنحاء العالم. تكمن إحدى السمات المميزة لمرض الزهايمر بلا شك في تراكم β الأميلويد (Aβ) في الدماغ. يتم إنتاج Aβ من الانقسام المحلل للبروتين للسلائف بيتا أميلويد (APP) بواسطة β-secretase و γ-secretase. في الظروف المرضية ، يؤدي الانقسام المتزايد β ل APP إلى الإفراط في إنتاج Aβ ، والذي يتجمع في لويحات Aβ. نظرا لأن لويحات Aβ هي سمة من سمات أمراض مرض الزهايمر ، فإن اكتشاف كمية Aβ مهم جدا في أبحاث مرض الزهايمر. في هذا البروتوكول ، نقدم طريقة تلطيخ الفلورسنت المناعي لتصور ترسب Aβ. نموذج الفأر المستخدم في تجاربنا هو 5×FAD ، والذي يحمل خمس طفرات موجودة في AD العائلي البشري. تم توثيق العجز العصبي المرضي والسلوكي للفئران 5xFAD جيدا ، مما يجعلها نموذجا حيوانيا جيدا لدراسة أمراض Aβ. سنقدم الإجراء بما في ذلك نضح القلب ، والتقطيع بالتبريد ، والتلوين المناعي الفلوري ، والقياس الكمي للكشف عن تراكم Aβ في فئران 5×FAD. باستخدام هذا البروتوكول ، يمكن للباحثين التحقيق في علم أمراض Aβ في نموذج فأر AD.
Introduction
مرض الزهايمر (AD) هو مرض تنكسي عصبي يسبب 60٪ -70٪ من الخرف في جميع أنحاء العالم ويكلف الكثير من الموارد الاجتماعية1. من المعروف أن تراكم β الأميلويد (Aβ) هو سمة مميزة مرضية لمرض الزهايمر. بروتين سلائف الأميلويد (APP) هو بروتين غشائي متكامل موجود في العديد من الأنسجة. يتم إنتاج الببتيد Aβ ، الذي يتكون من 36-42 من الأحماض الأمينية2 ، عن طريق الانقسام اللاحق ل β- و γ-secretase في APP3،4. تؤدي التغييرات في انقسام APP والطفرات في جين APP إلى الإفراط في إنتاج Aβ. يمكن أن تتجمع جزيئات Aβ لتشكيل قلة أو ألياف ، والتي يعتقد أنها سامة للأعصاب5،6. في الدراسات السابقة ، ثبت أن تراكم Aβ مرتبط بموت الخلايا العصبية في7،8،9 بعد الميلاد.
تحتوي الفئران المعدلة وراثيا 5×FAD (C57BL / 6J) على 3 طفرات في APP ، وطفرتين في PSEN1. يبدأ تراكم Aβ داخل الخلايا في وقت مبكر من عمر 1.5 شهر. تم العثور على تراكم Aβ خارج الخلية حوالي شهرين ، في القشرة والحصين. زاد التراكم بسرعة مع سن10 سنوات. إن علم أمراض Aβ الموثق جيدا يجعله نموذجا حيوانيا جيدا لبروتوكولنا.
الهدف من طريقة التلوين الموصوفة هو تصور وقياس ترسب Aβ في دماغ نموذج الفئران المزيل بمرض الزهايمر. سيتم تقديم الإجراء بما في ذلك نضح بارافورمالديهايد عبر القلب ، والتقطيع بالتبريد ، والتلوين المناعي الفلوري ، والقياس الكمي للكشف عن تراكم Aβ في الفئران المصابة ب 5×FAD. هذا البروتوكول هو طريقة موثوقة وسهلة للتحقيق في علم أمراض Aβ في نموذج فأر AD.
Protocol
تم تنفيذ جميع الإجراءات التجريبية بموافقة اللجنة المؤسسية لرعاية واستخدامه في جامعة Xuzhou الطبية ووفقا للمبادئ التوجيهية للوائح الحكومية الصينية لرعاية واستخدام المختبر.
1. نضح الفئران
ملاحظة: يمكن الرجوع إلى مزيد من التفاصيل حول إجراء التروية إلى الفيديو من مختبر ويليام شاين 11.
- تخدير الفئران المعدلة وراثيا 5×FAD (C57BL / 6J) مع 1٪ بنتوباربيتال الصوديوم (50 مجم / كجم من وزن الجسم) عن طريق الحقن داخل الصفاق12،13. يشير فقدان الاستجابة لقرص المخلب الخلفي إلى التخدير المناسب. لا تبدأ التروية قبل تخدير الفأر بشكل صحيح.
- استخدم أربعة دبابيس لتثبيت الأطراف على لوح الرغوة. ضع بطن الفأر المخدر لأعلى ، مع شد أطرافه بشكل كاف. استخدم زوجا من مقص القزحية لعمل شق في عملية الخنجري. ثم سيتم الكشف عن الحجاب الحاجز.
- استخدم مقصا جراحيا لعمل شق في الحجاب الحاجز ، واستمر في شق الحجاب الحاجز بعناية إلى الحد العلوي للقفص الصدري. قطع الأضلاع والعضلات الصدرية ، وتشريح الأنسجة المرفقة لكشف القلب.
- ابحث عن الأذين الأيمن للماوس. اقطع الأذين الأيمن باستخدام مقص القزحية.
- حقن 20 مل من 37 درجة مئوية PBS (0.01 M، درجة الحموضة 7.2-7.4) من البطين الأيسر للقلب لطرد الدم. ثم حقن ببطء 20 مل من 4٪ PFA من درجة حرارة الغرفة من البطين الأيسر لإصلاح الأنسجة. يبلغ معدل حقن PBS و 4٪ PFA حوالي 5 مل / دقيقة. يجب ملاحظة رعشة التثبيت في غضون ثوان.
تحذير: يمكن أن يؤدي 4٪ من PFA إلى تهيج العينين والممرات الهوائية ، وقد تثير الحساسية. يجب أن تتم هذه الخطوة في أماكن جيدة التهوية ، ويجب على المشغل ارتداء نظارات واقية وأقنعة للوجه. - استخدم مقصا جراحيا لقطع الرأس ، وقم بإزالة الجمجمة بعناية ، واستخدم ملقط تشريح واستخراج الدماغ. ثم اغمر الدماغ في 4 مل من 4٪ PFA في أنبوب بلاستيكي سعة 5 مل لمدة 12-24 ساعة عند 4 درجات مئوية.
2. التضمين والتقطيع بالتبريد
- بعد التثبيت في 4٪ PFA ، انقل الدماغ إلى 4 مل من السكروز بنسبة 15٪ في أنبوب بلاستيكي سعة 5 مل عند 4 درجات مئوية. بعد 12-24 ساعة ، يجب أن يغرق الدماغ في القاع.
- انقل الدماغ إلى 4 مل من السكروز بنسبة 30٪ في أنبوب بلاستيكي سعة 5 مل عند 4 درجات مئوية لمدة 12-24 ساعة. ثم يكون الدماغ جاهزا للتضمين. الغرض من نقع السكروز التدريجي بنسبة 15٪ و 30٪ هو تجفيف الدماغ ، مما يتجنب تكوين بلورات الجليد داخل الخلايا أثناء التضمين والتقطيع بالتبريد. يمكن تخزين الدماغ المجفف عند 4 درجات مئوية لمدة أسبوع واحد.
- اترك ما يقرب من 1 مل من السكروز مع الدماغ في الأنبوب. ثم أضف نفس الحجم ، مركب درجة حرارة القطع المثلى (OCT) في الأنبوب واخلطه بشكل صحيح. هذا يساعد مركب OCT على لف الدماغ بشكل كاف.
- قم بتركيب طبقة سميكة من مركب OCT على سطح المقبض وقم بتجميدها عند -21 درجة مئوية قبل التقطيع بالتبريد. قطع الدماغ سهمي من الوسط. استخدم أي من النصفين للتقسيم في ناظم البرد.
- بعد أن يصلب مركب OCT ، قم بتركيب المقبض على رأس العينة وقم بقصه في سطح المنصة. ضع نصف الدماغ على السطح المشذب مع الجانب الأوسط لأسفل.
- ضع حلقة من ورق القصدير حول الدماغ لتجنب تسرب مركب OCT ، ثم املأ الحلقة بمركب OCT حتى يتم غمر الدماغ. عندما يتجمد تضمين مركب OCT ، يكون جاهزا للتقسيم.
- اضبط سمك القسم على 20 ميكرومتر. اضبط درجة حرارة الغرفة على -21 درجة مئوية ، ودرجة حرارة رأس العينة على -19 درجة مئوية. قسم الدماغ من النهاية المنقارية إلى النهاية الذيلية.
- قم بتنظيف بعض PBS على الشرائح الزجاجية. قم بتغطية الشرائح الزجاجية مسبقا بمادة بولي ليسين لمنع تقشير الأقطاع. قم بإرفاق القسم على الشريحة. إذا كان القسم مطويا ، فاستخدم فرشاة ناعمة لفتح الأقسام باستخدام PBS.
- جفف الأقسام طوال الليل في درجة حرارة الغرفة وتخزينها في درجة حرارة -20 درجة مئوية. يمكن الاحتفاظ بالأقسام عند -20 درجة مئوية لمدة تصل إلى شهر واحد قبل تلطيخ Aβ.
3. إجراء تلطيخ Aβ
- قم بتسخين الأقسام في درجة حرارة الغرفة ، وجفف سطح الشريحة ، واستخدم قلما كارها للماء لرسم دائرة حول القسم لحضانة الأجسام المضادة.
- انقع الشريحة في PBS في صندوق تلطيخ بلاستيكي سعة 30 مل لغسل مركب OCT. استخدم ما لا يقل عن 20 مل من PBS.
- أضف 100 ميكرولتر من محلول استرجاع المستضد 1x للأقسام المجمدة على الشريحة. احتضن لمدة 5 دقائق في درجة حرارة الغرفة.
- اغسل محلول الاسترجاع بما لا يقل عن 20 مل من PBS من درجة حرارة الغرفة لمدة 3 مرات (5 دقائق لكل منهما).
- أضف الجسم المضاد الأولي المخفف (6E10) على الأقسام واحتضانه عند 4 درجات مئوية لمدة 16-24 ساعة في صندوق رطب ومظلم (محلول تخفيف الأجسام المضادة الأولي: 1٪ BSA ، 0.3٪ Triton X-100 ، 0.01٪ أزيد الصوديوم في PBS ، تخفيف 1: 500). يعمل BSA كعامل حظر.
- اغسل الأقسام باستخدام PBS لمدة 3 مرات ، 5 دقائق في كل مرة.
ملاحظة: قم بتنفيذ الخطوات 3.7 و 3.8 و 3.9 في مكان مظلم. - احتضان الأقسام في محلول الأجسام المضادة الثانوية (الماعز المضاد للفأر IgG (H + L) Alexa Flour 594 ، المخفف ب PBS 1: 200) لمدة ساعة واحدة في درجة حرارة الغرفة في صندوق مبلل ومظلم.
- اغسل الجسم المضاد الثانوي من الأقسام بما لا يقل عن 20 مل من PBS لمدة 3 مرات ، 5 دقائق في كل مرة.
ملاحظة: لا تصب PBS على الأقسام أثناء الغسيل لمنع تقشير الأقسام. حافظ على الأقسام رطبة. - امتصاص السائل حول الأقسام وأضف قطرة من وسط التركيب في كل قسم. أغلق الأقسام بغطاء زجاجي ، وتجنب الفقاعات.
- راقب الأقسام الملطخة بالمجهر الفلوري. حافظ على اتساق معلمات التصوير لتجنب الاشتقاق. احتفظ بالشرائح عند 4 درجات مئوية في مكان مظلم. قم بتحليل الأقسام في غضون أسبوع واحد ، لأن التلوين سوف يتلاشى بمرور الوقت.
4. تصوير وقياس تراكم Aβ بواسطة ImageJ
- التقط الصور بواسطة مجهر مضان متصل بكاميرا رقمية وبرنامج تصوير. استخدمنا برنامج Image Pro Plus وتم تعيين معلمة التصوير على النحو التالي: Exp Pvw: 450 مللي ثانية ، Exp Acq: 450 مللي ثانية ؛ Pvw: 1 × 1 ، ACQ: 1 × 1 ؛ قرار Pvw: العرض 1 × الارتفاع 1 ، دقة ACQ: العرض 1 × الارتفاع 1 ؛ عمق الالتقاط: 8 بت أحادية اللون ؛ الكسب: Pvw: 13 ، Acq: 13 ، Gamma: Pvw: 1 ، Acq: 1 ، Offse: Pvw: -700 ، Acq: -700.
- في ImageJ Fiji 2.0.0 (https://imagej.net/Fiji) ، حدد الإضافات | خياطة | MosaicJ في القائمة. ثم حدد الملفات | افتح تسلسل الصورة لفتح الصور المراد خياطتها (الشكل 1 أ).
- سيتم عرض جميع الصور المحددة في الأسفل. بعد خياطة الصور يدويا ، حدد ملف | إنشاء فسيفساء (الشكل 1 ب ، ج ، د).
- حدد صورة | ضبط | السطوع / التباين ...، وضبط سطوع الصورة وتباينها (الشكل 3 أ). ثم يمكن حفظ الصورة (الشكل 1E).
- لتحديد تراكم Aβ ، افتح الصورة من خلال ملف | مفتوح... في القائمة (الشكل 2 أ).
- حدد صورة | النوع | 8 بت لضبط الصورة على 8 بت. ثم اختر المنطقة المراد عدها باستخدام تحديد المضلع (الشكل 2 ب).
- حدد صورة | ضبط | عتبة لتحديد العتبة المناسبة للإشارات. يمكن ضبط العتبة عن طريق سحب أشرطة التمرير أو تغيير الأرقام مباشرة في مربع النص (الحد الأقصى: 255 ، الحد الأدنى: 0). عندما تصبح جميع إشارات Aβ في القسم حمراء ، تكون العتبة مناسبة للقياس (الشكل 2C). تأكد من تحديد مربع الخلفية الداكنة .
- تحديد تحليل | تعيين القياس... في القائمة لاختيار المعلمات التي ستظهر في النتائج. تأكد من تحديد الكثافة المتكاملة والحد إلى الحد. الكثافة المتكاملة (الكثافة الكلية) هي هدف القياس (الشكل 2 د).
- حدد تحليل | قم بالقياس للحصول على النتائج. سيتم عرض النتائج وجاهزة للتحليل الإحصائي (الشكل 2 هاء).
النتائج
استخدمنا إجراءات تلطيخ الفلورسنت المناعي الموصوفة أعلاه للتحقيق في ترسب تراكم Aβ في فئران 5×FAD من مختلف الأعمار. يمثل الشكل 3 النتائج النموذجية والنتائج دون المستوى الأمثل باستخدام بروتوكولنا. تم تلطيخ شرائح الدماغ من الفئران المعدلة وراثيا 5×FAD متغايرة الزيجوت لمدة 5 أشهر و 8 أشهر والتحكم من النوع البري من 4 إلى 6 أشهر بجسم مضاد 6E10 وتم اكتشافها تحت المجهر الفلوري. يوضح الشكل 3 أ تراكم Aβ في اللويحات في القسم السهمي من دماغ الفأر. يتم ترسيبها بشكل أساسي في القشرة والحصين ، مع أعلى كثافة في تحت الحصين ، وهو ما يتوافق مع الدراسة السابقة10. كما تظهر الصورة ، تم اكتشاف تراكم Aβ بوضوح بواسطة الجسم المضاد في فئران 5×FAD. الكثافة المتكاملة (الكثافة المتكاملة = متوسط × المساحة. الكثافة المتكاملة: مجموع شدة التألق في هذه المنطقة ؛ يعني: متوسط شدة التألق في منطقة معينة ؛ المنطقة: كانت مساحة إشارة التألق الإيجابية في الصورة) لتراكم Aβ في الفئران 8m 5×FAD أعلى بكثير من تلك الموجودة في الفئران 5m 5×FAD (اختبار t للطلاب غير المزاوجين ، ص = 0.0071) ، مما يدل على أن تراكم Aβ سيزداد تدريجيا مع تقدم العمر. بالإضافة إلى ذلك ، لم يتم ملاحظة أي إشارة Aβ في التحكم من النوع البري ، مما يوضح خصوصية الجسم المضاد 6E10. تظهر أيضا بعض النتائج دون المستوى الأمثل (فأر متغاير الزيجوت 5×FAD لمدة 8 أشهر وعنصر تحكم من النوع البري لمدة 8 أشهر) في الشكل 3C. يشمل العجز كسر الشريحة والحافة الملتفة. ستتم مناقشة كيفية منع هذا الموقف. بشكل عام ، يعد تلطيخ الفلورسنت المناعي باستخدام الجسم المضاد 6E10 المضاد ل Aβ طريقة محددة يمكنها بسهولة تحديد تراكم Aβ في الفئران 5×FAD.
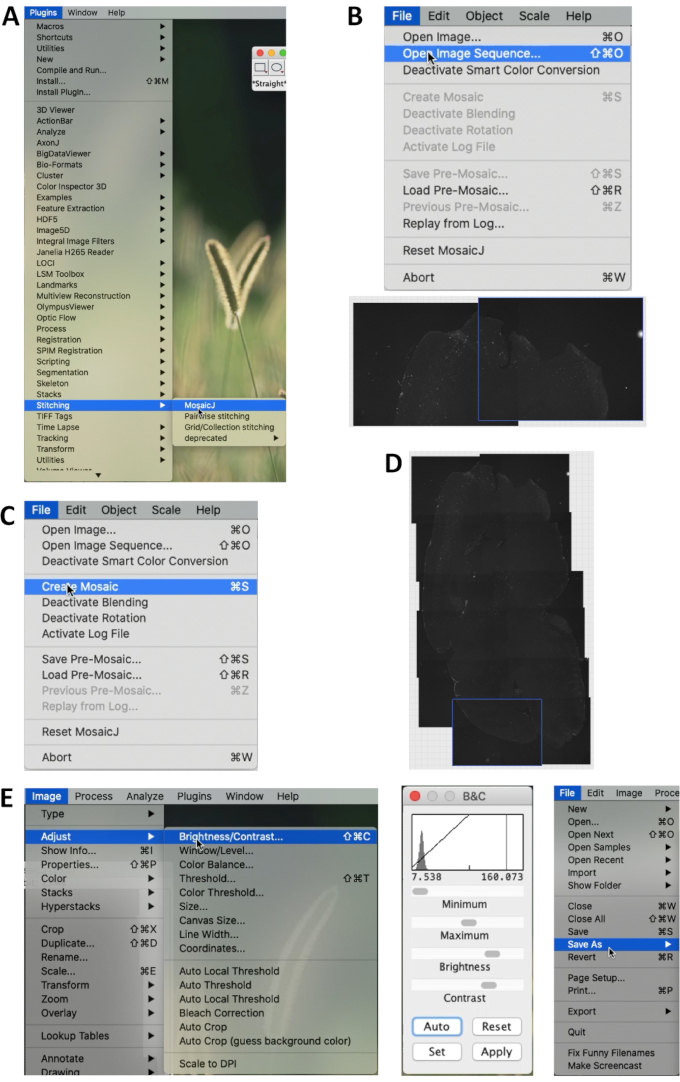
الشكل 1. خياطة صور شرائح الدماغ بواسطة ImageJ. (أ) في قائمة ImageJ / Fiji ، حدد المكونات الإضافية | خياطة | MosaicJ لبدء الخياطة. (ب) حدد ملف | افتح تسلسل الصورة وحدد الصور المراد دمجها. قم بغرزة الصور يدويا وفقا للهياكل التشريحية للقسم. (ج) بعد الخياطة، حدد ملف | قم بإنشاء فسيفساء لإنشاء الصورة الكاملة للقسم. (د) مثال على صورة مخيطة. (ه) حدد الصورة | ضبط | السطوع / التباين ... لضبط سطوع وتباين الصورة بأكملها. تعرض اللوحة الوسطى قائمة الضبط. حدد ملف | حفظ باسم... لحفظ الصورة في Tiff أو تنسيق آخر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
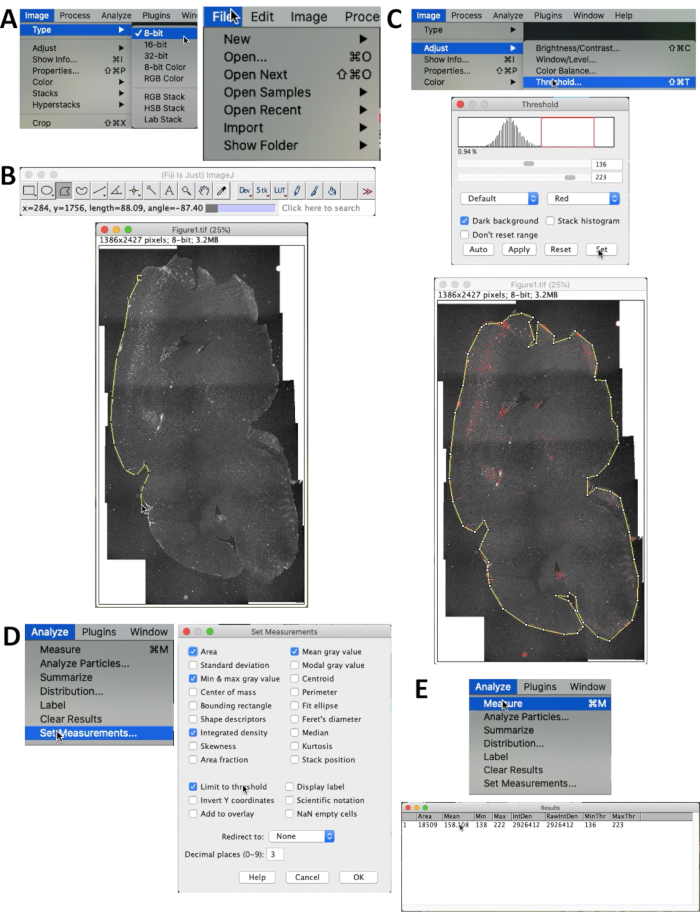
الشكل 2. طريقة القياس الكمي لمضان Aβ. (أ) قم بتعيين نوع الصورة على أنه 8 بت من خلال تحديد صورة | النوع | 8 بت. (ب) استخدم تحديد المضلع في قائمة ImageJ وصور محيط الدماغ كله. (ج) حدد الصورة | ضبط | عتبة... لاستبعاد ضوضاء الخلفية. تأكد من تحديد مربع الخلفية الداكنة . اسحب الخطوط الحمراء أو أشرطة التمرير حتى يتم تمييز التألق Aβ بشكل صحيح. (د) استخدام التحليل | قم بتعيين القياسات لاختيار ما سيتم تقديمه في جدول النتائج وتعيين طريقة العد. يتم عرض قائمة تعيين القياسات. تأكد من تحديد الكثافة المتكاملة والحد إلى الحد. (ه) حدد تحليل | قم بالقياس للحصول على النتائج. تمثل الكثافة المتكاملة (الموضحة باسم IntDen) الكثافة الإجمالية للتألق Aβ (الكثافة المتكاملة = المساحة × المتوسط). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3. النتائج التمثيلية لتلوين الفلورسنت المناعي لترسيب Aβ في الفئران 5×FAD. (أ) التلوين المناعي لترسيب Aβ في القسم السهمي للفئران المعدلة وراثيا 5 أشهر و 8 أشهر 5×FAD وأدمغة الفئران البرية من 4 إلى 6 أشهر باستخدام الجسم المضاد المضاد ل Aβ 6E10. تم التقاط الصور بواسطة مجهر مضان تحت هدف 4x أو 20x. اللوحة العلوية ، مخيط صور الدماغ بالكامل في تكبير أقل. اللوحة السفلية ، صور القشرة بتكبير أعلى. كما تشير الأسهم البيضاء ، لوحظت إشارات الإزهار لترسيب Aβ بوضوح في مجموعات 5×FAD ، ولكن لم يتم ملاحظة أي إشارة Aβ في مجموعة من النوع البري. (ب) يوضح المخطط الشريطي التحليل الكمي للكثافة الإجمالية (الكثافة المتكاملة = المساحة × المتوسط) لمضان Aβ في أدمغة الفئران المعدلة وراثيا 5 أشهر و 8 أشهر 5×FAD. اختبار t للطلاب غير المزوجين: ** ، ص < 0.01 (ن = 3 لكل مجموعة). تمثل أشرطة الخطأ SD. (ج) حالات الشرائح دون المستوى الأمثل في تلطيخ الفلورسنت المناعي ، والتي تمثل فأر معدل وراثيا 5×FAD لمدة 8 أشهر وعنصر تحكم من النوع البري لمدة 8 أشهر. اليسار ، كسر القسم. الحافة اليمنى الملتفة للقسم. شريط المقياس ، 200 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
يمكن أن يكتشف تلطيخ الفلورسنت المناعي باستخدام الجسم المضاد 6E10 على وجه التحديد تراكم Aβ في الدماغ ، والذي يسهل قياسه كميا بواسطة الصورة J. ما يجدر الانتباه هو أن بعض الخطوات الحاسمة في هذا البروتوكول قد تؤثر على النتائج.
لمنع الشرائح من التقشير أو الكسر الموضح في الشكل 3 ج ، يجب ملاحظة بعض النقاط الرئيسية. يجب أن يستمر التروية بسرعة بعد إجراء شق في الحجاب الحاجز بسبب التأثيرات الفيزيولوجية المرضية التي لا رجعة فيها الناجمة عن نقص الأكسجة. قد تؤثر هذه التأثيرات بشكل عميق على النتائج11. يجب تثبيت أنسجة المخ وتجفيفها بشكل صحيح قبل التشريح بالتبريد. يجب ضبط درجة الحرارة بشكل صحيح لناظم البرد (الغرفة -21 درجة مئوية ، رأس العينة -19 درجة مئوية) ، ويجب التحقق من حالة شفرة القطع واللوحة المضادة للانزلاق. يجب ألا يكون هناك غبار أو صقيع على شفرة القطع أو اللوحة المضادة للانزلاق ، ويجب وضعها بشكل صحيح. يجب أيضا تسطيح الأقسام بشكل صحيح قبل التوصيل. بالإضافة إلى ذلك ، يجب طلاء الشرائح مسبقا لمنع الشرائح من التقشير أثناء التلوين. تشمل الطرق الشائعة بولي ليسين أو طلاء الجيلاتين. يمكن شراء شرائح التصاق المجهر المطلي بالبولي ليسين من الشركات.
ستؤثر بعض الخطوات في عملية التلوين أيضا على النتائج. قبل الحضانة ، يجب تطبيق محلول استرجاع المستضد على الأقسام لتمكين التعرض الكامل للمستضد. من أجل منع تبخر الجسم المضاد الأساسي أثناء الحضانة ، يجب تحضين الأقسام في صندوق مبلل. بالإضافة إلى ذلك ، يجب إبقاء الأقسام في الظلام بعد حضانة الجسم المضاد الثانوي لتجنب تبريد الفلورة. تم تطوير العديد من طرق التلوين للكشف عن Aβ ، مثل تلطيخ Thioflavin-S ، وتلوين الكونغو الأحمر ، وتلوين Gallyas الفضي ، لكن تلطيخ الفلورسنت المناعي باستخدام الجسم المضاد 6E10 له مزايا فريدة. يمكن أن يرتبط Thioflavin-S و Congo Red بجميع β الألواح التي تحتوي على البروتينات ، وبالتالي ، فإن هذه الأصباغ الكيميائية أقل تحديدا للكشف عن Aβ14،15. بالمقارنة مع التلوين الكيميائي ، فإن تلطيخ الفلورسنت المناعي أكثر تحديدا. يتفاعل الجسم المضاد أحادي النسيلة 6E10 المضاد ل Aβ على وجه التحديد مع بقايا الأحماض الأمينية 4-10 من Aβ ، وفقا لرسم خرائط سابقة عالية الدقة16. أشارت الدراسات السابقة أيضا إلى أن التلوين المناعي باستخدام الجسم المضاد 6E10 يمكن أن يكشف عن ترسب لويحات أكبر من تلطيخ الفضة Gallyas وتلوين Thioflavin-S ، مما يشير إلى أن الكشف عن Aβ باستخدام الجسم المضاد قد يكون أكثر حساسية من طرق التلوينالكيميائي 17. ومع ذلك ، فإن القيد الحرج لتلوين 6E10 هو أن هذا الجسم المضاد لا يزال بإمكانه التعرف على APP كامل الطول والببتيدات المشقوقة الأخرى التي تحتوي على 6E10 حاتمة ، لكن إشارة التألق خارج لويحات Aβ ضعيفة جدا في الفئران 5xFAD. أظهرت الدراسات السابقة أن الجسم المضاد 6E10 مرتبط بببتيدات Aβ بطريقتين تعتمد على التشكل والتسلسل16. على الرغم من القيود ، لا يزال هذا البروتوكول طريقة عملية ومحددة يمكن أن تساعد الباحثين على التحقيق في أمراض Aβ لمرض الزهايمر.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا البحث من خلال مشروع عام لمؤسسة العلوم الطبيعية في الصين (رقم المنحة: 81974157) من مؤسسة العلوم الطبيعية في الصين ، وأستاذية معينة خاصة في جيانغسو (إلى CL) من إدارة التعليم في جيانغسو ، وبرنامج فريق الابتكار وريادة الأعمال في مقاطعة جيانغسو (إلى H.Z. ، A. L. ، W.W. ، C.L. و YS) ، منحة أولية للمواهب الممتازة (D2019025) وبرنامج التدريب على الابتكار وريادة الأعمال (201910313038Z إلى Z.S. ، YX و MZ و JD.) من جامعة Xuzhou الطبية. تم دعم هذا البحث أيضا من قبل المركز الوطني التجريبي لتعليم العلوم الطبية الأساسية التجريبية (جامعة Xuzhou الطبية).
Materials
| Name | Company | Catalog Number | Comments |
| Anesthetia | |||
| Injection syringe | KLMEDICAL | 1 mL | |
| Pentobarbitual sodium | Sigma-Aldrich | P3761 | 1% in saline for i.p. injection |
| Thoracotomy: | |||
| IRIS-Fine Straight iris scissors (~11.5 cm) | RWD | S12010-11 | |
| Sharp curved surgical scissors(11.5 cm) | RWD | S14016-11 | |
| Straight dissecting forceps (~10.5 cm) | RWD | F12010-10 | |
| Perfusion | |||
| Centrifugal tube (5 mL) | Biosharp | ||
| Injection syringe | KLMEDICAL | 20 mL | |
| Paraformaldehyde | Vicmed | VIH100 | |
| PBS 0.01M (PH7.2-7.4) powder | Vicmed | VC2001P | Add deionized water to make solution |
| Fixation, Dehydration and Cryosectioning | |||
| Adhesion microscope slides | CITOTEST | 188105 | 76.2 mm × 25.4 mm |
| Microtome Cryostat | LEICA | CM1950 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| Sucrose | VETEC | V900116 | |
| Immunofluorescence staining | |||
| Fluorescence microscope | OLYMPUS | IX-81 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Thermo Fisher Scientific | A-11005 | 200X |
| Image-Pro Plus 7.0C | Media Cybernetics | Scientific graphing and data analysis software | |
| Immunohistochemical Wet Box (black) | Sinylab | Customized | 300 mm × 100 mm × 38 mm, groove depth 27 mm, can contain 10 standard slides |
| Pipet | Thermo Scientific | ||
| Pipette tips | Well-offer | ||
| Plastic staining box | Sinylab | Customized | 30 mL, can contain 5 standard slides |
| Primary Antibody Dilution Buffer | made in our lab | 1% BSA 1g, 0.3% Triton X-100 300ul, 0.01% sodium azide 10mg in 100ml PBS | |
| Purified anti beta amyloid,1-16 antibody (6E10) | Biolegend | SIG-39320 | 500X |
| Quick Antigen Retrieval Solution for Frozen Sections | KeyGEN BioTECH | KGIHC005 | 5X |
| Quantification | |||
| Graphpad Prism 8.0.1 | Graphpad | Medical mapping software | |
| Image J Fiji 2.0.0 | National Institute of Health | Scientific graphing and data analysis software |
References
- Burns, A., Iliffe, S. Alzheimer's disease. BMJ. 338, 158(2009).
- Leong, Y. Q., Ng, K. Y., Chye, S. M., Ling, A. P. K., Koh, R. Y. Mechanisms of action of amyloid-beta and its precursor protein in neuronal cell death. Metabolic Brain Disease. 35 (1), 11-30 (2020).
- Tiwari, S., Atluri, V., Kaushik, A., Yndart, A., Nair, M. Alzheimer's disease: pathogenesis, diagnostics, and therapeutics. International Journal of Nanomedicine. 14, 5541-5554 (2019).
- Murphy, M. P., LeVine, H. Alzheimer's disease and the amyloid-beta peptide. Journal of Alzheimer's Disease. 19 (1), 311-323 (2010).
- Hardy, J. A., Higgins, G. A. Alzheimer's disease: the amyloid cascade hypothesis. Science. 256 (5054), 184-185 (1992).
- Reitz, C. Alzheimer's disease and the amyloid cascade hypothesis: a critical review. International Journal of Alzheimer's Disease. 2012, 369808(2012).
- Bozyczko-Coyne, D., et al. CEP-1347/KT-7515, an inhibitor of SAPK/JNK pathway activation, promotes survival and blocks multiple events associated with Abeta-induced cortical neuron apoptosis. Journal of Neurochemistry. 77 (3), 849-863 (2001).
- Canevari, L., Abramov, A. Y., Duchen, M. R. Toxicity of amyloid beta peptide: tales of calcium, mitochondria, and oxidative stress. Neurochemical Research. 29 (3), 637-650 (2004).
- Zhu, X., et al. Oxidative stress signalling in Alzheimer's disease. Brain Research. 1000 (1-2), 32-39 (2004).
- Oakley, H., et al. Intraneuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer's disease mutations: potential factors in amyloid plaque formation. Journal of Neuroscience. 26 (40), 10129-10140 (2006).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- An, S., et al. Medial septum glutamatergic neurons control wakefulness through a septo-hypothalamic circuit. Current Biology. , (2021).
- Cao, J. L., et al. Activation of peripheral ephrinBs/EphBs signaling induces hyperalgesia through a MAPKs-mediated mechanism in mice. Pain. 139 (3), 617-631 (2008).
- Ly, P. T., Cai, F., Song, W. Detection of neuritic plaques in Alzheimer's disease mouse model. Journal of Visualized Experiments. (53), e2831(2011).
- Klunk, W. E., Jacob, R. F., Mason, R. P. Quantifying amyloid beta-peptide (Abeta) aggregation using the Congo red-Abeta (CR-abeta) spectrophotometric assay. Analytical Biochemistry. 266 (1), 66-76 (1999).
- Hatami, A., Albay, R., Monjazeb, S., Milton, S., Glabe, C. Monoclonal antibodies against Abeta42 fibrils distinguish multiple aggregation state polymorphisms in vitro and in Alzheimer disease brain. Journal of Biological Chemistry. 289 (46), 32131-32143 (2014).
- Shi, X. Z., Wei, X., Sha, L. Z., Xu, Q. Comparison of beta-Amyloid Plaque Labeling Methods: Antibody Staining, Gallyas Silver Staining, and Thioflavin-S Staining. Chinese Medical Sciences Journal. 33 (3), 167-173 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved