Method Article
Detecção do acúmulo de β amilóide por meio de coloração imunofluorescente em um modelo de camundongo com doença de Alzheimer
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Na neuropatologia da doença de Alzheimer, uma das características mais cruciais é a deposição de β amilóide. Neste protocolo, descrevemos o método de coloração imunofluorescente em camundongos transgênicos 5×FAD para detectar o acúmulo de β amilóide em placas. O processo de perfusão, criosecção, coloração e quantificação será descrito em detalhes.
Resumo
A doença de Alzheimer (DA) é uma doença neurodegenerativa que contribui para 60-70% da demência em todo o mundo. Uma das características da DA, sem dúvida, está no acúmulo de β amilóide (Aβ) no cérebro. Aβ é produzido a partir da clivagem proteolítica da proteína precursora beta-amilóide (APP) pela β-secretase e γ-secretase. Em circunstâncias patológicas, o aumento da clivagem β da APP leva à superprodução de Aβ, que se agrega em placas Aβ. Como as placas Aβ são uma característica da patologia da DA, detectar a quantidade de Aβ é muito importante na pesquisa da DA. Neste protocolo, introduzimos o método de coloração imunofluorescente para visualizar a deposição de Aβ. O modelo de camundongo usado em nossos experimentos é o 5×FAD, que carrega cinco mutações encontradas na DA familiar humana. Os déficits neuropatológicos e comportamentais de camundongos 5xFAD estão bem documentados, o que o torna um bom modelo animal para estudar a patologia Aβ. Apresentaremos o procedimento incluindo perfusão transcárdica, criosecção, coloração imunofluorescente e quantificação para detectar o acúmulo de Aβ em camundongos 5×FAD. Com este protocolo, os pesquisadores podem investigar a patologia Aβ em um modelo de camundongo com DA.
Introdução
A doença de Alzheimer (DA) é uma doença neurodegenerativa que causa demência de 60% a 70% em todo o mundo e custa muitos recursos sociais1. É bem sabido que o acúmulo de β amilóide (Aβ) é uma marca patológica na doença de Alzheimer. A proteína precursora de amilóide (APP) é uma proteína de membrana integral que existe em muitos tecidos. O peptídeo Aβ, consistindo de 36-42 aminoácidos2, é produzido pela clivagem subsequente da β e γ-secretase em APP 3,4. Alterações na clivagem da APP e mutações no gene da APP levam à superprodução de Aβ. As moléculas de Aβ podem se agregar para formar oligômeros ou fibrilas, que se acredita serem neurotóxicos 5,6. Em estudos anteriores, o acúmulo de Aβ demonstrou estar correlacionado com a morte neuronal em AD 7,8,9.
Os camundongos transgênicos 5×FAD (C57BL/6J) contêm 3 mutações em APP e 2 mutações em PSEN1. O acúmulo de Aβ intracelular começa a partir de 1,5 mês de idade. O acúmulo extracelular de Aβ foi encontrado por volta dos 2 meses, no córtex e no hipocampo. O acúmulo aumentou rapidamente com a idadede 10 anos. A patologia Aβ bem documentada o torna um bom modelo animal para o nosso protocolo.
O objetivo do método de coloração descrito é visualizar e quantificar a deposição de Aβ no cérebro de camundongos com DA. O procedimento incluindo perfusão transcárdica de paraformaldeído, criosecção, coloração imunofluorescente e quantificação para detectar o acúmulo de Aβ em camundongos 5×FAD será introduzido. Este protocolo é um método confiável e fácil para investigar a patologia Aβ em modelo de camundongo com DA.
Protocolo
Todos os procedimentos experimentais foram realizados com a aprovação do Comitê Institucional de Cuidados e Uso de Animais da Universidade Médica de Xuzhou e de acordo com as diretrizes dos regulamentos governamentais chineses para o cuidado e uso de animais de laboratório.
1. Perfusão de camundongos
NOTA: Mais detalhes do procedimento de perfusão podem consultar o vídeo do laboratório 11 de Wiliam Shain.
- Anestesiar camundongos transgênicos 5×FAD (C57BL/6J) com pentobarbital sódico a 1% (50 mg/kg de peso corporal) por injeção intraperitoneal12,13. A perda de resposta ao beliscão da pata traseira indica anestesia adequada. Não inicie a perfusão antes que o mouse esteja devidamente anestesiado.
- Use quatro pinos para fixar os membros na prancha de poliestire. Coloque o abdômen do camundongo anestesiado para cima, com os membros adequadamente esticados. Use uma tesoura de íris para fazer uma incisão no processo xifóide. Em seguida, o diafragma será exposto.
- Use uma tesoura cirúrgica para fazer uma incisão no diafragma e continue cuidadosamente a incisão do diafragma até o limite superior da caixa torácica. Corte as costelas e os músculos torácicos, disseque os tecidos ligados para expor o coração.
- Encontre o átrio direito do mouse. Abra o átrio direito usando uma tesoura de íris.
- Injete 20 ml de PBS a 37 °C (0,01 M, pH 7,2-7,4) do ventrículo esquerdo do coração para eliminar o sangue. Em seguida, injete lentamente 20 mL de PFA a 4% de temperatura ambiente do ventrículo esquerdo para fixar os tecidos. A taxa de injeção de PBS e 4% de PFA é de cerca de 5 mL / min. Tremores de fixação devem ser observados em segundos.
CUIDADO: 4% de PFA pode irritar os olhos e as vias aéreas e pode provocar reações alérgicas. Esta etapa deve ser feita em locais ventilados, e o operador deve usar óculos de segurança e máscaras faciais. - Use uma tesoura cirúrgica para cortar a cabeça e remova cuidadosamente o crânio, use pinças de dissecação e extraia o cérebro. Em seguida, mergulhe o cérebro em 4 mL de PFA a 4% em um tubo de plástico de 5 mL por 12-24 h a 4 ° C.
2. Incorporação e criosseccionamento
- Após a fixação em PFA a 4%, transfira o cérebro para 4 mL de sacarose a 15% em um tubo plástico de 5 mL a 4 ° C. Após 12-24 h, o cérebro deve afundar.
- Transfira o cérebro para 4 mL de sacarose a 30% em um tubo de plástico de 5 mL a 4 ° C por 12-24 h. Então o cérebro está pronto para incorporar. O objetivo da imersão gradual de sacarose a 15% e 30% é desidratar o cérebro, o que evita a formação de cristais de gelo dentro das células durante a incorporação e criossecção. O cérebro desidratado pode ser armazenado a 4°C por uma semana.
- Deixe cerca de 1 mL de sacarose com o cérebro no tubo. Em seguida, adicione o mesmo composto de temperatura de corte ideal (OCT) de volume no tubo e misture bem. Isso ajuda o composto OCT a envolver o cérebro de forma mais suficiente.
- Monte uma camada espessa de composto OCT na superfície do botão e congele a -21 °C antes da criosecção. Corte o cérebro sagitalmente do meio; Use qualquer uma das metades para seccionar em um criostato.
- Depois que o composto OCT solidificar, monte o botão na cabeça da amostra e corte-o em uma superfície de plataforma. Coloque metade do cérebro na superfície aparada com o lado do meio voltado para baixo.
- Coloque um anel de papel alumínio ao redor do cérebro para evitar vazamento de composto OCT e, em seguida, encha o anel com composto OCT até que o cérebro esteja submerso. Quando a incorporação de compostos OCT se solidifica, ela está pronta para o seccionamento.
- Defina a espessura da seção para 20 μm. Defina a temperatura da câmara para -21 °C e a temperatura da cabeça da amostra para -19 °C. Separe o cérebro da extremidade rostral para a extremidade caudal.
- Pincele um pouco de PBS nas lâminas de vidro. Pré-revestida as lâminas de vidro em polilisina para evitar que as seções descasquem. Prenda a seção no slide. Se a seção estiver dobrada, use uma escova macia para desdobrar as seções com PBS.
- Seque as secções durante a noite à temperatura ambiente e conserve a -20 °C. As secções podem ser mantidas a -20 °C até um mês antes da coloração Aβ.
3. Procedimento de coloração Aβ
- Aqueça as seções em temperatura ambiente, seque a superfície da lâmina e use uma caneta hidrofóbica para desenhar um círculo ao redor da seção para incubação de anticorpos.
- Mergulhe a lâmina em PBS em uma caixa de coloração de plástico de 30 mL para lavar o composto OCT. Use pelo menos 20 mL de PBS.
- Adicione 100 μL de solução de recuperação de antígeno 1x para seções congeladas na lâmina. Incube por 5 min em temperatura ambiente.
- Lave a solução de recuperação com pelo menos 20 mL de PBS em temperatura ambiente por 3 vezes (5 minutos para cada).
- Adicionar anticorpo primário diluído (6E10) nas secções e incubar a 4 °C durante 16-24 h numa caixa escura húmida (solução de diluição do anticorpo primário: 1% BSA, 0,3% Triton X-100, 0,01% azida sódica em PBS, diluição 1:500). O BSA funciona como agente bloqueador.
- Lave as seções com PBS por 3 vezes, 5 min de cada vez.
NOTA: Execute as etapas 3.7, 3.8 e 3.9 em um local escuro. - Incube as seções em solução de anticorpo secundário (IgG de cabra anti-camundongo (H + L) Alexa Flour 594, diluída com PBS 1: 200) por 1 h em temperatura ambiente em uma caixa úmida e escura.
- Lave o anticorpo secundário das seções com pelo menos 20 mL de PBS por 3 vezes, 5 min de cada vez.
NOTA: Não despeje PBS nas seções durante a lavagem para evitar que as seções descasquem. Mantenha as seções molhadas. - Absorva o líquido ao redor das seções e adicione um gotejamento de meio de montagem em cada seção. Sele as seções com vidro de cobertura, evitando bolhas.
- Observe as seções coradas com um microscópio de fluorescência. Mantenha os parâmetros de imagem consistentes para evitar derivação. Mantenha os slides a 4°C em um local escuro. Analise as seções dentro de uma semana, pois a coloração desaparecerá com o tempo.
4. Imagem e quantificação do acúmulo de Aβ por ImageJ
- Capture imagens por um microscópio de fluorescência conectado a uma câmera digital e software de imagem. Utilizou-se o software Image Pro Plus e o parâmetro de imagem foi definido da seguinte forma: Exp Pvw: 450 ms, Exp Acq: 450 ms; Pvw: 1 × 1, Acq: 1 × 1; Resolução Pvw: Largura 1 × Altura 1, Resolução Acq: Largura 1 × Altura 1; Profundidade de captura: 8 bits mono; Ganho: Pvw: 13, Acq: 13, Gama: Pvw: 1, Acq: 1, Offse: Pvw: -700, Acq: -700.
- No ImageJ Fiji 2.0.0 (https://imagej.net/Fiji), selecione Plugins | Costura | MosaicJ no menu. Em seguida, selecione Arquivos | Abra a sequência de imagens para abrir as imagens a serem costuradas (Figura 1A).
- Todas as imagens selecionadas serão exibidas na parte inferior. Depois de costurar as imagens manualmente, selecione Arquivo | Crie um mosaico (Figura 1B, C, D).
- Selecionar imagem | Ajustar | Brilho/Contraste..., e ajuste o brilho e o contraste da imagem (Figura 3A). Em seguida, a imagem pode ser salva (Figura 1E).
- Para quantificar o acúmulo de Aβ, abra a imagem através de Arquivo | Abrir... no menu (Figura 2A).
- Selecionar imagem | Tipo | 8 bits para ajustar a imagem para 8 bits. Em seguida, escolha a área que se pretende contar usando a seleção de polígono (Figura 2B).
- Selecionar imagem | Ajustar | Threshold para selecionar o limite adequado de sinais. O limite pode ser ajustado arrastando as barras de rolagem ou alterando os números diretamente na caixa de texto (máximo: 255, mínimo: 0). Quando todos os sinais Aβ na seção ficarem vermelhos, o limite é apropriado para medição (Figura 2C). Certifique-se de que a caixa Fundo escuro esteja marcada.
- Selecionando Analisar | Definir medição... no menu para escolher os parâmetros que serão mostrados nos resultados. Confirme se a opção Densidade integrada e Limitar ao limite estão selecionadas. A densidade integrada (intensidade total) é o alvo da medição (Figura 2D).
- Selecione Analisar | Meça para obter os resultados. Os resultados serão exibidos e prontos para análise estatística (Figura 2E).
Resultados
Usamos os procedimentos de coloração imunofluorescente descritos acima para investigar a deposição de acúmulo de Aβ em camundongos 5×FAD de diferentes idades. A Figura 3 representa resultados típicos e resultados abaixo do ideal usando nosso protocolo. Fatias de cérebro de camundongos transgênicos heterozigotos 5×FAD de 5 meses e 8 meses e controle de tipo selvagem de 4 a 6 meses foram coradas com anticorpo 6E10 e detectadas em microscópio de fluorescência. A Figura 3A mostra o acúmulo de Aβ em placas na seção sagital do cérebro do camundongo. Eles são depositados principalmente no córtex e no hipocampo, com a maior densidade no subículo do hipocampo, o que é consistente com estudos anteriores10. Como mostra a imagem, o acúmulo de Aβ foi claramente detectado pelo anticorpo em camundongos 5×FAD. A densidade integrada (densidade integrada = Área × Média. Densidade integrada: soma da intensidade de fluorescência desta zona; Média: a intensidade média de fluorescência em uma determinada área; Área: a área de sinal de fluorescência positiva na imagem) de acúmulo de Aβ em camundongos 5×FAD de 8m foi significativamente maior do que em camundongos 5×FAD de 5m (teste t de Student não pareado, p = 0,0071), o que mostra que o acúmulo de Aβ aumentará gradualmente com a idade. Além disso, nenhum sinal Aβ foi observado no controle do tipo selvagem, o que mostra a especificidade do anticorpo 6E10. Alguns resultados abaixo do ideal (um camundongo transgênico heterozigoto 5×FAD de 8 meses e um controle de tipo selvagem de 8 meses) também são mostrados na Figura 3C. Os déficits incluem quebra de fatia e borda enrolada. Como evitar essa situação será discutido. Em geral, a coloração imunofluorescente usando o anticorpo anti-Aβ 6E10 é um método específico que pode quantificar facilmente o acúmulo de Aβ em camundongos 5×FAD.
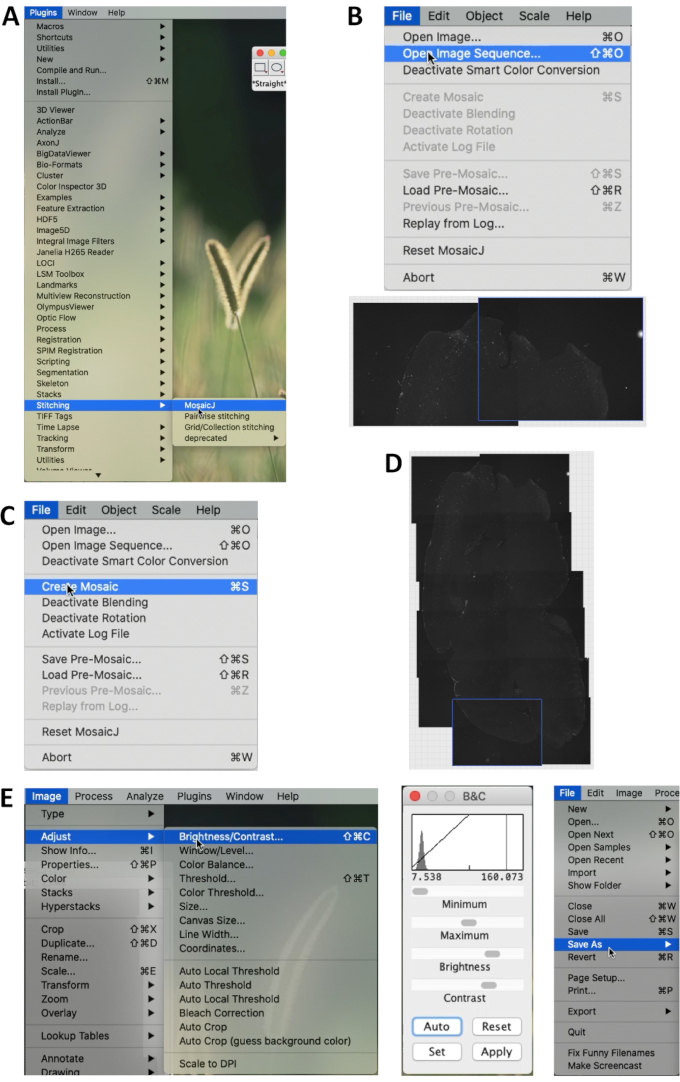
Figura 1. Costurando imagens de fatias cerebrais por ImageJ. (A) No menu do ImageJ/Fiji, selecione Plugins | Costura | MosaicJ para começar a costurar. (B) Selecione Arquivo | Abra a Sequência de Imagens e selecione as imagens a serem unidas. Costure as imagens manualmente de acordo com as estruturas anatômicas da seção. (C) Após a costura, selecione Arquivo | Criar Mosaico para criar toda a imagem da seção. (D) Um exemplo de uma imagem costurada. (E) Selecione a imagem | Ajustar | Brilho/Contraste... para ajustar o brilho e o contraste de toda a imagem. O painel do meio mostra o menu de ajuste. Selecione Arquivo | Salvar como... para salvar a imagem em Tiff ou outro formato. Clique aqui para ver uma versão maior desta figura.
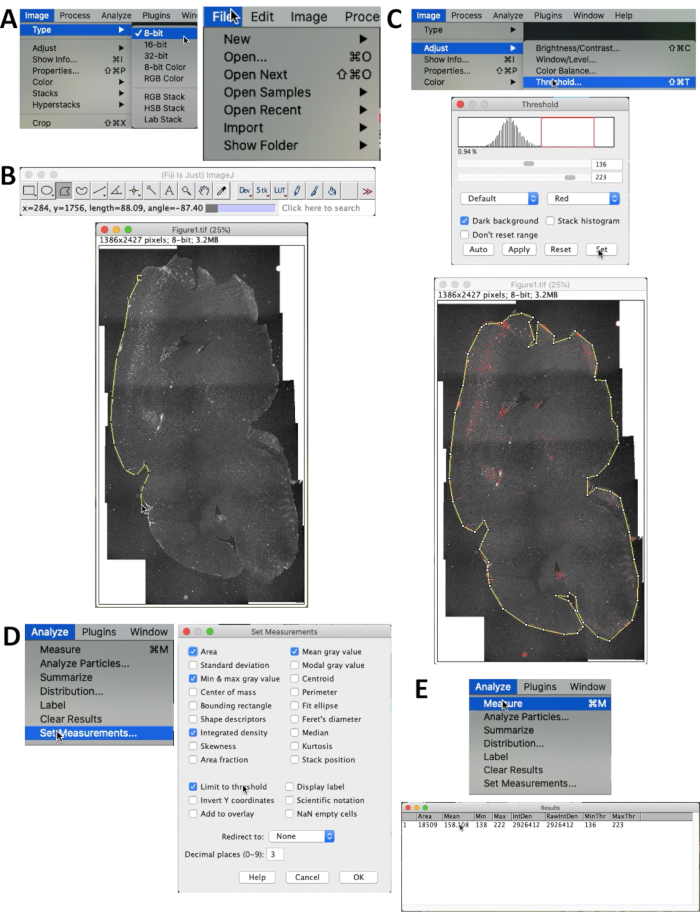
Figura 2. Método de quantificação da fluorescência Aβ. (A) Defina o tipo de imagem como 8 bits selecionando Imagem | Tipo | 8 bits. (B) Use a seleção de polígono no menu do ImageJ e descreva o contorno de todo o cérebro. (C) Selecione a imagem | Ajustar | Limiar... para excluir o ruído de fundo. Certifique-se de que a caixa de fundo escuro esteja marcada. Arraste as linhas vermelhas ou barras de rolagem até que a fluorescência Aβ esteja devidamente destacada. (D) Use Analisar | Defina Medidas para escolher o que será apresentado na tabela de resultados e defina o método de contagem. O menu de Definir medidas é exibido. Confirme se a Densidade integrada e Limitar ao limite estão selecionados. (e) Selecione Analisar | Meça para obter os resultados. A densidade integrada (mostrada como IntDen) representa a intensidade total da fluorescência Aβ (Densidade Integrada = Área × Média). Clique aqui para ver uma versão maior desta figura.

Figura 3. Resultados representativos da coloração imunofluorescente da deposição de Aβ em camundongos 5×FAD. (A) A imunocoloração da deposição de Aβ na seção sagital de camundongos transgênicos 5×FAD de 5 meses e 8 meses e cérebros de camundongos selvagens de 4 a 6 meses usando anticorpo anti-Aβ 6E10. As imagens foram capturadas por um microscópio de fluorescência sob uma objetiva de 4x ou 20x. Painel superior, imagens cerebrais inteiras costuradas em menor ampliação. Painel inferior, imagens do córtex em maior ampliação. Como as setas brancas indicam, os sinais de florescência da deposição de Aβ foram observados claramente nos grupos 5×FAD, mas nenhum sinal de Aβ foi observado no grupo do tipo selvagem. (B) O gráfico de barras mostra a análise quantitativa da intensidade total (Densidade Integrada = Área × Média) da fluorescência Aβ nos cérebros de camundongos transgênicos 5×FAD de 5 meses e 8 meses. Teste t de alunos não pareados: **, p < 0,01 (n = 3 para cada grupo). As barras de erro representam SD. (C) Casos de fatias subótimas na coloração imunofluorescente, representando um camundongo transgênico 5×FAD de 8 meses e um controle de tipo selvagem de 8 meses. Esquerda, quebra de seção; Borda direita e enrolada da seção. Barra de escala, 200 μm. Clique aqui para ver uma versão ampliada desta figura.
Discussão
A coloração imunofluorescente usando o anticorpo 6E10 pode detectar especificamente o acúmulo de Aβ no cérebro, que é fácil de ser quantificado pela Imagem J. O que vale a pena notar é que algumas etapas cruciais desse protocolo podem afetar os resultados.
Para evitar que as fatias descasquem ou quebrem mostradas na Figura 3C, alguns pontos-chave devem ser observados. A perfusão deve prosseguir rapidamente após a incisão no diafragma devido aos efeitos fisiopatológicos irreversíveis causados pela hipóxia. Esses efeitos podem influenciar profundamente os resultados11. O tecido cerebral deve ser devidamente fixado e desidratado antes da criossecção. A temperatura deve ser ajustada corretamente para o criostato (câmara -21 °C, cabeça da amostra -19 °C) e a situação da lâmina de corte e da placa estabilizadora deve ser verificada. Nenhuma poeira ou gelo deve estar na lâmina de corte ou na placa estabilizadora, e eles devem ser posicionados corretamente. As seções também devem ser achatadas corretamente antes de serem fixadas. Além disso, as lâminas devem ser pré-revestidas para evitar que as fatias descasquem durante a coloração. Os métodos populares incluem polilisina ou revestimento de gelatina. As lâminas de adesão de microscópio revestidas de polilisina podem ser compradas de empresas.
Algumas etapas do processo de coloração também afetarão os resultados. Antes da incubação, a solução de recuperação de antígeno deve ser aplicada às seções para permitir a exposição total do antígeno. Para evitar a evaporação do anticorpo primário durante a incubação, as seções devem ser incubadas em uma caixa úmida. Além disso, as seções devem ser mantidas no escuro após a incubação do anticorpo secundário para evitar a extinção da fluorescência. Vários métodos de coloração foram desenvolvidos para detecção de Aβ, como coloração com tioflavina-S, coloração com vermelho Congo e coloração com prata de Gallyas, mas a coloração imunofluorescente usando o anticorpo 6E10 tem vantagens únicas. A tioflavina-S e o vermelho Congo podem se ligar a todas as folhas de β contendo proteínas, portanto, esses corantes químicos são menos específicos para a detecção de Aβ 14,15. Em comparação com a coloração química, a coloração imunofluorescente é mais específica. O anticorpo monoclonal 6E10 anti-Aβ é especificamente reativo aos resíduos de aminoácidos 4-10 de Aβ, de acordo com um mapeamento anterior de alta resolução16. Estudos anteriores também indicaram que a imunomarcação usando o anticorpo 6E10 pode detectar maior deposição de placa do que a coloração de prata Gallyas e a coloração de tioflavina-S, o que indica que a detecção de Aβ usando anticorpo pode ser mais sensível do que os métodos de coloração química17. No entanto, a limitação crítica da coloração 6E10 é que esse anticorpo ainda pode reconhecer APP de comprimento total e outros peptídeos clivados contendo epítopo 6E10, mas o sinal de fluorescência fora das placas Aβ é muito fraco em camundongos 5xFAD. Estudos anteriores mostraram que o anticorpo 6E10 se ligou aos peptídeos Aβ de maneiras dependentes de conformação e sequência16. Apesar das limitações, este protocolo ainda é um método prático e específico que pode ajudar os pesquisadores a investigar a patologia Aβ da DA.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Esta pesquisa foi apoiada por um projeto geral da Fundação de Ciências Naturais da China (número da concessão: 81974157) da Fundação de Ciências Naturais da China, uma Cátedra Nomeada Especial de Jiangsu (para CL) do Departamento de Educação de Jiangsu, um Programa de Equipe Inovadora e Empreendedora da Província de Jiangsu (para H.Z., A. L., W.W., CL e Y.S.), uma bolsa inicial de excelente talento (D2019025) e Programa de Treinamento em Inovação e Empreendedorismo (201910313038Z para Z.S., Y.X., M.Z. e J.D.) da Universidade Médica de Xuzhou. Esta pesquisa também foi apoiada pelo Centro Nacional de Demonstração para Educação Experimental em Ciências Médicas Básicas (Universidade Médica de Xuzhou).
Materiais
| Name | Company | Catalog Number | Comments |
| Anesthetia | |||
| Injection syringe | KLMEDICAL | 1 mL | |
| Pentobarbitual sodium | Sigma-Aldrich | P3761 | 1% in saline for i.p. injection |
| Thoracotomy: | |||
| IRIS-Fine Straight iris scissors (~11.5 cm) | RWD | S12010-11 | |
| Sharp curved surgical scissors(11.5 cm) | RWD | S14016-11 | |
| Straight dissecting forceps (~10.5 cm) | RWD | F12010-10 | |
| Perfusion | |||
| Centrifugal tube (5 mL) | Biosharp | ||
| Injection syringe | KLMEDICAL | 20 mL | |
| Paraformaldehyde | Vicmed | VIH100 | |
| PBS 0.01M (PH7.2-7.4) powder | Vicmed | VC2001P | Add deionized water to make solution |
| Fixation, Dehydration and Cryosectioning | |||
| Adhesion microscope slides | CITOTEST | 188105 | 76.2 mm × 25.4 mm |
| Microtome Cryostat | LEICA | CM1950 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| Sucrose | VETEC | V900116 | |
| Immunofluorescence staining | |||
| Fluorescence microscope | OLYMPUS | IX-81 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Thermo Fisher Scientific | A-11005 | 200X |
| Image-Pro Plus 7.0C | Media Cybernetics | Scientific graphing and data analysis software | |
| Immunohistochemical Wet Box (black) | Sinylab | Customized | 300 mm × 100 mm × 38 mm, groove depth 27 mm, can contain 10 standard slides |
| Pipet | Thermo Scientific | ||
| Pipette tips | Well-offer | ||
| Plastic staining box | Sinylab | Customized | 30 mL, can contain 5 standard slides |
| Primary Antibody Dilution Buffer | made in our lab | 1% BSA 1g, 0.3% Triton X-100 300ul, 0.01% sodium azide 10mg in 100ml PBS | |
| Purified anti beta amyloid,1-16 antibody (6E10) | Biolegend | SIG-39320 | 500X |
| Quick Antigen Retrieval Solution for Frozen Sections | KeyGEN BioTECH | KGIHC005 | 5X |
| Quantification | |||
| Graphpad Prism 8.0.1 | Graphpad | Medical mapping software | |
| Image J Fiji 2.0.0 | National Institute of Health | Scientific graphing and data analysis software |
Referências
- Burns, A., Iliffe, S. Alzheimer's disease. BMJ. 338, 158 (2009).
- Leong, Y. Q., Ng, K. Y., Chye, S. M., Ling, A. P. K., Koh, R. Y. Mechanisms of action of amyloid-beta and its precursor protein in neuronal cell death. Metabolic Brain Disease. 35 (1), 11-30 (2020).
- Tiwari, S., Atluri, V., Kaushik, A., Yndart, A., Nair, M. Alzheimer's disease: pathogenesis, diagnostics, and therapeutics. International Journal of Nanomedicine. 14, 5541-5554 (2019).
- Murphy, M. P., LeVine, H. Alzheimer's disease and the amyloid-beta peptide. Journal of Alzheimer's Disease. 19 (1), 311-323 (2010).
- Hardy, J. A., Higgins, G. A. Alzheimer's disease: the amyloid cascade hypothesis. Science. 256 (5054), 184-185 (1992).
- Reitz, C. Alzheimer's disease and the amyloid cascade hypothesis: a critical review. International Journal of Alzheimer's Disease. 2012, 369808 (2012).
- Bozyczko-Coyne, D., et al. CEP-1347/KT-7515, an inhibitor of SAPK/JNK pathway activation, promotes survival and blocks multiple events associated with Abeta-induced cortical neuron apoptosis. Journal of Neurochemistry. 77 (3), 849-863 (2001).
- Canevari, L., Abramov, A. Y., Duchen, M. R. Toxicity of amyloid beta peptide: tales of calcium, mitochondria, and oxidative stress. Neurochemical Research. 29 (3), 637-650 (2004).
- Zhu, X., et al. Oxidative stress signalling in Alzheimer's disease. Brain Research. 1000 (1-2), 32-39 (2004).
- Oakley, H., et al. Intraneuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer's disease mutations: potential factors in amyloid plaque formation. Journal of Neuroscience. 26 (40), 10129-10140 (2006).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- An, S., et al. Medial septum glutamatergic neurons control wakefulness through a septo-hypothalamic circuit. Current Biology. , (2021).
- Cao, J. L., et al. Activation of peripheral ephrinBs/EphBs signaling induces hyperalgesia through a MAPKs-mediated mechanism in mice. Pain. 139 (3), 617-631 (2008).
- Ly, P. T., Cai, F., Song, W. Detection of neuritic plaques in Alzheimer's disease mouse model. Journal of Visualized Experiments. (53), e2831 (2011).
- Klunk, W. E., Jacob, R. F., Mason, R. P. Quantifying amyloid beta-peptide (Abeta) aggregation using the Congo red-Abeta (CR-abeta) spectrophotometric assay. Analytical Biochemistry. 266 (1), 66-76 (1999).
- Hatami, A., Albay, R., Monjazeb, S., Milton, S., Glabe, C. Monoclonal antibodies against Abeta42 fibrils distinguish multiple aggregation state polymorphisms in vitro and in Alzheimer disease brain. Journal of Biological Chemistry. 289 (46), 32131-32143 (2014).
- Shi, X. Z., Wei, X., Sha, L. Z., Xu, Q. Comparison of beta-Amyloid Plaque Labeling Methods: Antibody Staining, Gallyas Silver Staining, and Thioflavin-S Staining. Chinese Medical Sciences Journal. 33 (3), 167-173 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados