Method Article
Количественная оценка зоны сцепления cell-substrate и распределения формы клеток в монолиях клеток MCF7
В этой статье
Резюме
В статье описывается количественная оценка 1) размера и количества фокусных спаек и 2) индекса формы клеток и его распределения от конфокальных изображений слияние моноселей клеток MCF7.
Аннотация
Методы, представленные здесь количественно некоторые параметры слияния адептов клеток монослой из нескольких соответствующим образом окрашенных конфокальных изображений: прилипание к субстрату в качестве функции числа и размера фокусных спаек, и форма клеток, характеризующаяся индексом формы клетки и другими дескрипторами формы. Фокусные спайки были визуализированы при окрашивании паксилина, а клеточные границы были отмечены стыковым плакоглобином и актином. Методы клеточной культуры и окрашивания являются стандартными; изображения представляют собой единые фокусные плоскости; анализ изображений проводился с использованием общедоступного программного обеспечения для обработки изображений. Представленные протоколы используются для количественной оценки количества и размера фокусных спаек и различий в распределении формы клеток в монослоях, но они могут быть перепрофилированы для количественной оценки размера и формы любой другой клеточной структуры, которая может быть окрашена (например, митохондрии или ядра). Оценка этих параметров имеет важное значение в характеристике динамических сил в адептов клеточного слоя, в том числе клея клеток и актомиозин контрактистойности, которая влияет на форму клеток.
Введение
Эпителиальные клеточные монослой действуют как коллектив, в котором ячейка-клетка и клеточный субстратный спайка, а также контрактные силы и напряжения представляют важные параметры, и их надлежащий баланс способствует общей целостности блока1,2,3. Таким образом, оценка этих параметров представляет собой способ установить текущее состояние слоя ячейки.
Два описанных здесь метода представляют собой двумерный анализ слияние монослой адептов, эпителиальных клеток (в данном случае линия клеток рака молочной железы MCF7). Анализ проводится с использованием конфокополиальных изображений (одиночных ломтиков) из разных регионов на оси з; базальной области вблизи субстрата для фокусных измерений сцепления (FA) и апкической области для измерения формы клеток. Представленные методы являются относительно простыми и требуют стандартных лабораторных методов и программного обеспечения с открытым исходным кодом. Конфокальной микроскопии достаточно для этого протокола, поэтому она может быть выполнена без использования более специализированной микроскопии TIRF (Total Internal Reflection Fluorescence). Таким образом, протокол может быть реализован в относительно стандартных лабораторных условиях. Хотя точность методов ограничена, они могут различать основные различия в фокусной спайке и форме клеток.
Оба описанных здесь метода состоят из стандартных экспериментальных процедур, таких как культивирование клеток, иммуносументирование, конфокальная визуализация и анализ изображений, выполняемый с помощью ImageJ. Тем не менее, любое программное обеспечение для обработки изображений с соответствующими функциями может быть использовано. Представленные методы могут отслеживать и сравнивать изменения, вызванные фармакологическим лечением или минимальной генетической модификацией. Получение определенных значений не рекомендуется, из-за ограниченной точности этих методов. Два автоматизированных макроса были включены, чтобы облегчить измерения многих изображений.
протокол
1. Подготовительные шаги
- Сотовый посев для получения слияние монослой
- Перед посевом, пальто колодцы 4-колодцы камерной слайд с коллагеном I (или другой компонент ECM выбора). Для покрытия коллагена I, следуйте коммерческому протоколу: https://www.sigmaaldrich.com/technical-documents/articles/biofiles/collagen-product-protocols.html с концентрацией 8 мкг/см2.
- Семя 400000 клеток к одному колодцу 4-хорошо камерной слайд.
- Культура клеток на 24 ч (или больше, в зависимости от экспериментальных конечных точек) перед окрашивания, в инкубаторе при 37 градусов по Цельсию, 5% CO2. Этот шаг позволяет созревания клеточных контактов и формирования монослой.
- Используйте оптический перевернутый микроскоп для проверки слияния (требуется около 90%) и общего состояния монослой. Не продолжайте, если клетки плавают или выглядят напряженными.
- Иммунофлуоресцентирование окрашивания
ПРИМЕЧАНИЕ: Клетки могут быть окрашены с протоколом выбора. Здесь иммунофлуоресценция была выполнена, как описано ранее4.- Для фокусного анализа сцепления, пятно клеток с фокусной спайки белка выбора (в этом протоколе paxillin). Для анализа формы клетки пятно с клеточным соединением белка выбора (в этом протоколе desmosomal белка plakoglobin).
- Для процедуры используйте 0,5 мл указанных решений, если не указано иное.
- Исправить клетки в 4% формальдегида в PBS в течение 30 минут на льду.
- Инкубировать 0,1 млн хлорида аммония (в PBS) в течение 10 мин, чтобы утолить автоматическое флуоресценция.
- Добавить 0,5% Triton X-100 (в PBS) в течение 30 минут (пермяки).
- Блок с 5% молока (или 1% BSA) в TBS-T за 1 ч.
- Инкубировать первичным антителом при 4 градусов по Цельсию в одночасье (анти-паксиллин: кролик, 1:250, анти-плакоглобин: кролик, 1:400)
- Инкубировать вторичным антителом в течение 30 минут (Alexa Fluor 594 козы анти-кролик, 1:500, 1:500)
- Пятно с 300 nM DAPI в течение 1-5 мин, защищено от света.
ПРИМЕЧАНИЕ: Дополнительное окрашивание актина с флуоресцентными спряжениями фаллоидин (conc. 1:400) может быть выполнено; фаллоидин следует добавлять на том же этапе, что и вторичное антитело.
- Конфокальные изображения
- С помощью конфокального микроскопа (например, Зейсс LSM800) сфотографировать один ломтики.
ПРИМЕЧАНИЕ: Факультативное окрашивание actin может помочь оценить правильный фокус плоскости. Кортикальное окрашивание актина присутствует в апкической области, в то время как actin стресс волокна присутствуют в базальной области, вблизи субстрата, как показано на рисунке 1. - Фокусная визуализация сцепления
- Выберите ломтики для фокусного анализа сцепления из базальной области, близкой к субстрату.
- Используйте цель с наивысшей численной диафрагмой (предпочтительно 63x N.A.: 1.4).
ПРИМЕЧАНИЕ: Форма FA очень специфична и легко узнаваема. Таким образом, рекомендуется начать сканирование с фокусной плоскости ниже клеток, а затем медленно сканировать к ним, пока FAs четко видны. Анализ изображений будет более точным из небольших полей зрения, которые, как правило, более однородны, но это означает, что меньшее количество ячеек будет рассчитываться в одном поле зрения.
- Изображение контактов клеток
- Используйте 40x или 63x цель.
- Выберите каналы для ядерного окрашивания и предпочтительного окрашивания белка соединения.
- Выберите ломтики для анализа формы клеток из аической области монослой.
- Сфотируйте по крайней мере 3 различных поля зрения (200-400 клеток).
- С помощью конфокального микроскопа (например, Зейсс LSM800) сфотографировать один ломтики.
2. Анализ изображений
ПРИМЕЧАНИЕ: При условии, макросы работают оптимально на ImageJ версии 1.50f или новее. Используйте для количественной оценки только изображения с высоким соотношением сигнала к шуму и без недостаточно или перенасыщенных пикселей. Описанные методы включают шаги, требующие ручной регулировки параметров. Таким образом, рекомендуется слепой анализ/слепая настройка эксперимента. Для шифрования имен файлов изображений могут использоваться плагины ImageJ, такие как "Слепой инструмент анализа" (доступен по адресу: https://imagej.net/Blind_Analysis_Tools).
- Анализ фокусной адгезии
ПРИМЕЧАНИЕ: Рекомендуемые файлы ввода для следующих методов: изображения FAs, представленные в 8-битном сером масштабе, сохраненном в формате .tiff.- Открытое изображение с помощью ImageJ.
- Установите шкалу изображения на пиксели(Анализ Шкала установки; Удалите шкалу и проверьте глобальную опцию).
- Включите название файла и область рентабельности инвестиций в варианты измерений(Анализ Набор измерений...); проверить параметры области и отображения этикетки.
- Вычитание фона(Процесс Вычитать фон; установить параметр радиуса Катетья шара до 50 пикселей; проверить скользящий параболоидный вариант). В случае псевдоцветных RGB изображений: разделить каналы RGB, оставить канал с FAs открыт, закрыть оставшиеся каналы (Изображение Цвет Сплит каналов).
- Определите площадь наименьшего интересующего региона (ROI). Использование от руки или выбора полигона наметить наименьший фокусной спайки и измерить его площадь (Анализ Мера). Повторите этот шаг для различных ROIs (FAs) из нескольких случайно выбранных изображений (в общей сложности 20 ROIs). Рассчитайте и сохраните среднее значение полученных результатов.
ПРИМЕЧАНИЕ: Этот шаг необходим только тогда, когда данный набор изображений анализируется впервые (специфическая линия клеток, слайды покрытия с конкретными внеклеточными матричными компонентами, различные условия культуры). - Преобразуйте изображение в двоичный, используя один из следующих методов:
- Установить глобальный порог(Изображение Отрегулируйте Порог; проверяйте параметры по умолчанию, B и W и Dark Background, подготовим порог вручную или установите его автоматически).
- Установите локальный порог(изображение Отрегулируйте Автоместный порог...; установить метод для Phansalkar и проверить белые объекты на черном фоне вариант. Далее, инвертировать изображение(Редактировать Инвертировать).
- Измерьте количество и площадь ОИ. Выберите Анализ (ru) Проанализируйте частицы; проверить пиксель единиц, результаты отображения, четкие результаты и суммировать варианты, установить параметр размера, как нижняя граница использовать среднее из самых маленьких ROIs от шага 2.1.5. Верхняя граница может быть установлена до 25% от типичной области ячейки.
- Передача данных (которая включает имя изображения, количество FAs, общая и средняя площадь FAs; соответственно Slice, Count, Total Area, Средний размер)из окна Резюме в программу управления данными по выбору.
- Определите количество клеток на изображении, считая окрашенные DAPI ядра. Подсчет можно сделать вручную(Plugins Анализ Cell Counter) или как в доступных протоколах, таких как: https://imagej.net/Nuclei_Watershed_Separation.
- Кроме того, для облегчения подсчета FAs, используйте прилагаемый макрос ImageJ (FAs.ijm).
- Переместите файл .ijm с макросом на плагины или папку макросов, расположенных в папках исходных файлов ImageJ.
- Определите область наименьшей рентабельности инвестиций, описанную в шаге 2.1.4.
- Открытый макрофайт(Plugins Макросы Редактировать ...).
- Перед запуском макросу установить значение трех переменных: заполнить значение area_of_the_smallest_region_of_interest с числом, приобретенным во время шага 2.1.4. Установите значение threshold_type на ручное или автоматическое.
- Сохранить изменения (макрос должен быть готов к использованию).
- Позвоните на макрос из панели ImageJ или сделайте к нему ярлык. Макро начинается со стандартного открытого окна диалога. Выберите изображение для обработки.
ПРИМЕЧАНИЕ: В случае ручной корректировки пороговых значений потребуется ручное подтверждение порогового значения (избегайте принятия изменений с помощью кнопки Применить в окне диалога Порога, вместо этого используйте обязательное окно пользовательского диалога Action. Результаты, полученные при работе с макросом, такие же, как и результаты, описанные в шаге 2.1.8 (включены в окно диалога Резюме). Кроме того, в случае ручной регулировки порога Нижний уровень порога отображается в окне диалога журнала, так как это значение позволяет воспроизводить полученные результаты в будущем, если это необходимо. Дополнительные цифры S1 и S2 были включены в качестве набора обучающих данных для макроса FAs.ijm.
- Анализ формы клеток
- Вручную
- Откройте изображение в ImageJ или другом программном обеспечении для обработки изображений с аналогичным набором функций (дальнейшие инструкции относятся к ImageJ). Выберите параметры, которые будут измеряться, выбрав из меню Анализ Набор измерений и тикающих дескрипторов формы в появляющемся поле.
- Вручную очерчивайте границы клеток, отмеченные белком соединения (ы) выбора, используя значок выбора Freehand. Выбранные параметры автоматически рассчитываются для каждой ячейки. Храните результаты после описания каждой ячейки, нажав на Редактировать Отбор Добавить к менеджеру. Следует учитывать только полные, полностью видимые ячейки с непрерывными границами.
- Когда все ячейки в поле зрения изложены, сделать измерение, пометив все числа, появляющиеся в левой коробке менеджера рентабельности инвестиций (соответствующие ячейки) и нажав измерения Результаты отображаются в поле результаты и могут быть переданы в таблицу выбора.
- Автоматизированные
ПРИМЕЧАНИЕ: Для облегчения количественной оценки дескрипторов формы клеток (CSI, соотношение сторон, округлость, твердость) макрос ImageJ был подготовлен и прикреплен к этой статье (CSI.ijm). Макро в основном на основе ImageJ плагин называется MorphoLibJ (https://imagej.net/MorphoLibJ)5. Макро выполняет следующие шаги: 1) Расширение каждой границы изображения на 10 черных пикселей (MorpholibJ); 2) раунды дилатаций и эрозий - морфологический фильтр (MorpholibJ); 3) Поколение двоичного изображения границ клеток по морфологической сегментации «MorpholibJ»; 4) Расширение границ клеток; 5) Инверсия значения пикселей; 6) Поколение отборов и измерение площади и периметра клеток на изображении; и 7) Сохранение изображения с очерченными ячейками и выбором рентабельности инвестиций ImageJ в новый файл.- Переместите файл .ijm с макросом в папку плагинов или макросов, расположенных в папках исходных файлов ImageJ. Позвоните на макрос из панели ImageJ или сделайте к нему ярлык.
- Перед количественной оценкой нового набора данных определите значения самых маленьких и крупнейших регионов, представляющих интерес. Схема (выбор от руки или полигона) несколько (3-10) примеров самых маленьких и самых больших клеток на изображении, а затем измерить их площадь(Анализ Мера).
- Кроме того, запустите макрос с настройками по умолчанию (нижний предел размера установлен до 0, а верхний предел установлен до бесконечности), подождите, пока макрос закончится, и выберите параметр границ размера ячейки Set. Измерьте область самых маленьких и самых больших ячеек, нажав на их этикетку, а затем нажмите Мера в менеджере окупаемости ImageJ. Установите значение переменных the_smallest_cell и the_biggest_cell. Сохраните изменения, закройте все макро-диалоговые окна и снова запустите макрос.
ПРИМЕЧАНИЕ: Макрос может быть использован без установления границ размера рентабельности инвестиций, но это не рекомендуется, поскольку это значительно увеличивает вероятность измерения неподходящих фрагментов клеток или клеточных кластеров. - Начните макрос со стандартным открытым окном диалога. Выберите изображение для обработки (серый масштаб).
- Проанализируйте результаты. Выход, предоставляемый макросом, состоит из: таблицы результатов (клеточная метка, метка изображения, область ячейки«пиксели 2»,периметр ячейки«пиксели 2»,круговорота ,CSI), соотношение сторон, округлость, твердость), изображение с очерченными ячейками и списком выборов ROI (который также будет сохранен в новом файле в подотделе результатов). Таблица результатов будет автоматически скопирована на буфер обмена пользователя.
ПРИМЕЧАНИЕ: Дополнительные цифры S3 и S4 были включены в качестве набора обучающих данных для макроса CSI.ijm.
- Вручную
3. Количественная оценка
- Количественная оценка FAs
- Рассчитайте среднее число FAs и средний размер FA на клетку/ядра.
ПРИМЕЧАНИЕ: Для некоторых линий клеток можно считать FAs отдельно в различных клетках. Для клеточных линий, которые имеют сильные клеточные контакты и растут как монослой, такие как MCF7, число и размер FAs на ячейку могут быть рассчитаны путем деления значений, полученных от FAs подсчета по количеству ядер во всем изображении. - Оценить статистическую значимость потенциальных различий между популяциями (экспериментальными группами). В зависимости от распределения и дисперсии данных, для сравнения двух различных групп используйте Студенческий т-тест (нормальное распределение) или неатраметрический U-тест (Mann-Whitney). Для сравнения нескольких групп используйте односторонние ANOVA или Kruskal-Wallis в сочетании с соответствующими пост-специальными тестами.
- Рассчитайте среднее число FAs и средний размер FA на клетку/ядра.
- Анализ формы клеток
- Расчет дескрипторов форм
- Ручной анализ: Рассчитайте индекс формы клеток (CSI, также называемый круговоротностью или формой ячейки) в электронной таблице выбора для каждой измеренной ячейки из соответствующей области и периметра с использованием формулы:

ПРИМЕЧАНИЕ: CSI предполагает значения между 1 (круговой) и 0 (удлиненный). Примеры различных форм клеток (с той же областью) и соответствующие ХИ представлены на рисунке 2. При автоматизированном анализе значения дескрипторов формы (зачисленные и определенные ниже) вычисляются автоматически и отображаются в поле результатов:
(1) CSI ю 4 »область/(периметр)2
(2) AR - основная ось/малая ось
(3) Круглость 4 'область/ (основная ось)2
(4) Твердость и область/выпуклая область
- Ручной анализ: Рассчитайте индекс формы клеток (CSI, также называемый круговоротностью или формой ячейки) в электронной таблице выбора для каждой измеренной ячейки из соответствующей области и периметра с использованием формулы:
- Гистограммы распределения формы клеток
- Распределение формы клеток участка как гистограмма круговорота (CSI). Классифицировать ячейки в соответствии с их значением CSI (рассчитанным для минимум 200-400 ячеек), до одного из десяти равномерных интервалов (диапазон: 0-1, ширина ячейки: 0,1). Гистограмма отображает количество клеток в каждой категории.
ПРИМЕЧАНИЕ: Гистограмма, показывающая распределение формы типичного слоя клеток MCF7, показывает пик около 0,7-0,8 CSI. Если форма клеток искажена каким-то фактором (например, лечение паклитаксела, которое вызывает остановку фазы G2/M и в последствии больше клеток круглые), она должна быть отражена на гистограмме.
- Распределение формы клеток участка как гистограмма круговорота (CSI). Классифицировать ячейки в соответствии с их значением CSI (рассчитанным для минимум 200-400 ячеек), до одного из десяти равномерных интервалов (диапазон: 0-1, ширина ячейки: 0,1). Гистограмма отображает количество клеток в каждой категории.
- Совокупные участки распределения
- Сравните кумулятивные распределения CSI для каждой клеточной линии, поскольку это лучший способ оценить статистически важные различия в изменениях формы клеток (или любых других изменениях в распределении. Например, его можно применить для отслеживания изменяющегося распределения FAs.
- Рассчитайте функцию совокупного распределения (CDF) для сравнения дистрибутивов. CDF присваивает для данного значения CSI (на ставок на оси X) процент (или относительное количество), для которого все значения менее или равны этому значению CSI (построен на оси Y). Таким образом, по мере увеличения значения CSI процент набора значений, которые менее или равны этому значению, также становится выше. CDF может быть рассчитана по выбору статистического программного обеспечения или вручную.
- Для статистического анализа используйте непараметрический тест Колгоморова-Смирнова.
- Расчет дескрипторов форм
Результаты
Анализ фокусной адгезии
Нокдаун гена HAX1 ранее было показано, влияют на фокусные спайки6. Клетки были культивируются на поверхности коллагена I-покрытием для 48 h. Изображения клеток управления MCF7 и клеток MCF7 с нокдауном HAX1 (HAX1 KD) из трех независимых экспериментов, окрашенных с фокусной клей белка paxillin были получены с помощью конфокального микроскопа (изображение из одной фокусной плоскости / К-ломтик из базальной области). FAs от около 2000-2500 ячеек от каждой линии клетки были количественно с помощью описанного протокола. Среднее значение для наименьшей фокусной спайки было установлено до 50 (пиксель2). Репрезентативные изображения FAs рассчитывать с ImageJ, в том числе окончательные, пронумерованные очертания и наложение FAs очертания с исходным изображением, показаны для обеих линий ячейки на рисунке 3A. Различия в количестве и размере FAs в обеих клеточных линиях представлены на рисунке 3B.
Анализ формы клеток
Ручная оценка: КЛЕТКи MCF7 были культивируемы для 24 h, средство было обменено для такой же свежей среды (untreated) или среды с paclitaxel 0.1 qM (PTX) - для того чтобы навести округление клетки - и закультуряно для других 24 ч. Изображения confluent MCF7 monolayers запятнанные с антителами anti-plakoglobin и DAPI были получены используя aoc-под микроскоп (один-срез). Около 200-400 ячеек (2-3 поля зрения) из каждого эксперимента (необработанные / обработанные) были задокументированы (40x цель) и изображения были оценены с помощью программного обеспечения обработки изображений ImageJ (Рисунок 4A). Репрезентативные области каждого клеточного слоя с очерченными клетками показаны на рисунке 4A (необработанные и обработанные PTX клетки). Все клетки были классифицированы в соответствии с их значениями CSI (10 интервалов, ширина ячеек 0,1) и представлены в соответствующих гистограммах(рисунок 4B),которые показывают увеличение последнего бункера (0,9-1) и уплощение основных пиков (0,6-0,9) для обработанных PTX-клеток, по сравнению с необработанным контролем. Различия в кумулятивном распределении CSI были рассчитаны на статистическую значимость с помощью теста Колгоморова-Смирнова (K-S), непараметрического теста равенства одномерных распределений вероятностей. Гистограммы распределения частот и кумулятивные участки распределения(Рисунок 4C) были созданы с помощью программного обеспечения.
Автоматизированная оценка: КЛЕТКи MCF7 были культивируны для 24 h, фикчированных и запятнанных с флюорофор-конъюгированным фаллоидином для того чтобы визуализировать актин. Изображения были сделаны с помощью конфокального микроскопа (один ломтик из апкической области). Серые изображения монослой были проанализированы с помощью прикрепленного макрофайла, в соответствии с включенным протоколом(рисунок 5A-C). В целом были количественно оценены 512 ячеек из 12 областей зрения. Результаты были построены как гистограмма, представляющая распределение круговой(Рисунок 5D).
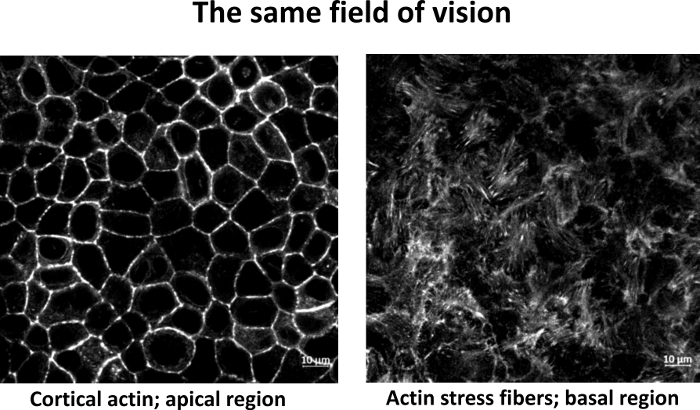
Рисунок 1: Actin окрашивания с фторфор-конъюгированный фаллоидин, два различных й-ломтики из того же поля зрения. (A) А) Апкическая область с корковым актином. (B) Базальная область с actin стресс волокон. Бар: 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 2: Примеры различных значений индекса формы клеток (CSI) для фигур с различными периметрами, но одной и той же области. Очень удлиненная форма слева имеет CSI близко к 0, в то время как идеальный круг справа имеет CSI 1. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
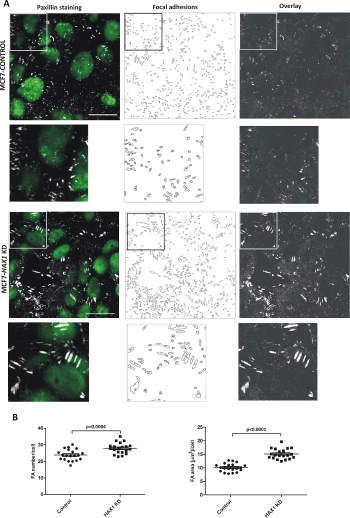
Рисунок 3: Количественная оценка фокусной слипания. (A) Представитель изображения MCF7 основе линий клеток: CONTROL и HAX1 KD окрашенных с paxillin; слева направо: (1) паксиллин и ядра (2) изложены и пронумерованы FAs (3) наложение FAs очертания и оригинальное изображение. Бар: 20 мкм. Вставки (ниже каждого рисунка) показывают увеличенные области коробки. (B) Участки, показывающие разницу в размере и количестве FAs между двумя линиями ячейки. Статистическая значимость оценивалась с помощью студенческого т-теста. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
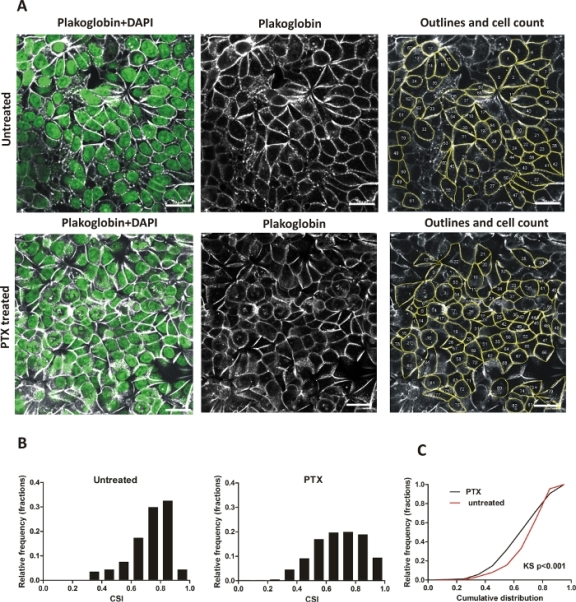
Рисунок 4: Изменения в форме клеток, вызванные паклитакселом (PTX) в слое ячейки MCF7; ручное количество. (A) Представитель регионов MCF7 монослой, клетки необработанных и обработанных с ПОМОЩЬЮ PTX, окрашенных с помощью соединения белка plakoglobin и DAPI, бар: 20 мкм. Панель справа показывает изображение, обработанное в ImageJ; края ячейки очерчены и все подсчитанные ячейки пронумерованы. (B) Гистограммы, показывающие распределение CSI в необработанных и PTX-обработанных клеток, 200-400 клеток в каждом эксперименте (необработанные / обработанные), ширина бункера: 0,1. Участки создавались с помощью анализа распределения частот с относительными частотами в качестве фракции. (C) Участок кумулятивного распределения для необработанных и PTX обработанных монослой. Статистическая разница рассчитывается с помощью непараметрического теста Колгоморова-Смирнова (КС). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
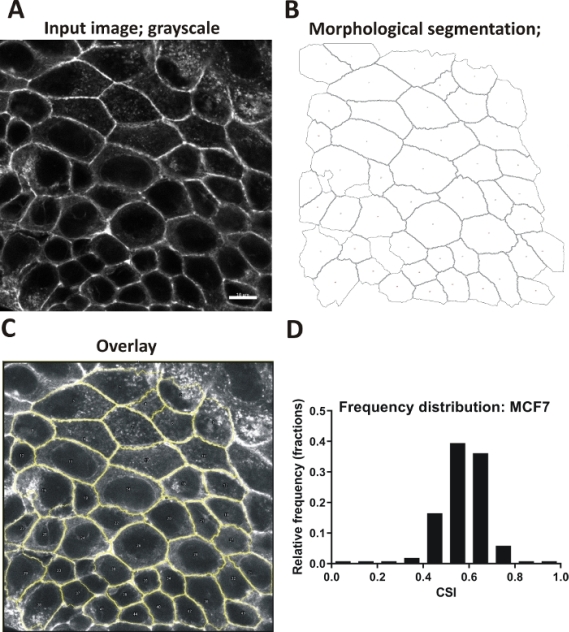
Рисунок 5: Форма ячейки в монослоях MCF7, оцениваемая с помощью автоматизированного метода. (A-C) Пример автоматизированного анализа изображений, иллюстрирующий последующие шаги, выполненные прикрепленным макросом. (A) Входное изображение; корковый актин; серый масштаб, масштаб бар 10 мкм (для информативных целей; масштабные бары не должны быть встроены в анализируемые изображения). (B) Слой клетки после сегментации; клеточные границы изложены; ячейки без полных границ устранены. (C) Наложение контуров ячейки на исходном изображении. (D) Гистограмма, показывающая распределение CSI в анализируемом наборе данных, 512 ячеек. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
Дополнительный рисунок S1, S2: КЛЕТКи MCF7, паксиллин и DAPI-окрашенные для визуализации FAs и ядер. Предоставляется в качестве набора обучающих данных для макроса FAs.ijm.
Рисунок S1: Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Рисунок S2: Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Дополнительный рисунок S3, S4: КЛЕТКи MCF7, плакоглобин и DAPI-окрашенные для визуализации клеточных клеточных соединений и ядер. Предоставляется в качестве набора обучающих данных для макроса CSI.ijm.
Рисунок S3: Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Рисунок S4: Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
FAs.txt: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Клеточная и клеточно-субстратная адгеция являются неотъемлемыми атрибутами эпителиальных клеток и играют решающую роль в морфогенезе ткани и эмбриогенезе. В взрослых тканях правильное регулирование механических свойств клеточного слоя имеет решающее значение для поддержания гомеостаза и предотвращения патологических реакций, таких как прогрессирование опухоли и метастазы. Размер и количество фокусных спаек зависят от силы клеточной субстратной спайки, в то время как форма клеток зависит от сократительных сил и связана со статусом клеточных клеточных контактов.
Здесь мы описываем два простых метода количественного анализа области, количества и формы клеточных структур, окрашенных иммунофлуоресценцией, в данном случае фокусных спаек и целых клеток в клеточном слое. Однако предлагаемые инструменты могут быть перепрофилированы для количественной оценки любой выбранной структуры. Ключевым вопросом для этих анализов является качество иммунофлуоресцентного окрашивания и конфокальной визуализации. Эти методы могут быть реализованы в любой стандартной лаборатории, оснащенной блоком клеточной культуры и конфокальным микроскопом. Они предназначены для сравнения клеточных линий, особенно когда различия (естественные или индуцированные специфической обработкой) в измеренных параметрах являются существенными. Им не рекомендуется измерять мельчайшие различия или устанавливать абсолютные измерения, поскольку они чувствительны к минимальным изменениям в первоначальных произвольных настройках, особенно в случае фокусных спаек. Этот метод количественной оценки FAs уступает более продвинутым и специфическим методам, таким как микроскопия TIRF, но имеет преимущество, не требующее сложного оборудования.
Аналогичные методы измерения фокусной адгезии были описаны до7,,8,,9,,10. Здесь мы определили настройки и создали бесплатный макрос ImageJ, с несколькими вариантами, чтобы облегчить измерения.
Анализ формы клеток был описан много раз, в том числе очень сложные и подробные методы11,12. Здесь мы представляем простой метод отслеживания изменений в моносейе эпителиальных клеток, которые могут быть очень важны для сравнения морфологии клеток или изменений в развитии. Ручной метод анализа формы клеток в монослойках, представленный в этом протоколе, был описан в предыдущем отчете6. Формула CSI как способ описать и сравнить форму объекта (ы) широко используется в различных дисциплинах13,14, в том числе геологии, из которых он возник. Представление результатов в виде гистограммы и/или в качестве кумулятивной функции распределения обычно используется для сравнения распределений любого рода8,,10,,15.
Примечательно, что мы представляем здесь инструмент для автоматизированного анализа формы ячейки на основе плагина ImageJ MorhpLibJ (https://imagej.net/MorphoLibJ). Мы предоставляем макро файл, который может выполнять этот анализ быстро и эффективно. Этот метод не всегда распознает правильные границы клеток, но процент неисправных измерений (которые присутствуют в каждом автоматизированном анализе) является минимальным и не должен существенно влиять на конечный результат, особенно если достаточное количество ячеек анализируется. Ячейки без полных границ ликвидированы. Автоматизированный анализ формы клеток имеет неоспоримые преимущества, и мы представляем этот метод, чтобы он мог быть оценен научным сообществом.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Польским национальным научным центром в рамках гранта No 2014/14/M/N'1/00437.
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 594 | ThermoFisher Scientific | A32740 | goat anti-rabbit, 1:500 |
| Ammonium chloride | Sigma | A9434 | |
| BSA | BioShop | ALB001.500 | |
| Collagen from calf skin | Sigma | C9791-10MG | |
| DAPI | Sigma | D9542 | 1:10000 (stock 1 mg/mL in H2O), nucleic acid staining |
| DMEM + GlutaMAX, 1 g/L D-Glucose, Pyruvate | ThermoFisher Scientific | 21885-025 | |
| FBS | ThermoFisher Scientific | 10270-136 | |
| Junction plakoglobin | Cell Signaling | 2309S | rabbit, 1:400 |
| Laminar-flow cabinet class 2 | Alpina | standard equipment | |
| MCF7-basedHAX1KD cell line | Cell line established in the National Institute of Oncology, Warsaw, described in Balcerak et al., 2019 | MCF7 cell line withHAX1knockdown | |
| MCF7 cell line (CONTROL) | ATCC | ATCC HTB-22 | epithelial, adherent breast cancer cell line |
| Olympus CK2 light microscope | Olympus | ||
| Paxillin | Abcam | ab32084 | rabbit, 1:250, Y113 |
| PBS | ThermoFisher Scientific | 10010023 | |
| Phalloidin-TRITC conjugate | Sigma | P1951 | 1:400 (stock 5 mg/mL in DMSO), actin labeling |
| PTX | Sigma | T7402-1MG | |
| TBST – NaCl | Sigma | S9888 | |
| TBST – Trizma base | Sigma | T1503 | |
| Triton X-100 | Sigma | 9002-93-11 | |
| Zeiss LSM800 Confocal microscope | Zeiss |
Ссылки
- Li, D. S., Zimmermann, J., Levine, H. Modeling closure of circular wounds through coordinated collective motion. Search Results. 13 (1), 016006 (2016).
- Ilina, O., Friedl, P. Mechanisms of collective cell migration at a glance. Journal of Cell Science. 122, 3203-3208 (2009).
- Ladoux, B., Mege, R. M. Mechanobiology of collective cell behaviours. Nature Reviews Molecular Cell Biology. 18 (12), 743-757 (2017).
- Stossi, F., et al. High throughput microscopy identifies bisphenol AP, a bisphenol A analog, as a novel AR down-regulator. Oncotarget. 7 (13), 16962-16974 (2016).
- Legland, D., Arganda-Carreras, I., Andrey, P. MorphoLibJ: integrated library and plugins for mathematical morphology with ImageJ. Bioinformatics. 32 (22), 3532-3534 (2016).
- Balcerak, A., et al. HAX1 impact on collective cell migration, cell adhesion, and cell shape is linked to the regulation of actomyosin contractility. Molecular Biology of the Cell. 30 (25), 3024-3036 (2019).
- Buskermolen, A. B. C., Kurniawan, N. A., Bouten, C. V. C. An automated quantitative analysis of cell, nucleus and focal adhesion morphology. PLoS One. 13 (3), 0195201 (2018).
- Fokkelman, M., et al. Cellular adhesome screen identifies critical modulators of focal adhesion dynamics, cellular traction forces and cell migration behaviour. Scientific Reports. 6, 31707 (2016).
- Horzum, U., Ozdil, B., Pesen-Okvur, D. Step-by-step quantitative analysis of focal adhesions. MethodsX. 1, 56-59 (2014).
- Kim, D. H., Wirtz, D. Focal adhesion size uniquely predicts cell migration. FASEB Journal. 27 (4), 1351-1361 (2013).
- Pincus, Z., Theriot, J. A. Comparison of quantitative methods for cell-shape analysis. Journal of Microscopy. 227, 140-156 (2007).
- Tsygankov, D., et al. CellGeo: a computational platform for the analysis of shape changes in cells with complex geometries. Journal of Cell Biology. 204 (3), 443-460 (2014).
- Tiryaki, V. M., Adia-Nimuwa, U., Ayres, V. M., Ahmed, I., Shreiber, D. I. Texture-based segmentation and a new cell shape index for quantitative analysis of cell spreading in AFM images. Cytometry A. 87 (12), 1090-1100 (2015).
- Tong, J., et al. Cell micropatterning reveals the modulatory effect of cell shape on proliferation through intracellular calcium transients. Biochimica et Biophysica Acta. 1864 (12), 2389-2401 (2017).
- Vartanian, K. B., Kirkpatrick, S. J., Hanson, S. R., Hinds, M. T. Endothelial cell cytoskeletal alignment independent of fluid shear stress on micropatterned surfaces. Biochemical and Biophysical Research Communications. 371 (4), 787-792 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены