Method Article
القياس الكمي لمنطقة التصاق الخلايا الركازة وتوزيعات شكل الخلية في الطبقات الأحادية الخلية MCF7
In This Article
Summary
ويصف المقال كم من 1) حجم وعدد من الالتصاقات البؤري و 2) مؤشر شكل الخلية وتوزيعها من الصور confocal من monolayers التقاء من الخلايا MCF7.
Abstract
الأساليب المعروضة هنا كمي بعض المعلمات من monolayers الخلية التقاء التصاق من الصور متعددة ملوّن بشكل مناسب confocal: التصاق إلى الركيزة كدالة لعدد وحجم التصاقات البؤري، وشكل الخلية، التي تتميز مؤشر شكل الخلية وغيرها من واصفات الشكل. تم تصور الالتصاقات البؤرية بواسطة تلطيخ paxillin وكانت الحدود الخلوية مميزة بتقاطع plakoglobin و actin. وكانت أساليب زراعة الخلايا وتلطيخها قياسية؛ تمثل الصور مستويات بؤرية واحدة؛ تم إجراء تحليل الصور باستخدام برامج معالجة الصور المتاحة للجمهور. وتستخدم البروتوكولات المعروضة لتحديد عدد وحجم الالتصاقات البؤرية والاختلافات في توزيع شكل الخلايا في الطبقات الأحادية، ولكن يمكن إعادة استخدامها لتحديد حجم وشكل أي بنية خلوية متميزة أخرى يمكن أن تكون ملطخة (على سبيل المثال، الميتوكوندريا أو نوكلي). تقييم هذه المعلمات مهم في توصيف القوى الديناميكية في طبقة الخلية المنضمة، بما في ذلك التصاق الخلية وانكماش أكتوميوسين الذي يؤثر على شكل الخلية.
Introduction
monolays الخلية الظهارية بمثابة الجماعية التي خلية الخلية وخلوية الركيزة التصاق وكذلك القوى المتعاقدة والتوترات تمثل المعلمات الهامة وتوازنها السليم يساهم في سلامة الشاملة للوحدة1،2،3. وهكذا، فإن تقييم هذه المعلمات يمثل وسيلة لتحديد الوضع الحالي لطبقة الخلية.
الطريقتان الموصوفتان هنا تمثلان تحليلا ثنائي الأبعاد للطبقات الأحادية المتقاربة للخلايا الظهارية (في هذه الحالة MCF7 خط خلايا سرطان الثدي). ويتم إجراء التحليل باستخدام الصور confocal (واحد Z-شرائح) من مناطق مختلفة على المحور Z; منطقة القاعدية بالقرب من الركيزة لقياسات الالتصاق البؤري (FA) والمنطقة apical لقياسات شكل الخلية. الطرق المعروضة بسيطة نسبيا وتتطلب تقنيات مختبرية معيارية وبرامجية مفتوحة المصدر. المجهر Confocal كافية لهذا البروتوكول، لذلك يمكن أن يؤديها دون استخدام أكثر تخصصا TIRF (الانعكاس الداخلي الكلي الفلورية) المجهر. وهكذا، يمكن تنفيذ البروتوكول في إطار مختبري معياري نسبياً. على الرغم من أن دقة الطرق محدودة، إلا أنها يمكن أن تميز الاختلافات الأساسية في الالتصاق البؤري وشكل الخلية.
كلا الأسلوبين الموصوفين هنا تتكون من الإجراءات التجريبية القياسية مثل زراعة الخلايا، والمناعة، والتصوير confocal وتحليل الصور التي أجريت باستخدام ImageJ. ومع ذلك، يمكن استخدام أي برنامج معالجة الصور مع وظائف مناسبة. ويمكن للطرق المعروضة أن تتعقب وتقارن التغيرات التي يحدثها العلاج الدوائي أو الحد الأدنى من التعديل الوراثي. لا ينصح بالحصول على قيم محددة، نظراً لدقة محدودة لهذه الطرق. تم تضمين اثنين من وحدات الماكرو الآلي، لتسهيل قياسات العديد من الصور.
Protocol
1 - الخطوات التحضيرية
- بذر الخلية للحصول على monolayers التقاء
- قبل البذر، معطف آبار شريحة غرفة 4-آبار مع الكولاجين الأول (أو عنصر ECM آخر من الاختيار). لطلاء الكولاجين الأول، اتبع بروتوكول تجاري: https://www.sigmaaldrich.com/technical-documents/articles/biofiles/collagen-product-protocols.html بتركيز 8 ميكروغرام/سم2.
- بذور 400،000 الخلايا إلى بئر واحد من شريحة غرفة 4-جيدا.
- ثقافة الخلايا لمدة 24 ساعة (أو لفترة أطول، اعتمادا على نقاط النهاية التجريبية) قبل تلطيخ، في حاضنة في 37 °C، 5٪ CO2. هذه الخطوة تسمح لنضوج اتصالات الخلية الخلية وتشكيل monolayers.
- استخدام بصري، المجهر المقلوب للتحقق من التقاء (حوالي 90٪ مطلوب) وحالة عامة من monolayers. لا تستمر إذا كانت الخلايا عائمة أو تبدو مجهدة.
- تلوين مناعي
ملاحظة: يمكن أن تكون الخلايا ملطخة ببروتوكول من اختيار. هنا، تم تنفيذ الفلوروسنس المناعي كما سبق وصفه4.- لتحليل التصاق التنسيق، وصمة عار الخلايا مع بروتين التصاق التنسيق من الاختيار (في هذا البروتوكول paxillin). لخلية شكل تحليل وصمة عار مع خلية خلية وصلة البروتين من الاختيار (في هذا البروتوكول البروتين desmosomal plakoglobin).
- بالنسبة للإجراء، استخدم 0.5 مل من الحلول المحددة ما لم يتم تحديد خلاف ذلك.
- إصلاح الخلايا في الفورمالديهايد 4٪ في برنامج تلفزيوني لمدة 30 دقيقة على الجليد.
- احتضان مع 0.1 M الأمونيوم كلوريد (في برنامج تلفزيوني) لمدة 10 دقيقة لإخماد لصناعة السيارات fluorescence.
- إضافة 0.5٪ تريتون X-100 (في برنامج تلفزيوني) لمدة 30 دقيقة (permeabilization).
- كتلة مع 5٪ حليب (أو 1٪ BSA) في TBS-T لمدة 1 ساعة.
- احتضان مع الأجسام المضادة الأولية في 4 درجة مئوية بين عشية وضحاها (المضادة لباكسيلين: أرنب، 1:250، المضادة plakoglobin: أرنب، 1:400)
- احتضان مع الأجسام المضادة الثانوية لمدة 30 دقيقة (اليكسا فلور 594 الماعز المضادة للأرنب، 1:500، 1:500)
- وصمة عار مع 300 NM DAPI لمدة 1-5 دقيقة، وحمايتها من الضوء.
ملاحظة: اختيارياً، قد يتم تنفيذ تلطيخ إضافية من actin مع conjugates phalloidin الفلورية (conc. 1:400) ; يجب إضافة phalloidin في نفس الخطوة مثل الأجسام المضادة الثانوية.
- التصوير Confocal
- التقاط صور لشرائح Z واحدة باستخدام المجهر confocal (على سبيل المثال، زيس LSM800).
ملاحظة: قد تساعد تلطيخ actin الاختيارية في تقييم المستوى البؤري المناسب. تلطّخ الكوّن القشري موجود في المنطقة المُضَلّية بينما توجد ألياف الإجهاد actin في المنطقة القاعدية، بالقرب من الركيزة، كما هو موضح في الشكل 1. - التصوير التصاق البؤري
- اختر شرائح Z لتحليل التصاق البؤري من المنطقة القاعدية، على مقربة من الركيزة.
- استخدام هدف مع أعلى الفتحة العددية المتاحة (يفضل 63x N.A.: 1.4).
ملاحظة: شكل FA محدد جداً ويمكن التعرف عليه بسهولة. وهكذا، فمن المستحسن لبدء المسح الضوئي من مستوى التنسيق تحت الخلايا ومن ثم مسح ببطء نحوها، حتى FAs مرئية بوضوح. سيكون تحليل الصور أكثر دقة من مجالات الرؤية الأصغر ، والتي تميل إلى أن تكون أكثر اتساقًا ، ولكن هذا يعني أنه سيتم حساب عدد أقل من الخلايا في مجال رؤية واحد.
- تصوير جهات اتصال الخلية
- استخدم هدف 40x أو 63x.
- حدد قنوات للتلوين النووي وتلطيخ بروتين التقاطع المفضل.
- اختر شرائح Z لتحليل شكل الخلية من المنطقة الزّلية للطبقات الأحادية.
- التقاط الصور ل3 على الأقل مجالات مختلفة من الرؤية (200-400 الخلايا).
- التقاط صور لشرائح Z واحدة باستخدام المجهر confocal (على سبيل المثال، زيس LSM800).
2. تحليل الصور
ملاحظة: وحدات الماكرو المتوفرة تعمل على النحو الأمثل على الإصدار 1.50f أو أحدث. يستخدم في القياس الكمي فقط للصور ذات نسبة إشارة عالية إلى الضوضاء وبدون وحدات بكسل أقل أو غير مشبعة. تتضمن الطرق الموصوفة خطوات تتطلب تعديل المعلمة يدويًا. وبالتالي، ينصح تحليل أعمى / إعداد التجربة أعمى. لتشفير أسماء ملفات الصور، يمكن استخدام الإضافات ImageJ مثل "أداة التحليل الأعمى" (المتوفرة على: https://imagej.net/Blind_Analysis_Tools).
- تحليل الالتصاق البؤري
ملاحظة: ملفات الإدخال الموصى بها للأساليب التالية: صور FAs ممثلة في الرمادي 8 بت حفظ بتنسيق .tiff.- افتح الصورة باستخدام ImageJ.
- تعيين مقياس الصورة إلى بكسل (تحليل | تعيين مقياس;; إزالة مقياس ثم تحقق من خيار عمومي).
- إدراج اسم الملف ومنطقة العائد على الاستثمار في خيارات القياس (تحليل | تعيين القياسات...); حدد خيارات تسمية المنطقة والعرض.
- طرح الخلفية (العملية | طرح الخلفية; تعيين المعلمة نصف قطر الكرة المتداول إلى 50 بكسل؛ تحقق من انزلاق الخيار مكافئة). في حالة الصور RGB pseudocolored: قنوات RGB الانقسام، وترك القناة مع FAs فتح، وإغلاق القنوات المتبقية (صورة | لون | انقسام القنوات).
- تحديد مساحة أصغر منطقة ذات فائدة (ROI). باستخدام التحديدات اليدوي أو المضلع الخطوط العريضة أصغر التصاق بؤري واحد وقياس مساحته(تحليل | القياس). كرر هذه الخطوة لـ ROIs مختلفة (FAs) من بعض الصور التي تم اختيارها عشوائياً (ما مجموعه 20 ريال عماني). حساب و حفظ الوسط من النتائج التي تم الحصول عليها.
ملاحظة: هذه الخطوة مطلوبة فقط عندما يتم تحليل مجموعة معينة من الصور للمرة الأولى (خط خلية محدد، والشرائح الطلاء مع مكونات مصفوفة خارج الخلية محددة، شروط ثقافة مختلفة). - تحويل الصورة إلى ثنائي باستخدام إحدى الطرق التالية:
- تعيين العتبة العالمية(صورة | ضبط | الحد الأدنى؛ تحقق من خيارات افتراضي، B&W والخلفية الداكنة، أو قم بضبط العتبة يدويًا أو قم بتعيينها تلقائيًا).
- تعيين العتبة المحلية(صورة | ضبط | عتبة محلية تلقائية...; تعيين الأسلوب إلى Phansalkar والتحقق من الكائنات البيضاء على خيار خلفية سوداء. بعد ذلك، عكس الصورة (تحرير | العكس).
- قياس عدد ومنطقة ريال عماني. حدد تحليل | تحليل الجسيمات; تحقق من وحدات بكسل، نتائج العرض، مسح النتائج وخيارات التلخيص، تعيين معلمة الحجم، كحد أدنى استخدام متوسط أصغر ROIs من الخطوة 2.1.5. يمكن تعيين الحد العلوي إلى 25% من مساحة خلية نموذجية.
- نقل البيانات (التي تشمل اسم الصورة، وعدد FAs، وإجمالي ويعني مساحة FAs؛ على التوالي شريحة، عدد، المساحة الإجمالية، متوسط الحجم)من إطار ملخص إلى برنامج إدارة البيانات من اختيار.
- تحديد عدد الخلايا لكل صورة عن طريق عد النوى الملطخة DAPI. يمكن إجراء العد يدوياً(الإضافات | تحليل | عداد الخلية)أو كما في البروتوكولات المتوفرة مثل: https://imagej.net/Nuclei_Watershed_Separation.
- بدلاً من ذلك، لتسهيل عمليات الاعتماد على الـ FAs، استخدم الماكرو ImageJ المرفق (FAs.ijm).
- نقل ملف .ijm مع الماكرو إلى الإضافات أو المجلدات الماكرو الموجودة في المجلدات ملفات المصدر ImageJ.
- تحديد مساحة أصغر عائد استثمار كما هو موضح في الخطوة 2.1.4.
- فتح ملف الماكرو (الإضافات | وحدات الماكرو | تحرير...
- قبل تشغيل الماكرو تعيين قيمة متغيرات ثلاثة: قيمة التعبئة area_of_the_smallest_region_of_interest مع رقم المكتسبة أثناء الخطوة 2.1.4. قم بتعيين قيمة threshold_type إلى يدوي أو تلقائي.
- حفظ التغييرات (يجب أن يكون الماكرو جاهز للاستخدام).
- قم باستدعاء الماكرو من لوحة ImageJ أو قم بعمل اختصار له. يبدأ الماكرو مع إطار الحوار المفتوح القياسي. حدد الصورة التي ستتم معالجتها.
ملاحظة: في حالة ضبط عتبة يدوي، سيتم طلب تأكيد يدوي من قيمة عتبة (تجنب قبول التغييرات باستخدام تطبيق زر في إطار الحوار عتبة استخدام الإجراء المطلوب إطار الحوار المخصص بدلاً من ذلك). النتائج التي تم الحصول عليها بواسطة العمل مع الماكرو هي نفسها كما هو موضح في الخطوة 2.1.8 (المضمنة في إطار الحوار الملخص). بالإضافة إلى ذلك، في حالة ضبط عتبة يدوي مستوى العتبة الأدنى يتم عرض في إطار حوار سجل، كما تسمح هذه القيمة إلى إعادة إنتاج النتائج التي تم الحصول عليها في المستقبل إذا لزم الأمر. تم تضمين الأرقام التكميلية S1 و S2 كـ مجموعة بيانات تدريبية لمكرو FAs.ijm.
- تحليل شكل الخلية
- دليل
- فتح صورة في ImageJ أو برنامج آخر لمعالجة الصور مع مجموعة مماثلة من الوظائف (تعليمات إضافية تتعلق ImageJ). اختر المعلمات التي سيتم قياسها عن طريق الاختيار من القائمة Analysis | تعيين القياسات و واصفات الشكل الموقّتة في المربع الظاهر.
- تعيين حدود الخلايا يدويًا، التي تتميز ببروتين (بروتين) الوصلات من الاختيار، باستخدام رمز التحديدات اليدوية. يتم حساب المعلمات المختارة تلقائياً لكل خلية. تخزين النتائج بعد تحديد كل خلية بالنقر على تحرير | اختيار | إضافة إلى مدير. وينبغي أن تحسب فقط كاملة، وخلايا مرئية تماما، مع حدود دون انقطاع.
- عندما يتم تحديد جميع الخلايا في مجال الرؤية، قم بإجراء القياس عن طريق وضع علامة على جميع الأرقام التي تظهر في المربع الأيسر لمدير ROI (المقابل للخلايا) والنقر على قياس تظهر النتائج في مربع النتائج ويمكن نقلها إلى جدول البيانات الذي تختاره.
- الالي
ملاحظة: لتسهيل التحديد الكمي لصفات شكل الخلية (CSI، نسبة العرض إلى الارتفاع، استدارة، صلابة) تم إعداد ماكرو ImageJ وإرفاقه بهذه المقالة (CSI.ijm). ويستند الماكرو أساسا على ImageJ المساعد دعا MorphoLibJ (https://imagej.net/MorphoLibJ)5. الماكرو ينفذ الخطوات التالية: 1) امتداد كل حدود الصورة بواسطة 10 بكسل أسود [MorpholibJ]; 2) جولات من التمددات والتآكلات - مرشح المورفولوجية [MorpholibJ]؛ 3) جيل من الصور الثنائية من حدود الخلايا عن طريق تجزئة المورفورية [MorpholibJ]؛ 4) تمدد حدود الخلية؛ 5) عكس قيمة بكسل؛ 6) توليد الاختيارات وقياس المنطقة ومحيط الخلايا على الصورة؛ و 7) حفظ الصورة مع الخلايا المبينة وMededj ROI التحديدات إلى ملف جديد.- نقل الملف .ijm مع الماكرو إلى المجلد الإضافات أو وحدات الماكرو الموجودة في المجلدات الملفات المصدر ImageJ. قم باستدعاء الماكرو من لوحة ImageJ أو قم بعمل اختصار له.
- قبل التحديد الكمي لمجموعة بيانات جديدة، تحديد قيم أصغر وأكبر المناطق ذات الأهمية. مخطط (حرية أو اختيار المضلع) أمثلة قليلة (3-10) من أصغر وأكبر الخلايا على الصورة ومن ثم قياس منطقتهم (تحليل | القياس).
- بدلاً من ذلك، قم بتشغيل الماكرو مع الإعدادات الافتراضية (يتم تعيين الحد الأدنى لحجم إلى 0 وتعيين الحد الأعلى إلى ما لا نهاية)، انتظر الماكرو لإنهاء وحدد تعيين حدود حجم الخلية الخيار. قم بقياس مساحة أصغر وأكبر الخلايا بالنقر على الملصق ثم اضغط على قياس في ImageJ ROI Manager. تعيين قيمة the_smallest_cell ومتغيرات the_biggest_cell. حفظ التغييرات وإغلاق كافة إطارات حوار الماكرو وتشغيل الماكرو مرة أخرى.
ملاحظة: يمكن استخدام الماكرو دون تعيين حدود حجم العائد على الاستثمار ولكن لا ينصح لأنه يزيد بشكل كبير فرصة قياس شظايا الخلايا غير ملائمة أو كتل الخلايا. - بدء تشغيل الماكرو مع إطار الحوار فتح القياسية. حدد الصورة التي ستتم معالجتها (تدرج الرمادي).
- تحليل النتائج. يتكون الإخراج الذي يقدمه الماكرو من: جدول النتائج (تسمية الخلية، تسمية الصورة، منطقة الخلية [بكسل2]، محيط الخلية [بكسل2]، دائرية [CSI] ، نسبة العرض إلى الارتفاع ، استدارة ، صلابة) ، صورة مع الخلايا المحددة وقائمة تحديدات ROI (والتي سيتم حفظها أيضًا في ملف جديد في المجلد الفرعي النتائج). سيتم نسخ جدول النتائج تلقائياً إلى الحافظة الخاصة بالمستخدم.
ملاحظة: تم تضمين الأرقام التكميلية S3 و S4 كـ مجموعة بيانات تدريب لمكرو CSI.ijm.
- دليل
3- تحديد الكم
- القياس الكمي لـ FAs
- حساب متوسط عدد FAs ومتوسط حجم FA لكل خلية/نوات.
ملاحظة: بالنسبة لبعض خطوط الخلايا فمن الممكن حساب FAs بشكل منفصل في خلايا مميزة. بالنسبة لخطوط الخلايا التي تحتوي على اتصالات قوية بخلية الخلية وتنمو كطبقات أحادية مثل MCF7، يمكن حساب عدد وحجم FAs لكل خلية بقسمة القيم التي تم الحصول عليها من FAs التي يتم عدها بعدد النوى في الصورة بأكملها. - تقييم الأهمية الإحصائية للاختلافات المحتملة بين السكان (المجموعات التجريبية). اعتمادا على توزيع و تباين البيانات، للمقارنة بين المجموعتين المختلفة استخدام الطالب t-اختبار (التوزيع العادي) أو غير بارامترية U اختبار (مان ويتني). للمقارنة بين مجموعات متعددة استخدام ANOVA أو Kruskal-Wallis في اتجاه واحد بالتزامن مع اختبارات ما بعد المخصص المناسبة.
- حساب متوسط عدد FAs ومتوسط حجم FA لكل خلية/نوات.
- تحليل شكل الخلية
- حساب واصفات الشكل
- التحليل اليدوي: حساب فهرس شكل الخلية (CSI، ويسمى أيضا دائرية أو شكل الخلية) في جدول البيانات من اختيار لكل خلية قياس من المنطقة المناسبة والمحيط باستخدام الصيغة:

ملاحظة: يفترض CSI القيم بين 1 (دائري) و0 (ممدود). وترد أمثلة أشكال الخلايا المختلفة (مع نفس المنطقة) وCSIs الخاصة بها في الشكل 2. في التحليل الآلي يتم حساب قيم واصفات الشكل (مُدرج و معرفة أدناه) تلقائياً وتظهر في مربع النتيجة:
(1) CSI = 4π* المنطقة/ (محيط)2
(2) ع = المحور الرئيسي/ المحور الثانوي
(3) استدارة = 4 * منطقة / π * (المحور الرئيسي)2
(4) صلابة = منطقة/ منطقة محدبة
- التحليل اليدوي: حساب فهرس شكل الخلية (CSI، ويسمى أيضا دائرية أو شكل الخلية) في جدول البيانات من اختيار لكل خلية قياس من المنطقة المناسبة والمحيط باستخدام الصيغة:
- مدرجات توزيع شكل الخلية
- رسم توزيع شكل الخلية كـ مدرج تكراري من التدوير (CSI). تصنيف الخلايا وفقا لقيمة CSI الخاصة بهم (محسوبة للحد الأدنى من 200-400 خلية)، إلى واحدة من الفواصل العشر الموحدة (النطاق: 0-1، عرض سلة: 0.1). يعرض الرسم البياني عدد الخلايا في كل فئة.
ملاحظة: يظهر الرسم البياني الذي يعرض توزيع شكل طبقة الخلايا MCF7 النموذجية ذروة حوالي 0.7-0.8 CSI. إذا تم تشويه شكل الخلايا من قبل بعض العوامل (على سبيل المثال العلاج paclitaxel، الذي يسبب G2/M مرحلة الاعتقال وفي النتيجة المزيد من الخلايا هي الجولة) ينبغي أن تنعكس على الرسم البياني.
- رسم توزيع شكل الخلية كـ مدرج تكراري من التدوير (CSI). تصنيف الخلايا وفقا لقيمة CSI الخاصة بهم (محسوبة للحد الأدنى من 200-400 خلية)، إلى واحدة من الفواصل العشر الموحدة (النطاق: 0-1، عرض سلة: 0.1). يعرض الرسم البياني عدد الخلايا في كل فئة.
- مخططات التوزيع التراكمي
- مقارنة توزيعات CSI التراكمي لكل خط خلية، لأنه هو أفضل طريقة لتقييم الاختلافات الهامة إحصائياً في تغييرات شكل الخلية (أو أي تغييرات أخرى في التوزيع. على سبيل المثال، يمكن تطبيقه لتتبع التوزيع المتغير لـ FAs.
- حساب دالة التوزيع التراكمي (CDF) لمقارنة التوزيعات. يعين CDF لقيمة CSI معينة (مرسومة على المحور س) النسبة المئوية (أو عدد نسبي) التي تكون كافة القيم أقل أو تساوي قيمة CSI هذه (رسم على المحور ص). وهكذا، كما يحصل على قيمة CSI أعلى، النسبة المئوية لمجموعة القيم التي هي أقل أو تساوي هذه القيمة أيضا يحصل على أعلى. يمكن حساب CDF بواسطة البرامج الإحصائية المختارة، أو يدوياً.
- للتحليل الإحصائي، استخدم اختبار Kolgomorov-Smirnov غير القياسي.
- حساب واصفات الشكل
النتائج
تحليل الالتصاق البؤري
وقد ثبت سابقا الضربة القاضية من الجين HAX1 تؤثر على الالتصاقات البؤري6. تم استزراع الخلايا على سطح الكولاجين المغلف I لمدة 48 ساعة. تم الحصول على صور خلايا التحكم MCF7 وخلايا MCF7 مع ضربة قاضية HAX1 (HAX1 KD) من ثلاث تجارب مستقلة ملطخة بباكسيلين بروتين التصاق البؤري باستخدام مجهر confocal (صورة من طائرة محورية واحدة / Z-شريحة من منطقة القاعدية). تم تحديد كمية FAs من حوالي 2000-2500 خلية من كل خط خلية باستخدام البروتوكول الموصوف. تم تعيين متوسط قيمة أصغر الالتصاق البؤري إلى 50 (بكسل2). يتم عرض الصور التمثيلية للـ FAs مع ImageJ ، بما في ذلك الخطوط العريضة النهائية المرقمة وتراكب الخطوط العريضة لـ FAs مع الصورة الأصلية ، لكلا الخطين الخلويين على الشكل 3A. يتم عرض الاختلافات في عدد وحجم FAs في كلا الخطين الخلويين على الشكل 3B.
تحليل شكل الخلية
التقييم اليدوي: كانت خلايا MCF7 مثقفة لمدة 24 ساعة، تم تبادل المتوسطة لنفس المتوسطة الطازجة (غير المعالجة) أو المتوسطة مع 0.1 ميكرومتر باكليتاكسيل (PTX) - للحث على التقريب الخلية - وزرع لآخر 24 ح. صور من الطبقات الأحادية MCF7 الملطخة بالأجسام المضادة لبلاكوغلوبين وDAPI تم الحصول عليها باستخدام المجهر الاكوس (واحد Z-شريحة من المنطقة apical). حوالي 200-400 الخلايا (2-3 حقول الرؤية) من كل تجربة (غير المعالجة / المعالجة) تم توثيقها (40x الهدف) وتم تقييم الصور باستخدام ImageJ برامج معالجة الصور (الشكل 4A). وترد المناطق التمثيلية لكل طبقة خلية مع الخلايا المبينة في الشكل 4A (الخلايا المعالجة المعالجة وغير المعالجة PTX). تم تصنيف جميع الخلايا وفقا لقيمها CSI (10 فترات، عرض بن 0.1) وعرضت في المدرج التكراري المعني(الشكل 4B)،والتي تظهر زيادة في سلة المهملات الأخيرة (0.9-1) وتسطيح القمم الرئيسية (0.6-0.9) للخلايا المعالجة PTX، مقارنة مع التحكم غير المعالجة. وقد حسبت الفروق في التوزيع التراكمي لـ CSI من حيث الأهمية الإحصائية باستخدام اختبار كولغوموروف - سميرنوف (K-S)، وهو اختبار غير قياسي للمساواة في توزيعات الاحتمال أحادية البعد. تم إنشاء مدرجات التكرار والتوزيع التراكمي(الشكل 4C)مع البرامج.
التقييم الآلي: كانت خلايا MCF7 مثقفة لمدة 24 ساعة ، ثابتة وملطخة بالفلوروور - phalloidin مترافق لتصور actin. تم التقاط الصور باستخدام مجهر confocal (واحد Z شريحة من منطقة apical). تم تحليل الصور الرمادية من monolayers باستخدام ملف الماكرو المرفقة، وفقا للبروتوكول المدرجة(الشكل 5A-C). وإجمالا، تم تحديد كمي 512 خلية من 12 ميدانا من مجالات الرؤية. وقد رسمت النتائج كما الرسم البياني تقديم توزيع دائرية (الشكل 5D).
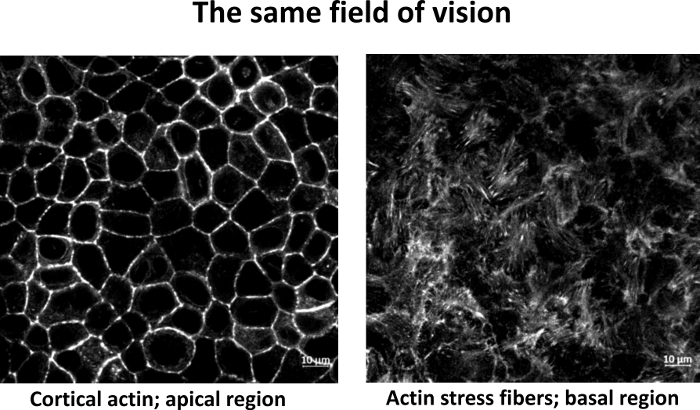
الشكل 1: Actin تلطيخ مع الفلوروفور- phalloidin مترافق، وهما مختلف Z-شرائح من نفس المجال من الرؤية. (أ) المنطقة apical مع actin القشرية. (ب) المنطقة القاعدية مع ألياف الإجهاد actin. شريط: 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: أمثلة على قيم مختلفة لفهرسة أشكال الخلايا (CSI) للأشكال ذات محيطات مميزة، ولكن نفس المنطقة. الشكل ممدود جدا على اليسار لديه CSI قريبة من 0، في حين أن الدائرة المثالية على اليمين لديه CSI من 1. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
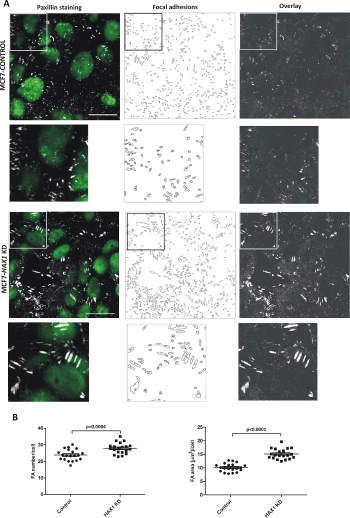
الشكل 3: القياس الكمي للتصاق البؤري. (أ)صور تمثيلية لخطوط الخلايا القائمة على MCF7: CONTROL و HAX1 KD ملطخة بالباكسيلين؛ من اليسار إلى اليمين: (1) paxillin والنويات (2) مبينة مرقمة FAs (3) تراكب الخطوط العريضة لـ FAs والصورة الأصلية. شريط: 20 ميكرومتر. Insets (أسفل كل صورة) تظهر المناطق المُلبّبة المُكبّرة. (ب) المؤامرات التي تبين الفرق في حجم FAs وعدد بين خطي الخلية. تم تقييم الأهمية الإحصائية باستخدام اختبار T للطالب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
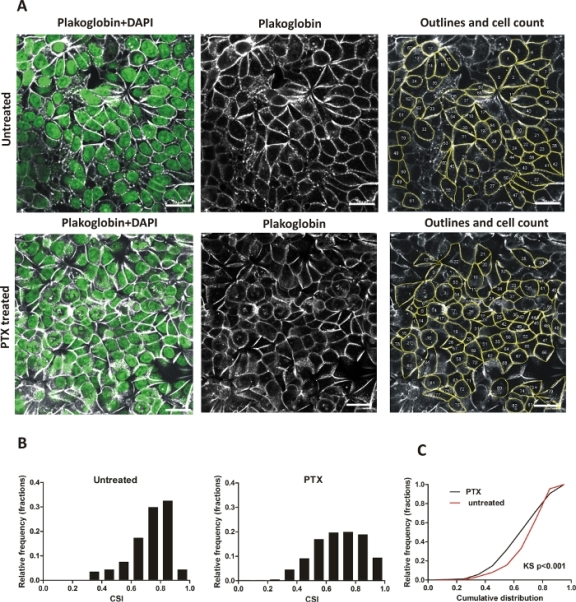
الشكل 4: التغيرات في شكل الخلية الناجمة عن باكليتاكسيل (PTX) في طبقة الخلايا MCF7؛ العد اليدوي. (أ)المناطق التمثيلية من الطبقات الأحادية MCF7، والخلايا غير المعالجة والمعالجة مع PTX، ملطخة مع plakoglobin البروتين تقاطع وDAPI، شريط: 20 ميكرومتر. لوحة على اليمين يظهر صورة معالجتها في ImageJ; يتم تحديد حواف الخلية ويتم ترقيم كافة الخلايا التي تم حسابها. (B) الرسوم البيانية التي تظهر توزيع CSI في الخلايا غير المعالجة وPTX المعالجة، 200-400 خلية في كل تجربة (غير المعالجة/ المعالجة)، عرض سلة: 0.1. وقد تم إنشاء مخططات باستخدام تحليل توزيع الترددات مع الترددات النسبية كسر. (C) مؤامرة التوزيع التراكمي لmonlayers غير المعالجة وغير المعالجة PTX. الفرق الإحصائي محسوباً باستخدام اختبار كولغوموروف-سميرنوف غير القياسي (KS). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
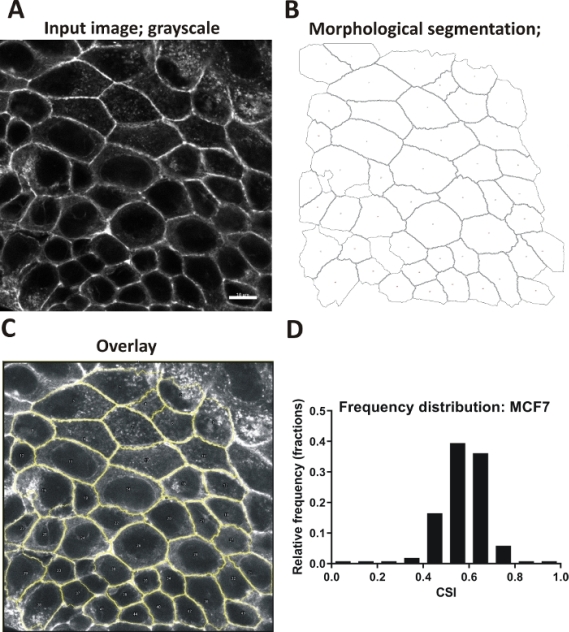
الشكل 5: شكل الخلية في الطبقات الأحادية MCF7 تقييم باستخدام طريقة الآلي. (أ - ج) مثال على تحليل الصور التلقائي الذي يوضح الخطوات اللاحقة التي يتم تنفيذها بواسطة الماكرو المرفق. (أ) صورة الإدخال؛ actin القشرية؛ الرمادي، شريط مقياس 10 μm (لأغراض إعلامية؛ يجب ألا تكون أشرطة المقياس جزءا لا يتجزأ من الصور المحللة). (ب)طبقة الخلية بعد تجزئة؛ حدود الخلية الموضحة؛ خلايا من دون حدود كاملة القضاء عليها. (C) تراكب من الخطوط العريضة للخلية على الصورة الأصلية. (D) رسم بياني يبين توزيع CSI في مجموعة البيانات المحللة، 512 خلية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تكميلية الشكل S1، S2: MCF7 الخلايا، paxillin وDAPI الملطخة لتصور FAs والنيات. قدمت كـ مجموعة بيانات تدريبية لمكرو FAs.ijm.
الشكل S1: يرجى النقر هنا لتحميل هذا الرقم.
الشكل S2: يرجى النقر هنا لتحميل هذا الرقم.
الرقم التكميلي S3، S4: خلايا MCF7، plakoglobin وDAPI- الملون لتصور تقاطعات الخلية والخلايا. قدمت كـ مجموعة بيانات تدريبية لماكرو CSI.ijm.
الشكل S3: الرجاء الضغط هنا لتحميل هذا الرقم.
الشكل S4: يرجى النقر هنا لتحميل هذا الرقم.
FAs.txt: الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
خلية الخلية وخلية الخلية الركيزة التصاق تشكل سمات متأصلة من الخلايا الظهارية وتلعب دورا حاسما في تكوين الأنسجة وتولد. في أنسجة البالغين التنظيم السليم للخصائص الميكانيكية لطبقة الخلية أمر بالغ الأهمية في الحفاظ على التوازن والوقاية من الاستجابات المرضية مثل تطور الورم والنقائل. يعتمد حجم وعدد الالتصاقات البؤرية على قوة التصاق الخلايا الركازة ، في حين يعتمد شكل الخلية على القوى المتعاقدة ويرتبط بحالة اتصالات الخلية الخلوية.
هنا، ونحن وصف طريقتين بسيطة من التحليل الكمي للمنطقة، وعدد وشكل الهياكل الخلوية الملطخة بالفلورية المناعية، في هذه الحالة الالتصاقات التنسيقية والخلايا كلها في طبقة الخلية. ومع ذلك، يمكن إعادة استخدام الأدوات المقترحة من أجل التحديد الكمي لأي هيكل مختار. والمسألة الرئيسية لهذه التحليلات هي نوعية تلطيخ الفلورات المناعية والتصوير confocal. ويمكن تنفيذ هذه الأساليب في أي مختبر قياسي مجهز بوحدة استزراع الخلايا ومجهر مشترك. وهي مصممة لمقارنة خطوط الخلية، خاصة عندما تكون الاختلافات (الطبيعية أو الناجمة عن العلاج المحدد) في المعلمات المقاسة كبيرة. ولا يوصى بقياس الفروق الدقيقة أو وضع قياسات مطلقة، لأنها حساسة للتغيرات الدنيا في البيئات التعسفية الأولية، وخاصة في حالة الالتصاقات البؤرية. هذه الطريقة من القياس الكمي FAs هو أقل شأنا من أساليب أكثر تقدما ومحددة مثل المجهر TIRF، ولكن لديها ميزة عدم الحاجة إلى معدات متطورة.
وقد وصفت أساليب مماثلة لقياسات الالتصاق البؤري قبل7،8،9،10. هنا ، قمنا بتحديد الإعدادات وأنشأنا ماكرو ImageJ مجاني ، مع العديد من الخيارات ، لتسهيل القياسات.
وقد وصفت تحليل شكل الخلية عدة مرات، بما في ذلك أساليب معقدة جدا ومفصلة11،12. هنا، نقدم طريقة بسيطة لتتبع التغيرات في monolayers الخلية الظهارية، والتي يمكن أن تكون مهمة جدا لمقارنة مورفولوجيا الخلية أو التغيرات التنموية. تم وصف الطريقة اليدوية لتحليل شكل الخلية في الطبقات الأحادية المعروضة في هذا البروتوكول في تقرير سابق6. صيغة CSI كوسيلة لوصف ومقارنة شكل كائن (ق) يستخدم على نطاق واسع في مختلف التخصصات13،14، بما في ذلك الجيولوجيا التي نشأت. عرض النتائج في شكل مدرج التكراري و / أو كدالة توزيع تراكمية يستخدم عادة لمقارنات التوزيعات من أي نوع8,10,15.
وتجدر الإشارة إلى أننا نقدم هنا أداة لتحليل شكل الخلية الآلي على أساس برنامج ImageJ المساعد MorhpLibJ (https://imagej.net/MorphoLibJ). نحن نقدم ملف ماكرو، والذي يمكنه إجراء هذا التحليل بسرعة وكفاءة. لا يتعرف هذا الأسلوب دائماً على حدود الخلايا الصحيحة، ولكن النسبة المئوية للقياسات الخاطئة (الموجودة في كل تحليل آلي) هي الحد الأدنى ويجب ألا تؤثر بشكل كبير على النتيجة النهائية، خاصةً إذا تم تحليل عدد كافٍ من الخلايا. يتم القضاء على الخلايا التي لا حدود كاملة. تحليل شكل الخلية الآلي له مزايا لا يمكن إنكارها ونحن نقدم هذه الطريقة بحيث يمكن أن تكون موضع تقدير من قبل المجتمع العلمي.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد دعم هذا العمل المركز الوطني البولندي للعلوم بموجب المنحة رقم 2014/14/M/NZ1/00437.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 594 | ThermoFisher Scientific | A32740 | goat anti-rabbit, 1:500 |
| Ammonium chloride | Sigma | A9434 | |
| BSA | BioShop | ALB001.500 | |
| Collagen from calf skin | Sigma | C9791-10MG | |
| DAPI | Sigma | D9542 | 1:10000 (stock 1 mg/mL in H2O), nucleic acid staining |
| DMEM + GlutaMAX, 1 g/L D-Glucose, Pyruvate | ThermoFisher Scientific | 21885-025 | |
| FBS | ThermoFisher Scientific | 10270-136 | |
| Junction plakoglobin | Cell Signaling | 2309S | rabbit, 1:400 |
| Laminar-flow cabinet class 2 | Alpina | standard equipment | |
| MCF7-basedHAX1KD cell line | Cell line established in the National Institute of Oncology, Warsaw, described in Balcerak et al., 2019 | MCF7 cell line withHAX1knockdown | |
| MCF7 cell line (CONTROL) | ATCC | ATCC HTB-22 | epithelial, adherent breast cancer cell line |
| Olympus CK2 light microscope | Olympus | ||
| Paxillin | Abcam | ab32084 | rabbit, 1:250, Y113 |
| PBS | ThermoFisher Scientific | 10010023 | |
| Phalloidin-TRITC conjugate | Sigma | P1951 | 1:400 (stock 5 mg/mL in DMSO), actin labeling |
| PTX | Sigma | T7402-1MG | |
| TBST – NaCl | Sigma | S9888 | |
| TBST – Trizma base | Sigma | T1503 | |
| Triton X-100 | Sigma | 9002-93-11 | |
| Zeiss LSM800 Confocal microscope | Zeiss |
References
- Li, D. S., Zimmermann, J., Levine, H. Modeling closure of circular wounds through coordinated collective motion. Search Results. 13 (1), 016006 (2016).
- Ilina, O., Friedl, P. Mechanisms of collective cell migration at a glance. Journal of Cell Science. 122, 3203-3208 (2009).
- Ladoux, B., Mege, R. M. Mechanobiology of collective cell behaviours. Nature Reviews Molecular Cell Biology. 18 (12), 743-757 (2017).
- Stossi, F., et al. High throughput microscopy identifies bisphenol AP, a bisphenol A analog, as a novel AR down-regulator. Oncotarget. 7 (13), 16962-16974 (2016).
- Legland, D., Arganda-Carreras, I., Andrey, P. MorphoLibJ: integrated library and plugins for mathematical morphology with ImageJ. Bioinformatics. 32 (22), 3532-3534 (2016).
- Balcerak, A., et al. HAX1 impact on collective cell migration, cell adhesion, and cell shape is linked to the regulation of actomyosin contractility. Molecular Biology of the Cell. 30 (25), 3024-3036 (2019).
- Buskermolen, A. B. C., Kurniawan, N. A., Bouten, C. V. C. An automated quantitative analysis of cell, nucleus and focal adhesion morphology. PLoS One. 13 (3), 0195201 (2018).
- Fokkelman, M., et al. Cellular adhesome screen identifies critical modulators of focal adhesion dynamics, cellular traction forces and cell migration behaviour. Scientific Reports. 6, 31707 (2016).
- Horzum, U., Ozdil, B., Pesen-Okvur, D. Step-by-step quantitative analysis of focal adhesions. MethodsX. 1, 56-59 (2014).
- Kim, D. H., Wirtz, D. Focal adhesion size uniquely predicts cell migration. FASEB Journal. 27 (4), 1351-1361 (2013).
- Pincus, Z., Theriot, J. A. Comparison of quantitative methods for cell-shape analysis. Journal of Microscopy. 227, 140-156 (2007).
- Tsygankov, D., et al. CellGeo: a computational platform for the analysis of shape changes in cells with complex geometries. Journal of Cell Biology. 204 (3), 443-460 (2014).
- Tiryaki, V. M., Adia-Nimuwa, U., Ayres, V. M., Ahmed, I., Shreiber, D. I. Texture-based segmentation and a new cell shape index for quantitative analysis of cell spreading in AFM images. Cytometry A. 87 (12), 1090-1100 (2015).
- Tong, J., et al. Cell micropatterning reveals the modulatory effect of cell shape on proliferation through intracellular calcium transients. Biochimica et Biophysica Acta. 1864 (12), 2389-2401 (2017).
- Vartanian, K. B., Kirkpatrick, S. J., Hanson, S. R., Hinds, M. T. Endothelial cell cytoskeletal alignment independent of fluid shear stress on micropatterned surfaces. Biochemical and Biophysical Research Communications. 371 (4), 787-792 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved