Method Article
Изучение короткого пептидного адсорбции на растворе, рассеянном неорганических наночастицах с использованием метода истощения
В этой статье
Резюме
Первым шагом в опонимание биомолекулы-неорганического взаимодействия твердых фаз является выявление фундаментальных физикохимических констант, которые могут быть оценены путем создания адсорбции изотермс. Адсорбция от жидкой фазы ограничена кинетикой, емкостью поверхности, рН и конкурентоспособной адсорбцией, которую все следует осторожно рассмотреть перед установкой эксперимента по адсорбции.
Аннотация
Основы неорганических органических взаимодействий имеют решающее значение для открытия и разработки новых биоинтерфейсов, поддающимся использованию в биотехнологии и медицине. Недавние исследования показывают, что белки взаимодействуют с поверхностями через ограниченные сайты адсорбции. Фрагменты белка, такие как аминокислоты и пептиды, могут быть использованы для моделирования взаимодействия между сложными биологическими макромолекулами и неорганическими поверхностями. В течение последних трех десятилетий, многие действительные и чувствительные методы были разработаны для измерения физической химии основы этих взаимодействий: изотермальной титрации калореметрии (ITC), поверхностный плазмон резонанс (SPR), кварцевый кристаллический микробаланс (ККМ), общее внутреннее отражение флуоресценции (TIRF), и аттенированной общей спектроскопии отражения (ATR).
Самый простой и доступный метод измерения адсорбции – метод истощения, при котором вычисляется изменение концентрации сорбата (истощение) после контакта с рассеянным сорбентом, рассеянным раствором. Адсорбция изотермс, основанная на данных об истощении, обеспечивает все основные физикохимические данные. Однако адсорбция от решений требует более длительного времени уравновешенности из-за кинетической ограничения и сорбентов с высокой конкретной площадью поверхности, что делает его почти неприменимым к макроскопическим фиксированным поверхностям плоскости. Кроме того, при изучении адсорбирующих пептидов следует учитывать такие факторы, как нестабильность зол, агрегаты наночастиц, кристалличность сорбента, распределение размеров наночастиц, рН раствора и конкуренция за адсорбцию. Истощение данных является частью конструкции обеспечивает всеобъемлющие данные физической химии буквально для каждого растворимого сорбата, но остается наиболее доступной методологией, так как она не требует дорогостоящих населенных конструкций. В этой статье описывается базовый протокол экспериментального исследования пептидной адсорбции на неорганический оксид и охватывает все критические моменты, влияющие на процесс.
Введение
За последние 50 лет взаимодействие неорганических поверхностей и пептидов привлекло большое внимание из-за его высокой важности в материаловедении и медицине. Биомедицинские исследования направлены на совместимость и стабильность биоинорганических поверхностей, которые имеют прямые последствия для регенеративной медицины, тканевой инженерии1,,2,,3,и имплантации4,,,5,6,7. Современные биочувствительные устройства, такие как датчики и приводы, основаны на функциональных белках, обездвижемых на оксидных полупроводниковых поверхностях88,9,,10,,11,,12,,13. Современные методы очистки для производства белка часто полагаются на свойства взаимодействия биомолекулы в вниз по течению очистки и разделения14.
Среди нескольких неорганических оксидов, диоксид титана остается наиболее часто используемым в сочетании с биологически значимыми субстратами15,16. Исследования в области биоинтерфейсов на основе TiO2были сосредоточены на установлении прочного и специфического связывания белков и пептидов без изменения их биологических и структурных свойств. В конечном счете, основной целью является высокая плотность поверхности слоя биомолекул с высокой стабильностью и повышенной функциональностью, которая будет способствовать созданию титана на основе биотехнологических и медицинских приложений17.
Титан и его сплавы широко используются в качестве хирургического материала имплантата, по крайней мере шесть десятилетий, потому что поверхность TiO2 слой с толщиной в несколько нанометров коррозии устойчивы и экспонатов высокий уровень биосовместимости во многих in vivo приложений18,19,20. Диоксид титана также широко считается неорганическим субстратом, производимым в биоминерализации, где нуклеация и неорганический фазовый рост, сопровождаемый белками и пептидами, могут обеспечить материалы с многообещающими каталитическими и оптическими свойствами21,22,,23,,24.
Учитывая высокую актуальность взаимодействия между неорганическими материалами и биомолекулами в целом и белково-Тио2 взаимодействий, в частности, было много исследований для решения манипуляции и контроля адсорбции белков на TiO2. Благодаря этим исследованиям, некоторые фундаментальные свойства этого взаимодействия были выявлены, такие как адсорбция кинетики, поверхностного покрытия, и биомолекулы конформации, давая существенную поддержку для дальнейшего прогресса в биоинтерфейсах5,13.
Однако, сложность протеина добавляет значительные ограничения на полное определение и понимание взаимодействия молекулярного уровня белка с неорганическими поверхностями. Предполагая, что биомолекулы взаимодействуют с неорганическими поверхностями через ограниченные участки, некоторые белки с известными структурами и аминокислотными последовательностями были сведены к их компонентам-пептидам и аминокислотам, которые изучаются отдельно. Некоторые из этих пептидов продемонстрировали значительную активность, что делает их уникальным предметом исследований адсорбции без необходимости предыдущего разделения белка25,26,27,28,29,30.
Количественная характеристика пептидной адсорбции на ТиО2 или других неорганических поверхностях может быть достигнута с помощью физических методов, которые были адаптированы специально для биомолекул в течение последних нескольких десятилетий. Эти методы включают в себя итермальной титрации калоремии (ITC), поверхностный плазмон резонанс (SPR), кварцевый кристалл микробаланс (ККМ), полное внутреннее отражение флуоресценции (TIRF), и ослабленной общей спектроскопии отражения (ATR),31все из которых позволяют обнаружить прочность адсорбции, предоставляя ключевые термодинамические данные:
Адсорбция биомолекул к неорганическому материалу может быть осуществлена двумя способами: 1) ЦМТ, а также метод истощения использования частиц, рассеянных в растворе, связывающем с фиксированными макроскопическими поверхностями; 2) SPR, ККМ, TIRF и ATR используют макроскопические поверхности, модифицированные неорганическим материалом, такими как стеклянные или металлические чипсы с золотым покрытием, кристаллы кварца, кристаллы сульфида цинка и чипы PMMA, соответственно.
Изотермальная калория титрации (ITC) является без этикетки физический метод, который измеряет тепло производится или потребляется при титроре растворов или неоднородных смесей. Чувствительные калориметрические клетки обнаруживают тепловые эффекты размером до 100 наноджоулей, что делает возможным измерение тепла адсорбции на поверхностях наночастиц. Тепловое поведение сорбата во время непрерывного добавления - титрования, обеспечивает полный термодинамический профиль взаимодействия выявление enthalpy, связывающей постоянной, и энтропии при заданной температуре32,33,34,35,36.
Спектроскопия поверхностного плазмонного резонанса (SPR) представляет собой поверхностно-чувствительный оптический метод, основанный на измерении рефракционного индекса носителей в непосредственной близости от исследуемой поверхности. Это метод мониторинга обратимой адсорбции и толщины адсорбированного слоя в режиме реального времени и без этике. Связывающая константа может быть рассчитана из коэффициентов ассоциации и диссоциации. Эксперименты по адсорбции, проводимые при различных температурах, могут дать информацию о температурной зависимости энергии активации и последовательно других термодинамических параметров37,,38,,39.
Метод микробаланса кварцевого кристалла измеряет изменение колеблющихся частот ыпизоэлектрических кристаллов во время процессов адсорбции и дезорпации. Связывающая константа может оцениваться по соотношению констант скорости адсорбции и desorption. ККМ используется для измерения относительной массы и, следовательно, не нуждается в калибровке25,,27,,40. ККМ используется для адсорбции как из газа, так и из жидкости. Техника жидкости позволяет использовать цКМ в качестве инструмента анализа для описания осаждения на различных модифицированных поверхностях41.
Полная внутренняя флуоресценция внутреннего отражения (TIRF) является чувствительной оптической межфалетовой техникой, основанной на измерении флуоресценции адсорбированных флюорофоров, возбужденных внутренне отраженными эвакуационными волнами. Метод позволяет обнаружить флуоресцентные молекулы, покрывающие поверхность толщиной на порядок в десятки нанометров, поэтому он используется при изучении макромолекулярного адсорбции на различных поверхностях42,,43. На месте мониторинга динамики флуоресценции при адсорбции и desorption обеспечивают адсорбции кинетики и, следовательно, термодинамические данные42,43.
Ослабленная общая отражательная лента (ATR) была использована Роддиком-Ланзилоттой для создания изотермов изазомерм изазомермизии лизиновых спектров на уровне 1600 и 1525 см-1. Это первый случай, когда связывающая константа для пептида на TiO2 была определена с помощью инфракрасного метода in situ44. Этот метод был эффективен в создании асотермации для полилизиновых пептидов45 и кислых аминокислот46.
В отличие от вышеупомянутых методов, где параметр адсорбции измеряется на месте, в обычном эксперименте количество адсорбированных биомолекул измеряется изменением концентрации после того, как поверхность связалась с раствором. Поскольку концентрация сорбата распадается в подавляющем большинстве случаев адсорбции, этот метод называется методом истощения. Измерения концентрации требуют проверенного аналитического исследования, который может быть основан на внутреннее аналитическое свойство сорбата или на основе маркировки47,,48,,49,,50 или произвобления51,,52 из них.
Эксперименты по адсорбции с использованием ККМ, SPR, TIRF или ATR требуют специальной подготовки поверхности чипов и датчиков, используемых для исследований адсорбции. Подготовленные поверхности должны использоваться один раз и требуют изменения при переключении адсорбата, в связи с неизбежным гидратации поверхности оксида или возможной chemisorption сорбата. Только один образец в то время может быть запущен с помощью ЦМТ, ККм, SPR, TIRF, или ATR, в то время как в методе истощения можно запустить десятки образцов, для которых количество ограничено только емкостью термостата и наличием сорбента. Это особенно важно при обработке больших выборочных партий или библиотек биологически активных молекул. Важно отметить, что метод истощения требует не дорогостоящего оборудования, а только термостата.
Однако, несмотря на очевидные преимущества, метод истощения требует сложных процедурных функций, которые могут показаться громоздкими. В этой статье представлено, как выполнить всеобъемлющее физико-химическое исследование дипептидного адсорбции на TiO2 с использованием метода истощения и рассматриваются проблемы, с которыми исследователи могут столкнуться при проведении соответствующих экспериментов.
протокол
1. Приготовление растворов дипептидных запасов и разбавлений
- Приготовление дипептидного раствора 16 мМ
- Поместите 0,183 г дипептида (Ile-His) (см. Таблица Материалов)в стерильной полимерной пробирке, разбавьте до 35 мл с двойной дистиллированной водой (DDW), и растворитесь при комнатной температуре (RT) под энергичным перемешиванием.
ПРИМЕЧАНИЕ: Если дипептид не растворяется в DDW во время перемешивания, поместите раствор дипептида в ультразвуковую ванну и сномите в течение нескольких минут. - Приготовьте 50 мМ растворN2-(N-morpholino)этанесульфоновой кислоты (MES) буфера путем растворения 0,533 г сухой 2-(N-morpholino)этанесульфоновой кислоты в 50 мл DDW в стерильной пробильной трубке.N Подготовьте раствор гидроксида натрия 50 мМ путем растворения 200 мг гидроксида натрия в 100 мл DDW.
- Отрегулируйте рН предрастворимого дипептидного раствора до 7,4, тщательно добавляя (микролитровую титровку) 50 мМ МЧС, или 50 мМ гидроксида натрия, к раствору дипептида 16 мм, перемешивая при РТ и отслеживая рН с помощью рН-метра. После регулировки рН, залить раствор в измерительный цилиндр, промыть пробирку, и заполнить измерительный цилиндр с DDW до 40 мл, чтобы сделать окончательную концентрацию 16 мм.
- Поместите 0,183 г дипептида (Ile-His) (см. Таблица Материалов)в стерильной полимерной пробирке, разбавьте до 35 мл с двойной дистиллированной водой (DDW), и растворитесь при комнатной температуре (RT) под энергичным перемешиванием.
- Приготовление дипептидных разбавлений из 16 мМ бульонного раствора
- Приготовьте пептидные разбавления с концентрациями от 0,4 до 12,0 мм, разбавив дипептидный раствор 16 мМ DDW. Например, для того, чтобы подготовить дипептидный раствор 8 мМ, добавьте 7 мл DDW к 10 мл раствора дипептида 16 мм. После разбавления отрегулируйте рН до 7,4, добавив 50 мМ МЧС или 50 мМ NaOH падение за каплей до дипептидного раствора (см. шаг 1.1.3). После регулировки рН, залить раствор в измерительный цилиндр, промыть пробирку, и заполнить измерительный цилиндр до 20 мл с DDW, чтобы сделать концентрацию дипептида 8 мм.
ПРИМЕЧАНИЕ: Другие разбавления 16 мМ дипептидного бульона раствор астептидного раствора с концентрациями 0,4, 0,8, 1,2, 1,6, 2,0, 3,0, 4,0, 8,0 и 12,0 мм, готовятся в соответствии с рисунком 1. Регулировка каждого дипептидного раствора pH до 7.4 описана в шаге 1.1.3.
- Приготовьте пептидные разбавления с концентрациями от 0,4 до 12,0 мм, разбавив дипептидный раствор 16 мМ DDW. Например, для того, чтобы подготовить дипептидный раствор 8 мМ, добавьте 7 мл DDW к 10 мл раствора дипептида 16 мм. После разбавления отрегулируйте рН до 7,4, добавив 50 мМ МЧС или 50 мМ NaOH падение за каплей до дипептидного раствора (см. шаг 1.1.3). После регулировки рН, залить раствор в измерительный цилиндр, промыть пробирку, и заполнить измерительный цилиндр до 20 мл с DDW, чтобы сделать концентрацию дипептида 8 мм.
2. Приготовление титании соль
- Подготовьте 10 мМ раствор буфера МЧС путем растворения 1,066 г МЧС в 500 мл DDW. Отрегулируйте рН до 7,4 с гидроксидом сухого натрия при помешивании и мониторинге рН с помощью счетчика рН.
- Измельчить 200 мг нанокристаллической линии TiO2 в ступке не менее 5 мин (см. Таблица материалов).
- Взвесить 40 мг наночастиц диоксида молотого титана в лабораторную колбу. Положите колбу в сониковую ванну (см. Таблицу Материалов)с помощью лабораторного стенда.
- Добавьте 20 мл буфера МЧС 10 мм в колбу с TiO2 и снотворное в ультразвуковой ванне (5 л, 40 кГц, 120 Вт) в течение 20 мин.
3. Смешивание и термостатирование
- Установите термостат (см. Таблицу Материалов)до желаемых температур (т.е. 0,00, 10.00, 20.00, 30.00, или 40.00 C).
- Добавьте 1 мл звукового раствора TiO2 к отмеченным флаконам адсорбции. Поместите отмеченные адсорбционные флаконы против соответствующего разбавления дипептида в импровизированном устройстве флотации из экструдированной полистироровочной пены. Поместите устройство флотации с отмеченными флаконами и соответствующими дипептидными разбавлениями в термостат, по крайней мере 5 мин.
- Добавьте 1 мл каждого разбавления дипептида к соответствующему пдсорбциону флакону, убедившись, что все растворы смешивания имеют одинаковую температуру. Держите серию полученных образцов адсорбции на термостате на 0.00, 10.00, 20.00, 30.00, или 40.00 C для 24 h для достижения равновесия адсорбции.
ПРИМЕЧАНИЕ: Осторожно встряхните все образцы полученных дисперсий до сдачи их в термостат. - Иногда смешивайте дисперсии TiO2, вручную встряхивая их во время термостатации.
4. Фильтрация термоустановленных образцов
- Во избежание температуры индуцированной опора вынимайте один образец за раз из термостата для фильтрации.
- Возьмите образец раствора дипептида из каждого стеклянного флакона со шприцем, через шприц иглу. Снимите иглу со шприца и положите на фильтр шприца (см. таблицу материалов),чтобы отфильтровать раствор дипептида в стеклянный флакон. Повторите фильтрацию с другими образцами.
- Проанализируйте фильтрат в соответствии с разделом 5.
ПРИМЕЧАНИЕ: Не центрифуги образцов, потому что это занимает несколько минут и может привести к изменению равновесия концентрации.
5. Анализ дериватизации и HPLC
- Сделать 50 мл раствор трифтороацетической кислоты (TFA) в ацетонитриле. Добавьте 0,34 мл TFA в измерительный цилиндр и отрегулируйте объем раствора до 50 мл с помощью ацетонитрила на RT.
ВНИМАНИЕ: Работа с TFA под дымовым капотом с выхлопной вентиляцией, потому что трифторорацетическая кислота вредна при вдыхании, вызывает сильные ожоги кожи, и токсична для водных организмов даже при низких концентрациях53. - Подготовьте раствор произвилизации (т.е. реагент Edman54) путем размещения 299 л фенил изотиоцианата и 347 Л триэтиламин в градуированном цилиндре и регулировки объема раствора до 50 мл с ацетонитрилом на РТ.
- Перед высокопроизводительным анализом жидкой хроматографии (HPLC) производные образцы с реагентом Эдмана во флаконах хроматографии. Смешайте 400 л образца с 400 зл реагента Эдмана. Нагрейте образец при температуре 60 градусов по Цельсию в течение 15 мин. После нагрева нейтрализуйте образец с 225 злителем раствора TFA и подождите несколько минут, чтобы охладить образец до RT.
- Используйте анализ HPLC (см. Таблицу материалов),чтобы определить концентрацию раствора дипептида до и после адсорбции. Поместите флаконы хроматографии с проанализированных решений в HPLC autosampler и начать анализ ировать образцы с необходимыми условиями, которые устанавливаются программным обеспечением (см. Таблица материалов).
ПРИМЕЧАНИЕ: Мобильная фаза состоит из 0,1% TFA в деионизированной воде и чистом ацетонитриле, с градиентами ацетонитрила от 20-90% при 286 нм в течение 13 мин. Проанализируйте каждый образец в тройном. Измерьте концентрацию раствора дипептида с помощью ранее установленной кривой калибровки(рисунок 2). Для спецификаций хроматографии см.55
Результаты
Адсорбция дипептида на нанокристаллическом диоксиде титана изучалась в биосовместимых условиях в температурном диапазоне от 0 до 40 градусов по Цельсию. Экспериментальная дипептидная адсорпация (A, mmol/g) на поверхности диоксида титана

Где C0 и Ce являются дипептидные начальные и равновесные концентрации в миллимолях, соответственно; V - это объем дипептидного раствора в литрах; и м вес сорбента в граммах.
Измерения дипептидного адсорбции были обработаны данными с помощью модели Генри. Эта модель предполагает адсорбцию в относительно низких концентрациях с молекулами сорбата, изолированными друг от друга на поверхности сорбента, и подходит для описания экспериментальных данных(рисунок 3). Обратите внимание, однако, что эта модель может быть применена только в случае обратимого адсорбции, который также должен быть подтвержден. Для этого подходит ИК-спектроскопия материала, промытого несколько раз. Полученные равновесные пептидные количества на TiO2 и растворе связаны в соответствии с линейным уравнением:

где KH является константой адсорбции Генри.
Равновесие, связывающее постоянную KH, было получено со склона зависимости дипептидной адсорбции(A) от концентрации дипептидного равновесия(Ce). Стандартная свободная энергия Гиббса(ЗГ,кДж/мол) для каждой температуры T была определена с помощью уравнения Ван'т Хоффа:

где R является идеальной газовой константой в J/mol'K, а T - это температура процесса адсорбции в Кельвине.
Дипептид Гиббс свободных энергий определяется при каждой температуре (Рисунок 4) раскрыты enthalpy (ЗГ) как перехват линейной регрессии с оси. Переменная регрессии, энтропия процесса (QS), была выведена из фундаментального уравнения:
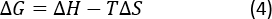
Рассчитанные значения равновесной связывающей постоянной(KH), стандартные энергии Гиббса (ЗГ), enthalpy (ЗГ), и энтропии() для Иль-Его представлены в таблице 1.

Рисунок 1: Разбавление раствора дипептидного запаса 16 мМ. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Кривая калибровки при различной концентрации дипептида. Концентрация дипептида составила 0,4-16,0 мМ. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Дипептидадсид изотермс, рассчитанный по модели Генри для каждой температуры. Дипептидадсид изотермсывания при (A) 0 КС (B) 10 C (C) 20 градусов по Цельсию(D) 30 градусов по Цельсию, и (E) 40 градусов по Цельсию, соответственно. Расчетные коэффициенты корреляции (R2) упали в диапазон 0,96-0,99 для всех полученных истеромов модели Henry. Бары ошибок представляют 95% доверительный интервал для каждой концентрации образца, измеренной в тройном. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Зависимость стандартного Гиббса свободной энергии дипептидного адсорбции от температуры. Ошибки баров представляют 95% доверительный интервал для Гиббса свободной энергии в качестве косвенного измерения на основе модели Генри. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| T, K | KH | ЗГ0, kJ/mol | ЗХ0, kJ/mol | ΔS0, kJ/mol K |
| 273.15 | 0,32 и 0,01 | 2,6 и 0,0 | - - 41 и 9 | - 0,16 и 0,03 |
| 283.15 | 0,25 и 0,01 | 3,2 и 0,1 | ||
| 293.15 | 0,17 и 0,06 | 4,3 и 0,9 | ||
| 303.15 | 0,050 и 0,002 | 7,6 и 0,1 | ||
| 313.15 | 0,037 и 0,002 | 8,3 и 0,1 |
Таблица 1: Термодинамические параметры дипептидного адсорбции.
Обсуждение
Адсорбция от растворов для изотермовой конструкции требует более длительного времени для уравновешенности из-за кинетических ограничений и сорбентов с высокой специфической площадью поверхности. Кроме того, при адсадосировании аминокислот следует учитывать нестабильность зол, агрегатов наночастиц, кристалличность, распределение размеров наночастиц, рН раствора и конкуренцию за адсорбцию. Тем не менее, адсорбция является отермом строительства с использованием метода истощения остается наиболее доступной методологией, потому что она не требует дорогостоящих населенностей, и все же она обеспечивает исчерпывающие данные физической химии буквально для каждого растворимого сорбата.
Необходимо проводить различие между режимами адсорбции (т.е. раствором, рассеянным частицами или на фиксированной поверхности), когда кристаллический материал используется в качестве сорбента. Следует ожидать существенной разницы в распределении кристаллических граней на макроскопически плоских поверхностях и на частицах. Результат термодинамических параметров, определяемых с адсорбцией пептидов на наночастицах, может не соответствовать термодинамическим параметрам пептидного адсорбции на макроскопически плоские поверхности.
Среднее количество пептидов, адсорбируется на неорганических поверхностях, крайне низко. При комнатной температуре это значение составляет около нескольких сотен микрограммов на квадратный метр28. Это небольшое количество адсорбате требует точных методов измерения и твердых веществ с хорошо развитыми поверхностями. Поэтому мелкие частицы веществ с большой конкретной поверхностью (сотни квадратных метров) следует использовать для экспериментов по адсорбции43,,56,,57,,58,,59,,60.
Пептиды, как и белки, нестабильны и сохраняют свою функциональность в узком диапазоне условий. Проводились адсорбционные эксперименты на нанокристаллическом диоксиде титана при биосовместимых температурах 0 кс-40 кС (273,15 К-313,15 К), которые аналогичны экспериментам нормального, функционирующего живого организма. Адсорбция при более высоких или низких температурах не имеет значения и не должна рассматриваться для эксперимента.
Многофункциональные биологически активные соединения также обладают высокой восприимчивостью к рН носителей, так как это влияет на поверхностный заряд и, следовательно, взаимодействие Кулона между заряженными функциональными группами61,,62,,63. Сорбентный заряд оксидных материалов также зависит от рН-зависимых из-за активного обрыва протона на гидратаной поверхности64. Для создания pH стабильных условий для адсорбционного равновесия требуется использование буфера. В этом исследовании, MES буфер используется для его некоординирующих свойств65, поэтому он не будет конкурировать с пептидом для адсорбции на поверхности оксида металла, в отличие от фосфатных буферов66.
Это недавнее испытание аминокислоты адсорбции показывает, что основным местом связывания на наночастицы является дефект поверхности55. Распределение дефектов на поверхности является одной из наименее контролируемых особенностей нанокристаллических субстратов, поэтому следует использовать сорбент из одной партии для поддержания консистенции в исследованиях адсорбции.
ККМ, плазмонный резонанс и ЦМТ являются подлинными методами с тонкой чувствительностью, которые в сочетании спектроскопических методов выявляют структурные особенности адсорбата во время взаимодействия с поверхностью. Однако они не преодолевают кинетические ограничения и по-прежнему требуют значительного времени для достижения уравновешивания адсорбции. Кроме того, может быть обработан только один образец за один раз, что затрудняет анализ пакетных образцов. С другой стороны, представленный метод истощения прост и ограничен только емкостью термостата, что делает возможным обработку большого количества образцов.
Термоизированные образцы должны быть отфильтрованы, как только они будут удалены из термостата, чтобы избежать переимеченности, вызванной температурой. Хотя уравновешивать при новой температуре может занять до нескольких часов, сохранение образцов адсорбции при другой температуре должно быть сведено к минимуму. Центругирование образцов для сверхнатантного разделения также не рекомендуется, так как оно занимает до нескольких минут и может привести к изменению концентрационного равновесия. Выбор фильтровального материала зависит от характера сорбата и должен уменьшить возможную привязку фильтра для максимального восстановления. Лучше всего следовать инструкциям и рекомендациям поставщиков при выборе конкретных фильтров.
Кроме того, следует иметь в виду, что изменение концентрации в исследованиях адсорбции должно контролироваться с помощью проверенного метода количественной оценки с использованием масс-спектрометрии, радиоспектроскопии или уф-видимой спектроскопии. Анализ прост, если адсорбировать является спектроскопически активным, в противном случае требуется дополнительная маркировка или производная адсорбация.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была финансово поддержана Российским фондом фундаментальных исследований (Грант No 15-03-07834-а).
Материалы
| Name | Company | Catalog Number | Comments |
| 2-(N-Morpholino)ethanesulfonic acid | TCI Chemicals | 4432-31-9 | MES, >98% |
| Acetonitrile | Panreac AppliChem | HPLC grade | |
| Chromatography vials | glass | ||
| Dipeptide Ile-His | Bachem | 4000894 | |
| Double-distilled water | DDW was obtained on spot | ||
| Heating cleaning bath "Ultrasons-HD" | J.P. Selecta | 3000865 | 5 L, 40 kHz, 120 Watts |
| High-performance liquid chromatograph system equipped with a UV−vis detector | Shimadzu, LC-20 Prominence | HPLC | |
| Isopropanol | Sigma-Aldrich (Merck) | 67-63-0 | 99.70% |
| LabSolutions Lite | Shimadzu | 223-60410 | Software for high-performance liquid chromatography system |
| Nanocrystalline TiO2 | Pure anatase with at least 99% crystallinity. Average particle size 10.62 ± 3.31 nm. Specific surface 131.9 m2/g (BET). See Langmuir 2019, 35, 538−550, for details. | ||
| Phenyl isothiocyanate | Acros Organics | 103-72-0 | PITC, 98% |
| Reversed-phase Zorbax column | ZORBAX LC | 150×2.5 mm i.d. with a mean particle size of 5 μm | |
| Syringe filter | Vladfilter | 25 mm, 0.2 μm pore, cellulose acetate | |
| Test sterile polymeric tube | polypropylene | ||
| Thermostat TC-502 | Brookfield | Refrigerating/heating circulating bath with the programmable controller for the sample derivatization | |
| Triethylamine | Sigma-Aldrich (Merck) | 121-44-8 | TEA; 99% |
| Trifluoroacetic acid | Panreac AppliChem | 163317 | TFA, 99% |
Ссылки
- Garcia, A. J. Interfaces to Control Cell-Biomaterial Adhesive Interactions. Polymers for Regenerative Medicine. 203, Chapter 71 171-190 (2006).
- Mahmood, T. A., et al. Modulation of chondrocyte phenotype for tissue engineering by designing the biologic-polymer carrier interface. Biomacromolecules. 7 (11), 3012-3018 (2006).
- Gandavarapu, N. R., Mariner, P. D., Schwartz, M. P., Anseth, K. S. Extracellular matrix protein adsorption to phosphate-functionalized gels from serum promotes osteogenic differentiation of human mesenchymal stem cells. Acta Biomaterialia. 9 (1), 4525-4534 (2013).
- Horbett, T. Biological Activity of Adsorbed Proteins. Surfactant Science Series. 110, 393-413 (2010).
- Ratner, B. D., Hoffman, A. S., Schoen, F. J., Lemons, J. E. Biomaterials Science: An Introduction to Materials in Medicine. , Elsevier Academic Press/Academic Press. San Diego. (2004).
- Jahangir, A. R., et al. Fluorinated surface-modifying macromolecules: Modulating adhesive protein and platelet interactions on a polyether-urethane. Journal of Biomedical Materials Research. 60 (1), 135-147 (2002).
- Shen, M., et al. PEO-like plasma polymerized tetraglyme surface interactions with leukocytes and proteins: In vitro and in vivo studies. Journal of Biomaterials Science, Polymer Edition. 13 (4), 367-390 (2002).
- Wisniewski, N., Moussy, F., Reichert, W. M. Characterization of implantable biosensor membrane biofouling. Fresenius' Journal of Analytical Chemistry. 366 (6-7), 611-621 (2000).
- Geelhood, S. J., et al. Passivating Protein Coatings for Implantable Glucose Sensors: Evaluation of Protein Retention. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 81, 251-260 (2007).
- Knowles, J. R. Enzyme catalysis: not different, just better. Nature. 350 (6314), 121-124 (1991).
- Blankschien, M. D., et al. Light-triggered biocatalysis using thermophilic enzyme - Gold nanoparticle complexes. ACS Nano. 7 (1), 654-663 (2013).
- Wu, H., et al. Catechol modification and covalent immobilization of catalase on titania submicrospheres. Journal of Molecular Catalysis B: Enzymatic. 92, 44-50 (2013).
- Gray, J. J. The interaction of proteins with solid surfaces. Current Opinion in Structural Biology. 14 (1), 110-115 (2004).
- Hlady, V., Buijs, J. Protein adsorption on solid surfaces. Current Opinion in Biotechnology. 7 (1), 72-77 (1996).
- Kulkarni, M., et al. Titanium nanostructures for biomedical applications. Nanotechnology. 26 (6), 062002(2015).
- Yin, F. Z., Wu, L., Gui Yang, H., Su, H. Y. Recent progress in biomedical applications of titanium dioxide. Physical Chemistry Chemical Physics. 15 (14), 4844-4858 (2013).
- Rezania, A., Johnson, R., Lefkow, A. R., Healy, K. E. Bioactivation of metal oxide surfaces. 1. Surface characterization and cell response. Langmuir. 15 (20), 6931-6939 (1999).
- Schenk, R. The Corrosion Properties of Titanium and Titanium Alloys. Titanium in Medicine. Brunette, D. M., et al. , Springer-Verlag. Berlin, Germany. 145-170 (2001).
- Bozzini, B., et al. An electrochemical impedance investigation of the behaviour of anodically oxidised titanium in human plasma and cognate fluids, relevant to dental applications. Journal of Materials Science: Materials in Medicine. 19 (11), 3443-3453 (2008).
- Popa, M. V., et al. Long-term assessment of the implant titanium material - Artificial saliva interface. Journal of Materials Science: Materials in Medicine. 19 (1), 1-9 (2008).
- Kim, J. K., et al. Lysozyme-mediated biomineralization of titanium-tungsten oxide hybrid nanoparticles with high photocatalytic activity. Chemical Communications. 50, 12392-12395 (2014).
- Suriyaraj, S. P., Selvakumar, R. Room temperature biosynthesis of crystalline TiO2 nanoparticles using Bacillus licheniformis and studies on the effect of calcination on phase structure and optical properties. RSC Advances. 4, 39619-39624 (2014).
- Inoue, I., et al. Thermo-stable carbon nanotube-TiO2 nanocompsite as electron highways in dye-sensitized solar cell produced by bio-nano-process. Nanotechnology. 26 (28), 285601(2015).
- Gardères, J., et al. Self-assembly and photocatalytic activity of branched silicatein/silintaphin filaments decorated with silicatein-synthesized TiO2 nanoparticles. Bioprocess and Biosystems Engineering. 39 (9), 1477-1486 (2016).
- Chen, H., Su, X., Neoh, K. G., Choe, W. S. QCM-D analysis of binding mechanism of phage particles displaying a constrained heptapeptide with specific affinity to SiO2 and TiO2. Analytical Chemistry. 78 (14), 4872-4879 (2006).
- Iucci, G., et al. Peptides adsorption on TiO2 and Au: Molecular organization investigated by NEXAFS, XPS and IR. Surface Science. 601 (18), 3843-3849 (2007).
- Gronewold, T. M. A., Baumgartner, A., Weckmann, A., Knekties, J., Egler, C. Selection process generating peptide aptamers and analysis of their binding to the TiO2 surface of a surface acoustic wave sensor. Acta Biomaterialia. 5 (2), 794-800 (2009).
- Gitelman, A., Rapaport, H. Bifunctional designed peptides induce mineralization and binding to TiO2. Langmuir. 30 (16), 4716-4724 (2014).
- Tada, S., Timucin, E., Kitajima, T., Sezerman, O. U., Ito, Y. Direct in vitro selection of titanium-binding epidermal growth factor. Biomaterials. 35 (11), 3497-3503 (2014).
- Micksch, T., Liebelt, N., Scharnweber, D., Schwenzer, B. Investigation of the peptide adsorption on ZrO2, TiZr, and TiO2 surfaces as a method for surface modification. ACS Applied Materials and Interfaces. 6 (10), 7408-7416 (2014).
- Limo, M. J., Perry, C. C., Thyparambil, A. A., Wei, Y., Latour, R. A. Experimental Characterization of Peptide-Surface Interactions. Bio-Inspired Nanotechnology: From Surface Analysis to Applications. , 37-94 (2013).
- Draczkowski, P., Matosiuk, D., Jozwiak, K. Isothermal titration calorimetry in membrane protein research. Journal of Pharmaceutical and Biomedical Analysis. 87, 313-325 (2014).
- Omanovic-Miklicanin, E., Manfield, I., Wilkins, T. Application of isothermal titration calorimetry in evaluation of protein-nanoparticle interactions. Journal of Thermal Analysis and Calorimetry. 127, 605-613 (2017).
- Jing, X., et al. Interaction of peptidomimetics with bilayer membranes: Biophysical characterization and cellular uptake. Langmuir. 28 (11), 5167-5175 (2012).
- Mizuguchi, C., et al. Effect of phosphatidylserine and cholesterol on membrane-mediated fibril formation by the N-terminal amyloidogenic fragment of apolipoprotein A-I. Scientific Reports. 8 (1), 5497(2018).
- Bisker, G., et al. Insulin Detection Using a Corona Phase Molecular Recognition Site on Single-Walled Carbon Nanotubes. ACS Sensors. 3 (2), 367-377 (2018).
- Singh, N., Husson, S. M. Adsorption thermodynamics of short-chain peptides on charged and uncharged nanothin polymer films. Langmuir. 22 (20), 8443-8451 (2006).
- Seker, U. O. S., et al. Thermodynamics of engineered gold binding peptides: Establishing the structure-activity relationships. Biomacromolecules. 15 (7), 2369-2377 (2014).
- Beutner, R., Michael, J., Schwenzer, B., Scharnweber, D. Biological nano-functionalization of titanium-based biomaterial surfaces: A flexible toolbox. Journal of the Royal Society Interface. 7 (Suppl 1), S93-S105 (2010).
- Sultan, A. M., et al. Aqueous Peptide-TiO2 Interfaces: Isoenergetic Binding via Either Entropically or Enthalpically Driven Mechanisms. ACS Applied Materials and Interfaces. 8 (28), 18620-18630 (2016).
- Teichroeb, J. H., Forrest, J. A., Jones, L. W., Chan, J., Dalton, K. Quartz crystal microbalance study of protein adsorption kinetics on poly(2-hydroxyethyl methacrylate). Journal of Colloid and Interface Science. 325 (1), 157-164 (2008).
- Lok, B. K., Cheng, Y. L., Robertson, C. R. Protein adsorption on crosslinked polydimethylsiloxane using total internal reflection fluorescence. Journal of Colloid And Interface Science. 91 (1), 104-116 (1983).
- Nakanishi, K., Sakiyama, T., Imamura, K. On the Adsorption of Proteins on Solid Surfaces, a Common but Very Complicated Phenomenon. Journal of Bioscience and Bioengineering. 91 (3), 233-244 (2001).
- Roddick-Lanzilotta, A. D., Connor, P. A., McQuillan, A. J. An In Situ Infrared Spectroscopic Study of the Adsorption of Lysine to TiO2 from an Aqueous Solution. Langmuir. 14, 6479-6484 (1998).
- Roddick-Lanzilotta, A. D., McQuillan, A. J. An in situ infrared spectroscopic investigation of lysine peptide and polylysine adsorption to TiO2 from aqueous solutions. Journal of Colloid and Interface Science. 217 (1), 194-202 (1999).
- Roddick-Lanzilotta, A., McQuillan, A. An in situ infrared spectroscopic study of glutamic acid and of aspartic acid adsorbed on TiO2: implications for the biocompatibility of titanium. Journal of Colloid and Interface Science. 227 (1), 48-54 (2000).
- Chan, B. M. C., Brash, J. L. Adsorption of fibrinogen on glass: reversibility aspects. Journal of Colloid And Interface Science. 82 (1), 217-225 (1981).
- van Enckevort, H. J., Dass, D. V., Langdon, A. G. The adsorption of bovine serum albumin at the stainless-steel/aqueous solution interface. Journal of Colloid And Interface Science. 98 (1), 138-143 (1984).
- Arnebrant, T., Nylander, T. Sequential and competitive adsorption of β-lactoglobulin and κ-casein on metal surfaces. Journal of Colloid And Interface Science. 111 (2), 529-533 (1986).
- Van Dulm, P., Norde, W. The adsorption of human plasma albumin on solid surfaces, with special attention to the kinetic aspects. Journal of Colloid And Interface Science. 91 (1), 248-255 (1983).
- Gonçalves, T. Fluorescent labeling of biomolecules with organic probes. Chemical Reviews. 109 (1), 190-212 (2009).
- Roth, K. D. W., Huang, Z. H., Sadagopan, N., Watson, J. T. Charge derivatization of peptides for analysis by mass spectrometry. Mass Spectrometry Reviews. 17 (4), 255-274 (1998).
- AppliChem, P. Safety Data Sheet According to Regulation (EU) 830/2015 3317 Trifluoroacetic Acid. , http://pub.panreac.com/msds/ing/3317.htm 112(2018).
- Heinrikson, R. L., Meredith, S. C. Amino acid analysis by reverse-phase high-performance liquid chromatography: Precolumn derivatization with phenylisothiocyanate. Analytical Biochemistry. 136 (1), 65-74 (1984).
- Shchelokov, A., et al. Adsorption of Native Amino Acids on Nanocrystalline TiO2: Physical Chemistry, QSPR, and Theoretical Modeling. Langmuir. 35 (2), 538-550 (2019).
- Fair, B. D., Jamieson, A. M. Studies of Protein Adsorption on Polystyrene Latex Surfaces. Journal of Colloid and Interface Science. 77 (2), 525-534 (1980).
- Kim, J. C., Lund, D. B. Adsorption behavior of p-lactoglobulin onto stainless steel surfaces. Journal of Food Processing and Preservation. 21 (607), 303-317 (1997).
- Kondo, A., Oku, S., Murakami, F., Higashitani, K. Conformational changes in protein molecules upon adsorption on ultrafine particles. Colloids and Surfaces B: Biointerfaces. 1, 197-201 (1993).
- Itoh, H., Nagai, T., Saeki, T., Sakiyama, T., Nakanishi, K. Adsorption of Protein onto Stainless Steel Particle Surface and its Desorption Behavior. Developments in Food Engineering. , 811-813 (1994).
- Itoh, H., Nagata, A., Toyomasu, T., Sakiyama, T., Nagai, T. Adsorption of β-Lactoglobulin onto the Surface of Stainless Steel Particles. Bioscience, Biotechnology, and Biochemistry. 59 (9), 1648-1651 (1995).
- Mudunkotuwa, I. A., Grassian, V. H. Histidine adsorption on TiO2 nanoparticles: An integrated spectroscopic, thermodynamic, and molecular-based approach toward understanding nano-bio interactions. Langmuir. 30, 8751-8760 (2014).
- Pászti, Z., Guczi, L. Amino acid adsorption on hydrophilic TiO2: A sum frequency generation vibrational spectroscopy study. Vibrational Spectroscopy. 50 (1), 48-56 (2009).
- Costa, D., Savio, L., Pradier, C. M. Adsorption of Amino Acids and Peptides on Metal and Oxide Surfaces in Water Environment: A Synthetic and Prospective Review. Journal of Physical Chemistry B. 120 (29), 7039-7052 (2016).
- Kosmulski, M. The significance of the difference in the point of zero charge between rutile and anatase. Advances in Colloid and Interface Science. 99 (3), 255-264 (2002).
- Kandegedara, A., Rorabacher, D. B. Noncomplexing tertiary amines as "better" buffers covering the range of pH 3-11. Temperature dependence of their acid dissociation constants. Analytical Chemistry. 71 (15), 3140-3144 (1999).
- Susumu, O., Teruaki, A., Koichi, T. The Adsorption of Basic a-Amino Acids in an Aqeous Solution by Titanium(IV) Oxide. Bulletin of the Chemical Society of Japan. 54, 1595-1599 (1981).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены