Method Article
Макрофаг Репортер Ячейка Анализ для изучения Toll-как Рецептор-опосредованный NF-kB/AP-1 Сигнализация на Adsorbed белковых слоев на полимерных поверхностях
В этой статье
Резюме
Этот протокол предоставляет исследователям быстрый, косвенный метод измерения TLR-зависимых NF-Ap-1 транскрипционный фактор активности в линии макрофаговой линии murine макрофагов в ответ на различные полимерные поверхности и адсорированные белковые слои, которые моделируют микросреду биоматериального имплантата.
Аннотация
Стойкий воспалительный ответ хозяина на имплантированный биоматериал, известный как реакция инородного тела, является серьезной проблемой в разработке и внедрении биомедицинских устройств и конструкций тканевой инженерии. Макрофаги, врожденная иммунная клетка, являются ключевыми игроками в реакции инородного тела, потому что они остаются на месте имплантата в течение всего срока службы устройства, и обычно изучаются, чтобы получить понимание этого вредного ответа хозяина. Многие исследователи биоматериалов показали, что адсорбированные белковые слои на имплантированных материалах влияют на поведение макрофагов, а затем влияют на реакцию хозяина. Методы в этой работе описывают модель in vitro с использованием адсорбовых белковых слоев, содержащих молекулы клеточного повреждения на полимерных биоматериальных поверхностях для оценки реакций макрофагов. Репортер NF/AP-1 репортер макрофаг-клеток линии и связанных с ним колориметрической щелочной фосфатазы анализа были использованы в качестве быстрого метода для косвенного изучения NF-ЗБ /AP-1 транскрипции фактор активности в ответ на сложные адсорbed белковых слоев, содержащих белки крови и повреждения связанных молекулярных моделей, как модель комплексного адсора белка.
Введение
Реакция инородного тела (FBR) является хронической реакцией хозяина, которая может негативно повлиять на производительность имплантированного материала или устройства (например, устройства доставки лекарств, биосенсоров), через постоянное высвобождение воспалительных посредников и препятствуя интеграции между имплантированным материалом и окружающим веществом1. Этот врожденный иммунный ответ инициируется процедурой имплантации и характеризуется долгосрочным наличием врожденных иммунных клеток и образованием волокнистой капсулы вокруг имплантата1. В контексте ответов на материалы хоста взаимодействия макрофагов-материалов оказывают значительное влияние на прогрессирование реакции хозяина и развитие FBR1. Макрофаги представляют собой разнообразную популяцию врожденных иммунных клеток, набираемую в место имплантации либо из популяций макрофагов, проживающих в тканях, либо из крови в качестве макрофагов, полученных из моноцитов. Они начинают накапливаться в месте имплантации вскоре после имплантации, и в течение нескольких дней становятся преобладающей популяцией клеток в микросреде имплантата. Макрофаги, придерживающиеся материалов, наряду с инородными клетками-гигантами тела (FBGC), образующиеся в результате синтеза макрофагов, могут сохраняться на поверхности материка в течение всего срока службы имплантата2,3. Следовательно, макрофаги считаются ключевыми игроками в ответ ениму теле из-за их роли оркестровки характерные шаги FBR: острый воспалительный ответ, ремоделирование тканей, и формирование фиброзной ткани1.
Платные рецепторы (TLRs) являются семейством рецепторов распознавания образов, которые выражаются многими иммунными клетками, включая макрофаги, и, как было показано, играют значительную роль в воспалении и заживлении ран. В дополнение к патогенных лигандов, TLRs способны связывать эндогенные молекулы, известные как повреждения связанных молекулярных моделей (DAMPs), которые высвобождаются во время некроза клеток и активировать воспалительные сигнальные пути в результате производства провоспалительных цитокинов4. Мы и другие предложили, что ущерб, понесенный во время процедур биоматерии мягких тканей релиз DAMPs, которые затем адсорб на биоматериальные поверхности в дополнение к белкам крови и модулировать последующие клеточные материалы взаимодействия5,6. Когда макрофаги взаимодействуют с адсорбированным слоем белка на имплантате, их поверхность TLRs может распознавать адсорбированные DAMPs и активировать провоспалительные сигнальные каскады, что приводит к активации фактора транскрипции NF-З и AP-1 и выработке провоспалительных цитокинов. Ранее мы показали, что макрофаги минина значительно увеличили активность NF-QB/AP-1 и фактор некроза опухоли (TNF-з, провоспалительных цитокинов) секреции в ответ на DAMP-содержащих адсорбированных белков ы слоев на различных полимерных поверхностей по сравнению с поверхностями с адсорбированных сыворотки или плазмы только (т.е., нет DAMPs настоящее время), и что этот ответ в значительной степени опосредовано TLR2, в то время как TLR4 играет меньшую роль5.
NF-ЗБ / AP-1 репортер макрофаг клеточной линии(Таблица материалов), используемый в этом протоколе является удобным методом для измерения относительной активности NF-ЗБ и AP-1 в макрофагах5,7,8. В сочетании с ингибиторами Пути TLR, эта клеточная линия является полезным инструментом для исследования активации TLR и его роль в воспалении в ответ на различные стимулы5,7,8. Клетки репортера являются модифицированной мышью макрофагов-подобной клеточной линии, которая может застойно производить секретную эмбриональную щелочнуюфосфатазу (SEAP) на NF-ЗБ и AP-1 активации транскрипционного фактора 9. Анализ колориметрической эзамиатической щелочной фосфатазы(Таблица материалов)может быть использован для количественной оценки относительных количеств экспрессии SEAP в качестве косвенного измерения активности NF--ЗБ/AP-1. Поскольку NF-КВ и AP-1 находятся ниже по течению многих клеточных сигнальных путей, нейтрализация антител и ингибиторов, нацеленных на конкретные TLRs (например, TLR2) или молекулы адаптера TLR (например, MyD88), могут быть использованы для проверки роли конкретного пути. Методология, описанная в этой статье, обеспечивает простой и быстрый подход для оценки вклада TLR сигнализации в реакции murine macrophage на различные полимерные поверхности с адсорбированными слоями белка, содержащими как белки крови, так и DAMPs в качестве модели в ипруто имплантированных биоматериалов.
протокол
1. Подготовка сми и реагентов
- Подготовка фибробластных носителей. Смешайте 450 мл модифицированной среды Орла Dulbecco (DMEM), 50 мл сыворотки крупного рогатого скота плода (FBS) и 5 мл пенициллина/стрептомицина. Хранить при 4 градусах по Цельсию до 3 месяцев.
- Подготовьте репортер макрофаг роста средств массовой информации в 50 мл aliquots. Комбинат 45 мл DMEM, 5 мл FBS, 5 мкг/мл mycoplasma ликвидации реагента (Таблица материалов), и 200 мкг /мЛ флеомицин D1 (Таблица материалов). Хранить при 4 градусах по Цельсию до 3 месяцев.
- Подготовьте репортер макрофаг анализ средств массовой информации в 50 мл aliquots. Комбинат 45 мл DMEM, 5 мл тепла инактивированных FBS (HI-FBS), 5 мкг /мЛ микоплазмы ликвидации реагента, и 200 мкг /мЛ флеомицин D1. Хранить при 4 градусах по Цельсию до 3 месяцев.
2. Покрытие поверхностей культуры клеток с поли (метил-метакрилат)
- Растворите поли (метил метакрилат) (PMMA) в хлороформе при 20 мг/мл (например, 100 мг ПММА в 5 мл хлороформа) в 20 мл стеклянного сцинтилляционного флакона. Поместите магнитный перемешивание бар в флакон и позволяют перемешать, по крайней мере 2 ч, пока все твердые вещества не растворяются.
ПРЕДЕКТО: Хлороформ вреден при вдыхании. Убедитесь в использовании растворителя в дым овой капот во время ношения PVA перчатки. - Пипетка 400 л раствора PMMA на центр боросиликатного стеклянного микроскопа скользит в спин-шерохе и вращается при 3000 об/мин в течение 2 мин. Подготовьте количество слайдов, необходимых для проведения обзора, а также 3-5 дополнительных для измерения угла контакта с водой. Храните слайды в чистой коробке (распыленной и протертой с 70% этанола) для использования в будущем.
ПРИМЕЧАНИЕ: Спиновое покрытие часто используется для отложения тонкого, равномерного покрытия на плоской поверхности. Спин-шубят вращает субстрат на высоких скоростях, используя центробежную силу для распространения покрытия по поверхности.- Измерьте угол контакта воды в двух случайных положениях на поверхности дополнительных покрытых горок (т.е. не слайдов, используемых для клеточной культуры) с помощью гониометра, чтобы стеклянная поверхность была полностью покрыта полимером.
ПРИМЕЧАНИЕ: Для измерения угла наклона контакта с водой следует использовать только воду высочайшей чистоты (например, стеклянную тройную дистиллированную).
- Измерьте угол контакта воды в двух случайных положениях на поверхности дополнительных покрытых горок (т.е. не слайдов, используемых для клеточной культуры) с помощью гониометра, чтобы стеклянная поверхность была полностью покрыта полимером.
- В шкафе биологической безопасности (BSC) прикрепите 8-камерные липкие колодцы к слякотам с покрытием PMMA с помощью стерильных щипцы и следуя асептической технике. Нажмите твердо на верхней части липких скважин, чтобы убедиться, что они сильно прилагается. Инкубировать слайды с прикрепленными липкими колодцами при 37 градусах Цельсия на ночь, чтобы обеспечить печать.
- Проверьте печать липких скважин, добавив 200 л клеточной культуры класса (эндотоксин-бесплатно) воды для каждой скважины. Инкубировать при комнатной температуре (RT) в течение 60 минут и обеспечить отсутствие утечки перед продолжением. Аспирируйте воду, стараясь не беспокоить покрытие PMMA.
- Выполните безэндитоксинов воды, добавляя 300 л воды без эндотоксина к каждой скважине и инкубируя по 1 ч (три раза), 12 ч и 24 ч перед использованием для удаления оставшегося растворителя.
- Испытать концентрацию эндотоксина слайдов, которые будут использоваться для клеточной культуры. Инкубировать 200 л без эндотоксина воды реагента(Таблица материалов) в одной скважине каждого слайда в течение 1 ч. Измерьте концентрацию эндотоксина в экстракте с помощью конечной точки хромогенного эндотоксина(Таблица Материалов).
ПРИМЕЧАНИЕ: Следующий протокол специфичен для эндотоксина асссеивкомплект, перечисленныев таблице материалов . - Используйте только воду и расходные материалы (т.е. пипетки советы, микроцентрифуг трубки и хорошо пластин), которые сертифицированы пирогена бесплатно (т.е. эндотоксин бесплатно) для этой работы. Кроме того, любая стеклянная посуда, используемая при приготовлении полимерных поверхностей, должна быть депирогенирована с помощью сухой тепловой стерилизации (250 градусов по Цельсию на 30 мин) до использования10. Измерение эндотоксина в растворе экстракта, как описано здесь, может привести к недооценке эндотоксина на поверхности материала11,12. Следовательно, рекомендуется, чтобы при разработке протокола полимерного покрытия, выполнять эндотоксина реакции анализа (т.е. шаги 2.5.4'2.5.6 для тестовых образцов (реагентная вода) или шип контроля) непосредственно в скважинах, содержащих утес с покрытием, чтобы обеспечить неисточник эндотоксина непреднамеренно вводятся в систему в процессе покрытия.
- Принесите все тестовые образцы (т.е. экстракты) и эндотоксинные реагенты анализа на RT. Восстановите хромогенный реагент в буфере анализа и эндотоксине стандарта в реагентной воде, позволяют растворить в течение 5 мин и аккуратно закружить перед использованием. Обложка все бутылки с парафина пленки, когда не используется.
- Создайте стандартную кривую разбавления эндотоксина в диапазоне от нижнего до верхнего предела ассея, выполняя серийное разбавление стандарта эндотоксина в реагентной воде.
- Для контроля для повышения или ингибирования эндотоксина анализ в образцах испытаний, подготовить положительный контроль (также называемый шип контроля или шипами образца) путем разбавления известное количество эндотоксина в неиспользованных тест овыхрить раствор.
ПРИМЕЧАНИЕ: Концентрация положительного контроля должна быть такой же концентрацией, как и стандарт в середине стандартной кривой. Если восстановленное количество эндотоксинного всплеска (т.е. концентрация положительного контроля за вычетом концентрации несвязанного испытательного образца) находится в пределах 50–200% от номинальной концентрации эндотоксина шипа, то раствор экстракции может считаться не существенным вмешательством в анализ. - Добавьте 50 юл стандартов, образцов или элементов управления шипами к каждой скважине 96-хорошо пластины в дубликат или тройной. Используйте реагентную воду в качестве отрицательного контроля.
- Добавьте 50 л хромогенного реагента в каждую скважину. Добавить реагент быстро во все скважины. Используйте таймер для записи времени, необходимого для добавления реагента во все скважины. Накройте тарелку клеевым уплотнением и инкубация на 37 градусов по Цельсию (время инкубации много зависит и указано на Сертификат анализа, включенный в комплект хромогенного реагента). Кроме того, проверьте на пластине каждые 15 минут во время инкубации до изменения цвета наблюдается во всех стандартных скважин.
- После инкубации, добавить 25 л 50% уксусной кислоты к каждому колодцу (окончательная концентрация 10% уксусной кислоты на хорошо), чтобы остановить реакцию. Добавить уксусную кислоту в том же порядке, что и хромогенный реагент. Прочитайте абсорбцию пластины с помощью считывателя пластин на 405 нм. Аспирируйте жидкость и выбрасывайте тарелку.
ПРИМЕЧАНИЕ: Добавление уксусной кислоты должно занять такое же время, чтобы добавить к каждой скважине, как хромогенный реагент взял (30 с).
- Ультрафиолет (УФ) стерилизовать слайды в течение 30 минут до экспериментов клеточной культуры.
3. Покрытие поверхностей культуры клеток с полидиметилсилоксаном
- Смешайте полидиметилсилоксан (PDMS) эластомер в соотношении веса 10:1 (база:лечебное средство). В шкафу биологической безопасности, пипетка примерно 10 мл полидиметилсилоксана базы в стерильной трубке. Взвесьте трубку и медленно добавить лечебное средство, пока 10% не был добавлен.
ПРЕДЕКТО: Используйте реагенты PDMS в хорошо проветриваемом месте и избегайте зрительного контакта, надев защитные очки. - Тщательно смешайте эластомер, помешивая с стерильной серологической наконечник пипетки и пипеткой вверх и вниз. Добавьте примерно 200 qL раствора к каждой скважине из 48-колодца пластины. Наклоните скважину медленно, чтобы обеспечить полное покрытие скважин эластомерным раствором.
- Поместите хорошую тарелку с эластомером в вакуумную духовку, установленную при температуре 50 см г, 40 градусов по Цельсию. Снимите крышку и накройте одностряйным протрите, чтобы предотвратить попадание других обломков в колодцы. Разрешить инкубировать не менее 48 ч.
- Подтвердите, что скважины полностью покрыты с помощью визуального осмотра. Убедитесь, что эластомер полностью вылечен, мягко подталкивая стерильным наконечником пипетки перед удалением.
- Добавьте 300 л из 70% этанола (сделанного с абсолютным этанолом и безэндивоченной водой) и инкубировать на РТ в течение 1 ч. Удалить этанол и выполнить безэндитоксинов вымывает воду, добавляя 300 л без эндотоксина воды к каждому колодцу и инкубируя в течение 1 ч (три раза), 12 ч. , и 24 ч до использования для удаления любого оставшегося растворителя.
- Инкубировать 200 л эндотоксина воды в трех скважинах каждой пластины на 1 ч. Измерьте концентрацию эндотоксинов в экстрактах воды с помощью конечной хромогенной эндотоксинной асссе (шаги 2.5.1-2.5.6).
4. Покрытие клеточных культуры поверхностей с флуоринированной поли (тетрафтороэтилен)
- Сделать 1 мг/мл раствор фторированного поли (тетрафторэтилен) (fPTFE) (например, добавить 10 мг fPTFE до 10 мл фторированного растворителя -Таблица материалов)в 20 мл стекло сцинтилляции флакальной. Поместите магнитный перемешивание бар в флакон и позволяют перемешать, по крайней мере 24 ч, пока все твердые вещества не растворяются.
- Добавьте примерно 150 юл полимерного раствора к каждой скважине из 48-хорошо обработанной пластины (т.е. не обработанной культуры тканей). Наклоните скважину медленно, чтобы обеспечить полное покрытие всех скважин полимерным раствором. Замените крышку.
- Для обеспечения эффективного покрытия скважин, стеклянные крышки должны быть покрыты fPTFE и использоваться для измерения угла контакта с водой (шаг 4.3.1). Место охватывает крышки внутри колодцев 24-колодской пластины. Добавьте около 400 юаней полимерного раствора к каждому хорошо содержащему крышку. Нажмите крышки вниз с помощью стерильных щипков, гарантируя, что они полностью покрыты полимерным раствором, и накройте хорошо пластины с крышкой.
- Поместите хорошо тарелку с полимерным раствором и/или крышками в вакуумную печь, установленную при температуре 50 см г, 40 градусов по Цельсию. Снимите крышку и накройте одностряйным протрите, чтобы предотвратить попадание других обломков в колодцы. Разрешить инкубировать не менее 48 ч.
- Измерьте угол контакта воды с покрытием fPTFE крышками с помощью гониометра для обеспечения эффективного покрытия.
ПРИМЕЧАНИЕ: Для измерения угла наклона контакта с водой следует использовать только воду высочайшей чистоты (например, стеклянную тройную дистиллированную).
- Измерьте угол контакта воды с покрытием fPTFE крышками с помощью гониометра для обеспечения эффективного покрытия.
- Добавьте 300 л из 70% этанола (сделанного с абсолютным этанолом и безэндивоченной водой) и инкубировать на РТ в течение 1 ч. Удалить этанол и выполнить безэндитоксинов вымывает воду, добавляя 300 л без эндотоксина воды к каждому колодцу и инкубируя в течение 1 ч (три раза), 12 ч. , и 24 ч до использования для удаления любого оставшегося растворителя.
- Инкубировать 200 л эндотоксина воды в трех скважинах каждой пластины на 1 ч. Измерьте концентрацию эндотоксинов в водных экстрактах с помощью конечной хромогенной эндотоксинной асссе (шаги 2.5.1-2.5.6).
- УФ стерилизовать скважины пластин в течение 30 минут до экспериментов клеточной культуры.
5. Изготовление лисата из 3T3 клеток
- Выращивайте 3T3 клетки в нескольких колбах T150 до 70% слияния. Чтобы отделить клетки, аспирировать носители, мыть поверхность с 5 мл PBS, и аспирировать PBS. Добавьте 5 мл бесзащитного, рекомбинантного клеточного диссоциационирующего фермента(Таблица Материалов)и инкубацию при 37 градусах Цельсия в течение 3-5 мин.
- Отсоедините клетки, аккуратно наклоняя колбу взад и вперед. Добавьте 5 мл PBS, чтобы нейтрализовать рекомбинантный фермент, используемый для диссоциации клеток. Перенесите отдельные клетки из колбы в центрифугу трубки и перемешайте через пипетки. Выполните количество живых клеток с помощью гемоцитометра и красителя жизнеспособности клеток.
ПРИМЕЧАНИЕ: Фермент диссоциации клеток, который может быть нейтрализован путем разбавления в PBS был выбран, чтобы избежать введения сыворотки на основе белков в препарате лизата. Если трипсин используется для диссоциации клеток, его следует нейтрализовать раствором, содержащим сыворотку, и следует провести дополнительную стирку PBS, чтобы уменьшить количество белков сыворотки, переносимых в препарат лизата. - Центрифуги клетки на 200 х г в течение 5 мин. Аспирировать супернатант и resuspend клетки в первоначальном объеме (т.е., 10 мл х количество колб) PBS смыть все оставшиеся средства массовой информации. Повторите.
- Центрифуги клетки снова на 200 х г в течение 5 минут и аспирации супернатанта. Добавьте объем PBS, необходимый для достижения конечной концентрации клеток 1 х 106 ячеек/мл. Поместите раствор клетки в морозильную камеру -80 градусов до полного замораживания образца (не менее 2 ч).
- Оттепель клеточного раствора в водяной бане 37 градусов. После полного размораживания, поместите раствор обратно в морозильную камеру -80 градусов до полного замораживания. Повторите в общей сложности 3 циклов замораживания-оттепели.
- Выполните микро-бисинхониновой кислоты (BCA) анализ на лизат клетки при различных разбавлениях (например, 1/100, 1/200, 1/500, 1/1000), чтобы определить концентрацию белка. Разбавить лизат клеток до концентрации белка 468,75 мкг/мл, aliquot, и хранить при -80 градусов по Цельсию для использования в будущем.
ПРИМЕЧАНИЕ: Окончательная концентрация белка в 48-хорошо пластине составляет 125 мкг/см2 (на основе площади поверхности одной скважины, 0,75 см2). - Выполните западную помотку для оценки присутствия DAMPs в лизате (например, белок теплового шока 60 «HSP60», коробка группы высокой мобильности 1 «HMGB1»), загрузив 40–60 мкг белка лизата в буфере на 1,5 мм толщиной 10% полиакриламидного геля и следуйте стандарту Западного поплавка Процедуры.
6. Оценка влияния адсорбирующих белковых слоев и платных рецепторов на активность макрофагов NF-ЗБ
ПРИМЕЧАНИЕ: Для схемы экспериментального рабочего процесса и макета пластины, обратитесь к рисунку 1А и дополнительной рисунку 1, соответственно.
- Расти репортер макрофаги в соответствующих размеров колбу до 70% слияния. Аспирные носители, мыть поверхность с PBS, и аспирный PBS. Добавьте рекомбинантный клеточный диссоциационный фермент и инкубацию при 37 градусах По Цельсию в течение 8 мин.
- Отсоедините клетки, плотно нажав по бокам колбы. Инактивируйте реконъюкцию реконъюнции диссоциации рекоменции рекоментом рекоментом клетки путем добавления равного объема носителей роста (содержащих 10% FBS). Выполните количество живых клеток с помощью гемоцитометра и красителя жизнеспособности клеток.
ПРИМЕЧАНИЕ: Ожидаемая жизнеспособность для репортера макрофагов после 8-минутной инкубации в клеточном ферменте диссоциации составляет 90%. - Клетки центрифуги при 200 х г в течение 5 мин. Аспир супернатант и resuspend в первоначальном объеме PBS для мытья клеток. Центрифуге снова и resuspend клетки на 7,3 х 105 клеток / мл в ассе-медиа (содержащий тепло инактивированных FBS).
- Отдельная клеточная подвеска на 3 различных трубки: ингибитор TLR4, анти-TLR2 и необработанные. Инкубировать клетки с 1 мг/мл tLR4 ингибитор в течение 60 мин на RT или с 50 мкг /мЛ анти-TLR2 в течение 30 мин на RT.
- Добавьте 200 кЛ лисата, 10% FBS, 10% коммерческую плазму мыши(Таблица материалов),или смесь белковых растворов в 48-ну хорошую пластину (или эквивалент) и дайте протеину адсорбировать при 37 градусах По Цельсия в течение нужного количества времени (т.е. 30 мин, 60 мин, или 24 ч). Аспирные белковые растворы из скважин, используя свежий пипетку Pasteur для каждого белкового раствора, и мыть поверхности с 250 Зл ТБС в течение 5 мин. Aspirate PBS. Повторите в общей сложности 3 стирания.
ПРИМЕЧАНИЕ: Этот шаг может потребоваться начать раньше в протоколе в зависимости от желаемого времени адсорбции. Соответствующим образом отрегулируйте протокол. - После инкубационного периода с ингибитором TLR4 или анти-TLR2, клетки пипетки, чтобы приостановить. Добавьте 200 л клеточного раствора к каждому колодцу.
- При положительном состоянии контроля TLR2 добавьте Pam3CSK4 к конечной концентрации 150 нг/мл. При положительном состоянии контроля TLR4 добавьте липополисахарид (LPS) к конечной концентрации 1,5 мкг/мл. Инкубировать клетки при 37 градусах по Цельсию на 20 ч.
- Образец 20 зл супернатант из каждого колодца и пластины в дублировать в 96-колодец пластины. Включите три скважины из 20 ассеаных носителей в качестве фонового контроля. Добавьте 200 Зл реагента реагента репортера SEAP к каждой скважине. Накройте тарелку клеевым уплотнением и инкубировать по 2,5 ч при 37 градусах Цельсия.
ПРИМЕЧАНИЕ: Время инкубации может варьироваться в зависимости от экспериментальных условий и должно быть оптимизировано для сильной разницы в абсорбции между положительными и отрицательными контрольными скважинами.- Перенесите оставшуюся часть супернатанта в трубку 1,5 мл (в скважине). Центрифуга на 1000 х г в течение 10 минут, чтобы гранулы любого мусора. Перенесите супернатант на новую трубку 1,5 мл и храните при -80 градусах Цельсия. Анализ супернатанта на наличие провоспалительных цитокинов (например, ТНФ-з, интерлейкин 6) с помощью ферментосвязанного иммуносорбента (ELISA).
- Удалите клейкую пластину уплотнения. Прочитайте абсорбцию пластины с помощью считывателя пластин ы на 635 нм. Аспирируйте жидкость и выбрасывайте тарелку.
Результаты
Методы очистки поверхностей с полимерным покрытием были протестированы, чтобы убедиться, что не было нарушения покрытия, которое будет рассматриваться как изменение угла контакта с водой на непокрытом стеклянном покрывале(рисунок 2). Замачивание PMMA покрытием микроскоп агонии в 70% этанола для 1 ч было установлено, чтобы удалить покрытие PMMA(Рисунок 2, левая панель), вероятно, из-за растворимости PMMA в 80 ВТ% этанола13, поэтому PMMA покрытием поверхностей были очищены с помощью 30 мин УФ стерилизации в одиночку. Концентрация ПММА для покрытия была оптимизирована ранее5. 1 ч 70% этанола замочить был использован для очистки PDMS, и УФ стерилизации было пренебречь, поскольку УФ-излучение может вызвать цепные ножницы и влиять на поверхность смачивания свойства PDMS14. Оба 70% этанола замачивания и УФ стерилизации не влияет на угол контакта воды fPTFE покрытием coverslips(Рисунок 2, правая панель), поэтому два метода, подряд, были использованы для очистки покрытий fPTFE. Метод покрытия fPTFE ранее был описан группойГрейнджера 15.
Западная поместье была выполнена на lysate 3T3 для обеспечения присутствия видов DAMP в сложной молекулярной смеси. Результаты показали, что оба HMGB1 и HSP60, два хорошо документированных DAMPs16,17, присутствовали в lysate(Рисунок 1B). Адсорбция лигандов TLR из лизата на полимерные поверхности была подтверждена культивированием репортермакрофагов (необработанных, TLR2 нейтрализован, или TLR4 ингибируется) на 20 ч на белковых поверхностях полимера (т.е. ткань культуры обработанных полистирола (TCPS), PMMA, PDMS, fPTFE), а затем косвенно оценки NF-ЗБ / AP-1 деятельности на основе производства SEAP с использованием ферментативной оценки(рисунок 1C и рисунок 3). Кроме того, репортер макрофагов значительно увеличили активность NF-qB/AP-1 на адсорбированных лисате по сравнению с адсорбированным FBS или плазмой и без предварительно адсорбированных белков (медиа) (Рисунок 4). TLR лиганды синтетических триацилатой липопептида (Pam3CSK4, TLR2 лиганд) и липополисахарида (LPS, TLR4 лиганд) были включены в качестве положительного контроля для подтверждения антитела или ингибитор и тест работалдолжным должным образом. TLR2 нейтрализации было заметно сильнее сокращение NF-ЗБ / AP-1 ответ репортер макрофагов на адсорbed lysate по сравнению с TLR4 ингибирования. Кроме того, небольшое количество лизата, разбавленного в сыворотке (на основе общего белка), индуцированного значительно увеличили nF-sB/AP-1 ответ по сравнению с сывороткой в одиночку, с самым низким эффективным разбавлением зависит от полимерной поверхности(рисунок 5). Эти результаты демонстрируют потенцию молекул, полученных из адсорбированных лисатов, на индуцировании TLR-зависимой активности NF-AP/AP-1 в репортерских макрофагах на различных полимерных поверхностях.
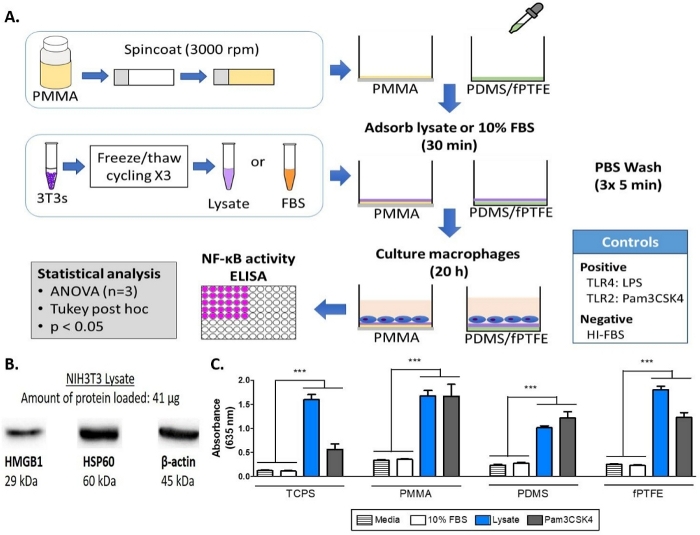
Рисунок 1: Методы и результаты для щелочной фосфатазы анализ NF-SB / AP-1 репортер макрофагов на TCPS, PMMA, PDMS, и fPTFE. (A) Диаграмма рабочего процесса для репортера макрофаг щелочной фосфатазы анализ. (B) Западная поместье lysate подтверждая присутсвие видов DAMP HMGB1 и HSP60, с q-actin как контроль нагрузки. (C) NF-qB/AP-1 деятельности (представлены поглощения) репортер макрофагов культивируется на средствах массовой информации (отрицательный контроль), 10% FBS, lysate, и Pam3CSK4 (TLR2 лиганд, положительный контроль) для 20 ч. Данные показывают результаты одного эксперимента и является репрезентативным результаты по крайней мере 2 отдельных экспериментов, показанных как средний уклон (SD). Каждый эксперимент использовал n no 3 отдельных скважин на условие, и каждая скважина была покрыта дубликатом для ферментативного асссея. Анализируется с помощью одностороннего aNOVA и Tukey после специального теста. р Злт; 0,001. Эта цифра была адаптирована с разрешения McKiel и Фицпатрик5. Авторское право 2018 Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Оптимизация методов очистки поверхностей с покрытием PMMA- и fPTFE, оцениваемых с помощью угла контакта с водой (WCA). Измерения были проведены на 2 отдельных пятен, по крайней мере 3 coverslips. Данные отображаются как средние SD. Анализируемые с помощью одностороннего aNOVA и Tukey послеспециального теста. - стр. 0,05. Эта цифра была адаптирована с разрешения McKiel и Фицпатрик5. Авторское право 2018 Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: TLR-опосредованный NF-КБ/AP-1 деятельности (представлены поглощения) репортер макрофагов культивируется на 10% FBS (контроль), lysate, и положительный контроль за 20 ч. (A) Влияние TLR2 нейтрализации на репортер макрофаг ответы на адсорированный лизат. Положительный контроль - Pam (Pam3CSK4, Ligand TLR2). (B) Влияние торможения TLR4 на реакцию репортера макрофагов на адсорбированный лисат. Положительный контроль LPS (Ligand TLR4). Данные показывают результаты одного эксперимента и являются репрезентативными для результатов, по крайней мере, 2 отдельных экспериментов, показанных как среднее и SD. Каждый эксперимент использовал n no 3 отдельных скважин на условие, и каждая скважина была покрыта дубликатом для ферментативного асссея. Анализируется с помощью одностороннего aNOVA и Tukey после специального теста. р-р злт; 0,01, р-н Эта цифра была адаптирована с разрешения McKiel и Фицпатрик5. Авторское право 2018 Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
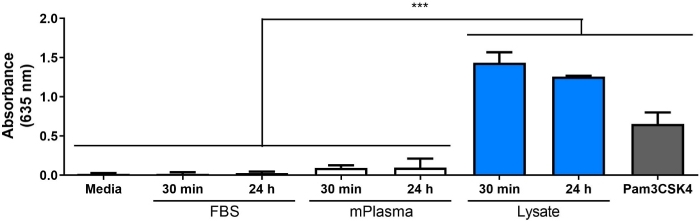
Рисунок 4: Активность NF-qB/AP-1 (представленная абсорбцией) репортерских макрофагов, культивированных на носителях (отрицательный контроль), 30 мин и 24 ч адсорбированных белковых слоев, и Pam3CSK4 (положительный контроль) на TCPS за 20 ч. Данные объединяются из 3 отдельных экспериментов и отображаются как средние SD. Каждый эксперимент использовал n no 3 отдельных скважин на состояние, и каждая скважина была покрыта дубликатом для ферментативного асссе (т.е. n no 9 ненезависимых клеточных культуры скважин и n no 18 ненезависимых ферментативных скважин ассаи). Анализируется с помощью одностороннего aNOVA и Tukey после специального теста. р Злт; 0,001. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Репортер макрофаг NF-AP-1 деятельности (представлены абсорбции) после 20 ч в ответ на разбавления лизата в FBS (общий белок 280 мкг / хорошо) адсорбируется на полимерные поверхности в течение 30 минут. (A)TCPS. (B) PMMA. (C) PDMS. (D) fPTFE. Данные показывают результаты одного эксперимента и являются репрезентативными для результатов, по крайней мере, 2 отдельных экспериментов, показанных как среднее и SD. Каждый эксперимент использовал n no 3 отдельных скважин на условие, и каждая скважина была покрыта дубликатом для ферментативного асссея. Анализируется с помощью одностороннего aNOVA и Tukey после специального теста. - стр. 0,05, п.л.; 0,01,. р.; 0,001. Эта цифра была адаптирована с разрешения McKiel и Фицпатрик5. Авторское право 2018 Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Дополнительная диаграмма 1: Пример макетов, используемых для NF-QB/AP-1 репортер макрофаг клеточной культуры анализ в 8-камерных и 48-ну хорошо пластины форматов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Основным направлением нашей лаборатории является реакция хозяина на имплантаты твердых биоматериалов мягких тканей, и, в частности, как повреждение клеток, понесенное во время процедуры имплантации, влияет на реакцию хозяина. Представленная здесь работа описывает предварительные эксперименты с использованием репортера макрофаг овой линии и in vitro-генерируемых DAMP-содержащих клеточного лизата, чтобы исследовать влияние молекул, выпущенных во время повреждения клеток (т.е., от операции имплантата) на макрофаг ответы на биоматериалы. Фибробластный клеточный лисат был использован для моделирования клеточного повреждения и высвобождения DAMPs из-за размещения биоматериала. Фибробласты были выбраны для создания лизата из-за распространенности фибробластов в мягких тканях, а также их способности выделять различные внеклеточные матричные белки (ECM), в том числе фибронектин18. Цикл замораживания-оттепели был выбран в качестве метода лиза для производства как внутриклеточных, так и ECM-производных DAMPs, подобно тому, что будет присутствовать в среде имплантатов. Ингибиторы протеазы не были использованы, чтобы сделать этот lysate. В то время как неконтролируемый лиза клетки, как замораживание оттепели езда на велосипеде может привести к освобождению протеаз, которые могут деградировать DAMPs, эти ферменты также, вероятно, будет присутствовать в среде биоматериала имплантата, когда клетки повреждены во время процедуры имплантации. Наличие ДАМП в сложной молекулярной смеси лизата было подтверждено западным пятном(рисунок 1B; HMGB1 и HSP60) и SEAP репортер асссе(Рисунок 1C; Активность NF-'B/AP-1 в ответ на адсорбированный лисат). Мы также провели анализы, где лисат был разбавлен в FBS на основе общей концентрации белка и адсорбируется на поверхности клеточной культуры(Рисунок 5), чтобы лучше отражать сложность среды имплантата, так как он будет содержать обилие белков крови, а также DAMPs6. Активность репортера макрофага NF-sB/AP-1 значительно возросла на адсорбированных слоях от лизата, разбавленного в FBS, а наименьшее разбавление для достижения значительной активации было зависимым от поверхности, варьируясь от 0,1% (TCPS) до 10% (PDMS и fPTFE).
Полимеры PMMA, PDMS и PTFE были выбраны для этой работы, потому что они не разлагаются и широко используются в литературе для оценки белкового адсорбции и макрофагов ответ на биоматериалы19,20,21,22,23,24,25. TCPS также был использован для сравнения, так как это общий субстрат, используемый для макрофага in vitro и TLR сигнализацииработы 21,26,27,28. Материалы, используемые в нашей работе, являются репрезентативными примерами неразлагаемых, твердых биоматериалов. Тем не менее, многие другие материалы могут быть использованы с этой моделью, при условии, что материал может быть покрыта на плиты клеточной культуры или микроскоп слайды и должным образом обеззараживаются. Для этой модели in vitro была выбрана линия макрофагов nF-AP/AP-1, поскольку она позволяет быстро, косвенно измерять активность NF-N-B/AP-1 через индуцируемое выражение СЕЭП NF-Ap-1. Макрофаги репортера NF-'B/AP-1 требуют использования фломемицина D1 в культурных носителях в качестве селективного антибиотика, чтобы гарантировать, что только клетки с индуцированным геном СЭЭП NF-qB/AP-1 присутствуют29. Для щелочной фосфатазы анализ, очень важно использовать HI-FBS в среде клеточной культуры, чтобы избежать потенциальных ложных положительных результатов, порожденных щелочных фосфатаз, присутствующих в сыворотке. Наши исследования на сегодняшний день показывают, что FBS-адсорбируется поверхностей не генерируют обнаруживаемый ложноположительный результат, вероятно, потому, что молекулы сыворотки сильно адсорбируется на поверхность культуры и не выпущены в супернатант. Точка времени культуры для репортера макрофагов (20 ч), точка инкубации инкубации (2,5 ч) и абсорбция считывания длины волны (635 нм) для щелочную фосфатазу были оптимизированы с помощью этой системы для обеспечения надежных и воспроизводимых измерений для всех условий.
Первоначальный протеин адсорбции timepoint 30 мин был выбран для этой работы из-за его общего использования в литературе адсорбции белка(Рисунок 1C)30,31,32,33,34. Тем не менее, мы также исследовали больше времени адсорбции (т.е. 60 мин и 24 ч, Рисунок 4), чтобы лучше представлять адсорбированный слой белка, что макрофаги будут взаимодействовать с in vivo, что, вероятно, произойдет 4'24 ч после имплантации1. Было постулировано, что большинство белков адсорбции и обмена происходит в первые 60 минут воздействия на поверхность26,35,36, Поэтому 60 мин адсорбции время может быть более актуальным timepoint. Мы также перешли от использования FBS в качестве отрицательного контроля за присутствием DAMPs в адсорбируется слой белка к коммерческой плазмы мыши. Обоснование использования плазмы вместо сыворотки является то, что плазменные белки, как известно, играют значительную роль в адсорбции белка и макрофаг ответ1, и что плазма обеспечивает лучшее представление белков в ране окружающей среды. Плазма, используемая в экспериментах по адсорбции белка, обычно готовится в виде разбавления26,36,37,что мотивировало наше использование 10% плазмы. Человеческая плазма обычно используется26,36, как это легче получить в больших количествах и более клинически актуальным, по сравнению с плазмой мыши. Тем не менее, мы решили использовать коммерческую плазму мыши для в этой модели, чтобы сохранить вид белковых растворов в соответствии с клетками репортера.
Использование репортер макрофаг клеточной линии ввели некоторые ограничения в рамках исследования. Во-первых, использование муринового лейкемии макрофаг овой линии имеет свои ограничения, как фенотип и поведение может варьироваться от первичных культур макрофага. Хотя это ограничение будет рассмотрено в будущей работе с использованием первичных макрофагов, родительской линии клеток макрофага было показано, тесно имитировать мышь костного мозга полученных макрофагов с точки зрения их рецепторов поверхности клетки и ответ на микробные лиганды для TLRs 2, 3 и 438. Кроме того, макрофаги репортера NF-'B/AP-1 дали аналогичные результаты в ответ на стимуляцию HMGB1 и LPS по сравнению с перитонеальными первичными макрофагами39. Следует отметить, что NF-ЗБ / AP-1 репортер макрофагов, и их родительской деформации, не выражают TLR540. Исследователи показали, что HMGB1 был в состоянии активировать NF-ЗБ транскрипционные факторы через TLR5 сигнальных путей в HEK-293 клеток застежко трансфицируется с человеком TLR541. Таким образом, вклад HMGB1-TLR5 сигнализации для общей активности NF-ЗБ на поверхностях с покрытием lysate был проигнорирован в этой модели. Кроме того, репортер макрофаги и их родительский штамм не выражают ASC адаптер белка, и, следовательно, не образуют большинство типов воспаления и не может обрабатывать неактивные IL-1 " или неактивных IL-18 их зрелые формы42. Таким образом, модель, которая мы использовали, не учитывает вклад аСК-зависимой активности воспаления и последующего автокрина ИЛ-1 и Ил-18 сигнализации в макрофаге реакции на lysate-адсорбированных поверхностей. Следовательно, этот анализ предназначен как предварительное исследование активации ТЛР-зависимых NF-ЗВ, и последующие исследования с использованием первичных макрофагов рекомендуется обеспечить более полное и репрезентативное понимание активации макрофагов и фенотипа на материальных поверхностях, представляющих интерес.
Щелочный фосфатазный анализ косвенно измеряет активность макрофагов репортера NF-sB/AP-1. Тем не менее, Есть много сигнальных путей, кроме TLRs, которые включают NF-ЗВ / AP-1 (например, интерлейкин-1 рецептор "IL-1R"43 и рецептор фактора некроза опухоли (TNFR)44). Поэтому необходимо было оценить вклад TLR2 и TLR4 сигнализации в увеличенный NF-QB/AP-1 ответ на lysate-адсордных поверхностей с помощью ингибирующих анализов(рисунок 3). Обоснование для выбора этих двух поверхностных TLRs было то, что по крайней мере 23 DAMPs, которые были показаны для сигнала через TLR2 и TLR445, в том числе хорошо характерные HMGB1, и оба рецептора выражаются на поверхности клетки и могут взаимодействовать непосредственно с поверхностью биоматериала6. Анализы ингибирования TLR2 и TLR4 показали, что при блокировке сигнализации TLR2 или TLR4 реакция NF-qB/AP-1 репортера макрофагов на адсорбированный лизат была снижена, что указывает на то, что оба пути участвуют. Тем не менее, было заметно больше сокращения активности NF-ЗБ/AP-1, когда сигнализация TLR2 была нейтрализована, что свидетельствует о том, что TLR2 может играть главную роль в ответе репортермакрофагов на адсорбированный лизат. Мы признаем, что может быть некоторое нецелевое ингибирование с TLR сигнальный путь нейтрализации антител и ингибиторов. Нейтрализующее антитело было использовано для ингибирования пути TLR2, так как на момент этой работы не было коммерчески доступных молекул ингибитора TLR2.
Методы, представленные здесь, используют лисат в качестве сложного источника DAMPs, а макрофаги репортера NF-ЗВ/AP-1 в качестве модели in vitro для макрофагов ответов на DAMPs и другие белки, адсорированные полимерными биоматериалами(рисунок 1). Мы ожидаем, что наш протокол может быть использован для быстрого анализа NF-'B/AP-1 ответов и вверх по течению TLR сигнализации репортер макрофагов на различные материалы (в том числе разлагаемых материалов, пористых лесов или гидрогелей) и адсорбирования белковых слоев(рисунок 3). Тем не менее, использование пористых материалов и гидрогелей приведет к сложности в системе, так как это может быть сложно провести различие между адсорбированных молекул и entrained молекул. Мы также ожидаем, что этот протокол может быть легко адаптирован для изучения вклада других сигнальных путей вверх по течению NF-qB/AP-1 (например, C-тип лектина рецепторов46 и нуклеотид-связывающих домена олигомеризации (NOD)-подобных рецепторов47) с соответствующими ингибиторами. Кроме того, nF-ЗБ/AP-1 ответ репортер макрофагов можно сравнить между различными материалами, при условии, ответы нормализуются к исходной активности клеток (т.е. клетки в средах на каждой поверхности без предварительно адсорбированного белка) и все материалы имеют необнаруживаемые уровни эндотоксина.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы с благодарностью признают оперативное финансирование со стороны Канадских институтов здравоохранения исследовательский проект (PTJ 162251), Королевский университет Сената Консультативный комитет по исследованиям и инфраструктурной поддержки со стороны Канадского фонда инноваций Джон Эван лидерство фонда (проект 34137) и Министерство исследований и инноваций Онтарио научно-исследовательский фонд (проект 34137). L.A.M. была поддержана Королевским университетом Р. Сэмюэлем Маклафлином, Советом по естественным наукам и инженерным исследованиям Канадской премии канадской стипендии и стипендией Онтарио. Авторы хотели бы поблагодарить д-ра Мирона Шевчука за его щедрый дар репортера NF-ЗБ/AP-1, а также докторов Майкла Бленнерхассетта и Сандры Лоуренссен за использование их системы гельной визуализации и считывателя пластин.
Материалы
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| anti-mouse/human CD282 (TLR2) | Biolegend | 121802 | |
| CLI-095 (TLR4 inhibitor) | Invivogen | TLRL-CLI95 | |
| C57 complement plasma K2 EDTA 10ml, innovative grade US origin | InnovativeResearch | IGMSC57-K2 EDTA-Compl-10ml | Mouse plasma |
| Dulbecco's modified eagle medium (DMEM) | Sigma Aldrich | D6429-500ML | |
| Dulbecco's phosphate buffered saline (DPBS) | Fisher Scientific | 14190250 | No calcium, no magnesium |
| Fetal bovine serum (FBS), research grade | Wisent | 98150 | |
| LPS-EK | Invivogen | TLRL-EKLPS | Lipopolysaccharide from Escherichia coli K12 |
| NIH/3T3 fibroblasts | ATCC | CRL-1658 | |
| Pam3CSK4 | Invivogen | tlrl-pms | Synthetic triacylated lipopeptide - TLR1/2 ligand |
| Penicillin/streptomycin | Sigma Aldrich | P4333-100ML | |
| Plasmocin | Invivogen | ANT-MPP | Mycoplasma elimination reagent |
| RAW-Blue cells | Invivogen | raw-sp | NF-κB/AP-1 reporter macrophage cell line |
| Trypan blue solution, 0.4% | Fisher Scientific | 15250061 | |
| TrypLE express enzyme (1X) | Fisher Scientific | 12604021 | animal origin-free recombinant cell dissociation enzyme |
| Zeocin | Invivogen | ANT-ZN-1 | |
| Kits and assays | |||
| ELISA precoated plates, mouse IL-6 | Biolegend | B213022 | |
| ELISA precoated plates, mouse TNF-α | Biolegend | B220233 | |
| Endotoxin (Escherichia coli) - Control standard endotoxin (CSE) | Associates of Cape Cope Inc. | E0005-5 | Endotoxin for standard curve in chromogenic endotoxin assay |
| LAL water, 100 mL | Associates of Cape Cope Inc. | WP1001 | Used with chromogenic endotoxin assay |
| Micro BCA protein assay | Fisher Scientific | PI23235 | |
| Limulus amebocyte lysate (LAL) Pyrochrome endotoxin test kit | Associates of Cape Cope Inc. | C1500-5 | Chromogenic endotoxin assay reagent |
| QUANTI-Blue alkaline phosphatase detection medium | Invivogen | rep-qb2 | Alkaline phosphatase assay to indirectly measure NF-κB/AP-1 activity |
| Polymeric coating reagents | |||
| Chloroform, anhydrous | Sigma Aldrich | 288306-1L | |
| Ethyl alcohol anhydrous | Commercial Alcohols | P006EAAN | Sigma: Reagent alcohol, anhydrous, 676829-1L |
| Straight tapered fine tip forceps | Fisher Scientific | 16-100-113 | |
| Fluorinert FC-40 solvent | Sigma Aldrich | F9755-100ML | Fluorinated solvent for fPTFE |
| Cell culture grade water (endotoxin-free) | Fisher Scientific | SH30529LS | |
| Poly(methyl methacrylate) (PMMA) | Sigma Aldrich | 182230-25G | |
| Sylgard 184 elastomer kit | Fisher Scientific | 50822180 | |
| Teflon-AF (fPTFE) | Sigma Aldrich | 469610-1G | Poly[4,5-difluoro-2,2-bis(trifluoromethyl)-1,3-dioxole-co-tetrafluoroethylene] |
| Consumables | |||
| Adhesive plate seals | Fisher Scientific | AB-0580 | |
| Axygen microtubes, 1.5 mL | Fisher Scientific | 14-222-155 | |
| Borosilicate glass scintillation vials, with white polypropylene caps | Fisher Scientific | 03-337-4 | |
| Clear PS 48-well plate | Fisher Scientific | 08-772-52 | |
| Clear TCPS 96-well plate | Fisher Scientific | 08-772-2C | |
| Clear TCPS 48-well plate | Fisher Scientific | 08-772-1C | |
| Cover glasses, circles | Fisher Scientific | 12-545-81 | |
| Falcon tissue culture treated flasks, T25 | Fisher Scientific | 10-126-10 | |
| sticky-Slide 8 Well | Ibidi | 80828 | |
| Superfrost microscope slides | Fisher Scientific | 12-550-15 | |
| Tissue culture treated flasks, T150 | Fisher Scientific | 08-772-48 |
Ссылки
- Anderson, J. M., Rodriguez, A., Chang, D. T. Foreign body reaction to biomaterials. Seminars in Immunology. 20 (2), 86-100 (2008).
- Anderson, J. M., Miller, K. M. Biomaterial biocompatibility and the macrophage. Biomaterials. 5 (1), 5-10 (1984).
- Collier, T. O., Anderson, J. M. Protein and surface effects on monocyte and macrophage adhesion, maturation, and survival. Journal of Biomedical Materials Research. 60 (3), 487-496 (2002).
- Bianchi, M. E. DAMPs, PAMPs and alarmins: all we need to know about danger. Journal of Leukocyte Biology. 81 (1), 1-5 (2007).
- McKiel, L. A., Fitzpatrick, L. E. Toll-like Receptor 2-Dependent NF-κB/AP-1 Activation by Damage-Associated Molecular Patterns Adsorbed on Polymeric Surfaces. ACS Biomaterials Science & Engineering. 4 (11), 3792-3801 (2018).
- Babensee, J. E. Interaction of dendritic cells with biomaterials. Seminars in Immunology. 20 (2), 101-108 (2008).
- Sintes, J., Romero, X., de Salort, J., Terhorst, C., Engel, P. Mouse CD84 is a pan-leukocyte cell-surface molecule that modulates LPS-induced cytokine secretion by macrophages. Journal of Leukocyte Biology. 88 (4), 687-697 (2010).
- Tom, J. K., Mancini, R. J., Esser-Kahn, A. P. Covalent modification of cell surfaces with TLR agonists improves and directs immune stimulation. Chemical Communications. 49 (83), 9618-9620 (2013).
- Abdulkhalek, S., et al. Neu1 sialidase and matrix metalloproteinase-9 cross-talk is essential for toll-like receptor activation and cellular signaling. Journal of Biological Chemistry. 286 (42), 36532-36549 (2011).
- Gorbet, M. B., Sefton, M. V. Endotoxin: The uninvited guest. Biomaterials. 26 (34), 6811-6817 (2005).
- Xing, Z., Pabst, M. J., Hasty, K. A., Smith, R. A. Accumulation of LPS by polyethylene particles decreases bone attachment to implants. Journal of Orthopaedic Research. 24 (5), 959-966 (2006).
- Ding, H., et al. Comparison of the cytotoxic and inflammatory responses of titanium particles with different methods for endotoxin removal in RAW264.7 macrophages. Journal of Materials Science: Materials in Medicine. 23 (4), 1055-1062 (2012).
- Hoogenboom, R., Becer, C. R., Guerrero-Sanchez, C., Hoeppener, S., Schubert, U. S. Solubility and thermoresponsiveness of PMMA in alcohol-water solvent mixtures. Australian Journal of Chemistry. 63 (8), 1173-1178 (2010).
- Efimenko, K., Wallace, W. E., Genzer, J. Surface modification of Sylgard-184 poly(dimethyl siloxane) networks by ultraviolet and ultraviolet/ozone treatment. Journal of Colloid and Interface Science. 254 (2), 306-315 (2002).
- Godek, M. L., Sampson, J. A., Duchsherer, N. L., McElwee, Q., Grainger, D. W. Rho GTPase protein expression and activation in murine monocytes/macrophages is not modulated by model biomaterial surfaces in serum-containing in vitro cultures. Journal of Biomaterials Science. Polymer Edition. 17 (10), 1141-1158 (2006).
- Park, J. S., et al. Involvement of Toll-like Receptors 2 and 4 in Cellular Activation by High Mobility Group Box 1 Protein. Journal of Biological Chemistry. 279 (9), 7370-7377 (2004).
- Ohashi, K., Burkart, V., Flohé, S., Kolb, H. Cutting Edge: Heat Shock Protein 60 Is a Putative Endogenous Ligand of the Toll-Like Receptor-4 Complex. The Journal of Immunology. 164 (2), 558-561 (2000).
- Wong, T., McGrath, J. A., Navsaria, H. The role of fibroblasts in tissue engineering and regeneration. British Journal of Dermatology. 156 (6), 1149-1155 (2007).
- van Wachem, P. B., et al. The influence of protein adsorption on interactions of cultured human endothelial cells with polymers. Journal of Biomedical Materials Research. 21 (6), 701-718 (1987).
- Miller, K. M., Anderson, J. M. Human monocyte/macrophage activation and interleukin 1 generation by biomedical polymers. Journal of Biomedical Materials Research. 22 (8), 713-731 (1988).
- Bonfield, T. L., Colton, E., Anderson, J. M. Plasma protein adsorbed biomedical polymers: Activation of human monocytes and induction of interleukin 1. Journal of Biomedical Materials Research. 23 (6), 535-548 (1989).
- González, O., Smith, R. L., Goodman, S. B. Effect of size, concentration, surface area, and volume of polymethylmethacrylate particles on human macrophages in vitro. Journal of Biomedical Materials Research. 30 (4), 463-473 (1996).
- Anderson, J. M., et al. Protein adsorption and macrophage activation on polydimethylsiloxane and silicone rubber. Journal of Biomaterials Science. Polymer Edition. 7 (2), 159-169 (1995).
- Lord, M. S., Foss, M., Besenbacher, F. Influence of nanoscale surface topography on protein adsorption and cellular response. Nano Today. 5 (1), 66-78 (2010).
- Chen, S., et al. Characterization of topographical effects on macrophage behavior in a foreign body response model. Biomaterials. 31 (13), 3479-3491 (2010).
- Shen, M., Horbett, T. A. The effects of surface chemistry and adsorbed proteins on monocyte/macrophage adhesion to chemically modified polystyrene surfaces. Journal of Biomedical Materials Research. 57 (3), 336-345 (2001).
- Love, R. J., Jones, K. S. The recognition of biomaterials: Pattern recognition of medical polymers and their adsorbed biomolecules. Journal of Biomedical Materials Research Part A. 101 (9), 2740-2752 (2013).
- McNally, A. K., Anderson, J. M. Phenotypic expression in human monocyte-derived interleukin-4-induced foreign body giant cells and macrophages in vitro: Dependence on material surface properties. Journal of Biomedical Materials Research Part A. 103 (4), 1380-1390 (2015).
- Gambhir, V., et al. The TLR2 agonists lipoteichoic acid and Pam3CSK4 induce greater pro-inflammatory responses than inactivated Mycobacterium butyricum. Cellular Immunology. 280 (1), 101-107 (2012).
- Suzuki, O., Yagishita, H., Yamazaki, M., Aoba, T. Adsorption of Bovine Serum Albumin onto Octacalcium Phosphate and its Hydrolyzates. Cells and Materials. 5 (1), 45-54 (1995).
- Johnston, R. L., Spalton, D. J., Hussain, A., Marshall, J. In vitro protein adsorption to 2 intraocular lens materials. Journal of Cataract and Refractive Surgery. 25 (8), 1109-1115 (1999).
- Jin, J., Jiang, W., Yin, J., Ji, X., Stagnaro, P. Plasma proteins adsorption mechanism on polyethylene-grafted poly(ethylene glycol) surface by quartz crystal microbalance with dissipation. Langmuir. 29 (22), 6624-6633 (2013).
- Swartzlander, M. D., et al. Linking the foreign body response and protein adsorption to PEG-based hydrogels using proteomics. Biomaterials. 41, 26-36 (2015).
- Chamberlain, M. D., et al. Unbiased phosphoproteomic method identifies the initial effects of a methacrylic acid copolymer on macrophages. Proceedings of the National Academy of Sciences. 112 (34), 10673-10678 (2015).
- Dillman, W. J., Miller, I. F. On the adsorption of serum proteins on polymer membrane surfaces. Journal of Colloid And Interface Science. 44 (2), 221-241 (1973).
- Ishihara, K., Ziats, N. P., Tierney, B. P., Nakabayashi, N., Anderson, J. M. Protein adsorption from human plasma is reduced on phospholipid polymers. Journal of Biomedical Materials Research. 25 (11), 1397-1407 (1991).
- Warkentin, P., Wälivaara, B., Lundström, I., Tengvall, P. Differential surface binding of albumin, immunoglobulin G and fibrinogen. Biomaterials. 15 (10), 786-795 (1994).
- Berghaus, L. J., et al. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comparative Immunology, Microbiology and Infectious Diseases. 33 (5), 443-454 (2010).
- Zhang, Y., Karki, R., Igwe, O. J. Toll-like receptor 4 signaling: A common pathway for interactions between prooxidants and extracellular disulfide high mobility group box 1 (HMGB1) protein-coupled activation. Biochemical Pharmacology. 98 (1), 132-143 (2015).
- Mizel, S. B., Honko, A. N., Moors, M. A., Smith, P. S., West, A. P. Induction of macrophage nitric oxide production by Gram-negative flagellin involves signaling via heteromeric Toll-like receptor 5/Toll-like receptor 4 complexes. Journal of Immunology. 170 (12), 6217-6223 (2003).
- Das, N., et al. HMGB1 Activates Proinflammatory Signaling via TLR5 Leading to Allodynia. Cell Reports. 17 (4), 1128-1140 (2016).
- Pelegrin, P., Barroso-Gutierrez, C., Surprenant, A. P2X7 Receptor Differentially Couples to Distinct Release Pathways for IL-1β in Mouse Macrophage. The Journal of Immunology. 180 (11), 7147-7157 (2008).
- Tak, P. P., Firestein, G. S. NF-κB: A key role in inflammatory diseases. Journal of Clinical Investigation. 107 (1), 7-11 (2001).
- Ashkenazi, A., Dixit, V. M. Death receptors: signaling and modulation. Science. 281 (5381), 1305-1308 (1998).
- Erridge, C. Endogenous ligands of TLR2 and TLR4: agonists or assistants. Journal of Leukocyte Biology. 87 (6), 989-999 (2010).
- Feng, Y., et al. A macrophage-activating, injectable hydrogel to sequester endogenous growth factors for in situ angiogenesis. Biomaterials. 134, 128-142 (2017).
- Lonez, C., et al. Cationic lipid nanocarriers activate Toll-like receptor 2 and NLRP3 inflammasome pathways. Nanomedicine: Nanotechnology, Biology, and Medicine. 10 (4), 775-782 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены