Method Article
Um ensaio celular do repórter do macrófago para examinar a sinalização nf-kB/AP-1 mediada pelo receptor em macrófagos em camadas de proteína adsorbed em superfícies poliméricas
Neste Artigo
Resumo
Este protocolo fornece aos pesquisadores um método rápido e indireto de medição de atividade de fator de transcrição NF-кB/AP-1 dependente de TLR em uma linha de células de macrófagos de urina em resposta a uma variedade de superfícies poliméricas e camadas de proteína adsorbed que modelam o microambiente de implante biomaterial.
Resumo
A resposta inflamatória persistente do hospedeiro a um biomaterial implantado, conhecido como reação do corpo estranho, é um desafio significativo no desenvolvimento e implementação de dispositivos biomédicos e construções de engenharia de tecidos. Macrófagos, uma célula imune inata, são os principais intervenientes na reação do corpo estranho, porque eles permanecem no local do implante para a vida do dispositivo, e são comumente estudados para obter uma compreensão desta resposta hospedeira prejudicial. Muitos pesquisadores de biomateriais mostraram que as camadas de proteína adsorbed em materiais implantados influenciam o comportamento do macrófago e, posteriormente, impactam a resposta do hospedeiro. Os métodos deste artigo descrevem um modelo in vitro usando camadas de proteína adsorbed contendo moléculas de danos celulares em superfícies biomateriais de polímeros para avaliar as respostas de macrófagos. Um ensaio celular de macrófago de repórter NF-кB/AP-1 e o ensaio colorimmmétrico de fosfatase colorimétrica foram usados como um método rápido para examinar indiretamente a atividade do fator de transcrição NF-кB/AP-1 em resposta a camadas complexas de proteína adsorense contendo proteínas do sangue e padrões moleculares associados a danos, como um modelo das complexas camadas de proteína adsorbed formadas em superfícies biomateriais in vivo.
Introdução
A reação do corpo estranho (FBR) é uma resposta crônica do hospedeiro que pode impactar negativamente o desempenho de um material ou dispositivo implantado (por exemplo, dispositivos de entrega de medicamentos, biossensores), através da liberação persistente de mediadores inflamatórios e impedindo a integração entre o material implantado e o tecido circundante1. Esta resposta imune inata é iniciada pelo procedimento de implantação e é caracterizada pela presença a longo prazo de células imunes inatas e formação de cápsulas fibrosas em torno do implante1. No contexto das respostas materiais do hospedeiro, as interações macrofago-material têm um impacto significativo na progressão da resposta e desenvolvimento do hospedeiro de um FBR1. Macrófagos são uma população de células imunes inatas diversas, recrutadas para o local do implante, seja a partir de populações de macrófagos residentes em tecidos ou do sangue como macrófagos derivados de monócito. Eles começam a se acumular no local do implante logo após a implantação, e dentro de dias se tornam a população celular predominante no microambiente de implante. Macrófagos adeptos de materiais, juntamente com células gigantes de corpo estranho (FBGC) formadas através da fusão de macrófagos, podem persistir na superfície material para a vida útil do implante2,3. Consequentemente, os macrófagos são considerados atores-chave na resposta do corpo estranho devido a seus papéis orquestrando os passos característicos do FBR: resposta inflamatória aguda, remodelação do tecido e formação do tecido fibrótico1.
Receptores semelhantes a pedágios (TLRs) são uma família de receptores de reconhecimento de padrões que são expressos por muitas células imunes, incluindo macrófagos, e têm sido mostrados para desempenhar um papel significativo na inflamação e cicatrização de feridas. Além de ligantes derivados de patógenos, As TLRs são capazes de ligar moléculas endógenas, conhecidas como padrões moleculares associados a danos (DAMPs), que são liberados durante a necrose celular e ativam vias de sinalização inflamatória, resultando na produção de citocinas proinflamatórias4. Nós e outros propusemos que os danos causados durante os procedimentos de implantação de biomateriais de tecidos moles liberam DAMPs, que então adsorb para superfícies biomateriais, além de proteínas do sangue e modulam interações celulares subsequentes5,6. Quando os macrófagos interagem com a camada de proteína adsorbed em um implante, seus TLRs de superfície podem reconhecer DAMPs adsorbed e ativar cascatas de sinalização do proInflammatory, conduzindo à ativação e à produção do fator da transcrição nF-κB e do AP-1 de citocinas. Nós mostramos previamente que os macrófagos do murine aumentaram significativamente a atividade nf-κB/AP-1 e o fator α da necrose do tumor (TNF-α, secreção de citocina proinflamatória) em resposta às camadas de proteína adsorbed contendo DAMP em uma variedade de superfícies poliméricas em comparação com superfícies apenas com soro ou plasma adsorbed (ou seja, nenhum DAMPs presente), e que esta resposta é amplamente mediada pelo TLR2, enquanto o TLR4 desempenha um papel menor5.
A linha celular de macrófagos nf-κB/AP-1 repórter(Tabela de Materiais)utilizada neste protocolo é um método conveniente para medir a atividade relativa nf-κb e AP-1 em macrófagos5,7,8. Em combinação com inibidores da via TLR, esta linha celular é uma ferramenta útil para investigar a ativação do TLR e seu papel na inflamação em resposta a uma variedade de estímulos5,7,8. As células repórter são uma linha de células modificada semelhante a macrófago de camundongos que pode produzir facadamente a fosfatase alcalina embrionária secretada (SEAP) sobre a ativação do fator de transcrição NF-κB e AP-19. O ensaio colorimmmático de fósforo alcalino enzimático(Tabela de Materiais)pode então ser usado para quantificar quantidades relativas de expressão SEAP como uma medida indireta da atividade NF-κB/AP-1. Como NF-κB e AP-1 estão a jusante de muitas vias de sinalização celular, neutralizar anticorpos e inibidores visando TLRs específicos (por exemplo, TLR2) ou moléculas de adaptador TLR (por exemplo, MyD88) podem ser usadas para verificar o papel de uma via específica. A metodologia descrita neste artigo fornece uma abordagem simples e rápida para avaliar a contribuição da sinalização tlr em respostas de macrófagos de urina para uma variedade de superfícies poliméricas com camadas de proteína adsorbed contendo proteínas do sangue e DAMPs como um modelo in vitro de biomateriais implantados.
Protocolo
1. Preparação de mídia e reagente
- Prepare a mídia de fibroblasto. Combine 450 mL do meio modificado eagle (DMEM) de Dulbecco, 50 mL de soro bovino fetal (FBS) e 5 mL de penicilina/estreptomicina. Guarde a 4°C por até 3 meses.
- Prepare a mídia de crescimento de macrófagos de repórter em alíquotas de 50 mL. Combine 45 mL de DMEM, 5 mL de FBS, 5 μg/mL reagente de eliminação mycoplasma(Tabela de Materiais),e 200 μg/mL phleomycin D1 (Tabela de Materiais). Guarde a 4°C por até 3 meses.
- Prepare a mídia de talofagem de macrófagos de repórter em alíquotas de 50 mL. Combine 45 mL de DMEM, 5 mL de calor inativado FBS (HI-FBS), 5 μg/mL reagente de eliminação mycoplasma e 200 μg/mL phleomycin D1. Guarde a 4°C por até 3 meses.
2. Superfícies da cultura da pilha de revestimento com poli (methacrylate do methyl)
- Dissolva poli (metilme metacrilato) (PMMA) em clorofórmio a 20 mg/mL (por exemplo, 100 mg de PMMA em 5 mL de clorofórmio) em um frasco de cintilação de vidro de 20 mL. Coloque uma barra de agitação magnética no frasco e deixe mexer por pelo menos 2 h, até que todos os sólidos sejam dissolvidos.
CUIDADO: Clorofórmio é prejudicial se inalado. Certifique-se de usar solvente em um capô de fumaça enquanto estiver usando luvas PVA. - Pipette 400 μL da solução PMMA no centro de um microscópio de vidro borosilicato desliza em um coater de rotação, e gire a 3000 rpm por 2 min. Prepare o número de slides necessários para o ensaio, bem como 3-5 extra para medição de ângulo de contato com a água. Armazenar slides em uma caixa limpa (pulverizado e limpo com 70% de etanol) para uso futuro.
Nota: O revestimento da rotação é usado frequentemente para depositar um revestimento fino, uniforme em uma superfície lisa. Um coater da rotação gira um substrato em altas velocidades, usando a força centrífuga para espalhar a solução de revestimento sobre a superfície.- Medir o ângulo de contato de água em duas posições aleatórias na superfície de slides revestidos extras (ou seja, não os slides que estão sendo usados para a cultura celular) com um goniômetro para garantir que a superfície de vidro fosse completamente revestida com o polímero.
Nota: Somente a água da pureza a mais elevada (por exemplo, vidro destilado triplo) deve ser usada para medidas do ângulo do contato da água.
- Medir o ângulo de contato de água em duas posições aleatórias na superfície de slides revestidos extras (ou seja, não os slides que estão sendo usados para a cultura celular) com um goniômetro para garantir que a superfície de vidro fosse completamente revestida com o polímero.
- Em um armário de segurança biológica (BSC) anexar 8 câmaras de poços pegajosos para PMMA revestido-slides usando fórceps estéreis e seguindo a técnica asséptica. Pressione firmemente na parte superior dos poços pegajosos para certificar-se que são unidos fortemente. Incubar os slides com poços pegajosos anexados a 37 °C durante a noite para proteger o selo.
- Teste o selo dos poços pegajosos adicionando 200 μL de água de nível de cultura celular (livre de endotoxina) a cada poço. Incubar à temperatura ambiente (RT) por 60 min e garantir nenhum vazamento antes de prosseguir. Assaa a água, tomando cuidado para não perturbar o revestimento PMMA.
- Executar lavhes de água livre de endotoxina, adicionando 300 μL de água livre de endotoxina para cada poço e incubação por 1 h (três vezes), 12 h e 24 h antes de usar para remover qualquer solvente restante.
- Teste a concentração de endotoxinas dos slides para ser usado para a cultura celular. Incubar 200 μL de água reagente livre de endotoxina(Mesa de Materiais)em um poço de cada slide para 1 h. Medir a concentração de endotoxina no extrato usando um ensaio de endotoxina cromogênica de ponto final (Tabela de Materiais).
Nota: O protocolo a seguir é específico para o kit de ensaio de endotoxina listado na Tabela de Materiais. - Use apenas água e consumíveis (ou seja, pontas de pipetas, tubos de microcentrífuga e placas de poço) que são certificados sem pirógeno (ou seja, livre de endotoxina) para este trabalho. Além disso, qualquer vidro usado na preparação das superfícies revestidas de polímero deve ser depyrogenated usando esterilização de calor seco (250 °C para 30 minutos) antes de usar10. Medir a endotoxina na solução do extrato, como descrito aqui, pode conduzir a uma subestimação da endotoxina na superfície material11,12. Consequentemente, recomenda-se que, ao desenvolver um protocolo de revestimento de polímero, realize a reação do ensaio de endotoxina (ou seja, passos 2,5,4-2,5,6 para amostras de teste [água reagente] ou controles de pico) diretamente dentro de poços contendo a amostra revestida para garantir que nenhuma fonte de endotoxina seja inadvertidamente introduzida no sistema durante o processo de revestimento.
- Traga todas as amostras de teste (ou seja, extratos) e reagentes de ensaio de endotoxina para RT. Reconstituir reagente cromogênico no buffer de ensaios e padrão de endotoxina em água reagente, permitir dissolver por 5 min e girar suavemente antes de usar. Cubra todas as garrafas com filme de parafina quando não estiver em uso.
- Crie uma curva de diluição padrão de 5 a 8 pontos do padrão de endotoxina que varia do limite inferior ao superior do ensaio, realizando uma diluição serial do padrão de endotoxina na água reagente.
- Para controlar o aprimoramento ou inibição do ensaio de endotoxina em amostras de teste, prepare um controle positivo (também chamado de controle de pico ou amostra cravada) diluindo uma quantidade conhecida de endotoxina na solução de amostra de teste não utilizada.
Nota: A concentração do controle positivo deve ser a mesma concentração que um padrão no meio da curva padrão. Se a quantidade recuperada do pico de endotoxina (ou seja, a concentração do controle positivo menos a concentração da amostra de teste não cravado) está dentro de 50-200% da concentração nominal do pico de endotoxina, a solução de extração pode ser considerada não interferir significativamente com o ensaio. - Adicione 50 μL de padrões, amostras ou controles de pico para cada poço de uma placa de 96 poços em duplicata ou triplicado. Use a água do reagente como um controle negativo.
- Adicione 50 μL de reagente cromogênico a cada poço. Adicione reagente rapidamente a todos os poços. Use um tempora para registrar a quantidade de tempo que leva para adicionar reagente a todos os poços. Cubra a placa com um selo adesivo e incubada a 37 °C (o tempo de incubação é dependente de lote e indicado no Certificado de Análise incluído no kit de reagente cromogênico). Alternativamente, verifique a placa a cada 15 min durante a incubação até que a mudança de cor seja observada em todos os poços padrão.
- Após a incubação, adicione 25 μL de 50% de ácido acético a cada poço (concentração final de 10% de ácido acético por poço) para parar a reação. Adicione o ácido acético na mesma ordem que o reagente cromogênico foi adicionado. Leia a absorção da placa usando um leitor de placa em 405 nm. Aspirar líquido e descartar placa.
Nota: A adição de ácido acético deve levar o mesmo período de tempo para adicionar a cada poço como o reagente cromogênico levou (± 30 s).
- Ultravioleta (UV) esterilizar os slides para 30 minutos antes de experimentos de cultura celular.
3. Superfícies da cultura da pilha de revestimento com polydimethylsiloxane
- Misture o polidimetilsiloxano (PDMS) elastômero em uma relação de peso 10:1 (base:agente de cura). Em um armário de segurança biológica, pipeta de aproximadamente 10 mL de base polidimitilsiloxano em um tubo estéril. Pese o tubo e adicione lentamente o agente de cura até que 10% seja adicionado.
CUIDADO: Use reagentes PDMS em uma área bem ventilada e evitar o contato visual usando óculos de segurança. - Misture bem o elastômero mexendo com uma ponta de pipeta sorológica e por pipetting cima e para baixo. Adicione aproximadamente 200 μL da solução a cada poço de uma placa de 48 poços. Incline a placa do poço lentamente para assegurar a cobertura completa dos poços com solução do elastômero.
- Coloque a placa de poço com elastômero em um forno a vácuo fixado em 50 cmHg, 40 °C. Retire a tampa e cubra com uma limpeza única dobra para evitar que outros detritos caiam nos poços. Deixe incubar por pelo menos 48 h.
- Confirme que os poços estão completamente revestidos por inspeção visual. Certifique-se de que o elastômero é totalmente curado por cutucar suavemente com uma ponta de pipeta estéril antes de remover.
- Adicione 300 μL de 70% de etanol (feito com etanol absoluto e água livre de endotoxina) e incubada na RT por 1 h. Retire o etanol e execute laves de água livres de endotoxina adicionando 300 μL de água livre de endotoxina a cada poço e incubando por 1 h (três vezes), 12 h , e 24 h antes de usar para remover qualquer solvente restante.
- Incubar 200 μL de água livre de endotoxina em três poços de cada placa para 1 h. Medir a concentração de endotoxina dos extratos de água usando um ensaio de endotoxina cromogênica de ponto final (passos 2,5,1-2,5,6).
4. Superfícies da cultura da pilha de revestimento com poli fluorado (tetrafluoroetileno)
- Faça uma solução de 1 mg/mL de poli fluorado (tetrafluoroetileno) (fPTFE) (por exemplo, adicione 10 mg de fPTFE a 10 mL de solvente fluorado [Tabela de Materiais])em um frasco de cintilação de vidro de 20 mL. Coloque uma barra de agitação magnética no frasco e deixe mexer por pelo menos 24 h, até que todos os sólidos sejam dissolvidos.
- Adicione aproximadamente 150 μL da solução do polímero a cada poço de uma placa do poliestireno 48-poço (isto é, não cultura do tecido tratada). Incline a placa do poço lentamente para assegurar a cobertura completa de todos os poços com solução do polímero. Substitua a tampa.
- Para garantir o revestimento eficaz de poços fPTFE, os lábios de vidro devem ser revestidos em fPTFE e usados para medição do ângulo de contato com a água (passo 4.3.1). Coloque os lábios de cobertura dentro dos poços de uma placa de 24 poços. Adicione aproximadamente 400 μL da solução do polímero a cada poço que contem um coverslip. Empurre os lábios para baixo usando fórceps estéreis, garantindo que eles estão completamente cobertos de solução de polímero, e cubra a placa de poço com uma tampa.
- Coloque a placa de poço com solução de polímero e/ ou coverslips em um forno a vácuo fixado em 50 cmHg, 40 °C. Retire a tampa e cubra com uma limpeza única dobra para evitar que outros detritos caiam nos poços. Deixe incubar por pelo menos 48 h.
- Medir o ângulo de contato de água de cobres revestidos de fPTFE com um goniômetro para garantir revestimento eficaz.
Nota: Somente a água da pureza a mais elevada (por exemplo, vidro destilado triplo) deve ser usada para medidas do ângulo do contato da água.
- Medir o ângulo de contato de água de cobres revestidos de fPTFE com um goniômetro para garantir revestimento eficaz.
- Adicione 300 μL de 70% de etanol (feito com etanol absoluto e água livre de endotoxina) e incubada na RT por 1 h. Retire o etanol e execute laves de água livres de endotoxina adicionando 300 μL de água livre de endotoxina a cada poço e incubando por 1 h (três vezes), 12 h , e 24 h antes de usar para remover qualquer solvente restante.
- Incubar 200 μL de água livre de endotoxina em três poços de cada placa para 1 h. Medir a concentração de endotoxina de extratos de água usando um ensaio de endotoxina cromogênica de ponto final (passos 2,5,1-2,5,6).
- UV esterilizar as placas de poço para 30 minutos antes de experimentos de cultura celular.
5. Fazendo lysate a partir de células 3T3
- Crescer células 3T3 em vários frascos T150 para 70% de confluência. Para separar as células, aspirate mídia, lavar a superfície com 5 mL de PBS, e aspirar PBS. Adicione 5 mL de enzima de dissociação de células recombinantes e sem origem animal(Tabela de Materiais)e incubada a 37 °C por 3 a 5 min.
- Desaque as células inclinando suavemente o frasco para frente e para trás. Adicione 5 mL de PBS para neutralizar a enzima recombinante usada para dissociação celular. Transfira as células destacadas dos frascos em um tubo de centrífuga e misture através de pipetting. Executar uma contagem de células vivas usando um hemocytometer e tinuosidade de viabilidade celular.
Nota: Uma enzima de dissociação celular que pode ser neutralizada através da diluição na PBS foi selecionada para evitar a introdução de proteínas à base de soro na preparação de lisato. Se a trippsina é usada para dissociar as células, ela deve ser neutralizada com uma solução contendo soro, e uma lavagem pbs adicional deve ser realizada para reduzir a quantidade de proteínas séricatransportadas para a preparação de lisato. - Centrífugas as células a 200 x g por 5 min. Aspirar as células supernatant e resuspender em volume original (ou seja, 10 mL x número de frascos) de PBS para lavar qualquer mídia restante. Repetir.
- Centrífugaas as células novamente a 200 x g por 5 min e aspiram o supernatant. Adicione o volume de PBS necessário para alcançar uma concentração final de células de 1 x 106 células/mL. Coloque a solução celular em um freezer -80 °C até que a amostra esteja totalmente congelada (pelo menos 2 h).
- Descongele a solução celular em um banho de água de 37 °C. Uma vez completamente descongelado, coloque a solução de volta para o congelador -80 °C até totalmente congelado. Repita para um total de 3 ciclos de congelamento-degelo.
- Realize um micro ácido bicinchoninic (BCA) ensaio no lysate da pilha em uma variedade de diluições (por exemplo, 1/100, 1/200, 1/500, 1/1000) para determinar a concentração da proteína. Diluir o lisato celular a uma concentração de proteína de 468,75 μg/mL, alíquota e armazenar a -80 °C para uso futuro.
Nota: A concentração final de proteína em uma placa de 48 poços é de 125 μg/cm2 (com base na área de superfície de um poço, 0,75 cm2). - Realize uma mancha ocidental para avaliar a presença de DAMPs em lisato (por exemplo, proteína de choque térmico 60 [HSP60], caixa de grupo de alta mobilidade 1 [HMGB1]) carregando 40-60 μg de proteína de lisato no buffer de carga em um gel de poliacrilamida de 1,5 mm de espessura e siga a mancha ocidental padrão e siga a mancha ocidental padrão Procedimentos.
6. Avaliando o efeito das camadas de proteína adsorbed e receptores semelhantes a pedágio na atividade nf-κb de macrófagos
Nota: Para um esquema do fluxo de trabalho experimental e do layout da placa, consulte a Figura 1A e a Figura Suplementar 1,respectivamente.
- Crescer macrófagos repórter em um frasco de tamanho adequado para 70% de confluência. Mídia aspirate, lavar a superfície com PBS, e pirata PBS. Adicione a enzima de dissociação celular recombinante e incubar a 37 °C por 8 min.
- Separar as células batendo firmemente os lados do frasco. Inativar a enzima de dissociação de células recombinante, adicionando um volume igual de mídia de crescimento (contendo 10% FBS). Executar uma contagem de células vivas usando um hemocytometer e tinuosidade de viabilidade celular.
Nota: A viabilidade esperada para os macrófagos do repórter que seguem uma incubação de 8 min na enzima da dissociação da pilha é 90%. - Células centrífugas a 200 x g por 5 min. Aspirate supernatant e resuspender no volume original de PBS para lavar as células. Centrífuga novamente e resuspender as células em 7,3 x 105 células / mL em meios de ensaio (contendo calor inativado FBS).
- Suspensão celular separada em 3 tubos diferentes: inibidor de TLR4, anti-TLR2 e não tratada. Incubate células com 1 μg/mL Inibidor TLR4 para 60 min em RT ou com 50 μg/mL anti-TLR2 por 30 min na RT.
- Adicione 200 μL de lysate, 10% FBS, 10% de plasma comercial do rato(Tabela de Materiais), ou uma mistura das soluções proteicas a uma placa de 48 poços (ou equivalente) e permita que a proteína adsorb a 37 °C para a quantidade desejada de tempo (ou seja, 30 min, 60 min, ou 24 h). Soluções de proteína Aspirate de poços, usando uma pipeta Pasteur fresca para cada solução de proteína, e lavasuperfícies com 250 μL de PBS por 5 min. Aspirate PBS. Repita para um total de 3 laves.
Nota: Esta etapa pode precisar de ser começada mais cedo no protocolo dependendo do tempo desejado do adsorption. Ajuste o protocolo em conformidade. - Após o período de incubação com o inibidor tlr4 ou anti-TLR2, células pipetas para resuspender. Adicione 200 μL de solução celular para cada poço.
- Para a condição de controle positivo tlr2, adicione Pam3CSK4 a uma concentração final de 150 ng/mL. Para a condição de controle positivo TLR4, adicione o lipopolissacarídeo (LPS) a uma concentração final de 1,5 μg/mL. Incubar células a 37 °C por 20 h.
- Experimente 20 μL de supernatant de cada poço e placa em duplicata em uma placa de 96 poços. Inclua três poços de 20 μL ensaio mídia como um controle de fundo. Adicione 200 μL de repórter SEAP ensaio reagente para cada poço. Cubra a placa com um selo adesivo e incubar por 2,5 h a 37 °C.
Nota: O tempo de incubação pode variar dependendo das condições experimentais, e deve ser otimizado para uma forte diferença na absorção entre poços de controle positivos e negativos.- Transfira o restante do supernatant a um tubo de 1.5 mL (por o poço). Centrífuga a 1.000 x g por 10 min para pelota quaisquer detritos. Transfira o supernatant a um tubo novo de 1.5 mL e armazene -80 °C. Analise o supernatant para a presença de citocinas proinflamatórias (por exemplo, TNF-α, interleucina 6) através de ensaio imunosorvente ligado a enzimas (ELISA).
- Retire o selo da placa adesiva. Leia a absorção da placa usando um leitor de placa em 635 nm. Aspirar líquido e descartar placa.
Resultados
Os métodos de limpeza para as superfícies revestidas de polímero foram testados para garantir que não houvesse interrupção do revestimento, o que seria visto como uma mudança no ângulo de contato com a água para um coverslip de vidro não revestido (Figura 2). Foram encontrados slides de microscópio revestidos de PMMA em 70% de etanol por 1 h para remover o revestimento PMMA(Figura 2,painel esquerdo), provavelmente devido à solubilidade do PMMA em 80 wt% de etanol13,portanto, superfícies revestidas de PMMA foram limpas usando 30 min de esterilização UV sozinho. A concentração de PMMA para revestimento foi otimizada anteriormente5. Um 1 h 70% de etanol embeber foi usado para limpar PDMS, e a esterilização UV foi negligenciada, uma vez que a luz UV pode causar produção em cadeia e influenciar as propriedades de molhar a superfície do PDMS14. Tanto a imersão de etanol de 70% quanto a esterilização UV não influenciaram o ângulo de contato com a água dos lábios revestidos de fPTFE(Figura 2,painel direito), portanto, os dois métodos, em sucessão, foram utilizados para limpar revestimentos fPTFE. O método de revestimento fPTFE foi previamente descrito pelo grupo Grainger15.
Uma mancha ocidental foi realizada no lysate 3T3 para garantir que as espécies DAMP estivessem presentes na complexa mistura molecular. Os resultados mostraram que tanto o HMGB1 quanto o HSP60, dois DAMPs16,17,bem documentados, estavam presentes no lysate(Figura 1B). A adsorção de ligands TLR do lisato para as superfícies de polímero foi confirmada por cultivar macrófagos repórter (não tratadas, TLR2 neutralizado, ou TLR4 inibido) por 20 h em superfícies de polímero protein-adsorbed (ou seja, poliestireno tratado pela cultura do tecido [TCPS], PMMA, PDMS, fPTFE), e, em seguida, avaliando indiretamente a atividade NF-кB/AP-1 com base na produção do SEAP usando uma figura de ensaio enzimática (Ce Figura 3). Além disso, os macrófagos repórter tinha aumentado significativamente NF-кB/ AP-1 atividade em lysate adsorbed em comparação com FBS adsorbed ou plasma e nenhuma proteína pré-adsorbed (mídia) (Figura 4). TLR ligands lipopeptide triacylated sintético (Pam3CSK4, Ligand TLR2) e lipopolissaccharide (LPS, ligand TLR4) foram incluídos como controles positivos para confirmar o anticorpo ou inibidor e o ensaio estava funcionando corretamente. A neutralização tlr2 teve uma redução visivelmente mais forte na resposta nf-кB/AP-1 de macrófagos de repórter supõelysato em comparação com a inibição do TLR4. Além disso, pequenas quantidades de lysato diluído em soro (com base na proteína total) induzida significativamente aumentou NF-кB/ AP-1 resposta em comparação com o soro sozinho, com a menor diluição eficaz dependente da superfície do polímero (Figura 5). Estes resultados demonstram a potência das moléculas adsorbed lysate-derivadas em induzir a atividade NF-кB/AP-1 TLR-dependente em macrófagos do repórter em uma variedade de superfícies poliméricas.
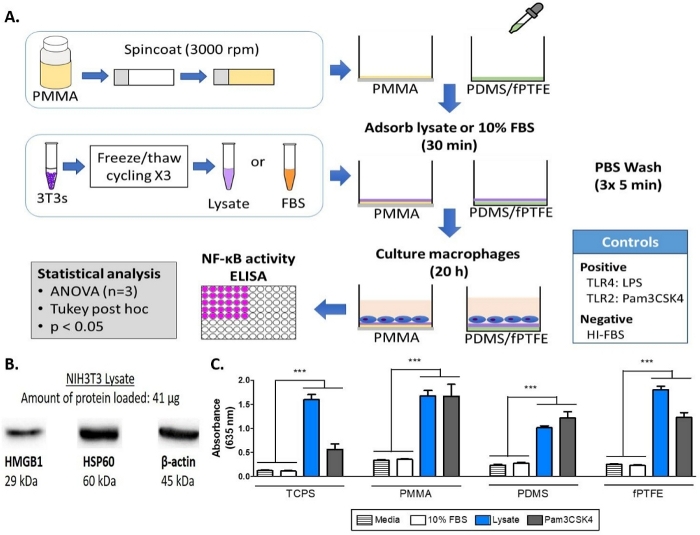
Figura 1: Métodos e resultados para o ensaio alcalino de fosfatase de macrófagos repórter NF-кB/AP-1 no TCPS, PMMA, PDMS e fPTFE. (A)Diagrama do fluxo de trabalho para o ensaio de phosphatase alcalino do macrofago do repórter. (B) Mancha ocidental de lysate confirmando a presença de espécies DAMP HMGB1 e HSP60, com β-actin como o controle de carga. (C) NF-кB/AP-1 atividade (representada pela absorção) de macrófagos repórter cultivada na mídia (controle negativo), 10% FBS, lysate, e Pam3CSK4 (ligand TLR2, controle positivo) para 20 h. Dados mostra os resultados de um experimento e é representativo dos resultados de pelo menos 2 experimentos separados, mostradocomo média ± desvio padrão (SD). Cada experimento usou n = 3 poços separados por condição, e cada poço foi banhado em duplicado para o ensaio enzimático. Analisado usando teste pós-hoc de Ida E Tukey. p < 0,001. Esta figura foi adaptada com permissão de McKiel e Fitzpatrick5. Direitos autorais 2018 American Chemical Society. Clique aqui para ver uma versão maior deste número.

Figura 3: Atividade NF-кB/AP-1 mediada por TLR (representada pela absorção) de macrófagos de repórter cultivadas em 10% FBS (controle), lysate e controle positivo por 20 h. (A)Influência da neutralização TLR2 nas respostas de macrófagos de repórters ao lysate adsorbed. O controle positivo é Pam (Pam3CSK4, ligand TLR2). (B) Influência da inibição tlr4 na resposta de macrófago repórter para adsorbed lysate. O controle positivo é LPS (ligand TLR4). Os dados mostram os resultados de um experimento e são representativos dos resultados de pelo menos 2 experimentos separados, mostrados como média ± SD. Cada experimento usou n = 3 poços separados por condição, e cada poço foi banhado em duplicado para o ensaio enzimático. Analisado usando teste pós-hoc de Ida E Tukey. ** p < 0,01, *** p < 0,001. Esta figura foi adaptada com permissão de McKiel e Fitzpatrick5. Direitos autorais 2018 American Chemical Society. Clique aqui para ver uma versão maior deste número.
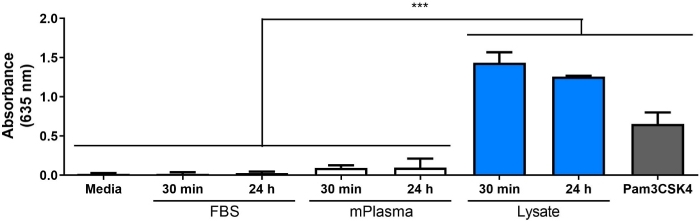
Figura 4: NF-кB/AP-1 atividade (representada pela absorção) de macrófagos repórter cultivada na mídia (controle negativo), 30 min e 24 h adsorbed camadas de proteína, e Pam3CSK4 (controle positivo) no TCPS por 20 h. Os dados são combinados de 3 experimentos separados e mostrados como média ± SD. Cada experimento usou n = 3 poços separados por condição, e cada poço foi banhado em duplicado para o ensaio enzimático (ou seja, n = 9 poços de cultura celular não independentes e n = 18 poços de ensaio enzimáticos não independentes). Analisado usando teste pós-hoc de Ida E Tukey. p < 0,001. Clique aqui para ver uma versão maior deste número.

Figura 5: Repórter macrófago NF-кB/AP-1 atividade (representada pela absorção) após 20 h em resposta a diluições de lysate em FBS (proteína total = 280 μg/bem) adsorbed para superfícies de polímero por 30 min. (A)TCPS. (B)PMMA. PDMs. (D)fPTFE. Os dados mostram os resultados de um experimento e são representativos dos resultados de pelo menos 2 experimentos separados, mostrados como média ± SD. Cada experimento usou n = 3 poços separados por condição, e cada poço foi banhado em duplicado para o ensaio enzimático. Analisado usando teste pós-hoc de Ida E Tukey. * p < 0,05, ** p < 0,01, *** p < 0,001. Esta figura foi adaptada com permissão de McKiel e Fitzpatrick5. Direitos autorais 2018 American Chemical Society. Clique aqui para ver uma versão maior deste número.

Figura suplementar 1: Exemplo de layouts usados para o ensaio de cultura de macrofagagem de repórter NF-кB/AP-1 em formatos de placa de 8 câmaras e 48 poços. Clique aqui para ver uma versão maior deste número.
Discussão
Um foco principal do nosso laboratório é a resposta do hospedeiro a implantes sólidos de tecidos moles biomateriais e, em particular, como os danos celulares sofridos durante o procedimento de implantação afetam a resposta do hospedeiro. O trabalho apresentado aqui descreve experimentos preliminares usando uma linha de células de macrófago repórter e lysate celular contendo DAMP in vitro, para investigar a influência das moléculas liberadas durante danos celulares (ou seja, da cirurgia de implante) nas respostas de macrófagos aos biomateriais. O lysato celular fibroblasto foi usado para modelar os danos celulares e a liberação de DAMPs devido à colocação de biomateriais. Fibroblastos foram escolhidos para criar o lysato por causa da prevalência de fibroblastos no tecido mole, bem como a sua capacidade de secretar uma variedade de proteínas de matriz extracelular (ECM), incluindo fibronectina18. O ciclo de congelamento-degelo foi escolhido como método de lise para produzir DAMPs intracelulares e derivados de ECM, semelhante ao que estaria presente no ambiente de implante. Inibidores da protease não foram usados para fazer este lysate. Embora a lise celular descontrolada, como o ciclo de congelamento e degelo, possa resultar na liberação de proteases que podem degradar os DAMPs, essas enzimas também provavelmente estariam presentes no ambiente de implante biomaterial quando as células são danificadas durante o procedimento de implantação. A presença de DAMPs na complexa mistura molecular do liceu foi confirmada pela mancha ocidental (Figura 1B; HmGB1 e HSP60) e seap repórter ensaio (Figura 1C; NF-кB/AP-1 atividade em resposta ao lysate adsorbed). Também realizamos ensaios onde o lisato foi diluído em FBS com base na concentração total de proteínas e adsorbed em superfícies de cultura celular (Figura 5) para refletir melhor a complexidade do ambiente de implante, uma vez que irá conter uma abundância de proteínas do sangue, bem como DAMPs6. Repórter macrofago NF-кB/AP-1 atividade permaneceu significativamente aumentada em camadas adsorbed de lysate diluído em FBS, ea menor diluição para alcançar a ativação significativa foi dependente da superfície, variando de 0,1% (TCPS) a 10% (PDMS e fPTFE).
Os polímeros PMMA, PDMS e PTFE foram escolhidos para este trabalho por não serem degradáveis e têm sido amplamente utilizados na literatura para avaliar a adsorção de proteínas e a resposta de macrófagos aos biomateriais19,20,21,22,23,24,25. O TCPS também foi utilizado para comparação, uma vez que é um substrato comum utilizado para macrofago in vitro e trabalho de sinalização TLR21,26,27,28. Os materiais utilizados em nosso trabalho são exemplos representativos de biomateriais sólidos não degradáveis. No entanto, muitos outros materiais poderiam ser usados com este modelo, desde que o material possa ser revestido em placas de cultura celular ou slides de microscópio e devidamente descontaminado. A linha de células de macrófago do repórter NF-κB/AP-1 foi selecionada para esse modelo in vitro porque permite a medição rápida e indireta da atividade NF-κB/AP-1 através da expressão indutível NF-κB/AP-1 da SEAP. Os macrófagos do repórter NF-κB/AP-1 exigem o uso de phleomicina D1 na mídia cultural como antibiótico seletivo para garantir que apenas células com o gene SEAP indutor NF-кB/AP-1 estejam presentes29. Para o ensaio de fósforo alcalino, é fundamental usar HI-FBS na mídia de cultura celular para evitar potenciais resultados falsos positivos gerados pelas fosfatases alcalinas presentes no soro. Nossa pesquisa até o momento sugere que as superfícies adsorbed FBS não geram um resultado falso positivo detectável, provavelmente porque as moléculas de soro são fortemente adsorbed para a superfície da cultura e não são liberados para o supernatant. O ponto de tempo de cultura para os macrofrófagos repórter (20 h), ensaio ponto de incubação (2,5 h), e absorvente leitura comprimento de onda (635 nm) para o ensaio de fósforo alcalino foram otimizados com este sistema para garantir medições robustas e reprodutíveis para todas as condições.
Um ponto de tempo de adsorção de proteína inicial de 30 min foi escolhido para este trabalho devido ao seu uso comum na literatura de adsorção de proteínas (Figura 1C)30,31,32,33,34. No entanto, também exploramos tempos de adsorção mais longos (ou seja, 60 min e 24 h, Figura 4) para melhor representar a camada de proteína adsorbed que macrófagos interagiriam com in vivo, que provavelmente ocorrerá 4-24 h após a implantação1. Foi postulado que a maioria dos adsorption proteína e troca ocorre nos primeiros 60 min de exposição a uma superfície26,35,36, portanto, um tempo de adsorção de 60 min pode ser um ponto de tempo mais relevante. Também passamos do uso da FBS como controle negativo para a presença de DAMPs na camada de proteína adsorbed para plasma comercial do mouse. A justificativa para o uso de plasma em vez de soro é que as proteínas plasmáticas são conhecidas por desempenhar papéis significativos na adsorção de proteínas e resposta de macrófagos1,e que o plasma fornece uma melhor representação das proteínas no ambiente de feridas. O plasma utilizado em experimentos de adsorção de proteínas é comumente preparado como uma diluição de 1 a 10%26,36,37,o que motivou nosso uso de plasma de 10%. O plasma humano é comumente usado26,36,pois é mais fácil de obter em grandes quantidades e mais relevante clinicamente, em comparação com o plasma do rato. No entanto, optamos por usar plasma de camundongo comercial para neste modelo para manter as espécies das soluções proteicas consistentes com as das células repórter.
O uso da linha celular de macrófagos repórter introduziu algumas limitações dentro do estudo. Primeiro, o uso de uma linha de células de macrófago leukemic murine tem limitações inerentes, como o fenótipo e comportamento podem variar de culturas de macrófagos primários. Embora essa limitação seja abordada em trabalhos futuros usando macrófagos primários, a linha celular de macrófagos parentais foi mostrada para imitar de perto macrófagos derivados de medula óssea do rato em termos de seus receptores de superfície celular e resposta a ligantes microbianos para TLRs 2, 3 e 438. Além disso, os macrófagos repórter NF-κB/AP-1 produziram resultados semelhantes em resposta à estimulação HMGB1 e LPS quando comparados aos macrófagos primários de urina peritoneal39. Note-se que o NF-κB/AP-1 repórter macrófagos, e sua tensão parental, não expressam TLR540. Os pesquisadores demonstraram que hmgb1 foi capaz de ativar nf-κb transcription fatores através do TLR5 sinalização vias em hek-293 células etalitadamente transfected com humano TLR541. Portanto, a contribuição da sinalização hmgb1-tlr5 para a atividade geral nf-κb em superfícies revestidas de lysate foi negligenciada neste modelo. Além disso, os macrófagos repórter e sua cepa parental não expressam a proteína adaptador ASC e, conseqüentemente, não formam a maioria dos tipos de inflammasomes e não podem processar IL-1β inativo ou IL-18 inativo para suas formas maduras42. Portanto, o modelo que usamos não leva em conta a contribuição da atividade inflammasome dependente do ASC e da subsequente sinalização autocrina IL-1β e IL-18 em respostas de macrófagos a superfícies adsorençadas por lisato. Consequentemente, este ensaio destina-se como um exame preliminar da ativação NF-κB dependente da TLR, e pesquisas subsequentes usando macrófagos primários são recomendadas para fornecer uma compreensão mais completa e representativa da ativação de macrófagos e fenótipo em superfícies materiais de interesse.
O ensaio de fósforo alcalino mede indiretamente a atividade NF-кB/AP-1 dos macrófagos do repórter. No entanto, existem muitas vias de sinalização que não tlrs que envolvem NF-кB/AP-1 (por exemplo, interleucina-1 receptor [IL-1R]43 e receptor de fator de necrose tumoral [TNFR]44). Portanto, foi necessário avaliar a contribuição da sinalização TLR2 e TLR4 no aumento da resposta NF-кB/AP-1 às superfícies adsorbed de lysate usando ensaios de inibição (Figura 3). A justificativa para a seleção desses dois TLRs de superfície foi que pelo menos 23 DAMPs que foram mostrados para sinalizar através de TLR2 e TLR445, incluindo o HMGB1 bem caracterizado, e ambos os receptores são expressos na superfície celular e podem interagir diretamente com a superfície biomaterial6. Os ensaios de inibição TLR2 e TLR4 demonstraram que, quando a sinalização TLR2 ou TLR4 foram bloqueadas, a resposta nf-кB/AP-1 dos macrófagos de repórter para o lysate adsorbed foi reduzida, indicando que ambas as vias estão envolvidas. No entanto, houve uma redução visivelmente maior na atividade NF-кB/AP-1 quando a sinalização TLR2 foi neutralizada, sugerindo que o TLR2 pode desempenhar um papel primordial na resposta de macrófagos de repórters ao lysate adsorbed. Reconhecemos que pode haver alguma inibição fora do alvo com a via de sinalização TLR neutralizando anticorpos e inibidores. Um anticorpo neutralizante foi usado para inibir a via TLR2, uma vez que não havia moléculas inibidoras de TLR2 comercialmente disponíveis no momento deste trabalho.
Os métodos apresentados aqui usam o lysate, como uma fonte complexa de DAMPs, e macrófagos do repórter nf-κB/AP-1 como um modelo in vitro para respostas do macrófago aos DAMPs e às outras proteínas adsorbed aos biomateriais poliméricos(figura 1). Prevemos que nosso protocolo pode ser usado para analisar rapidamente as respostas NF-κB/AP-1 e sinalização TLR a montante de macrófagos de repórter para uma variedade de materiais (incluindo materiais degradáveis, andaimes porosos ou hidrogéis) e camadas de proteína adsorbed (Figura 3). No entanto, o uso de materiais porosos e hidrogéis introduzirá complexidade dentro do sistema, pois pode ser um desafio distinguir entre moléculas adsorbed e moléculas armadilhadas. Prevemos também que este protocolo pode ser facilmente adaptado para investigar a contribuição de outras vias de sinalização a montante de NF-кB/AP-1 (por exemplo, receptores de lectina do tipo C46 e o domínio de oligomerização de ligação ao nucleotídeo (NOD) como receptores47) com os inibidores apropriados. Além disso, a resposta NF-κB/AP-1 dos macrófagos de repórters poderia ser comparada entre diferentes materiais, desde que as respostas sejam normalizadas à atividade celular de base (ou seja, células em mídia em cada superfície sem proteína pré-adsorbed) e todos os materiais têm níveis de endotoxina indetectáveis.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores reconhecem com gratidão o financiamento operacional do Canadian Institutes of Health Research Project (PTJ 162251), do Queen's University Senate Advisory Research Committee e do apoio à infraestrutura do Canadian Foundation for Innovation John Evan's Leadership Fund (Project 34137) e do Ministry of Research and Innovation Ontario Research Fund (Project 34137). L.A.M. foi apoiada por um Queen's University R. Samuel McLaughlin Fellowship, um Natural Sciences and Engineering Research Council of Canada Canadian Graduate Scholarship Master's Award e uma Bolsa de Pós-Graduação de Ontário. Os autores gostariam de agradecer ao Dr. Myron Szewczuk por seu generoso dom da linha de células de macfagagem repórter NF-κB/AP-1 e drs. Michael Blennerhassett e Sandra Lourenssen pelo uso de seu sistema de imagem gel e leitor de placas.
Materiais
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| anti-mouse/human CD282 (TLR2) | Biolegend | 121802 | |
| CLI-095 (TLR4 inhibitor) | Invivogen | TLRL-CLI95 | |
| C57 complement plasma K2 EDTA 10ml, innovative grade US origin | InnovativeResearch | IGMSC57-K2 EDTA-Compl-10ml | Mouse plasma |
| Dulbecco's modified eagle medium (DMEM) | Sigma Aldrich | D6429-500ML | |
| Dulbecco's phosphate buffered saline (DPBS) | Fisher Scientific | 14190250 | No calcium, no magnesium |
| Fetal bovine serum (FBS), research grade | Wisent | 98150 | |
| LPS-EK | Invivogen | TLRL-EKLPS | Lipopolysaccharide from Escherichia coli K12 |
| NIH/3T3 fibroblasts | ATCC | CRL-1658 | |
| Pam3CSK4 | Invivogen | tlrl-pms | Synthetic triacylated lipopeptide - TLR1/2 ligand |
| Penicillin/streptomycin | Sigma Aldrich | P4333-100ML | |
| Plasmocin | Invivogen | ANT-MPP | Mycoplasma elimination reagent |
| RAW-Blue cells | Invivogen | raw-sp | NF-κB/AP-1 reporter macrophage cell line |
| Trypan blue solution, 0.4% | Fisher Scientific | 15250061 | |
| TrypLE express enzyme (1X) | Fisher Scientific | 12604021 | animal origin-free recombinant cell dissociation enzyme |
| Zeocin | Invivogen | ANT-ZN-1 | |
| Kits and assays | |||
| ELISA precoated plates, mouse IL-6 | Biolegend | B213022 | |
| ELISA precoated plates, mouse TNF-α | Biolegend | B220233 | |
| Endotoxin (Escherichia coli) - Control standard endotoxin (CSE) | Associates of Cape Cope Inc. | E0005-5 | Endotoxin for standard curve in chromogenic endotoxin assay |
| LAL water, 100 mL | Associates of Cape Cope Inc. | WP1001 | Used with chromogenic endotoxin assay |
| Micro BCA protein assay | Fisher Scientific | PI23235 | |
| Limulus amebocyte lysate (LAL) Pyrochrome endotoxin test kit | Associates of Cape Cope Inc. | C1500-5 | Chromogenic endotoxin assay reagent |
| QUANTI-Blue alkaline phosphatase detection medium | Invivogen | rep-qb2 | Alkaline phosphatase assay to indirectly measure NF-κB/AP-1 activity |
| Polymeric coating reagents | |||
| Chloroform, anhydrous | Sigma Aldrich | 288306-1L | |
| Ethyl alcohol anhydrous | Commercial Alcohols | P006EAAN | Sigma: Reagent alcohol, anhydrous, 676829-1L |
| Straight tapered fine tip forceps | Fisher Scientific | 16-100-113 | |
| Fluorinert FC-40 solvent | Sigma Aldrich | F9755-100ML | Fluorinated solvent for fPTFE |
| Cell culture grade water (endotoxin-free) | Fisher Scientific | SH30529LS | |
| Poly(methyl methacrylate) (PMMA) | Sigma Aldrich | 182230-25G | |
| Sylgard 184 elastomer kit | Fisher Scientific | 50822180 | |
| Teflon-AF (fPTFE) | Sigma Aldrich | 469610-1G | Poly[4,5-difluoro-2,2-bis(trifluoromethyl)-1,3-dioxole-co-tetrafluoroethylene] |
| Consumables | |||
| Adhesive plate seals | Fisher Scientific | AB-0580 | |
| Axygen microtubes, 1.5 mL | Fisher Scientific | 14-222-155 | |
| Borosilicate glass scintillation vials, with white polypropylene caps | Fisher Scientific | 03-337-4 | |
| Clear PS 48-well plate | Fisher Scientific | 08-772-52 | |
| Clear TCPS 96-well plate | Fisher Scientific | 08-772-2C | |
| Clear TCPS 48-well plate | Fisher Scientific | 08-772-1C | |
| Cover glasses, circles | Fisher Scientific | 12-545-81 | |
| Falcon tissue culture treated flasks, T25 | Fisher Scientific | 10-126-10 | |
| sticky-Slide 8 Well | Ibidi | 80828 | |
| Superfrost microscope slides | Fisher Scientific | 12-550-15 | |
| Tissue culture treated flasks, T150 | Fisher Scientific | 08-772-48 |
Referências
- Anderson, J. M., Rodriguez, A., Chang, D. T. Foreign body reaction to biomaterials. Seminars in Immunology. 20 (2), 86-100 (2008).
- Anderson, J. M., Miller, K. M. Biomaterial biocompatibility and the macrophage. Biomaterials. 5 (1), 5-10 (1984).
- Collier, T. O., Anderson, J. M. Protein and surface effects on monocyte and macrophage adhesion, maturation, and survival. Journal of Biomedical Materials Research. 60 (3), 487-496 (2002).
- Bianchi, M. E. DAMPs, PAMPs and alarmins: all we need to know about danger. Journal of Leukocyte Biology. 81 (1), 1-5 (2007).
- McKiel, L. A., Fitzpatrick, L. E. Toll-like Receptor 2-Dependent NF-κB/AP-1 Activation by Damage-Associated Molecular Patterns Adsorbed on Polymeric Surfaces. ACS Biomaterials Science & Engineering. 4 (11), 3792-3801 (2018).
- Babensee, J. E. Interaction of dendritic cells with biomaterials. Seminars in Immunology. 20 (2), 101-108 (2008).
- Sintes, J., Romero, X., de Salort, J., Terhorst, C., Engel, P. Mouse CD84 is a pan-leukocyte cell-surface molecule that modulates LPS-induced cytokine secretion by macrophages. Journal of Leukocyte Biology. 88 (4), 687-697 (2010).
- Tom, J. K., Mancini, R. J., Esser-Kahn, A. P. Covalent modification of cell surfaces with TLR agonists improves and directs immune stimulation. Chemical Communications. 49 (83), 9618-9620 (2013).
- Abdulkhalek, S., et al. Neu1 sialidase and matrix metalloproteinase-9 cross-talk is essential for toll-like receptor activation and cellular signaling. Journal of Biological Chemistry. 286 (42), 36532-36549 (2011).
- Gorbet, M. B., Sefton, M. V. Endotoxin: The uninvited guest. Biomaterials. 26 (34), 6811-6817 (2005).
- Xing, Z., Pabst, M. J., Hasty, K. A., Smith, R. A. Accumulation of LPS by polyethylene particles decreases bone attachment to implants. Journal of Orthopaedic Research. 24 (5), 959-966 (2006).
- Ding, H., et al. Comparison of the cytotoxic and inflammatory responses of titanium particles with different methods for endotoxin removal in RAW264.7 macrophages. Journal of Materials Science: Materials in Medicine. 23 (4), 1055-1062 (2012).
- Hoogenboom, R., Becer, C. R., Guerrero-Sanchez, C., Hoeppener, S., Schubert, U. S. Solubility and thermoresponsiveness of PMMA in alcohol-water solvent mixtures. Australian Journal of Chemistry. 63 (8), 1173-1178 (2010).
- Efimenko, K., Wallace, W. E., Genzer, J. Surface modification of Sylgard-184 poly(dimethyl siloxane) networks by ultraviolet and ultraviolet/ozone treatment. Journal of Colloid and Interface Science. 254 (2), 306-315 (2002).
- Godek, M. L., Sampson, J. A., Duchsherer, N. L., McElwee, Q., Grainger, D. W. Rho GTPase protein expression and activation in murine monocytes/macrophages is not modulated by model biomaterial surfaces in serum-containing in vitro cultures. Journal of Biomaterials Science. Polymer Edition. 17 (10), 1141-1158 (2006).
- Park, J. S., et al. Involvement of Toll-like Receptors 2 and 4 in Cellular Activation by High Mobility Group Box 1 Protein. Journal of Biological Chemistry. 279 (9), 7370-7377 (2004).
- Ohashi, K., Burkart, V., Flohé, S., Kolb, H. Cutting Edge: Heat Shock Protein 60 Is a Putative Endogenous Ligand of the Toll-Like Receptor-4 Complex. The Journal of Immunology. 164 (2), 558-561 (2000).
- Wong, T., McGrath, J. A., Navsaria, H. The role of fibroblasts in tissue engineering and regeneration. British Journal of Dermatology. 156 (6), 1149-1155 (2007).
- van Wachem, P. B., et al. The influence of protein adsorption on interactions of cultured human endothelial cells with polymers. Journal of Biomedical Materials Research. 21 (6), 701-718 (1987).
- Miller, K. M., Anderson, J. M. Human monocyte/macrophage activation and interleukin 1 generation by biomedical polymers. Journal of Biomedical Materials Research. 22 (8), 713-731 (1988).
- Bonfield, T. L., Colton, E., Anderson, J. M. Plasma protein adsorbed biomedical polymers: Activation of human monocytes and induction of interleukin 1. Journal of Biomedical Materials Research. 23 (6), 535-548 (1989).
- González, O., Smith, R. L., Goodman, S. B. Effect of size, concentration, surface area, and volume of polymethylmethacrylate particles on human macrophages in vitro. Journal of Biomedical Materials Research. 30 (4), 463-473 (1996).
- Anderson, J. M., et al. Protein adsorption and macrophage activation on polydimethylsiloxane and silicone rubber. Journal of Biomaterials Science. Polymer Edition. 7 (2), 159-169 (1995).
- Lord, M. S., Foss, M., Besenbacher, F. Influence of nanoscale surface topography on protein adsorption and cellular response. Nano Today. 5 (1), 66-78 (2010).
- Chen, S., et al. Characterization of topographical effects on macrophage behavior in a foreign body response model. Biomaterials. 31 (13), 3479-3491 (2010).
- Shen, M., Horbett, T. A. The effects of surface chemistry and adsorbed proteins on monocyte/macrophage adhesion to chemically modified polystyrene surfaces. Journal of Biomedical Materials Research. 57 (3), 336-345 (2001).
- Love, R. J., Jones, K. S. The recognition of biomaterials: Pattern recognition of medical polymers and their adsorbed biomolecules. Journal of Biomedical Materials Research Part A. 101 (9), 2740-2752 (2013).
- McNally, A. K., Anderson, J. M. Phenotypic expression in human monocyte-derived interleukin-4-induced foreign body giant cells and macrophages in vitro: Dependence on material surface properties. Journal of Biomedical Materials Research Part A. 103 (4), 1380-1390 (2015).
- Gambhir, V., et al. The TLR2 agonists lipoteichoic acid and Pam3CSK4 induce greater pro-inflammatory responses than inactivated Mycobacterium butyricum. Cellular Immunology. 280 (1), 101-107 (2012).
- Suzuki, O., Yagishita, H., Yamazaki, M., Aoba, T. Adsorption of Bovine Serum Albumin onto Octacalcium Phosphate and its Hydrolyzates. Cells and Materials. 5 (1), 45-54 (1995).
- Johnston, R. L., Spalton, D. J., Hussain, A., Marshall, J. In vitro protein adsorption to 2 intraocular lens materials. Journal of Cataract and Refractive Surgery. 25 (8), 1109-1115 (1999).
- Jin, J., Jiang, W., Yin, J., Ji, X., Stagnaro, P. Plasma proteins adsorption mechanism on polyethylene-grafted poly(ethylene glycol) surface by quartz crystal microbalance with dissipation. Langmuir. 29 (22), 6624-6633 (2013).
- Swartzlander, M. D., et al. Linking the foreign body response and protein adsorption to PEG-based hydrogels using proteomics. Biomaterials. 41, 26-36 (2015).
- Chamberlain, M. D., et al. Unbiased phosphoproteomic method identifies the initial effects of a methacrylic acid copolymer on macrophages. Proceedings of the National Academy of Sciences. 112 (34), 10673-10678 (2015).
- Dillman, W. J., Miller, I. F. On the adsorption of serum proteins on polymer membrane surfaces. Journal of Colloid And Interface Science. 44 (2), 221-241 (1973).
- Ishihara, K., Ziats, N. P., Tierney, B. P., Nakabayashi, N., Anderson, J. M. Protein adsorption from human plasma is reduced on phospholipid polymers. Journal of Biomedical Materials Research. 25 (11), 1397-1407 (1991).
- Warkentin, P., Wälivaara, B., Lundström, I., Tengvall, P. Differential surface binding of albumin, immunoglobulin G and fibrinogen. Biomaterials. 15 (10), 786-795 (1994).
- Berghaus, L. J., et al. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comparative Immunology, Microbiology and Infectious Diseases. 33 (5), 443-454 (2010).
- Zhang, Y., Karki, R., Igwe, O. J. Toll-like receptor 4 signaling: A common pathway for interactions between prooxidants and extracellular disulfide high mobility group box 1 (HMGB1) protein-coupled activation. Biochemical Pharmacology. 98 (1), 132-143 (2015).
- Mizel, S. B., Honko, A. N., Moors, M. A., Smith, P. S., West, A. P. Induction of macrophage nitric oxide production by Gram-negative flagellin involves signaling via heteromeric Toll-like receptor 5/Toll-like receptor 4 complexes. Journal of Immunology. 170 (12), 6217-6223 (2003).
- Das, N., et al. HMGB1 Activates Proinflammatory Signaling via TLR5 Leading to Allodynia. Cell Reports. 17 (4), 1128-1140 (2016).
- Pelegrin, P., Barroso-Gutierrez, C., Surprenant, A. P2X7 Receptor Differentially Couples to Distinct Release Pathways for IL-1β in Mouse Macrophage. The Journal of Immunology. 180 (11), 7147-7157 (2008).
- Tak, P. P., Firestein, G. S. NF-κB: A key role in inflammatory diseases. Journal of Clinical Investigation. 107 (1), 7-11 (2001).
- Ashkenazi, A., Dixit, V. M. Death receptors: signaling and modulation. Science. 281 (5381), 1305-1308 (1998).
- Erridge, C. Endogenous ligands of TLR2 and TLR4: agonists or assistants. Journal of Leukocyte Biology. 87 (6), 989-999 (2010).
- Feng, Y., et al. A macrophage-activating, injectable hydrogel to sequester endogenous growth factors for in situ angiogenesis. Biomaterials. 134, 128-142 (2017).
- Lonez, C., et al. Cationic lipid nanocarriers activate Toll-like receptor 2 and NLRP3 inflammasome pathways. Nanomedicine: Nanotechnology, Biology, and Medicine. 10 (4), 775-782 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados