Method Article
Un analisi della cella del Macrophage Reporter per esaminare la segnalazione NF-kB/AP-1 mediata da un rata a tollo su superfici polimetiche
In questo articolo
Riepilogo
Questo protocollo fornisce ai ricercatori un metodo rapido e indiretto per misurare l'attività del fattore di trascrizione NF-B-B/AP-1 dipendente da TLR in una linea cellulare murina di macrofaci in risposta a una varietà di superfici polimeriche e strati proteici adzuolabili che modellano il microambiente implantare biomateriale.
Abstract
La persistente risposta infiammatoria all'uso di un biomateriale impiantato, noto come reazione del corpo estraneo, è una sfida significativa nello sviluppo e nell'implementazione di dispositivi biomedici e costrutti di ingegneria tissutale. I macrofagi, una cellula immunitaria innata, sono attori chiave nella reazione del corpo estraneo perché rimangono nel sito dell'impianto per tutta la durata del dispositivo e sono comunemente studiati per comprendere questa risposta dannosa dell'ospite. Molti ricercatori di biomateriali hanno dimostrato che gli strati proteici adsorbiti sui materiali impiantati influenzano il comportamento dei macrofafi e successivamente influenzano la risposta dell'ospite. I metodi di questo documento descrivono un modello in vitro utilizzando strati proteici adsorbiti contenenti molecole di danno cellulare su superfici biomateriali polimeriche per valutare le risposte dei macrofagi. Una linea cellulare di macrofasi reporter nF-B/AP-1 e l'addetto altest alcalino metrico sono stati utilizzati come metodo rapido per esaminare indirettamente l'attività del fattore di trascrizione NF-B/AP-1 in risposta a complessi strati proteici adsorbiti contenenti proteine ematiche e modelli molecolari associati ai danni, come modello dei complessi strati proteici adsorbenti formati sulle superfici biomateriali in vivo.
Introduzione
La reazione del corpo estraneo (FBR) è una risposta cronica dell'ospite che può influire negativamente sulle prestazioni di un materiale o dispositivo impiantato (ad esempio, dispositivi di somministrazione di farmaci, biosensori), attraverso il rilascio persistente di mediatori infiammatori e impedendo l'integrazione tra il materiale impiantato e il tessuto circostante1. Questa risposta immunitaria innata è iniziata dalla procedura di impianto ed è caratterizzata dalla presenza a lungo termine di cellule immunitarie innate e formazione di capsule fibrose intorno all'impianto1. Nel contesto delle risposte materiali dell'ospite, le interazioni macrofago-materiale hanno un impatto significativo sulla progressione della risposta dell'ospite e sullo sviluppo di un FBR1. I macrofagi sono una popolazione di cellule immunitarie innate diversificata, reclutate nel sito dell'impianto sia da popolazioni di macrofagi residenti in tessuto che dal sangue come macrofagi derivati da monociti. Iniziano ad accumularsi nel sito dell'impianto poco dopo l'impianto e in pochi giorni diventano la popolazione cellulare predominante nel microambiente dell'impianto. I macrofagi aderenti ai materiali, insieme alle cellule giganti del corpo estraneo (FBGC) formate attraverso la fusione dei macrofagi, possono persistere sulla superficie materiale per tutta la durata dell'impianto2,3. Di conseguenza, i macrofagi sono considerati attori chiave nella risposta del corpo estraneo a causa dei loro ruoli orchestrando i passi caratteristici della FBR: risposta infiammatoria acuta, rimodellamento dei tessuti e formazione del tessuto fibrotico1.
I recettori a pedaggio (TLR) sono una famiglia di recettori di riconoscimento dei pattern che sono espressi da molte cellule immunitarie, tra cui i macrofagi, e hanno dimostrato di svolgere un ruolo significativo nell'infiammazione e nella guarigione delle ferite. Oltre ai ligandi di derivazione patogena, i TLR sono in grado di legare molecole endogene, note come modelli molecolari associati a i danni (DAMP), che vengono rilasciate durante la necrosi cellulare e attivano vie di segnalazione infiammatoria con conseguente produzione di citochine infiammatorie4. Noi e altri abbiamo proposto che i danni subiti durante le procedure di impianto dei biomateriali dei tessuti molli rilasciano DAMP, che poi adsorbisce alle superfici biomateriali oltre alle proteine del sangue e modulano le successive interazioni cellula-materiale5,6. Quando i macrofagi interagiscono con lo strato proteico adsorbito su un impianto, i loro TLR di superficie possono riconoscere i DAMP adsorbiti e attivare le cascate di segnalazione infiammatorie, portando all'attivazione del fattore di trascrizione NF-B e AP-1 e alla produzione di citochine proinfiammatorie. In precedenza abbiamo dimostrato che i macrofagi murini hanno aumentato significativamente l'attività di NF-B/AP-1 e il fattore di necrosi tumorale citochina infiammatoria) secrezione in risposta agli strati proteici adsorbiti contenenti DAMP su una varietà di superfici polimeriche rispetto alle superfici con siero adsorbito o solo plasma (cioè, nessun DAMP presente), e che questa risposta è in gran parte mediata da TLR2, mentre TLR4 svolge un ruolo minore5.
La linea cellulare macrofagia del reporter NF-B/AP-1 (Tabella dei materiali) utilizzata in questo protocollo è un metodo conveniente per misurare l'attività relativa NF-B e AP-1 nei macrofagi5,7,8. In combinazione con gli inibitori della via TLR, questa linea cellulare è uno strumento utile per studiare l'attivazione della TLR e il suo ruolo nell'infiammazione in risposta a una varietà di stimoli5,7,8. Le cellule del reporter sono una linea cellulare modificata simile a un macrofago murino che può produrre stabilmente fosfosate alcalina embrionale (SEAP) su attivazione del fattore di trascrizione NF-B e AP-19. Il saggio di fosfofosate alcalina enzimatica colorimetrica (Tabella dei materiali) può quindi essere utilizzato per quantificare quantità relative di espressione SEAP come misura indiretta dell'attività NF-B/AP-1. Poiché le molecole di adattatore NF-B e AP-1 sono a valle di molte vie di segnalazione cellulare, è possibile neutralizzare anticorpi e inibitori mirati a TLR specifici (ad esempio, TLR2) o molecole di adattatore TLR (ad esempio MyD88) per verificare il ruolo di una via specifica. La metodologia descritta in questo articolo fornisce un approccio semplice e rapido per valutare il contributo della segnalazione TLR nelle risposte murine dei macrofafi a una varietà di superfici polimeriche con strati proteici adsorbiti contenenti sia proteine ematiche che DAMP come modello in vitro di biomateriali impiantati.
Protocollo
1. Preparazione dei supporti e dei reagenti
- Preparare i supporti fibroblasti. Unire 450 mL di Dulbecco's modified Eagle medium (DMEM), 50 mL di siero bovino fetale (FBS) e 5 mL di penicillina/streptomicina. Conservare a 4 gradi centigradi per un massimo di 3 mesi.
- Preparare i media di crescita del macrofago reporter in aliquote da 50 mL. Unire 45 mL di DMEM, 5 mL di FBS, 5 reagente di eliminazione del micoplasma/mL(Tabella dei materiali) e 200 fleomycin D1 (Tabella dei materiali). Conservare a 4 gradi centigradi per un massimo di 3 mesi.
- Preparare reporter macrophage saggio media in 50 mL aliquots. Unire 45 mL di DMEM, 5 mL di FBS inattivato dal calore (HI-FBS), 5 reagenti a eliminazione del micoplasma e 200 fleomycin D1. Conservare a 4 gradi centigradi per un massimo di 3 mesi.
2. Rivestimento colture cellulari con poli (methacritame metileto)
- Sciogliere il poli(methacritame metillare) (PMMA) in cloroformio a 20 mg/mL (ad esempio, 100 mg di PMMA in 5 mL di cloroformio) in una fiala di scintillazione di vetro da 20 mL. Mettere una barra magnetica di agitazione nella fiala e lasciare mescolare per almeno 2 h, fino a quando tutti i solidi sono sciolti.
ATTENZIONE: Il cloroformio è dannoso se inalato. Assicurarsi di utilizzare il solvente in un cappuccio fumi mentre si indossano guanti PVA. - Pipette 400 -L di PMMA al centro di un vescopio di vetro borosilicato in un rivestimento di spin, e girare a 3000 rpm per 2 min. Preparare il numero di vetrini necessari per il saggio, così come 3-5 extra per la misurazione dell'angolo di contatto con l'acqua. Conservare i vetrini in una scatola pulita (spruzzata e pulita con 70% di etanolo) per un uso futuro.
NOT: Il rivestimento a rotazione viene spesso utilizzato per depositare un rivestimento sottile e uniforme su una superficie piana. Un rivestimento di spin ruota un substrato ad alta velocità, utilizzando la forza centrifuga per diffondere la soluzione di rivestimento sulla superficie.- Misurare l'angolo di contatto dell'acqua in due posizioni casuali sulla superficie di vetrini rivestiti extra (cioè, non i vetrini utilizzati per la coltura cellulare) con un goniometro per garantire che la superficie del vetro fosse completamente rivestita con il polimero.
NOT: Solo l'acqua di altissima purezza (ad esempio, il triplo vetro distillato) deve essere utilizzata per le misurazioni dell'angolo di contatto con l'acqua.
- Misurare l'angolo di contatto dell'acqua in due posizioni casuali sulla superficie di vetrini rivestiti extra (cioè, non i vetrini utilizzati per la coltura cellulare) con un goniometro per garantire che la superficie del vetro fosse completamente rivestita con il polimero.
- In un armadietto di sicurezza biologica (BSC) fissare pozzi appiccicosi a 8 camere a vetrini rivestiti PMMA utilizzando pinze sterili e seguendo la tecnica austica. Premere saldamente sulla parte superiore dei pozze appiccicose per assicurarsi che siano fortemente attaccati. Incubare i vetrini con pozzi appiccicosi attaccati a 37 gradi durante la notte per fissare la guarnigioni.
- Testare il sigillo dei pozzi appiccicosi aggiungendo 200 l una l di acqua di grado di coltura cellulare (senza endotossina) ad ogni pozzo. Incubare a temperatura ambiente (RT) per 60 min e garantire nessuna perdita prima di procedere. Aspirare l'acqua, facendo attenzione a non disturbare il rivestimento PMMA.
- Eseguire i fusti d'acqua senza endotossina aggiungendo 300 l di acqua endotossina a ogni pozzo e incubando per 1 h (tre volte), 12 h e 24 h prima di essere utilizzato per rimuovere qualsiasi solvente rimanente.
- Testare la concentrazione di endotossina dei vetrini da utilizzare per la coltura cellulare. Incubare 200 -L di acqua reagente senza endotossina (Tabella dei materiali) in un pozzo di ogni diapositiva per 1 h. Misurare la concentrazione di endotossina nell'estratto utilizzando un'onda endotogena endotossina finale ( Tabella deimateriali).
NOT: Il seguente protocollo è specifico del kit di analisi dell'endotossina elencato nella Tabella dei Materiali. - Utilizzare solo acqua e materiali di consumo (ad esempio, punte di pipette, tubi di microcentrifuga e piastre di pozzi) certificati senza pirogeni (cioè privi di endotossina) per questo lavoro. Inoltre, qualsiasi vetro utilizzato nella preparazione delle superfici rivestite di polimeri deve essere depyrogenated utilizzando la sterilizzazione del calore secco (250 gradi centigradi per 30 min) prima di utilizzare10. Misurare l'endotossina nella soluzione di estratto, come descritto qui, può provocare una sottovalutazione dell'endotossina sulla superficie del materiale11,12. Di conseguenza, quando si sviluppa un protocollo di rivestimento polimerico, eseguire la reazione di analisi endotossina (cioè, i passaggi 2.5.4.5.5.6 per i campioni di prova [controlli di reagente acqua] o picco) direttamente all'interno di pozzi contenenti il campione rivestito per garantire che nessuna fonte di endotossina venga introdotta inavvertitamente nel sistema durante il processo di rivestimento.
- Portare tutti i campioni di prova (ad esempio, estratti) e i reagenti di analisi dell'endotossina in RT. Ricostituire il reagente cromogenico nel buffer di analisi e nello standard di endotossina nell'acqua di reagente, lasciare sciogliere per 5 min e vortice delicatamente prima dell'uso. Coprire tutte le bottiglie con pellicola di paraffina quando non è in uso.
- Creare una curva di diluizione standard da 5-8 punti dello standard di endotossina che va dal limite inferiore a quello superiore dell'aspetto eseguendo una diluizione seriale dello standard di endotossina nell'acqua reagente.
- Per controllare il miglioramento o l'inibizione del saggio di endotossina nei campioni di prova, preparare un controllo positivo (chiamato anche controllo del picco o campione a spillo) diluindo una quantità nota di endotossina nella soluzione campione di prova inutilizzata.
NOT: La concentrazione del controllo positivo dovrebbe essere la stessa concentrazione di una norma al centro della curva standard. Se la quantità recuperata del picco di endotossina (cioè la concentrazione del controllo positivo meno la concentrazione del campione di prova non sgualcito) è entro il 50-200% della concentrazione nominale del picco di endotossina, la soluzione di estrazione può essere considerata non interferire in modo significativo con il test. - Aggiungete 50 -L di standard, campioni o comandi di picco a ogni pozzetto di una piastra di 96 pozzetto o triplicare. Utilizzare l'acqua reagente come controllo negativo.
- Aggiungete 50 l di reagente cromogenico ad ogni pozzo. Aggiungere rapidamente il reagente a tutti i pozzi. Utilizzare un timer per registrare la quantità di tempo necessaria per aggiungere il reagente a tutti i pozzetti. Coprire la piastra con una guarnizione adesiva e incubare a 37 gradi centigradi (il tempo di incubazione è dipendente dal lotto e indicato sul Certificato di Analisi incluso nel kit di reagente cromogenico). In alternativa, controllare sulla piastra ogni 15 min durante l'incubazione fino a quando il cambiamento di colore è osservato in tutti i pozzi standard.
- Dopo l'incubazione, aggiungere 25 luna del 50% di acido acetico ad ogni pozzo (concentrazione finale di 10% di acido acetico per pozzo) per fermare la reazione. Aggiungere l'acido acetico nello stesso ordine in cui è stato aggiunto il reagente cromogenico. Leggere l'assorbimento della piastra utilizzando un lettore di lamiere a 405 nm. Liquido aspirato e piastra di scarto.
NOT: L'aggiunta di acido acetico dovrebbe richiedere lo stesso periodo di tempo per aggiungere ad ogni bene come il reagente cromogenico ha preso (30 s).
- L'ultravioletto (UV) sterilizza i vetrini per 30 minuti prima degli esperimenti di coltura cellulare.
3. Rivestimento colture cellulari con polidimetilsiloxane
- Mescolare l'elastomer ovulo polidimetilsixane (PDMS) in un rapporto di peso 10:1 (agente base:stagionatura). In un armadietto di sicurezza biologica, pipetta circa 10 mL di base polidimetilsiloxana in un tubo sterile. Pesare il tubo e aggiungere lentamente l'agente di polimerità fino a quando non è stato aggiunto il 10%.
ATTENZIONE: Utilizzare i reagenti PDMS in un'area ben ventilata ed evitare il contatto visivo indossando occhiali di sicurezza. - Mescolare accuratamente l'elastomermescolando con una punta di pipetta sierologica sterile e pipettando su e giù. Aggiungere circa 200 l della soluzione ad ogni pozzetto di una piastra di 48 pozze. Inclinare lentamente la piastra del pozzo per garantire una copertura completa dei pozzi con soluzione elastomer.
- Mettere la piastra del pozzo con elastomero in un forno a vuoto a 50 cmHg, 40 gradi centigradi. Rimuovere il coperchio e coprire con una pulizia a singolo soecco per evitare che altri detriti cadano nei pozze. Lasciare incubare per almeno 48 h.
- Verificare che i pozzi siano completamente rivestiti tramite ispezione visiva. Assicurarsi che l'elastomer sia completamente guarito spingendo delicatamente con una punta sterile pipetta prima di rimuovere.
- Aggiungere 300 l di 70% di etanolo (realizzato con etanolo assoluto e acqua priva di endotossina) e incubare a RT per 1 h. Rimuovere l'etanolo ed eseguire fuorti d'acqua senza endotossina aggiungendo 300 l of endotoxin-free a ogni pozzo e incubando per 1 h (tre volte), 12 h , e 24 h prima dell'uso per rimuovere il solvente rimanente.
- Incubare 200 L di acqua endotossina senza tre pozze di ogni piastra per 1 h. Misurare la concentrazione di endotossina degli estratti d'acqua utilizzando un'anedi endotossina cromogenica del punto finale (passaggi 2.5.1.2.5.6).
4. Superfici di coltura delle cellule di rivestimento con polifluurato (tetrafluoroetilene)
- Fare una soluzione da 1 mg/mL di poli fluorurato (tetrafluoroetilene) (fPTFE) (ad esempio, aggiungere 10 mg di fPTFE a 10 mL di solvente fluorurato [Tabella dei materiali]) in una fiala di scintillazione di vetro da 20 mL. Mettere una barra magnetica di agitazione nella fiala e lasciare mescolare per almeno 24 h, fino a quando tutti i solidi sono sciolti.
- Aggiungere circa 150 l della soluzione polimerica ad ogni pozzo di una piastra di polistirolo 48 pozze (cioè, non coltura tissutale trattata). Inclinare lentamente la piastra del pozzo per garantire una copertura completa di tutti i pozzi con soluzione polimerica. Sostituire il coperchio.
- Per garantire un efficace rivestimento fPTFE dei pozzi, i rivestimenti in vetro devono essere rivestiti in fPTFE e utilizzati per la misurazione dell'angolo di contatto con l'acqua (passaggio 4.3.1). Posizionare i copricapi all'interno dei pozze di una piastra di 24 pozze. Aggiungere circa 400 l della soluzione polimerica ad ogni pozzo contenente un coperchio. Spingere i copricopertine verso il basso con pinze sterili, assicurandosi che siano completamente coperte in soluzione polimerica, e coprire la piastra del pozzo con un coperchio.
- Collocare la piastra del pozzo con soluzione polimerica e/o copricapi in un forno a vuoto impostato a 50 cmHg, 40 gradi centigradi. Rimuovere il coperchio e coprire con una pulizia a singolo soecco per evitare che altri detriti cadano nei pozze. Lasciare incubare per almeno 48 h.
- Misurare l'angolo di contatto con l'acqua dei coprilabbra rivestiti in fPTFE con un goniometro per garantire un rivestimento efficace.
NOT: Solo l'acqua di altissima purezza (ad esempio, il triplo vetro distillato) deve essere utilizzata per le misurazioni dell'angolo di contatto con l'acqua.
- Misurare l'angolo di contatto con l'acqua dei coprilabbra rivestiti in fPTFE con un goniometro per garantire un rivestimento efficace.
- Aggiungere 300 l di 70% di etanolo (realizzato con etanolo assoluto e acqua priva di endotossina) e incubare a RT per 1 h. Rimuovere l'etanolo ed eseguire fuorti d'acqua senza endotossina aggiungendo 300 l of endotoxin-free a ogni pozzo e incubando per 1 h (tre volte), 12 h , e 24 h prima dell'uso per rimuovere il solvente rimanente.
- Incubare 200 L di acqua endotossina senza tre pozze di ogni piastra per 1 h. Misurare la concentrazione di endotossina di estratti d'acqua utilizzando un'anesay endotossina cromogenica del punto finale (passaggi 2.5.1.2.5.6).
- UV sterilizzare le piastre di pozzo per 30 min prima di esperimenti di coltura cellulare.
5. Fare Lysate da 3T3 cellule
- Far crescere 3T3 cellule in più flaconi T150 fino al 70% di confluenza. Per staccare le cellule, supporti aspirati, lavare la superficie con 5 mL di PBS e PBS aspirato. Aggiungere 5 mL di enzima di dissociazione cellulare ricombinante privo di origine animale (Tabella dei materiali) e incubare a 37 gradi centigradi per 3 o 5 min.
- Staccare le cellule inclinando delicatamente il pallone avanti e indietro. Aggiungere 5 mL di PBS per neutralizzare l'enzima ricombinante utilizzato per la dissociazione cellulare. Trasferire le cellule staccate dai flaconi in un tubo di centrifuga e mescolare tramite pipettaggio. Eseguire un conteggio delle cellule vive utilizzando un emocitometro e un tinrio di vitalità cellulare.
NOT: È stato selezionato un enzima di dissociazione cellulare che può essere neutralizzato attraverso la diluizione in PBS per evitare l'introduzione di proteine a base di siero nella preparazione del lisone. Se la trypsin viene utilizzata per dissociare le cellule, deve essere neutralizzata con una soluzione contenente siero e deve essere eseguito un ulteriore lavaggio PBS per ridurre la quantità di proteine del siero trasportate nella preparazione del lisato. - Centrifugare le cellule a 200 x g per 5 min. Aspirate the supernatant and resuspend cells in original volume (es, 10 mL x number of flasks) of PBS to wash off any remaining media. Ripetere.
- Centrifugare nuovamente le cellule a 200 x g per 5 min e aspirare il supernatante. Aggiungere il volume di PBS necessario per ottenere una concentrazione cellulare finale di 1 x 106 cellule / mL. Collocare la soluzione cellulare in un congelatore a -80 gradi centigradi fino a quando il campione non è completamente congelato (almeno 2 h).
- Scongelare la soluzione cellulare in un bagno d'acqua a 37 gradi centigradi. Una volta completamente scongelato, riporre la soluzione nel congelatore -80 gradi fino a congelare completamente. Ripetere l'operazione per un totale di 3 cicli di congelamento-scongelamento.
- Eseguire un'analisi micro dell'acido bicinchoninico (BCA) sul lisa cellulare a una varietà di diluizioni (ad esempio, 1/100, 1/200, 1/500, 1/1000) per determinare la concentrazione proteica. Diluire il lisa toeto cellulare a una concentrazione proteica di 468,75 g/mL, e conservare a -80 gradi centigradi per un uso futuro.
NOT: La concentrazione finale di proteine in una piastra di 48 pozzetto è 125 g/cm2 (basata sulla superficie di un pozzo, 0,75 cm2). - Eseguire una macchia occidentale per valutare la presenza di DAPP nel lysato (ad esempio, proteina da urto termico 60 [HSP60], scatola di gruppo ad alta mobilità 1 [HMGB1]) caricando 40-60 g di proteine di lisfatto nel buffer di carico su un gel di poliacilofo 10% di spessore 10% e seguire la macchia occidentale standard Procedure.
6. Valutazione dell'effetto degli strati proteici adsorbiti e dei ricettivi simili alle attività nF-B dei Macrofagi
NOT: Per uno schema del flusso di lavoro sperimentale e del layout della piastra, fare riferimento rispettivamente alle figure 1A e alla figura supplementare 1.
- Coltiva i macrofagi dei reporter in una fiaschetta di dimensioni adeguate al 70% di confluenza. Aspirate supporti, superficie di lavaggio con PBS, e PBS aspirato. Aggiungere l'enzima di dissociazione cellulare ricombinante e incubare a 37 gradi centigradi per 8 min.
- Staccare le cellule toccando saldamente i lati del pallone. Inattivare l'enzima di dissociazione cellulare ricombinante aggiungendo un volume uguale di supporti di crescita (contenente 10% FBS). Eseguire un conteggio delle cellule vive utilizzando un emocitometro e un tinrio di vitalità cellulare.
NOT: La vitalità prevista per i macrofagi reporter dopo un'incubazione di 8 min nell'enzima di dissociazione cellulare è del 90%. - Centrifuga cellule a 200 x g per 5 min. Aspirate supernatante e risospensione nel volume originale di PBS per lavare le cellule. Centrifuga di nuovo e risospendere le cellule a 7,3 x 105 cellule / mL nel supporto di saggio (contenente calore inattivato FBS).
- Sospensione cellulare separata in 3 tubi diversi: inibitore TLR4, anti-TLR2 e non trattato. Incubare le cellule con 1 inibitore TLR4 g/mL per 60 min a RT o con 50 g/mL anti-TLR2 per 30 min a RT.
- Aggiungere 200 l di lispetto, 10% FBS, 10% plasma di topo commerciale (Tabella dei materiali) o una miscela delle soluzioni proteiche a una piastra di 48 pozze (o equivalente) e consentire alle proteine di adsorbenti a 37 gradi centigradi per la quantità di tempo desiderata (cioè 30 min, 60 min o 24 h). Soluzioni proteiche aspirati da pozzi, utilizzando una pipetta Pasteur fresca per ogni soluzione proteica, e lavare le superfici con 250 -L di PBS per 5 min. Ripetere per un totale di 3 lavamenti.
NOT: Questo passaggio potrebbe essere necessario iniziare in precedenza nel protocollo a seconda del tempo di annunci desiderato. Regolare il protocollo di conseguenza. - Dopo il periodo di incubazione con l'inibitore TLR4 o anti-TLR2, le cellule pipeta da riutilizzare. Aggiungere 200 l di soluzione cellulare ad ogni bene.
- Per la condizione di controllo positivo TLR2, aggiungere Pam3CSK4 a una concentrazione finale di 150 ng/mL. Per la condizione di controllo positivo TLR4, aggiungere il lipopolisaccharide (LPS) a una concentrazione finale di 1,5 g/mL. Incubano cellule a 37 gradi centigradi per 20 ore.
- Campione 20 l di supernatante da ogni pozzo e piastra in duplicata in una piastra da 96 pozze. Includere come controllo in background tre pozze di 20 l. Aggiungete a ogni pozzo 200 di raccordo di saggio del giornalista SEAP. Coprire la piastra con una guarnizione adesiva e incubare per 2,5 ore a 37 gradi centigradi.
NOT: Il tempo di incubazione può variare a seconda delle condizioni sperimentali e deve essere ottimizzato per una forte differenza di assorbimento tra pozzi di controllo positivi e negativi.- Trasferire il resto del supernatante in un tubo da 1,5 mL (per pozzo). Centrifuga a 1.000 x g per 10 min a pellet eventuali detriti. Trasferire supernatante in un nuovo tubo da 1,5 mL e conservarlo a -80 gradi centigradi. Analizzare il supernatante per la presenza di citochine infiammatorie (ad es., TNF-z, interleuchina 6) attraverso il saggio immunosorbente legato agli enzimi (ELISA).
- Rimuovere la guarne della piastra adesiva. Leggere l'assorbimento della piastra utilizzando un lettore di lamiere a 635 nm. Liquido aspirato e piastra di scarto.
Risultati
Sono stati testati metodi di pulizia per le superfici rivestite di polimeri per garantire che non vi fosse alcuna interruzione del rivestimento, che sarebbe stato visto come un cambiamento dell'angolo di contatto con l'acqua a una vetrina di vetro non rivestita (Figura 2). L'immergenza di vetrini al microscopio rivestiti pmMA in 70% etanolo per 1 h è stato trovato per rimuovere il rivestimento PMMA (Figura 2, pannello sinistro), probabilmente a causa della solubilità di PMMA in 80 wt% etanolo13, quindi le superfici rivestite PMMA sono state pulite utilizzando 30 min di sterilizzazione UV da solo. La concentrazione di PMMA per il rivestimento è stata ottimizzata in precedenza5. Un ammollo di etanolo 70% è stato utilizzato per pulire PDMS, e la sterilizzazione UV è stata trascurata poiché la luce UV può causare la scissione della catena e influenzare le proprietà di bagnatura superficiale di PDMS14. Sia il 70% di ammollo di etanolo che la sterilizzazione UV non hanno influenzato l'angolo di contatto con l'acqua dei coprilabbra rivestiti in fPTFE(Figura 2, pannello destro), quindi i due metodi, in successione, sono stati utilizzati per pulire i rivestimenti fPTFE. Il metodo di rivestimento fPTFE è stato precedentemente descritto dal gruppo Grainger15.
Una macchia occidentale è stata eseguita sul lisato 3T3 per garantire che le specie DAMP fossero presenti nella complessa miscela molecolare. I risultati hanno mostrato che sia HMGB1 che HSP60, due DAMP ben documentati16,17, erano presenti nel lysate (Figura 1B). L'adsorbimento dei ligandi TLR dal lisato sulle superfici polimeriche è stato confermato dal culto dei macrofagi (non trattati, TLR2 neutralizzato, o TLR4 inibito) per 20 h su superfici polimeriche adsorbite di proteine (cioè, polistirolo trattato con coltura tissutale [TCPS], PMMA, PDMS, fPTFE), e quindi valutare indirettamente l'attività nF--B/AP-1 sulla base della produzione SEAP utilizzando un saggio enzimatico (Figura 1C e 3 ). Inoltre, i macrofagi reporter avevano aumentato significativamente l'attività di NF-B/AP-1 sul lisato adsorbito rispetto all'adsorbito FBS o plasma e nessuna proteina pre-adsorbita (media) (Figura 4). I ligandi sintetici tl-r (Pam3CSK4, TLR2 ligando) e lipopolysaccharide (LPS, ligando TLR4) sono stati inclusi come controlli positivi per confermare l'anticorpo o l'inibitore e l'analisi funzionava correttamente. La neutralizzazione della TLR2 ha avuto una riduzione notevolmente più forte della risposta NF-B/AP-1 dei macrofagi reporter ad adsorbito lisato rispetto all'inibizione di TLR4. Inoltre, piccole quantità di liscia diluito nel siero (in base alla proteina totale) hanno indotto un aumento significativo della risposta NF-B/AP-1 rispetto al solo siero, con la diluizione effettiva più bassa dipendente dalla superficie polimerica (Figura 5). Questi risultati dimostrano la potenza delle molecole derivate dal lisato adsorbito nell'indurre l'attività NF-'B/AP-1 dipendente da TLR su una varietà di superfici polimeriche.
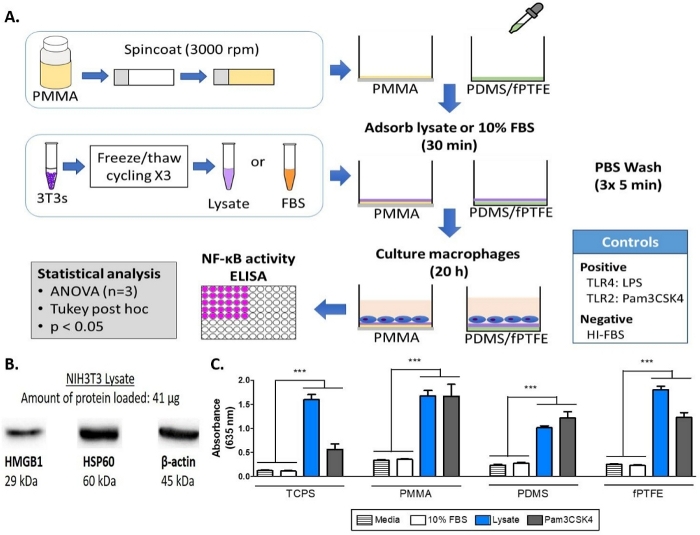
Figura 1: Metodi e risultati per il saggio di fosfofoculosi alcalina dei macrofagi reporter NF-B/AP-1 su TCPS, PMMA, PDMS e fPTFE. (A) Diagramma del flusso di lavoro per il saggio di fosfofosano macrofalo reporter. (B) La macchia occidentale del lisa che conferma la presenza delle specie DAMP HMGB1 e HSP60, con come controllo di carico. (C) Attività NF-B/AP-1 (rappresentata dall'assorbimento) dei macrofagi reporter coltivati su supporti (controllo negativo), 10% FBS, lysate, e Pam3CSK4 (Legamento positivo TLR2) per 20 h. Data mostra i risultati di un esperimento ed è rappresentativo dei risultati di almeno 2 esperimenti separati, mostrati come deviazione standard media (SD). Ogni esperimento ha usato n : 3 pozzi separati per condizione, e ogni pozzo è stato placcato in duplicato per il saggio enzimatico. Analizzato utilizzando test post-hoc ANOVA unidirezionali e Tukey. p < 0.001. Questa cifra è stata adattata con il permesso di McKiel e Fitzpatrick5. Copyright 2018 American Chemical Society. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Ottimizzazione dei metodi di pulizia per superfici rivestite pmMA e fPTFE, valutate utilizzando l'angolo di contatto con l'acqua (WCA). Le misurazioni sono state effettuate su 2 punti separati di almeno 3 coverlips. I dati vengono visualizzati come media: SD. Analizzati utilizzando test post-hoc ANOVA e Tukey unidirezionali. p < 0,05. Questa cifra è stata adattata con il permesso di McKiel e Fitzpatrick5. Copyright 2018 American Chemical Society. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: attività NF-B/AP-1 mediata da TLR (rappresentata dall'assorbimento) dei macrofagi dei reporter coltivati su 10% FBS (controllo), lisa e controllo positivo per 20 h. (A) Influenza della neutralizzazione tLR2 sulle risposte dei macrofafi dei reporter all'adsorbito. Il controllo positivo è Pam (Pam3CSK4, legamento TLR2). (B) Influenza dell'inibizione del TLR4 sulla risposta del macrofago reporter all'adsorbito lisma. Il controllo positivo è il ligando LPS (TLR4). I dati mostrano i risultati di un esperimento ed è rappresentativo dei risultati di almeno 2 esperimenti separati, mostrati come media : SD. Ogni esperimento ha usato n : 3 pozzi separati per condizione, e ogni pozzo è stato placcato in duplicato per il saggio enzimatico. Analizzato utilizzando test post-hoc ANOVA unidirezionali e Tukey. < 0,01, p < 0,001. Questa cifra è stata adattata con il permesso di McKiel e Fitzpatrick5. Copyright 2018 American Chemical Society. Fare clic qui per visualizzare una versione più grande di questa figura.
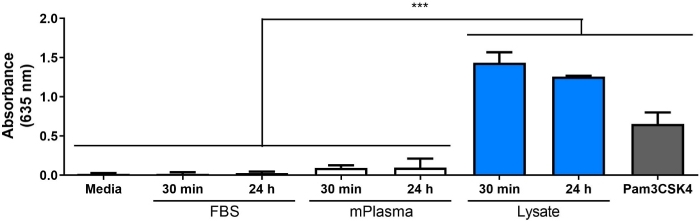
Figura 4: attività NF-B/AP-1 (rappresentata dall'assorbimento) dei macrofagi reporter coltivati su supporti (controllo negativo), 30 strati di proteine adsorate da 30 min e 24 h e Pam3CSK4 (controllo positivo) su TCPS per 20 h. I dati vengono combinati da 3 esperimenti separati e visualizzati come media: SD. Ogni esperimento ha usato n : 3 pozzi separati per condizione, e ogni pozzo è stato placcato in duplicato per il saggio enzimatico (cioè, n - 9 pozzi di coltura cellulare non indipendenti e n - 18 pozzi di saggio enzimatici non indipendenti). Analizzato utilizzando test post-hoc ANOVA unidirezionali e Tukey. p < 0.001. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Attività di Reporter macrofagio NF-'B/AP-1 (rappresentata dall'assorbimento) dopo 20 h in risposta alle diluizioni di lisitata in FBS (proteina totale - 280 g/pozzo) adsorbito su superfici polimeriche per 30 min. (A) TCPS. (B) PMMA. (C) PDMS. (D) fPTFE. I dati mostrano i risultati di un esperimento ed è rappresentativo dei risultati di almeno 2 esperimenti separati, mostrati come media : SD. Ogni esperimento ha usato n : 3 pozzi separati per condizione, e ogni pozzo è stato placcato in duplicato per il saggio enzimatico. Analizzato utilizzando test post-hoc ANOVA unidirezionali e Tukey. : p < 0,05, p < 0,01, p < 0,001. Questa cifra è stata adattata con il permesso di McKiel e Fitzpatrick5. Copyright 2018 American Chemical Society. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare 1: Layout di esempio utilizzati per l'esempio di applicazione delle colture di macrofanze di reporter NF--B/AP-1 in formati a 8 camere e 48 pozzetto. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Uno degli obiettivi principali del nostro laboratorio è la risposta dell'ospite agli impianti di tessuti molli biomateriali solidi, e in particolare il modo in cui il danno cellulare subito durante la procedura di impianto influisce sulla risposta dell'ospite. Il lavoro qui presentato descrive gli esperimenti preliminari utilizzando una linea cellulare del macrofago reporter e il lisa cellulare contenente DAMP generato in vitro, per studiare l'influenza delle molecole rilasciate durante i danni cellulari (cioè dalla chirurgia implantare) sulle risposte dei macrofagini ai biomateriali. Lisato a cellule fibroblaste è stato utilizzato per modellare il danno cellulare e il rilascio di DAMP a causa del posizionamento biomateriale. I fibroblasti sono stati scelti per creare il lisciato a causa della prevalenza dei fibroblasti nei tessuti molli, così come la loro capacità di secernere una varietà di proteine della matrice extracellulare (ECM), tra cui la fibronectina18. Il ciclo del gelo è stato scelto come metodo di lisi per produrre DAMP sia intracellulari che derivati da ECM, simile a quello che sarebbe presente nell'ambiente implantare. Gli inibitori della proteasi non sono stati utilizzati per fare questo lisato. Mentre la lisi cellulare incontrollata come il ciclo del gelo può provocare il rilascio di proteasi che possono degradare DAMP, questi enzimi sarebbero probabilmente presenti anche nell'ambiente dell'impianto biomateriale quando le cellule sono danneggiate durante la procedura di impianto. La presenza di DAMP nella complessa miscela molecolare del lisato è stata confermata dalla macchia occidentale (Figura 1B; HMGB1 e HSP60) e il saggio di reporter SEAP (Figura 1C; attività n. B/AP-1 in risposta all'adsorbito lisata). Abbiamo anche eseguito saggi in cui il lisato è stato diluito in FBS sulla base della concentrazione totale di proteine e adsorbito su superfici di coltura cellulare (Figura 5) per riflettere meglio la complessità dell'ambiente implantare, dal momento che conterrà un'abbondanza di proteine del sangue così come DAMP6. Il macrofagio reporter NF-'B/AP-1 è rimasto significativamente aumentato sui livelli adsorbiti da lisanei diluiti in FBS, e la diluizione più bassa per ottenere un'attivazione significativa è stata dipendente dalla superficie, che va dallo 0,1% (TCPS) al 10% (PDMS e fPTFE).
I polimeri PMMA, PDMS e PTFE sono stati scelti per questo lavoro perché non sono degradabili e sono stati ampiamente utilizzati nella letteratura per valutare l'adsorbimento proteico e la risposta del macrofago ai biomateriali19,20,21,22,23,24,25. TCPS è stato utilizzato anche per il confronto in quanto è un substrato comune utilizzato per il macrofagio in vitro e il lavoro di segnalazione TLR21,26,27,28. I materiali utilizzati nel nostro lavoro sono esempi rappresentativi di biomateriali solidi e non degradabili. Tuttavia, molti altri materiali potrebbero essere utilizzati con questo modello, a condizione che il materiale possa essere rivestito su piastre di coltura cellulare o vetrini al microscopio e adeguatamente decontaminati. Per questo modello in vitro è stata selezionata la linea cellulare macrofagio reporter NF-B/AP-1, in quanto consente una misurazione rapida e indiretta dell'attività di NF-B/B-1 attraverso l'espressione inducibile NF-B/AP-1 di SEAP. I macrofagi dei reporter NF-B/AP-1 richiedono l'uso di fleomicina D1 nei mezzi di coltura come antibiotico selettivo per garantire che siano presenti solo le cellule con il gene SEAP inducibile NF-B/AP-129. Per il saggio di fosfofoculosi alcalina, è fondamentale utilizzare HI-FBS nei mezzi di coltura cellulare per evitare potenziali risultati falsi positivi generati dalle fosfache alcaline presenti nel siero. La nostra ricerca fino ad oggi suggerisce che le superfici di FBS-adsorbed non generano un risultato falso positivo rilevabile, probabilmente perché le molecole di siero sono fortemente adsorbite alla superficie di coltura e non vengono rilasciate nel supernatante. Il momento culturale per i macrofagi reporter (20 h), il tempo di incubazione del saggio (2,5 h) e la lunghezza d'onda di lettura dell'assorbimento (635 nm) per il saggio di fosfoculosi alcalina sono stati ottimizzati con questo sistema per garantire misurazioni robuste e riproducibili per tutte le condizioni.
Un primo timepoint di adsorbiuntazione proteica di 30 min è stato scelto per questo lavoro a causa del suo uso comune nella letteratura di adsorbizioneproteica( Figura 1C)30,31,32,33,34. Tuttavia, abbiamo anche esplorato tempi di assorbimento più lunghi (cioè, 60 min e 24 h, Figura 4) per rappresentare meglio lo strato proteico adsorbito con cui i macrofagi interagirebbero con in vivo, che probabilmente si verificherà 4-24 h dopo l'impianto1. È stato ipotizzato che la maggior parte degli adsorbizione proteica e lo scambio si verifica nei primi 60 min di esposizione a una superficie26,35,36, quindi un tempo di adsorbimento 60 min può essere un timepoint più rilevante. Abbiamo anche spostato dall'utilizzo di FBS come controllo negativo per la presenza di DAMP nello strato proteico adsorbito al plasma di topo commerciale. La logica per l'utilizzo del plasma al posto del siero è che le proteine del plasma sono note per svolgere un ruolo significativo nell'adsorbimento delle proteine e nella risposta al macrofagio1e che il plasma fornisce una migliore rappresentazione delle proteine nell'ambiente della ferita. Il plasma usato negli esperimenti di adsorbizione proteica è comunemente preparato come una diluizionedi 26,36,37, che ha motivato il nostro uso di plasma del 10%. Il plasma umano è comunemente usato26,36, in quanto è più facile da ottenere in grandi quantità e più clinicamente rilevanti, rispetto al plasma murino. Tuttavia, abbiamo scelto di utilizzare il plasma di topo commerciale per in questo modello per mantenere le specie delle soluzioni proteiche coerenti con quella delle cellule reporter.
L'uso della linea cellulare reporter macrofago ha introdotto alcune limitazioni all'interno dello studio. In primo luogo, l'uso di una linea cellulare murina di macrofago leucemico ha limitazioni intrinseche, poiché il fenotipo e il comportamento possono variare dalle colture primarie dei macrofafi. Mentre questa limitazione sarà affrontata in lavori futuri utilizzando macrofagi primari, la linea cellulare dei macrofagi parentali ha dimostrato di imitare da vicino i macrofagi derivati dal midollo osseo del topo in termini di recettori della superficie cellulare e risposta ai ligandi microbici per TLR 2, 3 e 438. Inoltre, i macrofagi dei reporter NF-B/AP-1 hanno dato risultati simili in risposta alla stimolazione HMGB1 e LPS rispetto ai macrofagi murini primari peritoneali39. Va notato che i macrofagi reporter NF-B/AP-1 e il loro ceppo parentale non esprimono TLR540. I ricercatori hanno dimostrato che l'HMGB1 è stato in grado di attivare i fattori di trascrizione NF-B attraverso le vie di segnalazione TLR5 nelle cellule HEK-293 esfetate stabilmente con l'uomo TLR541. Pertanto, il contributo della segnalazione HMGB1-TLR5 all'attività complessiva di NF-B sulle superfici rivestite di lismi è stato trascurato in questo modello. Inoltre, i macrofagi reporter e il loro ceppo parentale non esprimono la proteina dell'adattatore ASC, e di conseguenza non formano la maggior parte dei tipi di infiammazioni e non possono elaborare l'IL-1 inattivo o l'IL-18 inattivo alle loro forme mature42. Pertanto, il modello che abbiamo utilizzato non tiene conto del contributo dell'attività infiammatoria dipendente dall'ASC e della successiva segnalazione di autocrini IL-1 e IL-18 nelle risposte di macrofago alle superfici con assorbimento di lisci. Di conseguenza, questo test è inteso come un esame preliminare dell'attivazione di NF-B dipendente da TLR, e si raccomanda una successiva ricerca utilizzando macrofagi primari per fornire una comprensione più completa e rappresentativa dell'attivazione dei macrofagi e del fenotipo sulle superfici materiali di interesse.
Il saggio alcalina fosfopbulasi misura indirettamente l'attività NF-B/AP-1 dei macrofagi reporter. Tuttavia, ci sono molte vie di segnalazione diverse dai TLR che coinvolgono NF-B/AP-1 (ad esempio, il recettore interleuina-1 [IL-1R]43 e il recettore del fattore di necrosi tumorale [TNFR]44). Pertanto, è stato necessario valutare il contributo della segnalazione TLR2 e TLR4 nella maggiore risposta NF-B/AP-1 alle superfici lisate-adsorbite utilizzando saggi inibitori (Figura 3). La logica per la selezione di questi due TLR di superficie era che almeno 23 DAMP che hanno dimostrato di segnalare attraverso TLR2 e TLR445, compreso il ben caratterizzato HMGB11, ed entrambi i recettori sono espressi sulla superficie cellulare e possono interagire direttamente con la superficie biomateriale6. I saggi di inibizione di TLR2 e TLR4 hanno dimostrato che quando la segnalazione TLR2 o TLR4 è stata bloccata, la risposta NF-B/AP-1 dei macrofagi reporter al lisato adsorbito è stata ridotta, indicando che entrambe le vie sono coinvolte. Tuttavia, c'è stata una riduzione notevolmente maggiore nell'attività di NF-B/AP-1 quando la segnalazione TLR2 è stata neutralizzata, suggerendo che TLR2 può svolgere un ruolo primario nella risposta dei macrofagi reporter al lisato adsorbito. Riconosciamo che ci può essere qualche inibizione fuori bersaglio con la via di segnalazione TLR che neutralizza anticorpi e inibitori. Un anticorpo neutralizzante è stato utilizzato per inibire il percorso TLR2 poiché non c'erano molecole inibitorie TLR2 disponibili in commercio al momento di questo lavoro.
I metodi qui presentati utilizzano il lisato, come fonte complessa di DAMP, e i macrofagi dei reporter NF-B/AP-1 come modello in vitro per le risposte dei macrofagi alle DAMP e ad altre proteine che assorbono i biomateriali polimerici (Figura 1). Prevediamo che il nostro protocollo può essere utilizzato per analizzare rapidamente le risposte NF-B/AP-1 e la segnalazione TLR a monte dei macrofagi dei reporter a una varietà di materiali (compresi materiali degradabili, scaffold porosi o idrogel) e strati proteici adsorbiti (Figura 3). Tuttavia, l'uso di materiali porosi e idrogel introdurrà complessità all'interno del sistema, in quanto può essere difficile distinguere tra molecole adsorbite e molecole addestrate. Prevediamo inoltre che questo protocollo può essere facilmente adattato per studiare il contributo di altri percorsi di segnalazione a monte di NF- Inoltre, la risposta NF-B/AP-1 dei macrofagi dei reporter potrebbe essere confrontata tra materiali diversi, a condizione che le risposte siano normalizzate all'attività cellulare di base (cioè le cellule nei supporti su ogni superficie senza proteina pre-adsorbed) e tutti i materiali abbiano livelli di endotossina non rilevabili.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono con gratitudine il finanziamento operativo del Canadian Institutes of Health Research Project (PTJ 162251), del Queen's University Senate Advisory Research Committee e del sostegno alle infrastrutture della Canadian Foundation for Innovation John Evan's Leadership Fund (Project 34137) e del Ministry of Research and Innovation Ontario Research Fund (Progetto 34137). L.A.M. è stato sostenuto da una Queen's University R. Samuel McLaughlin Fellowship, da un Natural Sciences and Engineering Research Council del Canada Canadian Graduate Scholarship Master's Award e da una borsa di studio Ontario Graduate. Gli autori desiderano ringraziare il Dr. Myron Szewczuk per il suo generoso dono della linea cellulare macrofagio reporter NF-B/AP-1 e i dottori Michael Blennerhassett e Sandra Lourenssen per l'uso del loro sistema di imaging gel e lettore di placche.
Materiali
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| anti-mouse/human CD282 (TLR2) | Biolegend | 121802 | |
| CLI-095 (TLR4 inhibitor) | Invivogen | TLRL-CLI95 | |
| C57 complement plasma K2 EDTA 10ml, innovative grade US origin | InnovativeResearch | IGMSC57-K2 EDTA-Compl-10ml | Mouse plasma |
| Dulbecco's modified eagle medium (DMEM) | Sigma Aldrich | D6429-500ML | |
| Dulbecco's phosphate buffered saline (DPBS) | Fisher Scientific | 14190250 | No calcium, no magnesium |
| Fetal bovine serum (FBS), research grade | Wisent | 98150 | |
| LPS-EK | Invivogen | TLRL-EKLPS | Lipopolysaccharide from Escherichia coli K12 |
| NIH/3T3 fibroblasts | ATCC | CRL-1658 | |
| Pam3CSK4 | Invivogen | tlrl-pms | Synthetic triacylated lipopeptide - TLR1/2 ligand |
| Penicillin/streptomycin | Sigma Aldrich | P4333-100ML | |
| Plasmocin | Invivogen | ANT-MPP | Mycoplasma elimination reagent |
| RAW-Blue cells | Invivogen | raw-sp | NF-κB/AP-1 reporter macrophage cell line |
| Trypan blue solution, 0.4% | Fisher Scientific | 15250061 | |
| TrypLE express enzyme (1X) | Fisher Scientific | 12604021 | animal origin-free recombinant cell dissociation enzyme |
| Zeocin | Invivogen | ANT-ZN-1 | |
| Kits and assays | |||
| ELISA precoated plates, mouse IL-6 | Biolegend | B213022 | |
| ELISA precoated plates, mouse TNF-α | Biolegend | B220233 | |
| Endotoxin (Escherichia coli) - Control standard endotoxin (CSE) | Associates of Cape Cope Inc. | E0005-5 | Endotoxin for standard curve in chromogenic endotoxin assay |
| LAL water, 100 mL | Associates of Cape Cope Inc. | WP1001 | Used with chromogenic endotoxin assay |
| Micro BCA protein assay | Fisher Scientific | PI23235 | |
| Limulus amebocyte lysate (LAL) Pyrochrome endotoxin test kit | Associates of Cape Cope Inc. | C1500-5 | Chromogenic endotoxin assay reagent |
| QUANTI-Blue alkaline phosphatase detection medium | Invivogen | rep-qb2 | Alkaline phosphatase assay to indirectly measure NF-κB/AP-1 activity |
| Polymeric coating reagents | |||
| Chloroform, anhydrous | Sigma Aldrich | 288306-1L | |
| Ethyl alcohol anhydrous | Commercial Alcohols | P006EAAN | Sigma: Reagent alcohol, anhydrous, 676829-1L |
| Straight tapered fine tip forceps | Fisher Scientific | 16-100-113 | |
| Fluorinert FC-40 solvent | Sigma Aldrich | F9755-100ML | Fluorinated solvent for fPTFE |
| Cell culture grade water (endotoxin-free) | Fisher Scientific | SH30529LS | |
| Poly(methyl methacrylate) (PMMA) | Sigma Aldrich | 182230-25G | |
| Sylgard 184 elastomer kit | Fisher Scientific | 50822180 | |
| Teflon-AF (fPTFE) | Sigma Aldrich | 469610-1G | Poly[4,5-difluoro-2,2-bis(trifluoromethyl)-1,3-dioxole-co-tetrafluoroethylene] |
| Consumables | |||
| Adhesive plate seals | Fisher Scientific | AB-0580 | |
| Axygen microtubes, 1.5 mL | Fisher Scientific | 14-222-155 | |
| Borosilicate glass scintillation vials, with white polypropylene caps | Fisher Scientific | 03-337-4 | |
| Clear PS 48-well plate | Fisher Scientific | 08-772-52 | |
| Clear TCPS 96-well plate | Fisher Scientific | 08-772-2C | |
| Clear TCPS 48-well plate | Fisher Scientific | 08-772-1C | |
| Cover glasses, circles | Fisher Scientific | 12-545-81 | |
| Falcon tissue culture treated flasks, T25 | Fisher Scientific | 10-126-10 | |
| sticky-Slide 8 Well | Ibidi | 80828 | |
| Superfrost microscope slides | Fisher Scientific | 12-550-15 | |
| Tissue culture treated flasks, T150 | Fisher Scientific | 08-772-48 |
Riferimenti
- Anderson, J. M., Rodriguez, A., Chang, D. T. Foreign body reaction to biomaterials. Seminars in Immunology. 20 (2), 86-100 (2008).
- Anderson, J. M., Miller, K. M. Biomaterial biocompatibility and the macrophage. Biomaterials. 5 (1), 5-10 (1984).
- Collier, T. O., Anderson, J. M. Protein and surface effects on monocyte and macrophage adhesion, maturation, and survival. Journal of Biomedical Materials Research. 60 (3), 487-496 (2002).
- Bianchi, M. E. DAMPs, PAMPs and alarmins: all we need to know about danger. Journal of Leukocyte Biology. 81 (1), 1-5 (2007).
- McKiel, L. A., Fitzpatrick, L. E. Toll-like Receptor 2-Dependent NF-κB/AP-1 Activation by Damage-Associated Molecular Patterns Adsorbed on Polymeric Surfaces. ACS Biomaterials Science & Engineering. 4 (11), 3792-3801 (2018).
- Babensee, J. E. Interaction of dendritic cells with biomaterials. Seminars in Immunology. 20 (2), 101-108 (2008).
- Sintes, J., Romero, X., de Salort, J., Terhorst, C., Engel, P. Mouse CD84 is a pan-leukocyte cell-surface molecule that modulates LPS-induced cytokine secretion by macrophages. Journal of Leukocyte Biology. 88 (4), 687-697 (2010).
- Tom, J. K., Mancini, R. J., Esser-Kahn, A. P. Covalent modification of cell surfaces with TLR agonists improves and directs immune stimulation. Chemical Communications. 49 (83), 9618-9620 (2013).
- Abdulkhalek, S., et al. Neu1 sialidase and matrix metalloproteinase-9 cross-talk is essential for toll-like receptor activation and cellular signaling. Journal of Biological Chemistry. 286 (42), 36532-36549 (2011).
- Gorbet, M. B., Sefton, M. V. Endotoxin: The uninvited guest. Biomaterials. 26 (34), 6811-6817 (2005).
- Xing, Z., Pabst, M. J., Hasty, K. A., Smith, R. A. Accumulation of LPS by polyethylene particles decreases bone attachment to implants. Journal of Orthopaedic Research. 24 (5), 959-966 (2006).
- Ding, H., et al. Comparison of the cytotoxic and inflammatory responses of titanium particles with different methods for endotoxin removal in RAW264.7 macrophages. Journal of Materials Science: Materials in Medicine. 23 (4), 1055-1062 (2012).
- Hoogenboom, R., Becer, C. R., Guerrero-Sanchez, C., Hoeppener, S., Schubert, U. S. Solubility and thermoresponsiveness of PMMA in alcohol-water solvent mixtures. Australian Journal of Chemistry. 63 (8), 1173-1178 (2010).
- Efimenko, K., Wallace, W. E., Genzer, J. Surface modification of Sylgard-184 poly(dimethyl siloxane) networks by ultraviolet and ultraviolet/ozone treatment. Journal of Colloid and Interface Science. 254 (2), 306-315 (2002).
- Godek, M. L., Sampson, J. A., Duchsherer, N. L., McElwee, Q., Grainger, D. W. Rho GTPase protein expression and activation in murine monocytes/macrophages is not modulated by model biomaterial surfaces in serum-containing in vitro cultures. Journal of Biomaterials Science. Polymer Edition. 17 (10), 1141-1158 (2006).
- Park, J. S., et al. Involvement of Toll-like Receptors 2 and 4 in Cellular Activation by High Mobility Group Box 1 Protein. Journal of Biological Chemistry. 279 (9), 7370-7377 (2004).
- Ohashi, K., Burkart, V., Flohé, S., Kolb, H. Cutting Edge: Heat Shock Protein 60 Is a Putative Endogenous Ligand of the Toll-Like Receptor-4 Complex. The Journal of Immunology. 164 (2), 558-561 (2000).
- Wong, T., McGrath, J. A., Navsaria, H. The role of fibroblasts in tissue engineering and regeneration. British Journal of Dermatology. 156 (6), 1149-1155 (2007).
- van Wachem, P. B., et al. The influence of protein adsorption on interactions of cultured human endothelial cells with polymers. Journal of Biomedical Materials Research. 21 (6), 701-718 (1987).
- Miller, K. M., Anderson, J. M. Human monocyte/macrophage activation and interleukin 1 generation by biomedical polymers. Journal of Biomedical Materials Research. 22 (8), 713-731 (1988).
- Bonfield, T. L., Colton, E., Anderson, J. M. Plasma protein adsorbed biomedical polymers: Activation of human monocytes and induction of interleukin 1. Journal of Biomedical Materials Research. 23 (6), 535-548 (1989).
- González, O., Smith, R. L., Goodman, S. B. Effect of size, concentration, surface area, and volume of polymethylmethacrylate particles on human macrophages in vitro. Journal of Biomedical Materials Research. 30 (4), 463-473 (1996).
- Anderson, J. M., et al. Protein adsorption and macrophage activation on polydimethylsiloxane and silicone rubber. Journal of Biomaterials Science. Polymer Edition. 7 (2), 159-169 (1995).
- Lord, M. S., Foss, M., Besenbacher, F. Influence of nanoscale surface topography on protein adsorption and cellular response. Nano Today. 5 (1), 66-78 (2010).
- Chen, S., et al. Characterization of topographical effects on macrophage behavior in a foreign body response model. Biomaterials. 31 (13), 3479-3491 (2010).
- Shen, M., Horbett, T. A. The effects of surface chemistry and adsorbed proteins on monocyte/macrophage adhesion to chemically modified polystyrene surfaces. Journal of Biomedical Materials Research. 57 (3), 336-345 (2001).
- Love, R. J., Jones, K. S. The recognition of biomaterials: Pattern recognition of medical polymers and their adsorbed biomolecules. Journal of Biomedical Materials Research Part A. 101 (9), 2740-2752 (2013).
- McNally, A. K., Anderson, J. M. Phenotypic expression in human monocyte-derived interleukin-4-induced foreign body giant cells and macrophages in vitro: Dependence on material surface properties. Journal of Biomedical Materials Research Part A. 103 (4), 1380-1390 (2015).
- Gambhir, V., et al. The TLR2 agonists lipoteichoic acid and Pam3CSK4 induce greater pro-inflammatory responses than inactivated Mycobacterium butyricum. Cellular Immunology. 280 (1), 101-107 (2012).
- Suzuki, O., Yagishita, H., Yamazaki, M., Aoba, T. Adsorption of Bovine Serum Albumin onto Octacalcium Phosphate and its Hydrolyzates. Cells and Materials. 5 (1), 45-54 (1995).
- Johnston, R. L., Spalton, D. J., Hussain, A., Marshall, J. In vitro protein adsorption to 2 intraocular lens materials. Journal of Cataract and Refractive Surgery. 25 (8), 1109-1115 (1999).
- Jin, J., Jiang, W., Yin, J., Ji, X., Stagnaro, P. Plasma proteins adsorption mechanism on polyethylene-grafted poly(ethylene glycol) surface by quartz crystal microbalance with dissipation. Langmuir. 29 (22), 6624-6633 (2013).
- Swartzlander, M. D., et al. Linking the foreign body response and protein adsorption to PEG-based hydrogels using proteomics. Biomaterials. 41, 26-36 (2015).
- Chamberlain, M. D., et al. Unbiased phosphoproteomic method identifies the initial effects of a methacrylic acid copolymer on macrophages. Proceedings of the National Academy of Sciences. 112 (34), 10673-10678 (2015).
- Dillman, W. J., Miller, I. F. On the adsorption of serum proteins on polymer membrane surfaces. Journal of Colloid And Interface Science. 44 (2), 221-241 (1973).
- Ishihara, K., Ziats, N. P., Tierney, B. P., Nakabayashi, N., Anderson, J. M. Protein adsorption from human plasma is reduced on phospholipid polymers. Journal of Biomedical Materials Research. 25 (11), 1397-1407 (1991).
- Warkentin, P., Wälivaara, B., Lundström, I., Tengvall, P. Differential surface binding of albumin, immunoglobulin G and fibrinogen. Biomaterials. 15 (10), 786-795 (1994).
- Berghaus, L. J., et al. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comparative Immunology, Microbiology and Infectious Diseases. 33 (5), 443-454 (2010).
- Zhang, Y., Karki, R., Igwe, O. J. Toll-like receptor 4 signaling: A common pathway for interactions between prooxidants and extracellular disulfide high mobility group box 1 (HMGB1) protein-coupled activation. Biochemical Pharmacology. 98 (1), 132-143 (2015).
- Mizel, S. B., Honko, A. N., Moors, M. A., Smith, P. S., West, A. P. Induction of macrophage nitric oxide production by Gram-negative flagellin involves signaling via heteromeric Toll-like receptor 5/Toll-like receptor 4 complexes. Journal of Immunology. 170 (12), 6217-6223 (2003).
- Das, N., et al. HMGB1 Activates Proinflammatory Signaling via TLR5 Leading to Allodynia. Cell Reports. 17 (4), 1128-1140 (2016).
- Pelegrin, P., Barroso-Gutierrez, C., Surprenant, A. P2X7 Receptor Differentially Couples to Distinct Release Pathways for IL-1β in Mouse Macrophage. The Journal of Immunology. 180 (11), 7147-7157 (2008).
- Tak, P. P., Firestein, G. S. NF-κB: A key role in inflammatory diseases. Journal of Clinical Investigation. 107 (1), 7-11 (2001).
- Ashkenazi, A., Dixit, V. M. Death receptors: signaling and modulation. Science. 281 (5381), 1305-1308 (1998).
- Erridge, C. Endogenous ligands of TLR2 and TLR4: agonists or assistants. Journal of Leukocyte Biology. 87 (6), 989-999 (2010).
- Feng, Y., et al. A macrophage-activating, injectable hydrogel to sequester endogenous growth factors for in situ angiogenesis. Biomaterials. 134, 128-142 (2017).
- Lonez, C., et al. Cationic lipid nanocarriers activate Toll-like receptor 2 and NLRP3 inflammasome pathways. Nanomedicine: Nanotechnology, Biology, and Medicine. 10 (4), 775-782 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon