Method Article
Поколение Крысиной модели острой печеночной недостаточности путем объединения 70% частичная гепатэктомия и ацетаминофен
В этой статье
Резюме
Острая печеночная недостаточность животных модель, разработанная в текущем исследовании представляет собой осуществимую альтернативу для изучения потенциальных методов лечения. Нынешняя модель использует комбинированный эффект физической и наркотической травмы и обеспечивает подходящее временное окно для изучения потенциала новых методов лечения.
Аннотация
Острая печеночная недостаточность (ALF) является клиническим заболеванием, вызванным различными этиологиями, приводящим к потере метаболических, биохимических, синтезирующих и детоксикационных функций печени. В большинстве случаев необратимые повреждения печени, ортотропическая пересадка печени (OLT) остается единственным доступным лечением. Для изучения терапевтического потенциала лечения ALF, его предварительное тестирование в животной модели ALF имеет важное значение. В текущем исследовании, модель ALF у крыс была разработана путем объединения 70% частичной гепатэктомии (PHx) и инъекций ацетаминофен (APAP), который обеспечивает терапевтическое окно 48 ч. Средние и левые боковые доли печени были удалены до акцизного 70% массы печени и APAP был дан 24 ч после хирургического в течение 2 дней. Было установлено, что выживаемость животных, вызванных АЛФ, сильно снизилась. Развитие ALF было подтверждено измененным уровнем сыворотки ферментов аланина аминотрансферозы (ALT), аспартатами амино-трансферазы (АСТ), щелочной фосфатазой (ALP); изменения протромбина времени (PT); и оценка международного нормализованного коэффициента (INR). Изучение профиля экспрессии генов qPCR выявило увеличение уровня экспрессии генов, участвующих в апоптозе, воспалении и прогрессировании травмы печени. Диффузная дегенерация гепатоцитов и инфильтрация иммунных клеток наблюдалась гистологическая оценка. Реверсивность ALF была подтверждена восстановлением уровня выживания и сыворотки АЛТ, АСТ и ALP после интраспельной трансплантации сингенных здоровых крысиных гепатоцитов. Эта модель представляет собой надежную альтернативу имеющимся МОделям животных ALF для изучения патофизиологии ALF, а также для оценки потенциала новой терапии для ALF. Использование двух различных подходов также позволяет изучить комбинированный эффект физической и медикаментозной травмы печени. Воспроизводимость и осуществимость текущей процедуры является дополнительным преимуществом модели.
Введение
Острая печеночная недостаточность (ALF) определяется Американской ассоциацией по изучению заболеваний печени как быстрое развитие острой травмы печени без каких-либо предварительных признаков повреждения и характеризуется тяжелыми нарушениями синтетических, метаболических и детоксикационных функций печени1. ALF отличается от хронической печеночной недостаточности, где отказ происходит в результате травмы печени, вызванной в течение длительного периода времени и от острой хронической печеночной недостаточности (ACLF), где резкое повреждение печени происходит в результате хронических заболеваний печени2,3,4. Единственным доступным лекарством для ALF является ортотопическая пересадка печени (OLT), или смерть может произойти. Из-за нехватки доноров печени, уровень смертности у пациентов, страдающих от ALF очень высока.
Для изучения потенциала альтернативных терапевтических подходов и лучше гораздо лучше понять патофизиологию ALF необходимы модели животных, которые могут отражать ALF, происходящие в человеческих существах. Многие из уже имеющихся моделей животных ALF имеют ряд недостатков. Эффекты ацетаминофена (APAP) трудно поддаются размножению, но имеют самое близкое сходство с точки зрения временных, клинических, биохимических и патологических параметров. APAP-индуцированных животных модели часто сталкиваются с проблемами из-за присутствия метемоглобинемии, вызванной окислением гемоглобина APAP и его промежуточных5,6,7. Еще одной проблемой является отсутствие воспроизводимости, отражаемые непредсказуемыми ответами на дозу и временем смерти. Модели животных ALF, произведенные с использованием углеродного тетрахлорида (CCl4) имеют плохую воспроизводимость8,9,10,11. Модели животных ALF, индуцированные ALF, не отражают клиническую структуру заболевания человека, хотя и имеют преимущества в изучении клеточных механизмов, участвующих в аутоиммунных заболеваниях печени и в изучении сепсиса соответственно12,13,14,15. Аналогичным образом, тиоацетамид (TAA) также требует биотрансформации к активному метаболиту тиоацетамида сульфоксида и показывает видовые изменения16,17,18,19. D-галактозамин (D-Gal) производит некоторые биохимические, метаболические и физиологические изменения, аналогичные ALF, но не в состоянии отразить все патологическое состояние ALF20,21,22,23. Там было очень мало попыток объединить два или более из этих методов для разработки модели ALF, которая способна отражать синдром ALF в лучшем виде13. Поэтому необходимы дальнейшие исследования для разработки модели, которая может отражать параметры заболевания, имеет лучшую воспроизводимость и предоставляет достаточно времени для изучения последствий терапевтического вмешательства.
В текущем исследовании, альтернативная модель ALF у крыс была создана путем объединения эффектов частичной гепатэктомии (PHx) и более низкие дозы гепатотоксического реагента. APAP имеет хорошо зарекомендовавшую себя роль в причинении травмы печени5,24,25. Это широко используется обезболивающее и является токсичным для печени в супратерапевтических дозах путем формирования токсичных метаболитов. АПАП является причиной многих смертей в развитых странах. Физические повреждения, вызванные частичной гепатэктомии инициирует активацию различных процессов, участвующих в воспалении, а также регенерации печени. Инъекция гепатотоксического агента APAP вызывает враждебную среду в печени, предотвращая распространение гепатоцитов. Это уменьшает период стресса на животное, что в сочетании с меньшими дозами гепатотоксина, приводит к лучшей воспроизводимости процедуры. Поэтому, используя эту модель, был изучен комбинированный эффект двух типов травм печени. Для характеристики разработанной модели ЖИВОТНЫх ALF были изучены физиологические и биохимические параметры. Успешная обратимость ALF была подтверждена трансплантацией сингенных здоровых крысиных гепатоцитов.
протокол
Процедура, описанная ниже, была одобрена Институциональным комитетом по этике животных Национального института иммунологии, Нью-Дели. Серийный справочный номер утверждения - IAEC-355/14.
1. Подготовка
- Подготовка к хирургической процедуре, как описано ранее Das B и др.26.
- Используйте 6-8-недельных инбредных крыс Wistar с массой тела 200-250 г.
- Дом животных в стандартных условиях ухода за животными и кормить их крысы чау и libitum до и после процедуры.
- При выполнении 70% PHx, используйте стандартную смесь коктейля гидрохлорида кетамина (100 мг/кг массы тела) и ксилазина (10 мг/кг массы тела), который вводится интраперитонеально.
ПРИМЕЧАНИЕ: Тип используемого анестезии может иметь послеоперационное воздействие на смертность и заболеваемость. - Во время пересадки клеток, использовать ингаляционную анестезию Isoflurane (2-хлоро-2-(дифторететокси)-1,1-трифтор-этан), чтобы уменьшить время восстановления животного после операции по трансплантации.
- Побудить и поддерживать ингаляционную анестезию с помощью индивидуальной анестезии системы. Поддерживайте поток кислорода на уровне 4 л/мин. Для индукции используют изофруран на 4%, а для обслуживания используют 2-3% во время хирургической процедуры.
2. Предоперационные процедуры
- Обезоживать крысу путем введения смеси кетамина-ксилазина, описанной в шаге 3.1 интраперитонеально. Подтвердите полную анестезию, щипая нос животного. Дальнейшие процедуры проводятся только тогда, когда нет педали рефлекса.
- Для предотвращения высыхания роговицы, применить carboxy метил-целлюлозы основе глаз капля на оба глаза.
- Сдержать обезопадеваемых животных к хирургической доске с помощью белой ленты. Поместите животное с брюшной стороны вверх, обеспечивая рот находится на дистальной стороне от лица, выполняющего операцию.
- Удалите волосы из верхней правой брюшной полости хирургической области с помощью электрического клипера.
- Дезинфицировать хирургическое место тремя чередующимися скрабы из йода повидина и 70% этанола с помощью стерилизованных ватных палок в круговом движении.
3. Частичная гепатэктомия (PHx) для удаления 70% массы печени
ПРИМЕЧАНИЕ: Выполните всю хирургическую процедуру в стерильной среде в ламинарном капоте потока. Используйте только стерильные хирургические инструменты, чтобы свести к минимуму риск инфекции после хирургического вмешательства. Удаление 70% массы печени, названный 70% частичной гепатэктомии (70% PHx), было выполнено, как описано C. Митчелл и H. Willenbring, 200827.
- Перед началом операции, подтвердить полную анестезию животного, щипать его ног. Дальнейшие процедуры проводятся только тогда, когда нет педали рефлекса.
- Отметьте кожу, чтобы ее вырезали чуть ниже грудины, перпендикулярно к сифоиду и параллельно грудной клетке.
- Поместите стерильный лист драпировки, имеющий отверстие около 3 см х 1 см над отмеченной кожей.
- Выполните поперечный разрез около 2-3 см вдоль отмеченной линии скальпелем. Используйте хирургическое лезвие No 22. Аккуратно удалите крепление кожи к базовому мышечному слою в непосредственной близости от разрезанных площадей с помощью стерильных увлажненных кончиков хлопка.
- Далее, сделать поперечный разрез через брюшной слой прямо под процессом xiphoid.
- С помощью двух солевых увлажненных кончиков хлопка, разоблачить левую дочку печени, применяя мягкое давление на грудную клетку. Поместите один кончик хлопка на диафрагмальную область разрезаемой части, а другой кончик хлопка ниже разрезанный области, чтобы поднять доли печени вверх.
- Проскользните 8-10 см длиной стерильной нейлоновой петли (размер 4-0, 0,15 мм в диаметре) вокруг открытой доли печени. Возьмите петлю к основанию доли близко к hilum с помощью микрорассечения щипцы или увлажненные ватные палочки.
- С помощью держателя иглы микрохирургии и микрофорспы, связать два конца петли, поставив узел как можно ближе к основанию доли, как это возможно, чтобы сжать кровеносный сосуд и уменьшить кровотечение после удаления доли печени. Свяжите два дополнительных узла с другой стороны.
- Примите меры предосторожности, чтобы не завязать узел слишком близко к близлежащим кровеносным сосудам, которые в противном случае могут вызвать венозную обструкцию (стеноз).
- Используйте ножницы микрохирургии, чтобы вырезать связанную долбу чуть выше узла, которая оставляет обесцвеченную массу ткани, называемую ишемическим пень вместо доли.
ПРИМЕЧАНИЕ: Крысиная печень, как и у мышей, делится на четыре различных долей: медианная доли, правая боковая доли, левая боковая доли, и доли каудат, которые представляют около 40%, 20%, 30% и 7% от общей массы печени, соответственно. Любая комбинация этих долей может быть удалена до акцизной 70% массы печени. В текущем исследовании, средняя доли и левые боковые доли были удалены. - Тщательно найдите медианную долбу, не повреждая оставшийся пень левой боковой доли. Аккуратно вытащите его из брюшной полости, а у основания доли завязать нейлоновой нитью длиной 8-10 см (размер 4-0), как упоминалось ранее. Свяжите два дополнительных узла с другой стороны. Тщательно акцизных и удалить связали средней доли принимая все меры предосторожности, упомянутые.
- После удаления долей шов перитонеума с помощью абсорбируемого хромашного 4-0 шва с непрерывными стежками с последующим швом кожи с прерванным швом.
- Нанесите повидйон на кожу, окружающую швы, чтобы предотвратить инфекцию.
- Снимите шторку и удалите животное с операционной доски.
4. Послеоперационный уход за животными
- Интраперитонеально вводят животному дозу 12 мг антибиотика цефотаксима в 1 мл 5% раствора глюкозы с шприцем 1 мл, чтобы защитить его от риска послеоперационной инфекции.
- Администрирование подкожной инъекции обезболивающее meloxicam (1 мг/кг массы тела) для облегчения боли после операции и следовать его еще на две дозы, сохраняя режим в качестве одной дозы в день.
- Дом эксплуатируемых животных в стандартных условиях 12 ч свет / темный цикл и контролировать через регулярные промежутки времени.
5. Инъекции препарата у частично гепатэктомизированных животных, чтобы вызвать печеночную недостаточность
- После 24 ч послеоперации, когда животные успешно оправились от 70% PHx, измерить вес тела животного с последующим ими инъекциями.
- Вводят 750 мг/кг массы тела APAP интраперитоневом виде у частично гепатэктомизированных животных 24 ч после 70% PHx после успешного восстановления животных после хирургической процедуры. Повторите дозу снова после 24 ч.
ПРИМЕЧАНИЕ: Две дозы APAP вводят интраперитоневом для животного (т.е., 24 ч и 48 ч после 70% PHx процедуры, соответственно). - В каждый момент после инъекции APAP, измерять вес тела выздоравливающего животного.
ПРИМЕЧАНИЕ: APAP (биоцетамол) вводится у животных в качестве раствора 150 мг/мл в 2% бензилового спирта.
6. Трансплантация здоровых гепатоцитов в моделях животных ALF
ПРИМЕЧАНИЕ: Для изучения обратимости ALF у крыс, трансплантации здоровых сингенных гепатоцитов крыс интраспленически в ALF-индуцированных животных вместе с1-й дозы APAP. В текущем исследовании, чтобы обеспечить достаточно времени для пересаженных клеток для самонаведения и придания, трансплантация была сделана сразу после предоставления1-й дозы APAP. Крысиные гепатоциты изолированы протоколом, впервые опубликованным Берри и Друзьями и др.28, а затем адаптированы в различных других исследованиях29,30,31 с некоторыми изменениями. Для интраспелинической трансплантации клеток в модели животных ALF выполните вышеуказанные шаги.
- Поместите крысу в поли (метил-метакрилат) камеру для индукции анестезии с 4% изофлуран и 4 Л / мин кислородного потока для крысы 250-350 г массы тела. Проверьте глубину анестезии из-за отсутствия педалей рефлексов при щипать нос животного.
- Поместите обезопаживаемую крысу на хирургическую доску так, чтобы ее левая боковая часть была обращена вверх. Поддержание анестезии при 2-3% вдыхании изофруранов через подходящий мундштук.
- Побрить кожу на левой боковой области и стерилизовать его с помощью повидонйского раствора йода.
- Сделайте поперечный разрез на бритой области кожи.
- Сделайте 1-2 см, вырезанный в перитонеальном слое, чтобы разоблачить селезенку.
- Аккуратно выняйте селезенку перитонеальной полости и поднимите ее с помощью двух увлажненных кончиков хлопка.
- Держите клетки (обычно 107 на животное), которые будут пересажены приостановлено в 50 МЛ IMDM средств массовой информации в 1 мл инсулина шприц с иглой 29 G.
- Аккуратно пронзите иглу в кору селезенки и отпустите суспензию клетки в селезенку в течение 2-3 мин.
- После пересадки клеток, тщательно вынуть иглу и мазок области прокола иглы с увлажненной кончик хлопка, чтобы избежать утечки клеточной подвески с сайта.
- Закройте перитонеум и кожу на 4-0 усваиваемый шов с непрерывным и прерывистым зашиванием соответственно.
- Нанесите раствор йода на кожу в месте швов, чтобы предотвратить заражение на оперируемом участке.
- Интраперитонеально вводят 1 мл объема 12 мг/мл антибиотика (например, цефотаксима) раствора и подкожно вводят анальгетик (например, мелоксикам) 1 мг/кг массы тела животному в рамках послеоперационного ухода. Переместите животное в теплую клетку для восстановления.
- Держите оперированного животного в изоляции в нормальных условиях 12 ч свет / темный цикл, пока хирургические раны полностью зажили. Это может занять 3-4 дня.
7. Характеристика развития ALF
- Эвтанизировать животных путем передозировки кетамина-ксилазина раствор 2 ч после2-й дозы лечения APAP и собирать образцы крови и тканей.
- Соберите сыворотку из крови для биохимических исследований32.
- Обработайте образцы тканей печени для гистологических и генных исследований экспрессии33,34,35.
Результаты
Процент выживаемости в животных моделях ALF
Оптимальная доза APAP, чтобы вызвать ALF в сочетании с 70% PHx была стандартизирована как 750 мг/кг массы тела. Режим лечения начался 24 ч после 70% PHx, когда животные полностью оправились от операции, и состоял из двух доз APAP с интервалом 24 ч. Смертность наблюдалась в размере 80% после введения второй дозы APAP, 48 ч после операции. Процент выживаемости был проанализирован и построен с помощью метода Каплан-Мейер(рисунок 1). Воспроизводимость во время смерти и период времени, предусмотренный этой моделью, делает ее подходящим кандидатом для изучения терапевтического вмешательства против ALF.
Для исследования были рассмотрены четыре группы животных: Группа 1 (контрольная группа, только соленая обработка), Группа 2 (только APAP при весе тела 750 мг/кг), Группа 3 (соленовая обработка с 70% PHx) и Группа 4 (APAP при 750 мг/кг массы тела с 70% PHx). Три животных были включены во все группы и два репрезентативных изображения включены из каждой группы. После введения2-й дозы соответствующего лечения животные из всех четырех групп были усыплены 2 ч. Образцы печени, взятые из всех четырех групп показали различные морфологии друг от друга. Группа 1 показала красновато-коричневую морфологию здоровой печени грызунов. Образцы печени группы 2 не показали явных признаков повреждения на морфологическом уровне и показали аналогичный внешний вид здоровой печени группы 1. Образцы печени, взятые из групп 3 и 4, не выглядели здоровыми и имели обесцвечивание и неоднородный вид. Обесцвечивание соответствует повреждению тканей печени и было более очевидным в группе 4. Репрезентативные данные представлены на рисунке 2.
Степень повреждения печени была определена путем проверки уровня сыворотки AL, AST и ALP ферментов36,37,38. Уровни ALT, AST и ALP показали заметные различия между четырьмя группами, соответствующие степени повреждения печени. Группа 4 показала значительное увеличение уровня AST и ALP по сравнению с группой 1(рисунок 3).
Для сравнения профиля экспрессии генов в контрольных и ALF-индуцированных группах, q-PCR анализ генов, участвующих в гибели клеток(Bax2, Caspase3, Fas) в образцах тканей печени было выполнено35,39. Было установлено, что они были upregulated в группе 3 по сравнению с контрольной группы 1, в то время как никакой разницы не было замечено в группе 2 и группы 4. Гены, которые, как известно, переэкспрессированы в ответ на травму печени (Mcp1 и Mmp2)33,40 были найдены, чтобы быть upregulated во всех трех группах по сравнению с контрольной группы 1. Mmp9 был upregulated в группах 3 и 4 в то время как группа 2 не показал заметное отличие от контрольной группы 1. Уровни экспрессии Timp1 и Timp234 были признаны более высокими в группе 3, но не показали заметного перевыражения в группе 4(рисунок 4).
Гены, участвующие в воспалении печени(Tnfa, IL1a, Tgfbr1, и IL1b)41,42,43,44 были обнаружены, чтобы быть переэкспрессированы в группе 3 по сравнению с контрольной группой 1, но их уровень экспрессии был снижен в группе 4. ALR переэкспрессирован в тканях печени после индукции травмы печени. Каскады этого гена ниже по течению помогают в регенерации печени. RIP1 белок необходим в APAP индуцированной токсичности. Было установлено, что ALR и RIP1 регулируются в группах 2 и 3 по сравнению с контрольной группой 1, в то время как их уровни остаются одинаковыми или ниже в группе 4. Альфа гладкий мышечный актин(aSMA), маркер чрезмерного осаждения ECM, что далее приводит к фиброзу, было установлено, что upregulated в группе 3 и 4 по сравнению с контрольной группы 1 (Рисунок 4). Данные экспрессии генов свидетельствуют о том, что вышеупомянутые биомаркеры воспаления и клеточной смерти, которые, как известно, переэкспрессированы во время травмы печени, регулируются в образцах тканей печени животных, в которых ALF был индуцирован предложенным методом, тем самым подтверждая возникновение травмы печени на молекулярном уровне.
Гематоксилин и эозин (Н И Э) окрашивание
Гематоксилин и эозин (H и E) окрашивание было сделано для оценки тяжести повреждения печени, наблюдая степень дегенерации гепатоцитов. Разделы тканей печени, окрашенные Н И Е, были подвергнуты слепому анализу третьей стороной. В 70% частичной гепатэктомии наблюдалась групповая везикулярная жировая дегенерация, а в апетаминофен группы перипортирующего воспаления и некроза наблюдалось наряду с мягким синусоидальным расширением. Везикулярная жировая дегенерация наблюдалась в основном в группе ALF(рисунок 5).
Протромбин время и уровень глюкозы в крови
Протромбин время (PT) является параметром, который зависит от активности печени синтезированных тканей тромбопластика и используется для характеристики эффективности механизма свертывания крови45. Как правило, увеличение PT наблюдается в условиях заболеваний, связанных с печенью. Было установлено, что PT значительно выше в группе, индуцированной ALF, по сравнению с контрольной группой. Было также установлено, что международное нормализованное соотношение (INR)45 также выше, что представляет собой дефект в механизме свертывания крови в результате неэффективной физиологии печени(рисунок 6).
Оценка выживаемости после трансплантации клеточных здоровых синеносических крысиных гепатоцитов
Важным критерием модели ALF является обратимость печеночной недостаточности при наличии терапевтического вмешательства. В текущем исследовании, 10 миллионов здоровых сингенных гепатоцитов крыс были пересажены инстраспленически наблюдать влияние клеточной трансплантационной терапии на печеночную недостаточность. Соответствующее количество клеток, которые должны быть пересажены, было определено путем наблюдения обратимости печеночной недостаточности после трансплантации различных номеров клеток (данные не показаны). Клетки были пересажены после введения1-й дозы APAP, и выживание было установлено, чтобы быть восстановлены у животных после трансплантации клеток(рисунок 7). Уровни сыворотки ферментов ALT, AST и ALP были признаны нормализованными после 10 дней трансплантации клеток(рисунок 8).

Рисунок 1: Процент выживаемости в группе, индуцированной ALF. Каплан-Мейер кривой выживания показаны процент выживания животных после индукции ALF с сочетанием 70% PHx и APAP дозы (750 мг/кг массы тела). Время 0 ч обозначает время 70% PHx. 1-й и2-й дозы APAP вводили 24 и 48 h после хирургического (n No 12, общее количество животных). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Репрезентативные изображения морфологии печени в четырех различных группах, включенных в исследование. Панели изображений A-D показывают морфологию печени различных групп после того, как усыпили 2 ч после2-й дозы соответствующего лечения. (A) Морфология печени контрольной группы 1, в которой был дан только солин. (B) Морфология печени группы 2, в которой только APAP был дан в дозе 750 мг/кг массы тела. (C) Морфология печени группы 3, в которой солин был дан после 70% PHx. (D) Морфология печени в группе 4, в которой APAP было дано после 70% PHx в дозе, аналогичной группе 3 (n - 3 животных в группе). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Сравнение биохимического профиля сыворотки в различных группах. Диаграммы адвокатов отражают среднее значение ALT, AST и ALP в образцах сыворотки четырех групп, включенных в исследование. Сыворотка была собрана 2 ч после2-й дозы соответствующего лечения. Бары ошибок - S.E.M; p qlt; 0.001; - стр. 0;; 0,05; n No 3. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
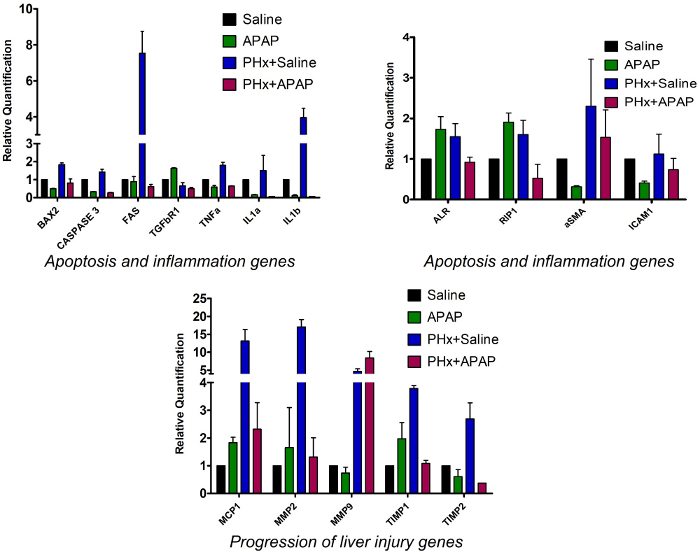
Рисунок 4: Профиль экспрессии гена образцов тканей печени. Бар графики представляют относительную количественную оценку мРНК выражение различных генов, участвующих в воспалении и смерти клеток в четырех группах подвергаются различным методам лечения. Все гены были нормализованы против выражения контроля Gapdh. Панель ошибок - стандартное погрешность трех различных образцов (n No 3). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Гистологическое исследование образцов тканей печени. Представитель гематоксилин и эозиновые окрашивающие изображения образцов тканей печени из четырех групп, включенных в исследование, как наблюдается под 200-кратным увеличением в яркой полевой микроскопии. В контрольной группе 1 были в основном нормальные гепатоциты с легким инфильтрацией перипорта (зеленые стрелки). В группе 3 (70% частичная гепатэктомия) наблюдалась везикулярная жировая дегенерация (белые стрелки), а в апетаминофен группы 2 перипорта воспаление (красные стрелки) и некроз были замечены наряду с мягким синусоидным дилатацией (желтыми стрелками). Макровезикулярная жировая дегенерация в основном наблюдалась в ГРУППе 4 ALF (оранжевые стрелки). Шкала бар 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: Сравнение протромбина (PT) и международного нормализованного коэффициента (INR). (A) Сравнение PT между контрольной группой 1 (солен инъекции после 70% PHx) и ALF-индуцированной группы 4 (APAP инъекции пост 70% PHx). Кровь была собрана 2 ч после2-й дозы соответствующего лечения и времени (в секундах), необходимых для формирования сгустка фибрина показано на оси Y (я п. (B) INR в ALF-индуцированной группы 4 по сравнению с контрольной группой 1. Было установлено, что среднее значение INR в группе 4 составило 2,28, что подпадает под действие противковарного эффекта(n No 5). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 7: Процент выживаемости в группе, индуцированной ALF после пересадки клеток. Кривая выживания Каплан-Мейер показывает процент выживаемости после здоровой трансплантации гепатоцитов в группе 4, вызванной ALF, по сравнению с контрольной группой 1 (n No 5). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
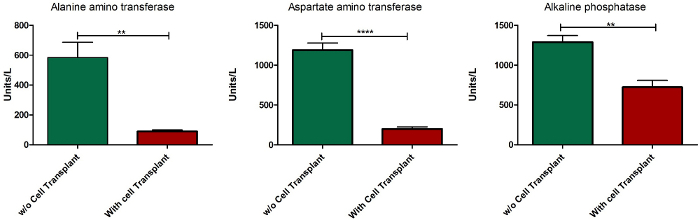
Рисунок 8: биохимический профиль сыворотки животных, индуцированных ALF, после пересадки клеток. Уровни сыворотки ферментов ALT, AST и ALP через 10 дней после пересадки клеток по сравнению с уровнями сыворотки усыпленных ALF животных после2-й дозы введения APAP. Панель ошибок - стандартная ошибка среднего значения пяти различных образцов; p qlt; 0.0001; П. n No 5. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Развитие соответствующей модели животных для ALF имеет первостепенное значение для лучшего понимания патогенеза и прогрессирования ALF. Хорошо характеризуется ALF животных модель также предоставляет возможность для разработки и испытания новых терапевтических подходов против ALF. Было предпринято много попыток разработать клинически актуальную модель ALF6,12,21,23,46,47,48. Большинство из этих исследований либо использовать хирургические процедуры или вызвать травму печени гепатотоксических химических веществ.
Трудно создать модель ALF только PHx, потому что PHx не будет отражать патологию ALF из-за отсутствия воспаления, вызванного некротической и апоптотической ткани. В терапевтических дозах АПАП полностью метаболизируется в процессах глюкоронации и сульфатации. При более высоких дозах, когда эти пути насыщены, APAP метаболизируется цитохромными ферментами p450, которые в основном синтезируются гепатоцитами, что приводит к образованию токсичного промежуточного, НАПЗИ (N-ацетил-п-бензохинон имин). При нормальных условиях НАПЗИ нейтрализуется запасами глутатиона (ГСГ) клеток, в то время как в супратерапевтических дозах он вызывает окислительный стресс у гепатоцитов, что приводит к смерти гепатоцитов4,24,46. Таким образом, путем объединения физиологических эффектов 70% PHx и APAP-индуцированной травмы печени, модель КРЫСы ALF была создана в текущем исследовании. Меньшее терапевтическое окно уменьшает период стресса на животное. В сочетании с меньшими дозами APAP, это приводит к лучшей воспроизводимости процедуры.
Доза APAP была выбрана для обеспечения подходящего терапевтического окна, в течение которого терапевтическое вмешательство может быть дано животному (т.е. в пределах 48 ч от1-й дозы и 24 ч2-й дозы). В течение 24 ч после2-й дозы APAP, 100% смертности наблюдалась. Однако время смерти в течение этого периода было переменным для каждого животного. Таким образом, с целью изучения развития ALF, животные были усыплены в стандартный момент времени 2 ч после2-й дозы APAP.
Время терапевтического вмешательства может быть определено в зависимости от индивидуального исследования и типа терапии изучается, который в текущем исследовании была трансплантация сингенных гепатоцитов крыс сразу после1-й дозы APAP, что позволяет клеткам достаточно времени для дома и привить. В нынешней модели, трансплантация по крайней мере 10 миллионов клеток требуется для успешного спасения от ALF.
Для обеспечения успеха хирургической процедуры следует рассмотреть несколько важных моментов. Рекомендуется использовать различные виды анестезии в различных хирургических процедурах. Для выполнения частичной гепатэктомии, коктейль из кетамина-ксилазина следует использовать в рекомендуемых дозах, потому что это дает достаточно времени для завершения хирургической процедуры. Во время пересадки клеток следует использовать ингаляционный анестезию изофлуран, поскольку она снижает физическую нагрузку на животных, вызванных АЛФ.
В заключение, из-за единого коэффициента смертности и удобного терапевтического окна, APAP и 70% PHx комбинированная модель была использована для изучения обратимости ALF путем трансплантации клеток. Для оценки обратимости ALF, 10 миллионов здоровых сингенных крысиных гепатоцитов были пересажены внутриспленически в ALF-индуцированных животных. После трансплантации, процент выживаемости было установлено, что увеличивается у ALF-индуцированных животных. Улучшение уровня в сыворотке крови АЛТ, АСТ и ALP также наблюдалось у животных после пересадки клеток, что свидетельствует о восстановлении метаболизма печени. Эта модель ЖИВОТНЫх ALF представляет собой альтернативу для оценки терапевтического потенциала клеток, преодолевая разрыв между острой печеночной недостаточностью и трансплантацией печени. Он также предоставляет возможность изучить повреждения печени, вызванные физической травмы и гепатотоксического агента.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана основным грантом, полученным от Департамента биотехнологии, правительства Индии Национальному институту иммунологии, Нью-Дели.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetaminophen (Biocetamol) | EG Pharmaceuticals | No specific Catalog Number (Local Procurement) | |
| Alkaline Phosphatase Kit (DEA) | Coral Clinical System, India | No specific Catalog Number (Local Procurement) | |
| Automated analyser | Tulip, Alto Santracruz, India | Screen Maaster 3000 | Biochemical analyser for liver functional test |
| Betadine (Povidon-Iodine Solution) | Win-Medicare; India | No specific Catalog Number (Local Procurement) | |
| Biological safety cabinet (Class I) | Kartos international; India | No specific Catalog Number (Local Procurement) | |
| Bright Field Microscope | Olympus, Japan | LX51 | |
| Cefotaxime (Taxim®) | AlKem; India | cefotaxime sodium injection, No specific Catalog Number (Local Procurement) | |
| Cell Strainer | Sigma; US | CLS431752 | |
| Collagenase Type I | Gibco by Life Technologies | 17100-017 | |
| Cotton Buds | Pure Swabs Pvt Ltd; India | No specific Catalog Number (Local Procurement) | |
| Drape Sheet | JSD Surgicals, Delhi, India | No specific Catalog Number (Local Procurement) | |
| DPX Mountant | Sigma; US | 6522 | |
| Eosin Y solution, alcoholic | Sigma; US | HT110132 | |
| Forceps | Major Surgicals; India | No specific Catalog Number (Local Procurement) | |
| Gas Anesthesia System | Ugo Basile; Italy | 211000 | |
| Glucose | Himedia, India | GRM077 | |
| Hair removing cream (Veet®) | Reckitt Benckiser, India | No specific Catalog Number (Local Procurement) | |
| Hematoxylin Solution, Mayer's | Sigma; US | MHS16 | |
| Heparin sodium salt | Himedia; India | RM554 | |
| Hyaluronidase From Sheep Testes | Sigma; US | H6254 | |
| I.V. Cannula (Plusflon) | Mediplus, India | Ref 1732411420 | |
| Insulin Syringes | BD; US | REF 303060 | |
| Isoflurane (Forane®) | Asecia Queenborough | No B506 | Inhalation Anaesthetic |
| Ketamine (Ketamax®) | Troikaa Pharmaceuticals Ltd. | Ketamine hydrochloride IP, No specific Catalog Number (Local Procurement) | |
| Meloxicam (Melonex®) | Intas Pharmaceuticals Ltd; India | No specific Catalog Number (Local Procurement) | |
| Micro needle holders straight & curved | Mercian; England | BS-13-8 | |
| Micro needle holders straight & curved | Mercian; England | BS-13-8 | |
| Microtome | Histo-Line Laboratories, Italy | MRS3500 | |
| Nylon Thread | Mighty; India | No specific Catalog Number (Local Procurement) | |
| Paraformaldehyde | Himedia; India | GRM 3660 | |
| Percoll® | GE Healthcare | 17-0891-01 | |
| Refresh Tears/Eyemist Gel | Allergan India Private Limited/Sun Pharma, India | P3060 | No specific Catalog Number |
| RPMI | Himedia; India | No specific Catalog Number (Local Procurement) | |
| Scalpel | Major Surgicals; India | No specific Catalog Number (Local Procurement) | |
| Scissors | Major Surgicals; India | No specific Catalog Number (Local Procurement) | |
| SGOT (ASAT) KIT | Coral Clinical System, India | No specific Catalog Number (Local Procurement) | |
| SGPT (ALAT) KIT | Coral Clinical System, India | No specific Catalog Number (Local Procurement) | |
| Shandon Cryotome E Cryostat | Thermo Electron Corporation; US | No specific Catalog Number | |
| Sucrose | Sigma; US | S0389 | |
| Surgical Blade No. 22 | La Medcare, India | No specific Catalog Number (Local Procurement) | |
| Surgical Board | Locally made | No specific Catalog Number (Local Procurement) | |
| Surgical White Tape | 3M India; India | 1530-1 | Micropore Surgical Tape |
| Sutures | Ethicon, Johnson & Johnson, India | NW 5047 | |
| Syringes (1ml, 26 G) | Dispo Van; India | No specific Catalog Number (Local Procurement) | |
| Trimmer (Clipper) | Philips | NL9206AD-4 DRACHTEN QT9005 | |
| Weighing Machine | Braun | No specific Catalog Number (Local Procurement) | |
| William's E Media | Himedia; India | AT125 | |
| Xylazine (Xylaxin®) | Indian Immunologicals Limited | Sedative, Pre-Anaesthetic, Analgesic and muscle relaxant |
Ссылки
- Polson, J., Lee, W. M. AASLD position paper: the management of acute liver failure. Hepatology. 41, 1179-1197 (2005).
- Chung, R. T., et al. Pathogenesis of liver injury in acute liver failure. Gastroenterology. 143, 1-7 (2012).
- Fyfe, B., Zaldana, F., Liu, C. The Pathology of Acute Liver Failure. Clinical Liver Disease. 22, 257-268 (2018).
- Lefkowitch, J. H. The Pathology of Acute Liver Failure. Advances in Anatomic Pathology. 23, 144-158 (2016).
- Mitchell, J. R., et al. Acetaminophen-induced hepatic necrosis. I. Role of drug metabolism. Journal of Pharmacology and Experimental Therapeutics. 187, 185-194 (1973).
- Rahman, T. M., Hodgson, H. J. Animal models of acute hepatic failure. International Journal of Clinical and Experimental Pathology. 81, 145-157 (2000).
- Rahman, T. M., Selden, A. C., Hodgson, H. J. A novel model of acetaminophen-induced acute hepatic failure in rabbits. Journal of Surgical Research. 106, 264-272 (2002).
- Dashti, H., et al. Thioacetamide- and carbon tetrachloride-induced liver cirrhosis. European Surgical Research. 21, 83-91 (1989).
- Demirdag, K., et al. Role of L-carnitine in the prevention of acute liver damage-induced by carbon tetrachloride in rats. Journal of Gastroenterology and Hepatology. 19, 333-338 (2004).
- Sheweita, S. A., Abd El-Gabar, M., Bastawy, M. Carbon tetrachloride-induced changes in the activity of phase II drug-metabolizing enzyme in the liver of male rats: role of antioxidants. Toxicology. 165, 217-224 (2001).
- Sinicrope, R. A., Gordon, J. A., Little, J. R., Schoolwerth, A. C. Carbon tetrachloride nephrotoxicity: a reassessment of pathophysiology based upon the urinary diagnostic indices. American Journal of Kidney Diseases. 3, 362-365 (1984).
- Takada, Y., Ishiguro, S., Fukunaga, K. Large-animal models of fulminant hepatic failure. Journal of Artificial Organs. 6, 9-13 (2003).
- Takada, Y., et al. Increased intracranial pressure in a porcine model of fulminant hepatic failure using amatoxin and endotoxin. Journal of Hepatology. 34, 825-831 (2001).
- Leist, M., Wendel, A. A novel mechanism of murine hepatocyte death inducible by concanavalin A. Journal of Hepatology. 25, 948-959 (1996).
- Mizuhara, H., et al. Strain difference in the induction of T-cell activation-associated, interferon gamma-dependent hepatic injury in mice. Hepatology. 27, 513-519 (1998).
- Bruck, R., et al. Hypothyroidism minimizes liver damage and improves survival in rats with thioacetamide-induced fulminant hepatic failure. Hepatology. 27, 1013-1020 (1998).
- Chieli, E., Malvaldi, G. Role of the microsomal FAD-containing monooxygenase in the liver toxicity of thioacetamide S-oxide. Toxicology. 31, 41-52 (1984).
- Fontana, L., et al. Serum amino acid changes in rats with thioacetamide-induced liver cirrhosis. Toxicology. 106, 197-206 (1996).
- Peeling, J., et al. Cerebral metabolic and histological effects of thioacetamide-induced liver failure. American Journal of Physiology. 265, 572-578 (1993).
- Blitzer, B. L., et al. A model of fulminant hepatic failure in the rabbit. Gastroenterology. 74, 664-671 (1978).
- Diaz-Buxo, J. A., Blumenthal, S., Hayes, D., Gores, P., Gordon, B. Galactosamine-induced fulminant hepatic necrosis in unanesthetized canines. Hepatology. 25, 950-957 (1997).
- Maezono, K., Mawatari, K., Kajiwara, K., Shinkai, A., Maki, T. Effect of alanine on D-galactosamine-induced acute liver failure in rats. Hepatology. 24, 1211-1216 (1996).
- Patzer, J. F., et al. D-galactosamine based canine acute liver failure model. Hepatobiliary & Pancreatic Diseases International. 1, 354-367 (2002).
- Newsome, P. N., Plevris, J. N., Nelson, L. J., Hayes, P. C. Animal models of fulminant hepatic failure: a critical evaluation. Liver Transplantation. 6, 21-31 (2000).
- Yoon, E., Babar, A., Choudhary, M., Kutner, M., Pyrsopoulos, N. Acetaminophen-Induced Hepatotoxicity: a Comprehensive Update. Journal of Clinical and Translational Hepatology. 4, 131-142 (2016).
- Das, B., et al. Intrasplenic Transplantation of Hepatocytes After Partial Hepatectomy in NOD.SCID Mice. Journal of Visualized Experiments. , (2018).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3, 1167-1170 (2008).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43, 506-520 (1969).
- Fry, J. R., Jones, C. A., Wiebkin, P., Bellemann, P., Bridges, J. W. The enzymic isolation of adult rat hepatocytes in a functional and viable state. Analytical Biochemistry. 71, 341-350 (1976).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell Tissue Bank. 18, 597-604 (2017).
- Ismail, T., et al. Growth of normal human hepatocytes in primary culture: effect of hormones and growth factors on DNA synthesis. Hepatology. 14, 1076-1082 (1991).
- Greenfield, E. A. Sampling and Preparation of Mouse and Rat Serum. Cold Spring Harbor Protocols. 11, (2017).
- Walsh, K. M., Timms, P., Campbell, S., MacSween, R. N., Morris, A. J. Plasma levels of matrix metalloproteinase-2 (MMP-2) and tissue inhibitors of metalloproteinases -1 and -2 (TIMP-1 and TIMP-2) as noninvasive markers of liver disease in chronic hepatitis C: comparison using ROC analysis. Digestive Diseases and Sciences. 44, 624-630 (1999).
- Thiele, N. D., et al. TIMP-1 is upregulated, but not essential in hepatic fibrogenesis and carcinogenesis in mice. Scientific Reports. 7, 714 (2017).
- Li, C. P., Li, J. H., He, S. Y., Li, P., Zhong, X. L. Roles of Fas/Fasl, Bcl-2/Bax, and Caspase-8 in rat nonalcoholic fatty liver disease pathogenesis. Genetics and Molecular Research. 13, 3991-3999 (2014).
- Kim, W. R., Flamm, S. L., Di Bisceglie, A. M., Bodenheimer, H. C. Serum activity of alanine aminotransferase (ALT) as an indicator of health and disease. Hepatology. 47, 1363-1370 (2008).
- Henry, L. Serum transaminase levels in liver disease. Journal of Clinical Pathology. 12, 131-137 (1959).
- Giannini, E. G., Testa, R., Savarino, V. Liver enzyme alteration: a guide for clinicians. Canadian Medical Association Journal. 172, 367-379 (2005).
- Hammam, O., et al. The role of fas/fas ligand system in the pathogenesis of liver cirrhosis and hepatocellular carcinoma. Hepatitis Monthly. 12, 6132 (2012).
- Prystupa, A., et al. Activity of MMP-2, MMP-8 and MMP-9 in serum as a marker of progression of alcoholic liver disease in people from Lublin Region, eastern Poland. The Annals of Agricultural and Environmental Medicine. 22, 325-328 (2015).
- Sekiyama, K. D., Yoshiba, M., Thomson, A. W. Circulating proinflammatory cytokines (IL-1 beta, TNF-alpha, and IL-6) and IL-1 receptor antagonist (IL-1Ra) in fulminant hepatic failure and acute hepatitis. Clinical and Experimental Immunology. 98, 71-77 (1994).
- Schwabe, R. F., Brenner, D. A. Mechanisms of Liver Injury. I. TNF-alpha-induced liver injury: role of IKK, JNK, and ROS pathways. American Journal of Physiology-Gastrointestinal and Liver Physiology. 290, 583-589 (2006).
- Ataseven, H., et al. The levels of ghrelin, leptin, TNF-alpha, and IL-6 in liver cirrhosis and hepatocellular carcinoma due to HBV and HDV infection. Mediators of Inflammation. 2006, 78380 (2006).
- Ambrosino, G., et al. Cytokines and liver failure: modification of TNF- and IL-6 in patients with acute on chronic liver decompensation treated with Molecular Adsorbent Recycling System (MARS). Acta Bio Medica Atenei Parmensis. 74, 7-9 (2003).
- Robert, A., Chazouilleres, O. Prothrombin time in liver failure: time, ratio, activity percentage, or international normalized ratio. Hepatology. 24, 1392-1394 (1996).
- Francavilla, A., et al. A dog model for acetaminophen-induced fulminant hepatic failure. Gastroenterology. 96, 470-478 (1989).
- Terblanche, J., Hickman, R. Animal models of fulminant hepatic failure. Digestive Diseases and Sciences. 36, 770-774 (1991).
- Tunon, M. J., et al. Rabbit hemorrhagic viral disease: characterization of a new animal model of fulminant liver failure. Journal of Laboratory and Clinical Medicine. 141, 272-278 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены