Method Article
Generierung eines Rattenmodells für akutes Leberversagen durch Kombination von 70% partieller Hepatektomie und Acetaminophen
In diesem Artikel
Zusammenfassung
Das in der aktuellen Studie entwickelte Modell für akutes Leberversagen stellt eine praktikable Alternative zur Untersuchung potenzieller Therapien dar. Das aktuelle Modell nutzt die kombinierte Wirkung von körperlichen und drogeninduzierten Leberverletzungen und bietet ein geeignetes Zeitfenster, um das Potenzial neuartiger Therapien zu untersuchen.
Zusammenfassung
Akutes Leberversagen (ALF) ist ein klinischer Zustand, der durch verschiedene Ätiologien verursacht wird, was zum Verlust von metabolischen, biochemischen, synthetisierenden und entgiftenden Funktionen der Leber führt. In den meisten irreversiblen Leberschäden, orthotrope Lebertransplantation (OLT) bleibt die einzige verfügbare Behandlung. Um das therapeutische Potenzial einer Behandlung für ALF zu untersuchen, ist ihre vorherige Prüfung in einem Tiermodell von ALF unerlässlich. In der aktuellen Studie wurde ein ALF-Modell bei Ratten entwickelt, indem 70% partielle Hepatectomie (PHx) und Injektionen von Acetaminophen (APAP) kombiniert wurden, das ein therapeutisches Fenster von 48 h bietet. Die medianen und linken seitlichen Lappen der Leber wurden entfernt, um 70% der Lebermasse zu verbrauchen und APAP wurde 24 h postchirurgisch für 2 Tage gegeben. Das Überleben bei ALF-induzierten Tieren wurde als stark verringert. Die Entwicklung von ALF wurde durch veränderte Serumspiegel der Enzyme Alanin-Aminotransferase (ALT), Aspartat-Aminotransferase (AST), alkalische Phosphatase (ALP); Veränderungen der Prothrombinzeit (PT); und Bewertung des international normalisierten Verhältnisses (INR). Die Untersuchung des Genexpressionsprofils durch qPCR ergab einen Anstieg der Expressionskonzentrationen von Genen, die an Apoptose, Entzündungen und am Fortschreiten der Leberverletzung beteiligt sind. Diffuse Degeneration von Hepatozyten und Infiltration von Immunzellen wurde durch histologische Auswertung beobachtet. Die Reversibilität von ALF wurde durch die Wiederherstellung des Überlebens- und Serumspiegels von ALT, AST und ALP nach intrasplenischer Transplantation syngenischer gesunder Rattenhepatozyten bestätigt. Dieses Modell stellt eine zuverlässige Alternative zu den verfügbaren ALF-Tiermodellen dar, um die Pathophysiologie von ALF zu untersuchen und das Potenzial einer neuartigen Therapie für ALF zu bewerten. Die Verwendung von zwei verschiedenen Ansätzen ermöglicht es auch, die kombinierte Wirkung von körperlichen und drogeninduzierten Leberverletzungen zu untersuchen. Die Reproduzierbarkeit und Durchführbarkeit des laufenden Verfahrens ist ein zusätzlicher Vorteil des Modells.
Einleitung
Akutes Leberversagen (ALF) wird von der American Association for the Study of Liver Diseases als schnelle Entwicklung akuter Leberschäden ohne vorherige Anzeichen von Schäden definiert und ist durch eine schwere Beeinträchtigung der synthetischen, metabolischen und entgiftenden Funktionen der Leber gekennzeichnet1. ALF unterscheidet sich von chronischem Leberversagen, bei dem das Versagen als Folge von Leberschäden über einen langen Zeitraum verursacht und von akutem chronischem Leberversagen (ACLF), wo abrupte Leberschäden als Folge von chronischen Lebererkrankungen2,3,4. Die einzige verfügbare Heilung für ALF ist orthotopische Lebertransplantation (OLT), oder der Tod kann auftreten. Aufgrund des Mangels an Leberspendern ist die Sterblichkeitsrate bei Patienten mit ALF sehr hoch.
Um das Potenzial alternativer therapietherapeutischer Ansätze zu untersuchen und die Pathophysiologie von ALF besser zu verstehen, sind Tiermodelle erforderlich, die die ALF beim Menschen widerspiegeln können. Viele der bereits verfügbaren ALF-Tiermodelle weisen einige Mängel auf. Acetaminophen (APAP) Effekte sind schwer zu reproduzieren, haben aber die engsten Ähnlichkeiten in Bezug auf zeitliche, klinische, biochemische und pathologische Parameter. APAP-induzierte Tiermodelle stoßen häufig auf Probleme aufgrund des Vorhandenseins von Methemoglobinämie, die durch die Oxidation von Hämoglobin durch APAP und seine Zwischenprodukte5,6,7verursacht wird. Ein weiteres Problem ist die mangelnde Reproduzierbarkeit, die sich in unvorhersehbaren Dosisreaktionen und dem Zeitpunkt des Todes widerspiegelt. Die ALF-Tiermodelle, die mit Tetrachlorkohlenstoff (CCl4) hergestellt wurden, haben eine schlechte Reproduzierbarkeit8,9,10,11. Concavalin A (Con A) und Lipoplysaccharid (LPS)-induzierte ALF-Tiermodelle spiegeln nicht das klinische Muster der menschlichen Krankheit wider, obwohl sie Vorteile in der Untersuchung von zellulären Mechanismen haben, die an Autoimmunlebererkrankungen beteiligt sind, und in der Studie von Sepsis bzw.12,13,14,15. In ähnlicher Weise erfordert Thioacetamid (TAA) auch eine Biotransformation zu einem aktiven Metaboliten Thioacetamidsulfoxid und zeigt Artenvariation16,17,18,19. D-Galactosamin (D-Gal) produziert einige biochemische, metabolische und physiologische Veränderungen ähnlich ALF, ist aber nicht in der Lage, den gesamten alf pathologischen Zustand20,21,22,23widerzuspiegeln. Es gab nur sehr wenige Versuche, zwei oder mehr dieser Methoden zu kombinieren, um ein ALF-Modell zu entwickeln, das in der Lage ist, das ALF-Syndrom besser widerzuspiegeln13. Daher sind weitere Studien erforderlich, um ein Modell zu entwickeln, das die Krankheitsparameter widerspiegeln kann, eine bessere Reproduzierbarkeit hat und genügend Zeit bietet, um die Auswirkungen einer therapeutischen Intervention zu untersuchen.
In der aktuellen Studie wurde ein alternatives ALF-Modell bei Ratten durch die Kombination der Wirkungen der partiellen Hepatektomie (PHx) und niedrigeren Dosen eines hepatotoxischen Reagenzes geschaffen. APAP hat eine etablierte Rolle bei der Entstehung von Leberschäden5,24,25. Es ist ein weit verbreitetes Schmerzmittel und ist toxisch für die Leber in supratherapeutischen Dosen durch die Bildung von toxischen Metaboliten. APAP ist die Ursache für viele Todesfälle in den Industrieländern. Körperliche Verletzungen durch partielle Hepatektomie initiieren Aktivierung verschiedener Prozesse bei Entzündungen sowie Leberregeneration. Die Injektion des hepatotoxischen Mittels APAP verursacht eine feindliche Umgebung in der Leber und verhindert die Proliferation von Hepatozyten. Dies reduziert die Belastungszeit für das Tier, was in Kombination mit kleineren Dosen von Hepatotoxin zu einer besseren Reproduzierbarkeit des Verfahrens führt. Daher wurde mit diesem Modell eine kombinatorische Wirkung von zwei Arten von Leberverletzungen untersucht. Um das entwickelte ALF-Tiermodell zu charakterisieren, wurden physiologische und biochemische Parameter untersucht. Die erfolgreiche Reversibilität von ALF wurde durch die Transplantation syngenischer gesunder Rattenhepatozyten bestätigt.
Protokoll
Das unten beschriebene Verfahren wurde von der Institutional Animal Ethics Committee of National Institute of Immunology, Neu-Delhi, genehmigt. Die Seriennummer der Zulassung lautet IAEC-355/14.
1. Vorbereitung
- Bereiten Sie sich auf den chirurgischen Eingriff vor, wie zuvor von Das B et al.26beschrieben.
- Verwenden Sie 6–8 Wochen alte inzuchtige Wistar-Ratten mit einem Körpergewicht von 200–250 g.
- Die Tiere unter normalen Tierpflegebedingungen unterbringen und vor und nach dem Eingriff mit Ratten-Chow und Libitum füttern.
- Verwenden Sie bei der Ausführung von 70 % PHx eine Standard-Cocktailmischung aus Ketaminhydrochlorid (100 mg/kg Körpergewicht) und Xylazin (10 mg/kg Körpergewicht), der intraperitoneal injiziert wird.
HINWEIS: Die Art des verwendeten Anästhetikums kann postoperative Auswirkungen auf die Sterblichkeit und Morbidität haben. - Verwenden Sie während der Zelltransplantation die anhalante Anästhesie Isoflurane (2-Chlor-2-(Difluormethoxy)-1,1,1-Trifluor-Ethan), um die Zeit der Genesung des Tieres nach der Transplantationsoperation zu verkürzen.
- Induzieren und pflegen Sie die inhalative Anästhesie mit einem maßgeschneiderten Anästhesiesystem. Halten Sie den Sauerstoffstrom bei 4 L/min. Zur Induktion sofluranbei bei 4% und zur Wartung 2–3% während des chirurgischen Eingriffs.
2. Präoperative Verfahren
- Anästhetisieren Sie die Ratte, indem Sie die in Schritt 3.1 beschriebene Ketamin-Xylazin-Mischung intraperitoneal injizieren. Bestätigen Sie die vollständige Anästhesisierung, indem Sie die Zehen des Tieres kneifen. Weitere Eingriffe werden nur durchgeführt, wenn kein Pedalreflex vorhanden ist.
- Um die Austrocknung der Hornhaut zu verhindern, wenden Sie einen carboxy Methyl-Zellulose-basierten Augentropfen auf beide Augen an.
- Halten Sie das anästhesierte Tier mit weißem Klebeband auf ein operationsgestütztes Brett zurück. Platzieren Sie das Tier mit der Bauchseite nach oben, um sicherzustellen, dass sich der Mund auf der distalen Seite der Person befindet, die die Operation durchführt.
- Entfernen Sie Das Haar aus dem rechten Rechten Bauchchirurgiebereich mit einem elektrischen Clipper.
- Desinfizieren Sie die chirurgische Stelle durch drei abwechselnde Peelings von Povidon-Jod und 70% Ethanol mit sterilisierten Wattepads in kreisförmiger Bewegung.
3. Partielle Hepatektomie (PHx), um 70% der Lebermasse zu entfernen
HINWEIS: Führen Sie den gesamten chirurgischen Eingriff unter einer sterilen Umgebung in einer laminaren Durchflusshaube durch. Verwenden Sie nur sterile chirurgische Instrumente, um das Infektionsrisiko postchirurgisch zu minimieren. Die Entfernung von 70% der Lebermasse, genannt 70% partielle Hepatektomie (70% PHx), wurde durchgeführt, wie von C. Mitchell und H. Willenbring beschrieben, 200827.
- Bestätigen Sie vor Beginn der Operation die vollständige Anästhesisierung des Tieres, indem Sie den Zehen kneifen. Weitere Eingriffe werden nur durchgeführt, wenn kein Pedalreflex vorhanden ist.
- Markieren Sie die Haut, die direkt unter dem Brustbein geschnitten werden soll, senkrecht zum Xiphoid und parallel zum Brustkorb.
- Legen Sie ein steriles Drapat mit einer Öffnung von ca. 3 cm x 1 cm über die markierte Haut.
- Führen Sie einen Querschnitt von etwa 2–3 cm entlang der markierten Linie mit einem Skalpell durch. Verwenden Sie die chirurgische Klinge Nr. 22. Entfernen Sie vorsichtig die Befestigung der Haut an der darunter liegenden Muskelschicht in der Nähe des eingeschnittenen Bereichs mit sterilen befeuchteten Baumwollspitzen.
- Als nächstes machen Sie einen Querschnitt durch die Peritonealschicht direkt unter dem xiphoiden Prozess.
- Mit Hilfe von zwei kochigen befeuchteten Baumwollspitzen, entlarven Sie den linken Leberlappen, indem Sie sanften Druck auf den Thorax ausüben. Legen Sie eine Baumwollspitze auf den Zwerchfellbereich des eingeschnittenen Teils und die andere Baumwollspitze unterhalb des eingeschnittenen Bereichs, um den Leberlappen nach oben zu heben.
- Schieben Sie eine 8–10 cm lange sterile Nylonfadenschlaufe (Größe 4–0, 0,15 mm Durchmesser) um den exponierten Leberlappen. Nehmen Sie die Schleife an die Basis des Lappens in der Nähe des Hilums mit Hilfe von mikrosezierenden Zangen oder befeuchteten Baumwollknospen.
- Mit Hilfe des Mikrochirurgie-Nadelhalters und der Mikrozange binden Sie die beiden Enden der Schleife, indem Sie den Knoten so nah wie möglich an die Basis des Lappens legen, um das Blutgefäß zu verengen und Blutungen zu reduzieren, nachdem der Leberlappen entfernt wurde. Binden Sie zwei zusätzliche Knoten auf der anderen Seite.
- Seien Sie vorsorglich, um den Knoten nicht zu nah an die nahe gelegenen Blutgefäße zu binden, was sonst zu venösen Obstruktionen (Stenose) führen kann.
- Verwenden Sie eine Mikrochirurgie-Schere, um den gebundenen Lappen knapp über dem Knoten zu schneiden, der eine verfärbte Gewebemasse hinterlässt, die als ischämischer Stumpf anstelle des Lappens bezeichnet wird.
HINWEIS: Die Rattenleber ist, wie die von Mäusen, in vier verschiedene Lappen unterteilt: den Medianlappen, den rechten Seitenlappen, den linken Seitenlappen und den Caudatelappen, die etwa 40 %, 20 %, 30 % bzw. 7 % der gesamten Lebermasse ausmachen. Jede Kombination dieser Lappen kann entfernt werden, um 70% Lebermasse verbrauchen. In der aktuellen Studie wurden der Medianlappen und die linken Seitenlappen entfernt. - Lokalisieren Sie den Mittleren Lappen vorsichtig, ohne den verbleibenden Stumpf des linken Seitenlappens zu beschädigen. Ziehen Sie es vorsichtig aus der Bauchhöhle, und an der Basis des Lappens binden Sie einen 8–10 cm langen Nylonfaden (Größe 4–0) Knoten, wie bereits erwähnt. Binden Sie zwei zusätzliche Knoten auf der anderen Seite. Unter Allen genannten Vorsichtsmaßnahmen müssen Sie vorsichtig verbrauchen und den gebundenen Mittellappen entfernen.
- Nach dem Entfernen der Lappen, Nähen Sie das Peritoneum mit einer resorbierbaren chromischen 4:0-Nähte mit kontinuierlichen Stichen, gefolgt von Haut nähen mit einer unterbrochenen Naht.
- Tragen Sie Povidon-Jod auf die Haut rund um die Nähte auf, um eine Infektion zu verhindern.
- Entfernen Sie das Drapat und entfernen Sie das Tier vom Operationsbrett.
4. Postoperative Pflege bei Tieren
- Intraperitoneal injizieren Sie das Tier mit einer Dosis von 12 mg Cefotaxam-Antibiotikum in 1 ml 5% Glukoselösung mit einer 1 ml Spritze, um es vor dem Risiko einer postoperativen Infektion zu schützen.
- Verabreichen Sie eine subkutane Injektion von schmerzstillendem Meloxicam (1 mg/kg Körpergewicht) zur Schmerzlinderung nach der Operation und folgen Sie ihr durch zwei weitere Dosen, wobei das Regime als eine Dosis pro Tag erhalten bleibt.
- Die betriebenen Tiere unter Standardbedingungen von 12 h Licht/Dunkel-Zyklus unterbringen und in regelmäßigen Abständen überwachen.
5. Injektion von Medikamenten bei teilweise hepatectomisierten Tieren, um Leberversagen zu induzieren
- Nach 24 h Postchirurgie, wenn die Tiere erfolgreich von 70% PHx erholt haben, messen Sie das Körpergewicht des Tieres gefolgt von den Injektionen.
- Injizieren Sie 750 mg/kg Körpergewicht von APAP intraperitoneal bei teilweise hepatectomisierten Tieren 24 h nach dem 70% PHx nach erfolgreicher Genesung der Tiere vom chirurgischen Eingriff. Wiederholen Sie die Dosis nach 24 h erneut.
HINWEIS: Zwei Dosen APAP werden dem Tier intraperitoneal verabreicht (d. h. 24 h bzw. 48 h nach dem 70% PHx-Verfahren). - Messen Sie zu jedem Zeitpunkt nach der Injektion von APAP das Körpergewicht des genesenden Tieres.
HINWEIS: APAP (Biocetamol) wird bei Tieren als 150 mg/ml-Lösung in 2% Benzylalkohol injiziert.
6. Transplantation gesunder Hepatozyten in ALF-Tiermodellen
HINWEIS: Um die Reversibilität von ALF bei Ratten zu untersuchen, transplantieren Sie gesunde syngene Rattenhepatozyten intrasplenisch bei den ALF-induzierten Tieren zusammen mit der1. Dosis von APAP. In der aktuellen Studie, um genügend Zeit für die transplantierten Zellen für Homing und Engraftment zu bieten, wurde die Transplantation kurz nach der1. Dosis von APAP durchgeführt. Rattenhepatozyten werden durch ein Protokoll isoliert, das zuerst von Berry and Friends et al.28 veröffentlicht und später in verschiedenen anderen Studien29,30,31 mit einigen Modifikationen angepasst wurde. Für intrasplenische Transplantation von Zellen im ALF-Tiermodell, folgen Sie den unten genannten Schritten.
- Die Ratte zur Induktion der Anästhesie mit 4% Isofluran und 4 L/min Sauerstoffdurchfluss für eine Ratte von 250–350 g Körpergewicht in eine Poly-Methacrylat-Kammer geben. Überprüfen Sie die Tiefe der Anästhesie durch den Mangel an Pedalreflexen beim Kneifen der Zehen des Tieres.
- Legen Sie die anästhesierte Ratte so auf das Operationsbrett, dass ihr linker seitenteil nach oben gerichtet ist. Halten Sie die Anästhesie bei 2–3% Isofluran-Inhalation durch ein geeignetes Mundstück aufrecht.
- Rasieren Sie die Haut auf der linken Seitenregion und sterilisieren Sie sie mit Povidon Jodlösung.
- Machen Sie einen Querschnitt auf den rasierten Bereich der Haut.
- Machen Sie einen 1-2 cm großen Schnitt in der Peritonealschicht, um die Milz freizulegen.
- Nehmen Sie vorsichtig die Milz der Peritonealhöhle heraus und heben Sie sie mit Hilfe von zwei befeuchteten Baumwollspitzen an.
- Bewahren Sie die Zellen (in der Regel 107 pro Tier) auf, die in 50 L IMDM-Medien in einer 1 ml Insulinspritze mit einer 29 G-Nadel transplantiert werden.
- Pierce die Nadel vorsichtig in den Milzkortex und lassen Sie die Zellsuspension innerhalb von 2-3 min in die Milz.
- Nach Abschluss der Zelltransplantation nehmen Sie vorsichtig die Nadel heraus und tupferen Sie den Bereich der Nadelpunktion mit einer befeuchteten Baumwollspitze, um ein Auslaufen der Zellsuspension von der Stelle zu vermeiden.
- Schließen Sie das Peritoneum und die Haut durch eine 4:0-absorbierbare Naht mit kontinuierlicher bzw. diskontinuierlicher Naht.
- Tragen Sie Povidon Jodlösung auf die Haut an der Stelle der Nähte, um eine Infektion auf der operierten Stelle zu verhindern.
- Intraperitoneal injizieren 1 ml Volumen von 12 mg/ml Antibiotikum (z. B. Cefotaxim) Lösung und subkutan injiziert analgetisch (z. B. Meloxicam) 1 mg/kg Körpergewicht in das Tier als Teil der postoperativen Pflege. Bewegen Sie das Tier in einen warmen, sich erholenden Käfig.
- Halten Sie das operierte Tier unter normalen Bedingungen von 12 h Hell/Dunkel-Zyklus isoliert, bis die chirurgischen Wunden vollständig geheilt sind. Dies kann 3 bis 4 Tage dauern.
7. Charakterisierung der ALF-Entwicklung
- Euthanisieren Sie die Tiere durch Überdosierung der Ketamin-Xylazin-Lösung 2 h nach der2. Dosis der APAP-Behandlung und sammeln Sie Blut- und Gewebeproben.
- Serum aus Blut für biochemische Studien sammeln32.
- Verarbeiten Lebergewebeproben für histologische und Genexpressionsstudien33,34,35.
Ergebnisse
Überlebensprozentsatz in Tiermodellen von ALF
Die optimale Dosis von APAP, die ALF in Kombination mit 70% PHx verursachte, wurde als 750 mg/kg Körpergewicht standardisiert. Das Behandlungsschema begann 24 h nach 70% PHx, als sich die Tiere vollständig von der Operation erholt hatten, und bestand aus zwei APAP-Dosen in 24-Stunden-Intervallen. Die Sterblichkeit wurde mit einer Rate von 80% nach der Verabreichung der zweiten Dosis von APAP, 48 h nach der Operation beobachtet. Der Überlebensprozentsatz wurde mit der Kaplan-Meier-Methode analysiert und geplottet (Abbildung 1). Die Reproduzierbarkeit in der Todeszeit und dem Zeitraum dieses Modells macht es zu einem geeigneten Kandidaten für das Studium einer therapeutischen Intervention gegen ALF.
Für die Studie wurden vier Gruppen von Tieren berücksichtigt: Gruppe 1 (Kontrollgruppe, nur Saline-Behandlung), Gruppe 2 (nur APAP bei 750 mg/kg Körpergewicht), Gruppe 3 (Salinebehandlung mit 70 % PHx) und Gruppe 4 (APAP bei 750 mg/kg Körpergewicht mit 70 % PHx). Jeweils drei Tiere wurden in alle Gruppen aufgenommen, und zwei repräsentative Bilder sind aus jeder Gruppe enthalten. Tiere aus allen vier Gruppen wurden 2 h nach Verabreichung der2. Dosis der jeweiligen Behandlung eingeschläfert. Leberproben aus allen vier Gruppen zeigten eine ausgeprägte Morphologie voneinander. Gruppe 1 zeigte die rötlich-braune Morphologie einer gesunden Nagetierleber. Leberproben der Gruppe 2 zeigten keine offensichtlichen Anzeichen einer Schädigung auf morphologischer Ebene und zeigten ein ähnliches Aussehen wie die gesunden Lebern der Gruppe 1. Leberproben aus den Gruppen 3 und 4 erschienen nicht gesund und hatten Verfärbungen und ein lückenhaftes Aussehen. Die Verfärbung entspricht der Schädigung im Lebergewebe und war in Gruppe 4 deutlicher zu erkennen. Repräsentative Daten sind in Abbildung 2dargestellt.
Das Ausmaß der Leberverletzung wurde durch die Überprüfung der Serumspiegel der ALT-, AST- und ALP-Enzyme36,37,38bestimmt. Die Werte von ALT, AST und ALP zeigten deutliche Unterschiede zwischen den vier Gruppen, die dem Ausmaß der Leberschäden entsprachen. Gruppe 4 verzeichnete einen deutlichen Anstieg der AST- und ALP-Werte im Vergleich zu Gruppe 1 (Abbildung 3).
Um das Genexpressionsprofil in Kontroll- und ALF-induzierten Gruppen zu vergleichen, wurde die q-PCR-Analyse von Genen durchgeführt, die am Zelltod beteiligt waren (Bax2, Caspase3, Fas) in Lebergewebeproben35,39. Diese wurden in Gruppe 3 im Vergleich zur Kontrollgruppe 1 hochreguliert, während in Gruppe 2 und Gruppe 4 kein Unterschied zu verzeichnen war. Gene, von denen bekannt ist, dass sie als Reaktion auf Leberverletzungen überexprimiert werden (Mcp1 und Mmp2)33,40 wurden in allen drei Gruppen im Vergleich zu Kontrollgruppe 1 hochreguliert. Mmp9 wurde in den Gruppen 3 und 4 reguliert, während Gruppe 2 keinen deutlichen Unterschied zur Kontrollgruppe 1 aufwies. Die Expressionswerte von Timp1 und Timp234 waren in Gruppe 3 höher, zeigten aber in Gruppe 4 keine deutliche Überexpression (Abbildung 4).
Gene, die an einer Entzündung der Leber beteiligt sind (Tnfa, IL1a, Tgfbr1 und IL1b)41,42,43,44 wurden in Gruppe 3 im Vergleich zu Kontrollgruppe 1 überexprimiert, aber ihr Expressionsniveau wurde in Gruppe 4 verringert. ALR wird nach der Induktion einer Leberverletzung im Lebergewebe überexprimiert. Die nachgeschalteten Kaskaden dieses Gens helfen bei der Leberregeneration. RIP1-Protein ist bei APAP-induzierter Toxizität notwendig. AlR und RIP1 wurden in den Gruppen 2 und 3 im Vergleich zur Kontrollgruppe 1 hochreguliert, während ihre Werte in Gruppe 4 ähnlich oder niedriger bleiben. Alpha-Glattmuskelaktin (aSMA), ein Marker für übermäßige ECM-Ablagerung, die weiter zu Fibrose führt, wurde in Gruppe 3 und 4 im Vergleich zu Kontrollgruppe 1 (Abbildung 4) hochreguliert. Genexpressionsdaten deuten darauf hin, dass die oben genannten Biomarker von Entzündungen und Zelltod, von denen bekannt ist, dass sie während einer Leberverletzung überexprimiert werden, in Lebergewebeproben von Tieren hochreguliert werden, bei denen ALF durch eine vorgeschlagene Methode induziert wurde, wodurch das Auftreten von Leberverletzungen auf molekularer Ebene bestätigt wird.
Hematoxylin- und Eosinfärbung (H&E)
Hematoxylin und Eosin (H&E) Färbung wurde getan, um die Schwere der Leberverletzung zu bewerten, indem das Ausmaß der Hepatozytendegeneration beobachtet wurde. Die mit H&E gefärbten Lebergewebeabschnitte wurden von dritten Dritten blind analysiert. In der 70% partiellen Hepatectomiegruppe wurde eine vesikuläre Fettdegeneration beobachtet und in der Acetaminophen-Gruppe periportal-Entzündung und Nekrose zusammen mit leichter sinusförmiger Dilatation beobachtet. Die vesikuläre Fettdegeneration wurde vor allem in der ALF-Gruppe beobachtet (Abbildung 5).
Prothrombin-Zeit und Blutzuckerspiegel
Prothrombin-Zeit (PT) ist ein Parameter, der von der Aktivität des Leber-synthetisierten Gewebethromboplastins abhängt und verwendet wird, um die Effizienz des Blutgerinnungsmechanismus zu charakterisieren45. Im Allgemeinen wird ein Anstieg der PT bei leberbedingten Erkrankungen beobachtet. In der ALF-induzierten Gruppe war PT im Vergleich zur Kontrollgruppe signifikant höher. Das international normalisierte Verhältnis (INR)45 wurde ebenfalls als höher befunden, was einen Defekt im Mechanismus der Blutgerinnung als Folge der ineffizienten Leberphysiologie darstellt (Abbildung 6).
Bewertung des Überlebens nach zellgesunder syngener Rattenhepatozytentransplantation
Ein wichtiges Kriterium eines ALF-Modells ist die Reversibilität von Leberversagen in Gegenwart einer therapeutischen Intervention. In der aktuellen Studie wurden 10 Millionen gesunde syngene Rattenhepatozyten instrasplenisch transplantiert, um die Wirkung der Zelltransplantationstherapie auf DasleberVersagen zu beobachten. Die entsprechende Anzahl der zu transplantierenden Zellen wurde bestimmt, indem die Reversibilität von Leberversagen nach der Transplantation verschiedener Zellnummern beobachtet wurde (Daten nicht dargestellt). Die Zellen wurden nach Verabreichung der1. Dosis von APAP transplantiert, und das Überleben wurde bei Tieren nach der Transplantation von Zellen wiederhergestellt (Abbildung 7). Die Serumspiegel der Enzyme ALT, AST und ALP normalisierten sich nach 10 Tagen Zelltransplantation(Abbildung 8).

Abbildung 1: Überlebensprozentsatz in der ALF-induzierten Gruppe. Kaplan-Meier Survival Curve zeigt den Überlebensprozentsatz von Tieren nach Induktion von ALF mit der Kombination von 70% PHx und APAP-Dosis (750 mg/kg Körpergewicht). Zeit 0 h bezeichnet die Zeit von 70% PHx. Die1. und2. Dosis von APAP wurden 24 und 48 h postchirurgisch verabreicht (n = 12, Gesamttiere). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative Bilder der Lebermorphologie in den vier verschiedenen Gruppen, die in der Studie enthalten sind. Bildtafeln A-D zeigen die Morphologie der Lebern verschiedener Gruppen nach der Einschlähigkeit 2 h nach der2. Dosis der jeweiligen Behandlung. (A) Die Lebermorphologie der Kontrollgruppe 1, in der nur Saline angegeben wurde. (B) Die Lebermorphologie der Gruppe 2, in der nur APAP in der Dosis von 750 mg/kg Körpergewicht verabreicht wurde. (C) Die Lebermorphologie der Gruppe 3, in der Saline nach 70% PHx verabreicht wurde. (D) Die Lebermorphologie in Gruppe 4, in der APAP nach 70% PHx in der Dosis ähnlich der Gruppe 3 (n = 3 Tiere pro Gruppe) verabreicht wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Vergleich des biochemischen Profils von Serum in den verschiedenen Gruppen. Balkendiagramme stellen den Mittelwert von ALT, AST und ALP in Serumproben der vier in die Studie einbezogenen Gruppen dar. Serum wurde 2 h nach der2. Dosis der jeweiligen Behandlung gesammelt. Fehlerbalken = S.E.M; = p < 0,001; * = p < 0,05; n = 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
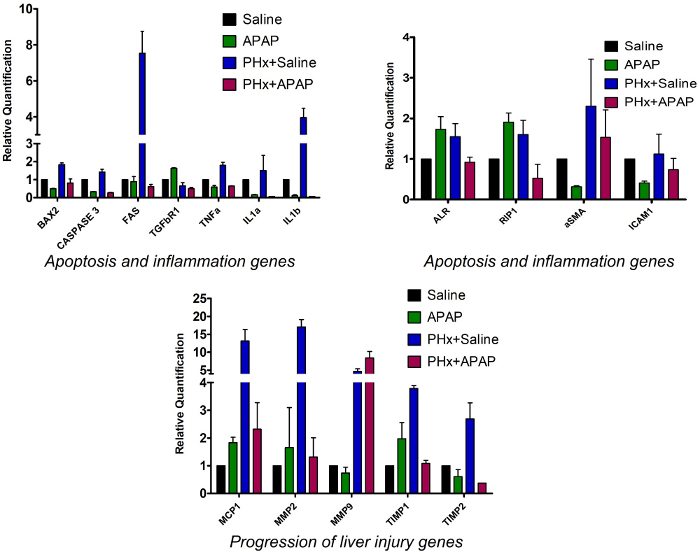
Abbildung 4: Genexpressionsprofil von Lebergewebeproben. Balkendiagramme stellen die relative Quantifizierung der mRNA-Expression verschiedener Gene dar, die an Entzündungen und Zelltod in den vier Gruppen beteiligt sind, die verschiedenen Behandlungen unterzogen werden. Alle Gene wurden gegen die Expression der Kontrolle Gapdhnormalisiert. Fehlerbalken = Standardfehlermittel der drei verschiedenen Stichproben (n = 3). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Histologische Untersuchung von Lebergewebeproben. Repräsentative Hämatoxylin- und Eosin-Färbungsbilder von Lebergewebeproben aus den vier in die Studie einbezogenen Gruppen, wie unter 200-facher Vergrößerung in der Hellfeldmikroskopie beobachtet. Es gab meist normale Hepatozyten in Kontrollgruppe 1 mit leichter Periportal-Infiltration (grüne Pfeile). In Gruppe 3 (70% partielle Hepatektomie) wurde eine vesikuläre Fettdegeneration beobachtet (weiße Pfeile) und in der Acetaminophengruppe 2 periportalentzündung (rote Pfeile) und Nekrose wurden zusammen mit leichter sinusförmiger Dilatation (gelbe Pfeile) beobachtet. Die makrovesikuläre Fettdegeneration wurde vor allem in der ALF-Gruppe 4 (orange Pfeile) beobachtet. Maßstabsleiste = 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Vergleich der Prothrombinzeit (PT) mit dem internationalen normalisierten Verhältnis (INR). (A) Vergleich von PT zwischen Kontrollgruppe 1 (Saline-Injektion nach 70% PHx) und ALF-induzierter Gruppe 4 (APAP-Injektion nach 70% PHx). Blut wurde 2 h nach der2. Dosis der jeweiligen Behandlung entnommen und die für die Fibringergeringerbildung erforderliche Zeit (in Sekunden) wird auf der Y-Achse angezeigt (**** = p < 0,0001, n = 5). (B) Das INR in der ALF-induzierten Gruppe 4 im Vergleich zur Kontrollgruppe 1. Der Mittelwert von INR in Gruppe 4 wurde auf 2,28 ermittelt, was in der Warfarin-induzierten Anti-Koagulationswirkung (n = 5) liegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Überlebensprozentsatz in der ALF-induzierten Gruppe nach einer Zelltransplantation. Kaplan-Meier-Überlebenskurve zeigt den Überlebensprozentsatz nach gesunder Hepatozytentransplantation in der ALF-induzierten Gruppe 4 im Vergleich zur Kontrollgruppe 1 (n = 5). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
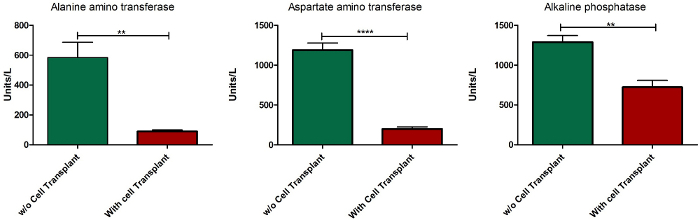
Abbildung 8: Serum biochemisches Profil von ALF-induzierten Tieren nach einer Zelltransplantation. Serumspiegel der Enzyme ALT, AST und ALP 10 Tage nach der Zelltransplantation im Vergleich zu den Serumspiegeln von ALF-induzierten Tieren, die nach einer2. Dosis APAP-Verabreichung eingeschläfert wurden. Fehlerleiste = Standardfehler des Mittelwerts von fünf verschiedenen Stichproben; = p < 0,0001; ** = p > 0,01; n = 5. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Entwicklung eines geeigneten Tiermodells für ALF ist für ein besseres Verständnis der Pathogenese und des Fortschreitens von ALF von größter Bedeutung. Ein gut charakterisiertes ALF-Tiermodell bietet auch die Möglichkeit, neue therapeutische Ansätze gegen ALF zu entwickeln und zu erproben. Es wurden viele Versuche unternommen, ein klinisch relevantes Modell von ALF6,12,21,23,46,47,48zu entwickeln. Die meisten dieser Studien nutzen entweder chirurgische Verfahren oder induzieren Leberschäden durch hepatotoxische Chemikalien.
Es ist schwierig, ein ALF-Modell durch PHx allein zu erstellen, da PHx die Pathologie von ALF aufgrund des Fehlens einer Entzündung, die durch das nekrotische und apoptotische Gewebe verursacht wird, nicht widerspiegeln würde. Bei therapeutischen Dosen wird APAP vollständig durch die Prozesse der Glucoronidation und Sulphation metabolisiert. Bei höheren Dosen, wenn diese Wege gesättigt sind, Wird APAP durch Cytochrom p450 Enzyme metabolisiert, die in erster Linie durch Hepatozyten synthetisiert werden, was zur Bildung eines toxischen Zwischenprodukts, NAPQI (N-acetyl-p-benzoquinon imine) führt. Unter normalen Bedingungen wird NAPQI durch die Glutathionreserven (GSH) von Zellen neutralisiert, während es bei supratherapeutischen Dosen oxidativen Stress in Hepatozyten verursacht, was zu Hepatozytentod4,24,25,46führt. Durch die Kombination der physiologischen Wirkungen von 70% PHx und APAP-induzierten Leberverletzungen wurde in der aktuellen Studie ein ALF-Rattenmodell erstellt. Ein kleineres therapeutisches Fenster reduziert die Belastungszeit für das Tier. In Kombination mit kleineren Dosen von APAP führt dies zu einer besseren Reproduzierbarkeit des Verfahrens.
Die Dosis von APAP wurde ausgewählt, um ein geeignetes therapeutisches Fenster zu bieten, in dem dem Tier eine therapeutische Intervention verabreicht werden kann (d. h. innerhalb von 48 h der1. Dosis und 24 h von 2nd Dosis). Innerhalb von 24 h nach der2. Dosis von APAP wurde eine 100%ige Mortalität beobachtet. Der Todeszeitpunkt innerhalb dieses Zeitraums war jedoch für jedes Tier variabel. Daher wurden die Tiere zur Untersuchung der Entwicklung von ALF zu einem Standardzeitpunkt von 2 h nach der2. Dosis von APAP eingeschläfert.
Der Zeitpunkt der therapeutischen Intervention kann je nach der einzelnen Studie und der Art der untersuchten Therapie entschieden werden, die in der aktuellen Studie die Transplantation von syngenen Rattenhepatozyten kurz nach der1. Dosis von APAP war, so dass die Zellen genügend Zeit zum Zuhause und Einpfropzten ließen. Nach dem aktuellen Modell ist die Transplantation von mindestens 10 Millionen Zellen für eine erfolgreiche Rettung aus ALF erforderlich.
Um den Erfolg des chirurgischen Eingriffs zu gewährleisten, sollten einige wichtige Punkte berücksichtigt werden. Es wird empfohlen, verschiedene Arten von Anästhetika in verschiedenen chirurgischen Verfahren zu verwenden. Um eine partielle Hepatektomie durchzuführen, sollte ein Cocktail aus Ketamin-Xylazin in den empfohlenen Dosen verwendet werden, da er genügend Zeit gibt, den chirurgischen Eingriff abzuschließen. Während der Zelltransplantation sollte inhalierbare Anästhesie isofluranverwendet werden, da sie die körperliche Belastung von ALF-induzierten Tieren reduziert.
Zusammenfassend lässt sich sagen, dass aufgrund einer einheitlichen Sterblichkeitsrate und eines praktischen therapeutischen Fensters ein kombiniertes APAP- und 70% PHx-Modell verwendet wurde, um die Reversibilität von ALF durch Zelltransplantation zu untersuchen. Um die Reversibilität von ALF zu beurteilen, wurden 10 Millionen gesunde syngene Rattenhepatozyten intrasplenisch in die ALF-induzierten Tiere transplantiert. Nach der Transplantation wurde festgestellt, dass der Überlebensprozentsatz bei ALF-induzierten Tieren erhöht wurde. Eine Verbesserung des Serumspiegels von ALT, AST und ALP wurde auch bei Tieren nach der Zelltransplantation beobachtet, was auf die Wiederherstellung des Leberstoffwechsels hindeutet. Dieses ALF-Tiermodell bietet eine Alternative zur Bewertung des therapeutischen Potenzials von Zellen, die die Lücke zwischen akutem Leberversagen und Lebertransplantation überbrücken. Es bietet auch die Möglichkeit, Leberschäden durch Körperliche Verletzungen und hepatotoxische Mittel verursacht zu studieren.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch den Kernzuschuss des Department of Biotechnology, Government of India an das National Institute of Immunology, Neu-Delhi, unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetaminophen (Biocetamol) | EG Pharmaceuticals | No specific Catalog Number (Local Procurement) | |
| Alkaline Phosphatase Kit (DEA) | Coral Clinical System, India | No specific Catalog Number (Local Procurement) | |
| Automated analyser | Tulip, Alto Santracruz, India | Screen Maaster 3000 | Biochemical analyser for liver functional test |
| Betadine (Povidon-Iodine Solution) | Win-Medicare; India | No specific Catalog Number (Local Procurement) | |
| Biological safety cabinet (Class I) | Kartos international; India | No specific Catalog Number (Local Procurement) | |
| Bright Field Microscope | Olympus, Japan | LX51 | |
| Cefotaxime (Taxim®) | AlKem; India | cefotaxime sodium injection, No specific Catalog Number (Local Procurement) | |
| Cell Strainer | Sigma; US | CLS431752 | |
| Collagenase Type I | Gibco by Life Technologies | 17100-017 | |
| Cotton Buds | Pure Swabs Pvt Ltd; India | No specific Catalog Number (Local Procurement) | |
| Drape Sheet | JSD Surgicals, Delhi, India | No specific Catalog Number (Local Procurement) | |
| DPX Mountant | Sigma; US | 6522 | |
| Eosin Y solution, alcoholic | Sigma; US | HT110132 | |
| Forceps | Major Surgicals; India | No specific Catalog Number (Local Procurement) | |
| Gas Anesthesia System | Ugo Basile; Italy | 211000 | |
| Glucose | Himedia, India | GRM077 | |
| Hair removing cream (Veet®) | Reckitt Benckiser, India | No specific Catalog Number (Local Procurement) | |
| Hematoxylin Solution, Mayer's | Sigma; US | MHS16 | |
| Heparin sodium salt | Himedia; India | RM554 | |
| Hyaluronidase From Sheep Testes | Sigma; US | H6254 | |
| I.V. Cannula (Plusflon) | Mediplus, India | Ref 1732411420 | |
| Insulin Syringes | BD; US | REF 303060 | |
| Isoflurane (Forane®) | Asecia Queenborough | No B506 | Inhalation Anaesthetic |
| Ketamine (Ketamax®) | Troikaa Pharmaceuticals Ltd. | Ketamine hydrochloride IP, No specific Catalog Number (Local Procurement) | |
| Meloxicam (Melonex®) | Intas Pharmaceuticals Ltd; India | No specific Catalog Number (Local Procurement) | |
| Micro needle holders straight & curved | Mercian; England | BS-13-8 | |
| Micro needle holders straight & curved | Mercian; England | BS-13-8 | |
| Microtome | Histo-Line Laboratories, Italy | MRS3500 | |
| Nylon Thread | Mighty; India | No specific Catalog Number (Local Procurement) | |
| Paraformaldehyde | Himedia; India | GRM 3660 | |
| Percoll® | GE Healthcare | 17-0891-01 | |
| Refresh Tears/Eyemist Gel | Allergan India Private Limited/Sun Pharma, India | P3060 | No specific Catalog Number |
| RPMI | Himedia; India | No specific Catalog Number (Local Procurement) | |
| Scalpel | Major Surgicals; India | No specific Catalog Number (Local Procurement) | |
| Scissors | Major Surgicals; India | No specific Catalog Number (Local Procurement) | |
| SGOT (ASAT) KIT | Coral Clinical System, India | No specific Catalog Number (Local Procurement) | |
| SGPT (ALAT) KIT | Coral Clinical System, India | No specific Catalog Number (Local Procurement) | |
| Shandon Cryotome E Cryostat | Thermo Electron Corporation; US | No specific Catalog Number | |
| Sucrose | Sigma; US | S0389 | |
| Surgical Blade No. 22 | La Medcare, India | No specific Catalog Number (Local Procurement) | |
| Surgical Board | Locally made | No specific Catalog Number (Local Procurement) | |
| Surgical White Tape | 3M India; India | 1530-1 | Micropore Surgical Tape |
| Sutures | Ethicon, Johnson & Johnson, India | NW 5047 | |
| Syringes (1ml, 26 G) | Dispo Van; India | No specific Catalog Number (Local Procurement) | |
| Trimmer (Clipper) | Philips | NL9206AD-4 DRACHTEN QT9005 | |
| Weighing Machine | Braun | No specific Catalog Number (Local Procurement) | |
| William's E Media | Himedia; India | AT125 | |
| Xylazine (Xylaxin®) | Indian Immunologicals Limited | Sedative, Pre-Anaesthetic, Analgesic and muscle relaxant |
Referenzen
- Polson, J., Lee, W. M. AASLD position paper: the management of acute liver failure. Hepatology. 41, 1179-1197 (2005).
- Chung, R. T., et al. Pathogenesis of liver injury in acute liver failure. Gastroenterology. 143, 1-7 (2012).
- Fyfe, B., Zaldana, F., Liu, C. The Pathology of Acute Liver Failure. Clinical Liver Disease. 22, 257-268 (2018).
- Lefkowitch, J. H. The Pathology of Acute Liver Failure. Advances in Anatomic Pathology. 23, 144-158 (2016).
- Mitchell, J. R., et al. Acetaminophen-induced hepatic necrosis. I. Role of drug metabolism. Journal of Pharmacology and Experimental Therapeutics. 187, 185-194 (1973).
- Rahman, T. M., Hodgson, H. J. Animal models of acute hepatic failure. International Journal of Clinical and Experimental Pathology. 81, 145-157 (2000).
- Rahman, T. M., Selden, A. C., Hodgson, H. J. A novel model of acetaminophen-induced acute hepatic failure in rabbits. Journal of Surgical Research. 106, 264-272 (2002).
- Dashti, H., et al. Thioacetamide- and carbon tetrachloride-induced liver cirrhosis. European Surgical Research. 21, 83-91 (1989).
- Demirdag, K., et al. Role of L-carnitine in the prevention of acute liver damage-induced by carbon tetrachloride in rats. Journal of Gastroenterology and Hepatology. 19, 333-338 (2004).
- Sheweita, S. A., Abd El-Gabar, M., Bastawy, M. Carbon tetrachloride-induced changes in the activity of phase II drug-metabolizing enzyme in the liver of male rats: role of antioxidants. Toxicology. 165, 217-224 (2001).
- Sinicrope, R. A., Gordon, J. A., Little, J. R., Schoolwerth, A. C. Carbon tetrachloride nephrotoxicity: a reassessment of pathophysiology based upon the urinary diagnostic indices. American Journal of Kidney Diseases. 3, 362-365 (1984).
- Takada, Y., Ishiguro, S., Fukunaga, K. Large-animal models of fulminant hepatic failure. Journal of Artificial Organs. 6, 9-13 (2003).
- Takada, Y., et al. Increased intracranial pressure in a porcine model of fulminant hepatic failure using amatoxin and endotoxin. Journal of Hepatology. 34, 825-831 (2001).
- Leist, M., Wendel, A. A novel mechanism of murine hepatocyte death inducible by concanavalin A. Journal of Hepatology. 25, 948-959 (1996).
- Mizuhara, H., et al. Strain difference in the induction of T-cell activation-associated, interferon gamma-dependent hepatic injury in mice. Hepatology. 27, 513-519 (1998).
- Bruck, R., et al. Hypothyroidism minimizes liver damage and improves survival in rats with thioacetamide-induced fulminant hepatic failure. Hepatology. 27, 1013-1020 (1998).
- Chieli, E., Malvaldi, G. Role of the microsomal FAD-containing monooxygenase in the liver toxicity of thioacetamide S-oxide. Toxicology. 31, 41-52 (1984).
- Fontana, L., et al. Serum amino acid changes in rats with thioacetamide-induced liver cirrhosis. Toxicology. 106, 197-206 (1996).
- Peeling, J., et al. Cerebral metabolic and histological effects of thioacetamide-induced liver failure. American Journal of Physiology. 265, 572-578 (1993).
- Blitzer, B. L., et al. A model of fulminant hepatic failure in the rabbit. Gastroenterology. 74, 664-671 (1978).
- Diaz-Buxo, J. A., Blumenthal, S., Hayes, D., Gores, P., Gordon, B. Galactosamine-induced fulminant hepatic necrosis in unanesthetized canines. Hepatology. 25, 950-957 (1997).
- Maezono, K., Mawatari, K., Kajiwara, K., Shinkai, A., Maki, T. Effect of alanine on D-galactosamine-induced acute liver failure in rats. Hepatology. 24, 1211-1216 (1996).
- Patzer, J. F., et al. D-galactosamine based canine acute liver failure model. Hepatobiliary & Pancreatic Diseases International. 1, 354-367 (2002).
- Newsome, P. N., Plevris, J. N., Nelson, L. J., Hayes, P. C. Animal models of fulminant hepatic failure: a critical evaluation. Liver Transplantation. 6, 21-31 (2000).
- Yoon, E., Babar, A., Choudhary, M., Kutner, M., Pyrsopoulos, N. Acetaminophen-Induced Hepatotoxicity: a Comprehensive Update. Journal of Clinical and Translational Hepatology. 4, 131-142 (2016).
- Das, B., et al. Intrasplenic Transplantation of Hepatocytes After Partial Hepatectomy in NOD.SCID Mice. Journal of Visualized Experiments. , (2018).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3, 1167-1170 (2008).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43, 506-520 (1969).
- Fry, J. R., Jones, C. A., Wiebkin, P., Bellemann, P., Bridges, J. W. The enzymic isolation of adult rat hepatocytes in a functional and viable state. Analytical Biochemistry. 71, 341-350 (1976).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell Tissue Bank. 18, 597-604 (2017).
- Ismail, T., et al. Growth of normal human hepatocytes in primary culture: effect of hormones and growth factors on DNA synthesis. Hepatology. 14, 1076-1082 (1991).
- Greenfield, E. A. Sampling and Preparation of Mouse and Rat Serum. Cold Spring Harbor Protocols. 11, (2017).
- Walsh, K. M., Timms, P., Campbell, S., MacSween, R. N., Morris, A. J. Plasma levels of matrix metalloproteinase-2 (MMP-2) and tissue inhibitors of metalloproteinases -1 and -2 (TIMP-1 and TIMP-2) as noninvasive markers of liver disease in chronic hepatitis C: comparison using ROC analysis. Digestive Diseases and Sciences. 44, 624-630 (1999).
- Thiele, N. D., et al. TIMP-1 is upregulated, but not essential in hepatic fibrogenesis and carcinogenesis in mice. Scientific Reports. 7, 714 (2017).
- Li, C. P., Li, J. H., He, S. Y., Li, P., Zhong, X. L. Roles of Fas/Fasl, Bcl-2/Bax, and Caspase-8 in rat nonalcoholic fatty liver disease pathogenesis. Genetics and Molecular Research. 13, 3991-3999 (2014).
- Kim, W. R., Flamm, S. L., Di Bisceglie, A. M., Bodenheimer, H. C. Serum activity of alanine aminotransferase (ALT) as an indicator of health and disease. Hepatology. 47, 1363-1370 (2008).
- Henry, L. Serum transaminase levels in liver disease. Journal of Clinical Pathology. 12, 131-137 (1959).
- Giannini, E. G., Testa, R., Savarino, V. Liver enzyme alteration: a guide for clinicians. Canadian Medical Association Journal. 172, 367-379 (2005).
- Hammam, O., et al. The role of fas/fas ligand system in the pathogenesis of liver cirrhosis and hepatocellular carcinoma. Hepatitis Monthly. 12, 6132 (2012).
- Prystupa, A., et al. Activity of MMP-2, MMP-8 and MMP-9 in serum as a marker of progression of alcoholic liver disease in people from Lublin Region, eastern Poland. The Annals of Agricultural and Environmental Medicine. 22, 325-328 (2015).
- Sekiyama, K. D., Yoshiba, M., Thomson, A. W. Circulating proinflammatory cytokines (IL-1 beta, TNF-alpha, and IL-6) and IL-1 receptor antagonist (IL-1Ra) in fulminant hepatic failure and acute hepatitis. Clinical and Experimental Immunology. 98, 71-77 (1994).
- Schwabe, R. F., Brenner, D. A. Mechanisms of Liver Injury. I. TNF-alpha-induced liver injury: role of IKK, JNK, and ROS pathways. American Journal of Physiology-Gastrointestinal and Liver Physiology. 290, 583-589 (2006).
- Ataseven, H., et al. The levels of ghrelin, leptin, TNF-alpha, and IL-6 in liver cirrhosis and hepatocellular carcinoma due to HBV and HDV infection. Mediators of Inflammation. 2006, 78380 (2006).
- Ambrosino, G., et al. Cytokines and liver failure: modification of TNF- and IL-6 in patients with acute on chronic liver decompensation treated with Molecular Adsorbent Recycling System (MARS). Acta Bio Medica Atenei Parmensis. 74, 7-9 (2003).
- Robert, A., Chazouilleres, O. Prothrombin time in liver failure: time, ratio, activity percentage, or international normalized ratio. Hepatology. 24, 1392-1394 (1996).
- Francavilla, A., et al. A dog model for acetaminophen-induced fulminant hepatic failure. Gastroenterology. 96, 470-478 (1989).
- Terblanche, J., Hickman, R. Animal models of fulminant hepatic failure. Digestive Diseases and Sciences. 36, 770-774 (1991).
- Tunon, M. J., et al. Rabbit hemorrhagic viral disease: characterization of a new animal model of fulminant liver failure. Journal of Laboratory and Clinical Medicine. 141, 272-278 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten