Method Article
Доставка антител в мозг Мурин через конвекционно-увеличенную доставку
В этой статье
Резюме
Конвекционные расширенные поставки (CED) является методом, позволяющим эффективной доставки терапии в мозг путем прямого перфузии больших объемов тканей. Процедура требует использования катетеров и оптимизированной процедуры инъекций. Этот протокол описывает методологию CED антитела в мозг мыши.
Аннотация
Конвекционные расширенные поставки (CED) является нейрохирургической техникой, позволяющей эффективно перфузии больших объемов мозга с помощью системы катетера. Такой подход обеспечивает безопасный метод доставки путем прохождения гематоэнцефалического барьера (BBB), что позволяет лечение с терапевтическими с плохой BBB-проницаемость или те, для которых системное воздействие не желательно, например, из-за токсичности. CED требует оптимизации конструкции катетера, протокола инъекций и свойств инфузата. С помощью этого протокола мы описываем, как выполнять CED раствора, содержащего до 20 мкг антитела в каудат путамины мышей. Он описывает подготовку шага катетеров, тестирование их в пробирке и выполнения CED у мышей с помощью рампы программы инъекций. Протокол может быть легко скорректирован для других объемов инфузии и может быть использован для инъекций различных трассаторов или фармакологически активных или неактивных веществ, включая химиотерапию, цитокины, вирусные частицы и липосомы.
Введение
Гематоэнцефалический барьер (BBB) образует полупроницаемую границу, отделяющую центральную нервную систему (ЦНС) от кровообращения. Достижение ЦНС с терапевтическими, однако, необходимо в контексте различных заболеваний, как опухоли головного мозга, болезнь Альцгеймера (AD) или болезнь Паркинсона (PD) среди других1. Это становится важным в разработке новых методов лечения, особенно если проверенный препарат проявляет плохую проницаемость BBB или его системное воздействие может привести к опасной токсичности1,2. Некоторые из клинически используемых антител отображают обе эти особенности. Решение этой проблемы было бы доставить терапии непосредственно за BBB.
Конвекционные усовершенствованные роды (CED) - нейрохирургическая методика, позволяющая эффективно перфузить больших объемов мозга. Это достигается хирургическим путем установки одного или нескольких катетеров в целевой области. Во время применения препарата при открытии катетера образуется градиент давления, который становится движущей силой дисперсии инфузата в ткани3,4. Таким образом, продолжительность инфузии, а не диффузионные коэффициенты определяют диапазон перфузии2,4,5. Это обеспечивает равномерное доставки инфузата в течение гораздо большего объема мозга по сравнению с обычными, диффузии на основе методов внутримозговой инъекции2,6. В то же время, эта модальность доставки имеет более низкий риск повреждения тканей2. Соответственно, CED может обеспечить безопасное и эффективное введение обычных химиотерапевтических методов лечения опухолей ЦНС, а также доставку иммуномодулирующих средств или агонистических и антагонистических антител во множестве других расстройств ЦНС2 ,7,8,9. CED в настоящее время тестируется в терапии болезни Паркинсона, болезни Альцгеймера, а также полноценной глиомы2,7,8,10,11.
Конструкция катетера и режим инъекций являются одними из наиболее важных факторов, влияющих на исход CED 10,12,13,14,15,16. Кроме того, он требует специфических физико-химических свойств инфузата, включая умеренный размер частиц, анионический заряд и сродство низкой ткани 10,17. Каждый из этих параметров должен быть потенциально скорректирован в соответствии с гистологическими особенностями области мозга, которые будут направлены2,10,17.
Здесь мы описываем методологию для выполнения CED раствора антител в caudate putamen (striatum) мышей. Кроме того, протокол включает в себя подготовку ступенчатых катетеров в лабораторной установке, тестирование их в пробирке и выполнение CED.
Есть несколько конструкций катетера доступны в литературе, отличаясь по форме канюли, используемых материалов и количество катетер отверстия12,15,18,19,20 ,21,22. Мы используем ступенчатый катетер из сросшёрного капилляра, выступающего на 1 мм от тупой металлической иглы. Этот катетер дизайн может быть легко изготовлены в исследовательской лаборатории и воспроизводимо дает хорошие результаты CED при тестировании в пробирке с агарозными блоками с физическими параметрами, напоминающими мозг parenchyma in vivo23.
Кроме того, мы внедряем режим наращивания для доставки 5 зЛ инфусата in vivo. В таком протоколе скорость инъекций увеличивается с 0,2 л/мин до максимума 0,8 л/мин, тем самым сводя к минимуму вероятность инфузатного рефлюкса вдоль катетера, а также риск повреждения тканей16. Используя этот протокол, мы успешно вводили мышам до 20 мкг антител в 5 Л ПБС в течение 11 мин 30 с.
Протокол может быть легко скорректирован для других объемов инфузии или для инъекций различных других веществ, например, химиотерапевтических препаратов, цитокинов, вирусных частиц или липосом2,10,14,18 ,22. В случае использования инфузата с кардинально различными физикохимическими свойствами по сравнению с фосфатным буферным сольником (PBS) или искусственным спинномозговой жидкостью (aCSF) раствором антител рекомендуется, рекомендуются дополнительные шаги проверки. Для сборки катетера, проверки и CED мы описываем все шаги с помощью стереотаксического робота с дрелью и инъекционным блоком, установленным на обычную стереотаксическую раму. Эта процедура также может быть выполнена с ручной стереотаксической рамой, подключенной к программируемому микроинфузионному насосу, который может управлять описанными стеклянными микросилиями.
протокол
Все описанные здесь методы были одобрены Швейцарским кантональным ветеринарным управлением под номером лицензии No246/15.
1. Подготовка степных катетеров
- Приготовление смирения кремнезема для ступени катетера
- Вырезать сросшиеся кремнезема капилляра с внутренним диаметром 0,1 мм и стены толщиной 0,0325 мм труб до длины 30 мм.
- Изучите трубки для трещин и тепла польский концы с помощью микрокузнии для обеспечения труб отверстия имеют гладкую поверхность.
- Фиксация внутренней трубки металлической иглой
- Установите 27 G иглу на шприц 10 л и поместите шприц в стереотаксическом роботе.
- Используя робота, переместите шприц по твердой поверхности и коснитесь его кончиком иглы. Это положение должно быть отмечено или сохранено в программном обеспечении, поскольку оно будет служить эталонной поверхностью для установления длины шага катетера.
- Поднимите иглу, чтобы обеспечить размещение смытого капилляра кремнезема внутри иглы
- Поместите сросшийся кремнезем капилляр в иглу так, что 20 мм капилляра выступает от иглы.
- Используя пипетку, равномерно распределите 2 злицирования высоковязки цианоакрилатного клея над капилляром, начиная с металлической иглы и заканчивая 10 мм выше нижнего конца капилляра, как показано на рисунке 2.
- Используя стереотаксического робота, опустите иглу до кончика металлической иглы на 1 мм над эталонной поверхностью. Таким образом, сливные капилляры кремнезема будут зафиксированы в металлической игле и образуют 1 мм шаг от кончика металлической иглы. Удалите избыток клея, образующего в конце металлической иглы, чтобы избежать притупки шага.
- Подождите 15 минут для клея, чтобы затвердеть и удалить шприц с катетером от стереотаксического робота. Подтвердите, что на ступеньке все излишки клея были удалены, проверив кончик катетера под микроскопом.
- Тестирование ступенчатого катетера с помощью блока агарозы
- Приготовьте раствор агарозы 0,6% в PBS в обычном гелите и подождите, пока он полимеризируется. Разрежьте агароз примерно 20 мм х 20 мм блоков. До использования, держать блоки погружены в PBS.
- Вручную заполните шаг катетер шприц с 10 зл 0,4% раствор отфильтрованного трипан синий.
- Используя стереотаксического робота, распределите 1 л при 0,2 л/мин для оценки герметизации ступени катетера во время процедуры фиксации. Трипан синий раствор должен быть виден исключительно на кончике катетера. Протрите его бумажной тканью.
- Поместите блок агарозы в стереотаксическом роботе и откалибруйте робота, чтобы кончик катетера был отсылок к поверхности агарозного блока.
- Программа параметров инъекций для CED.
- Для впрыска объемом 5 л используйте следующие шаги: 1 кЛ при 0,2 л/мин, затем 2 л при 0,5 л/мин и 2 Л при 0,8 л/мин. Отрегулируйте окончательный объем инъекций в соответствии с конкретным экспериментальным планом, пропорционально изменив продолжительность каждого из этапов.
- Для того, чтобы ввести раствор в murine caudate putamen (striatum), выполните такую инъекцию в положении 1 мм лобной и 1,5-2 мм боковой из брегмы на глубине 3,5 мм.
- После инъекции оставьте катетер на месте в течение 2 мин, а затем сбросьте на 1 мм/мин, чтобы обеспечить надлежащую дисперсию жидкости в головном мозге и уплотнение инъекционного тракта во время удаления катетера.
ПРИМЕЧАНИЕ: В зависимости от используемого стереотаксического робота все параметры могут быть запрограммированы на один сценарий. Пример скрипта доступен в качестве дополнительного материала..
- Запустите процедуру CED и введите 5 злитровый синий раствор трипан в блок агарозы.
- Оцените форму облака трипан синего в агарозе и потенциальную утечку вдоль катетерного тракта. Трипан синий должен образовывать эллипсоид или круглое облако с центром вокруг кончика катетера и диаметром не менее 1 мм. Никакой основной обратный поток над кончиком металлической иглы не должен быть видимым.
- Поместите новый блок агарозы и начните вторую инъекцию в размере 1 л при 0,2 л/мин, чтобы оценить засорение катетера агарозой. Трипан синий должен снова начать формирование облака с кончика катетера сразу после начала инъекции.
- Оцените, соответствует ли оставшийся объем в шприцу 3 Зл. Любые изменения могут указывать на утечку жидкости через катетер крепления или шприц поршень.
- Если все тестовые инъекции успешны, катетер хорошо запечатан, прямой и не пробивной синий раствор наблюдается из других пятен, чем кончик катетера, мыть катетер с деионизированным H2O (dH2O) до тех пор, пока не видны следы трипан синий видны а затем мыть десять раз следующим образом: 70% этанола и 100% этанола следуют промывки снова с 70% этанола и чистой деионизированной воды.
- Храните катетер в сухих условиях.
2. Конвекция-улучшенная доставка антитела раствор амвона в мозг Мурин
ПРИМЕЧАНИЕ: В зависимости от местных правил защиты животных, различные виды анестезии, анальгетиков и антибиотиков могут быть реализованы для этой процедуры. Этот протокол описывает использование инъекционной анестезии. Ингаляционные анестезии, такие как изофлуран также могут быть использованы путем установки маски носа на стереотаксической раме. Кроме того, мы рекомендуем добавлять антибиотики в питьевую воду для профилактики инфекции.
- Хирургическая установка
- Приготовьте анестетики и противоядие. Мышей можно безопасно анестезировать с помощью трехкомпонентной анестезии, содержащей фентанил (0,05 мг/кг), мидазолам (5 мг/кг) и мететомидин (0,5 мг/кг), разбавленный стерильным dH2O. Мы проводим двухступенчатую процедуру пробуждения с использованием двух противоядиевых растворов, один из которых содержит флумазенил (0,5 мг/кг) и бупренорфин (0,1 мг/кг) в стерильных dH2O (первый противоядие). Второй содержит атипамезеол (2,5 мг/кг) в стерильном dH2O (второй противоядие).
- Приготовить раствор анальгезии, содержащий карпрофен (5,667 мг/кг), разбавленный стерильным dH2O.
- Очистите стереотаксическую раму, грелку и элементы стереотаксического робота. Имейте в виду, что не все части робота могут быть очищены без риска повреждения. Обратитесь к руководству робота для получения подробной информации о чистке и подготовке к использованию.
- Соберите шприц с катетером шага и промыть его несколько раз с dH2O, 70% этанола и 100% этанола следуют промывки снова с 70% этанола и dH2O. Наконец, промыть шприц с PBS или других буферов, которые будут использоваться для подготовки раствора для внутричерепной инъекции, например, искусственной спинномозговой жидкости. Поршень шприца должен двигаться плавно и свободно в течение всей процедуры.
- Калибровать стереотаксическому роботу программное обеспечение со стереотаксической рамой.
- Проверьте стереотаксическом программном обеспечении робота, гарантируя, что робот оружия свободно двигаться и что инъекционный насос правильно подключен и может выполнять процедуру CED без каких-либо помех. Это включает в себя тестирование движения робота, ramping инъекции, проверка 2 мин ожидания шаг и скорость опрокидки катетера. Все параметры должны соответствовать запрограммированной процедуре CED, описанной в пункте 1.3.5.
- Вставьте сверло бит в сверле. Рекомендуется стерилизовать буровые биты перед использованием.
- Подготовка антител решения с помощью PBS или других буферных решений, таких как aCSF. От 1 до 20 мкг антител в 5 Л может быть введен в одной процедуре CED. Другие объемы и количества белка должны быть проверены до проведения эксперимента. Имейте в виду, что использование решений высокой вязкости может привести к засорению катетера.
- Вручную загрузите шприц разбавленным антителом.
- Инъекции антител CED в стриатум
- Взвесьте мышь и введите раствор анестезии из трех компонентов в перитонеум в зависимости от массы тела. Обратите внимание на время инъекции. Перенесите мышь в отдельную клетку с подогревом с помощью грелки.
- Наблюдайте за мышью, чтобы определить, когда начнется седация. Как только мышь перестает двигаться, нанесите офтальмологическую мазь на глаза, чтобы защитить роговицу от высыхания во время операции. Полная седативная седативка обычно начинается 10-15 минут от инъекции раствора трехкомпонентной анестезии.
- Проверьте болевые реакции с помощью пинч-рефлекс тест для обеспечения полной анестезии животного.
- Бритье головы с помощью триммера волос.
- Дезинфицировать кожу ватными тампонами, пропитанными раствором йода. Сквысьть кожу три раза круговыми движениями.
- С помощью скальпеля, сделать 10 мм разрез кожи вдоль черепной средней линии отделки на уровне глаз.
- Закрепите мышь в стереотаксической раме с помощью зажима носа и ушных брусков. Убедитесь, что поверхность черепа горизонтальна и плотно защищена. Помимо правильной анатомической навигации это также имеет решающее значение, чтобы избежать наклона черепа во время бурения и процедуры CED.
- Поместите шприц в стереотаксическом роботе.
- Синхронизируйте сверло с кончиком катетера на точке отсчета. Очень важно, чтобы связь между положением сверла и шприцем точно определялась в программном обеспечении, поэтому инъекция может быть выполнена в желаемой анатомической области мозга.
- Урежесли кожу с помощью щипков и локализуйте брегму на поверхности черепа.
- Справочная bregma в программном обеспечении с использованием кончика сверла бит.
- Переместите сверло в положение 1 мм лобной и 2 мм боковой от bregma и просверлить заусенец отверстие. Будьте осторожны, чтобы не повредить dura mater.
- Переместите шприц над отверстием заусенца.
- Откажитесь от шприца 0,5-1 л, чтобы в катетере не осталось пузырьков воздуха.
- Запустите программу CED, описанную в пункте 1.3.5. Наблюдайте за поверхностью черепа на наличие следов притока жидкости из места инъекции. Следите за частотой дыхания животного.
- После того, как программа CED закончена и катетер выводится из мозга, запустите инъекционный насос на 0,2 л/мин, чтобы проверить наличие катетера во время CED. Если не засорения произошло, вы должны немедленно увидеть капли инъекций смесь из катетера отзыв.
- Перед повторного использования или хранения катетера, визуально изучить катетер шаг для любых признаков повреждения или носить под микроскопом и очистить его, как в шаге 1.3.10.
- Процедура пробуждения
- Аккуратно удалите мышь из стереотаксической рамы.
- Вымойте место операции стерильным сольным раствором.
- Используя щипцы, заполните заусенец отверстие с костным воском.
- Закройте кожу тонкими щипками и нанесите хирургический клей с помощью 10-ю пипетки на разрезе. Подождите 15-30 с для клея полимеризации.
- Применяют раствор анальгезии путем подкожной инъекции. Обратите внимание на время инъекции.
- Нанесите первый противоядие. Обратите внимание на время инъекции.
- Перенесите мышь в отдельную клетку с грелкой и следите за животным за поразительными рефлексами.
- Если мышь не набрала полного сознания через 15 мин после введения первого противоядия, примените второй противоядие путем подкожной инъекции.
- Мониторинг животных во время фазы восстановления.
- Проверьте 1-2 ч позже, а также на следующий день для послеоперационных осложнений. При необходимости повторно применять анальгезию.
- Для профилактики инфекции добавьте сульфадоксин (окончательная концентрация 0,08% w/v) и триметоприм (окончательная концентрация 0,016% w/v) к питьевой воде, к которой животные имеют доступ к ad libitum в течение 1 недели после операции.
Результаты
Этот протокол позволяет подготовить ступенчатые катетеры(рисунок 1) для использования в процедуре CED в лабораторных условиях. Для того, чтобы контролировать катетеры для утечки, рефлюкс вдоль иглы тракта и засорения, мы рекомендуем выполнять инъекции красителя, например, trypan синий раствор, в блок агарозы. На рисунке 3 изображено облако трипан-голубого, образующееся после инъекции в размере 1 л л при 0,5 л/минута с помощью катетера CED (рисунок3A). В начале шага катетера рефлюкс вдоль иглы не был виден. Кроме того, рассеянное облако сформировало желаемую сферическую форму. Это в отличие от результатов, полученных с помощью обычных 27 G тупой конец иглы(Рисунок 3B), где значительный рефлюкс может наблюдаться.
Кроме того, CED требует оптимизированной процедуры инъекций. На рисунке 4 показаны результаты инъекций 2 ЗЛ трипан синего цвета в блок агарозы с использованием процедуры ramping, описанной в протоколе (A) по сравнению с инъекцией с постоянной скоростью 2 Л/минута (B). Высокая скорость инъекций заставила рефлюкс вдоль катетера даже при использовании катетера CED.
Наконец, как показано на рисунке 5, CED позволяет перфузии больших объемов мозга мурина. Мышам вводили антитела против мыши TNF, в сочетании с FITC-dextran в 5 ЗЛ PBS cED (верхняя панель) или обычным иватом инъекцией болуса (нижняя панель). Перфузийный профиль CED был более однородным, чем обычные инъекции и меньше повреждений тканей можно было наблюдать. В обоих случаях был типичный профиль распределения антител и декекных частиц над мозолом тела. Однако профиль дисперсии инъекционных антител был более диффузным, чем высокомолекулярный вес декент, иллюстрируя различия в распределении между различными инфузатами.

Рисунок 1: Схематический рисунок, показывающий наконечник катетера шага CED. Фронтальные(A) и боковые (B ) виды. Схема не до масштабирования. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
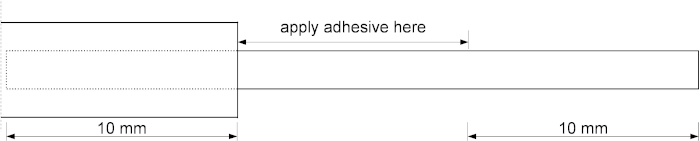
Рисунок 2: Схематический рисунок, изображающий область применения клея. Верхние 10 мм срастающей кремнезема трубки вставляются в металлическую иглу. Нанесите клей на 10 мм труб, начиная с кончика металлической иглы. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
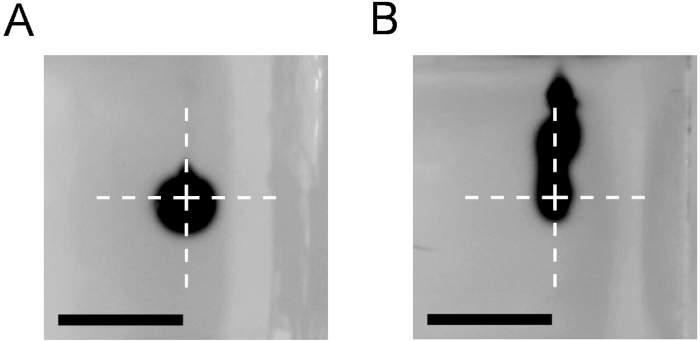
Рисунок 3: Сравнение результатов инфузии с использованием катетера CED или тупой иглы. Инъекция 1 л 0,4% трипан синий в 0,6% агарозный блок на 0,5 л /минута с использованием катетера CED (A) и 27G тупой конец иглы (B). Фотографии, сделанные сразу после катетера или иглы вывода. Крест отмечает кончик катетера или иглы. Шкала бар 5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
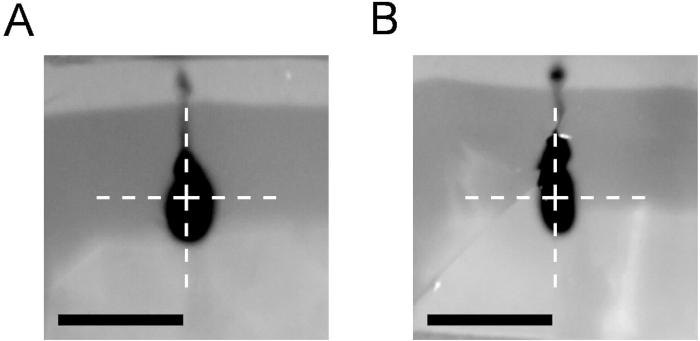
Рисунок 4: Сравнение результатов инфузии наращивания протокола CED с протоколом стабильной скорости. Инъекция 2 л 0,4% трипан синий в 0,6% агарозный блок с использованием ramping Протокол CED (0,4 л при 0,2 л/мин, затем 0,8 л при 0,5 л/мин и 0,8 л при 0,8 л/мин (A) или 2 л/мин устойчивый протокол впрыска (B). В обоих случаях использовался катетер CED. Фотографии, сделанные сразу после снятия катетера. Крест отмечает кончик катетера. Шкала бар 5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Репрезентативные результаты перфузии стриатумов морин ы cED или обычными инъекциями болуса. Мышей вводили в стриатум (позиция 1 мм лобной и 2 мм боковой от брегмы, глубина 3,5 мм) с 1 мкг крысиной антимышки ТНФЗ в сочетании с 1 мкг FITC-Dextran с молекулярным весом 2000 кДа в 5 л PBS. Был выполнен протокол CED (верхняя панель) или обычная инъекция болуса (27 G игла, скорость инъекций 1 Л/минута) (внизу). Мыши были принесены в жертву сразу после процедуры CED контролируемым CO2 удушья и проникнуты 4% формальдегида в PBS. Мозги были расчленены и дополнительно зафиксированы с 4% формальдегида в PBS при 4 C для 24 ч. Впоследствии мозги промывали 15% сахарозой в течение 60 мин и передавали на 30% сахарозу при 4 градусах Цельсия. После 24 ч мозги были заморожены на сухом льду. Свободно плавающие секции (25 мкм) были окрашены с использованием поликлональных коза анти-крыса IgG (H'L) антитела в сочетании с Alexa Fluor 647 и противопоставить DAPI. Изображения были обработаны с помощью фиджийского распространения ImageJ. 10-раз увеличение, шкала бар 5 мм. 4 мышей на группу; отображается репрезентативное изображение. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Конвекционно-увеличенная поставка, или давление-опосредованное инфузия снадобья в мозг, сперва была предложена в начале 19903. Этот подход обещает perfusion больших объемов мозга за гематоэнцефалический барьер в контролируемой манере2. Тем не менее, до сих пор, только несколько клинических испытаний были проведены с использованием этого подхода, отчасти потому, что CED в клинической установки показал, что технически требовательны24,25. Последние разработки в катетер дизайн и инфузионные программы, кажется, преодолели эти технические трудности8,19. Прогресс, достигнутый в клинической реализации терапевтических антител, в том числе появление иммуномодулирующих контрольных средств блокирования, ожидает применения в лечении заболеваний ЦНС10. Это развитие может быть значительно увеличено за счет использования CED в экспериментальной установке, например, с использованием небольших моделей грызунов.
Различные модели болезни ЦНС доступны у мышей. К ним относятся экспериментальные аутоиммунные энцефаломиелит (EAE) для рассеянного склероза (MS) и генетически модифицированных моделей для болезни Альцгеймера (AD), болезнь Паркинсона (PD), или для рака мозга. Многие модели опухоли головного мозга также полагаются на ортотопические опухоли прививки линий клеток глиомы морин или имплантации пациента полученных ксенотрансплантатов. Этот протокол позволяет доставлять антитела непосредственно в определенные анатомические места, тем самым напоминая терапевтические процедуры. Она может быть реализована в различных экспериментальных макетах, где доставка антител в точную область мозга играет ключевую роль.
Критическим фактором при выполнении CED у мышей является наличие катетеров. Этот протокол содержит точное описание того, как собрать шаг катетер и проверить его в серии экспериментов in vitro. Следует иметь в виду, что сливк, из которого сделана ступенчатая трубка, является хрупким материалом, а качество CED с заданном катетером может со временем снижаться. Рекомендуется контролировать параметры катетеров шага между экспериментами in vivo, повторяя тесты in vitro, описанные в разделе протокола 1.3.
Протокол может быть скорректирован для различных объемов инъекций, типов инфусата и областей мозга. Объемом инъекций можно манипулировать, пропорционально изменяя продолжительность шагов инъекции. Здесь мы описываем вливание 5 Л, но CED с 10 зл антитела раствора было сообщено в литературе, используя аналогичный подход в моделях опухоли мозга, достижение отличного распределения тканей и перфузии объемы значительно превышает bolus инъекции7 . Кроме того, до 28 мл объемов инфусата были зарегистрированы с использованием CED для применения жидкостей в мозг крыс22,26. Небелковые вещества также могут быть введены CED, имея в виду, что инфусат не должен быть высокой вязкости, чтобы избежать засорения узкого кончика катетера. Использование липосомы, было продемонстрировано, что заряд настоянных молекул может значительно повлиять на проникновение ткани, с нейтральными или отрицательно заряженных частиц, будучи в состоянии быть распределены по крупнейшим томам22. Как показано на рисунке 5, FITC-dextran и антитела расходятся по-разному: хотя оба антитела и FITC-dextran распределяют аналогичным образом вдоль корпуса мозоли, проникновение антител мозга паренхимы является более диффузным, чем для FITC-dextran, который показывает меньший радиус и более пятнистый шаблон распределения. Это подчеркивает различия в профиле CED между инфузатами с различными физикохимическими свойствами.
Кроме того, эксперимент CED, описанный здесь и показанный на рисунке 5, был выполнен инъекционным антимыктным антителам TNF в здоровых мышей, поэтому при условии минимального целевого количества в стриатуме. Наличие коньякантигена изменит структуру распределения тканей. Это может быть дополнительно зависит от неоднородных тканей на анатомическом сайте, как показано на рисунке 5 путем распределения инфузата вдоль корпуса мозоли.
Наконец, CED зависит от потока интерстициальной жидкости, которая в случае инъекции стриатума, может промыть инфусат к боковым желудочкам27. Действительно, даже когда ткань фиксируется сразу после окончания CED, мы можем наблюдать заметное слив к стенке желудочка(рисунок 5). Это может быть дополнительно зависит от патологических условий ЦНС, например, в контексте опухолей головного мозга. Фокусный некроз, часто наблюдаемый в опухолях головного мозга высокого класса28,может повлиять на поток интерстициальной жидкости и тем самым изменить структуру распределения инфузата29. Другие патологические условия, которые могут привести к изменению распределения тканей инфузата по сравнению со здоровой паренхимой включают инсульт или черепно-мозговую травму30. Подводя итог, каждая серия экспериментов CED должна быть тщательно проверена, чтобы обеспечить успешную перфузию области мозга цели.
В настоящее время исследователи часто используют имплантируемые осмотические насосы для доставки веществ в CSF или мозг (опухоль) паренхима31,32,33. В некоторых случаях CED, как описано здесь, может быть использован в качестве альтернативы. Это может быть выполнено несколько раз с частотами в зависимости от области мозга, типа инфузата, объема и анестезии протокол используется. Прерывистая доставка лекарств может быть особенно актуальной, когда длительное воздействие инфузата приводит к толерантности или системным побочным эффектам. Можно предположить, что в тех случаях, когда поставляются инфусаты с высоким уровнем удержания и периодом полураспада, такой подход будет представлять собой уточнение в соответствии с принципом 3R, поскольку не потребуется имплантация насоса. В заключение, этот протокол описывает эффективный способ вливание больших объемов раствора антител в стриатум мурина и может быть скорректирован для других областей мозга и типов инфузата.
Раскрытие информации
Иоганнес вом Берг упоминается как изобретатель по патентной заявке (PCT/EP2012/070088) Цюрихского университета. Михал Беффингер, Линда Шеллхаммер и Иоганнес Вом Берг упоминаются в качестве изобретателей по патентной заявке (EP19166231) Цюрихского университета. У авторов нет дополнительных финансовых интересов.
Благодарности
Эта работа была поддержана грантами Цюрихского университета (FK-15-057), Фонда новартисов по медико-биологическим исследованиям (16C231) и Швейцарского онкологического исследования (KFS-3852-02-2016, KFS-4146-02-2017) Иоганнесу Фому Бергу и BRIDGE Proof of Concept (20B1-1 177300) Линде Шеллхаммер.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 μL syringe | Hamilton | 7635-01 | |
| 27 G blunt end needle | Hamilton | 7762-01 | |
| Agarose | Promega | V3121 | |
| Atipamezol | Janssen | ||
| Bone wax | Braun | 1029754 | |
| Buprenorphine | Indivior Schweiz AG | ||
| Carprofen | Pfizer AG | ||
| Dental drill bits, steel, size ISO 009 | Hager & Meisinger | 1RF009 | |
| Ethanol 100% | Reuss-Chemie AG | 179-VL03K-/1 | |
| Fentanyl | Helvepharm AG | ||
| FITC-Dextran, 2000 kDa | Sigma Aldrich | FD2000S | |
| Flumazenil | Labatec Pharma AG | ||
| Formaldehyde | Sigma Aldrich | F8775-500ML | |
| High viscosity cyanoacrylate glue | Migros | ||
| Iodine solution | Mundipharma | ||
| Medetomidin | Orion Pharma AG | ||
| Microforge | Narishige | MF-900 | |
| Midazolam | Roche Pharma AG | ||
| Ophthalmic ointment | Bausch + Lomb | Vitamin A Blache | |
| PBS | ThermoFischer Scientific | 10010023 | |
| Polyclonal goat anti-rat IgG (H+L) antibody coupled with Alexa Fluor 647 | Jackson Immuno | ||
| Scalpels | Braun | BB518 | |
| Silica tubing internal diameter 0.1 mm, wall thickness of 0.0325 mm | Postnova | Z-FSS-100165 | |
| Stereotactic frame for mice | Stoelting | 51615 | |
| Stereotactic robot | Neurostar | Drill and Injection Robot | |
| Succrose | Sigma Aldrich | S0389-500G | |
| Topical tissue adhesive | Zoetis | GLUture | |
| Trypan blue | ThermoFischer Scientific | 15250061 | |
| Water | Bichsel | 1000004 |
Ссылки
- Scherrmann, J. M. Drug delivery via the blood-brain barrier. Vascular Pharmacology. 38 (6), 349-354 (2002).
- Barua, N. U., Gill, S. S. Convection-enhanced drug delivery: prospects for glioblastoma treatment. CNS Oncology. 3 (5), 313-316 (2014).
- Bobo, R. H., et al. Convection-enhanced delivery of macromolecules in the brain. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2076-2080 (1994).
- Morrison, P. F., Laske, D. W., Bobo, H., Oldfield, E. H., Dedrick, R. L. High-flow microinfusion: tissue penetration and pharmacodynamics. American Journal of Physiology. 266 (1 Pt 2), R292-R305 (1994).
- Zhou, Z., Singh, R., Souweidane, M. M. Convection-Enhanced Delivery for diffuse intrinsic pontine glioma treatment. Current Neuropharmacology. 15 (1), 116-128 (2017).
- Barua, N. U., et al. Intrastriatal convection-enhanced delivery results in widespread perivascular distribution in a pre-clinical model. Fluids and Barriers of the CNS. 9 (1), 2 (2012).
- Shoji, T., et al. Local convection-enhanced delivery of an anti-CD40 agonistic monoclonal antibody induces antitumor effects in mouse glioma models. Neuro-Oncology. 18 (8), 1120-1128 (2016).
- Souweidane, M. M., et al. Convection-enhanced delivery for diffuse intrinsic pontine glioma: a single-centre, dose-escalation, phase 1 trial. The Lancet Oncology. , (2018).
- Zhang, X., et al. Targeting immune checkpoints in malignant glioma. Oncotarget. 8 (4), 7157-7174 (2017).
- Barua, N. U., Gill, S. S., Love, S. Convection-enhanced drug delivery to the brain: therapeutic potential and neuropathological considerations. Brain Pathology. 24 (2), 117-127 (2014).
- Mehta, A. M., Sonabend, A. M., Bruce, J. N. Convection-Enhanced Delivery. Neurotherapeutics. 14 (2), 358-371 (2017).
- Krauze, M. T., et al. Reflux-free cannula for convection-enhanced high-speed delivery of therapeutic agents. Journal of Neurosurgery. 103 (5), 923-929 (2005).
- Nash, K. R., Gordon, M. N. Convection Enhanced Delivery of Recombinant Adeno-associated Virus into the Mouse Brain. Methods in Molecular Biology. 1382, 285-295 (2016).
- Ohlfest, J. R., et al. Combinatorial antiangiogenic gene therapy by nonviral gene transfer using the sleeping beauty transposon causes tumor regression and improves survival in mice bearing intracranial human glioblastoma. Molecular Therapy. 12 (5), 778-788 (2005).
- Yin, D., Forsayeth, J., Bankiewicz, K. S. Optimized cannula design and placement for convection-enhanced delivery in rat striatum. Journal of Neuroscience Methods. 187 (1), 46-51 (2010).
- Mamot, C., et al. Extensive distribution of liposomes in rodent brains and brain tumors following convection-enhanced delivery. Journal of Neuro-Oncology. 68 (1), 1-9 (2004).
- Saito, R., et al. Tissue affinity of the infusate affects the distribution volume during convection-enhanced delivery into rodent brains: implications for local drug delivery. Journal of Neuroscience Methods. 154 (1-2), 225-232 (2006).
- Oh, S., et al. Improved distribution of small molecules and viral vectors in the murine brain using a hollow fiber catheter. Journal of Neurosurgery. 107 (3), 568-577 (2007).
- Barua, N. U., et al. A novel implantable catheter system with transcutaneous port for intermittent convection-enhanced delivery of carboplatin for recurrent glioblastoma. Drug Delivery. 23 (1), 167-173 (2016).
- Rosenbluth, K. H., et al. Design of an in-dwelling cannula for convection-enhanced delivery. Journal of Neuroscience Methods. 196 (1), 118-123 (2011).
- Debinski, W., Tatter, S. B. Convection-enhanced delivery for the treatment of brain tumors. Expert Review of Neurotherapeutics. 9 (10), 1519-1527 (2009).
- MacKay, J. A., Deen, D. F., Szoka, F. C. Distribution in brain of liposomes after convection enhanced delivery; modulation by particle charge, particle diameter, and presence of steric coating. Brain Research. 1035 (2), 139-153 (2005).
- Chen, Z. J., et al. A realistic brain tissue phantom for intraparenchymal infusion studies. Journal of Neurosurgery. 101 (2), 314-322 (2004).
- Sampson, J. H., et al. Poor drug distribution as a possible explanation for the results of the PRECISE trial. Journal of Neurosurgery. 113 (2), 301-309 (2010).
- Wick, W., Weller, M., et al. Trabedersen to target transforming growth factor-beta: when the journey is not the reward, in reference to Bogdahn et al. (Neuro-Oncology 2011;13:132-142). Neuro-Oncology. 13 (5), 559-560 (2011).
- Saito, R., Tominaga, T. Convection-enhanced delivery of therapeutics for malignant gliomas. Neurologia Medico-Chirurgica. 57 (1), 8-16 (2017).
- Bedussi, B., et al. Clearance from the mouse brain by convection of interstitial fluid towards the ventricular system. Fluids Barriers CNS. 12, 23 (2015).
- Noroxe, D. S., Poulsen, H. S., Lassen, U. Hallmarks of glioblastoma: a systematic review. ESMO Open. 1 (6), e000144 (2016).
- Boucher, Y., Salehi, H., Witwer, B., Harsh, G. R. t., Jain, R. K. Interstitial fluid pressure in intracranial tumours in patients and in rodents. British Journal of Cancer. 75 (6), 829-836 (1997).
- Glushakova, O. Y., et al. Prospective clinical biomarkers of caspase-mediated apoptosis associated with neuronal and neurovascular damage following stroke and other severe brain injuries: Implications for chronic neurodegeneration. Brain Circulation. 3 (2), 87-108 (2017).
- Vom Berg, J., et al. Inhibition of IL-12/IL-23 signaling reduces Alzheimer's disease-like pathology and cognitive decline. Nature Medicine. 18 (12), 1812-1819 (2012).
- Vom Berg, J., et al. Intratumoral IL-12 combined with CTLA-4 blockade elicits T cell-mediated glioma rejection. Journal of Experimental Medicine. 210 (13), 2803-2811 (2013).
- Kurdi, A., et al. Continuous administration of the mTORC1 inhibitor everolimus induces tolerance and decreases autophagy in mice. British Journal of Pharmacology. 173 (23), 3359-3371 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены