Method Article
Consegna di anticorpi nel cervello di Murine tramite consegna convezione-migliorato
In questo articolo
Riepilogo
La consegna a convezione migliorata (CED) è un metodo che consente la consegna efficace delle terapie nel cervello mediante la perfusione diretta di grandi volumi di tessuto. La procedura richiede l'uso di cateteri e una procedura di iniezione ottimizzata. Questo protocollo descrive una metodologia per il CED di un anticorpo in un cervello di topo.
Abstract
La consegna a convezione (CED) è una tecnica neurochirurgica che consente una perfusione efficace di grandi volumi cerebrali utilizzando un sistema di catetere. Tale approccio fornisce un metodo di somministrazione sicuro superando la barriera ematoencefalica (BBB), consentendo così il trattamento con terapie con scarsa permeabilità BBB o quelli per i quali l'esposizione sistemica non è desiderata, ad esempio a causa della tossicità. CED richiede l'ottimizzazione del design del catetere, del protocollo di iniezione e delle proprietà dell'infusate. Con questo protocollo viene descritto come eseguire il CED di una soluzione contenente fino a 20 g di anticorpo nel putamen caudato dei topi. Descrive la preparazione dei cateteri a gradini, testandoli in vitro ed eseguendo il CED nei topi utilizzando un programma di iniezione rampante. Il protocollo può essere facilmente regolato per altri volumi di infusione e può essere utilizzato per iniettare vari tracciatori o sostanze farmacologicamente attive o inattive, tra cui chemioterapiche, citochine, particelle virali e liposomi.
Introduzione
La barriera ematoencefalica (BBB) forma un confine semipermeabile che separa il sistema nervoso centrale (SNC) dalla circolazione sanguigna. Raggiungere il CNS con terapie è tuttavia necessario nel contesto di varie malattie, come tumori cerebrali, Morbo di Alzheimer (AD) o morbo di Parkinson (PD) tra gli altri1. Questo diventa importante nello sviluppo di nuove terapie, soprattutto se il farmaco testato presenta scarsa permeabilità BBB o la sua esposizione sistemica può portare a tossicità pericolosa1,2. Alcuni degli anticorpi clinicamente utilizzati mostrano entrambe queste caratteristiche. Una soluzione a questo problema sarebbe quella di fornire le terapie direttamente dietro la BBB.
La consegna convezione-migliorato (CED) è una tecnica neurochirurgica che consente una perfusione efficace di grandi volumi cerebrali. Ciò si ottiene installando chirurgicamente uno o più cateteri nell'area di destinazione. Durante l'applicazione del farmaco, si forma un gradiente di pressione all'apertura del catetere, che diventa la forza motrice della dispersione infusate nel tessuto3,4. È quindi la durata dell'infusione e non i coefficienti di diffusione che determinano l'intervallo di perfusione2,4,5. Questo fornisce una consegna uniforme dell'infusate su un volume cerebrale molto più grande rispetto ai metodi convenzionali di iniezione intracerebrale basati sulla diffusione2,6. Allo stesso tempo, questa modalità di consegna ha un minor rischio di danni ai tessuti2. Di conseguenza, il CED può consentire una somministrazione sicura ed efficace della chemioterapeutica convenzionale per il trattamento dei tumori del SNC, nonché la somministrazione di agenti immunomodulatori o anticorpi agonistici e antagonisti in una moltitudine di altri disturbi del SNC2 ,7,8,9. CED è attualmente testato in terapie del morbo di Parkinson, Morbo di Alzheimer, così come glioma di alta qualità2,7,8,10,11.
Il design del catetere e il regime di iniezione sono tra i fattori più importanti che influenzano l'esito del CED 10,12,13,14,15,16. Inoltre, richiede specifiche proprietà fisiche dell'infusate, comprese le dimensioni moderate delle particelle, una carica anionica e una bassa affinità tissutale 10,17. Ognuno di questi parametri deve essere potenzialmente regolato in base alle caratteristiche istologiche della regione del cervello da mirare2,10,17.
Qui descriviamo la metodologia per l'esecuzione del CED di una soluzione anticorpale nel putamen caudato (striato) dei topi. Inoltre, il protocollo include la preparazione di cateteri a gradini in una configurazione di laboratorio, testandoli in vitro ed eseguendo il CED.
Ci sono più disegni di catetere disponibili nella letteratura, che differiscono per la forma della cannula, i materiali utilizzati e il numero di aperture catetere12,15,18,19,20 ,21,22. Stiamo usando un catetere a gradini fatto di un capillare di silice fuso sporgente 1 mm da un ago metallico finale smussato. Questo design catetere può essere facilmente prodotto in un laboratorio di ricerca e fornisce risultati cED riproducibili quando testato in vitro con blocchi di agarose con parametri fisici simili al parenchyma cerebrale in vivo23.
Inoltre, implementiamo un regime di rampa per la consegna di 5 LeL di infusate in vivo. In un protocollo di questo tipo il tasso di iniezione è aumentato da 0,2 a 0,8 l/min, riducendo così al minimo le probabilità di reflusso lungo il catetere e il rischio di danni ai tessuti16. Utilizzando questo protocollo, abbiamo somministrato con successo topi con fino a 20 g di anticorpi in 5 gradi l di PBS nel corso di 11 min 30 s.
Il protocollo può essere facilmente regolato per altri volumi di infusione o per iniettare varie altre sostanze, ad esempio chemioterapiche, citochine, particelle virali o liposomi2,10,14,18 ,22. In caso di utilizzo di infusate con proprietà fisiologiche drasticamente diverse rispetto a una soluzione salina tamponata da fosfato (PBS) o fluido cerebrospinale artificiale (aCSF) di anticorpi, si raccomandano ulteriori misure di convalida. Per l'assemblaggio del catetere, la convalida e il CED, descriviamo tutti i passaggi utilizzando un robot stereotassico con un'unità di perforazione e iniezione montata su un normale telaio stereotassico. Questa procedura può essere eseguita anche con un telaio stereotassico manuale collegato alla pompa a microinfusione programmabile che può guidare i microsiringi di vetro descritti.
Protocollo
Tutti i metodi qui descritti sono stati approvati dall'Ufficio veterinario cantonale svizzero con numero di licenza 246/15.
1. Preparazione dei cateteri a gradini
- Preparazione di un tubo di silice fuso per la fase del catetere
- Tagliare la silice fusa capillare con diametro interno di 0,1 mm e spessore della parete di 0,0325 mm a una lunghezza di 30 mm.
- Esaminare il tubo per le crepe e smalto calore le estremità utilizzando una microforgia per garantire le aperture tubo hanno una superficie liscia.
- Fissazione della camera d'aria in un ago metallico
- Montare un ago da 27 G su una siringa da 10 litri e posizionare la siringa in un robot stereotassico.
- Utilizzando il robot, spostare la siringa su una superficie dura e toccarla con la punta dell'ago. Questa posizione deve essere annotata o salvata nel software perché servirà come superficie di riferimento per impostare la lunghezza del gradino.
- Elevare l'ago per consentire il posizionamento del capillare di silice fuso all'interno dell'ago
- Mettere la silice capillare fusa nell'ago in modo che 20 mm del capillare sporge dall'ago.
- Utilizzando una pipetta, si è sparsa uniformemente 2 -L di alta viscosità adesivo cianoacrita sopra il capillare, partendo dall'ago metallico e finendo 10 mm sopra l'estremità inferiore del capillare, come raffigurato figura 2.
- Utilizzando il robot stereotassico, abbassare l'ago fino a quando la punta dell'ago metallico è 1 mm sopra la superficie di riferimento. In questo modo il capillare di silice fuso sarà fissato nell'ago di metallo e formerà un passo di 1 mm dalla punta dell'ago metallico. Rimuovere l'eccesso di formazione della colla all'estremità dell'ago metallico per evitare di smussare il passo.
- Attendere 15 min per la colla per indurire e rimuovere la siringa con il catetere dal robot stereotassico. Confermare che al momento in cui tutta la colla in eccesso è stata rimossa controllando la punta del catetere al microscopio.
- Test del catetere a gradino utilizzando un blocco di agarose
- Preparare la soluzione agarose 0,6% in PBS in un vassoio di gel convenzionale e attendere che venga polimerizzato. Tagliare l'agarose in blocchi da circa 20 mm x 20 mm. Fino all'uso, tenere i blocchi immersi in PBS.
- Riempire manualmente la siringa del catetere a gradini con una soluzione di 10 gradini dello 0,4% di blu trypan filtrato.
- Utilizzando il robot stereotassico, erogare 1 L a 0,2 l/min per valutare l'inguarizione della fase del catetere durante la procedura di fissaggio. La soluzione blu Trypan dovrebbe essere visibile esclusivamente sulla punta del catetere. Puliscilo con un fazzoletto di carta.
- Posizionare il blocco agarose nel robot stereotassivo e calibrare il robot in modo che la punta del catetere sia referenziata sulla superficie del blocco agarose.
- Programmare i parametri di iniezione per il CED.
- Per il volume di iniezione di 5 gradi, utilizzare i seguenti passaggi: 1 : L a 0,2 l/min, quindi 2 ll a 0,5 l/min e 2 ll a 0,8 gradi l/min.
- Al fine di iniettare la soluzione in putamen caudato murino (striato), eseguire tale iniezione in una posizione 1 mm frontale e 1,5–2 mm laterale da bregma alla profondità di 3,5 mm.
- Dopo l'iniezione, lasciare il catetere in posizione per 2 min e poi ritrarre a 1 mm / min per garantire la corretta dispersione del fluido nel cervello e la sigillazione del tratto di iniezione durante la rimozione del catetere.
NOT: A seconda dello specifico robot stereotassico utilizzato, tutti i parametri possono essere programmati in un unico script. Uno script di esempio è disponibile come Materiale supplementare.. .
- Avviare la procedura CED e iniettare 5 - L di soluzione blu trypan nel blocco di agarose.
- Valutare la forma della nube di blu trypan nell'agarose e la potenziale perdita lungo il tratto del catetere. Il blu Trypan dovrebbe formare un ellissoide o una nuvola rotonda con il centro intorno alla punta del catetere e un diametro di almeno 1 mm. Non dovrebbe essere visibile alcun grande riflusso sulla punta dell'ago metallico.
- Mettere un nuovo blocco di agarose e iniziare una seconda iniezione di 1 L a 0,2 l/min per valutare l'intasamento del catetere con l'agarose. Trypan blu dovrebbe ricominciare a formare una nuvola dalla punta del catetere subito dopo l'inizio dell'iniezione.
- Valutare se il volume resimo nella siringa corrisponde a 3. Eventuali variazioni potrebbero indicare una fuoriuscita di liquido attraverso il montaggio del catetere o lo stanensire di siringhe.
- Se tutte le iniezioni di prova hanno successo, il catetere è ben sigillato, dritto e nessuna soluzione blu trypan è osservata da altri punti che la punta del catetere, lavare il catetere con deionizzato H2O (dH2O) fino a quando non sono visibili tracce di blu trypan e poi lavare dieci volte come segue: 70% etanolo e 100% etanolo seguito da lavaggio di nuovo con 70% di etanolo e acqua pulita deionizzata.
- Conservare il catetere in condizioni asciutte.
2. Consegna potenziata dalla convezione della soluzione anticorpale nel cervello di Murine
NOT: A seconda delle normative locali sul benessere degli animali, per questa procedura possono essere implementati vari tipi di anestetici, analgesici e antibiotici. Questo protocollo descrive l'uso di anestesia a iniezione. Gli anestetici di inalazione come l'isoflurane possono essere utilizzati anche montando una maschera per il naso sul telaio stereotassico. Inoltre, si consiglia di aggiungere antibiotici all'acqua potabile per la profilassi infezione.
- Configurazione chirurgica
- Preparare anestetici e soluzioni antidoto. I topi possono essere anestesisti in modo sicuro utilizzando un'anestesia a tre componenti contenente fentanil (0,05 mg/kg), midazolam (5 mg/kg) e medetomidine (0,5 mg/kg) diluiti in sterile dH2O. Eseguiamo una procedura di risveglio in due fasi utilizzando due soluzioni antidoto, una contenente flumazenil (0,5 mg/kg) e buprenorfina (0,1 mg/kg) in sterile dH2O (prima soluzione antidote). Il secondo contiene atipamezolo (2,5 mg/kg) in sterile dH2O (seconda soluzione antidoto).
- Preparare la soluzione di analgesia contenente carprofene (5.667 mg/kg) diluito con sterile dH2O.
- Pulire il telaio stereotassico, il pad di riscaldamento e gli elementi del robot stereotassico. Tenete a mente che non tutte le parti del robot possono essere pulite senza rischio di danni. Fare riferimento al manuale del robot per i dettagli sulla pulizia e la preparazione per l'uso.
- Assemblare la siringa con il catetere a gradini e sciacquarla più volte con dH2O, 70% etanolo e 100% etanolo seguito da vampate di nuovo con 70% etanolo e dH2O. Infine, lavare la siringa con PBS o altri buffer da utilizzare per la preparazione della soluzione per l'iniezione intracranica, ad esempio liquido cerebrospinale artificiale. Lo stantuffo della siringa dovrebbe muoversi senza intoppi e liberamente durante l'intera procedura.
- Calibrare il software robot stereotassico con la cornice stereotassica.
- Testare il software robot stereotassico assicurandosi che i bracci del robot si muovano liberamente e che la pompa di iniezione sia collegata correttamente e possa eseguire la procedura CED senza disturbi. Questo include il test del movimento del robot, l'iniezione rampa, il controllo della fase di attesa di 2 min e la velocità di retrazione del catetere. Tutti i parametri devono essere adatti alla procedura CED preprogrammata descritta al punto 1.3.5.
- Inserire la punta del trapano nel trapano. Si raccomanda di sterilizzare le punte di perforazione prima dell'uso.
- Preparare la soluzione anticorpale utilizzando PBS o altre soluzioni di buffer come aCSF. È possibile iniettare da 1 a 20 g di anticorpi in 5 o l in un'unica procedura CED. Altri volumi e quantità proteiche devono essere testati prima di eseguire l'esperimento. Tenere presente che l'utilizzo di soluzioni di elevata viscosità potrebbe portare all'intasamento del catetere.
- Caricare manualmente la siringa con l'anticorpo diluito.
- Iniezione di anticorpi dal CED nello striato
- Pesare il topo e iniettare la soluzione di anestesia a tre componenti nel peritoneo in base al peso corporeo. Prendere nota del tempo di iniezione. Trasferire il mouse in una gabbia separata riscaldata con una piastra di riscaldamento.
- Osservare il mouse per determinare quando inizia la sedazione. Non appena il mouse smette di muoversi, applicare unguento oftalmico sugli occhi per proteggere la cornea dall'essiccazione durante l'intervento chirurgico. La sedazione completa di solito inizia 10–15 min dall'iniezione della soluzione di anestesia a tre componenti.
- Controllare le reazioni del dolore utilizzando il test di pizzico-reflex per garantire l'anestesia completa dell'animale.
- Rasare la testa con un trimmer per capelli.
- Disinfettare la pelle con tamponi di cotone imbevuti di iodio in soluzione di iodio. Scrub la pelle tre volte in movimento circolare.
- Utilizzando un bisturi, fare un'incisione cutanea di 10 mm lungo la linea mediana cranica finitura a livello degli occhi.
- Fissare il mouse nel telaio stereotassico utilizzando il morsetto del naso e le barre dell'orecchio. Assicurarsi che la superficie del cranio sia orizzontale e ben fissata. Oltre alla corretta navigazione anatomica questo è anche cruciale per evitare l'inclinazione del cranio durante la perforazione e la procedura CED.
- Posizionare la siringa nel robot stereotassico.
- Sincronizzare la punta di foratura con la punta del catetere su un punto di riferimento. È fondamentale che la relazione tra la posizione del trapano e la siringa sia determinata con precisione nel software, quindi l'iniezione può essere eseguita nella regione anatomica desiderata del cervello.
- Ritirare la pelle con pinze e localizzare il bregma sulla superficie del cranio.
- Riferimento bregma nel software utilizzando la punta della punta del trapano.
- Spostare il trapano in una posizione frontale di 1 mm e 2 mm laterale da bregma e praticare un foro di bava. Fare attenzione a non danneggiare la dura mater.
- Spostare la siringa sul foro della bava.
- Distribuisci 0,5–1 - L dalla siringa per garantire che non vengano lasciate bolle d'aria nel catetere.
- Avviare il programma CED descritto nel punto 1.3.5. Osservare la superficie del cranio per eventuali tracce di riflusso del fluido dal punto di iniezione. Monitorare la frequenza respiratoria dell'animale.
- Una volta che il programma CED è finito e il catetere viene ritirato dal cervello, avviare la pompa di iniezione a 0,2 l/min al fine di verificare la intasamento del catetere durante il CED. Se non si è verificato alcun intasamento, si dovrebbe vedere immediatamente una goccia di miscela di iniezione proveniente dalla punta del catetere.
- Prima di riutilizzare o conservare il catetere, esaminare visivamente il passaggio del catetere per eventuali segni di danno o usura al microscopio e pulirlo come al punto 1.3.10.
- Procedura di risveglio
- Rimuovere delicatamente il mouse dal telaio stereotassico.
- Lavare il sito di chirurgia con soluzione salina sterile.
- Usando le pinze, riempi il foro di bava con la cera ossea.
- Chiudere la pelle con pinze a punta sottile e applicare la colla chirurgica con una pipetta da 10 luna sopra il taglio. Attendere 15-30 s per la colla per polimerizzare.
- Applicare la soluzione di analgesia mediante iniezione sottocutanea. Prendere nota dell'ora di iniezione.
- Applicare la prima soluzione antidoto. Prendere nota dell'ora di iniezione.
- Trasferire il mouse in una gabbia separata con un pad di riscaldamento e monitorare l'animale per i riflessi di avvistamenti.
- Se il topo non ha acquisito piena conoscenza 15 min dopo la somministrazione della prima soluzione antidoto, applicare la seconda soluzione antidoto con iniezione sottocutanea.
- Monitorare gli animali durante la fase di recupero.
- Controllare 1-2 h più tardi e il giorno successivo per le complicazioni post-operatorie. Se necessario, riapplicare l'analgesia.
- Per la profilassi dell'infezione, aggiungere il sulfadoxina (concentrazione finale 0,08% w/v) e il trimethoprim (concentrazione finale 0,016% w/v) all'acqua potabile a cui gli animali hanno accesso ad libitum per 1 settimana dopo l'intervento chirurgico.
Risultati
Questo protocollo consente la preparazione di cateteri di gradini (Figura 1) da utilizzare nella procedura CED in un ambiente di laboratorio. Al fine di controllare i cateteri per le perdite, il reflusso lungo il tratto dell'ago e l'intasamento, si consiglia di eseguire iniezioni di un colorante, ad esempio, soluzione blu trypan, in un blocco agarose. Figura 3 raffigura una nuvola di forma blu trypan dopo l'iniezione di 1 : L a 0,5 l/minuto utilizzando un catetere CED (Figura 3A). Nessun reflusso lungo il tratto dell'ago era visibile all'inizio del gradino del catetere. Inoltre, la nube dispersa forma una forma sferica desiderata. Questo è in contrasto con i risultati ottenuti utilizzando un ago finale smussato convenzionale 27 G (Figura 3B), dove si potrebbe osservare un reflusso significativo.
Inoltre, il CED richiede una procedura di iniezione ottimizzata. La figura 4 mostra i risultati dell'iniezione di 2 - L di trypan blu in un blocco di agarose utilizzando la procedura di rampa descritta nel protocollo (A) rispetto a un'iniezione ad una velocità costante di 2 L/minuto (B). L'alta velocità di iniezione ha forzato il reflusso lungo il catetere anche quando è stato utilizzato un catetere CED.
Infine, come illustrato nella Figura 5, CED consente la perfusione di grandi volumi del cervello murino. I topi sono stati iniettati con un anticorpo antito-topo TNF-dextran combinato con FITC-dextran in 5 -L di PBS da CED (pannello superiore) o da un'iniezione di bolus convenzionale (pannello inferiore). Il profilo di perfusione del CED era più uniforme rispetto all'iniezione convenzionale e si potevano osservare meno danni ai tessuti. In entrambi i casi c'era un tipico profilo di distribuzione delle particelle di anticorpi e dextran sopra il corpo calloso. Tuttavia, il profilo di dispersione dell'anticorpo iniettato era più diffuso rispetto al dextran ad alto peso molecolare, esemplificando le differenze di distribuzione tra infusati diversi.

Figura 1: Un disegno schematico che mostra la punta del catetere del cED. Viste frontale (A) e lato (B). Lo schema non è in grado di scalare. Fare clic qui per visualizzare una versione più grande di questa figura.
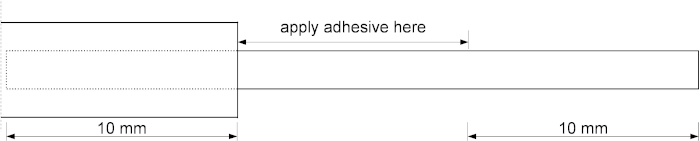
Figura 2: Un disegno schematico che rappresenta l'area di applicazione dell'adesivo. I 10 mm superiori del tubo di silice fuso sono inseriti nell'ago metallico. Applicare l'adesivo sui 10 mm di tubo a partire dalla punta dell'ago metallico. Fare clic qui per visualizzare una versione più grande di questa figura.
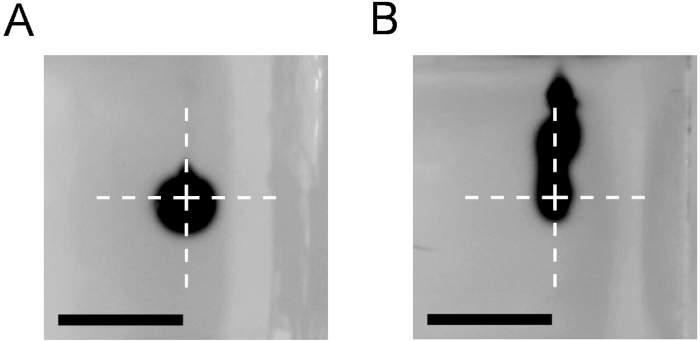
Figura 3: Confronto dei risultati di infusione utilizzando catetere CED o un ago contundente. Iniezione di 1 L dello 0,4% di blu trypan in un blocco di agarose dello 0,6% a 0,5 l/minuto utilizzando un catetere CED (A) e un ago con estremità smussata 27G (B). Foto scattate immediatamente dopo il catetere o il ritiro dell'ago. La croce segna la punta del catetere o dell'ago. Barra di scala - 5 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
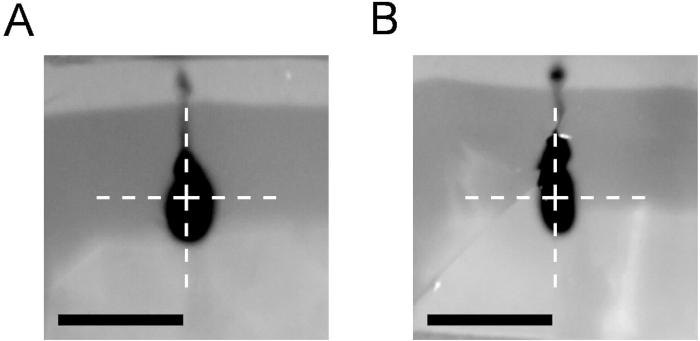
Figura 4: Confronto dei risultati di infusione del protocollo CED ramping con protocollo a velocità costante. Iniezione di 2 gradi di 0,4% di blu trypan nello 0,6% blocco di agarose utilizzando un protocollo CED rampante (0,4 l a 0,2 l/min, quindi 0,8 l a 0,5 l/min e 0,8 gradi l a 0,8 l/min (A) o un protocollo di iniezione a velocità costante 2L/min (B). In entrambi i casi è stato utilizzato un catetere CED. Foto scattate immediatamente dopo il ritiro del catetere. La croce segna la punta del catetere. Barra di scala - 5 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Risultati rappresentativi della perfusione di striato murine da parte del CED o mediante iniezione di bolo convenzionale. I topi sono stati iniettati nello striato (posizione 1 mm frontale e 2 mm laterale da bregma, profondità di 3,5 mm) con 1 g di ratto anti-topo TNF, combinato con 1 g di FITC-Dextran con il peso molecolare 2.000 kDa in 5 - L di PBS. È stato eseguito il protocollo CED (pannello superiore) o un'iniezione di bolus convenzionale (27 G di ago, velocità di iniezione 1 L/minuto) (in basso). I topi sono stati sacrificati subito dopo la procedura CED da asfissia controllata di CO2 e perfusi con il 4% di formaldeide in PBS. I cervelli sono stati sezionati e inoltre fissati con 4% formaldeide in PBS a 4 gradi centigradi per 24 h. Successivamente, i cervelli sono stati lavati con il 15% di saccarosio per 60 min e trasferiti al 30% di saccarosio a 4 gradi centigradi. Dopo 24 h, i cervelli sono stati congelati sul ghiaccio secco. Le sezioni fluttuanti (25 m) sono state colorate usando anticorpi igG policlonali di capra (H-L) accoppiati con Alexa Fluor 647 e controordinati con DAPI. Le immagini sono state elaborate utilizzando la distribuzione Fiji di ImageJ. Ingrandimento 10x, barra di scala - 5 mm. 4 topi per gruppo; viene visualizzata un'immagine rappresentativa. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La consegna migliorata della convezione, o infusione di farmaci mediati dalla pressione nel cervello, è stata proposta per la prima volta all'inizio del 19903. Questo approccio promette la perfusione di grandi volumi cerebrali dietro la barriera ematoencefalica in modo controllato2. Tuttavia, finora, solo pochi studi clinici sono stati eseguiti utilizzando questo approccio, in parte perché cED in una configurazione clinica ha dimostrato di essere tecnicamente esigente24,25. Recenti sviluppi nei programmi di progettazione e infusione del catetere sembrano aver superato queste difficoltà tecniche8,19. I progressi compiuti nell'attuazione clinica di anticorpi terapeutici, tra cui l'avvento di agenti di blocco del checkpoint immunomodulatori, attendono l'applicazione nel trattamento dei disturbi del SNC10. Questo sviluppo può essere notevolmente aumentato impiegando CED nella configurazione sperimentale, ad esempio utilizzando piccoli modelli di roditori.
Vari modelli di malattia del SNC sono disponibili nei topi. Questi includono l'encefalomielite autoimmune sperimentale (EAE) per la sclerosi multipla (MS) e modelli geneticamente ingegnerizzati per il morbo di Alzheimer (AD), il morbo di Parkinson (PD) o per il cancro al cervello. Molti modelli di tumore al cervello si basano anche sull'inoculazione ortotopica del tumore delle linee cellulari del glioma murino o sull'impianto di xenotrapiatori derivati dal paziente. Questo protocollo consente la consegna di soluzioni anticorpali direttamente in luoghi anatomici specifici, simile così a procedure terapeutiche. Può essere implementato in vari layout sperimentali in cui la consegna di anticorpi in una precisa regione del cervello svolge un ruolo fondamentale.
Il fattore critico nell'esecuzione del CED nei topi è la disponibilità di cateteri. Questo protocollo contiene una descrizione precisa di come assemblare un catetere a gradini e testarlo in una serie di esperimenti in vitro. Si dovrebbe tenere a mente che la silice fusa di cui è fatto il tubo passo è un materiale fragile e la qualità del CED con un determinato catetere potrebbe diminuire nel tempo. Si raccomanda di controllare i parametri dei cateteri a gradino tra gli esperimenti in vivo ripetendo i test in vitro descritti nella sezione protocollo 1.3.
Il protocollo può essere regolato per diversi volumi di iniezione, tipi di regioni infusate e cerebrali. Il volume di iniezione può essere manipolato modificando proporzionalmente la durata delle fasi di iniezione. Qui descriviamo l'infusione di 5 L, ma CED con 10 l di soluzione anticorpale è stato riportato in letteratura utilizzando un approccio simile nei modelli tumorale murino, ottenendo un'eccellente distribuzione dei tessuti e volumi di perfusione di gran lunga superiori all'iniezione di bolus7 . Inoltre, sono stati segnalati fino a 28 volumi di infnonanti lunatici utilizzando CED per l'applicazione di liquidi nel cervello del ratto22,26. Le sostanze non proteiche possono anche essere iniettate dal CED, tenendo presente che l'infsuoevole non dovrebbe essere di alta viscosità per evitare l'intasamento della punta del catetere stretto. Utilizzando i liposomi, è stato dimostrato che la carica delle molecole infuse può influenzare notevolmente la penetrazione del tessuto, con particelle neutre o caricate negativamente che possono essere distribuite sui volumi più grandi22. Come illustrato nella figura 5, FITC-dextran e anticorpi si disperdono in modo diverso: sebbene sia gli anticorpi che FITC-dextran distribuiscano in modo simile lungo il corpo calloso, la penetrazione degli anticorpi del parenchyma cerebrale è più diffusa rispetto a FITC-dextran, che mostra un raggio più piccolo e un modello di distribuzione più macchiato. Questo sottolinea le differenze nel profilo CED tra infusates con proprietà fisico variabili.
Inoltre, l'esperimento CED descritto qui e illustrato nella Figura 5 è stato eseguito l'iniezione di un anticorpo anti-mouse TNF , in topi sani, in modo da assumere una quantità minima di bersaglio nello striato. La presenza di antigene cognato cambierà il modello di distribuzione dei tessuti. Può essere ulteriormente influenzato dal tessuto inomogeneo in un sito anatomico, come illustrato nella Figura 5 dalla distribuzione dell'infusate lungo il corpo calloso.
Infine, il CED è influenzato dal flusso di liquido interstiziale, che nel caso dell'iniezione di striato, può lavare l'infsuoe verso i ventricoli laterali27. Infatti, anche quando il tessuto viene fissato immediatamente dopo la finitura del CED, possiamo osservare una marcata adesione dell'anticorpo iniettato alla parete del ventricolo (Figura 5). Questo può essere ulteriormente influenzato da condizioni patologiche del SNC, ad esempio nel contesto dei tumori cerebrali. La necrosi focale, spesso osservata nei tumori cerebrali di alta qualità28, può influenzare il flusso di liquido interstiziale e quindi alterare il modello di distribuzione dell'infusati29. Altre condizioni patologiche che possono portare a una modifica della distribuzione dei tessuti di infusate rispetto al parenchyma sano includono ictus o lesioni cerebrali traumatiche30. Per riassumere, ogni serie di esperimenti CED deve essere attentamente convalidata per garantire una perfusione di successo della regione del cervello bersaglio.
Attualmente, i ricercatori utilizzano spesso pompe osmotiche impiantabili per fornire sostanze nel CSF o cervello (tumore) parenchyma31,32,33. In alcuni casi il CED come descritto qui può essere utilizzato come alternativa. Può essere eseguito più volte con frequenze a seconda della regione del cervello, tipo di infusate, volume e protocollo di anestesia utilizzato. La somministrazione intermittente di farmaci può essere particolarmente rilevante quando un'esposizione prolungata all'infusate porta alla tolleranza o agli effetti collaterali sistemici. È concepibile che nei casi in cui vengono consegnati infnonenti ad alta ritenzione e di emivita, questo approccio rappresenterebbe un perfezionamento secondo il principio 3R poiché non sarebbe necessario alcun impianto della pompa. In conclusione, questo protocollo descrive un modo efficiente di infondere grandi volumi di soluzione anticorpale nello striato murino e può essere regolato per altre regioni del cervello e tipi di infusati.
Divulgazioni
Johannes vom Berg è menzionato come inventore della domanda di brevetto (PCT/EP2012/070088) dell'Università di zurighese. Michal Beffinger, Linda Schellhammer e Johannes vom Berg sono menzionati come inventori su una domanda di brevetto (EP19166231) dell'Università di zurigo. Gli autori non hanno interessi finanziari aggiuntivi.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni dell'Università di zurigo (FK-15-057), della Novartis Foundation for medical-biological Research (16C231) e della Swiss Cancer Research (KFS-3852-02-2016, KFS-4146-02-2017) a Johannes vom Berg e BRIDGE Proof of Concept (20B1-1 _177300) a Linda Schellhammer.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 μL syringe | Hamilton | 7635-01 | |
| 27 G blunt end needle | Hamilton | 7762-01 | |
| Agarose | Promega | V3121 | |
| Atipamezol | Janssen | ||
| Bone wax | Braun | 1029754 | |
| Buprenorphine | Indivior Schweiz AG | ||
| Carprofen | Pfizer AG | ||
| Dental drill bits, steel, size ISO 009 | Hager & Meisinger | 1RF009 | |
| Ethanol 100% | Reuss-Chemie AG | 179-VL03K-/1 | |
| Fentanyl | Helvepharm AG | ||
| FITC-Dextran, 2000 kDa | Sigma Aldrich | FD2000S | |
| Flumazenil | Labatec Pharma AG | ||
| Formaldehyde | Sigma Aldrich | F8775-500ML | |
| High viscosity cyanoacrylate glue | Migros | ||
| Iodine solution | Mundipharma | ||
| Medetomidin | Orion Pharma AG | ||
| Microforge | Narishige | MF-900 | |
| Midazolam | Roche Pharma AG | ||
| Ophthalmic ointment | Bausch + Lomb | Vitamin A Blache | |
| PBS | ThermoFischer Scientific | 10010023 | |
| Polyclonal goat anti-rat IgG (H+L) antibody coupled with Alexa Fluor 647 | Jackson Immuno | ||
| Scalpels | Braun | BB518 | |
| Silica tubing internal diameter 0.1 mm, wall thickness of 0.0325 mm | Postnova | Z-FSS-100165 | |
| Stereotactic frame for mice | Stoelting | 51615 | |
| Stereotactic robot | Neurostar | Drill and Injection Robot | |
| Succrose | Sigma Aldrich | S0389-500G | |
| Topical tissue adhesive | Zoetis | GLUture | |
| Trypan blue | ThermoFischer Scientific | 15250061 | |
| Water | Bichsel | 1000004 |
Riferimenti
- Scherrmann, J. M. Drug delivery via the blood-brain barrier. Vascular Pharmacology. 38 (6), 349-354 (2002).
- Barua, N. U., Gill, S. S. Convection-enhanced drug delivery: prospects for glioblastoma treatment. CNS Oncology. 3 (5), 313-316 (2014).
- Bobo, R. H., et al. Convection-enhanced delivery of macromolecules in the brain. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2076-2080 (1994).
- Morrison, P. F., Laske, D. W., Bobo, H., Oldfield, E. H., Dedrick, R. L. High-flow microinfusion: tissue penetration and pharmacodynamics. American Journal of Physiology. 266 (1 Pt 2), R292-R305 (1994).
- Zhou, Z., Singh, R., Souweidane, M. M. Convection-Enhanced Delivery for diffuse intrinsic pontine glioma treatment. Current Neuropharmacology. 15 (1), 116-128 (2017).
- Barua, N. U., et al. Intrastriatal convection-enhanced delivery results in widespread perivascular distribution in a pre-clinical model. Fluids and Barriers of the CNS. 9 (1), 2 (2012).
- Shoji, T., et al. Local convection-enhanced delivery of an anti-CD40 agonistic monoclonal antibody induces antitumor effects in mouse glioma models. Neuro-Oncology. 18 (8), 1120-1128 (2016).
- Souweidane, M. M., et al. Convection-enhanced delivery for diffuse intrinsic pontine glioma: a single-centre, dose-escalation, phase 1 trial. The Lancet Oncology. , (2018).
- Zhang, X., et al. Targeting immune checkpoints in malignant glioma. Oncotarget. 8 (4), 7157-7174 (2017).
- Barua, N. U., Gill, S. S., Love, S. Convection-enhanced drug delivery to the brain: therapeutic potential and neuropathological considerations. Brain Pathology. 24 (2), 117-127 (2014).
- Mehta, A. M., Sonabend, A. M., Bruce, J. N. Convection-Enhanced Delivery. Neurotherapeutics. 14 (2), 358-371 (2017).
- Krauze, M. T., et al. Reflux-free cannula for convection-enhanced high-speed delivery of therapeutic agents. Journal of Neurosurgery. 103 (5), 923-929 (2005).
- Nash, K. R., Gordon, M. N. Convection Enhanced Delivery of Recombinant Adeno-associated Virus into the Mouse Brain. Methods in Molecular Biology. 1382, 285-295 (2016).
- Ohlfest, J. R., et al. Combinatorial antiangiogenic gene therapy by nonviral gene transfer using the sleeping beauty transposon causes tumor regression and improves survival in mice bearing intracranial human glioblastoma. Molecular Therapy. 12 (5), 778-788 (2005).
- Yin, D., Forsayeth, J., Bankiewicz, K. S. Optimized cannula design and placement for convection-enhanced delivery in rat striatum. Journal of Neuroscience Methods. 187 (1), 46-51 (2010).
- Mamot, C., et al. Extensive distribution of liposomes in rodent brains and brain tumors following convection-enhanced delivery. Journal of Neuro-Oncology. 68 (1), 1-9 (2004).
- Saito, R., et al. Tissue affinity of the infusate affects the distribution volume during convection-enhanced delivery into rodent brains: implications for local drug delivery. Journal of Neuroscience Methods. 154 (1-2), 225-232 (2006).
- Oh, S., et al. Improved distribution of small molecules and viral vectors in the murine brain using a hollow fiber catheter. Journal of Neurosurgery. 107 (3), 568-577 (2007).
- Barua, N. U., et al. A novel implantable catheter system with transcutaneous port for intermittent convection-enhanced delivery of carboplatin for recurrent glioblastoma. Drug Delivery. 23 (1), 167-173 (2016).
- Rosenbluth, K. H., et al. Design of an in-dwelling cannula for convection-enhanced delivery. Journal of Neuroscience Methods. 196 (1), 118-123 (2011).
- Debinski, W., Tatter, S. B. Convection-enhanced delivery for the treatment of brain tumors. Expert Review of Neurotherapeutics. 9 (10), 1519-1527 (2009).
- MacKay, J. A., Deen, D. F., Szoka, F. C. Distribution in brain of liposomes after convection enhanced delivery; modulation by particle charge, particle diameter, and presence of steric coating. Brain Research. 1035 (2), 139-153 (2005).
- Chen, Z. J., et al. A realistic brain tissue phantom for intraparenchymal infusion studies. Journal of Neurosurgery. 101 (2), 314-322 (2004).
- Sampson, J. H., et al. Poor drug distribution as a possible explanation for the results of the PRECISE trial. Journal of Neurosurgery. 113 (2), 301-309 (2010).
- Wick, W., Weller, M., et al. Trabedersen to target transforming growth factor-beta: when the journey is not the reward, in reference to Bogdahn et al. (Neuro-Oncology 2011;13:132-142). Neuro-Oncology. 13 (5), 559-560 (2011).
- Saito, R., Tominaga, T. Convection-enhanced delivery of therapeutics for malignant gliomas. Neurologia Medico-Chirurgica. 57 (1), 8-16 (2017).
- Bedussi, B., et al. Clearance from the mouse brain by convection of interstitial fluid towards the ventricular system. Fluids Barriers CNS. 12, 23 (2015).
- Noroxe, D. S., Poulsen, H. S., Lassen, U. Hallmarks of glioblastoma: a systematic review. ESMO Open. 1 (6), e000144 (2016).
- Boucher, Y., Salehi, H., Witwer, B., Harsh, G. R. t., Jain, R. K. Interstitial fluid pressure in intracranial tumours in patients and in rodents. British Journal of Cancer. 75 (6), 829-836 (1997).
- Glushakova, O. Y., et al. Prospective clinical biomarkers of caspase-mediated apoptosis associated with neuronal and neurovascular damage following stroke and other severe brain injuries: Implications for chronic neurodegeneration. Brain Circulation. 3 (2), 87-108 (2017).
- Vom Berg, J., et al. Inhibition of IL-12/IL-23 signaling reduces Alzheimer's disease-like pathology and cognitive decline. Nature Medicine. 18 (12), 1812-1819 (2012).
- Vom Berg, J., et al. Intratumoral IL-12 combined with CTLA-4 blockade elicits T cell-mediated glioma rejection. Journal of Experimental Medicine. 210 (13), 2803-2811 (2013).
- Kurdi, A., et al. Continuous administration of the mTORC1 inhibitor everolimus induces tolerance and decreases autophagy in mice. British Journal of Pharmacology. 173 (23), 3359-3371 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon