Method Article
Lieferung von Antikörpern in das Murine Gehirn über Konvektionsverstärkte Lieferung
In diesem Artikel
Zusammenfassung
Konvektionsverstärkte Abgabe (CED) ist eine Methode, die eine effektive Abgabe von Therapeutika in das Gehirn durch direkte Perfusion großer Gewebevolumina ermöglicht. Das Verfahren erfordert den Einsatz von Kathetern und ein optimiertes Injektionsverfahren. Dieses Protokoll beschreibt eine Methodik für CED eines Antikörpers in ein Maushirn.
Zusammenfassung
Konvektionsverstärkte Abgabe (CED) ist eine neurochirurgische Technik, die eine effektive Perfusion großer Gehirnvolumina mit einem Kathetersystem ermöglicht. Ein solcher Ansatz bietet eine sichere Abgabemethode, die die Blut-Hirn-Schranke (BBB) passiert, wodurch eine Behandlung mit Therapeutika mit schlechter BBB-Permeabilität oder solchen, bei denen eine systemische Exposition nicht erwünscht ist, z. B. aufgrund von Toxizität, ermöglicht wird. CED erfordert eine Optimierung des Katheterdesigns, des Injektionsprotokolls und der Eigenschaften des Infusaten. Mit diesem Protokoll beschreiben wir, wie CED einer Lösung durchgeführt wird, die bis zu 20 g eines Antikörpers in das Caudate-Putamen von Mäusen enthält. Es beschreibt die Vorbereitung von Stepkathetern, deren Testung in vitro und die Durchführung des CED bei Mäusen mit einem Hochlauf-Injektionsprogramm. Das Protokoll kann leicht auf andere Infusionsvolumina eingestellt werden und kann zur Injektion verschiedener Tracer oder pharmakologisch aktiver oder inaktiver Substanzen, einschließlich Chemotherapeutika, Zytokinen, Viruspartikeln und Liposomen, verwendet werden.
Einleitung
Die Blut-Hirn-Schranke (BBB) bildet eine halbdurchlässige Grenze, die das zentrale Nervensystem (ZNS) von der Durchblutung trennt. Das Erreichen des ZNS mit Therapeutika ist jedoch im Zusammenhang mit verschiedenen Krankheiten notwendig, wie Hirntumoren, Alzheimer -Krankheit (AD) oder Parkinson (PD) unter anderem1. Dies wird wichtig bei der Entwicklung neuer Therapien, vor allem, wenn das getestete Medikament eine schlechte BBB-Permeabilität aufweist oder seine systemische Exposition zu gefährlicher Toxizität führen kann1,2. Einige der klinisch verwendeten Antikörper zeigen beide Eigenschaften. Eine Lösung für dieses Problem wäre die Bereitstellung der Therapeutika direkt hinter der BBB.
Konvektionsverstärkte Abgabe (CED) ist eine neurochirurgische Technik, die eine effektive Perfusion großer Gehirnvolumina ermöglicht. Dies wird durch die chirurgische Installation eines oder mehreren Katheter im Zielbereich erreicht. Während der Wirkstoffanwendung bildet sich bei der Öffnung des Katheters ein Druckgradient, der zur treibenden Kraft der Infusatendispersion im Gewebe3,4wird. Es ist also die Dauer der Infusion und nicht die Diffusionskoeffizienten, die den Durchfusionsbereich2,4,5bestimmen. Dies ermöglicht eine gleichmäßige Abgabe des Infusatübereinens über ein viel größeres Gehirnvolumen im Vergleich zu herkömmlichen, diffusionsbasierten intracerebralen Injektionsmethoden2,6. Gleichzeitig hat diese Abgabemodalität ein geringeres Risiko von Gewebeschäden2. Dementsprechend kann CED eine sichere und wirksame Verabreichung konventioneller Chemotherapeutika zur Behandlung von ZNS-Tumoren sowie die Abgabe von immunmodulatorischen Wirkstoffen oder agonistischen und antagonistischen Antikörpern bei einer Vielzahl anderer ZNS-Erkrankungen ermöglichen2 ,7,8,9. CED wird derzeit in Therapien der Parkinson-Krankheit, Alzheimer-Krankheit, sowie high-Grade-Gliom2,7,8,10,11getestet.
Katheter-Design und das Injektionsschema gehören zu den wichtigsten Faktoren, die das Ergebnis von CED 10,12,13,14,15,16beeinflussen. Darüber hinaus erfordert es spezifische physikalisch-chemische Eigenschaften des Infusaten, einschließlich der moderaten Größe der Partikel, eine anionische Ladung und geringe Gewebeaffinität 10,17. Jeder dieser Parameter muss potenziell an die histologischen Merkmale der Hirnregion angepasst werden, umanvisiertzu werden 2,10,17.
Hier beschreiben wir die Methodik zur Durchführung von CED einer Antikörperlösung in das Caudate Putamen (Striatum) von Mäusen. Darüber hinaus umfasst das Protokoll die Vorbereitung von Schrittkathetern in einem Laboraufbau, deren Prüfung in vitro und die Durchführung des CED.
Es gibt mehrere Katheter-Designs in der Literatur, die sich durch die Form der Kanüle, die verwendeten Materialien und die Anzahl der Katheteröffnungen12,15,18,19,20 unterscheiden ,21,22. Wir verwenden einen Stufenkatheter aus einer geschmolzenen Kieselsäurekapillare, die 1 mm aus einer stumpfen Metallnadel herausragt. Dieses Katheter-Design kann leicht in einem Forschungslabor hergestellt werden und liefert reproduzierbar gute CED-Ergebnisse, wenn es in vitro mit Agarose-Blöcken mit physikalischen Parametern getestet wird, die dem Gehirnparenchym in vivo23ähneln.
Darüber hinaus implementieren wir ein Ramping-Regime für die Bereitstellung von 5 L Infusate in vivo. In einem solchen Protokoll wird die Injektionsrate von 0,2 l/min auf maximal 0,8 l/min erhöht, wodurch die Wahrscheinlichkeit eines infusaten Refluxs entlang des Katheters sowie das Risiko einer Gewebeschädigung16minimiert wird. Mit diesem Protokoll haben wir im Laufe von 11 min 30 s erfolgreich Mäuse mit bis zu 20 g Antikörpern in 5 l PBS verabreicht.
Das Protokoll kann leicht für andere Infusionsvolumina oder für die Injektion verschiedener anderer Substanzen, z.B. Chemotherapeutika, Zytokine, Viruspartikel oder Liposomen2,10,14,18, ,22. Bei verwendung von Infusate mit drastisch unterschiedlichen physikalisch-chemischen Eigenschaften im Vergleich zu einer Phosphatgepufferten Saline (PBS) oder einer künstlichen Zerebrospinalflüssigkeit (aCSF) Lösung von Antikörpern werden zusätzliche Validierungsschritte empfohlen. Für Kathetermontage, Validierung und CED beschreiben wir alle Schritte mit einem stereotaktischen Roboter mit einer Bohr- und Einspritzeinheit, die auf einem normalen stereotaktischen Rahmen montiert ist. Dieses Verfahren kann auch mit einem manuellen stereotaktischen Rahmen durchgeführt werden, der mit einer programmierbaren Mikroinfusionspumpe verbunden ist, die die beschriebenen Glasmikrospritzen antreiben kann.
Protokoll
Alle hier beschriebenen Methoden wurden vom Kantonsveterinäramt unter der Lizenznummer ZH246/15 zugelassen.
1. Vorbereitung der Step Katheter
- Herstellung eines geschmolzenen Kieselsäurerohres für den Schritt des Katheters
- Schneiden Sie die geschmolzene Kieselsäurekapillare mit einem Innendurchmesser von 0,1 mm und einer Wandstärke von 0,0325 mm Rohren auf eine Länge von 30 mm.
- Untersuchen Sie die Schläuche auf Risse und politisieren Sie die Enden mit einer Mikroschmiede, um sicherzustellen, dass die Rohröffnungen eine glatte Oberfläche haben.
- Befestigung des Innenrohres in einer Metallnadel
- Montieren Sie eine 27 G Nadel auf einer 10-L-Spritze und legen Sie die Spritze in einen stereotaktischen Roboter.
- Bewegen Sie die Spritze mit dem Roboter über eine harte Oberfläche und berühren Sie sie mit der Nadelspitze. Diese Position sollte in der Software notiert oder gespeichert werden, da sie als Referenzfläche für die Einstellung der Länge des Katheterschritts dient.
- Elevate die Nadel, um die Platzierung der geschmolzenen Kieselsäure Kapillare innerhalb der Nadel zu ermöglichen
- Legen Sie die geschmolzene Kieselsäurekapillare so in die Nadel, dass 20 mm der Kapillare aus der Nadel herausragen.
- Mit einer Pipette gleichmäßig 2 l hochviskosen Cyanoacrylat-Klebstoff über die Kapillare verteilen, beginnend mit der Metallnadel und Veredelung 10 mm über dem unteren Ende der Kapillare, wie in Abbildung 2dargestellt.
- Mit dem stereotaktischen Roboter senken Sie die Nadel, bis die Spitze der Metallnadel 1 mm über der Referenzoberfläche liegt. Auf diese Weise wird die geschmolzene Kieselsäurekapillare in der Metallnadel fixiert und bildet einen 1 mm Schritt von der Spitze der Metallnadel. Entfernen Sie einen Überschuss an Leimformung am Ende der Metallnadel, um eine Abstumpfung des Schritts zu vermeiden.
- Warten Sie 15 min, bis der Kleber aushärtet und die Spritze mit dem Katheter aus dem stereotaktischen Roboter entfernt. Bestätigen Sie, dass bei der Stufe alle überschüssigen Kleber entfernt wurde, indem Sie die Spitze des Katheters unter dem Mikroskop überprüfen.
- Testen des Schrittkatheters mit einem Agaroseblock
- 0,6% Agaroselösung in PBS in einer herkömmlichen Gelschale vorbereiten und warten, bis sie polymerisiert ist. Die Agarose in ca. 20 mm x 20 mm Blöcke schneiden. Bis zur Verwendung die Blöcke in PBS eingetaucht.
- Füllen Sie die Schrittkatheterspritze manuell mit einer 0,4%-Lösung mit gefiltertem Trypanblau von 10 l. L.
- Geben Sie mit Dem stereotaktischen Roboter 1 l bei 0,2 l/min aus, um die Abdichtung des Kathetersschritts während des Fixierungsvorgangs zu bewerten. Trypan blue Lösung sollte nur auf der Spitze des Katheters sichtbar sein. Wischen Sie es mit einem Papiergewebe ab.
- Legen Sie den Agarose-Block in den stereotaktischen Roboter und kalibrieren Sie den Roboter, so dass die Spitze des Katheters auf die Oberfläche des Agarose-Blocks verwiesen wird.
- Programmieren Sie die Injektionsparameter für CED.
- Verwenden Sie für das Injektionsvolumen von 5 l die folgenden Schritte: 1 l bei 0,2 l/min, dann 2 l bei 0,5 l/min und 2 l bei 0,8 l/min. Passen Sie das endgültige Injektionsvolumen entsprechend dem spezifischen Versuchsplan an, indem Sie die Dauer der einzelnen Schritte proportional ändern.
- Um die Lösung in das murine Caudate Putamen (Striatum) zu injizieren, führen Sie eine solche Injektion in einer Position von 1 mm frontal und 1,5–2 mm seitlich aus Bregma in der Tiefe von 3,5 mm durch.
- Nach der Injektion den Katheter 2 min an Ort und Stelle lassen und dann bei 1 mm/min zurückziehen, um eine ordnungsgemäße Dispersion der Flüssigkeit im Gehirn und die Abdichtung des Injektionstraktes während der Katheterentfernung zu gewährleisten.
HINWEIS: Je nach verwendeter stereotaktischer Roboter können alle Parameter in einem einzigen Skript programmiert werden. Ein Beispielskript ist als Ergänzendes Materialverfügbar.
- Starten Sie das CED-Verfahren und injizieren Sie 5 l Trypan-Blau-Lösung in den Agarose-Block.
- Bewerten Sie die Form der Wolke aus Trypanblau in der Agarose und mögliche Leckagen entlang des Kathetertraktes. Trypan blue sollte ein Ellipsoid oder eine runde Wolke mit der Mitte um die Katheterspitze und einem Durchmesser von mindestens 1 mm bilden. Kein größerer Rücklauf über die Spitze der Metallnadel sollte sichtbar sein.
- Legen Sie einen neuen Agarose-Block und starten Sie eine zweite Injektion von 1 l bei 0,2 l/min, um die Verstopfung des Katheters mit der Agarose zu beurteilen. Trypan blue sollte unmittelbar nach Beginn der Injektion wieder eine Wolke von der Spitze des Katheters bilden.
- Beurteilen Sie, ob das übrig gebliebene Volumen in der Spritze 3 l entspricht. Jegliche Abweichungen können auf ein Auslaufen von Flüssigkeit durch die Kathetermontage oder spritzenkolbende Richtung hinzeigen.
- Wenn alle Testinjektionen erfolgreich sind, ist der Katheter gut versiegelt, gerade und es wird keine Trypan-Blau-Lösung von anderenStellen als der Katheterspitze beobachtet, den Katheter mit deionisiertem H2 O (dH2O) waschen, bis keine Spuren von Trypanblau sichtbar sind und dann zehnmal wie folgt waschen: 70% Ethanol und 100% Ethanol, gefolgt von der erneuten Spülung mit 70% Ethanol und sauberem entionisiertem Wasser.
- Den Katheter unter trockenen Bedingungen aufbewahren.
2. Konvektionsverstärkte Lieferung von Antikörperlösung in das Murine Gehirn
HINWEIS: Je nach örtlichen Tierschutzvorschriften können für dieses Verfahren verschiedene Arten von Anästhetika, Analgetika und Antibiotika eingesetzt werden. Dieses Protokoll beschreibt die Verwendung von Injektionsanästhesie. Inhalationsanästhetika wie Isofluran können auch verwendet werden, indem eine Nasenmaske auf dem stereotaktischen Rahmen montiert wird. Darüber hinaus empfehlen wir, antibiotikazum Thema Infektionsprophylaxe ins Trinkwasser einzutragen.
- Chirurgische Einrichtung
- Bereiten Sie Anästhetika und Antidiatlösungen vor. Mäuse können mit einer Dreikomponenten-Anästhesie, die Fentanyl (0,05 mg/kg), Midazolam (5 mg/kg) und Medetomidin (0,5 mg/kg) enthält, mit sterilem dH2 O verdünnt, sicher anästhesiert werden. Wir führen ein zweistufiges Weckverfahren mit zwei Gegenmittellösungen durch, eine mit Flumazenil (0,5 mg/kg) und Buprenorphin (0,1 mg/kg) in steriler dH2O (erste Gegenmittellösung). Die zweite enthält Atipamezol (2,5 mg/kg)in sterilem dH2 O (zweite Antidothlösung).
- Bereiten Sie eine Analgesielösung vor, die Carprofen (5,667mg/kg) enthält, die mit sterilem dH2 O verdünnt ist.
- Reinigen Sie den stereotaktischen Rahmen, das Heizkissen und die Elemente des stereotaktischen Roboters. Beachten Sie, dass nicht alle Teile des Roboters ohne Beschädigungsgefahr gereinigt werden können. Details zur Reinigung und Vorbereitung auf den Einsatz finden Sie im Handbuch des Roboters.
- Montieren Sie die Spritze mit dem Schrittkatheter und spülen Sie sie mehrmals mit dH2O, 70% Ethanol und 100% Ethanol, gefolgt von der erneuten Spülung mit 70% Ethanol und dH2O. Spülen Sie schließlich die Spritze mit PBS oder anderen Puffern, die zur Herstellung der Lösung für die intrakranielle Injektion verwendet werden, z. B. künstliche Zerebrospinalflüssigkeit. Der Kolben der Spritze sollte sich während des gesamten Eingriffs reibungslos und frei bewegen.
- Kalibrieren Sie die stereotaktische Robotersoftware mit dem stereotaktischen Rahmen.
- Testen Sie die stereotaktische Robotersoftware, indem Sie sicherstellen, dass sich die Roboterarme frei bewegen und die Einspritzpumpe richtig angeschlossen ist und den CED-Vorgang ohne Störungen durchführen kann. Dazu gehören das Testen der Roboterbewegung, die Ramminjektion, die Überprüfung des 2 min Warteschritts und die Geschwindigkeit des Katheterrückzugs. Alle Parameter sollten dem in Punkt 1.3.5 beschriebenen vorprogrammierten CED-Verfahren entsprechen.
- Legen Sie den Bohrer in den Bohrer ein. Es wird empfohlen, die Bohrer vor der Verwendung zu sterilisieren.
- Bereiten Sie Antikörperlösungen mit PBS oder anderen Pufferlösungen wie aCSF vor. 1 bis 20 g Antikörper in 5 l können in einem einzigen CED-Verfahren injiziert werden. Andere Mengen und Proteinmengen sollten vor der Durchführung des Experiments getestet werden. Beachten Sie, dass die Verwendung von Lösungen mit hoher Viskosität zu Katheterverstopfungen führen kann.
- Laden Sie die Spritze manuell mit dem verdünnten Antikörper.
- Antikörperinjektion per CED in Striatum
- Wiegen Sie die Maus und injizieren Sie die Dreikomponenten-Anästhesielösung entsprechend dem Körpergewicht in das Peritoneum. Beachten Sie die Injektionszeit. Übertragen Sie die Maus in einen separaten Käfig, der mit einem Heizkissen beheizt wird.
- Beobachten Sie die Maus, um zu bestimmen, wann die Sedierung beginnt. Sobald sich die Maus nicht mehr bewegt, tragen Sie die ophthalmologische Salbe auf die Augen auf, um die Hornhaut während der Operation vor dem Austrocknen zu schützen. Die volle Sedierung beginnt in der Regel 10–15 min ab der Injektion der Dreikomponenten-Anästhesielösung.
- Überprüfen Sie die Schmerzreaktionen mit dem Pinch-Reflex-Test, um eine vollständige Anästhesie des Tieres zu gewährleisten.
- Rasieren Sie den Kopf mit einem Haarschneider.
- Desinfizieren Sie die Haut mit Wattestäbchen, die in Jodlösung getränkt sind. Schrubben Sie die Haut dreimal in kreisförmiger Bewegung.
- Mit einem Skalpell, machen Sie einen 10 mm Hautschnitt entlang der Schädel-Mittellinie Veredelung auf der Augenhöhe.
- Fixieren Sie die Maus im stereotaktischen Rahmen mit der Nasenklemme und den Ohrbügeln. Stellen Sie sicher, dass die Schädeloberfläche horizontal und fest gesichert ist. Neben der korrekten anatomischen Navigation ist dies auch entscheidend, um eine Neigung des Schädels während des Bohrens und des CED-Verfahrens zu vermeiden.
- Legen Sie die Spritze in den stereotaktischen Roboter.
- Synchronisieren Sie den Bohrer mit der Spitze des Katheters auf einem Referenzpunkt. Es ist entscheidend, dass die Beziehung zwischen der Position des Bohrers und der Spritze in der Software genau bestimmt wird, so dass die Injektion im gewünschten anatomischen Bereich des Gehirns durchgeführt werden kann.
- Ziehen Sie die Haut mit Zangen zurück und lokalisieren Sie Bregma auf der Schädeloberfläche.
- Referenzbregma in der Software mit der Spitze des Bohrers.
- Bewegen Sie den Bohrer in eine Position 1 mm frontal und 2 mm seitlich von bregma und bohren Sie ein Gratloch. Achten Sie darauf, die Dura mater nicht zu beschädigen.
- Bewegen Sie die Spritze über das Gratloch.
- Geben Sie 0,5–1 l aus der Spritze, um sicherzustellen, dass keine Luftblasen im Katheter verbleiben.
- Starten Sie das unter Punkt 1.3.5 beschriebene CED-Programm. Beobachten Sie die Schädeloberfläche auf Spuren von flüssigem Rückfluss vom Injektionspunkt. Überwachen Sie die Atemfrequenz des Tieres.
- Sobald das CED-Programm beendet ist und der Katheter aus dem Gehirn entnommen wird, starten Sie die Einspritzpumpe bei 0,2 l/min, um während des CED nach Katheterverstopfung zu suchen. Wenn keine Verstopfung aufgetreten ist, sollten Sie sofort ein Tröpfchen der Injektionsmischung aus der Katheterspitze sehen.
- Vor der Wiederverwendung oder Lagerung des Katheters den Katheterschritt visuell auf Anzeichen von Beschädigung oder Verschleiß unter dem Mikroskop untersuchen und wie in Schritt 1.3.10 reinigen.
- Aufwachverfahren
- Entfernen Sie die Maus vorsichtig aus dem stereotaktischen Rahmen.
- Waschen Sie die Operationsstelle mit steriler Salinelösung.
- Füllen Sie das Gratloch mit Zangen mit Knochenwachs.
- Schließen Sie die Haut mit dünnen Zangen und tragen Sie chirurgischen Kleber mit einer 10-L-Pipette über den Schnitt auf. Warten Sie 15–30 s, bis der Kleber polymerisiert ist.
- Analgesielösung durch subkutane Injektion auftragen. Beachten Sie die Zeit der Injektion.
- Wenden Sie die erste Antidiatlösung an. Beachten Sie die Zeit der Injektion.
- Übertragen Sie die Maus in einen separaten Käfig mit einem Heizkissen und überwachen Sie das Tier auf erschreckte Reflexe.
- Wenn die Maus 15 min nach Verabreichung der ersten Antidotenlösung nicht das volle Bewusstsein erlangt hat, wenden Sie die zweite Antithlösung durch subkutane Injektion an.
- Überwachen Sie Tiere während der Erholungsphase.
- Überprüfen Sie 1-2 h später sowie am nächsten Tag auf postoperative Komplikationen. Falls erforderlich, wenden Sie die Analgesie erneut an.
- Zur Infektionsprophylaxe Sulfadoxin (Endkonzentration 0,08% w/v) und Trimethoprim (Endkonzentration 0,016% w/v) zu Trinkwasser hinzufügen, zu dem die Tiere 1 Woche nach der Operation ad libitum Zugang haben.
Ergebnisse
Dieses Protokoll ermöglicht die Vorbereitung von Schrittkathetern (Abbildung 1) für den Einsatz im CED-Verfahren in einer Laborumgebung. Um die Katheter auf Leckagen, Reflux entlang des Nadeltraktes und Verstopfung zu kontrollieren, empfehlen wir die Durchführung von Injektionen eines Farbstoffs, z.B. Trypan-Blaulösung, in einen Agaroseblock. Abbildung 3 zeigt eine Wolke aus Trypanblau, die sich nach der Injektion von 1 l bei 0,5 l/Minute mit einem CED-Katheter bildet (Abbildung 3A). Über den Beginn des Katheterschritts war kein Rückfluss entlang des Nadeltraktes sichtbar. Darüber hinaus bildete die dispergierte Wolke eine gewünschte kugelförmige Form. Dies steht im Gegensatz zu den Ergebnissen, die mit einer herkömmlichen 27 G stumpfen Endnadel (Abbildung3B) erzielt wurden, wo ein signifikanter Rückfluss beobachtet werden konnte.
Darüber hinaus erfordert CED ein optimiertes Injektionsverfahren. Abbildung 4 zeigt die Ergebnisse der Injektion von 2 l Trypan blau in einen Agarose-Block mit dem im Protokoll (A) beschriebenen Ramping-Verfahren im Vergleich zu einer Injektion mit einer konstanten Rate von 2 l/Minute (B). Die hohe Einspritzgeschwindigkeit erzwang den Rückfluss entlang des Katheters, selbst wenn ein CED-Katheter verwendet wurde.
Schließlich, wie in Abbildung 5gezeigt, CED ermöglicht perfusion von großen Volumen des murinen Gehirns. Mäuse wurden mit einem Rattenanti-Maus-TNF-Antikörper in Kombination mit FITC-Dextran in 5 l PBS durch CED (Obere Platte) oder durch eine konventionelle Bolus-Injektion (unteres Panel) injiziert. Das Perfusionsprofil von CED war gleichmäßiger als bei konventioneller Injektion und es konnten weniger Gewebeschäden beobachtet werden. In beiden Fällen gab es ein typisches Verteilungsprofil von Antikörpern und Dextranpartikeln über dem Corpus callosum. Das Dispersionsprofil des injizierten Antikörpers war jedoch diffuser als das hochmolekulare Dextran, was Unterschiede in der Verteilung zwischen verschiedenen Infusaten veranschaulichte.

Abbildung 1: Eine schematische Zeichnung, die die CED-Schrittkatheterspitze zeigt. Frontal (A) und Seite (B) Ansichten. Das Schema ist nicht maßstabsgetreu. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
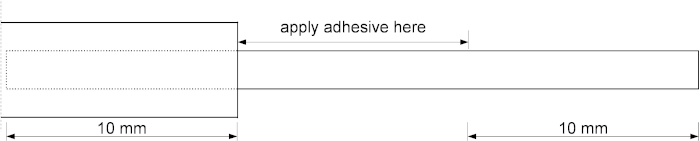
Abbildung 2: Eine schematische Zeichnung, die den Anwendungsbereich des Klebstoffs darstellt. Die oberen 10 mm der geschmolzenen Kieselsäureschläuche werden in die Metallnadel eingesetzt. Tragen Sie den Klebstoff auf die 10 mm Rohre ab der Spitze der Metallnadel auf. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
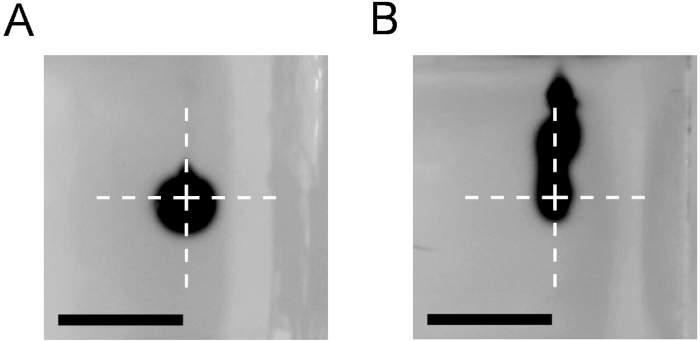
Abbildung 3: Vergleich der Infusionsergebnisse mit CED-Katheter oder einer stumpfen Endenadel. Injektion von 1 l 0,4% Trypan blau in einen 0,6% Agarose-Block bei 0,5 l/Minute mit einem CED-Katheter (A) und einer 27G stumpfen Endennadel (B). Bilder, die unmittelbar nach dem Katheter- oder Nadelentzug aufgenommen wurden. Kreuz markiert die Spitze des Katheters oder der Nadel. Maßstabsleiste = 5 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
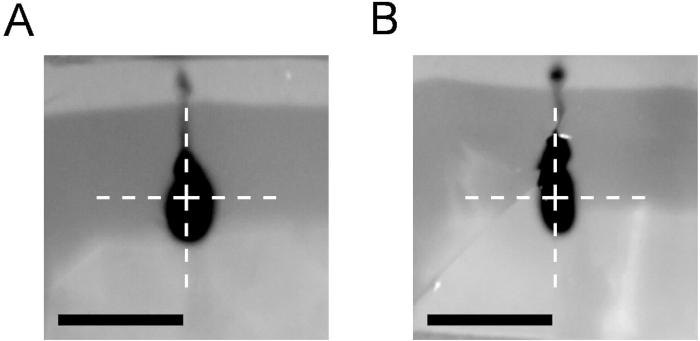
Abbildung 4: Vergleich der Infusionsergebnisse des Hochfahrens des CED-Protokolls mit dem Stationären Ratenprotokoll. Injektion von 2 l 0,4% Trypan blau in 0,6% Agarose-Block mit einem rampierenden CED-Protokoll (0,4 l bei 0,2 l/min, dann 0,8 l bei 0,5 l/min und 0,8 l bei 0,8 l/min (A) oder einem Injektionsprotokoll mit einer konstanten Rate von 2 l/min (B). In beiden Fällen wurde ein CED-Katheter verwendet. Bilder, die unmittelbar nach dem Katheterentzug aufgenommen wurden. Kreuz markiert die Spitze des Katheters. Maßstabsleiste = 5 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Repräsentative Ergebnisse der murinen Striatumperfusion durch CED oder durch konventionelle Bolusinjektion. Die Mäuse wurden in das Striatum (Position 1 mm frontal und 2 mm seitlich aus Bregma, Tiefe 3,5 mm) mit 1 g Rattenanti-Maus-TNF-Kombination mit 1 g FITC-Dextran mit dem Molekulargewicht 2.000 kDa in 5 l PBS injiziert. CED-Protokoll (Oberpanel) oder eine konventionelle Bolus-Injektion (27 G Nadel, Injektionsrate 1 L/Minute) wurde durchgeführt (unten). Mäuse wurden unmittelbar nach dem CED-Verfahren durch kontrollierte CO2-Erstickung geopfert und mit 4% Formaldehyd in PBS durchdrungen. Die Gehirne wurden seziert und zusätzlich mit 4% Formaldehyd in PBS bei 4 °C für 24 h fixiert. Anschließend wurden Gehirne 60 min lang mit 15% Saccharose gewaschen und bei 4 °C auf 30% Saccharose übertragen. Nach 24 H wurde das Gehirn auf Trockeneis eingefroren. Frei schwebende Abschnitte (25 m) wurden mit polyklonalen Ziegen anti-rat-IgG (H+L) Antikörper gekoppelt mit Alexa Fluor 647 gebeizt und mit DAPI gegengefärbt. Bilder wurden mit der Fidschi-Distribution von ImageJ verarbeitet. 10x Vergrößerung, Skalenstange = 5 mm. 4 Mäuse pro Gruppe; ein repräsentatives Bild wird angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Konvektionsverstärkte Abgabe, oder druckvermittelte Medikamenteninfusion in das Gehirn, wurde erstmals Infusion entost3vorgeschlagen. Dieser Ansatz verspricht Perfusion von großen Gehirnvolumen hinter der Blut-Hirn-Schranke in einer kontrollierten Weise2. Bisher wurden jedoch nur wenige klinische Studien mit diesem Ansatz durchgeführt, teilweise weil CED in einem klinischen Setup sich als technisch anspruchsvoll24,25erwiesen hat. Jüngste Entwicklungen in der Katheter-Design-und Infusionsprogramme scheinen diese technischen Schwierigkeiten überwunden haben8,19. Fortschritte bei der klinischen Umsetzung therapeutischer Antikörper, einschließlich des Aufkommens von immunmodulatorischen Checkpoint-Blockierungsmitteln, warten auf die Anwendung bei der Behandlung von ZNS-Erkrankungen10. Diese Entwicklung kann durch den Einsatz von CED im Versuchsaufbau, wie z. B. mit kleinen Nagetiermodellen, erheblich verstärkt werden.
Verschiedene CNS-Krankheitsmodelle sind bei Mäusen erhältlich. Dazu gehören experimentelle Autoimmun-Enzephalomyelitis (EAE) für Multiple Sklerose (MS) und gentechnisch veränderte Modelle für Alzheimer (AD), Parkinson -Krankheit (PD) oder für Hirntumor. Viele Hirntumormodelle sind auch auf die orthotopische Tumorimpfung von murinen Gliom-Zelllinien oder die Implantation von vom Patienten abgeleiteten Xenografts angewiesen. Dieses Protokoll ermöglicht die Lieferung von Antikörperlösungen direkt an bestimmte anatomische Standorte und ähnelt damit therapeutischen Verfahren. Es kann in verschiedenen experimentellen Layouts implementiert werden, in denen die Abgabe von Antikörpern in eine präzise Hirnregion eine zentrale Rolle spielt.
Der entscheidende Faktor bei der Durchführung von CED bei Mäusen ist die Verfügbarkeit von Kathetern. Dieses Protokoll enthält eine genaue Beschreibung, wie man einen Schrittkatheter zusammenbaut und in einer Reihe von In-vitro-Experimenten testet. Man sollte bedenken, dass die geschmolzene Kieselsäure, aus der der Stufenschlauch hergestellt wird, ein sprödes Material ist und die Qualität von CED mit einem bestimmten Katheter im Laufe der Zeit abnehmen könnte. Es wird empfohlen, die Parameter der Schrittkatheter zwischen den In-vivo-Experimenten zu kontrollieren, indem die im Protokollabschnitt 1.3 beschriebenen In-vitro-Tests wiederholt werden.
Das Protokoll kann für verschiedene Injektionsvolumina, Infusatentypen und Hirnregionen angepasst werden. Das Injektionsvolumen kann durch proportionale Änderung der Dauer der Injektionsschritte manipuliert werden. Hier beschreiben wir die Infusion von 5 l, aber CED mit 10 l Antikörperlösung wurde in der Literatur mit einem ähnlichen Ansatz in murinen Hirntumormodellen berichtet, wodurch eine ausgezeichnete Gewebeverteilung und Perfusionsvolumina erreicht wurden, die die Bolusinjektion erheblich übersteigen7 . Darüber hinaus wurden bis zu 28 L Infusaten-Volumen mit CED zur Anwendung von Flüssigkeiten in das Rattenhirn22,26berichtet. Nicht-proteinhaltige Substanzen können auch durch CED injiziert werden, wobei zu berücksichtigen ist, dass die Infusaten nicht von hoher Viskosität sein sollten, um eine Verstopfung der schmalen Katheterspitze zu vermeiden. Mit Liposomen wurde nachgewiesen, dass die Ladung der infundierten Moleküle die Gewebedurchdringung stark beeinflussen kann, wobei neutrale oder negativ geladene Partikel über die größten Volumina verteilt werden können22. Wie in Abbildung 5dargestellt, verteilen sich FITC-Dextran und Antikörper unterschiedlich: Obwohl sich Antikörper und FITC-Dextran ähnlich entlang des Corpus Callosum verteilen, ist die Antikörperdurchdringung von Hirnparenchym diffuser als bei FITC-Dextran, die einen kleineren Radius und ein fleckigeres Verteilungsmuster anzeigt. Dies unterstreicht die Unterschiede im CED-Profil zwischen Infusaten mit unterschiedlichen physikalisch-chemischen Eigenschaften.
Darüber hinaus wurde das hier beschriebene und in Abbildung 5 gezeigte CED-Experiment durchgeführt, indem ein Anti-Maus-TNF-Antikörper in gesunde Mäuse injiziert wurde, wobei eine minimale Zielmenge im Striatum angenommen wurde. Das Vorhandensein von Cognate-Antigen wird das Gewebeverteilungsmuster verändern. Es kann durch inhomogenes Gewebe an einer anatomischen Stelle weiter beeinflusst werden, wie in Abbildung 5 durch Verteilung des Infusaten entlang des Corpus callosum dargestellt.
Schließlich wird CED durch den Fluss von interstitiellem Flüssigkeit beeinflusst, die im Falle einer Striatum-Injektion die Infusate in Richtung der seitlichen Ventrikel spülen kann27. Selbst wenn das Gewebe unmittelbar nach Abschluss von CED fixiert ist, können wir eine deutliche Haftung des injizierten Antikörpers an der Ventrikelwand beobachten (Abbildung 5). Dies kann durch pathologische Erkrankungen des ZNS, z.B. im Zusammenhang mit Hirntumoren, weiter beeinflusst werden. Fokale Nekrose, oft bei hochgradigen Hirntumoren28beobachtet, kann den Fluss der interstitiellen Flüssigkeit beeinflussen und somit das Verteilungsmuster des Infusaten29verändern. Andere pathologische Bedingungen, die zu einer veränderten Gewebeverteilung von Infusate im Vergleich zu gesundem Parenchym führen können, sind Schlaganfall oder traumatische Hirnverletzung30. Zusammenfassend lässt sich zusammenfassen, dass jede Reihe von CED-Experimenten sorgfältig validiert werden muss, um eine erfolgreiche Durchblutung der Zielhirnregion zu gewährleisten.
Derzeit verwenden Forscher häufig implantierbare osmotische Pumpen, um Substanzen in das CSF oder Gehirn (Tumor) Parenchym31,32,33zu liefern. In bestimmten Fällen kann CED, wie hier beschrieben, als Alternative verwendet werden. Es kann mehrmals mit Frequenzen durchgeführt werden, abhängig von der Hirnregion, Art der Infusate, Volumen und Anästhesie Protokoll verwendet. Intermittierende Arzneimittelabgabe kann besonders relevant sein, wenn eine längere Exposition gegenüber dem Infusaten zu Toleranz oder systemischen Nebenwirkungen führt. Es ist denkbar, dass in Fällen, in denen hohe Retention und Halbwertszeit-Infusate geliefert werden, dieser Ansatz eine Verfeinerung nach dem 3R-Prinzip darstellen würde, da keine Pumpenimplantation erforderlich wäre. Zusammenfassend beschreibt dieses Protokoll eine effiziente Art und Weise, große Mengen an Antikörperlösung in das murine Striatum einzufließen und kann für andere Hirnregionen und Infusatentypen angepasst werden.
Offenlegungen
Johannes vom Berg wird als Erfinder der Patentanmeldung (PCT/EP2012/070088) der Universität Zürich erwähnt. Michal Beffinger, Linda Schellhammer und Johannes vom Berg werden als Erfinder einer Patentanmeldung (EP19166231) der Universität Zürich genannt. Die Autoren haben keine zusätzlichen finanziellen Interessen.
Danksagungen
Unterstützt wurde diese Arbeit durch Stipendien der Universität Zürich (FK-15-057), der Novartis Stiftung für medizinisch-biologische Forschung (16C231) und der Schweizer Krebsforschung (KFS-3852-02-2016, KFS-4146-02-2017) an Johannes vom Berg und BRIDGE Proof of Concept (20B1-1 _177300) an Linda Schellhammer.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 μL syringe | Hamilton | 7635-01 | |
| 27 G blunt end needle | Hamilton | 7762-01 | |
| Agarose | Promega | V3121 | |
| Atipamezol | Janssen | ||
| Bone wax | Braun | 1029754 | |
| Buprenorphine | Indivior Schweiz AG | ||
| Carprofen | Pfizer AG | ||
| Dental drill bits, steel, size ISO 009 | Hager & Meisinger | 1RF009 | |
| Ethanol 100% | Reuss-Chemie AG | 179-VL03K-/1 | |
| Fentanyl | Helvepharm AG | ||
| FITC-Dextran, 2000 kDa | Sigma Aldrich | FD2000S | |
| Flumazenil | Labatec Pharma AG | ||
| Formaldehyde | Sigma Aldrich | F8775-500ML | |
| High viscosity cyanoacrylate glue | Migros | ||
| Iodine solution | Mundipharma | ||
| Medetomidin | Orion Pharma AG | ||
| Microforge | Narishige | MF-900 | |
| Midazolam | Roche Pharma AG | ||
| Ophthalmic ointment | Bausch + Lomb | Vitamin A Blache | |
| PBS | ThermoFischer Scientific | 10010023 | |
| Polyclonal goat anti-rat IgG (H+L) antibody coupled with Alexa Fluor 647 | Jackson Immuno | ||
| Scalpels | Braun | BB518 | |
| Silica tubing internal diameter 0.1 mm, wall thickness of 0.0325 mm | Postnova | Z-FSS-100165 | |
| Stereotactic frame for mice | Stoelting | 51615 | |
| Stereotactic robot | Neurostar | Drill and Injection Robot | |
| Succrose | Sigma Aldrich | S0389-500G | |
| Topical tissue adhesive | Zoetis | GLUture | |
| Trypan blue | ThermoFischer Scientific | 15250061 | |
| Water | Bichsel | 1000004 |
Referenzen
- Scherrmann, J. M. Drug delivery via the blood-brain barrier. Vascular Pharmacology. 38 (6), 349-354 (2002).
- Barua, N. U., Gill, S. S. Convection-enhanced drug delivery: prospects for glioblastoma treatment. CNS Oncology. 3 (5), 313-316 (2014).
- Bobo, R. H., et al. Convection-enhanced delivery of macromolecules in the brain. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2076-2080 (1994).
- Morrison, P. F., Laske, D. W., Bobo, H., Oldfield, E. H., Dedrick, R. L. High-flow microinfusion: tissue penetration and pharmacodynamics. American Journal of Physiology. 266 (1 Pt 2), R292-R305 (1994).
- Zhou, Z., Singh, R., Souweidane, M. M. Convection-Enhanced Delivery for diffuse intrinsic pontine glioma treatment. Current Neuropharmacology. 15 (1), 116-128 (2017).
- Barua, N. U., et al. Intrastriatal convection-enhanced delivery results in widespread perivascular distribution in a pre-clinical model. Fluids and Barriers of the CNS. 9 (1), 2 (2012).
- Shoji, T., et al. Local convection-enhanced delivery of an anti-CD40 agonistic monoclonal antibody induces antitumor effects in mouse glioma models. Neuro-Oncology. 18 (8), 1120-1128 (2016).
- Souweidane, M. M., et al. Convection-enhanced delivery for diffuse intrinsic pontine glioma: a single-centre, dose-escalation, phase 1 trial. The Lancet Oncology. , (2018).
- Zhang, X., et al. Targeting immune checkpoints in malignant glioma. Oncotarget. 8 (4), 7157-7174 (2017).
- Barua, N. U., Gill, S. S., Love, S. Convection-enhanced drug delivery to the brain: therapeutic potential and neuropathological considerations. Brain Pathology. 24 (2), 117-127 (2014).
- Mehta, A. M., Sonabend, A. M., Bruce, J. N. Convection-Enhanced Delivery. Neurotherapeutics. 14 (2), 358-371 (2017).
- Krauze, M. T., et al. Reflux-free cannula for convection-enhanced high-speed delivery of therapeutic agents. Journal of Neurosurgery. 103 (5), 923-929 (2005).
- Nash, K. R., Gordon, M. N. Convection Enhanced Delivery of Recombinant Adeno-associated Virus into the Mouse Brain. Methods in Molecular Biology. 1382, 285-295 (2016).
- Ohlfest, J. R., et al. Combinatorial antiangiogenic gene therapy by nonviral gene transfer using the sleeping beauty transposon causes tumor regression and improves survival in mice bearing intracranial human glioblastoma. Molecular Therapy. 12 (5), 778-788 (2005).
- Yin, D., Forsayeth, J., Bankiewicz, K. S. Optimized cannula design and placement for convection-enhanced delivery in rat striatum. Journal of Neuroscience Methods. 187 (1), 46-51 (2010).
- Mamot, C., et al. Extensive distribution of liposomes in rodent brains and brain tumors following convection-enhanced delivery. Journal of Neuro-Oncology. 68 (1), 1-9 (2004).
- Saito, R., et al. Tissue affinity of the infusate affects the distribution volume during convection-enhanced delivery into rodent brains: implications for local drug delivery. Journal of Neuroscience Methods. 154 (1-2), 225-232 (2006).
- Oh, S., et al. Improved distribution of small molecules and viral vectors in the murine brain using a hollow fiber catheter. Journal of Neurosurgery. 107 (3), 568-577 (2007).
- Barua, N. U., et al. A novel implantable catheter system with transcutaneous port for intermittent convection-enhanced delivery of carboplatin for recurrent glioblastoma. Drug Delivery. 23 (1), 167-173 (2016).
- Rosenbluth, K. H., et al. Design of an in-dwelling cannula for convection-enhanced delivery. Journal of Neuroscience Methods. 196 (1), 118-123 (2011).
- Debinski, W., Tatter, S. B. Convection-enhanced delivery for the treatment of brain tumors. Expert Review of Neurotherapeutics. 9 (10), 1519-1527 (2009).
- MacKay, J. A., Deen, D. F., Szoka, F. C. Distribution in brain of liposomes after convection enhanced delivery; modulation by particle charge, particle diameter, and presence of steric coating. Brain Research. 1035 (2), 139-153 (2005).
- Chen, Z. J., et al. A realistic brain tissue phantom for intraparenchymal infusion studies. Journal of Neurosurgery. 101 (2), 314-322 (2004).
- Sampson, J. H., et al. Poor drug distribution as a possible explanation for the results of the PRECISE trial. Journal of Neurosurgery. 113 (2), 301-309 (2010).
- Wick, W., Weller, M., et al. Trabedersen to target transforming growth factor-beta: when the journey is not the reward, in reference to Bogdahn et al. (Neuro-Oncology 2011;13:132-142). Neuro-Oncology. 13 (5), 559-560 (2011).
- Saito, R., Tominaga, T. Convection-enhanced delivery of therapeutics for malignant gliomas. Neurologia Medico-Chirurgica. 57 (1), 8-16 (2017).
- Bedussi, B., et al. Clearance from the mouse brain by convection of interstitial fluid towards the ventricular system. Fluids Barriers CNS. 12, 23 (2015).
- Noroxe, D. S., Poulsen, H. S., Lassen, U. Hallmarks of glioblastoma: a systematic review. ESMO Open. 1 (6), e000144 (2016).
- Boucher, Y., Salehi, H., Witwer, B., Harsh, G. R. t., Jain, R. K. Interstitial fluid pressure in intracranial tumours in patients and in rodents. British Journal of Cancer. 75 (6), 829-836 (1997).
- Glushakova, O. Y., et al. Prospective clinical biomarkers of caspase-mediated apoptosis associated with neuronal and neurovascular damage following stroke and other severe brain injuries: Implications for chronic neurodegeneration. Brain Circulation. 3 (2), 87-108 (2017).
- Vom Berg, J., et al. Inhibition of IL-12/IL-23 signaling reduces Alzheimer's disease-like pathology and cognitive decline. Nature Medicine. 18 (12), 1812-1819 (2012).
- Vom Berg, J., et al. Intratumoral IL-12 combined with CTLA-4 blockade elicits T cell-mediated glioma rejection. Journal of Experimental Medicine. 210 (13), 2803-2811 (2013).
- Kurdi, A., et al. Continuous administration of the mTORC1 inhibitor everolimus induces tolerance and decreases autophagy in mice. British Journal of Pharmacology. 173 (23), 3359-3371 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten