Method Article
Изучение Cryptosporidium инфекции в 3D Ткани полученных человеческих органоидных систем культуры микроинъекции
В этой статье
Резюме
Мы описываем протоколы для подготовки яйцеклеток и очищения спорозоитов для изучения инфекции органов кишечника и дыхательных путей с помощью Cryptosporidium parvum. Мы демонстрируем процедуры микроинъекции паразитов в кишечный органоидный просвет и иммуностоидинг органоидов. Наконец, мы описываем изоляцию генерируемых яйцеклеток от органоидов.
Аннотация
Cryptosporidium parvum является одной из основных причин заболеваний человека диареи. Чтобы понять патологию паразита и разработать эффективные препараты, необходима система культуры in vitro, которая переоценивает условия в хозяине. Органоиды, которые очень похожи на ткани своего происхождения, идеально подходят для изучения взаимодействий хозяина-паразита. Органоиды являются трехмерными (3D) тканевыми структурами, которые получены из взрослых стволовых клеток и растут в культуре в течение длительных периодов времени, не подвергаясь никакой генетической аберрации или трансформации. Они имеют четко определенную полярность как с апиальными, так и с базолатеральными поверхностями. Органоиды имеют различные применения в тестировании на наркотики, био-банкинг, и болезни моделирования и принимающей микробов исследований взаимодействия. Здесь мы представляем пошаговый протокол о том, как подготовить яйцеклетки и спорозоиты криптоспоридия для заражения органов кишечника и дыхательных путей человека. Затем мы демонстрируем, как микроинъекция может быть использована для введения микробов в органоидный просвет. Существует три основных метода, с помощью которых органоиды могут быть использованы для исследований взаимодействия хозяина-микроба – микроинъекций, механического стрижки и покрытия, а также путем создания монослойных. Микроинъекция позволяет успомянить 3D-структуру и обеспечивает точный контроль объемов паразитов и прямого апкиальный боковой контакт для микробов. Мы предоставляем подробную информацию для оптимального роста органоидов для визуализации или производства яйцеклеток. Наконец, мы также демонстрируем, как вновь сгенерированные яйцеклетки могут быть изолированы от органоида для дальнейшей обработки и анализа вниз по течению.
Введение
Разработка лекарств или вакцин для лечения и профилактики инфекции Cryptosporidium была затруднена из-за отсутствия систем in vitro, которые точно имитируют in vivo ситуацию в организме человека1,2. Многие из имеющихся в настоящее время систем либо позволяют краткосрочную инфекцию (Злт;5 дней), либо не поддерживают полный жизненный цикл паразита3,4. Другие системы, которые позволяют полное развитие паразита основаны на увековеченных клеточных линий или раковых клеток линий, которые не точно резюмировать физиологическую ситуацию в организме человека5,6,7 . Органоиды или «мини-органы» являются 3D-структурами, полученными из тканей, которые выращиваются во внеклеточной матрице, дополненной различными специфическими факторами роста тканей. Органоиды были разработаны из различных органов и тканей. Они генетически стабильны и резюмируют большинство функций органов их происхождения и могут поддерживаться в культуре в течение длительных периодов времени. Мы разработали метод заражения органов кишечника и легких человека криптоспоридием, который обеспечивает точную модель in vitro для изучения взаимодействий хозяина-паразита, имеющих отношение к кишечному и респираторному криптоспоридиозу8 ,9,10,11,12,13. В отличие от других опубликованных моделей культуры, органоидная система является репрезентативной для взаимодействия паразитов в реальной жизни, позволяет завершить жизненный цикл, чтобы можно было изучить все этапы жизненного цикла паразита, и поддерживает распространение паразитов на срок до 28 дней10.
Cryptosporidium parvum является апикомплексным паразитом, который заражает эпителий дыхательных путей и кишечных путей, вызывая длительную диарею. Устойчивый экологический этап является яйцей, найденный в загрязненной пище и воде14. После того, как попадает или вдыхается, яйцеклетки excyst и выпускает четыре sporozoites, которые прикрепляются к эпителиальным клеткам. Sporozoites скользить по клеткам хозяев и заниматься рецепторами клеток-хозяев, но паразит не полностью вторгнуться в клетку, и, как представляется, побудить клетку-хозяина, чтобы поглотить его15. Паразит, который интернализирован в внутриклеточном, но экстрацитоплазматном отсеке, остается на апической поверхности клетки, реплицируя в паразитофорном вакуоле. Он проходит два раунда бесполого размножения - процесс, называемый мерогонии. Во время мерогонии, типа I меронты развиваться, которые содержат восемь merozoites, которые выпускаются вторгнуться в новые клетки. Эти мерозоиты вторгаются в новые клетки, чтобы превратиться в меронты типа II, содержащие четыре мерозоита. Эти мерозоиты, когда высвобождаются, заражают клетки и превращаются в макрогамонты и микрогамонты. Микрогаметы высвобождаются и удобряют макрогаметы, производящие зиготы, которые созревают в ооцисты. Зрелые яйцеклетки впоследствии высвобождаются в просвет. Ооцисты либо тонкостены, которые сразу же excyst для повторного заражения эпителия, или толстые стеной, которые высвобождаются в окружающую среду, чтобы заразить следующий хозяин14. Все этапы жизненного цикла Cryptosporidium были определены в системе органоидной культуры, ранее разработанной нашей группой10.
Так как человеческие органоиды верно реплицируют человеческие ткани9,11,13,и поддерживают все репликационные этапы Cryptosporidium10, они являются идеальной системой культуры тканей для изучения Криптоспоридий биологии и принимающей паразит взаимодействия. Здесь мы описываем процедуры заражения органоидов как с Cryptosporidium яйцевидных яйцеклеток и excysted sporozoites, и изоляции новых яйцеклеток, производимых в этой системе культуры тканей.
протокол
Вся обработка тканей и резекция проводилась в соответствии с утвержденными протоколами Институционального совета по обзору (IRB) с согласия пациента.
1. Подготовка C. parvum Oocysts для инъекций
ПРИМЕЧАНИЕ: Cryptosporidium ооцисты были приобретены из коммерческого источника (см. Таблица материалов). Эти яйцеклетки производятся в телятах и хранятся в фосфатно-буферном сольном (PBS) с антибиотиками. Они могут храниться в течение 3 месяцев при 4 градусах Цельсия и никогда не должны быть заморожены. Обычно мы используем яйцеклетки в течение одного месяца. Органоиды могут быть инфицированы либо нетронутыми яйцеклетки, или sporozoites могут быть изолированы от excysted яйцевидных яйцеклеток и используется для заражения органоидов, если важно не иметь ооцизтов переноса из оригинального инокулума.
-
Подготовка Cryptosporidium яйцеклетки для заражения клеток(рисунок 1A).
- Держите ооцисты на льду на протяжении всех манипуляций, пока они не добавляются в органоиды.
- Рассчитайте количество яйцеклеток, необходимых для полной шести-колодчатой пластины органоидов (обычно около 5 х 105-2,5 х 105 для тарелки). Подсчитайте количество яйцеклеток в гемоситометре, чтобы проверить количество и перенести в центрифужную трубку.
ПРИМЕЧАНИЕ: Чтобы помочь в визуализации, ооцисты могут быть смешаны 1:1 с ооцизтом конкретных флуоресцентных антител (см. Таблица материалов) перед загрузкой на гемоцитометр. Флюорофор помечены яйцеклетки могут быть легко визуализированы и перечислены с помощью флуоресцентного микроскопа. Мы предлагаем инъекционные около 100-1000 яйцеклеток / органоидов. В целом, 1000-2000 органоидов можно выращивать в шестиколодцной пластине. - Доведите объем ооцизтов до 900 л с помощью PBS. Добавьте 100 зЛ гипохлоритна натрия (например, Clorox) отбеливателя (при 4 градусах Цельсия). Инкубировать 10 мин на льду.
- Центрифуга в течение 3 мин в микроцентрифуге при 8000 х г при 4 градусах Цельсия. Ориентируйте трубы в центрифуге с крышкой открытия лицом внутрь. Гранулы может быть трудно увидеть так зная, где паразиты имеют гранулы в трубке имеет важное значение.
- Удалите супернатант с пипеткой быть осторожным, чтобы избежать гранулы. Добавьте 1 мл модифицированной среды Eagle (DMEM) и вихря для смешивания.
- Центрифуга в течение 3 мин в микроцентрифуге при 8000 х г при 4 градусах Цельсия.
- Повторите стих с DMEM еще два раза.
- Подготовка расширения среды (OME) или дифференциации органоидной среды (OMD), к которой тауроколат был добавлен к окончательной концентрации 0,5% (w/v) (см. Таблица материалов). Таурохолят всегда следует готовить и добавлять свежим.
ПРИМЕЧАНИЕ: Мы успешно использовали 0,5% таурохолата в наших анализов инфекции, где инокулум нетронутыми яйцеклетки, и увидел улучшение темпов инфекции без пагубного воздействия на клетки хозяина. Тем не менее, таурохолат может иметь непредвиденные последствия для клеток, и более низкие концентрации были успешно использованы в инфекции анализы16. - Resuspend яйцеклетки в 100 л органоидной культуры среды дополнены 0,5% (w/v) натрия таурочолат. Подсчитайте ооцисты снова, как описано в шаге 1.1.2.
- Добавьте быстрый зеленый краситель в подвеску, чтобы визуализировать инъекцию.
- Заполните советы микро-загрузчика (см. таблицу материалов)с подвеской oocyst и используйте его для заполнения вытащил капилляров.
ПРЕДЕКТО: Вся процедура должна быть сделана в капюшоне культуры ткани с протоколами безопасности уровня-2. Использование масок рекомендуется, как Cryptosporidium яйцеклетки также может быть инфекционным, когда воздушно-капельным путем.
2. В экстракорпорной очистке спорозоитов от C. parvum Oocysts
-
Очистите спорозоиты от Ооцизтов C. parvum после отбеливания и вымывания отбеливателя, как описано выше.
- Перенесите яйцеклетки в трубку 15 мл. Resuspend яйцеклетки в комнатной температуре excystation среды (0,75% W / V натрия таурохолата в DMEM) для получения 1 х 107 ооцизтов / мл. Добавление таурохолата улучшает скорость эксцизии яйцеклеток, улучшая урожайность спорозоита.
- Инкубировать суспензию яйцеклетки при 37 градусах по Цельсию на 1-1,5 ч.
- Проверка образца микроскопически на степень эксцстанции; 60-80% эксцизации является разумным для хорошего восстановления sporozoites. Если уровень эксцстанции низкий, инкубировать дольше (еще 30 мин до 1 ч).
- Определите процент эксцстанции относительно количества начальных яйцеклеток. Excystation рассчитывается как:
% эксцистационная станция No1 (количество нетронутых яйцеклеток/количество яйцеклеток в начале) х 100 - Вымойте клетки для удаления реагентов excystation, добавив 14 мл PBS или средних, смешивания и восстановления клеток (нетронутые ооцисты, ооцисты, оиоцитов и sporozoites) центрифугии на 3400 х г в течение 20 минут для восстановления sporozoites. Тщательно аспирируйте, чтобы избежать потери клеток.
- Отрежь пеллеты спорозоита в 1-2 мл DMEM, чтобы получить 3 х 107 ооцистых/мл (в зависимости от количества стартовых яйцеклеток).
- Чтобы удалить оставшиеся яйцеклетки и оболочки, процедите подвеску через фильтр 3 мкм(рисунок 1B). Используйте 47-мм аппарат для держателей фильтров, оснащенный поликарбонатным фильтром (размер омара), прикрепленным к стволу шприца объемом 10 мл. Поместите аппарат держателя фильтра поверх трубки 15 мл. Поместите сборку в ведро со льдом или в холодную комнату.
- Добавьте 7,5 мл спорозоитной подвески в сборку фильтра и дайте фильтруть его гравитацией. Промойте еще 7,5 мл DMEM.
ПРИМЕЧАНИЕ: Для обеспечения успеха в изоляции sporozoite свежие яйцеклетки и хорошая excystation имеют решающее значение. Если Слишком много неоступимых яйцеклеток, подвеска не будет проходить через гравитацию. Применение давления на шприц может заставить unexcysted ооцистых до конца. Микроинъекция спорозоитов является более сложной задачей, чем у ооцизом, потому что спорозоиты могут слипаться и блокировать капилляры. Чтобы избежать этого, мы рекомендуем сделать более широкий капиллярный наконечник при инъекционных органоидах с поporoзоитами. Для достижения достаточного уровня инфекции, в 2-4 раза больше спорозоитов необходимо вводить в каждый органоид по сравнению с органоидами, инфицированными ооцистами. - Centrifuge фильтрованного спорозоита подвески на 3400 х г с помощью размахивая ротор ведро в течение 20 минут, чтобы гранулы sporozoites.
- Повторное в 50-100 ЗЛ ОмЕ или OMD органоидной культуры среды (см. Таблица материалов) дополнены 0,05% (w/v) Быстрый зеленый краситель и L-глютатион, бетаин, L-цистеин, линолевая кислота и таурин-содержащий буфер5 (см. Таблица материалов).
ПРИМЕЧАНИЕ: Инкубации яйцеклеток слишком долго может привести к лизис спорозоитов и плохое восстановление и, следовательно, следует избегать.
3. В vitro Культура кишечника кишечника и легких органоидов для микроинъекции
- Культура кишечных органоидов в условиях расширения и дифференциации средств массовой информации.
Примечание:Детали распространения кишечного и леголегского органоида ранее были описаны в других статьях8,13(см.Таблица материаловдля медиа-рецептов). Здесь мы кратко описываем метод органоидной культуры с конкретной ссылкой на оптимизацию дляCryptosporidiumинъекции и роста. Мы обнаружили, что для визуализации паразитов в органоидов, органоиды, выращенные в среде расширения предпочтительнее тех, в выросли дифференциации средств массовой информации, как есть меньше накопления мусора, чем в органоидов, выращенных в среде дифференциации. Однако, если цель состоит в том, чтобы изолировать ооциды, органоиды, выращенные в средствах дифференциации производят гораздо большее количество яйцеклеток.- Поддержание органоидов в 3D-культурах во внеклеточной матрице (см. Таблицу Материалов)при 37 градусах Цельсия. Добавляйте OME (медиа-расширения) сверху и обновляйте каждый день.
ПРИМЕЧАНИЕ: Для легочных органоидов, у нас нет отдельного расширения и дифференциации средств массовой информации. - Чтобы разделить и пластины органоидов для микроинъекции, удалить средства массовой информации из 6-коловидной пластины, содержащей человеческие органоиды и добавить F12 "(См. Таблица материалов)в колодец и разбить матрицу путем пипетки с 1 мл пипетки отзыв несколько раз. Сбор клеток в трубку 15 мл (2 мл F12) на трубку достаточно для дальнейших процедур).
- Добавьте 10-12 мл F12 в еще одну трубку 15 мл и поместите огневую стеклянную трубку в среду, пипетку вверх и вниз 3 раза, чтобы разбить кишечные и легкие органоиды человека.
ПРИМЕЧАНИЕ: Используйте длинный стеклянный трубку (20-30 см) и огнем-полить его кратко. Не делайте отверстие (1 мм в диаметре) очень маленьким, потому что органоиды могут быть повреждены. Сделайте кончик трубы гладким, кратко огнеупорных его. Разбейте органоиды на более мелкие кусочки 50 мкм. Органоиды легких имеют более толстую внешнюю мембрану и поэтому требуют более сильного стрижки со стеклянной пипеткой по сравнению со кишечными органоидами. Кроме того, они имеют более медленные темпы роста, чем кишечные органоиды (до 14 дней между каждым проходом). - Добавьте F12 до 5-7 мл и центрифугу на 350 х г в течение 5 мин.
ПРИМЕЧАНИЕ: Скорость центрифугации на этом этапе выше, чем обычно, чтобы сделать хороший клеточной гранулы, которые хорошо отделены от внеклеточной матрицы (см. Таблица материалов). Мы заметили, что по сравнению с мышью тонкой кишечной органоидов, человеческий тонкий кишечник органоидов труднее нарушить. - Удалите как можно больше среды, не нарушая клетки, а затем resuspend гранулы с матрицей поддерживается на 4 градусов по Цельсию; Требуется 200-300 л матрицы на скважину из шестиколодцв. Органоиды должны быть разделены один на три для поддержания довольно высокой плотности клеток.
- Плита органоидов в матричных капель около 5-10 л каждый в колодце шестиколодцв пластины. Инкубировать в течение 20-30 мин при 37 градусах Цельсия, а затем добавить расширение среды (OME) на вершине.
- Изменение среды каждые 2-3 дней.
ПРИМЕЧАНИЕ: Примерно через 5-7 дней органоиды, растущие в ЭМ, достигают размера 100-200 мкм и готовы к инъекциям. - Чтобы дифференцировать органоиды, после 5-6 дней в EM, изменить средства массовой информации для дифференциации средств (DM) условия хищных и держать в течение 5-6 дополнительных дней до введения паразитов.
ПРИМЕЧАНИЕ: Для расширения органоидов рекомендуется плотно пластинировать органоиды. Для микроинъекций рекомендуется использовать шестиколочные пластины с органоидами, покрытыми при меньшей плотности. Например, пластинные органоиды из трех колодцев шестиколодцв в полную шестискважинную пластину для микроинъекций. Матрица должна быть сохранена при -20 градусов по Цельсию для длительного хранения и размораживаются при 4 градусах Цельсия или на льду перед использованием. Расширение органов легких делается аналогичным образом, но с использованием органов легких конкретных компонентов мультимедиа (Таблица 1)8 .
- Поддержание органоидов в 3D-культурах во внеклеточной матрице (см. Таблицу Материалов)при 37 градусах Цельсия. Добавляйте OME (медиа-расширения) сверху и обновляйте каждый день.
4. Микроинъекция ооцистых/спорозоитов в органоидный люмен
-
Микроинъекционные паразиты в апическую сторону 3D органоида(рисунок 2).
- Подготовка стеклянных капилляров диаметром 1 мм с помощью выдвижного микропипетта.
ПРИМЕЧАНИЕ: Настройки, используемые на выдвижной микропайпот (см. Таблица материалов) являются: Тепло No 663, Тянуть No 100, Скорость 200, Время 40 мс. Настройки должны быть скорректированы в соответствии с инструкциями пользователя для конкретной машины. - Вырезать кончик капилляра с щипцами. Размер/диаметр конца капилляра измеряет около 9-12 мкм; это позволяет легко течь яйцеклеток (размер 4-5 мкм).
- Заполните капилляры с ооцизтом или спорозоит подвески с помощью микро-загрузчик советы.
- Загрузите заполненный яйцей капилляр на микроинжектор.
- Микроинъекция 100-200 nL подвески в каждом органоидов под перевернутым микроскопом при 5x увеличение, сохраняя давление постоянным. После микроинъекции, освежить носители с OME или OMD каждый день и поддерживать пластину при 37 градусов по Цельсию.
ПРИМЕЧАНИЕ: Мы не используем микроманипулятор для микроинъекции. Использование одного и того же капилляра рекомендуется для всего эксперимента, чтобы обеспечить равную инъекцию в каждом образце.
- Подготовка стеклянных капилляров диаметром 1 мм с помощью выдвижного микропипетта.
5. Иммунофлуоресценция Окрашивание органоидов
- Соберите органоиды (1-2 х 24 скважины) с пипеткой P1000 в трубку 15 мл, содержащую холодный F12.
- Пеллетные органоиды при 300 х г в течение 2 мин, удалить супернатант, не нарушая гранулы, и осторожно пайпел гранулы свободно в оставшийся объем.
- Добавьте 5 мл 2% параформальдегида в PBS. Чтобы органоиды не прилипли к стене, не инвертировать трубку. Разрешить органоидов, чтобы осесть на дно трубки и исправить на 4 КС ночь или 1 ч при комнатной температуре.
- Удалить фиксатор и добавить 10 мл буфера пермяки (0,2% Тритон в PBS).
- Поверните трубку при комнатной температуре в течение 20 минут (это гарантирует, что все органоиды остаются в суспензии).
- Пелле органоидов на 300 х г в течение 2 мин, а затем отбросить супернатант.
- Приостановите органоиды мягко в 500 л блокирующего раствора (см. таблицу материалов)и перенесите в микроцентрифугную трубку 2 мл.
- Инкубировать в течение 20 минут при комнатной температуре на шейкере. Разрешить органоидов, чтобы осесть на дно трубки под действием силы тяжести. Замените блокирующий раствор первичным антителом (см. таблицу материалов)и инкубация для 1-2 ч при комнатной температуре или на ночь при температуре 4 градусов по Цельсию.
- Вымойте 3x с PBS, содержащим 0,1% Tween. Пусть органоиды оседают каждый раз и удалить супернатант.
- Добавьте вторичный раствор антител (см. таблицу материалов)и инкубировать в течение 2 ч при комнатной температуре.
- Вымойте 3x с PBS, содержащим 0,1% Tween. Оставьте 50 Л PBS после третьей стирки.
- Гора на слайде путем pipetting органоидов приостановлено в 50 Л PBS на слайде. Удалить избыток PBS, добавить каплю монтажного агента (см. таблицу материалов) и добавить coverslip на вершине. Запечатайте стороны лаком для ногтей и дайте ему высохнуть.
6. Изоляция ооцисты от органоидов
- Изолировать новообразованные ооцисты из органоидного просвета.
Примечание:Ооцисты изолированы от органоидов путем иммуномагнитного разделения с помощью комплекта изоляции яйцеклеток (см.Таблица материалов) с изменениями, описанными ниже. Изолированные яйцеклетки могут быть проанализированы с помощью иммунофлуоресценции и электронной микроскопии.- Начните с дифференцированных органоидов, которые были сохранены в OMD в течение 5-7 дней и которые не инфицированы, инфицированы в течение 1 дня и инфицированы в течение 5 дней. Используйте первые два в качестве отрицательного элемента управления.
ПРИМЕЧАНИЕ: Мы обнаружили, что дифференцированные органоиды производят больше яйцеклеток, чем легкие или расширение кишечных органоидов10. - Собирайте органоиды в центрифугные трубки мощностью 15 мл. Центрифуга органоидов в течение 20 мин при 3000 х г и 10 градусов по Цельсию.
ПРИМЕЧАНИЕ: Эта высокая скорость необходима, чтобы убедиться, что не яйцеклетки теряются из любых органоидов, которые могут быть нарушены. - Удалите органоидные носители и замените его 5 мл воды.
- Нарушить органоиды путем повторного энергичного пипетки с огневой полированной стеклянной пипеткой Pasteur.
- Если сгустки видны, перенесите органоидную суспензию в стекло dounce гомогенизатор, и гомогенизировать, пока органоиды хорошо нарушены. Выбросить гомогенизатор не повлияет на ооцисты.
- После того, как Есть нет видимых сгустков, добавить 5 мл буфера А из комплекта изоляции яйцеклеток. Смешайте, а затем добавить 120 л магнитных бусин, покрытых анти-ооцист IgM.
- Инкубировать клеточную подвеску и магнитные бусы на 2 ч при комнатной температуре с непрерывным смешиванием на рокерной платформе.
- В конце инкубации поместите трубки, содержащие клетки и бусы, на магнитной сепаратной стойке, рассчитанной на 15 мл труб.
- Поверните трубки в магнитной стойке разделения вручную в течение 3 мин. Бисер будет придерживаться стороны трубки рядом с магнитом.
- Осторожно, с 10 мл пипетки, удалить супернатант из бисера. Приготовьбуте бисер в 450 л буфера B и перенесите в микроцентрифугную трубку 1,5 мл.
ПРИМЕЧАНИЕ: Держите супернатант до тех пор, пока не подтвердится изоляция яйцеклеток. - Чтобы собрать все оставшиеся бусы и ооцисты, промойте трубку 15 мл с 450 л буфера B и добавьте эту стирку в магнитные бусы в микроцентрифуге трубки.
- Повторите шаг 6.1.11 еще раз. Все бусы и захваченные ооцисты теперь должны быть перенесены в микроцентрифугую трубку.
- Поместите микроцентрифугную трубку на магнитную сепаратную стойку, предназначенную для хранения микроцентрифуговых труб.
- Поверните трубку в магнитной стойке разделения вручную в течение 3 мин.
- Аккуратно удалите супернатант с пипеткой в новую трубку.
ПРИМЕЧАНИЕ: Держите супернатант до тех пор, пока не подтвердится изоляция яйцеклеток. - Удалите микроцентрифугную трубку, содержащую магнитные бусы и яйцеклетки, из магнитной стойки разделения.
- Добавьте 100 л 0,1 N HCl к магнитным бусинкам, чтобы выяснять яйцеклетки от бисера. Вихрь за 30 с.
ПРИМЕЧАНИЕ: Вихрь должен быть установлен на чуть меньше, чем максимальная скорость. - Инкубировать бусы в 0,1 N HCl в течение 10 минут при комнатной температуре.
- Снова вортекс. Затем поместите трубку обратно на магнитную стойку разделения. Подождите, пока шарики прилипут к стороне трубки, а затем перенесите супернатант в новую микроцентрифуговую трубку.
- Повторите шаги 6.1.17 через 6.1.19 и объедините второй eluate с первым elution.
- Нейтрализуем унитес с 20 зл и 1 N NaOH, или другой нейтрализующий буфер, такой как 1 M Tris, pH 8.
- Чтобы подсчитать яйцеклетки, возьмите 10 л элюат, свяжете его с 10 злистоками антител, специфичных для яйцеклеток (см. таблицу материалов)и посчитайте флуоресцентные яйцеты на гемоцитометре.
ПРИМЕЧАНИЕ: Изолированные яйцеклетки могут храниться при 4 градусах Цельсия или использоваться сразу для иммунофлюоресценции или электронной микроскопии.
- Начните с дифференцированных органоидов, которые были сохранены в OMD в течение 5-7 дней и которые не инфицированы, инфицированы в течение 1 дня и инфицированы в течение 5 дней. Используйте первые два в качестве отрицательного элемента управления.
Результаты
Представленные здесь протоколы приводят к эффективной очистке ооцизтов и спорозоитов(рисунок 1А),готовых к микроинъекциям. Протокол эксцистанции приводит к освобождению спорозоитов примерно от 70-80% яйцеклеток, поэтому важно отфильтровать оставшиеся ооцисты и оболочки через фильтр 3 мкм. Фильтрация приводит к почти 100% очистке спорозоита(рисунок 1B). Кроме того, добавление зеленого красителя помогает обеспечить инъекцию всех органоидов и позволяет визуализировать инъекционные органоиды, по крайней мере, в течение 24 ч после инъекции(рисунок 2B).
Эти протоколы для подготовки ооцисты и спорозоиты просты и используются в течение многих лет, поэтому ожидается, что обработанные ооцисты и очищенные спорозоиты будут жизнеспособными и инфекционными. Тем не менее, в наших исследованиях, мы использовали сканирование электронной микроскопии, чтобы убедиться, что процесс эксцизии не повредить sporozoites или яйцеклетки (Рисунок 2A)10. Инъекции равного количества яйцеклеток в органоидный просвет может быть визуально подтверждена простым микроскопическим изображением(рисунок 2C). Часть инфицированных органоидов должны быть созданы для проверки распространения паразитов количественных ПЦР, как мы описали10.
Прогресс через жизненный цикл паразита может быть визуализирован путем сбора инфицированных органоидов в разных точках времени после инфекции и анализа путем передачи электронной микроскопии или иммунофлуоресценции в сочетании с 4 ",6-диамидино-2-фенилиндол ( DAPI) окрашивание ядер паразита10. Например, антитела к мирозоитовым поверхности антигенов, такие как gp40 и gp1517, могут быть использованы для определения стадий меронта; типа I meronts будет иметь 8 ядер и типа II меронты, 4 ядра10. В последнее время, панель моноклональных антител, характерных для трофозоитов, мерозоитов, типа I против II меронты, и macrogamonts стала доступна18. Эти антитела также будут очень эффективны в маркировке прогресса паразита через его различные этапы жизненного цикла в органоидов.
Иммунофлуоресценция анализы также могут быть использованы для изучения, какие типы клеток заражены Cryptosporidium. Это было особенно важно смотреть на в дыхательных путей органоидов, как очень мало известно о дыхательных криптоспоридиоз, и точная клетка-хозяин для паразита не было известно. Мы провели иммунофлуоресценции анализы на Cryptosporidium-инфицированныхорганоидов, совместной локализации CC10, маркер для клубных клеток и обнаружили, что Cryptosporidium инфицированных как CC10- отрицательных и положительных клеток (Рисунок 3). Эти результаты были подтверждены TEMs, в котором мы наблюдали Cryptosporidium заражения секреторных и несекретных клеток в дыхательных путей органоидов10.
После дифференцированных органоидов были инфицированы в течение пяти дней, должно быть значительное количество яйцеклеток производится. В наших руках, инфекция органоидов из одной шести-хорошей пластины дали около 4000 яйцеклеток, которые могут быть легко идентифицированы и рассчитывать на гемоцитометр путем маркировки с ооцизтом конкретных антител. Присутствие четырех спорозоитов в яйцеклетках может быть подтверждено путем высыхания части яйцеклеток на клей слайд, фиксация с метанолом и объединения DAPI окрашивания с ооцизтом конкретных антител (Рисунок 4). Проверка производства толстых стенных ооцизтов может быть сделано с помощью tEM анализа10.
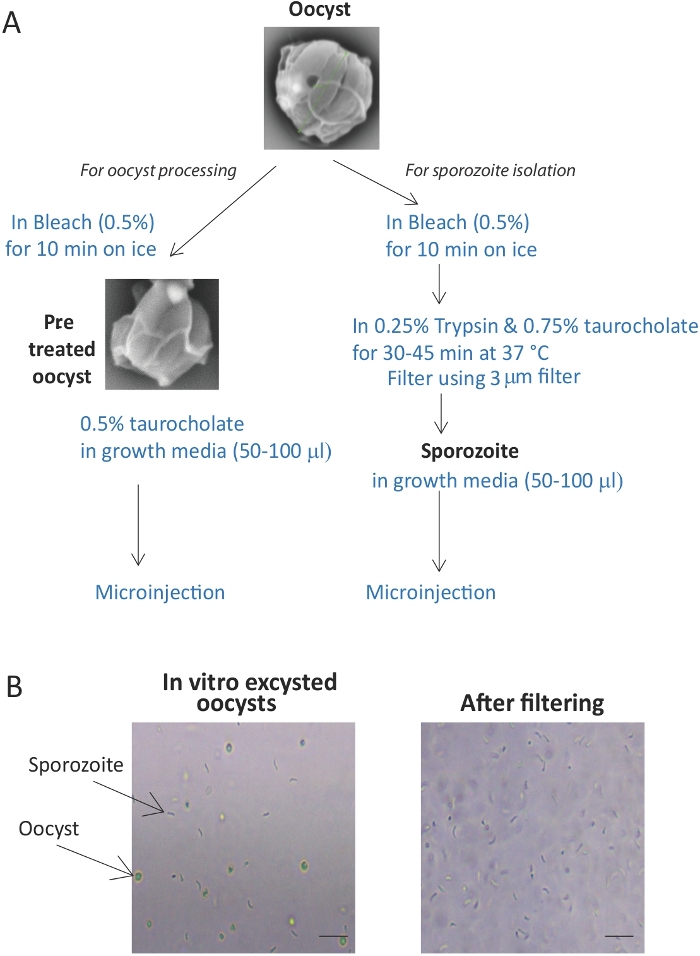
Рисунок 1: Подготовка и очистка ооцизтов криптоспоридия и спорозоитов. (A) Схематическое представление метода, используемого для ооцизста и спорозоита для инфекции. (B) Изображение, показывающее в пробирке эксцизии яйцеклеток. Фильтрация неостечения яйцеклеток и ракушек дает очищенный раствор спорозоитам. Шкала бар 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Микроинъекция яйцеклеток в органоидный просвет. Эта цифра была изменена с Heo et al.10. (A) сканирование электронной микроскопии (SEM) изображения яйцевидного и спорозоитов. (B) Изображение, показывающее ооцизм-инъекционные органоиды. Зеленый краситель помогает визуализировать инъекции каждого органоида и сохраняется в течение не менее 24 ч. (C) Изображение органоида вводят с ооцизтами. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
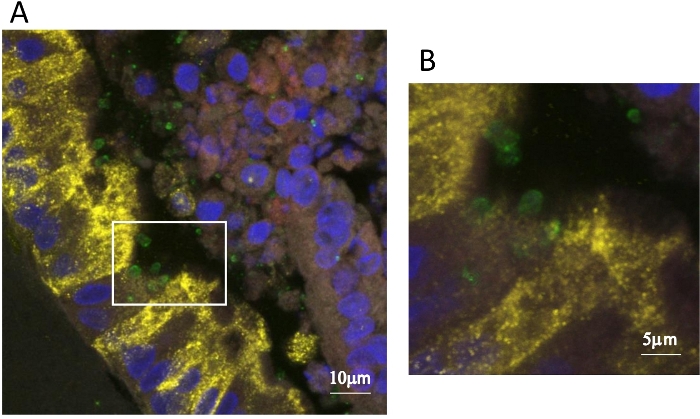
Рисунок 3: Иммунофлуоресценция изображение Cryptosporidium-инфицированныхдыхательных путей органоидов. Муцин помечен анти-муцин 5 антитела (красный) в просвет е органоидов, клубные клетки помечены анти-CC10 (желтый), Cryptosporidium обнаруживается с ооц-специфические антитела (зеленый), и ядра клеток окрашены DAPI (синий). Панель B представляет собой расширение площади, указанной в квадрате в панели A. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Иммунофлуоресценция изображение яйцеста, выделенного из дифференцированных кишечных органоидов. Оокистская стена помечена ооц-специфическими антителами в зеленом цвете, а четыре ядра поporoзоита визуализироваться с помощью DAPI (синий) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
Обсуждение
Культура паразитов Cryptosporidium в кишечных и дыхательных органах обеспечивает точную модель для изучения взаимодействия хозяина-паразита10, но также имеет много других применений. Например, современные методы отбора и распространения генетически модифицированных паразитов Cryptosporidium требуют прохождения у мышей19, что не позволяет изоляции паразитов, которые имеют изменения, необходимые для инфекции in vivo. Органоидная культура Криптоспоридиума является альтернативой этой процедуре. Тем не менее, мы отметили, что электропорастовые спорозоиты слипаются и блокируют микропипет. Для выбора генетически модифицированных паразитов, органоиды могут быть выращены на коллагеновпокрытие трансвеллы в двумерном формате в условиях дифференциации, чтобы инфекция с транс-инфицированных спорозоитов и, следовательно, выбор генетически модифицированных яйцеклеток. Трансвеллы обеспечивают доступ как к акическим, так и к базолатеральным поверхностям и стабильны в течение длительных периодов времени.
В настоящее время мы культуры органоидов в двумерном формате для высокой пропускной проликновки скрининга препаратов для рака ткани полученных органоидов (неопубликованные данные). Этот метод органоидной культуры также может быть адаптирован для тестированияанти-Криптоспоридиум наркотиков с использованием генетически модифицированных люциферазы помечены Штаммы Cryptosporidium 19. Более того, несмотря на то, что инфекция не синхронизирована, инфекция органоидов с порозоитами обеспечивает достаточную синхронизацию жизненного цикла, чтобы препараты могли быть проверены на их эффективность на конкретных этапах жизненного цикла.
Органоидные системы совместной культуры в настоящее время разрабатываются с учетом некоторых других аспектов системы хозяина, таких как микробиота и иммунные клетки20. Таким образом, способность вскрывать взаимодействия между паразитом и клетками-хозяинами, иммунными клетками и микробиотой скоро станет возможной в пробирке. Генетические манипуляции Cryptosporidium также теперь возможно19, и сочетание флуоресцентных штаммов репортер Cryptosporidium и органоидной культуры обеспечит инструменты для одноклеточного секвенирования инфицированных клеток, и еще более конкретно одноклеточного секвенирования клеток, инфицированных конкретными стадиями паразита.
Успех описанных здесь экспериментов в этом году сильно зависит от жизнеспособности и инфекционности яйцеклеток. Различные партии ооцизтов Cryptosporidium могут сильно различаться по показателям выбросов и способности заражать клетки-хозяина. Достаточная урожайность спорозоитов зависит от хороших показателей эксцостанции, а уровень эксцотестации не всегда коррелирует с инфекционностью. Если низкие уровни инфекции или плохой excystation наблюдаются с определенной партией ооцизтов, время и усилия могут быть сохранены путем получения нового много яйцеклеток, а не пытаться увеличить число яйцеклеток, или удлинение инкубационных раз.
Органоидные средства массовой информации культуры должны обновляться каждый альтернативный день. Рекомендуется использование более ранних пассажей органоидных культур. Важно разморозить новый флакон органоидов, если органоиды начинают дифференцироваться в более поздних пролетах, так как здоровье органоидных культур значительно определяет жизнеспособность паразита. После заражения, органоидные средства массовой информации должны обновляться каждый день, чтобы избежать накопления токсичных веществ в средствах массовой информации.
Органоидная культура Криптоспоридиума ограничена тем, что паразит не может размножаться бесконечно, а инфекция высаживается после трех пассажей в течение 28 дней10. Микроинъекция достаточного количества органоидов для экспериментов на мышах, подобных описанным мы, может занять много времени и физически облагать налогом. Тем не менее, на сегодняшний день ни один другой метод не позволяет полный жизненный цикл в системе in vitro полностью репрезентативны для инфекции человека, и ни одна культурная система не была описана, что позволяет исследовать взаимодействия хозяина-патогена, важные для респираторной инфекции. Органоидная культура Cryptosporidium обеспечивает мощный новый инструмент, который открывает возможности для исследования в принимающей паразит взаимодействия ранее не представляется возможным для Cryptosporidium.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы признательны Деборе А. Шефер из Школы животных и сравнительных биомедицинских наук, Колледжа сельского хозяйства и наук о жизни, Университета Аризоны, Тусона, ак, США за помощь в производстве и анализе яйцеклеток. Мы также благодарим Франчески Микроскопия и Imaging центр и Д. Л. Mullendore в Университете штата Вашингтон для TEM подготовки и визуализации изолированных органоидных ооц.
Д.Д. является получателем гранта VENI от Нидерландской организации научных исследований (NWO-ALW, 016.Veni.171.015). I.H. является получателем гранта VENI от Нидерландской организации научных исследований (NWO-ALW, 863.14.002) и поддерживается стипендией Марии Кюри от Европейской комиссии (Предложение 330571 FP7-PEOPLE-2012-IIF). Исследования, приведшие к этим результатам, получили финансирование от Европейского исследовательского совета в соответствии с Соглашением о расширенных грантах ERC No 67013 и от NIH NIAIH в соответствии с R21 AT009174 в RMO. Эта работа является частью Института Oncode, который частично финансируется Голландским онкологическим обществом и финансируется за счет гранта Голландского онкологического общества.
Материалы
| Name | Company | Catalog Number | Comments |
| Basement membrane extract (extracellular matrix) | amsbio | 3533-010-02 | |
| Crypt-a-Glo antibody (Oocyst specific antibody) | Waterborne, Inc | A400FLR-1X | Final Concentration = Use 2-3 drops/slide |
| Crypto-Grab IgM coated Magnetic beads | Waterborne, Inc | IMS400-20 | |
| Dynamag 15 rack | Thermofisher Scientific | 12301D | |
| Dynamag 2 rack | Thermofisher Scientific | 12321D | |
| EMD Millipore Isopore Polycarbonate Membrane Filters- 3µm | EMD-Millipore | TSTP02500 | |
| Fast green dye | SIGMA | F7252-5G | |
| Femtojet 4i Microinjector | Eppendorf | 5252000013 | |
| Glass capillaries of 1 mm diameter | WPI | TW100F-4 | |
| Matrigel (extracellular matrix) | Corning | 356237 | |
| Microfuge tube 1.5 mL | Eppendorf | T9661-1000EA | |
| Micro-loader tips | Eppendorf | 612-7933 | |
| Micropipette puller P-97 | Shutter instrument | P-97 | |
| Normal donkey Serum | Bio-Rad | C06SB | |
| Penstrep | Gibco | 15140-122 | |
| Sodium hypoclorite (use 5%) | Clorox | 50371478 | |
| Super stick slides | Waterborne, Inc | S100-3 | |
| Swinnex-25 47 mm Polycarbonate filter holder | EMD-Millipore | SX0002500 | |
| Taurocholic acid sodium salt hydrate | SIGMA | T4009-5G | |
| Tween-20 | Merck | 8221840500 | |
| Vectashield mounting agent | Vector Labs | H-1000 | |
| Vortex Genie 2 | Scientific industries, Inc | SI0236 | |
| Adv+++ (DMEM+Penstrep+Glutamax+Hepes) | Final amount | ||
| DMEM | Invitrogen | 12634-010 | 500 mL |
| Penstrep | Gibco | 15140-122 | 5 mL of stock in 500 mL DMEM |
| Glutamax | Gibco | 35050038 | 5 mL of stock in 500 mL DMEM |
| Hepes | Gibco | 15630056 | 5 mL of stock in 500 mL DMEM |
| INTESTINAL ORGANOID MEDIA-OME (Expansion media) | Final concentration | ||
| A83-01 | Tocris | 2939-50mg | 0.5 µM |
| Adv+++ | make up to 100 mL | ||
| B27 | Invitrogen | 17504044 | 1x |
| EGF | Peprotech | AF-100-15 | 50 ng/mL |
| Gastrin | Tocris | 3006-1mg | 10 nM |
| NAC | Sigma | A9125-25G | 1.25 mM |
| NIC | Sigma | N0636-100G | 10 mM |
| Noggin CM | In house* | 10% | |
| P38 inhibitor (SB202190) | Sigma | S7076-25 mg | 10 µM |
| PGE2 | Tocris | 2296/10 | 10 nM |
| Primocin | InvivoGen | ant-pm-1 | 1 mL/500 mL media |
| RSpoI CM | In house* | 20% | |
| Wnt3a CM | In house* | 50% | |
| In house* - cell lines will be provided upon request | |||
| INTESTINAL ORGANOID MEDIA-OMD (Differentiation media) | To differentiate organoids, expanding small intestinal organoids were grown in a Wnt-rich medium for six to seven days after splitting, and then grown in a differentiation medium (withdrawal of Wnt, nicotinamide, SB202190, in a differentiation medium (withdrawal of Wnt, nicotinamide, SB202190, prostaglandin E2 from a Wnt-rich medium or OME) | ||
| LUNG ORGANOID MEDIA- LOM (Differentiation media) | Final concentration | ||
| Adv+++ | make up to 100 mL | ||
| ALK-I A83-01 | Tocris | 2939-50mg | 500 nM |
| B27 | Invitrogen | 17504044 | 0.0763888889 |
| FGF-10 | Peprotech | 100-26 | 100 ng/mL |
| FGF-7 | Peprotech | 100-19 | 25 ng/mL |
| N-Acetylcysteine | Sigma | A9125-25G | 1.25 mM |
| Nicotinamide | Sigma | N0636-100G | 5 mM |
| Noggin UPE | U-Protein Express | Contact company directly | 10% |
| p38 MAPK-I | Sigma | S7076-25 mg | 1 µM |
| Primocin | InvivoGen | ant-pm-1 | 1:500 |
| RhoKI Y-27632 | Abmole Bioscience | M1817_100 mg | 2.5 µm |
| Rspo UPE | U-Protein Express | Contact company directly | 10% |
| Reducing buffer (for resuspension of oocysts and sporozoites for injection) | Final concentration | ||
| L-Glutathione reduced | Sigma | G4251-10MG | 0.5 μg/μL of OME/OMD/LOM |
| Betaine | Sigma | 61962 | 0.5 μg/μL of OME/OMD/LOM |
| L-Cysteine | Sigma | 168149-2.5G | 0.5 μg/μL of OME/OMD/LOM |
| Linoleic acid | Sigma | L1376-10MG | 6.8 μg/mL of OME/OMD /LOM |
| Taurine | Sigma | T0625-10MG | 0.5 μg/μL of OME/OMD/LOM |
| Blocking buffer (for immunoflourescence staining) | Final concentration | ||
| Donkey/Goat serum | Bio-Rad | C06SB | 2% |
| PBS | Thermo-Fisher | 70011044 | Make up to 100 mL |
| Tween 20 | Merck | P1379 | 0.1% |
| List of Antibodies used | |||
| Alexa 568 goat anti-rabbit | Invitrogen | A-11011 | Dilution-1:500; RRID: AB_143157 |
| Crypt-a-Glo Comprehensive Kit- Fluorescein-labeled antibody Crypto-Glo | Waterborne, Inc | A400FLK | Dilution- 1:200 |
| Crypta-Grab IMS Beads- Magnetic beads coated in monoclonal antibody reactive | Waterborne, Inc | IMS400-20 | Dilution-1:500 |
| DAPI | Thermo Fisher Scientific | D1306 | Dilution-1:1,000; RRID : AB_2629482 |
| Phalloidin-Alexa 674 | Invitrogen | A22287 | Dilution-1:1,000; RRID: AB_2620155 |
| Rabbit anti-gp15 antibody generated by R. M. O’Connor (co-author). | Upon request | Upon request | Dilution-1:500 |
| Sporo-Glo | Waterborne, Inc | A600FLR-1X | Dilution- 1:200 |
Ссылки
- Checkley, W., et al. A review of the global burden, novel diagnostics, therapeutics, and vaccine targets for Cryptosporidium. The Lancet Infectious Diseases. 15 (1), 85-94 (2015).
- Bones, A. J., et al. Past and future trends of Cryptosporidium in vitro research. Experimental Parasitology. 196, 28-37 (2018).
- Muller, J., Hemphill, A. In vitro culture systems for the study of apicomplexan parasites in farm animals. International Journal for Parasitology. 43 (2), 115-124 (2013).
- Karanis, P., Aldeyarbi, H. M. Evolution of Cryptosporidium in vitro culture. International Journal for Parasitology. 41 (12), 1231-1242 (2011).
- Morada, M., et al. Continuous culture of Cryptosporidium parvum using hollow fiber technology. International Journal for Parasitology. 46 (1), 21-29 (2016).
- DeCicco RePass, M. A., et al. Novel Bioengineered Three-Dimensional Human Intestinal Model for Long-Term Infection of Cryptosporidium parvum. Infection and Immunity. 85 (3), (2017).
- Miller, C. N., et al. A cell culture platform for Cryptosporidium that enables long-term cultivation and new tools for the systematic investigation of its biology. International Journal for Parasitology. 48 (3-4), 197-201 (2018).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modelling. bioRxiv. , (2018).
- Dutta, D., Clevers, H. Organoid culture systems to study host-pathogen interactions. Current Opinion in Immunology. 48, 15-22 (2017).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Dutta, D., Heo, I., Clevers, H. Disease Modeling in Stem Cell-Derived 3D Organoid Systems. Trends in Molecular Medicine. 23 (5), 393-410 (2017).
- Clevers, H. Modeling Development and Disease with Organoids. Cell. 165 (7), 1586-1597 (2016).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- O'Hara, S. P., Chen, X. M. The cell biology of Cryptosporidium infection. Microbes and Infection. 13 (8-9), 721-730 (2011).
- Lendner, M., Daugschies, A. Cryptosporidium infections: molecular advances. Parasitology. 141 (11), 1511-1532 (2014).
- Feng, H., Nie, W., Sheoran, A., Zhang, Q., Tzipori, S. Bile acids enhance invasiveness of Cryptosporidium spp. into cultured cells. Infection and Immunity. 74 (6), 3342-3346 (2006).
- O'Connor, R. M., Kim, K., Khan, F., Ward, H. Expression of Cpgp40/15 in Toxoplasma gondii: a surrogate system for the study of Cryptosporidium glycoprotein antigens. Infection and Immunity. 71, 6027-6034 (2003).
- Wilke, G., et al. Monoclonal Antibodies to Intracellular Stages of Cryptosporidium parvum Define Life Cycle Progression In Vitro. mSphere. 3 (3), (2018).
- Vinayak, S., et al. Genetic modification of the diarrhoeal pathogen Cryptosporidium parvum. Nature. 523 (7561), 477-480 (2015).
- Dijkstra, K. K., et al. Generation of Tumor-Reactive T Cells by Co-culture of Peripheral Blood Lymphocytes and Tumor Organoids. Cell. 174 (6), 1586-1598 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены