Method Article
دراسة عدوى Cryptosporidium في أنظمة الثقافة العضوية البشرية المشتقة من الأنسجة ثلاثية الدناطية عن طريق الحقن المجهري
In This Article
Summary
نحن نصف بروتوكولات لإعداد oocysts وتنقية sporozoites لدراسة العدوى من أجهزة الجهاز الهضمي والهواء البشري من قبل Cryptosporidium parvum. نقوم بتوضيح إجراءات الحقن المجهري للطفيليات في تجويف الأعضاء المعوية وتلطيخ المناعة من الأعضاء. وأخيرا، ونحن نصف عزل ة الخراجات المتولدة من الأعضاء.
Abstract
Cryptosporidium parvum هو واحد من الأسباب الرئيسية لمرض الإسهال البشري. لفهم أمراض الطفيلي وتطوير الأدوية الفعالة ، هناك حاجة إلى نظام زراعة في المختبر يلخص الظروف في المضيف. الأعضاء، التي تشبه إلى حد كبير الأنسجة من أصلها، مثالية لدراسة التفاعلات بين المضيف والطفيلي. الأعضاء هي هياكل ثلاثية الأبعاد مشتقة من الأنسجة مشتقة من الخلايا الجذعية للبالغين وتنمو في الثقافة لفترات طويلة من الزمن دون أن تتعرض لأي انحراف وراثي أو تحول. لديهم القطبية محددة جيدا مع كل من الأسطح البهيجة وbasolateral. الأعضاء لديها تطبيقات مختلفة في اختبار المخدرات، والأعمال المصرفية الحيوية، ونمذجة الأمراض ودراسات التفاعل بين المضيف والميكروبات. هنا نقدم بروتوكول خطوة بخطوة لكيفية إعداد oocysts وsporozoites من Cryptosporidium لإصابة الأمعاء البشرية والجهاز الهوائي. ثم نبين كيف يمكن استخدام الحقن المجهري لحقن الميكروبات في التجويف العضوي. هناك ثلاث طرق رئيسية يمكن من خلالها استخدام الأعضاء في دراسات التفاعل بين المضيف والميكروبات - الحقن المجهري، القص الميكانيكي والطلاء، وعن طريق صنع الطبقات الأحادية. الحقن المجهري يتيح الحفاظ على هيكل 3D ويسمح للسيطرة الدقيقة على أحجام الطفيليات والاتصال الجانبي apical مباشرة للميكروبات. نحن نقدم تفاصيل للنمو الأمثل للأعضاء إما التصوير أو إنتاج الكيسة. وأخيرا، ونحن نبين أيضا كيف يمكن عزل oocysts ولدت حديثا من الجهازية لمزيد من المعالجة النهائية والتحليل.
Introduction
وقد أعاق تطوير الأدوية أو اللقاحات لعلاج والوقاية من عدوى Cryptosporidium بسبب عدم وجود أنظمة في المختبر التي تحاكي على وجه التحديد في حالة الجسم الحي في البشر1،2. العديد من النظم المتاحة حاليا إما تسمح فقط العدوى على المدى القصير (<5 أيام) أو لا تدعم دورة الحياة الكاملة للطفيلي3،4. وتقوم الأنظمة الأخرى التي تمكن من التطور الكامل للطفيلي على خطوط الخلايا الخالدة أو خطوط الخلايا السرطانية التي لا تلخص بأمانة الوضع الفسيولوجي في البشر5و6و7 . الأعضاء أو "الأعضاء المصغرة" هي هياكل مشتقة من الأنسجة ثلاثية الأبعاد والتي تزرع في مصفوفة خارج الخلية تكملها عوامل نمو مختلفة خاصة بالأنسجة. وقد وضعت الأعضاء من مختلف الأجهزة والأنسجة. وهي مستقرة وراثيا وخلاصة معظم وظائف الأجهزة من أصلها، ويمكن الحفاظ عليها في الثقافة لفترات طويلة من الزمن. لقد طورنا طريقة لإصابة أجهزة الجهاز ية والرئة المعوية البشرية مع Cryptosporidium التي توفر نموذج دقيق في المختبر لدراسة التفاعلات بين المضيف والطفيليات ذات الصلة بالأمعاء والجهاز التنفسي cryptosporidiosis8 ،9،10،11،12،13. على النقيض من النماذج الثقافية المنشورة الأخرى، يمثل النظام العضوي تفاعلات الطفيليات المضيفة في الحياة الحقيقية، ويسمح بإكمال دورة الحياة بحيث يمكن دراسة جميع مراحل دورة حياة الطفيلي، ويحافظ على انتشار الطفيليات لمدة تصل إلى 28 يوما10.
Cryptosporidium parvum هو طفيلي أبي مركب يصيب ظهارة الجهاز التنفسي والأمعاء، مما يسبب مرض الإسهال لفترات طويلة. المرحلة البيئية المقاومة هي الكيسة، وجدت في المواد الغذائية والمياه الملوثة14. مرة واحدة بلعها أو استنشاقها، وexcysts oocysts ويطلق أربعة sporozoites التي تعلق على الخلايا الظهارية. Sporozoites تنزلق على الخلايا المضيفة والانخراط مستقبلات الخلية المضيفة، ولكن الطفيلي لا يغزو الخلية تماما، ويبدو أن حث الخلية المضيفة لغمرها15. يبقى الطفيلي، الذي يتم استيعابه داخل مقصورة داخل الخلايا ولكن خارج السيتوبلازم، على السطح الاستئصالي للخلية، وتكرار داخل vacuole الطفيلية. وهو يخضع لجولتين من التكاثر غير الجنسي - وهي عملية تسمى merogony. خلال merogony، نوع I meronts تطوير التي تحتوي على ثمانية merozoites التي يتم تحريرها لغزو خلايا جديدة. هذه merozoites غزو خلايا جديدة لتطوير إلى نوع 2 meronts تحتوي على أربعة merozoites. هذه merozoites، عندما صدر، تصيب الخلايا وتتطور إلى macrogamonts وmicrogamonts. يتم تحرير Microgametes وتخصيب الماكروجاميتس إنتاج الزيجوت التي تنضج في oocysts. يتم إطلاق الخراجات الناضجة في وقت لاحق في التجويف. الخراجات هي إما رقيقة الجدران التي excyst على الفور لإعادة تطهير ظهارة، أو سميكة الجدران التي يتم تحريرها في البيئة لتصيب المضيف المقبل14. وقد تم تحديد جميع مراحل دورة حياة Cryptosporidium في نظام الثقافة العضوية التي وضعت سابقا من قبل مجموعتنا10.
منذ الأعضاء البشرية بصدق تكرار الأنسجة البشرية9،11،13،ودعم جميع المراحل المستنسخة من Cryptosporidium10،فهي نظام زراعة الأنسجة المثالي لدراسة علم الأحياء Cryptosporidium والتفاعلات بين المضيف والطفيلي. هنا نقوم بوصف إجراءات إصابة الأعضاء مع كل من Cryptosporidium oocysts وsporozoites excysted، وعزل oocysts الجديدة المنتجة في هذا النظام زراعة الأنسجة.
Protocol
تم إجراء جميع مناولة الأنسجة واستئصالها في إطار البروتوكولات المعتمدة من مجلس المراجعة المؤسسية (IRB) بموافقة المريض.
1. إعداد C. parvum Oocysts للحقن
ملاحظة: تم شراء الخراجات Cryptosporidium من مصدر تجاري (انظر جدول المواد). يتم إنتاج هذه الخراجات في العجول ويتم تخزينها في محلول ملحي بالفوسفات (PBS) مع المضادات الحيوية. ويمكن تخزينها لمدة 3 أشهر تقريبا في 4 درجة مئوية وينبغي أبدا أن تكون مجمدة. نحن عادة استخدام oocysts في غضون شهر واحد. يمكن أن تكون الجهازية مصابة إما بأكياس أوكيسات سليمة، أو قد تكون معزولة من الخراجات الكيسية وتستخدم لإصابة الأعضاء إذا كان من المهم عدم نقل الخراجات من الأوكولوم الأصلي.
-
إعداد الخراجات Cryptosporidium لتصيب الخلايا(الشكل 1A).
- الحفاظ على oocysts على الجليد في جميع التلاعبات حتى يتم إضافتها إلى organoids.
- حساب عدد الخراجات اللازمة للوحة كاملة من ستة جيدا من الأعضاء (عادة حوالي 5 × 105-2.5 × 105 للوحة). عد أعداد الخراجات في مقياس الهيموكيتومات للتحقق من الكمية ونقلها إلى أنبوب الطرد المركزي.
ملاحظة: للمساعدة في التصور، قد تكون مختلطة oocysts 1:1 مع الأجسام المضادة الفلورية محددة oocyst (انظر جدول المواد)قبل تحميلها على مقياس الهيموكيتومات. ويمكن بعد ذلك تصور الخراجات ذات العلامات الفلورية بسهولة وتعدادها باستخدام مجهر الفلورة. نقترح حقن حوالي 100-1000 oocysts / الجهاز. بشكل عام، يمكن زراعة 1000-2000 عضو في لوحة من ستة آبار. - جلب حجم تعليق oocysts تصل إلى 900 درجة مئوية مع PBS. إضافة 100 ميكرولتر من هيبوكلوريت الصوديوم (على سبيل المثال، كلوروكس) التبييض (في 4 درجة مئوية). الحضانة لمدة 10 دقائق على الجليد.
- الطرد المركزي لمدة 3 دقائق في جهاز طرد مركزي صغير في 8000 × ز في 4 درجة مئوية. توجيه الأنابيب في الطرد المركزي مع فتحة الغطاء التي تواجه الداخل. بيليه يمكن أن يكون من الصعب أن نرى ذلك معرفة أين الطفيليات قد بيليه في الأنبوب أمر ضروري.
- إزالة supernatant مع ماصة الحرص على تجنب بيليه. أضف 1 مل من وسط النسر المعدل (DMEM) والدوامة لخلطها.
- الطرد المركزي لمدة 3 دقائق في جهاز طرد مركزي صغير في 8000 × ز في 4 درجة مئوية.
- كرر الإذابة مع DMEM مرتين إضافيتين.
- إعداد وسيط التوسع (OME) أو التمايز المتوسط العضوي (OMD) الذي أضيف إليه التوروتشولات إلى تركيز نهائي قدره 0.5% (ث/v) (انظر جدول المواد). يجب أن تكون دائما ً جاهزة وتضاف طازجة.
ملاحظة: لقد استخدمنا بنجاح 0.5٪ taurocholate في تجارب العدوى لدينا حيث inoculum هو oocysts سليمة، وشهدت معدلات محسنة من العدوى دون آثار ضارة على الخلايا المضيفة. ومع ذلك، قد يكون taurocholate آثار غير متوقعة على الخلايا، وقد استخدمت تركيزات أقل بنجاح في الاختبارات العدوى16. - إعادة تعليق الخراجات في 100 ميكرولتر من ثقافة العضوية المتوسطة تكملها 0.5٪ (ث / الخامس) توروتشولات الصوديوم. عد الخراجات مرة أخرى كما هو موضح في الخطوة 1.1.2.
- إضافة صبغة خضراء سريعة إلى التعليق من أجل تصور الحقن.
- املأ نصائح اللودر الصغير (راجع جدول المواد)مع تعليق الكيسة واستخدامها لملء الشعيرات الدموية المسحوبة.
تحذير: وينبغي أن يتم الإجراء بأكمله في غطاء محرك السيارة زراعة الأنسجة مع بروتوكولات السلامة من المستوى 2. ويوصى باستخدام الأقنعة كما Cryptosporidium oocysts يمكن أيضا أن تكون المعدية عندما المحمولة جوا.
2. في المختبر تنقية Sporozoites من C. parvum Oocysts
-
تنقية sporozoites من C. parvuم oocysts بعد تبييض وغسل التبييض كما هو موضح أعلاه.
- نقل الخراجات إلى أنبوب 15 مل. إعادة تعليق الخراجات في درجة حرارة الغرفة excystation المتوسطة (0.75٪ ث / ف توروتشولات الصوديوم في DMEM) للحصول على 1 × 107 oocysts / مل. إضافة taurocholate يحسن معدل excystation من oocysts، وتحسين العائد sporozoite.
- حمل تعليق الكيسة عند درجة حرارة 37 درجة مئوية لمدة 1-1.5 ساعة.
- التحقق من العينة مجهريًا لمدى الإثارة؛ 60-80٪ excystation هو معقول لاسترداد جيدة من sporozoites. إذا كان مستوى excystation منخفضًا، فاحتضن لفترة أطول (30 دقيقة أخرى إلى 1 ساعة).
- تحديد النسبة المئوية excystation نسبة إلى عدد من oocysts بدء. يتم حساب Excystation على النحو التالي:
٪ excystation = [1 - (عدد الخراجات سليمة / عدد من الخراجات في البداية)] × 100 - غسل الخلايا لإزالة الكواشف excystation عن طريق إضافة 14 مل من PBS أو المتوسطة، وخلط، واسترداد الخلايا (oocysts سليمة، وقذائف oocyst، وsporozoites) عن طريق الطرد المركزي في 3400 × ز لمدة 20 دقيقة لاسترداد sporozoites. يستنشق بعناية لتجنب فقدان الخلايا.
- إعادة تعليق بيليه sporozoite في 1-2 مل من DMEM للحصول على 3 × 107 oocysts / مل (على أساس عدد من oocysts بدء).
- لإزالة الخراجات والقذائف المتبقية، قم بتصفية التعليق من خلال فلتر 3 ميكرومتر(الشكل 1B). استخدم جهاز حامل فلتر مقاس 47 مم مزود بفلتر البولي (حجم المسام 3 ميكرومتر) المرفق ببرميل حقنة سعة 10 مل. ضع جهاز حامل الفلتر فوق أنبوب بـ 15 مل. وضع التجمع في دلو الجليد أو في غرفة باردة.
- إضافة 7.5 مل من تعليق sporozoite إلى الجمعية مرشح والسماح لتصفية من خلال الجاذبية. غسل من خلال مع آخر 7.5 مل من DMEM.
ملاحظة: لضمان النجاح في العزلة sporozoite oocysts الطازجة وexcystation جيدة حاسمة. إذا كان هناك الكثير من الخراجات غير الكيسية، فإن التعليق لن يتدفق من خلال الجاذبية. يمكن أن يؤدي الضغط على المحاقن إلى فرض الخراجات غير الكيسية من خلال. الحقن المجهري من sporozoites هو أكثر تحديا من ذلك من oocysts لأن sporozoites قد تكتل وكتلة الشعرية. لتجنب هذا، نوصي بإجراء طرف الشعرية أوسع عند حقن الأعضاء مع sporozoites. لتحقيق مستويات كافية من العدوى، 2-4 أضعاف عدد sporozoites تحتاج إلى حقن في كل عضوي بالمقارنة مع الأعضاء المصابة الخراجات. - الطرد المركزي تعليق sporozoite المصفاة في 3400 × ز باستخدام الدوار دلو يتأرجح لمدة 20 دقيقة إلى sporozoites بيليه.
- إعادة تعليق في 50-100 ميكرولتر من OME أو OMD أو أومد متوسط الثقافة العضوية (انظر جدول المواد)تستكمل مع 0.05٪ (ث / خمس) صبغ الأخضر السريع وL-الجلوتاثيون، البيتين، L-سيستين، حمض اللينوليك وتورين-- تحتوي على العازلة5 (انظر جدول المواد).
ملاحظة: قد يؤدي احتضان الخراجات لفترة طويلة جداً إلى انخفاض السبوروزويتس وضعف الانتعاش، وبالتالي ينبغي تجنبها.
3. في المختبر ثقافة الأمعاء البشرية والرئة العضوية للحقن المجهري
- ثقافة الأعضاء المعوية في ظل التوسع والتمايز الظروف الإعلامية.
ملاحظه:وقد سبق وصف تفاصيل انتشار الجهاز المعوي والرئة في مواد أخرى8,13(انظرجدول الموادلوصفات وسائل الإعلام). هنا، ونحن نصف بإيجاز طريقة الثقافة العضوية مع إشارة محددة إلى التحسين لCryptosporidiumالحقن والنمو. لقد وجدنا أنه بالنسبة لتصوير الطفيليات في الأعضاء، فإن الأعضاء المزروعة في وسط التوسع هي أفضل من تلك الموجودة في وسائل الإعلام التمايزية المزروعة حيث أن تراكم الحطام أقل من تراكم الحطام الذي يُرى في الأعضاء المزروعة في وسط التمايز. ومع ذلك، إذا كان الهدف هو عزل الخراجات، والأعضاء نمت في وسائل الإعلام التمايز تنتج أعداد أعلى بكثير من oocysts.- الحفاظ على الأعضاء في الثقافات 3D في مصفوفة خارج الخلية (انظر جدول المواد)في 37 درجة مئوية. إضافة OME (توسيع وسائل الإعلام) على رأس وتحديث كل يوم.
ملاحظة: بالنسبة للأعضاء الرئوية، ليس لدينا وسائل إعلام منفصلة للتوسع والتمايز. - لتقسيم ولوحة organoids للحقن الدقيق، وإزالة وسائل الإعلام من لوحة 6-جيدا تحتوي على الأعضاء البشرية وإضافة F12 +++ (انظر جدول المواد)إلى البئر وكسر المصفوفة عن طريق الأنابيب مع طرف ماصة 1 مل عدة مرات. جمع الخلايا في أنبوب 15 مل (2 مل من F12 +++ لكل أنبوب يكفي لمزيد من الإجراءات).
- إضافة 10-12 مل من F12 +++ في أنبوب آخر 15 مل ووضع أنبوب زجاجي مصقول النار في المتوسط، ماصة صعودا وهبوطا 3 مرات لتفريق الجهازية المعوية والرئة البشرية.
ملاحظة: استخدم أنبوب زجاجي طويل (20-30 سم) وتلميع النار لفترة وجيزة. لا تجعل فتح (1 مم قطر) صغيرة جدا لأن الأعضاء يمكن أن تتلف. جعل غيض من pipet على نحو سلس من قبل لفترة وجيزة تلميع النار عليه. كسر الأعضاء إلى قطع أصغر من ~ 50 ميكرومتر. وعلاوة على ذلك، لديهم معدل نمو أبطأ من الأعضاء المعوية (تصل إلى 14 يوما بين كل passaging). - أضف F12+++ حتى 5-7 مل والطرد المركزي بمعدل 350 × غرام لمدة 5 دقائق.
ملاحظة: سرعة الطرد المركزي في هذه الخطوة أعلى من المعتاد من أجل جعل بيليه الخلية الجيدة التي يتم فصلها بشكل جيد عن المصفوفة خارج الخلية (انظر جدول المواد). وقد لاحظنا أنه بالمقارنة مع الأعضاء الأمعاء الدقيقة الماوس، والأعضاء الأمعاء الدقيقة البشرية من الصعب تعطيل. - إزالة أكبر قدر ممكن من المتوسطة دون إزعاج الخلايا، ثم إعادة تعليق بيليه مع مصفوفة الحفاظ عليها في 4 درجة مئوية. مطلوب 200-300 درجة مئوية من المصفوفة لكل بئر من لوحة ستة آبار. يجب تقسيم الأعضاء واحد من كل ثلاثة للحفاظ على كثافة الخلايا عالية إلى حد ما.
- لوحة الأعضاء في قطرات مصفوفة من حوالي 5-10 ميكرول كل في بئر لوحة ستة جيدا. قم بالحضانة لمدة 20-30 دقيقة عند درجة حرارة 37 درجة مئوية ثم أضف وسيط ة توسيع (OME) في الأعلى.
- تغيير المتوسط كل 2-3 أيام.
ملاحظة: في حوالي 5-7 أيام، تصل الأعضاء التي تنمو في EM إلى حجم 100-200 ميكرومتر وهي جاهزة للحقن. - للتمييز بين الأعضاء، بعد 5-6 أيام في EM، تغيير وسائل الإعلام إلى ظروف وسائل الإعلام التمايز (DM) والحفاظ على 5-6 أيام إضافية قبل حقن الطفيليات.
ملاحظة: لتوسيع الأعضاء ، فمن المستحسن أن لوحة organoids بكثافة. للحقن الدقيق، ينصح باستخدام لوحة ستة جيدا مع العضويات مطلي ة في كثافة أقل. على سبيل المثال، لوحات organoids من ثلاثة آبار من لوحة ستة آبار في لوحة كاملة ستة جيدا للحقن المجهرية. وينبغي الإبقاء على المصفوفة عند -20 درجة مئوية للتخزين الطويل الأجل وذوبانها عند درجة حرارة 4 درجات مئوية أو على الجليد قبل استخدامها. يتم توسيع أعضاء الرئة بطريقة مماثلة ولكن باستخدام مكونات الوسائط الخاصة بالرئة العضوية(الجدول 1)8 .
- الحفاظ على الأعضاء في الثقافات 3D في مصفوفة خارج الخلية (انظر جدول المواد)في 37 درجة مئوية. إضافة OME (توسيع وسائل الإعلام) على رأس وتحديث كل يوم.
4. الحقن المجهري من الخراجات / Sporozoites في التجويف العضوية
-
الطفيليات المجهرية في الجانب apical من الجهازية 3D(الشكل 2).
- إعداد الشعيرات الدموية الزجاجية من قطر 1 ملم باستخدام سحب micropipette.
ملاحظة: الإعدادات المستخدمة على سحب micropipette (انظر جدول المواد)هي: الحرارة = 663، سحب = 100، السرعة = 200، الوقت = 40 مللي ثانية. الإعدادات سوف تحتاج إلى تعديل وفقا لتعليمات المستخدم لجهاز معين. - قطع غيض من الشعرية مع ملقط. يقيس حجم/قطر نهاية الشعرية حوالي 9-12 ميكرومتر؛ وهذا يتيح سهولة تدفق الخراجات (حجم 4-5 ميكرومتر).
- املأ الشعيرات الدموية بتعليق الكيسة أو السبوروزويت باستخدام نصائح اللودر الصغير.
- قم بتحميل الشعرية المليئة بالكيسة على محقن مجهري.
- Microinject 100-200 تعليق نمل في كل organoid تحت المجهر المقلوب في التكبير 5X، والحفاظ على الضغط ثابت. بعد الحقن المجهري، تحديث وسائل الإعلام مع OME أو OMD كل يوم والحفاظ على لوحة في 37 درجة مئوية.
ملاحظة: نحن لا نستخدم المتلاعب الدقيقة للحقن الدقيق. ينصح باستخدام نفس الشعرية للتجربة بأكملها لضمان حقن على قدم المساواة في كل عينة.
- إعداد الشعيرات الدموية الزجاجية من قطر 1 ملم باستخدام سحب micropipette.
5. تلطيخ الفلورة المناعية من الأعضاء
- جمع الأعضاء (1-2 × 24 الآبار) مع ماصة P1000 في أنبوب 15 مل تحتوي على F12 + + ++.
- بيليه organoids في 300 × ز لمدة 2 دقيقة، وإزالة supernatant دون تعطيل بيليه، وpipet بلطف بيليه فضفاضة في حجم المتبقية.
- إضافة 5 مل من 2٪ بارافورمالدهايد في PBS. لمنع الأعضاء من التمسك الجدار لا عكس الأنبوب. السماح للأعضاء لتسوية إلى الجزء السفلي من الأنبوب وإصلاح في 4 درجة مئوية بين عشية وضحاها أو 1 ساعة في درجة حرارة الغرفة.
- إزالة المثبت وإضافة 10 مل من المخزن المؤقت نفاذيبيلية (0.2% تريتون في PBS).
- تدوير الأنبوب في درجة حرارة الغرفة لمدة 20 دقيقة (وهذا يضمن أن جميع organoids لا تزال في تعليق).
- بيليه الأعضاء في 300 × ز لمدة 2 دقيقة، ومن ثم تجاهل supernatant.
- إعادة تعليق organoids بلطف في 500 درجة مئوية من محلول حظر (انظر جدول المواد)ونقلإلى أنبوب الطرد المركزي الصغير 2 مل.
- حضانة لمدة 20 دقيقة في درجة حرارة الغرفة على شاكر. السماح للأعضاء لتسوية إلى الجزء السفلي من الأنبوب عن طريق الجاذبية. استبدل محلول الحظر بمحلول الأجسام المضادة الأساسي (انظر جدول المواد)واحتضن لمدة 1-2 ساعة في درجة حرارة الغرفة أو بين عشية وضحاها عند درجة حرارة 4 درجة مئوية.
- غسل 3X مع PBS تحتوي على 0.1٪ توين. دع الأعضاء تستقر في كل مرة وتزيل الـ supernatant.
- إضافة حل الأجسام المضادة الثانوية (انظر جدول المواد)وحضانة لمدة 2 ساعة في درجة حرارة الغرفة.
- غسل 3X مع PBS تحتوي على 0.1٪ توين. ترك 50 ميكرولتر من PBS بعد الغسيل الثالث.
- جبل على الشريحة عن طريق الأنابيب العضوية علقت في 50 درجة مئوية من PBS على الشريحة. إزالة PBS الزائدة، إضافة قطرة من عامل تصاعد (انظر جدول المواد)وإضافة غطاء على رأس. ختم الجانبين مع طلاء الأظافر والسماح لها الجافة.
6. عزل الخراجات من الأعضاء
- عزل الخراجات التي تشكلت حديثا من التجويف العضوي.
ملاحظه:يتم عزل الخراجات من الأعضاء عن طريق الفصل المناعي المغناطيسي باستخدام مجموعة عزل الكيسة (انظرجدول المواد) مع التعديلات الموضحة أدناه. ويمكن بعد ذلك تحليل الخراجات المعزولة عن طريق الفلورة المناعية والفحص المجهري الإلكتروني.- ابدأ بالأعضاء المتمايزة التي تم الاحتفاظ بها في OMD لمدة 5-7 أيام وغير مصابة ومصابة لمدة يوم واحد ومصابة لمدة 5 أيام. استخدم الأولين كعناصر تحكم سالبة.
ملاحظة: لقد وجدنا أن الأعضاء المتمايزة تنتج أكثر من الخراجات من الرئة أو توسيع الأعضاء المعوية10. - جمع الأعضاء في أنابيب الطرد المركزي 15 مل. الطرد المركزي الأعضاء لمدة 20 دقيقة في 3000 × ز و 10 درجة مئوية.
ملاحظة: هناك حاجة إلى هذه السرعة العالية للتأكد من عدم فقدان الخراجات من أي أعضاء قد تكون مكسورة. - إزالة الوسائط العضوية واستبدالها مع 5 مل من الماء.
- تعطيل الأعضاء عن طريق تكرار الأنابيب القوية مع ماصة باستور الزجاج المصقول بالنار.
- إذا كانت الكتل مرئية، نقل تعليق الجهازية إلى الخالطون المندفع الزجاج، والتجانس حتى يتم تعطيل الأعضاء بشكل جيد. لن يؤثر الخالطون المناقض على الخراجات.
- بمجرد عدم وجود كتل مرئية، أضف 5 مل من المخزن المؤقت A من مجموعة عزل الكيسة. مزيج ثم إضافة 120 درجة مئوية من الخرز المغناطيسي المغلفة مع IgM المضادة للأوكيسة.
- احتضان تعليق الخلية والخرز المغناطيسي لمدة 2 ساعة في درجة حرارة الغرفة مع خلط مستمر على منصة الروك.
- في نهاية الحضانة، ضع الأنابيب التي تحتوي على خلايا والخرز على رف فصل مغناطيسي مصمم لأنابيب 15 مل.
- تدوير الأنابيب في رف الفصل المغناطيسي يدويا لمدة 3 دقائق. الخرز سوف تلتزم الجانب من الأنبوب بجوار المغناطيس.
- بعناية، مع ماصة 10 مل، وإزالة supernatant من الخرز. إعادة تعليق الخرز في 450 درجة مئوية من المخزن المؤقت B ونقلها إلى أنبوب الطرد المركزي الصغير 1.5 مل.
ملاحظة: الحفاظ على supernatant حتى يتم تأكيد عزل الخراجات. - لجمع أي حبات المتبقية وoocysts، وغسل أنبوب 15 مل مع 450 درجة مئوية من العازلة B وإضافة هذا الغسيل إلى الخرز المغناطيسي في أنبوب microcentrifuge.
- كرر الخطوة 6.1.11 مرة أخرى. وينبغي الآن نقل جميع الخرز والخراجات التي تم التقاطها إلى أنبوب الطرد المركزي الصغير.
- ضع أنبوب الطرد المركزي الصغير على رف فصل مغناطيسي مصمم لعقد أنابيب الطرد المركزي الدقيقة.
- تدوير الأنبوب في رف الفصل المغناطيسي باليد لمدة 3 دقائق.
- قم بإزالة الـ supernatant بعناية مع ماصة في أنبوب جديد.
ملاحظة: الحفاظ على supernatant حتى يتم تأكيد عزل الخراجات. - إزالة أنبوب الطرد المركزي الصغير الذي يحتوي على الخرز المغناطيسي وoocysts من رف الفصل المغناطيسي.
- إضافة 100 درجة مئوية من 0.1 N حمض الهيدروكلوريك إلى الخرز المغناطيسي لelute oocysts قبالة الخرز. دوامة لمدة 30 s.
ملاحظة: يجب تعيين دوامة إلى أقل قليلا من السرعة القصوى. - احتضان الخرز في 0.1 N حمض الهيدروكلوريك لمدة 10 دقيقة في درجة حرارة الغرفة.
- دوامة مرة أخرى. ثم وضع الأنبوب مرة أخرى على رف الفصل المغناطيسي. انتظر الخرز للتمسك إلى جانب الأنبوب ومن ثم نقل supernatant إلى أنبوب microcentrifuge جديد.
- كرر الخطوات 6.1.17 إلى 6.1.19 والجمع بين eluate الثاني مع elution الأول.
- تحييد eluate مع 20 درجة مئوية من 1 N هيدروكسيد الصوديوم، أو آخر العازلة تحييد مثل 1 M تريس، درجة الحموضة 8.
- لحساب الخراجات، خذ 10 ميكرولتر من الإيلوات، امزجه مع 10 ميكرولتر من الأجسام المضادة الخاصة بالكيسة (انظر جدول المواد)وعد الخراجات الفلورية على مقياس الهيموكياتومتر.
ملاحظة: يمكن تخزين الخراجات المعزولة عند 4 درجات مئوية أو استخدامها على الفور للتصوير المناعي أو التصوير المجهري الإلكتروني.
- ابدأ بالأعضاء المتمايزة التي تم الاحتفاظ بها في OMD لمدة 5-7 أيام وغير مصابة ومصابة لمدة يوم واحد ومصابة لمدة 5 أيام. استخدم الأولين كعناصر تحكم سالبة.
النتائج
البروتوكولات المعروضة هنا تؤدي إلى تنقية فعالة من الخراجات وsporozoites(الشكل 1A)على استعداد للحقن الدقيق. يؤدي بروتوكول excystation إلى إطلاق sporozoites من حوالي 70-80٪ من الخراجات، وبالتالي فمن الضروري تصفية الخراجات والقذائف المتبقية من خلال مرشح 3 ميكرومتر. نتائج الترشيح في ما يقرب من 100٪ تنقية sporozoite(الشكل 1B). وعلاوة على ذلك، إضافة صبغة خضراء يساعد على ضمان حقن جميع الأعضاء ويسمح التصور من الأعضاء عن طريق الحقن لمدة 24 ساعة على الأقل بعد الحقن(الشكل 2B).
هذه البروتوكولات لإعداد oocysts وsporozoites هي واضحة وقد استخدمت لسنوات عديدة، لذلك فمن المتوقع أن oocysts المعالجة وsporozoites تنقية ستكون قابلة للحياة والمعدية. ومع ذلك، في دراساتنا، استخدمنا المسح المجهري الإلكتروني للتأكد من أن عملية excystation لم تضر sporozoites أو oocysts(الشكل 2A)10. حقن كميات متساوية من الخراجات في تجويف الجهاز يمكن تأكيدها بصريا عن طريق التصوير المجهري البسيط(الشكل 2C). وينبغي إعداد جزء من الأعضاء المصابة للتحقق من انتشار الطفيلي اتّبساه الـPCR الكمي كما وصفنا10.
التقدم من خلال دورة حياة الطفيلي يمكن تصورها عن طريق جمع الأعضاء المصابة في نقاط زمنية مختلفة بعد العدوى والتحليل عن طريق مجهر الإلكترون انتقال أو عن طريق الفلورة المناعية جنبا إلى جنب مع 4′,6-دياميدينو-2-فينيليندول ( DAPI) تلطيخ النوى الطفيلية10. على سبيل المثال، يمكن استخدام الأجسام المضادة لمضدات سطح merozoite، مثل gp40 وgp1517 لتحديد مراحل meront; نوع I meronts سيكون 8 النوى والنوع الثاني meronts، 4 النوى10. في الآونة الأخيرة، لوحة من الأجسام المضادة أحادية النسيلة محددة لتروبوزويت، merozoites، نوع الأول مقابل meronts الثاني، وmacrogamonts أصبحت متاحة18. هذه الأجسام المضادة ستكون أيضا فعالة جدا في وضع علامات على تقدم الطفيلي من خلال مراحل دورة حياته المختلفة في الأعضاء.
كما يمكن استخدام اختبارات الفلورة المناعية لاستكشاف أنواع الخلايا المصابة بواسطة Cryptosporidium. وكان هذا مهما بشكل خاص للنظر في الجهاز يات مجرى الهواء كما لا يعرف سوى القليل جدا عن cryptosporidiosis الجهاز التنفسي، والخلية المضيفة بالضبط للطفيلي لم يكن معروفا. أجرينا اختبارات الفلورة المناعية على Cryptosporidium-المصابة الأعضاء، والمشاركة في توطين CC10، علامة لخلايا النادي ووجدنا أن Cryptosporidium إصابة كل من CC10- الخلايا السلبية والإيجابية (الشكل 3). وقد أكدت هذه النتائج من قبل TEMs التي لاحظنا Cryptosporidium تصيب الخلايا السرية وغير السرية في الجهاز الجوي10.
بعد إصابة الأعضاء المتمايزة لمدة خمسة أيام، يجب أن تكون هناك أعداد كبيرة من الخراجات التي يتم إنتاجها. في أيدينا، أسفرت عدوى الأعضاء من لوحة واحدة من ستة آبار حوالي 4000 oocysts، والتي يمكن التعرف عليها بسهولة وحسابها على مقياس الهيموكيتومتر عن طريق وضع العلامات مع جسم مضاد محدد أوكيسة. ويمكن تأكيد وجود أربعة sporozoites في oocysts عن طريق تجفيف جزء من oocysts على شريحة لاصقة، وتحديد مع الميثانول والجمع بين تلطيخ DAPI مع الأجسام المضادة أوكيست محددة (الشكل 4). التحقق من إنتاج الخراجات سميكة الجدران يمكن أن يتم عن طريق تحليل TEM10.
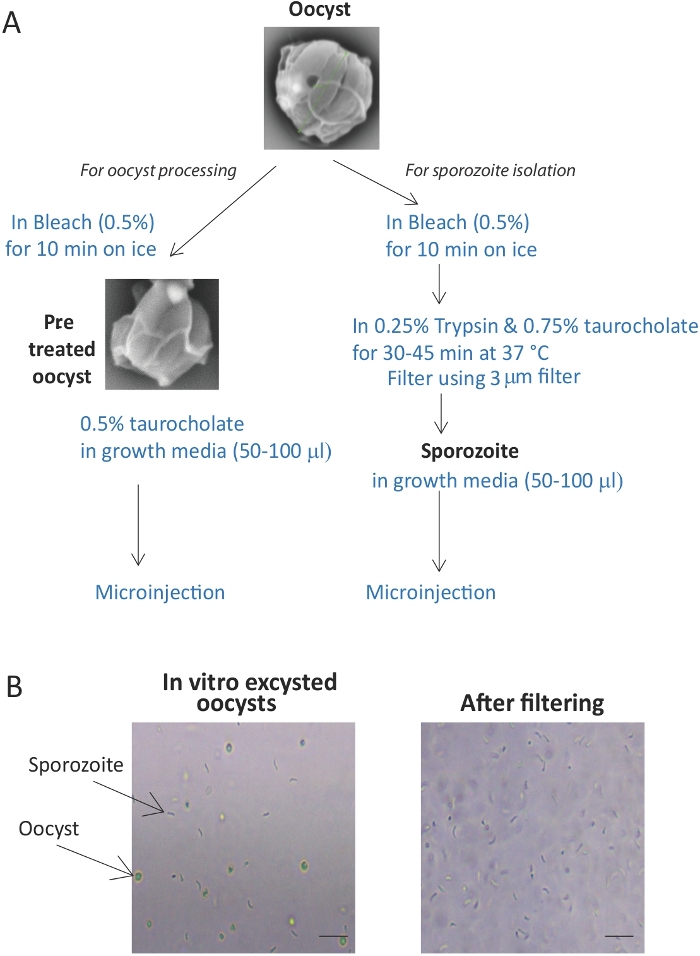
الشكل 1: إعداد وتنقية الخراجات وsporozoites Cryptosporidium. (أ)التمثيل التخطيطي للطريقة المستخدمة لإعداد الكيسة والسبوروزويت للعدوى. (ب)صورة تظهر في المختبر excystation من الخراجات. الترشيح من oocyts unexcysted وقذائف يعطي حلا نقيا من sporozoites. شريط مقياس = 10 درجة.

الشكل 2: الحقن المجهري للأوكيسات في تجويف الأعضاء. تم تعديل هذا الرقم من Heo et al.10. (أ)مسح الإلكترون المجهري (SEM) صور من الخراجات وsporozoites. (ب)صورة تظهر الأعضاء حقن أوكيسة. الصبغة الخضراء تساعد على تصور حقن كل عضوية ويستمر على الأقل 24 ح.(C)صورة من الجهازي حقن مع oocysts. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 3: صورة الفلورة المناعية من Cryptosporidium-المصابة مجرى الهواء العضوية. يتم تسمية Mucin مع الأجسام المضادة للمخاط 5 (الأحمر) في تجويف الجهاز، ووصفت خلايا النادي مع المضادة للCC10 (الأصفر)، يتم الكشف عن Cryptosporidium مع الأجسام المضادة الخاصة oocyst (الأخضر)، وملطخة نوى الخلايا مع DAPI (الأزرق). الفريق باء هو توسيع للمنطقة المشار إليها في المربع في الحلقة ألف.

الشكل 4: صورة الفلورة المناعية للأوكيسة المعزولة عن الأعضاء المعوية المتمايزة. تم تسمية جدار Oocyst مع الأجسام المضادة الخاصة بالخراجات باللون الأخضر ويتم تصور النوى الأربعة sporozoite مع DAPI (الأزرق) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
ثقافة الطفيليات Cryptosporidium في الجهازيات المعوية ومجرى الهواء يوفر نموذجا دقيقا لدراسة التفاعلات المضيفة الطفيلية10 ولكن أيضا لديها العديد من التطبيقات الأخرى. على سبيل المثال، تتطلب الطرق الحالية لاختيار ونشر طفيليات Cryptosporidium المعدلة وراثيا ً مروراً في الفئران19 الذي لا يسمح بعزل الطفيليات التي لديها تعديلات ضرورية للعدوى في الجسم الحي. الثقافة العضوية من Cryptosporidium يوفر بديلا لهذا الإجراء. ومع ذلك، لاحظنا أن sporozoites الكهربائي تكتل معا ومنع micropipette. لغرض اختيار الطفيليات المعدلة وراثيا، يمكن أن تزرع الأعضاء على transwells المغلفة الكولاجين في شكل ثنائي الأبعاد في ظل ظروف التمايز للسماح للعدوى مع sporozoites transfected وبالتالي اختيار الخراجات المعدلة وراثيا. تسمح الآبار بالوصول إلى كل من الأسطح الشاحبة والباسية وهي مستقرة لفترات طويلة من الزمن.
حاليا، ونحن ثقافة الأعضاء في شكل ثنائي الأبعاد لفحص الإنتاجية العالية من الأدوية للأعضاء المستمدة من الأنسجة السرطان (البيانات غير المنشورة). ويمكن أيضا تكييف هذه الطريقة من الثقافة العضوية لاختبار الأدوية المضادةللكريبتوسبوريديوم باستخدام لوسيفيراز المعدلة وراثيا الموسومة سلالات Cryptosporidium 19. وعلاوة على ذلك، على الرغم من أن العدوى ليست متزامنة بإحكام، فإن عدوى الأعضاء مع sporozoites توفر تزامنا كافيا لدورة الحياة التي يمكن اختبار هادتها ضد مراحل دورة حياة محددة.
ويجري الآن تطوير نظم الزراعة المشتركة العضوية مع مراعاة بعض الجوانب الأخرى للنظام المضيف مثل الكائنات المجهرية والخلايا المناعية20. وهكذا ، فإن القدرة على تشريح التفاعلات بين الطفيلي والخلايا المضيفة والخلايا المناعية والميكروبيوتا سيكون من الممكن قريبا في المختبر. التلاعب الوراثي من Cryptosporidium هو أيضا ممكن الآن19، والجمع بين سلالات مراسل الفلورسنت من Cryptosporidium والثقافة العضوية سوف توفر الأدوات لتسلسل خلية واحدة من الخلايا المصابة ، و حتى أكثر تحديدا تسلسل خلية واحدة من الخلايا المصابة بمراحل محددة من الطفيلي.
نجاح التجارب الموصوفة هنا يعتمد إلى حد كبير على صلاحية والعدوى من oocysts. يمكن أن تختلف دفعات مختلفة من الخراجات Cryptosporidium على نطاق واسع في معدلات excystation والقدرة على إصابة الخلايا المضيفة. تعتمد الغلة الكافية من السبوروزويتس على معدلات الإنزلاط الجيدة، ولا يرتبط معدل الاستئصال دائمًا بالعدوى. إذا لوحظت مستويات منخفضة من العدوى أو الاستئصال الضعيف مع دفعة معينة من الخراجات، يمكن توفير الوقت والجهد عن طريق الحصول على الكثير من الخراجات بدلاً من محاولة زيادة أعداد الكيسة، أو إطالة أوقات الحضانة.
يجب تحديث وسائل الإعلام الثقافة العضوية كل يوم بديل. من المستحسن استخدام المقاطع السابقة من الثقافات العضوية. من المهم إذابة قارورة جديدة من الأعضاء إذا بدأت الأعضاء في التمييز في الممرات اللاحقة حيث أن صحة الثقافات العضوية تحدد إلى حد كبير جدوى الطفيلي. بعد العدوى ، يجب تحديث الوسائط العضوية كل يوم لتجنب تراكم المواد السامة في وسائل الإعلام.
الثقافة العضوية من Cryptosporidium محدودة في أن الطفيلي لا يمكن نشرها إلى أجل غير مسمى ، والعدوى بيترز بعد ثلاثة ممرات على مدى 28 يوما10. الحقن المجهري من الأعضاء كافية لتجارب الماوس مثل وصفنا يمكن أن تستغرق وقتا طويلا والضرائب المادية. ومع ذلك، حتى الآن، لا توجد طريقة أخرى تمكن دورة الحياة الكاملة في نظام المختبر تمثل تماما العدوى البشرية، كما لم يتم وصف أي نظام الثقافة التي تسمح استكشاف التفاعلات المضيفة والممرض ة مهمة ل عدوى الجهاز التنفسي. الثقافة العضوية من Cryptosporidium يوفر أداة جديدة قوية تفتح سبل الاستكشاف في التفاعلات بين المضيف والطفيلي اتّبع او في السابق بالنسبة لـ Cryptosporidium.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
نحن ممتنون لديبورا أ. شايفر من كلية العلوم الطبية الحيوية الحيوانية والمقارنة، كلية الزراعة وعلوم الحياة، جامعة أريزونا، توسون، AZ، الولايات المتحدة الأمريكية لمساعدتنا في إنتاج وتحليل الخراجات. كما نشكر مركز فرانشي للتنظير المجهري والتصوير وD.L. Mullendore في جامعة ولاية واشنطن لإعداد وتصوير الخراجات العضوية المعزولة.
وقد حصل على منحة من المنظمة الهولندية للبحث العلمي (NWO-ALW, 016.Veni.171.015). وقد حصلت المنظمة الهولندية للبحوث العلمية (NWO-ALW، 863.14.002) على منحة من المعهد الهولندي للبحوث العلمية، وحظيت بدعم زمالات ماري كوري من المفوضية الأوروبية (الاقتراح 330571 FP7-PEOPLE-2012-IIF). وقد تلقى البحث الذي أدى إلى هذه النتائج تمويلاً من المجلس الأوروبي للبحوث بموجب اتفاقية المنح المتقدمة الخاصة بلجنة البحوث الدولية رقم 67013 ومن المعهد الوطني للصحة في إطار R21 AT009174 إلى RMO. هذا العمل هو جزء من معهد Oncode، الذي يمول جزئيا من قبل الجمعية الهولندية للسرطان وتم تمويله من منحة من جمعية السرطان الهولندية.
Materials
| Name | Company | Catalog Number | Comments |
| Basement membrane extract (extracellular matrix) | amsbio | 3533-010-02 | |
| Crypt-a-Glo antibody (Oocyst specific antibody) | Waterborne, Inc | A400FLR-1X | Final Concentration = Use 2-3 drops/slide |
| Crypto-Grab IgM coated Magnetic beads | Waterborne, Inc | IMS400-20 | |
| Dynamag 15 rack | Thermofisher Scientific | 12301D | |
| Dynamag 2 rack | Thermofisher Scientific | 12321D | |
| EMD Millipore Isopore Polycarbonate Membrane Filters- 3µm | EMD-Millipore | TSTP02500 | |
| Fast green dye | SIGMA | F7252-5G | |
| Femtojet 4i Microinjector | Eppendorf | 5252000013 | |
| Glass capillaries of 1 mm diameter | WPI | TW100F-4 | |
| Matrigel (extracellular matrix) | Corning | 356237 | |
| Microfuge tube 1.5 mL | Eppendorf | T9661-1000EA | |
| Micro-loader tips | Eppendorf | 612-7933 | |
| Micropipette puller P-97 | Shutter instrument | P-97 | |
| Normal donkey Serum | Bio-Rad | C06SB | |
| Penstrep | Gibco | 15140-122 | |
| Sodium hypoclorite (use 5%) | Clorox | 50371478 | |
| Super stick slides | Waterborne, Inc | S100-3 | |
| Swinnex-25 47 mm Polycarbonate filter holder | EMD-Millipore | SX0002500 | |
| Taurocholic acid sodium salt hydrate | SIGMA | T4009-5G | |
| Tween-20 | Merck | 8221840500 | |
| Vectashield mounting agent | Vector Labs | H-1000 | |
| Vortex Genie 2 | Scientific industries, Inc | SI0236 | |
| Adv+++ (DMEM+Penstrep+Glutamax+Hepes) | Final amount | ||
| DMEM | Invitrogen | 12634-010 | 500 mL |
| Penstrep | Gibco | 15140-122 | 5 mL of stock in 500 mL DMEM |
| Glutamax | Gibco | 35050038 | 5 mL of stock in 500 mL DMEM |
| Hepes | Gibco | 15630056 | 5 mL of stock in 500 mL DMEM |
| INTESTINAL ORGANOID MEDIA-OME (Expansion media) | Final concentration | ||
| A83-01 | Tocris | 2939-50mg | 0.5 µM |
| Adv+++ | make up to 100 mL | ||
| B27 | Invitrogen | 17504044 | 1x |
| EGF | Peprotech | AF-100-15 | 50 ng/mL |
| Gastrin | Tocris | 3006-1mg | 10 nM |
| NAC | Sigma | A9125-25G | 1.25 mM |
| NIC | Sigma | N0636-100G | 10 mM |
| Noggin CM | In house* | 10% | |
| P38 inhibitor (SB202190) | Sigma | S7076-25 mg | 10 µM |
| PGE2 | Tocris | 2296/10 | 10 nM |
| Primocin | InvivoGen | ant-pm-1 | 1 mL/500 mL media |
| RSpoI CM | In house* | 20% | |
| Wnt3a CM | In house* | 50% | |
| In house* - cell lines will be provided upon request | |||
| INTESTINAL ORGANOID MEDIA-OMD (Differentiation media) | To differentiate organoids, expanding small intestinal organoids were grown in a Wnt-rich medium for six to seven days after splitting, and then grown in a differentiation medium (withdrawal of Wnt, nicotinamide, SB202190, in a differentiation medium (withdrawal of Wnt, nicotinamide, SB202190, prostaglandin E2 from a Wnt-rich medium or OME) | ||
| LUNG ORGANOID MEDIA- LOM (Differentiation media) | Final concentration | ||
| Adv+++ | make up to 100 mL | ||
| ALK-I A83-01 | Tocris | 2939-50mg | 500 nM |
| B27 | Invitrogen | 17504044 | 0.0763888889 |
| FGF-10 | Peprotech | 100-26 | 100 ng/mL |
| FGF-7 | Peprotech | 100-19 | 25 ng/mL |
| N-Acetylcysteine | Sigma | A9125-25G | 1.25 mM |
| Nicotinamide | Sigma | N0636-100G | 5 mM |
| Noggin UPE | U-Protein Express | Contact company directly | 10% |
| p38 MAPK-I | Sigma | S7076-25 mg | 1 µM |
| Primocin | InvivoGen | ant-pm-1 | 1:500 |
| RhoKI Y-27632 | Abmole Bioscience | M1817_100 mg | 2.5 µm |
| Rspo UPE | U-Protein Express | Contact company directly | 10% |
| Reducing buffer (for resuspension of oocysts and sporozoites for injection) | Final concentration | ||
| L-Glutathione reduced | Sigma | G4251-10MG | 0.5 μg/μL of OME/OMD/LOM |
| Betaine | Sigma | 61962 | 0.5 μg/μL of OME/OMD/LOM |
| L-Cysteine | Sigma | 168149-2.5G | 0.5 μg/μL of OME/OMD/LOM |
| Linoleic acid | Sigma | L1376-10MG | 6.8 μg/mL of OME/OMD /LOM |
| Taurine | Sigma | T0625-10MG | 0.5 μg/μL of OME/OMD/LOM |
| Blocking buffer (for immunoflourescence staining) | Final concentration | ||
| Donkey/Goat serum | Bio-Rad | C06SB | 2% |
| PBS | Thermo-Fisher | 70011044 | Make up to 100 mL |
| Tween 20 | Merck | P1379 | 0.1% |
| List of Antibodies used | |||
| Alexa 568 goat anti-rabbit | Invitrogen | A-11011 | Dilution-1:500; RRID: AB_143157 |
| Crypt-a-Glo Comprehensive Kit- Fluorescein-labeled antibody Crypto-Glo | Waterborne, Inc | A400FLK | Dilution- 1:200 |
| Crypta-Grab IMS Beads- Magnetic beads coated in monoclonal antibody reactive | Waterborne, Inc | IMS400-20 | Dilution-1:500 |
| DAPI | Thermo Fisher Scientific | D1306 | Dilution-1:1,000; RRID : AB_2629482 |
| Phalloidin-Alexa 674 | Invitrogen | A22287 | Dilution-1:1,000; RRID: AB_2620155 |
| Rabbit anti-gp15 antibody generated by R. M. O’Connor (co-author). | Upon request | Upon request | Dilution-1:500 |
| Sporo-Glo | Waterborne, Inc | A600FLR-1X | Dilution- 1:200 |
References
- Checkley, W., et al. A review of the global burden, novel diagnostics, therapeutics, and vaccine targets for Cryptosporidium. The Lancet Infectious Diseases. 15 (1), 85-94 (2015).
- Bones, A. J., et al. Past and future trends of Cryptosporidium in vitro research. Experimental Parasitology. 196, 28-37 (2018).
- Muller, J., Hemphill, A. In vitro culture systems for the study of apicomplexan parasites in farm animals. International Journal for Parasitology. 43 (2), 115-124 (2013).
- Karanis, P., Aldeyarbi, H. M. Evolution of Cryptosporidium in vitro culture. International Journal for Parasitology. 41 (12), 1231-1242 (2011).
- Morada, M., et al. Continuous culture of Cryptosporidium parvum using hollow fiber technology. International Journal for Parasitology. 46 (1), 21-29 (2016).
- DeCicco RePass, M. A., et al. Novel Bioengineered Three-Dimensional Human Intestinal Model for Long-Term Infection of Cryptosporidium parvum. Infection and Immunity. 85 (3), (2017).
- Miller, C. N., et al. A cell culture platform for Cryptosporidium that enables long-term cultivation and new tools for the systematic investigation of its biology. International Journal for Parasitology. 48 (3-4), 197-201 (2018).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modelling. bioRxiv. , (2018).
- Dutta, D., Clevers, H. Organoid culture systems to study host-pathogen interactions. Current Opinion in Immunology. 48, 15-22 (2017).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Dutta, D., Heo, I., Clevers, H. Disease Modeling in Stem Cell-Derived 3D Organoid Systems. Trends in Molecular Medicine. 23 (5), 393-410 (2017).
- Clevers, H. Modeling Development and Disease with Organoids. Cell. 165 (7), 1586-1597 (2016).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- O'Hara, S. P., Chen, X. M. The cell biology of Cryptosporidium infection. Microbes and Infection. 13 (8-9), 721-730 (2011).
- Lendner, M., Daugschies, A. Cryptosporidium infections: molecular advances. Parasitology. 141 (11), 1511-1532 (2014).
- Feng, H., Nie, W., Sheoran, A., Zhang, Q., Tzipori, S. Bile acids enhance invasiveness of Cryptosporidium spp. into cultured cells. Infection and Immunity. 74 (6), 3342-3346 (2006).
- O'Connor, R. M., Kim, K., Khan, F., Ward, H. Expression of Cpgp40/15 in Toxoplasma gondii: a surrogate system for the study of Cryptosporidium glycoprotein antigens. Infection and Immunity. 71, 6027-6034 (2003).
- Wilke, G., et al. Monoclonal Antibodies to Intracellular Stages of Cryptosporidium parvum Define Life Cycle Progression In Vitro. mSphere. 3 (3), (2018).
- Vinayak, S., et al. Genetic modification of the diarrhoeal pathogen Cryptosporidium parvum. Nature. 523 (7561), 477-480 (2015).
- Dijkstra, K. K., et al. Generation of Tumor-Reactive T Cells by Co-culture of Peripheral Blood Lymphocytes and Tumor Organoids. Cell. 174 (6), 1586-1598 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved