Method Article
Estudio de la infección por criptosporidio en sistemas de cultivo organoides humanos derivados del tejido 3D por microinyección
En este artículo
Resumen
Describimos protocolos para preparar ovocitos y purificar esporozoitos para el estudio de la infección de organoides intestinales y de las vías respiratorias humanas por Cryptosporidium parvum. Demostramos los procedimientos para la microinyección de parásitos en el lumen organoide intestinal y la inmunomancha ción de organoides. Por último, describimos el aislamiento de los ovocitos generados de los organoides.
Resumen
Cryptosporidium parvum es una de las principales causas de la enfermedad diarreica humana. Para entender la patología del parásito y desarrollar fármacos eficientes, se necesita un sistema de cultivo in vitro que recapitula las condiciones en el huésped. Los organoides, que se asemejan mucho a los tejidos de su origen, son ideales para estudiar las interacciones huésped-parásito. Los organoides son estructuras tridimensionales (3D) derivadas del tejido que se derivan de células madre adultas y crecen en cultivo durante largos períodos de tiempo sin someterse a ninguna aberración o transformación genética. Tienen una polaridad bien definida con superficies apicales y basolaterales. Los organoides tienen varias aplicaciones en pruebas de drogas, biobanca, y modelado de enfermedades y estudios de interacción huésped-microbio. Aquí presentamos un protocolo paso a paso de cómo preparar los ovocitos y esporozoítos de Cryptosporidium para infectar los organoides intestinales y de las vías respiratorias humanas. A continuación, demostramos cómo se puede utilizar la microinyección para inyectar los microbios en el lumen organoide. Existen tres métodos principales por los que los organoides se pueden utilizar para los estudios de interacción huésped-microbio: microinyección, cizallamiento mecánico y chapado, y mediante la fabricación de monocapas. La microinyección permite el mantenimiento de la estructura 3D y permite un control preciso de los volúmenes del parásito y el contacto lateral apical directo para los microbios. Proporcionamos detalles para el crecimiento óptimo de organoides para la creación de imágenes u ovocitos. Por último, también demostramos cómo los ovocitos recién generados se pueden aislar del organoide para un mayor procesamiento y análisis aguas abajo.
Introducción
El desarrollo de fármacos o vacunas para el tratamiento y la prevención de la infección por Cryptosporidium se ha visto obstaculizado por la falta de sistemas in vitro que imitan con precisión la situación in vivo en los seres humanos1,2. Muchos de los sistemas disponibles actualmente sólo permiten la infección a corto plazo (<5 días) o no soportan el ciclo de vida completo del parásito3,4. Otros sistemas que permiten el desarrollo completo del parásito se basan en líneas celulares inmortalizadas o líneas celulares cancerosas que no recapitulan fielmente la situación fisiológica en los seres humanos5,6,7 . Los organoides o 'mini-órganos' son estructuras derivadas de tejido 3D que se cultivan en una matriz extracelular complementada con varios factores de crecimiento específicos del tejido. Los organoides se han desarrollado a partir de diversos órganos y tejidos. Son genéticamente estables y recapitulan la mayoría de las funciones de los órganos de su origen, y pueden mantenerse en cultivo durante largos períodos de tiempo. Hemos desarrollado un método para infectar los organoides intestinales y pulmonares humanos con Cryptosporidium que proporciona un modelo in vitro preciso para el estudio de las interacciones huésped-parásito relevantes para la criptosporidiosis intestinal y respiratoria8 ,9,10,11,12,13. A diferencia de otros modelos de cultivo publicados, el sistema organoide es representativo de las interacciones del parásito huésped de la vida real, permite completar el ciclo de vida para que se puedan estudiar todas las etapas del ciclo de vida del parásito y mantiene la propagación del parásito hasta 28 días10.
Cryptosporidium parvum es un parásito apicomplexiano que infecta el epitelio de las vías respiratorias e intestinales, causando una enfermedad diarreica prolongada. La etapa ambiental resistente es el ovocitos, que se encuentra en los alimentos contaminados y el agua14. Una vez ingeridos o inhalados, el ovocitos y libera cuatro esporozoitos que se unen a las células epiteliales. Los esporozoítos se deslizan sobre las células de los huésped y atraen a los receptores de células huésped, pero el parásito no invade completamente la célula, y parece inducir a la célula huésped a engullirla15. El parásito, que se internaliza dentro de un compartimento intracelular pero extractitoplasma, permanece en la superficie apical de la célula, replicando dentro de una vacuola parasitoforosa. Se somete a dos rondas de reproducción asexual, un proceso llamado merogonía. Durante la merogonía, se desarrollan merontas tipo I que contienen ocho merozoitas que se liberan para invadir nuevas células. Estos merozoítos invaden nuevas células para convertirse en merontas de tipo II que contienen cuatro merozoitas. Estos merozoítos, cuando se liberan, infectan las células y se convierten en macrogamontes y microgamontes. Los microgametos se liberan y fertilizan los macrogametos que producen cigotes que maduran en ovocitos. Los ovocitos maduros se liberan posteriormente en el lumen. Los ovocitos son de paredes delgadas que se exquistan inmediatamente para reinfectar el epitelio, o paredes gruesas que se liberan en el medio ambiente para infectar al siguiente huésped14. Todas las etapas del ciclo de vida de Cryptosporidium han sido identificadas en el sistema de cultivo organoide previamente desarrollado por nuestro grupo10.
Dado que los organoides humanos replican fielmente los tejidos humanos9,11,13, y apoyan todas las etapas replicativas de Cryptosporidium10,son el sistema de cultivo de tejido ideal para estudiar Biología criptosporidio e interacciones huésped-parásito. Aquí describimos los procedimientos para infectar organoides con ovocitos de Cryptosporidium y esporozoitos exquistes, y aislar los nuevos ovocitos producidos en este sistema de cultivo de tejidos.
Protocolo
Todo el manejo y resección de tejidos se realizó bajo protocolos aprobados por la Junta de Revisión Institucional (IRB) con el consentimiento del paciente.
1. Preparación de C. parvum Oocysts for Injection
NOTA: Los ovocitos de Cryptosporidium se compraron en una fuente comercial (ver la Tabla de Materiales). Estos ovocitos se producen en terneros y se almacenan en solución salina con fosfato tampón (PBS) con antibióticos. Se pueden almacenar durante unos 3 meses a 4 oC y nunca deben congelarse. Normalmente usamos ovocitos dentro de un mes. Los organoides pueden estar infectados con ovocitos intactos, o los esporozoitos pueden aislarse de los ovocitos exquistes y utilizarse para infectar organoides si es importante no tener oocistos de arrastre del inóculo original.
-
Preparar ovocitos de Cryptosporidium para infectar células (Figura 1A).
- Mantenga los ovocitos en el hielo durante todas las manipulaciones hasta que se añadan a los organoides.
- Calcular el número de ovocitos necesarios para una placa completa de seis pocillos de organoides (generalmente unos 5 x 105–2.5 x 105 para la placa). Cuente el número de ovocitos en un hemocitómetro para verificar la cantidad y transferirlo a un tubo centrífugo.
NOTA: Para ayudar en la visualización, los ovocitos pueden mezclarse 1:1 con un anticuerpo fluorescente específico de ovocitos (ver la Tabla de Materiales)antes de cargarlos en el hemocohmetrometro. Los ovocitos etiquetados con fluoróforo sacan ser fácilmente visualizados y enumerados usando un microscopio de fluorescencia. Sugerimos inyectar entre 100 y 1.000 ovocitos/organoides. En general, se pueden cultivar entre 1.000 y 2.000 organoides en una placa de seis pocillos. - Lleve el volumen de la suspensión de los ovocitos hasta 900 ml con PBS. Añadir 100 ml de lejía de hipoclorito sódico (p. ej., Clorox) (a 4 oC). Incubar durante 10 minutos sobre hielo.
- Centrífuga durante 3 min en una microcentrífuga a 8.000 x g a 4oC. Orientar los tubos en la centrífuga con la abertura de la tapa mirando hacia adentro. El pellet puede ser difícil de ver por lo que saber dónde los parásitos se han peletizado en el tubo es esencial.
- Retire el sobrenadante con una pipeta teniendo cuidado de evitar el pellet. Añade 1 mL del medio modificado de Dulbecco Eagle (DMEM) y vórtice para mezclar.
- Centrífuga durante 3 min en una microcentrífuga a 8.000 x g a 4oC.
- Repita los lavados con DMEM dos veces más.
- Preparar el medio de expansión (OME) o el medio organoide diferenciado (OMD) al que se ha añadido taurochola a una concentración final del 0,5% (p/v) (ver Tabla de Materiales). El taurocholato siempre debe estar preparado y añadido fresco.
NOTA: Hemos utilizado con éxito 0.5% taurocholato en nuestros ensayos de infección donde el inóculo está intacto ovocitos, y hemos visto mejores tasas de infección sin efectos nocivos en las células huésped. Sin embargo, el taurocholato puede tener efectos imprevistos en las células, y las concentraciones más bajas se han utilizado con éxito en los ensayos de infección16. - Resuspender los ovocitos en 100 ml de medio de cultivo organoide complementado con 0,5% (p/v) de taurocolato sódico. Cuente los ovocitos de nuevo como se describe en el paso 1.1.2.
- Añadir tinte verde rápido a la suspensión con el fin de visualizar la inyección.
- Llene las puntas del microcargador (ver la Tabla de Materiales)con la suspensión del ovis y utilípela para llenar los capilares tirados.
PRECAUCION: Todo el procedimiento debe realizarse en una campana de cultivo de tejidos con protocolos de seguridad de nivel 2. Se recomienda el uso de máscaras, ya que los ovocitos de Cryptosporidium también pueden ser infecciosos en el aire.
2. In Vitro Purificación de Esporozoritas de C. parvum Oocysts
-
Purificar los esporozoitos de los ovocitos de C. parvum después de blanquear y lavar la lejía como se describió anteriormente.
- Transfiera los ovocitos a un tubo de 15 ml. Resuspender los ovocitos en el medio de excestación a temperatura ambiente (0,75% p/v taurocolato sódico en DMEM) para obtener 1 x 107 ovocitos/ml. La adición de taurocholato mejora la tasa de excisestación de los ovocitos, mejorando el rendimiento de la esporozoita.
- Incubar la suspensión del ovis a 37oC durante 1–1,5 h.
- Compruebe la muestra microscópicamente para determinar la extensión de la excestación; 60–80% de excystation es razonable para una buena recuperación de los esporozoítos. Si el nivel de excestación es bajo, incubar más tiempo (otros 30 min a 1 h).
- Determinar el porcentaje de excystation en relación con el número de ovocitos iniciales. La excestación se calcula como:
% de excestación [1 – (número de ovocitos intactos/número de ovocitos al inicio)] x 100 - Lave las células para eliminar los reactivos de excisestación añadiendo 14 ml de PBS o medio, mezclando y recuperando células (ovocitos intactos, cáscaras de ovocitos y esporozoitos) por centrifugación a 3.400 x g durante 20 minutos para recuperar esporozoitos. Aspirar cuidadosamente para evitar la pérdida de células.
- Resuspenda el pellet de esporozoita en 1–2 ml de DMEM para obtener 3 x 107 ovocitos/ml (basado en el número de ovocitos iniciales).
- Para eliminar los ovocitos y conchas restantes, filtre la suspensión a través de un filtro de 3 m(Figura 1B). Utilice un aparato de soporte de filtro de 47 mm equipado con filtro de policarbonato (tamaño de poro de 3 m) unido a un barril de jeringa de 10 ml. Coloque el aparato del portafiltros encima de un tubo de 15 ml. Coloque el conjunto en una cubeta de hielo o en una cámara fría.
- Añadir 7,5 ml de la suspensión de esporozoita al conjunto del filtro y permitir filtrar por gravedad. Lavar con otro 7,5 ml de DMEM.
NOTA: Para asegurar el éxito en el aislamiento esporozoita, los nuevos ovocitos y una buena excestación son fundamentales. Si hay demasiados ovocitos sin excistos, la suspensión no fluirá por gravedad. La aplicación de presión sobre la jeringa puede forzar el paso de los ovocitos no exquistes. La microinyección de esporozoítos es más difícil que la de los ovocitos porque los esporozoitos pueden agruparse y bloquear el capilar. Para evitar esto, recomendamos hacer una punta capilar más ancha al inyectar organoides con esporozoitos. Para lograr niveles suficientes de infección, es necesario inyectar de 2 a 4 veces el número de esporozoítos en cada organoide en comparación con los organoides infectados con ovocitos. - Centrifugar la suspensión de esporozoita filtrada a 3.400 x g utilizando un rotor de cucharón oscilante durante 20 minutos a esporozoítos de pellet.
- Resuspender en 50–100 l de medio de cultivo organoide OME o OMD (ver la Tabla de Materiales)complementado con 0.05% (p/v) Tinte verde rápido y L-glutatión, betaína, L-cisteína, ácido linoleico y tampón reductor que contiene taurina5 (ver el Tabla de Materiales).
NOTA: La incubación de ovocitos durante demasiado tiempo puede dar lugar a la lisis de los esporozoitos y a una recuperación deficiente y, por lo tanto, debe evitarse.
3. In Vitro Culture of Human Intestinal and Lung Organoids for Microinjection
- Cultivo de organoides intestinales bajo condiciones de expansión y diferenciación de medios.
Nota:Los detalles de la propagación organoide intestinal y pulmonar se han descrito previamente en otros artículos8,13(verTabla de materialespara recetas de medios). Aquí, describimos brevemente el método de cultivo organoide con referencia específica a la optimización paraCryptosporidiuminyección y crecimiento. Hemos encontrado que para la toma de imágenes de parásitos en organoides, los organoides cultivados en medio de expansión son preferibles a los de los medios de diferenciación cultivados, ya que hay menos acumulación de escombros que la que se ve en los organoides cultivados en medio de diferenciación. Sin embargo, si el objetivo es aislar los ovocitos, los organoides cultivados en medios de diferenciación producen un número mucho mayor de ovocitos.- Mantener los organoides en cultivos 3D en matriz extracelular (ver la Tabla de Materiales)a 37oC. Agregue OME (medios de expansión) en la parte superior y actualice todos los días.
NOTA: En el lugar de los organoides pulmonares, no disponemos de medios separados de expansión y diferenciación. - Para dividir y placar organoides para microinyección, retire los medios de la placa de 6 pocillos que contiene organoides humanos y agregue F12++ ++ (Ver la Tabla de Materiales)al pozo y rompa la matriz pipeteando con una punta de pipeta de 1 ml varias veces. Recoger las células en un tubo de 15 ml (2 ml de F12+++ por tubo es suficiente para procedimientos adicionales).
- Añadir 10–12 ml de F12+++ en otro tubo de 15 ml y colocar un pipeta de vidrio pulido al fuego en el medio, pipeta arriba y abajo 3 veces para romper los organoides intestinales y pulmonares humanos.
NOTA: Utilice un pipeta de vidrio largo (20-30 cm) y pulirlo brevemente. No haga que la abertura (1 mm de diámetro) sea muy pequeña porque los organoides pueden dañarse. Haga que la punta del pipeta sea suave puliéndolo brevemente. Los organoides de rotura en trozos más pequeños de 50 m. Los organoides pulmonares tienen una membrana externa más gruesa y, por lo tanto, requieren un cizallamiento más fuerte con la pipeta de vidrio en comparación con los organoides intestinales. Además, tienen una tasa de crecimiento más lenta que los organoides intestinales (hasta 14 días entre cada paso). - Añadir F12+++ hasta 5-7 mL y centrifugar a 350 x g durante 5 min.
NOTA: La velocidad de centrifugación en este paso es más alta de lo normal con el fin de hacer un buen pellet celular que está bien separado de la matriz extracelular (ver la Tabla de Materiales). Hemos observado que en comparación con los organoides del intestino delgado del ratón, los organoides del intestino delgado humano son más difíciles de interrumpir. - Retirar tanto medio como sea posible sin perturbar las células, luego resuspender el pellet con la matriz mantenida a 4 oC; Se requieren 200–300 l de matriz por pozo de una placa de seis pocillos. Los organoides deben dividirse uno de cada tres para mantener una densidad celular bastante alta.
- Placar los organoides en gotas de matriz de aproximadamente 5-10 l cada una en el pozo de una placa de seis pocillos. Incubar durante 20-30 min a 37 oC y luego añadir el medio de expansión (OME) en la parte superior.
- Cambie el medio cada 2-3 días.
NOTA: En aproximadamente 5-7 días, los organoides que crecen en EM alcanzan un tamaño de 100-200 m y están listos para la inyección. - Para diferenciar los organoides, después de 5-6 días en EM, cambie los medios a condiciones de medios de diferenciación (DM) y guárdelos durante 5-6 días adicionales antes de inyectar los parásitos.
NOTA: Para la expansión de los organoides, se recomienda placar los organoides densamente. Para la microinyección, se recomienda el uso de una placa de seis pocillos con organoides chapados a una densidad menor. Por ejemplo, los organoides de placa de tres pocillos de una placa de seis pocillos en una placa completa de seis pocillos para microinyecciones. La matriz debe mantenerse a -20 oC para su almacenamiento a largo plazo y descongelarse a 4 oC o sobre hielo antes de su uso. La expansión de los organoides pulmonares se realiza de manera similar, pero utilizando componentes de medios específicos organoides pulmonares (Tabla 1)8 .
- Mantener los organoides en cultivos 3D en matriz extracelular (ver la Tabla de Materiales)a 37oC. Agregue OME (medios de expansión) en la parte superior y actualice todos los días.
4. Microinyección de oquistes/esporozoitos en el Lumen Organoide
-
Microinyectar parásitos en el lado apical del organoide 3D(Figura 2).
- Prepare capilares de vidrio de 1 mm de diámetro utilizando un tirador de micropipeta.
NOTA: Los ajustes que se utilizan en el tirador de micropipetas (Ver Tabla de Materiales) son: Calor 663, Tirar a 100, Velocidad 200, Tiempo a 40 ms. Los ajustes tendrán que ajustarse de acuerdo con las instrucciones del usuario para una máquina en particular. - Corta la punta del capilar con fórceps. El tamaño/diámetro del extremo capilar mide alrededor de 9-12 m; esto permite un flujo fácil de ovocitos (4-5 m de tamaño).
- Llene los capilares con suspensión ovocitos o esporozoitos utilizando puntas de microcargador.
- Cargue el capilar lleno de ovis en un microinyector.
- Microinyección de 100–200 nL de suspensión en cada organoide bajo un microscopio invertido con un aumento de 5x, manteniendo la presión constante. Después de la microinyección, refresque los medios con OME u OMD todos los días y mantenga la placa a 37 oC.
NOTA: No utilizamos un micromanipulador para microinyección. Se recomienda el uso del mismo capilar para todo el experimento para garantizar la misma inyección en cada muestra.
- Prepare capilares de vidrio de 1 mm de diámetro utilizando un tirador de micropipeta.
5. Mancha de inmunofluorescencia de los organoides
- Recoger organoides (1–2 x 24 pozos) con una pipeta P1000 en un tubo de 15 ml que contenga F12++++ frío.
- Organoides de pellet a 300 x g durante 2 min, retire el sobrenadante sin interrumpir el pellet, y pipetee suavemente el pellet suelto en el volumen restante.
- Añadir 5 mL de 2% de paraformaldehyde en PBS. Para evitar que los organoides se peguen a la pared, no invierta el tubo. Deje que los organoides se asienten en la parte inferior del tubo y se fijen a 4 oC durante la noche o 1 h a temperatura ambiente.
- Quite el fijador y agregue 10 mL de búfer de permeabilización (0,2% Titón en PBS).
- Gire el tubo a temperatura ambiente durante 20 minutos (esto asegura que todos los organoides permanezcan en suspensión).
- Peletizar los organoides a 300 x g durante 2 min, y luego desechar el sobrenadante.
- Resuspender los organoides suavemente en 500 ml de solución de bloqueo (Ver la Tabla de Materiales)y transferirlos a un tubo de microcentrífuga de 2 ml.
- Incubar durante 20 minutos a temperatura ambiente en una coctelera. Permita que los organoides se asienten en la parte inferior del tubo por gravedad. Sustituya la solución de bloqueo por una solución primaria de anticuerpos (ver Tabla de materiales)e incubar durante 1–2 h a temperatura ambiente o durante la noche a 4oC.
- Lavar 3x con PBS que contiene 0.1% Tween. Deja que los organoides se asienten cada vez y retire el sobrenadante.
- Añadir solución de anticuerpos secundarios (Ver la Tabla de Materiales)e incubar durante 2 h a temperatura ambiente.
- Lavar 3x con PBS que contiene 0.1% Tween. Dejar 50 oL de PBS después del tercer lavado.
- Montar en el portaobjetos pipeteando los organoides suspendidos en 50 l de PBS en la diapositiva. Retire el exceso de PBS, agregue una gota de agente de montaje (Consulte la Tabla de materiales)y agregue el cubreobjetos en la parte superior. Selle los lados con esmalte de uñas y déjelo secar.
6. Aislamiento de los ovocitos de los organoides
- Aísle los ovocitos recién formados del lumen organoide.
Nota:Los ovocitos se aíslan de los organoides por separación inmunomagnética utilizando un kit de aislamiento de ovocitos (verTabla de materiales) con las modificaciones descritas a continuación. Los ovocitos aislados pueden ser analizados por inmunofluorescencia y microscopía electrónica.- Comience con organoides diferenciados que se han mantenido en OMD durante 5-7 días y que no están infectados, infectados durante 1 día e infectados durante 5 días. Utilice los dos primeros como controles negativos.
NOTA: Hemos encontrado que los organoides diferenciados producen más ovocitos que los organoides intestinales pulmonares o en expansión10. - Recoger organoides en tubos centrífugos de 15 ml. Centrifugar los organoides durante 20 min a 3.000 x g y 10oC.
NOTA: Esta alta velocidad es necesaria para asegurarse de que no se pierdan ovocitos de los organoides que puedan romperse. - Retire el medio organoide y reemplácelo por 5 ml de agua.
- Interrumpa los organoides repitiendo un pipeteo vigoroso con una pipeta Pasteur de vidrio pulido al fuego.
- Si los grumos son visibles, transfiera la suspensión organoide a un homogeneizador de dounce de vidrio y homogeneice hasta que los organoides estén bien interrumpidos. El homogeneizador de ondounce no afectará a los ovocitos.
- Una vez que no haya grumos visibles, agregue 5 ml de tampón A del kit de aislamiento de ovocitos. Mezclar y luego añadir 120 l de las cuentas magnéticas recubiertas con IgM anti-oobisto.
- Incubar la suspensión celular y las perlas magnéticas durante 2 h a temperatura ambiente con mezcla continua en una plataforma balancín.
- Al final de la incubación, coloque los tubos que contienen células y perlas en un estante de separación magnética diseñado para tubos de 15 ml.
- Gire los tubos en el bastidor de separación magnética manualmente durante 3 minutos. Las perlas se adhieren al lado del tubo junto al imán.
- Con cuidado, con una pipeta de 10 ml, retire el sobrenadante de las perlas. Resuspenda las perlas en 450 ml de Tampón B y transfiera a un tubo de microcentrífuga de 1,5 ml.
NOTA: Mantenga el sobrenadante hasta que se confirme el aislamiento de los ovocitos. - Para recoger las perlas y ovocitos restantes, lave el tubo de 15 ml con 450 ml de tampón B y añada este lavado a las perlas magnéticas del tubo de microcentrífuga.
- Repita el paso 6.1.11 una vez más. Ahora todas las cuentas y los ovocitos capturados deben transferirse al tubo de microcentrífuga.
- Coloque el tubo de microcentrífuga en un estante de separación magnética diseñado para sujetar tubos de microcentrífuga.
- Gire el tubo en el bastidor de separación magnética a mano durante 3 minutos.
- Retire cuidadosamente el sobrenadante con una pipeta en un tubo nuevo.
NOTA: Mantenga el sobrenadante hasta que se confirme el aislamiento de los ovocitos. - Retire el tubo de microcentrífuga que contiene perlas magnéticas y ovocitos del estante de separación magnética.
- Añadir 100 l de 0,1 N HCl a las cuentas magnéticas para eluir los ovocitos de las cuentas. Vórtice para 30 s.
NOTA: Vortexer debe ajustarse a un poco menos de la velocidad máxima. - Incubar las perlas en 0,1 N HCl durante 10 min a temperatura ambiente.
- Vórtice otra vez. A continuación, vuelva a colocar el tubo en un bastidor de separación magnética. Espere a que las perlas se adhieran al lado del tubo y luego transfiera el sobrenadante a un nuevo tubo de microcentrífuga.
- Repita los pasos 6.1.17 a 6.1.19 y combine el segundo eluido con la primera elución.
- Neutralice el eluido con 20 s de 1 NAOH u otro tampón neutralizador como 1 M Tris, pH 8.
- Para contar los ovocitos, tome 10 ml del eluido, combínelo con 10 éL de anticuerpo específico para ovocitos (Ver Tabla de Materiales)y cuente los ovocitos fluorescentes en un hemocitómetro.
NOTA: Los ovocitos aislados pueden almacenarse a 4 oC o utilizarse inmediatamente para la inmunofluorescencia o la microscopía electrónica.
- Comience con organoides diferenciados que se han mantenido en OMD durante 5-7 días y que no están infectados, infectados durante 1 día e infectados durante 5 días. Utilice los dos primeros como controles negativos.
Resultados
Los protocolos presentados aquí dan como resultado la purificación eficiente de ovocitos y esporozoitos(Figura 1A)listos para la microinyección. El protocolo de excystation da como resultado la liberación de esporozoitos de aproximadamente el 70-80% de los ovocitos, por lo tanto, es esencial filtrar los ovocitos y conchas restantes a través de un filtro de 3 m. La filtración da como resultado una purificación de casi 100% esporozoita(Figura 1B). Además, la adición de un tinte verde ayuda a asegurar la inyección de todos los organoides y permite la visualización de organoides inyectados durante al menos 24 h después de la inyección(Figura 2B).
Estos protocolos para la preparación de ovocitos y esporozoítos son sencillos y se han utilizado durante muchos años, por lo que se espera que los ovocitos tratados y los esporozoitos purificados sean viables e infecciosos. Sin embargo, en nuestros estudios, utilizamos microscopía electrónica de barrido para asegurar que el proceso de excestación no dañó los esporozoitos u ovocitos(Figura 2A)10. La inyección de cantidades iguales de ovocitos en el lumen organoide puede confirmarse visualmente mediante imágenes microscópicas simples(Figura 2C). Una porción de organoides infectados debe configurarse para verificar la propagación de parásitos por PCR cuantitativo como hemos descrito10.
El progreso a través del ciclo de vida del parásito se puede visualizar mediante la recopilación de organoides infectados en diferentes puntos de tiempo después de la infección y el análisis por microscopía electrónica de transmisión o por inmunofluorescencia combinada con 4o,6-diamidino-2-fenilindolo ( DAPI) tinción de núcleos parásitos10. Por ejemplo, se pueden utilizar anticuerpos contra antígenos superficiales de merozoita, como gp40 y gp1517 para identificar etapas merontas; los meronts de tipo I tendrán 8 núcleos y merontas de tipo II, 4 núcleos10. Recientemente, un panel de anticuerpos monoclonales específicos de trophozoites, merozoites, tipo I frente a ii meronts, y macrogamonts ha estado disponible18. Estos anticuerpos también serían muy eficaces para marcar el progreso del parásito a través de sus diversas etapas del ciclo de vida en los organoides.
Los ensayos de inmunofluorescencia también se pueden utilizar para explorar qué tipos de células están infectadas por Cryptosporidium. Esto era especialmente importante para mirar en los organoides de las vías respiratorias como muy poco se sabe acerca de la criptosporidiosis respiratoria, y la célula huésped exacta para el parásito no se conocía. Realizamos ensayos de inmunofluorescencia en organoides infectados por Cryptosporidium,colocalizando CC10, un marcador para las células del club y encontramos que Cryptosporidium infectó células CC10- negativas y positivas(Figura 3). Estos resultados fueron corroborados por TEM en los que observamos Cryptosporidium infectando células secretoras y no secretoras en los organoides de las vías respiratorias10.
Después de que los organoides diferenciados se han infectado durante cinco días, debe haber un número significativo de ovocitos que se producen. En nuestras manos, la infección de organoides de una placa de seis pocillos produjo alrededor de 4000 ovocitos, que podrían ser fácilmente identificados y contados en un hemocitómetro mediante el etiquetado con un anticuerpo específico de ovis. La presencia de cuatro esporozoitos en los ovocitos podría confirmarse secando una porción de los ovocitos en una corredera adhesiva, fijando con metanol y combinando la tinción DAPI con un anticuerpo específico de ovocitos(Figura 4). La verificación de la producción de ovocitos de paredes gruesas podría realizarse mediante el análisis TEM10.
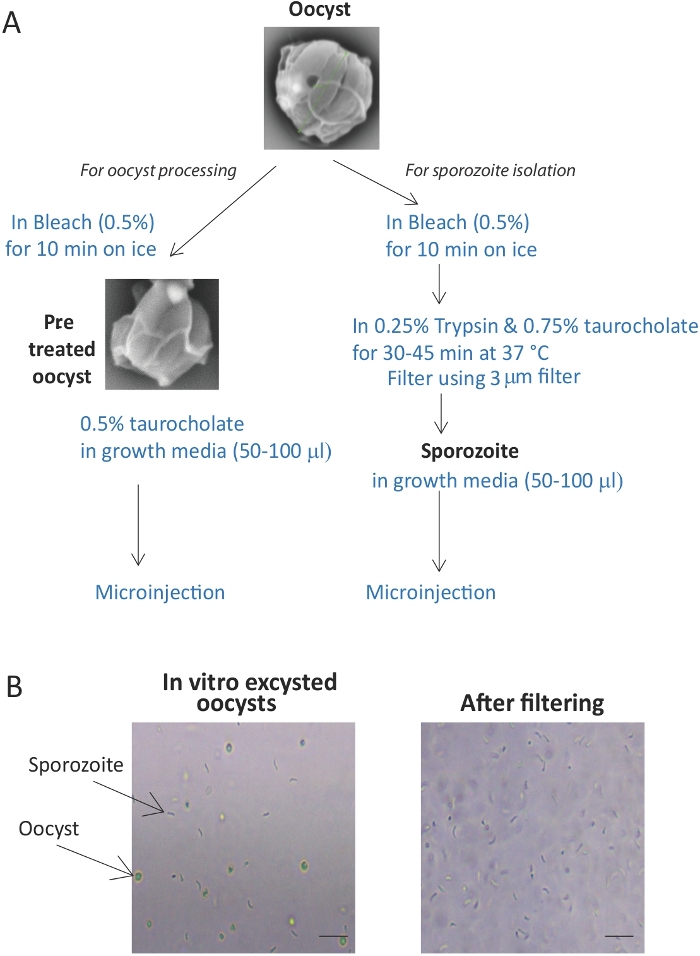
Figura 1: Preparación y purificación de ovocitos y esporozoítos de Cryptosporidium. (A) Representación esquemática del método utilizado para la preparación de ovocitos y esporozooítos para la infección. (B) Imagen que muestra la excestación in vitro de ovocitos. La filtración de ococitos y conchas no exquistadas proporciona una solución purificada de esporozoítos. Barra de escala a 10 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Microinyección de ovocitos en el lumen organoide. Esta cifra ha sido modificada de Heo et al.10. (A) escanear imágenes de microscopía electrónica (SEM) de ovocitos y esporozoitos. (B) Imagen que muestra organoides inyectados con ovis. El tinte verde ayuda a visualizar la inyección de cada organoide y persiste durante al menos 24 h. (C) Imagen de un organoide inyectado con ovocitos. Haga clic aquí para ver una versión más grande de esta figura.
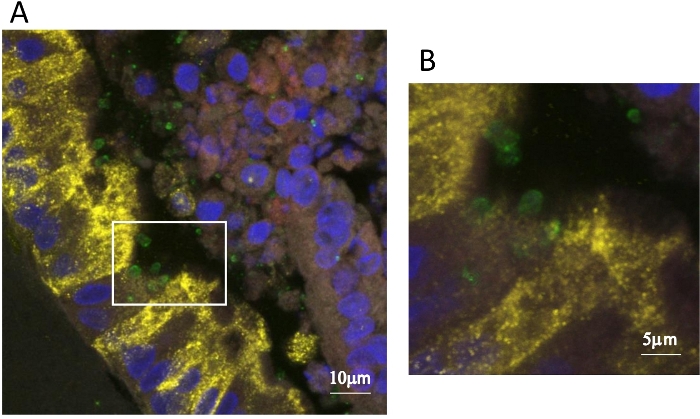
Figura 3: Imagen de inmunofluorescencia del organoide infectado por Cryptosporidium. Mucina está etiquetada con anticuerpo anti-mucina 5 (rojo) en el lumen del organoide, las células del club están etiquetadas con anti-CC10 (amarillo), Cryptosporidium se detecta con anticuerpo específico de oocisto (verde), y los núcleos celulares se tiñen con DAPI (azul). El panel B es una ampliación del área indicada en el cuadrado en el panel A. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imagen de inmunofluorescencia del ovis aislado de organoides intestinales diferenciados. La pared de Ooccyst está etiquetada con anticuerpoespecífico sorquista en verde y los cuatro núcleos de esporozoita se visualizan con DAPI (azul) Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Cultivo de parásitos Cryptosporidium en organoides intestinales y de las vías respiratorias proporciona un modelo preciso para estudiar las interacciones huésped-parásito10, pero también tiene muchas otras aplicaciones. Por ejemplo, los métodos actuales de selección y propagación de parásitos Cryptosporidium modificados genéticamente requieren el paso en ratones19 que no permite el aislamiento de parásitos que tienen modificaciones esenciales para la infección in vivo. El cultivo organoide de Cryptosporidium proporciona una alternativa a este procedimiento. Sin embargo, hemos observado que los esporozoitas electroporados se agrupan y bloquean la micropipeta. Con el fin de seleccionar parásitos modificados genéticamente, los organoides pueden cultivarse en transtoques recubiertos de colágeno en un formato bidimensional en condiciones de diferenciación para permitir la infección con esporozoitos transinfectados y, en consecuencia, la selección de los ovocitos modificados genéticamente. Los transwells permiten el acceso a las superficies apical y basolateral y son estables durante largos períodos de tiempo.
Actualmente, cultivamos organoides en un formato bidimensional para la detección de alto rendimiento de fármacos para organoides derivados del tejido canceroso (datos no publicados). Este método de cultivo organoide también se puede adaptar para las pruebas defármacos anti-Cryptosporidium utilizando la luciferasa modificada genéticamente etiquetada Cryptosporidium cepas19. Por otra parte, a pesar de que la infección no está estrechamente sincronizada, infección de organoides con esporozoítos proporciona suficiente sincronización del ciclo de vida que los fármacos pueden ser probados para su eficacia contra etapas específicas del ciclo de vida.
Los sistemas de cocultivo organoides se están desarrollando teniendo en cuenta algunos otros aspectos del sistema huésped, como la microbiota y las células inmunitarias20. Por lo tanto, la capacidad de diseccionar interacciones entre el parásito y las células huésped, las células inmunitarias y la microbiota pronto será posible in vitro. La manipulación genética de Cryptosporidium también es ahora posible19,y la combinación de cepas de reportero fluorescente de Cryptosporidium y el cultivo organoide proporcionará las herramientas para la secuenciación de una sola célula de las células infectadas, y más específicamente la secuenciación de células únicas de las células infectadas con etapas específicas del parásito.
El éxito de los experimentos descritos aquí depende en gran medida de la viabilidad e infectividad de los ovocitos. Diferentes lotes de ovocitos de Cryptosporidium pueden variar ampliamente en las tasas de excisestación y la capacidad de infectar las células huésped. Los rendimientos suficientes de los esporozoítos dependen de las buenas tasas de excisestación y la tasa de excystation no siempre está correlacionada con la infectividad. Si se observan niveles bajos de infección o excestación deficiente con un lote particular de ovocitos, el tiempo y el esfuerzo pueden ahorrarse obteniendo un nuevo lote de ovocitos en lugar de intentar aumentar el número de ovocitos, o alargando los tiempos de incubación.
Los medios de cultivo organoides deben refrescarse cada día alterno. Se recomienda el uso de pasajes anteriores de cultivos organoides. Es importante descongelar un nuevo vial de organoides si los organoides comienzan a diferenciarse en pasajes posteriores ya que la salud de los cultivos organoides determina enormemente la viabilidad del parásito. Después de la infección, los medios organoides deben refrescarse todos los días para evitar la acumulación de sustancias tóxicas en los medios.
El cultivo organoide de Cryptosporidium es limitado en que el parásito no puede propagarse indefinidamente, y la infección se desvanece después de tres pasajes durante 28 días10. La microinyección de suficientes organoides para experimentos con ratones como hemos descrito puede ser lenta y físicamente gravosa. Sin embargo, hasta la fecha, ningún otro método permite el ciclo de vida completo en un sistema in vitro completamente representativo de la infección humana, ni se ha descrito ningún sistema de cultivo que permita la exploración de las interacciones huésped-patógeno importantes para infección respiratoria. El cultivo organoide de Cryptosporidium proporciona una nueva herramienta poderosa que abre vías de exploración en interacciones huésped-parásito que antes no eran posibles para Cryptosporidium.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Estamos agradecidos a Deborah A. Schaefer de la Escuela de Ciencias Biomédicas Animales y Comparadas, Facultad de Agricultura y Ciencias de la Vida, Universidad de Arizona, Tucson, AZ, EE. UU. por ayudarnos con la producción y análisis de ovocitos. También agradecemos a Franceschi Microscopy and Imaging Center y a D.L. Mullendore de la Universidad Estatal de Washington por la preparación de TEM y la toma de imágenes de ovocitos organoides aislados.
D.D. es beneficiario de una subvención VENI de la Organización Neerlandesa de Investigación Científica (NWO-ALW, 016.Veni.171.015). I.H. es galardonado con una beca VENI de la Organización Neerlandesa de Investigación Científica (NWO-ALW, 863.14.002) y recibió el apoyo de becas Marie Curie de la Comisión Europea (Propuesta 330571 FP7-PEOPLE-2012-IIF). La investigación que ha llevado a estos resultados ha recibido financiación del Consejo Europeo de Investigación en virtud del Acuerdo Avanzado de Subvenciones DEL ERC no 67013 y del NIH NIAIH en virtud de R21 AT009174 a RMO. Este trabajo es parte del Instituto Oncode, que es financiado en parte por la Sociedad Holandesa contra el Cáncer y fue financiado por una subvención de la Sociedad Holandesa contra el Cáncer.
Materiales
| Name | Company | Catalog Number | Comments |
| Basement membrane extract (extracellular matrix) | amsbio | 3533-010-02 | |
| Crypt-a-Glo antibody (Oocyst specific antibody) | Waterborne, Inc | A400FLR-1X | Final Concentration = Use 2-3 drops/slide |
| Crypto-Grab IgM coated Magnetic beads | Waterborne, Inc | IMS400-20 | |
| Dynamag 15 rack | Thermofisher Scientific | 12301D | |
| Dynamag 2 rack | Thermofisher Scientific | 12321D | |
| EMD Millipore Isopore Polycarbonate Membrane Filters- 3µm | EMD-Millipore | TSTP02500 | |
| Fast green dye | SIGMA | F7252-5G | |
| Femtojet 4i Microinjector | Eppendorf | 5252000013 | |
| Glass capillaries of 1 mm diameter | WPI | TW100F-4 | |
| Matrigel (extracellular matrix) | Corning | 356237 | |
| Microfuge tube 1.5 mL | Eppendorf | T9661-1000EA | |
| Micro-loader tips | Eppendorf | 612-7933 | |
| Micropipette puller P-97 | Shutter instrument | P-97 | |
| Normal donkey Serum | Bio-Rad | C06SB | |
| Penstrep | Gibco | 15140-122 | |
| Sodium hypoclorite (use 5%) | Clorox | 50371478 | |
| Super stick slides | Waterborne, Inc | S100-3 | |
| Swinnex-25 47 mm Polycarbonate filter holder | EMD-Millipore | SX0002500 | |
| Taurocholic acid sodium salt hydrate | SIGMA | T4009-5G | |
| Tween-20 | Merck | 8221840500 | |
| Vectashield mounting agent | Vector Labs | H-1000 | |
| Vortex Genie 2 | Scientific industries, Inc | SI0236 | |
| Adv+++ (DMEM+Penstrep+Glutamax+Hepes) | Final amount | ||
| DMEM | Invitrogen | 12634-010 | 500 mL |
| Penstrep | Gibco | 15140-122 | 5 mL of stock in 500 mL DMEM |
| Glutamax | Gibco | 35050038 | 5 mL of stock in 500 mL DMEM |
| Hepes | Gibco | 15630056 | 5 mL of stock in 500 mL DMEM |
| INTESTINAL ORGANOID MEDIA-OME (Expansion media) | Final concentration | ||
| A83-01 | Tocris | 2939-50mg | 0.5 µM |
| Adv+++ | make up to 100 mL | ||
| B27 | Invitrogen | 17504044 | 1x |
| EGF | Peprotech | AF-100-15 | 50 ng/mL |
| Gastrin | Tocris | 3006-1mg | 10 nM |
| NAC | Sigma | A9125-25G | 1.25 mM |
| NIC | Sigma | N0636-100G | 10 mM |
| Noggin CM | In house* | 10% | |
| P38 inhibitor (SB202190) | Sigma | S7076-25 mg | 10 µM |
| PGE2 | Tocris | 2296/10 | 10 nM |
| Primocin | InvivoGen | ant-pm-1 | 1 mL/500 mL media |
| RSpoI CM | In house* | 20% | |
| Wnt3a CM | In house* | 50% | |
| In house* - cell lines will be provided upon request | |||
| INTESTINAL ORGANOID MEDIA-OMD (Differentiation media) | To differentiate organoids, expanding small intestinal organoids were grown in a Wnt-rich medium for six to seven days after splitting, and then grown in a differentiation medium (withdrawal of Wnt, nicotinamide, SB202190, in a differentiation medium (withdrawal of Wnt, nicotinamide, SB202190, prostaglandin E2 from a Wnt-rich medium or OME) | ||
| LUNG ORGANOID MEDIA- LOM (Differentiation media) | Final concentration | ||
| Adv+++ | make up to 100 mL | ||
| ALK-I A83-01 | Tocris | 2939-50mg | 500 nM |
| B27 | Invitrogen | 17504044 | 0.0763888889 |
| FGF-10 | Peprotech | 100-26 | 100 ng/mL |
| FGF-7 | Peprotech | 100-19 | 25 ng/mL |
| N-Acetylcysteine | Sigma | A9125-25G | 1.25 mM |
| Nicotinamide | Sigma | N0636-100G | 5 mM |
| Noggin UPE | U-Protein Express | Contact company directly | 10% |
| p38 MAPK-I | Sigma | S7076-25 mg | 1 µM |
| Primocin | InvivoGen | ant-pm-1 | 1:500 |
| RhoKI Y-27632 | Abmole Bioscience | M1817_100 mg | 2.5 µm |
| Rspo UPE | U-Protein Express | Contact company directly | 10% |
| Reducing buffer (for resuspension of oocysts and sporozoites for injection) | Final concentration | ||
| L-Glutathione reduced | Sigma | G4251-10MG | 0.5 μg/μL of OME/OMD/LOM |
| Betaine | Sigma | 61962 | 0.5 μg/μL of OME/OMD/LOM |
| L-Cysteine | Sigma | 168149-2.5G | 0.5 μg/μL of OME/OMD/LOM |
| Linoleic acid | Sigma | L1376-10MG | 6.8 μg/mL of OME/OMD /LOM |
| Taurine | Sigma | T0625-10MG | 0.5 μg/μL of OME/OMD/LOM |
| Blocking buffer (for immunoflourescence staining) | Final concentration | ||
| Donkey/Goat serum | Bio-Rad | C06SB | 2% |
| PBS | Thermo-Fisher | 70011044 | Make up to 100 mL |
| Tween 20 | Merck | P1379 | 0.1% |
| List of Antibodies used | |||
| Alexa 568 goat anti-rabbit | Invitrogen | A-11011 | Dilution-1:500; RRID: AB_143157 |
| Crypt-a-Glo Comprehensive Kit- Fluorescein-labeled antibody Crypto-Glo | Waterborne, Inc | A400FLK | Dilution- 1:200 |
| Crypta-Grab IMS Beads- Magnetic beads coated in monoclonal antibody reactive | Waterborne, Inc | IMS400-20 | Dilution-1:500 |
| DAPI | Thermo Fisher Scientific | D1306 | Dilution-1:1,000; RRID : AB_2629482 |
| Phalloidin-Alexa 674 | Invitrogen | A22287 | Dilution-1:1,000; RRID: AB_2620155 |
| Rabbit anti-gp15 antibody generated by R. M. O’Connor (co-author). | Upon request | Upon request | Dilution-1:500 |
| Sporo-Glo | Waterborne, Inc | A600FLR-1X | Dilution- 1:200 |
Referencias
- Checkley, W., et al. A review of the global burden, novel diagnostics, therapeutics, and vaccine targets for Cryptosporidium. The Lancet Infectious Diseases. 15 (1), 85-94 (2015).
- Bones, A. J., et al. Past and future trends of Cryptosporidium in vitro research. Experimental Parasitology. 196, 28-37 (2018).
- Muller, J., Hemphill, A. In vitro culture systems for the study of apicomplexan parasites in farm animals. International Journal for Parasitology. 43 (2), 115-124 (2013).
- Karanis, P., Aldeyarbi, H. M. Evolution of Cryptosporidium in vitro culture. International Journal for Parasitology. 41 (12), 1231-1242 (2011).
- Morada, M., et al. Continuous culture of Cryptosporidium parvum using hollow fiber technology. International Journal for Parasitology. 46 (1), 21-29 (2016).
- DeCicco RePass, M. A., et al. Novel Bioengineered Three-Dimensional Human Intestinal Model for Long-Term Infection of Cryptosporidium parvum. Infection and Immunity. 85 (3), (2017).
- Miller, C. N., et al. A cell culture platform for Cryptosporidium that enables long-term cultivation and new tools for the systematic investigation of its biology. International Journal for Parasitology. 48 (3-4), 197-201 (2018).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modelling. bioRxiv. , (2018).
- Dutta, D., Clevers, H. Organoid culture systems to study host-pathogen interactions. Current Opinion in Immunology. 48, 15-22 (2017).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Dutta, D., Heo, I., Clevers, H. Disease Modeling in Stem Cell-Derived 3D Organoid Systems. Trends in Molecular Medicine. 23 (5), 393-410 (2017).
- Clevers, H. Modeling Development and Disease with Organoids. Cell. 165 (7), 1586-1597 (2016).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- O'Hara, S. P., Chen, X. M. The cell biology of Cryptosporidium infection. Microbes and Infection. 13 (8-9), 721-730 (2011).
- Lendner, M., Daugschies, A. Cryptosporidium infections: molecular advances. Parasitology. 141 (11), 1511-1532 (2014).
- Feng, H., Nie, W., Sheoran, A., Zhang, Q., Tzipori, S. Bile acids enhance invasiveness of Cryptosporidium spp. into cultured cells. Infection and Immunity. 74 (6), 3342-3346 (2006).
- O'Connor, R. M., Kim, K., Khan, F., Ward, H. Expression of Cpgp40/15 in Toxoplasma gondii: a surrogate system for the study of Cryptosporidium glycoprotein antigens. Infection and Immunity. 71, 6027-6034 (2003).
- Wilke, G., et al. Monoclonal Antibodies to Intracellular Stages of Cryptosporidium parvum Define Life Cycle Progression In Vitro. mSphere. 3 (3), (2018).
- Vinayak, S., et al. Genetic modification of the diarrhoeal pathogen Cryptosporidium parvum. Nature. 523 (7561), 477-480 (2015).
- Dijkstra, K. K., et al. Generation of Tumor-Reactive T Cells by Co-culture of Peripheral Blood Lymphocytes and Tumor Organoids. Cell. 174 (6), 1586-1598 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados