Method Article
С помощью роботизированных систем для обработки и внедрить толстой мышиных проб для гистологического анализа
* Эти авторы внесли равный вклад
В этой статье
Erratum Notice
Резюме
Отсутствие стандартизации для обработки мышиных ткани уменьшает качество мышиных гистопатологические анализа по сравнению с человеческих особей. Здесь мы представляем протокол для выполнения гистопатологические экспертизы мышиных воспаленной и рифамицин толстой тканей чтобы показать возможности робототехнических систем, обычно используются для обработки и встраивание человеческих образцов.
Аннотация
Понимание человеческих заболеваний были значительно расширены благодаря изучению животных моделей. Тем не менее гистопатологические оценки экспериментальных моделей должен быть жестким, что применяется для человеческих образцов. Действительно надежные и точные выводы критически зависит от качества ткани секции подготовки. Здесь мы описываем протокол для гистопатологические анализа мышиных тканей, который реализует несколько автоматизированных шагов во время процедуры, от первоначальной подготовки для встраивания парафин мышиных образцов. Сокращение методологических переменных путем стандартизации строгий протокол от автоматизированных процедур способствует увеличению общей надежности мышиных патологических анализа. В частности этот протокол описывает использование автоматизированной обработки и внедрение робототехнических систем, обычно используются для обработки тканей и парафин встраивание человеческих образцов, для обработки мышиных образцы кишечные воспаления. Мы делаем вывод, что после внедрения стандартизированных и автоматизированных методов значительно повышена надежность гистопатологические осмотра мышиных тканей.
Введение
В последние десятилетия были разработаны несколько экспериментальных моделей вскрыть патогенетических механизмов, ведущих к заболеваний человека1,2. Для того чтобы оценить тяжесть заболевания, исследователи должны оценивать эффект от лечения и исследования цитологического и гистологического архитектурных изменений или количество воспаления3. Для выполнения этих экспериментальных моделей, необходимы подробные анализы гистопатологические, часто сравнивая мышиных и человеческих образцов4,5.
Кроме того людские пробы обычно обрабатываются и забил гистопатология основной зал и опытных человека патологоанатомов через стандартизированные гистопатологические критерии и методы. И наоборот мышиных ткани обычно фиксированной, встроенные и проанализированы исследователями с ограниченным опытом гистопатологические протоколов. Качество и надежность гистопатологические осмотра начинается с подготовки разделов ткани высокого качества. Несколько факторов способствуют критически увеличение или уменьшение, качество окончательного анализа, включая фиксацию, макроскопической секционирование, переработка, парафин встраивание и встраивание образцы6,7.
Все эти проходы с участием манипуляции образца подвергаются ручной ошибок, в том числе ручного встраивания образцов и, в меньшей степени, ручной правки микротомных секционирование и пятнать. В настоящее время весь процесс подготовки мышиных тканей для гистологического оценки опирается на протоколы, которые варьируются от лаборатории для лабораторных и ручной протоколов. Цель этого исследования заключается в реализации стандартных автоматизированных протоколов для уменьшения ошибок и изменчивости в мышиных гистопатологические экспертизы.
Насколько нам известно мы опишем здесь первые протоколы для полностью автоматизированной ткани обработки и внедрение оценки гистологических мышиных тканей; Обычно они используются в патологии подразделений для анализа человеческих особей. Как практический пример возможности метода, проанализировано модель мышиных кишечного воспаления, т.е., модель хронический колит вызванные повторного отправления декстран сульфата натрия (DSS) в питьевой воде8 ,9. Эта экспериментальная установка тесно напоминает человека воспалительных кишечника (IBD) заболеваний10 , поскольку DSS-лечить животных проявлять признаки кишечной воспаления, например, потеря веса, жидкий стул или понос и укорочение толстой кишки, а также фиброз 8,9,11. Как заметил человека IBD пациентов, DSS лечения создает сложное заболевание курс. В этом контексте сложных гистологических оценок необходимо понять глубокие изменения архитектуры ткани. Таким образом осуществление описанных протоколов для повышения качества подготовки образца может пользу исследователи, опираясь на интерпретации гистологические и иммуногистохимическое анализирует мышиных экспериментальных параметров. Мышиных экспериментальных моделях заболеваний человека с участием изменения архитектуры ткани, присутствие клетчатки инфильтрат или воспаление в различных тканях и органах (ЖКТ, мозга, печени, кожи) может использовать увеличение качества Пробоподготовка для гистопатологические осмотра.
протокол
Животных процедуры были одобрены министерством здравоохранения (авт. 127/15, 27/13) Италии и руководящими животных ухода Европейского института онкологии IACUC (институциональный уход за животными и использования Комитета)
1. хронический колит индукции администрацией повторяющихся DSS
- Отдельный возраст и пол соответствует мышей в 2 группах (лечение DSS против управления H2O, по крайней мере 5 мышей однопометники в экспериментальной группе).
- Администрировать 2,5% DSS (40 кДа) в питьевой воде за 7 дней до группе лечения и воды к группе элементов управления.
Примечание: Эта модель индуцирует Трансмуральное хронического воспаления кишечного9. - После 7 дней прекратить лечение DSS и дать воде обеих групп на 14 дней. Повторите эту процедуру 3 раза.
Примечание: Повторяющихся отправления DSS вызывает изменения слизистой кишечника, напоминающий человека IBD, т.е., фиброз9. - Пожертвовать мышей в соответствии с процедурами, уполномоченным институциональных IACUC, т.е., , CO2 ингаляции.
- Откройте с помощью скальпеля мыши живота и брюшины.
Примечание: Стерильность рекомендуется, но не строго необходимым. - Отделяйте толстой кишки от тонкой кишки с щипцами и пинцет. Акцизный толстой кишки с помощью пинцета и пинцет.
Примечание: Измерение длины двоеточия (рис. 1A) является метод для определения, если колит произошло в DSS-лечение мышей. - Промойте двоеточие в чашке Петри с 10 мл холодного 1 x фосфатный буфер (PBS) и аккуратно нажмите, чтобы удалить фекалии.
2. мышиных тканей фиксации
- Погрузите каждую мышиных Колон образца в 10 мл 10% нейтральных буферизуются формалина (NBF) на RT (комнатной температуры).
Примечание: Стерильность рекомендуется, но не строго необходимым. - Исправить ткани на 18 – 24 h на RT.
3. Колон секционирование и подготовка тканей
- Удаление фиксированных тканей из NBF контейнера с небольшой помощью пинцета и положить их в чашке Петри. Положите толстой кишки на секущей работы тарелку с небольшой помощью пинцета.
- Вырежьте двоеточия в фрагментов (0,2 см до 0,3 см длины) с стерильным скальпель. Этот фрагмент длина является оптимальным, чтобы не превышать толщину кассеты.
- Подобрать одно двоеточие сегмент малых пинцетом (рис. 2A). Вставьте один из пластика, выступающие советы ориентированные парафина, встраивание кассету с небольшой помощью пинцета (рис. 2B) одно двоеточие сегмента.
- Повторите данную операцию (3.2-3.3) с дополнительной 3 Колон сегментами одну кассету. Избегайте вставки сегментов в прилегающих выступающие советы, чтобы свести к минимуму дублирование тканей
- Плотно закройте кассету, осторожно нажав четырех краев (рис. 2 c). Избегайте, сжимая ткани, чтобы предотвратить повреждение тканей.
- Вставьте пластиковые несущую рамку сетки. Ярлык несущую рамку для идентификации образца. Повторите для каждого биологического образца.
4. ткань обработка
- Включите автоматические процессора, нажав на кнопку питания (рис. 3A, 3B).
- Прогреться в течение 1 ч для обеспечения плавления парафина. Подождите, пока этот документ подтверждает, что парафин полностью растаял, наблюдая за присутствие выделенный значок (рис. 3 c).
- Вставьте каждый ориентированной кассеты (содержащие образцы ткани) вручную в корзины металла, предоставляемый автоматизированных процессора (рис. 3D). Место кассеты вертикально накладки их недалеко от одного к другому, чтобы оптимизировать размещение корзина.
- Закройте корзины металла (Рисунок 3E).
- Откройте крышку реторты (Рисунок 3F). Реторта является местом, где корзина вставляется в машину. Вставьте корзину в выделенный корпус процессора (Рисунок 3 g). Закройте крышку реторты (рис. 3 H).
- Используйте сенсорный экран на компьютере инструмент для определения рабочей протокол (Рисунок 3I). Выберите последовательность решений, время и температуры должна осуществляться по схеме приводятся в таблице 1.
- Назначьте протокол для запуска на реторты, содержащие в корзину, нажав на иконку выделенный компьютер (Рисунок 3J). Запустите протокол, нажав на Кнопку «Пуск» (рис. 3 L).
- Подождите, пока прибор подтверждает в конце протокола, путем наблюдения за присутствие выделенный значок и услышав сигнал из машины.
- Откройте крышку реторты. Выньте корзину из процессора (рис. 3 M).
5. ткани встраивание
- Включите автоматические embedder, нажав кнопку питания (рис. 4A).
- Прогреться в течение 1 ч для обеспечения плавления парафина. Подождите, пока этот документ подтверждает, что парафин полностью растаял, наблюдая температуры Парафиновая ванночка, обозначается внутренний термометр инструмента.
- Вручную перенести все обработанные кассеты из корзины процессора embedder стойки. Каждый шкаф может содержать до 32 кассеты. (Рис. 4б, 4 C).
- Открывайте крышку главной embedder (рис. 4 c, 4 D, 4E).
- Использовать сенсорный экран на компьютере инструмент Робототехнические системы, что стойки вставить (Рисунок 4F).
- Откройте крышку корпуса впуска (Рисунок 4 g). Вставьте решетку в входе жилья. Каждый embedder может содержать до 4 стойки одновременно (рис. 4 H, 4I). Закройте крышку корпус впускного (Рисунок 4J).
- Используйте сенсорный экран на компьютере инструмент для начала внедрения процедуры, согласно таблице 2 (рис. 4 K).
Примечание: Каждая стойка 32 кассеты занимает 45 мин должен быть внедрен. - Подождите, пока прибор подтверждает в конце протокола, наблюдая за присутствие выделенный значок (рис. 4 L).
- Удалите выход стойки (рис. 4 M). Закройте крышку главной embedder.
- Удалите встроенные блоки (содержащие ориентации сеток) из стойки. Передачи встроенных блоков в картонной коробке хранения.
6. микрометр секционирование
- Включите охлаждающей плиты микротома. Установите температуру между -8-10 ° c.
- Включите термостатической водяной бане микротом, содержащий 2 Л дистиллированной воды. Установите температуру водяной бане между 42 – 45 ° C.
- Место парафина внедренные блоки охлаждения пластины. Подождите, по крайней мере 5 минут чтобы позволить блоки для охлаждения.
- Возьмите один блок от охлаждения пластины и поместите его в держатель блока микротома.
- Установите вырезать толщиной до 10 мкм. отделка блок путем разрезания он 6 раз в 10 мкм толщина микротома.
- Измените параметр толщина микротома от 10 мкм 3 µm. вырезать один 3 мкм секции для окрашивания гематоксилином и эозином (H & E).
-
Соберите в разделе 3 мкм с маленькой кистью. Поместите в разделе 3 мкм в водяной бане, тщательно класть его на поверхности воды для уменьшения морщин на ткани. Соберите в разделе ткани с термостатическим водяной бане на слайде одного стекла.
- При необходимости, сократить дополнительные разделы.
- Ярлык стеклянное скольжение, написав идентификации образца.
- Поместите слайды в 37 ° C духовке в течение по крайней мере 10 мин.
- Положите стекло слайды в стойки для немедленного анализа или в коробки хранения.
7. гематоксилином и эозином (H & E)
- Включите автоматические Стайнер, нажав кнопку питания. Разрешите инициализацию манипулятор, наблюдая изменения панели загрузки на экране монитора инструмента.
- Вставьте стекла слайды в стойку Стайнер, вертикально Вставка до 30 слайдов.
- Ярлык стойку с соответствующим радиочастотной идентификации (RFID) пластиковые тегом. RFID меток — это система идентификации правильный протокол окрашивание загружена в компьютер ситечко.
- Вставьте решетку в ситечко. Разрешить компьютеру автоматически загружать и запускать окрашивание протокол согласно признанию RFID метки.
Примечание: Протокол для H & E пятнать описан в Таблица 3.
8. иммуногистохимическое окрашивание
- Выполнения иммуногистохимических и Мэллори trichrome окрашивание как описано выше7.
Результаты
Экспериментальная хронический колит, вызванных повторного отправления DSS в питьевой воде является моделью мышиных кишечного воспаления, напоминающий человека IBD8,9. Рисунок 1 описывает эффекты лечения DSS, включая двоеточие сокращения (Рисунок 1A), широко используется параметр Оценка присутствия DSS-индуцированной воспаления и толстой выражение генов провоспалительных, включая CXCL10 , ФНО и МКП-1 (рис. 1B). Инфильтрация воспалительных клеток был значительно усовершенствован путем лечения DSS, показывая набора иммунного ответа в кишечной lamina propria как анализируемой cytofluorimetry (рис. 1 c).
Рисунок 2 изображает как толстой ткани секционного и вставлены в ориентированных на кассеты. Эти кассеты предназначены для внешне содержит сетку с экструдированного советы, позволяя вставки ткани вертикально и с надлежащей ориентацией, т.е., с просвета в внутренней части и стены (рис. 2A, 2B, 2 C ). Как только будут закрыты кассетами, ориентации ткани сохраняется сеток, вопреки тому, что происходит с обычными гистологические кассеты (рис. 2B).
Выполняется обработка ткани с процессором автоматизированных (Рисунок 3А-3 M и Таблица 1), при внедрении процедура выполняется с автоматизированной embedder (Рисунок 4A-4 M и Таблица 2). В последнем документе робот собирает кассеты и распределяет правильное количество парафина. Наконец используя микротом, секции, вырезанные из каждого блока парафина. Затем слайды готовятся для дальнейшего анализа.
Рисунок 5 описывает основные проходы автоматизированных H & E окрашивание (Рисунок 5A-5E и Таблица 3) и как слайды отображаются после H & E окрашивание (Рисунок 5F). Рисунок 6 и 7 Показать как осуществления автоматизированной обработки и внедрение протоколов сильно увеличить качество гистопатологические анализы образцов мышиных ободочной кишки. H & E stainings образцы, подготовленных с автоматизированной протоколов, производные от необработанной мышей (рис. 6A) были по сравнению с теми DSS лечение мышей (Рисунок 6B). Гистопатологические оценки были оценены путем оценки изменения различных параметров, происходящих в слизистой оболочке кишечника, включая воспалительных клеток инфильтрата, эпителиальные изменения и изменения слизистой архитектуры как описано в Таблица 4. Рисунок 6 c изображает представитель H & E пятнать из толстой ткани обрабатываются вручную и включены в традиционные кассеты. В рис 7, качество подготовки мышиных ткани и встраивание выполняется посредством автоматизированных инструментов была дополнительно подтверждена IHC окрашивание CD20 и Мэллори trichrome окрашивание8,9 в толстой разделы без лечения (рис. 7A, 7 C) и DSS-лечение (рис. 7B, 7 D) мышах.
Рисунок 8 описывает практическое значение этого метода. Же Колон образцы были обработаны и встроенные вручную или с помощью автоматических методов. Каждый образец (либо элемента управления или DSS-лечение) было разрезать на 2 равные части и обрабатываются параллельно, с ручной или автоматической методы. H & E пятнать был затем и полный микроскопические оценки, касающиеся всех патологических параметры решения изменения в слизистой архитектуры, детализации, иммунных клеток проникнуть, толщина слизистой, железистые разрежения обычно во время кишечного воспаления, была проведена оценка для каждого образца, как для руководства, так и автоматизированных протокол (рис. 8A и таблица 4). Подготовка образцов с автоматизированной протоколом последовательно позволила оценки более высокую долю гистологические параметры чем ручной метод. Кроме того, был проведен отдельный анализ различных гистологические параметры (Рисунок 8B). Архитектура и базальной инфильтрата оценки были положительно сказалось, особенно в необработанной мышей, подготовка образца с помощью автоматического метода.
Автоматизированный метод для образца обработки и встраивание в настоящее время используется для человека гистопатологические анализов может успешно применяется для анализа мышиных образцов. Высокое качество образцов создаются с автоматизированный метод, который демонстрирует превосходство над ручной метод оценки архитектуры и базальной иммунной инфильтрата мышиных кишечных тканей.
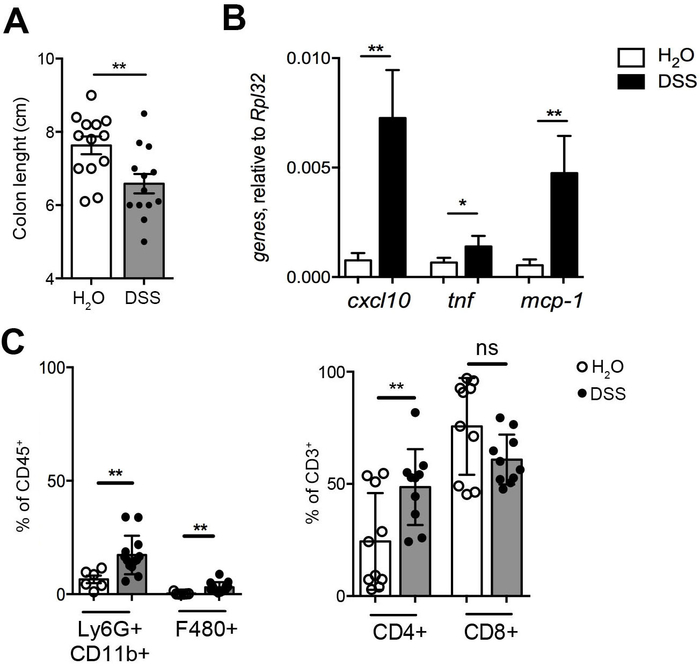
Рисунок 1: оценки хронического воспаления кишечного. (A) измерение длины двоеточия. (B) толстой выражение генов провоспалительных (cxcl10, ФНО, МКП-1) в DSS-лечение (чёрные полосы, n = 12) и лечить мышей (Белый баров, n = 6). (C) Иммунофенотипирование толстой lamina propria клеток в DSS-лечение (закрытые символы, n = 12) и лечить мышей (открыть символы, n = 6). CD11b + Ly6G + нейтрофилов, CD11b + F4 / 80 + макрофагов (левая панель), CD4 + и CD8 + T-клеток инфильтрата (правая панель) в элементах управления (открыть символы, n = 10) и DSS-лечение мышей (закрытые символы, n = 10). Статистическая значимость была рассчитана с использованием пар сопоставлены Вилкоксон подписали ранга t-тест. p ≤ 0,05 ** p ≤ 0.01. Средний значение ± SEM сообщается. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: описание пробоподготовки. (A) инструменты необходимые для подготовки ткани и картины ориентированные кассеты, состоящая из внешних кассеты (белый) и внутренней сетки с экструдированного ориентации советы. (B, C) Вставки из мышиных двоеточия в внутренней сетки кассету до (B) и после закрытия (C) сеток. В панели изображен B ориентированные кассеты (слева) или в традиционных кассеты (справа). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: описание автоматизированной обработки. (A, B) автоматизированных процессора. (C) икона, описывающих правильный парафина температуры плавления. (D, E) Включение кассету в корзины металла (D) и его закрытия (E). (F, G, H) Включение корзины металла в реторты. (I, J, K) Выбор протокола обработки. (L) ведения протокола. (M) удаление формы корзину реторты. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Описание внедрения автоматизированных . (A) картина автоматических embedder. (B, C) Вставки кассет в стойке. (D, E) Открытие (D) и (E) закрытия крышки. (F) сигнализации на машину присутствие стойку. (G, H) Вставки стойки в входе корпус. (I, J) закрытие крышки. (K) начало внедрения протокола. (L) открытие крышку корпуса розетки. (M) удаление стойки формы корпуса розетки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: описание автоматизированной H & E Стайнер. (A) фотография слайд владельца. (B, C) Вставки слайд держателя в машине. (D) закрытие машины. (E) начало окрашивание протокола. (F) Exemplificative изображение слайда после резки микротома и H & E окрашивания. Правая панель, H & E, окрашивание, изображающие ориентации образца. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
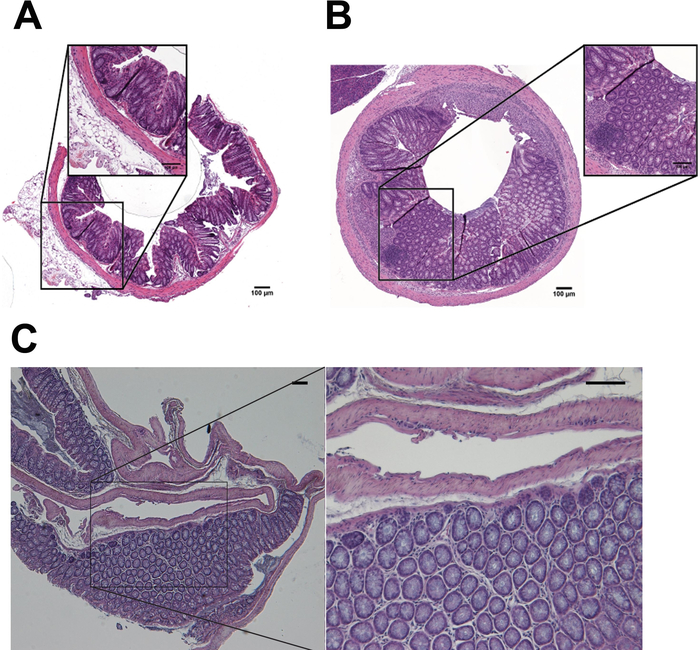
Рисунок 6: H & E stainings толстой образцов форме необработанных и обработанных DSS мышей. H & E окрашивания образцов DSS-лечение (B) и необработанной (A) подготовил (обрабатываются, встроенные, витражи) с автоматической (A, B) или ручной (C) методы. Шкалы бар = 100 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
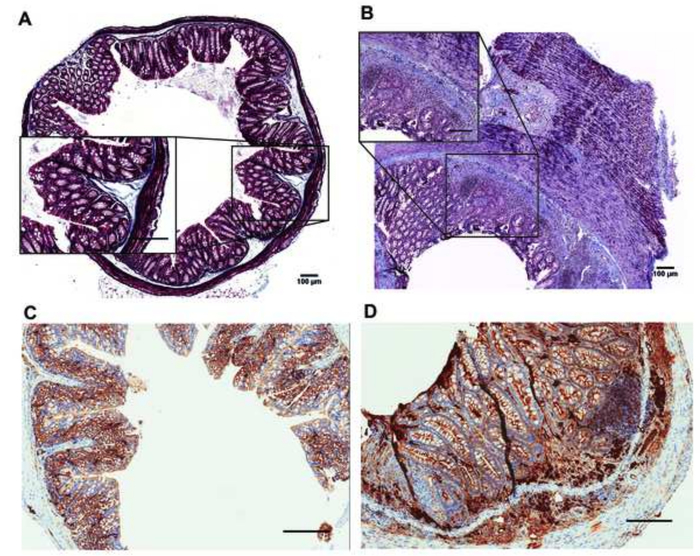
Рисунок 7: Мэллори trichrome (A, B) и ИХС stainings проникновения CD20 + клеток (C, D) из необработанной (A-C) и DSS лечить (B, D) мышах. Мэллори окрашивание: цитоплазмы, темно-розовый, голубой, ядер, темно-красный, коллаген. Шкалы бар = 100 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 8: сравнение между гистопатологические анализов с протоколами ручного и автоматизированного. (A) Общая гистопатологические параметры оценимый во всех разделах, подготовила руководство (Белый Барс) либо с методом автоматического (фиолетовый бары). (Б) процент указанных параметров в образцах, подготовленные с ручным (белые полосы) или с методом автоматического (фиолетовый бары) в необработанной (равнина баров) или DSS-лечение мышей (пунктирные линии). Статистическая значимость была рассчитана с использованием пар сопоставлены Вилкоксон подписали ранга t-тест. p < 0,05; p < 0,005. Средний значение ± SEM сообщается. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Реагент | время (мин) | Температура (° C) | давление |
| NBF | 1 | RT | окружающей среды |
| Этанола 95% | 1 | RT | окружающей среды |
| Этанола 95% | 1 | RT | окружающей среды |
| Этанола 95% | 1 | RT | окружающей среды |
| Абсолютного этанола | 1 | 45 | окружающей среды |
| Абсолютного этанола | 11 | 45 | окружающей среды |
| Абсолютного этанола | 30 | RT | окружающей среды |
| Ксилол нефтяной | 1 | RT | окружающей среды |
| Ксилол нефтяной | 1 | 45 | окружающей среды |
| Ксилол нефтяной | 28 | 45 | окружающей среды |
| Парафин воск | 5 | 65 | вакуум |
Таблица 1: Автоматизированная протокол обработки ткани.
| Исполнили действий робота на каждую кассету |
| Удалить одну кассету из стойки |
| Определить кассеты |
| Предварительно нагрейте плесень |
| Место кассеты на разогретую плесень |
| Отказаться от количество парафин для кассеты |
| Охладьте вниз плесень |
| Разрешить парафин для закрепления |
| Удалите блок Твёрдый парафин от плесени |
| Настоящее время блок качества датчиков |
| Поместите блок парафина в выходной двери |
Таблица 2: Автоматизированное внедрение протокола.
| Категория | Критерий | Определение | Оценка стоимости |
| Воспалительных клеток инфильтрата | Тяжести (плотность лейкоцита lamina propria области проникли в оценивали hpf) | Не инфильтрата | 0 |
| Минимальный острый (< 10%) | 0.25 | ||
| Мягкий хронический (10-25%, рассеянного нейтрофилов) | 0.5 | ||
| Умеренной хронической (26-50%) | 0.75 | ||
| Отмеченные (> проникнуть в 51%, плотная) | 1 | ||
| Степень (расширение лейкоцитарной инфильтрации) | Слизистых оболочек | 0.5 | |
| Слизистых оболочек и подслизистую | 0.75 | ||
| Эпителиальный изменения | Гиперплазия (увеличение числа эпителиальных клеток в продольных склепы, видимых как склеп удлинение) | Не гиперплазия | 0 |
| Минимальная (< 25%) | 0.25 | ||
| Мягкая (26 – 35%) | 0.5 | ||
| Умеренный (36 – 50%, митозов в верхней трети эпителия склеп) | 0.75 | ||
| Отмеченные (> 51%, митозов в склепе эпителия далеких от склепа базовый) | 1 | ||
| Кубок ячейка потерь (снижение числа клеток Кубок относительно базового числа клеток Кубок в склеп) | Без потерь | 0 | |
| Минимальная (< 25%) | 0.25 | ||
| Мягкая (26 – 35%) | 0.5 | ||
| Умеренный (36 – 50%) | 0.75 | ||
| Отмеченные (> 51%) | 1 | ||
| Слизистых оболочек архитектура | Изъязвления (выходит за рамки muscolaris mucosae эпителия дефект) | Нет язвы | 0 |
| Язвенной болезни | 0.25 | ||
| Грануляционной ткани (ремонт соединительной ткани с новых капилляров, окруженный проникают в клетки, гипертрофированные районы) | Не грануляционной ткани | 0 | |
| Грануляционной ткани | 0.25 | ||
| Слизистых оболочек толщины и склеп глубина | Без сгущения | 0 | |
| Сгущение | 0.5 | ||
| Железистой разрежения | Не разрежения | 0 | |
| Разрежение | 0.5 | ||
| Дисплазия | Не Дисплазия | 0 | |
| Дисплазия | 0.5 | ||
| МАКСИМАЛЬНАЯ ОЦЕНКА | 6 |
Таблица 3: Автоматизированная пятнать протокол.
| Исполнили действий, ситечко для каждого слайда | Реагент | время (ов) | Температура (° C) |
| Essicate | 180 | 60 | |
| Essicate | 180 | 60 | |
| Deparaffinize | Ксилол нефтяной | 120 | RT |
| Deparaffinize | Ксилол нефтяной | 120 | RT |
| Сода каустическая | Этанол 96% | 120 | RT |
| Сода каустическая | Этанол 96% | 120 | RT |
| Мойка | Дистиллированной wtaer | 240 | RT |
| Пятно гематоксилином | В Carazzi гематоксилином | 540 | RT |
| Полоскания | Водопроводная вода | 360 | RT |
| Пятно эозином | Эозин Y 1% aqueos раствор | 60 | RT |
| Полоскания | Водопроводная вода | 120 | RT |
| Дигидрат | Этанол 96% | 20 | RT |
| Дигидрат | Этанол 96% | 20 | RT |
| Дигидрат | Абсолютного этанола | 15 | RT |
| Дигидрат | Абсолютного этанола | 15 | RT |
| Ясно | Ксилол нефтяной | 30 | RT |
| Ясно | Ксилол нефтяной | 30 | RT |
Таблица 4: Озвучивание схемы для оценки кишечного воспаления.
Обсуждение
Мы используем различные автоматизированные действия во время подготовки мышиных тканей для гистопатологические анализа. Этот протокол направлен на обеспечение технического Советы увеличить воспроизводимость и стандартизации процесса в целом, повышая тем самым общее качество окончательной гистопатологические оценки. Мы реализовали автоматизированных инструментов и методов для подготовки и внедрения тканей, обычно используются в патологии основной зал для изучения человеческих особей.
Чтобы продемонстрировать потенциальные возможности применения этого метода, мы выбрали хронический мышиных экспериментальной установки кишечного воспаления, называется моделью DSS-индуцированной хронический колит. Этот параметр напоминает курс сложное заболевание наблюдается у пациентов IBD, требующих сложных гистологических оценки исследовать глубокие изменения архитектуры ткани, происходящие после хронического воспаления кишечного. Вообще гистологические оценки этих процессов может значительно выиграть от увеличения образец качества подготовки. Напомним, этот протокол может применяться для других мышиных тканей (то есть, селезенки, лимфатических узлов, печени, мозга), с той лишь разницей, что ориентированных на кассету не требуется для тканей без просвета.
Наиболее важное наблюдение было то, что уменьшение ошибок, ручной, (т.е., ориентация образца) учитывая использование кассеты с сетками и ликвидации кассеты повторного открытия для встраивания (шаг обычно выполняется во время руководство протоколы), сильно повысить общую воспроизводимость анализа. С протоколом, описанные здесь образец обрабатывается только в начале подготовки, когда экспериментатор вставляет ткани в ориентированной кассеты. После закрытия, кассеты, никогда не возобновлять, таким образом обеспечивая поддержание правильной ориентации и сокращения ручного ошибки3,11. Стандартизация этих двух важнейших шагов повысить качество весь последующий анализ и уменьшилось количество потерянных или не поддающийся выборок, проблемы, которые оба связаны с повторное открытие кассеты или неправильно ориентация образца3 ,11.
Нам также удалось в оценке сложных биологических событий как фиброз (рис. 7), что очень часто недооценивается в мышиных моделях экспериментальных кишечного воспаления, путем осуществления автоматизированной протокола. Во время настройки протокола мы строго стандартизированы технические детали, такие как время фиксации, что мы поняли, не должна превышать 24 часа, чтобы избежать изменения тканей. Поступая таким образом, мы могли бы сохранить качество последующих иммуногистохимических исследований.
Автоматизированный метод улучшения оценки этих параметров связанные изменения архитектуры ткани, особенно в необработанной мышей. Действительно правильное сравнение патологических тканей с здоровой коллега критически важное значение для окончательной оценки экспериментальной модели3.
Относительно обработки ткани, мы испытывали различные протоколы для запуска в автоматизированных процессор доступен в лаборатории. Протокол, описанные здесь дал звук и весьма последовательные результаты. Мы также ввели время длина для протокола. Так как мышиных образцы были сопоставимы с человека небольшие образцы biopsic в размер, короче протокол был достаточно для обработки мышиных (кишечника, в данном случае) тканей. Наконец весь автоматизированной процедуры уменьшить общее время экспериментально. С самого начала обработки микротом резки и подготовки ломтиками, мы подсчитали, что общее время, необходимое-5 ч. Напротив в зависимости от технической возможности оператора, завершение тех же протоколов вручную может потребовать более чем вдвое количество времени, особенно во время обработки и вложения. Один предел техники является, что она требует автоматизированных процессоров и embedder быть выполнены в лаборатории.
В заключение мы считаем, что осуществление этих автоматизированных протоколов может значительно улучшить работу переводческих исследователей, занимающихся мышиных экспериментальных моделях заболеваний человека.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим Департамент патологии больницы Поликлинико IRCCS, Милан для технической поддержки и НОО животных фонда для оказания помощи в животноводстве.
Материалы
| Name | Company | Catalog Number | Comments |
| Absolute Ethanol anhydrous | Carlo Erba | 414605 | reagent |
| Absolute ETOH | Honeywell | 02860-1L | reagent |
| Aluminium Potassium Sulfate | SIGMA | A6435 | reagent |
| Aniline Blue | SIGMA | 415049 | reagent |
| carbol Fuchsin | SIGMA | C4165 | reagent |
| CD11b (clone M1/70) | TONBO biosciences | 35-0112-U100 | antibody |
| CD20 IHC (clone SA275A11) | Biolegend | 150403 | antibody |
| CD3 (17A2) | TONBO biosciences | 35-0032-U100 | antibody |
| CD4 (GK1.5) | BD Biosciences | 552051 | antibody |
| CD45.2 (clone 104) | BioLegend | 109837 | antibody |
| CD8 (53-6.7) | BD Biosciences | 553031 | antibody |
| Citrate Buffer pH 6 10x | SIGMA | C9999 | reagent |
| Dab | Vector Laboratories | SK-4100 | reagent |
| DPBS 1x | Microgem | L0615-500 | reagent |
| DSS | TdB Consultancy | DB001 | reagent |
| EDTA | SIGMA | E9884 | reagent |
| EnVision Flex Peroxidase-Blocking Reagent | DAKO | compreso in GV80011-2 | |
| EnVision Flex Substrate | DAKO | compreso in GV80011-2 | |
| EnVision Flex/HRP | DAKO | compreso in GV80011-2 | |
| EnVision Flex+ Rat Linker | DAKO | compreso in GV80011-2 | |
| Eosin | VWR | 1.09844 | reagent |
| F4/80 (clone BM8) | BioLegend | 123108 | antibody |
| Formalin | PanReac | 2,529,311,215 | reagent |
| glacial acetic acid | SIGMA | 71251 | reagent |
| Goat-anti-Rat-HRP | Agilent DAKO | P0448 | antibody |
| Haematoxylin | DIAPATH | C0303 | reagent |
| LEICA Rotary microtome (RM2255) | Leica | RM2255 | equipment |
| Ly6g (clone 1A8) | BD Biosciences | 551459 | antibody |
| Mercury II Oxide | SIGMA | 203793 | reagent |
| Omnis Clearify Clearing Agent | DAKO | CACLEGAL | reagent |
| Omnis EnVision Flex TRS | DAKO | GV80011-2 | reagent |
| Orange G | SIGMA | O3756 | reagent |
| Paraffin | Sakura | 7052 | reagent |
| Peloris | LEICA | equipment | |
| Percoll | SIGMA | P4937 | reagent |
| RPMI 1640 without L-Glutamine | Microgem | L0501-500 | reagent |
| STS020 | Leica | equipment | |
| Tissue-Teck Paraform Sectionable Cassette | SAKURA | 7022 | equipment |
| Tissue-Tek Automated paraffin embedder | Sakura | equipment | |
| Xylene | J.T.Baker | 8080.1000 | reagent |
Ссылки
- Gibson-Corley, K. N., et al. Successful Integration of the Histology Core Laboratory in Translational Research. Journal of histotechnology. 35, 17-21 (2012).
- Olivier, A. K., et al. Genetically modified species in research: Opportunities and challenges for the histology core laboratory. Journal of histotechnology. 35, 63-67 (2012).
- Gibson-Corley, K. N., Olivier, A. K., Meyerholz, D. K. Principles for valid histopathologic scoring in research. Veterinary pathology. 50, 1007-1015 (2013).
- Stolfi, C., et al. Involvement of interleukin-21 in the regulation of colitis-associated colon cancer. The Journal of experimental medicine. 208, 2279-2290 (2011).
- Begley, C. G., Ellis, L. M. Drug development: Raise standards for preclinical cancer research. Nature. 483, 531-533 (2012).
- Peters, S. R. A Practical Guide to Frozen Section Technique. , New York, N.S.N.Y. (2010).
- Rosai, J. Rosai and Ackerman's Surgical Pathology. , Elsevier. (2011).
- Blumberg, R. S., Saubermann, L. J., Strober, W. Animal models of mucosal inflammation and their relation to human inflammatory bowel disease. Current opinion in immunology. 11, 648-656 (1999).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature. 2, 541-546 (2007).
- Kaser, A., Zeissig, S., Blumberg, R. S. Inflammatory bowel disease. Annual review of immunology. 28, 573-621 (2010).
- Cribiù, F. M., Burrello, C., et al. Implementation of an automated inclusion system for the histological analysis of murine tissue samples: A feasibility study in DSS-induced chronic colitis. European Journal of Inflammation. 16, 1-12 (2018).
Erratum
Formal Correction: Erratum: Using Robotic Systems to Process and Embed Colonic Murine Samples for Histological Analyses
Posted by JoVE Editors on 2/03/2019. Citeable Link.
An erratum was issued for: Using Robotic Systems to Process and Embed Colonic Murine Samples for Histological Analyses. An author affiliation was updated.
The affiliation for Claudia Burrello and Federica Facciotti was updated from:
Department of Experimental Oncology, European Institute of Oncology
to:
Department of Experimental Oncology, IEO, European Institute of Oncology IRCCS
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены