Method Article
Verwendung von Robotersystemen zu verarbeiten und Embed-Kolon Murine Proben für histologische Analysen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Erratum Notice
Zusammenfassung
Fehlende Standardisierung für murine Gewebe Verarbeitung reduziert die Qualität der murinen histopathologische Analyse im Vergleich zu menschlichen Exemplare. Hier präsentieren wir Ihnen ein Protokoll zur histopathologischen Untersuchung der murinen entzündet und uninflamed Kolon Gewebe auf die Machbarkeit von Robotersystemen routinemäßig verwendet für die Verarbeitung und Einbettung von humanen Proben durchführen.
Zusammenfassung
Das Verständnis der menschlichen Krankheiten wurde durch die Studie von Tiermodellen stark ausgebaut. Histopathologische Beurteilung der experimentellen Modellen muss allerdings so streng wie die Humanproben angemeldete sein. In der Tat, ist zuverlässig und präzise Schlussfolgerungen kritisch die Qualität des Gewebes Abschnitt Vorbereitung beeinflusst. Hier beschreiben wir ein Protokoll für histopathologische Analyse der murinen Geweben, die mehrere automatisierte Schritte während des Verfahrens, von der anfänglichen Vorbereitung zur Paraffin Einbettung der murinen Proben implementiert. Die Reduzierung der methodischen Variablen durch strengen Protokoll Standardisierung von automatisierten Verfahren trägt zur erhöhten Zuverlässigkeit der murinen pathologische Analyse. Insbesondere dieses Protokoll beschreibt die Nutzung der automatischen Verarbeitung und Einbettung Robotersysteme, routinemäßig für die Gewebe-Verarbeitung und Paraffin Einbetten von humanen Proben zur murine Proben von Darmentzündungen zu verarbeiten. Wir schlussfolgern, dass die Zuverlässigkeit der histopathologischen Untersuchung der murinen Gewebe mit der Einführung des standardisierten und automatisierten Techniken deutlich erhöht wird.
Einleitung
In den letzten Jahrzehnten wurden mehrere experimentelle Modelle entwickelt, um die pathogenen Mechanismen führen zu Krankheiten beim Menschen1,2zu sezieren. Bei der Beurteilung die schwere einer Krankheit müssen Forscher bewerten die Wirkung einer Behandlung und der zytologischen und histologischen architektonische Variationen oder die Höhe der Entzündung3zu studieren. Um auf diesen experimentellen Modellen durchzuführen, sind detaillierte histopathologische Analysen nötig, oft vergleichen murinen und menschlichen Proben4,5.
Darüber hinaus Humanproben häufig verarbeitet und erzielte durch Histopathologie Kern Einrichtungen und erfahrenen menschlichen Pathologen durch standardisierte histopathologischen Kriterien und Methoden. Umgekehrt werden murinen Gewebe in der Regel behoben, eingebettet und von Forschern mit begrenzter Erfahrung der histopathologischen Protokolle analysiert. Die Qualität und Zuverlässigkeit der histopathologischen Untersuchung beginnt mit der Vorbereitung der qualitativ hochwertigen Gewebeschnitten. Mehrere Faktoren tragen kritisch zu erhöhen oder verringern die Qualität der endgültigen Analyse, einschließlich Fixierung, makroskopischen Schnitt, Verarbeitung, paraffin einbetten und Einbettung der Proben6,7.
Alle diese Stellen mit Manipulation der Probe werden manuelle Fehler, einschließlich manueller Einbettung der Proben und, in geringerem Maße, manuelle Mikrotom schneiden und Färbung unterzogen. Derzeit setzt der gesamte Prozess der murinen Gewebe Vorbereitung für histologische Auswertung auf Protokolle, die von Labor zu Labor variieren und manuelle Protokolle. Das Ziel dieser Studie ist es, standardisierte automatisierten Protokolle zur Reduzierung von Fehlern und Variabilität in murinen histopathologische Untersuchung zu implementieren.
Nach unserem Kenntnisstand beschreiben wir hier die ersten Protokolle für vollautomatische Gewebe Verarbeitung und für die histologische Auswertung der murinen Gewebe einbetten; Diese werden routinemäßig in Pathologie Einheiten für die Analysen der menschlichen Proben verwendet. Als ein praktisches Beispiel für die Durchführbarkeit der Methode ein Mausmodell der Darmentzündung wurde analysiert, d. h., das Modell chronischer Kolitis verursacht durch wiederholte Gabe von Dextran Natriumsulfat (DSS) in der Trinkwasser-8 ,9. Diese experimentelle Einstellung eng ähnelt menschlichen entzündlichen Darmerkrankungen (IBD) Krankheiten10 da DSS-behandelten Tieren Anzeichen einer Darmentzündung, z. B. Gewichtsverlust, weichem Stuhl oder Durchfall und Verkürzung der Doppelpunkt und die Fibrose aufweisen 8,9,11. Wie für menschliche IBD-Patienten beobachtet, erzeugt DSS Behandlung eine komplexe Krankheitsverlauf. In diesem Zusammenhang sind aufwendige histologische Auswertungen erforderlich, die tiefgreifende Veränderung die Gewebearchitektur verstehen. Damit die Umsetzung der beschriebenen Protokolle zur Steigerung der Probenqualität Vorbereitung könnten Forscher unter Berufung auf die Interpretation der histologischen profitieren und immunhistochemische Analysen für murine experimentelle Einstellungen. Murinen experimentelle Modelle menschlicher Erkrankungen mit Veränderungen der Gewebearchitektur, das Vorhandensein von Zellgewebe infiltrieren oder Entzündungen in verschiedenen Geweben und Organe (Darm, Gehirn, Leber, Haut) können die erhöhte Qualität der Probenvorbereitung für die histopathologische Untersuchung.
Protokoll
Tierische Verfahren wurde vom italienischen Gesundheitsministerium (auth. 127/15, 27/13) genehmigt und folgte die Tierbetreuung Leitlinien des European Institute of Oncology IACUC (institutionelle Tier Pflege und Nutzung Ausschuss)
1. chronische Kolitis Induktion durch sich wiederholende DSS-Verwaltung
- Separate Alter und Geschlecht abgestimmt Mäuse in 2 Gruppen (Behandlung DSS vs. Kontrolle H2O, mindestens 5 Mäuse Wurfgeschwistern pro Versuchsgruppe).
- Verwalten von 2,5 % DSS (40 kDa) in das Trinkwasser für 7 Tage in der Behandlungsgruppe und der Kontrollgruppe Wasser.
Hinweis: Dieses Modell führt zu einer chronischen Transmural Darmentzündung9. - Nach 7 Tagen DSS Behandlung abbrechen und Wasser zu beiden Gruppen für 14 Tage geben. Wiederholen Sie diesen Vorgang 3-Mal.
Hinweis: Wiederholte Verabreichung von DSS induziert Veränderungen der Dickdarmschleimhaut sehr ähnlich menschlichen IBD, d. h. Fibrose9. - Mäuse nach dem Verfahren autorisiert durch die institutionellen IACUC, d.h., durch CO2 Inhalation zu opfern.
- Öffnen Sie das Maus-Bauch und Bauchfell mit einem Skalpell.
Hinweis: Sterilität ist empfehlenswert aber nicht unbedingt erforderlich. - Trennen Sie den Doppelpunkt aus dem Dünndarm mit Zangen und Pinzetten. Verbrauchssteuern Sie Dickdarms mit Pinzette und Zange.
Hinweis: Doppelpunkt Längenmessung (Abbildung 1A) ist eine Methode, um festzustellen, ob in DSS-behandelten Mäusen ulcerosa aufgetreten. - Spülen Sie den Doppelpunkt in einer Petrischale mit 10 mL kalten 1 x Phosphat-Puffer Kochsalzlösung (PBS) und drücken Sie sanft, um fäkal Material zu entfernen.
(2) murinen Gewebe Fixierung
- Tauchen murinen Doppelpunkt Proben in 10 mL 10 % Neutral gepufferte Formalin (NBF) bei RT (Raumtemperatur).
Hinweis: Sterilität ist empfehlenswert aber nicht unbedingt erforderlich. - Beheben Sie das Gewebe für 18 – 24 h bei RT
(3) Colon-Schnitt und Gewebe-Vorbereitung
- Festes Gewebe aus dem NBF-Container mit kleine Pinzette entfernen und steckte sie in eine Petrischale. Ein strukturierendes Arbeitsplatte des Dickdarms mit einer kleinen Pinzette aufgesetzt.
- Geschnitten Sie Doppelpunkte in Fragmente (0,2 cm bis 0,3 cm Länge) mit einem sterilen Skalpell. Dieses Fragmentlänge ist optimal, um nicht die Dicke der Kassette nicht überschreiten.
- Holen Sie einen Doppelpunkt Segment mit kleinen Pinzetten (Abbildung 2A). Setzen Sie einen Doppelpunkt Segment in eines der Kunststoff hervorstehenden Spitzen der orientierte Paraffin einbetten Kassette mit kleinen Pinzetten (Abb. 2 b).
- Wiederholen Sie den Vorgang (3.2-3.3) mit einem zusätzlichen 3 Doppelpunkt Segmente pro Kassette. Einlegen der Segmente in angrenzenden hervorstehenden Tipps zur Minimierung der Überlappung des Gewebes zu vermeiden
- Dicht schließen der Kassette vorsichtig drücken Sie die vier Kanten (Abbildung 2). Vermeiden Sie, drückte das Gewebe um Gewebeschäden zu vermeiden.
- Legen Sie das Raster in tragenden Kunststoffrahmen. Beschriften Sie den Tragrahmen um die Probe zu identifizieren. Wiederholen Sie für jede biologische Probe.
(4) Gewebe Verarbeitung
- Schalten Sie die automatische Prozessor durch Drücken der Power-Taste (Abb. 3A, 3 b).
- Warm-up für 1 h bis Paraffin Wachs schmelzen zu gewährleisten. Warten Sie, bis das Gerät, dass das Paraffin vollständig geschmolzen ist bestätigt, indem man beobachtet, das Vorhandensein von engagierten Symbol (Abbildung 3).
- Setzen Sie jedes orientierten Kassette (enthält die Gewebeproben) manuell in den Metallkorb zur Verfügung gestellt durch den automatisierten Prozessor (Abbildung 3D). Stellen Sie die Kassetten senkrecht durch Futter sie in der Nähe von einem zum anderen die Korb-Belegung optimieren.
- Schließen Sie den Metallkorb (Abbildung 3E).
- Öffnen Sie den Deckel der Retorte (Abbildung 3F). Die Retorte ist der Ort, wo der Korb in die Maschine eingesetzt wird. Legen Sie den Korb in das eigene Gehäuse des Prozessors (Abbildung 3). Schließen Sie den Deckel der Retorte (Abbildung 3 H).
- Verwenden Sie den Touch-Screen auf dem Instrument Computer Arbeitsprotokoll (Abbildung 3I) definieren. Wählen Sie die Reihenfolge der Lösungen, Timing und Temperatur nach dem Schema in Tabelle 1enthaltenen umgesetzt werden.
- Weisen Sie das Protokoll auf die Retorte mit dem Korb durch Klicken auf die dedizierten Computer-Symbol (Abbildung 3J) ausgeführt werden. Starten Sie das Protokoll, durch Klicken auf die Schaltfläche "Start" (Abbildung 3 L).
- Warten Sie, bis das Instrument am Ende des Protokolls, bestätigt durch die Beobachtung des Vorhandensein des Symbols gewidmet und durch das hören der Alarmton aus der Maschine.
- Öffnen Sie den Deckel der Retorte. Entfernen Sie den Korb aus dem Prozessor (Abbildung 3 M).
(5) Gewebe einbetten
- Schalten Sie die automatisierte Embedder drücken Sie den ein-/Ausschalter (Abb. 4A).
- Warm-up für 1 h bis Paraffin Wachs schmelzen zu gewährleisten. Warten Sie, bis das Gerät, dass das Paraffin vollständig geschmolzen ist bestätigt, durch die Beobachtung der Temperatur das Paraffinbad durch das interne Thermometer des Gerätes angezeigt.
- Manuell übertragen Sie die verarbeiteten Kassetten aus dem Prozessor Korb Embedder Rack. Jedes Rack kann bis zu 32 Kassetten enthalten. (Abbildung 4 b, 4 C).
- Öffnen Sie den wichtigsten Embedder-Deckel (Abbildung 4, 4D, 4E).
- Verwenden des Touchscreens auf dem Instrument-Computer, um den Roboter zu signalisieren-System, das eine Rack wird eingefügt (Abb. 4F).
- Öffnen Sie den Einlass Gehäusedeckel (Abbildung 4). Das Rack in das Einlass-Gehäuse einsetzen. Jedes Embedder kann gleichzeitig bis zu 4 Racks enthalten (Abbildung 4 H, 4I). Schließen Sie den Einlass Gehäusedeckel (Abbildung 4J).
- Verwenden Sie den Touch-Screen auf dem Instrument Computer, den Einbettungs-Vorgang starten nach Tabelle 2 (Abbildung 4 K).
Hinweis: Jedes Rack mit 32 Kassetten dauert 45 min. eingebettet werden. - Warten Sie, bis das Instrument am Ende des Protokolls, bestätigt durch die Beobachtung der Präsenz des Symbols gewidmet (Abbildung 4 L).
- Entfernen Sie den Auslass-Ständer (Abbildung 4 M). Schließen Sie den Deckel der wichtigsten Embedder.
- Entfernen Sie die eingebettete Blöcke (mit Ausrichtung Gitter) aus dem Rack. Übertragen Sie die eingebetteten Blöcke in einer Aufbewahrungsbox Pappe.
(6) Mikrometer-Schnitt
- Schalten Sie die Kühlplatte Mikrotom. Stellen Sie die Temperatur zwischen-8 und-10 ° C.
- Schalten Sie die thermostatischen Wasserbad Mikrotom, mit 2 L destilliertes Wasser. Stellen Sie die Temperatur des Wasserbads zwischen 42-45 ° C.
- Ort das Paraffin eingebettet Blöcke auf der Kühlplatte. Warten Sie mindestens 5 min um die Blöcke, um cool zu ermöglichen.
- Nehmen Sie einen Block von der Kühlplatte und legen Sie sie in das Mikrotom-Block-Halter.
- Legen Sie das Mikrotom Schneiden Dicke bis zu 10 µm. Trim den Block von 6 Mal bei 10 µm Dicke schneiden.
- Ändern Sie die Dicke Einstellung der Mikrotom von 10 µm bis 3 µm. Schnitt 3 µm-Teil für Hämatoxylin und Eosin (H & E) Färbung.
-
Sammeln Sie Abschnitt 3 µm mit einer kleinen Bürste. Setzen Sie im Abschnitt 3 µm im Wasserbad, legte sie sorgfältig auf die Wasseroberfläche, Gewebe Falten zu reduzieren. Sammeln Sie Abschnitt Gewebe aus dem thermostatisch gesteuerte Wasserbad auf einen einzigen Glasobjektträger.
- Wenn nötig, schneiden Sie zusätzliche Abschnitte.
- Beschriften Sie den Objektträger durch das Schreiben der Probenidentifikation.
- Legen Sie die Folien in einem 37 ° C Ofen mindestens 10 min lang.
- Gestelle für sofortige Analysen oder in Aufbewahrungsboxen Glas-Objektträger umgesetzt.
7. Hämatoxylin und Eosin (H & E) Färbung
- Die automatisierte Stainer durch Drücken der Power-Taste einschalten. Lassen Sie die Initialisierung des Roboterarms, durch die Änderung der Ladebalken auf dem Instrument Monitor beobachten.
- Legen Sie die Glas-Folien in Stainer Rack vertikal bis zu 30 Folien einfügen.
- Beschriften Sie das Gestell mit dem entsprechenden Radiofrequenz-Identifikation (RFID) Kunststoff-Tag. RFID-tagging ist ein System der Identifizierung der richtigen Färbung Protokolls in der Stainer Computer geladen.
- Die Stainer stecken Sie Rack. Lassen Sie den Computer automatisch laden und starten der Färbung Protokolls nach der Anerkennung des RFID-Tags.
Hinweis: Das Protokoll für H & E Färbung ist beschrieben in Tabelle 3.
(8) immunhistochemische Färbung
- Durchführen Sie immunhistochemische und Mallory trichrome Färbung als zuvor beschriebenen7.
Ergebnisse
Experimentelle chronischer Kolitis induziert durch wiederholte Gabe von DSS im Trinkwasser ist ein Mausmodell der Darmentzündung sehr ähnlich menschlichen IBD8,9. Abbildung 1 beschreibt die Auswirkungen der DSS Behandlung, einschließlich Doppelpunkt Verkürzung (Abbildung 1A), einen weit verbreiteten Parameter, das Vorhandensein von DSS-induzierte Entzündung und Kolon Expression von Pro-inflammatorischen Genen einschließlich CXCL10 zu erzielen , Tnf und mcp-1 (Abbildung 1 b). Infiltration von Entzündungszellen wurde durch DSS Behandlung, eine Einstellung der Immunantwort in der intestinalen Lamina Propria zeigen, wie durch Cytofluorimetry (Abbildung 1) analysiert erheblich verbessert.
Abbildung 2 zeigt wie Kolon Gewebe geschnitten und in die orientierten Kassetten eingelegt sind. Diese Kassetten sind entworfen, um ein Raster mit extrudierten Tipps, ermöglicht die Einfügung des Gewebes vertikal und mit der richtigen Ausrichtung, d. h., mit dem Lumen in den inneren Teil und die Wand Traktorprofils enthalten (Abbildung 2A, 2 b, 2 C ). Sobald die Kassetten geschlossen sind, wird die Gewebe Orientierung beibehalten, indem die Netze, im Gegensatz zu dem, was mit konventionellen histologischen Kassetten (Abb. 2 b passiert).
Die Gewebe-Verarbeitung erfolgt mit einem automatisierten Prozessor (Abb. 3A-3 M und Tabelle 1), während die Einbettung Prozedur erfolgt mit einer automatisierten Embedder (Abbildung 4A-4 M und Tabelle 2). In der letztgenannten Urkunde ein Roboter sammelt die Kassetten und die richtige Menge an Paraffin verzichtet. Zu guter Letzt sind mit einem Mikrotom, aus jedem Paraffinblock Querschnitte. Die Folien sind dann zur weiteren Analyse bereit.
Abbildung 5 beschreibt die wichtigsten Passagen der automatisierten H & E Färbung (Abbildung 5A-5E und Tabelle 3) und wie die Folien nach H & E Färbung (Abbildung 5F) erscheinen. Abbildung 6 und 7 zeigen, wie die Umsetzung der automatisierten Verarbeitung und Einbettung Protokolle stark erhöhen die Qualität der histopathologischen Analysen der murinen Kolon Exemplare. Der H & E Färbungen der Proben mit der automatisierten Protokolle von unbehandelten Mäusen (Abb. 6A) abgeleitet wurden mit denen von DSS behandelt Mäusen (Abbildung 6 b) verglichen. Histopathologischen Ergebnisse wurden durch die Auswertung der Änderungen verschiedener Parameter auftreten in der Darmschleimhaut, einschließlich der entzündlichen Infiltration, epitheliale Veränderungen und Veränderungen der Schleimhaut Architektur wie beschrieben in Zellen bewertet Tabelle 4. Abbildung 6 zeigt ein Vertreter H & E Färbung eines Kolon Gewebes manuell verarbeitet und in traditionellen Kassetten aufgenommen. In Abbildung 7, die Qualität der murinen Gewebe Vorbereitung und Einbettung, durchgeführt durch automatisierte Instrumente zusätzlich bestätigte IHC beflecken von CD20 und Mallory trichrome Färbung8,9 in Colon Teile der unbehandelten (Abbildung 7A, 7 C) und DSS-behandelt (Abb. 7 b, 7D) Mäuse.
Abbildung 8 beschreibt die praktische Relevanz dieser Methode. Die gleichen Doppelpunkt Proben wurden verarbeitet und entweder manuell oder durch automatische Methoden eingebettet. Jede Probe (entweder das Steuerelement oder DSS behandelt) in 2 gleiche Teile schneiden und parallel mit der manuellen oder automatischen Methoden verarbeitet wurde. H & E Färbung war dann durchgeführt und eine komplette mikroskopischen Auswertung über die pathologische Parameter Adressierung Veränderungen in der Schleimhaut Architektur, Granularität, Immunzelle zu infiltrieren, Dicke Schleimhaut, Drüsen Verdünnung normalerweise bei Darmentzündungen beobachtet, wurden für jede Probe, sowohl für die manuelle und automatisierte Protokoll (Abbildung 8A und Tabelle 4). Die Vorbereitung der Proben mit dem automatisierten Protokoll erlaubt konsequent die Bewertung eines höheren Anteils der histologischen Parameter als die manuelle Methode. Darüber hinaus wurde eine separate Analyse der verschiedenen histologischen Parameter durchgeführt (Abb. 8 b). Die Architektur und die basalen Infiltrat Bewertung waren positiv, vor allem bei unbehandelten Mäusen, die Probenvorbereitung mit der automatisierten Methode betroffen.
Das automatisierte Verfahren für Probe Verarbeitung und Einbettung derzeit für menschliche histopathologischen Analysen verwendet kann für die Analyse der murinen Proben erfolgreich angewendet werden. Qualitativ hochwertige Exemplare werden mit der automatisierten Methode generiert, die die Überlegenheit gegenüber der manuellen Methode bei der Bewertung der Architektur und der basalen immun Infiltrat der murinen Kolon Gewebe zeigt.
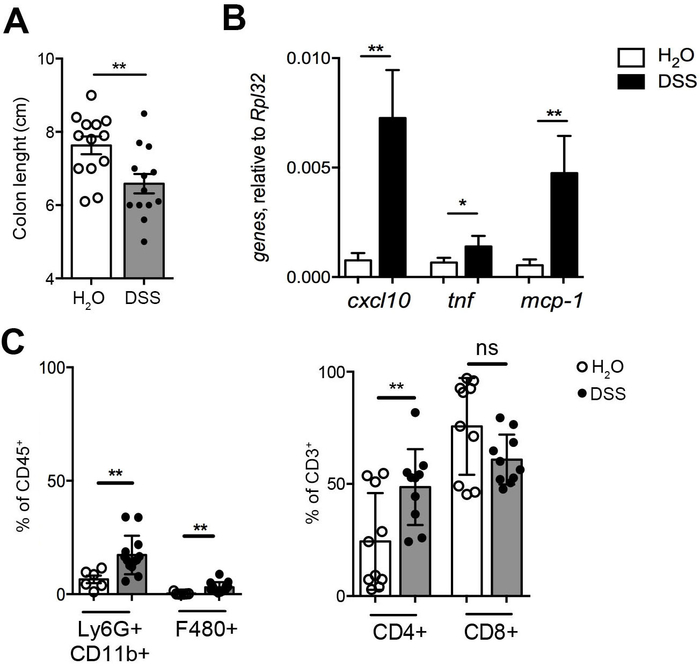
Abbildung 1: Bewertung der chronischen Darmentzündung. (A) Doppelpunkt Längenmessung. (B) Kolon Expression von Pro-inflammatorischen Genen (cxcl10, Tnf, mcp-1) in DSS-behandelt (schwarze Balken, n = 12) und unbehandelten Mäuse (weißer Balken, n = 6). (C) die Immunphänotypisierung der Kolon Lamina Propria in DSS-behandelten Zellen (geschlossen Symbole, n = 12) und unbehandelten Mäusen (öffnen Sie Symbole, n = 6). CD11b + Ly6G + Neutrophile, CD11b + F4 / 80 + Makrophagen (linken), CD4 + und CD8 + T Zellen (rechte Abbildung) Infiltration in Steuerelementen (öffnen Sie Symbole, n = 10) und DSS-behandelten Mäusen (geschlossen Symbole, n = 10). Statistischer Signifikanz wurde berechnet, dass mittels Wilcoxon abgestimmt-Paare Rang t Test angemeldet. p ≤ 0,05 ** p ≤ 0,01. Meine Wert ± SEM werden gemeldet. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Beschreibung der Probenvorbereitung. (A) Instrumente erforderlich für Gewebe Vorbereitung und Bild der orientierte Kassette, komponiert von einer externen Kassette (weiß) und internen Netz mit extrudierten Orientierung Tipps. (B, C) Einfügen von murinen Doppelpunkte in die internen Netze von der Kassette vor (B) und (C) Schließung der Netze. Im Bedienfeld "B dargestellt ist die orientierte Kassette (links) oder in einem traditionellen Kassette (rechts). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Beschreibung der automatischen Verarbeitung. (A, B) automatisiert Prozessor. (C) Symbol beschreibt das richtige Paraffinwachs Schmelztemperatur. (D, E) Einsetzen der Kassette in den Metallkorb (D) und seine Schließung (E). (F, G, H) Einfügen von Metallkorb in der Retorte. (I, J, K) Auswahl des Protokolls Verarbeitung. (L) Ausführung des Protokolls. (M) Entfernung des Korbes bilden die Retorte. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Beschreibung der Einbettung von automatisierten . (A) Bild von der automatisierten Embedder. (B, C) Einfügen von Kassetten im Rack. (D, E) (D) öffnen und schließen (E) des Deckels. (F) Signalisierung an der Maschine das Vorhandensein eines Racks. (G, H) Einfügung des Racks in das Einlass-Gehäuse. (I, J) Schließen des Deckels. (K) Start des Protokolls einbetten. (L) Eröffnung des Outlet-Gehäusedeckel. (M) Entfernung der Zahnstange bilden das Outlet-Gehäuse. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: Beschreibung der automatisierten H & E Stainer. (A) Bild des Diahalters. (B, C) Einfügung des Diahalters in der Maschine. (D) Schließung der Maschine. (E) Start des Protokolls Färbung. (F) Plastiche Bild einer Folie nach Mikrotom schneiden und H & E Färbung. Rechten Seite, H & E Färbung zeigt die Probe Ausrichtung. Bitte klicken Sie hier für eine größere Version dieser Figur.
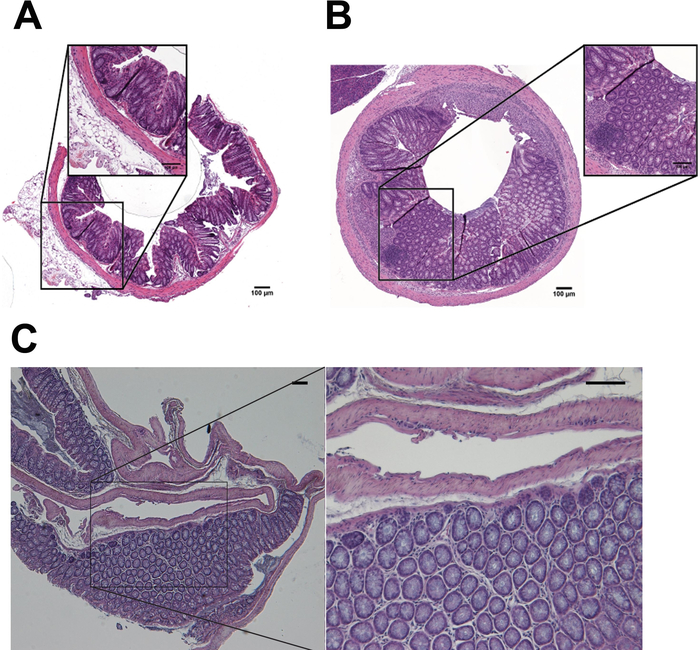
Abbildung 6: H & E Färbungen von Kolon Proben bilden unbehandelte und DSS-behandelten Mäusen. H & E Färbung des unbehandelten (A) und DSS-behandelt (B) Proben vorbereitet (verarbeitet, eingebettet, gebeizt) mit (A, B) automatisiert oder manuell (C) Methoden. Maßstabsleiste = 100 nm. Bitte klicken Sie hier für eine größere Version dieser Figur.
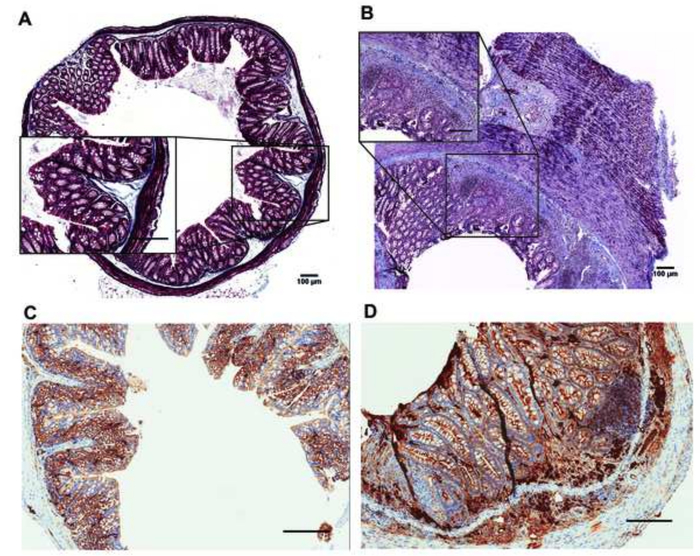
Abbildung 7: Mallory trichrome (A, B) und IHC Färbungen der Infiltration CD20 + Zellen (C, D) der unbehandelt (A-C) und DSS behandelt (B, D) Mäuse. Mallory Färbung: blau, Kollagen, dunkelrosa, Kerne, dunkles Rot, Zytoplasma. Maßstabsleiste = 100 nm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 8: Vergleich zwischen histologischen Analysen mit manuellen und automatisierten Protokolle. (A) insgesamt histopathologischen Parametern bewertbaren in allen Bereichen, die mit dem Handbuch (weiße Balken) oder mit der automatisierten Methode (lila Balken) vorbereitet. (B) Prozentsatz der angegebenen Parameter in den Proben vorbereitet, mit dem Handbuch (weiße Balken) oder mit der automatisierten Methode (lila Balken) im unbehandelten (Plain Balken) oder DSS-behandelten Mäusen (gestrichelte Balken). Statistischer Signifikanz wurde berechnet, dass mittels Wilcoxon abgestimmt-Paare Rang t Test angemeldet. p < 0,05; p < 0,005. Meine Wert ± SEM werden gemeldet. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Reagenz | Zeit (min) | Temperatur (° C) | Druck |
| NBF | 1 | RT | Ambient |
| Äthanol 95 % | 1 | RT | Ambient |
| Äthanol 95 % | 1 | RT | Ambient |
| Äthanol 95 % | 1 | RT | Ambient |
| Absoluter Ethanol | 1 | 45 | Ambient |
| Absoluter Ethanol | 11 | 45 | Ambient |
| Absoluter Ethanol | 30 | RT | Ambient |
| Xylol | 1 | RT | Ambient |
| Xylol | 1 | 45 | Ambient |
| Xylol | 28 | 45 | Ambient |
| Paraffin Wachs | 5 | 65 | Vakuum |
Tabelle 1: Automatisierte Gewebe Verarbeitung Protokoll.
| Aktion ausgeführt durch den Roboter für jede Kassette |
| Eine Kassette aus dem Rack entfernen |
| Identifizieren Sie die Kassette |
| Vorheizen der Form |
| Legen Sie die Kassette auf die vorgewärmte Form |
| Die Menge von Paraffin für die Kassette |
| Die Form abkühlen |
| Lassen Sie das Paraffin erstarren |
| Den erstarrte Paraffinblock aus der Form entfernen |
| Präsentieren Sie den Block zu Qualität Sensoren |
| Platzieren Sie den Paraffinblock in der Ausgabe-Tür |
Tabelle 2: Automatische Einbettung Protokoll.
| Kategorie | Kriterium | Definition | Score-Wert |
| Entzündlichen Zellen infiltrieren | Schwere (Leukozyten Dichte der Lamina Propria Bereich infiltriert bewertet hpf) | Kein Infiltrat | 0 |
| Minimale akute (< 10 %) | 0,25 | ||
| Leichte chronische (10-25 %, vereinzelt Neutrophile) | 0,5 | ||
| Moderate chronische (26 – 50 %) | 0,75 | ||
| Markierte (> 51 %, Dichte infiltrieren) | 1 | ||
| Maße (Ausbau der Leukozyten-Infiltration) | Schleimhaut- | 0,5 | |
| Schleimhaut und submucosal | 0,75 | ||
| Epitheliale Veränderungen | Hyperplasie (Zunahme der Epithelzelle Zahlen in Längsrichtung Krypten, sichtbar als Krypta Dehnung) | Keine Hyperplasie | 0 |
| Minimal (< 25 %) | 0,25 | ||
| Mild (26 – 35 %) | 0,5 | ||
| Mäßig (36 – 50 %, Mitosen im oberen Drittel des Epithels Krypta) | 0,75 | ||
| Markierte (> 51 %, Mitosen in Krypta Epithel Ferne aus Gruft Basis) | 1 | ||
| Becher Zellverlust (Reduktion der Feuerkelch Zellzahlen relativ zur Grundlinie Becher Zellzahlen pro Krypta) | Kein Verlust | 0 | |
| Minimal (< 25 %) | 0,25 | ||
| Mild (26 – 35 %) | 0,5 | ||
| Mäßig (36 – 50 %) | 0,75 | ||
| Markierte (> 51 %) | 1 | ||
| Schleimhaut-Architektur | Ulzeration (epitheliale defekt hinausreichende Muscolaris Schleimhäute) | Keine Geschwüre | 0 |
| Geschwüre | 0,25 | ||
| Granulationsgewebe (Bindegewebe-Reparatur mit neuen Kapillaren, umgeben durch die Infiltration von Zellen, hypertrophisch Bereiche) | Keine Granulationsgewebe | 0 | |
| Granulationsgewebe | 0,25 | ||
| Schleimhaut Dicke und Krypta Tiefe | Keine Verdickung | 0 | |
| Verdickung | 0,5 | ||
| Glanduläre Verdünnung | Keine Verdünnung | 0 | |
| Verdünnung | 0,5 | ||
| Dysplasie | Keine Dysplasie | 0 | |
| Dysplasie | 0,5 | ||
| MAX. PUNKTZAHL | 6 |
Tabelle 3: Automatisierte Färbeprotokoll.
| Aktion ausgeführt durch die Stainer für jede Folie | Reagenz | Zeit (s) | Temperatur (° C) |
| Essicate | 180 | 60 | |
| Essicate | 180 | 60 | |
| Deparaffinize | Xylol | 120 | RT |
| Deparaffinize | Xylol | 120 | RT |
| Hydrat | Ethanol 96 % | 120 | RT |
| Hydrat | Ethanol 96 % | 120 | RT |
| Waschen | Destilliertes wtaer | 240 | RT |
| Fleck Hämatoxylin | Die Carazzi Hämatoxylin | 540 | RT |
| Spülen | Wasser aus dem Wasserhahn | 360 | RT |
| Eosin Fleck | Eosin Y 1 % Aqueos Lösung | 60 | RT |
| Spülen | Wasser aus dem Wasserhahn | 120 | RT |
| Entwässern | Ethanol 96 % | 20 | RT |
| Entwässern | Ethanol 96 % | 20 | RT |
| Entwässern | Absoluter Ethanol | 15 | RT |
| Entwässern | Absoluter Ethanol | 15 | RT |
| Klar | Xylol | 30 | RT |
| Klar | Xylol | 30 | RT |
Tabelle 4: Scoring-System für die Bewertung der Darmentzündung.
Diskussion
Wir nutzen verschiedene automatisierte Schritte bei der Vorbereitung der murinen Gewebe zur histologischen Analyse. Dieses Protokoll bezweckt die Erbringung von technischen Hinweise um die Reproduzierbarkeit und die Standardisierung des gesamten Prozesses, wodurch die Gesamtqualität der histopathologischen Abschlussbewertung zu steigern. Wir realisiert automatisierte Instrumente und Methoden für die Vorbereitung und Einbettung von Geweben, routinemäßig in Pathologie Kern Anlagen für die Erforschung der menschlichen Proben eingesetzt.
Um die mögliche Anwendbarkeit dieser Methode zu demonstrieren, haben wir uns entschieden, eine chronische murine experimentelle Einstellung von Darmentzündungen, DSS-induzierte chronische Kolitis Modell bezeichnet. Diese Einstellung ähnelt der Komplex Krankheitsverlauf beobachtet bei IBD-Patienten erfordern aufwändige histologische Auswertung der die Gewebearchitektur auftreten bei chronischer Darmentzündung, tiefgreifendsten Veränderungen zu untersuchen. Insgesamt könnte die histologische Auswertung dieser Prozesse von erhöhten Probenqualität Vorbereitung profitieren. Um zu beachten, kann dieses Protokoll auf anderen murinen Geweben (z.B. Milz, Lymphknoten, Leber, Gehirn), mit dem einzigen Unterschied angewendet werden, ist, dass die orientierte Kassette für Gewebe ohne ein Lumen nicht benötigt wird.
Die wichtigste Beobachtung war, dass der Rückgang der manuelle Fehler (z.B., die Ausrichtung der Probe) gegeben, die Verwendung von Kassetten mit Gittern und die Beseitigung der Kassette Wiedereröffnung für die Einbettung (eines Schritt häufig durchgeführt während Handbuch (Protokolle), verbessert stark die allgemeine Reproduzierbarkeit der Analyse. Mit dem hier beschriebenen Protokoll ist die Probe erst am Anfang der Vorbereitung manipuliert, wenn der Experimentator das Gewebe in der ausgerichteten Kassetten einfügt. Einmal geschlossen, werden die Kassetten nie wieder geöffnet, damit die Wartung der richtigen Ausrichtung und reduziert manuelle Fehler3,11. Die Standardisierung dieser zwei kritische Schritte verbessert die gesamte Qualität der nachfolgenden Analysen und sank die Zahl der verlorenen oder nicht auswertbare Proben, Probleme, die sowohl die Wiedereröffnung der Kassette oder mit der falschen Ausrichtung der Probe3 verknüpft ,11.
Auch konnten wir ein komplexes biologisches Ereignis z. B. Fibrose (Abbildung 7), die sehr oft unterschätzt in murinen Modellen der experimentellen Darmentzündungen durch die Umsetzung des Protokolls automatisierte Auswertung. Beim Aufbau des Protokolls standardisierte wir streng technische Details wie die Fixierzeit, die wir realisiert, 24 h zur Vermeidung von Gewebeveränderung nicht überschreiten darf. Auf diese Weise konnten wir die Qualität der nachfolgenden immunhistochemische Analysen erhalten.
Das automatisierte Verfahren verbessert die Bewertung dieser Parameter zur Veränderung der die Gewebearchitektur, vor allem in den unbehandelten Mäusen assoziiert. In der Tat ist der korrekte Vergleich eines pathologischen Gewebes mit einem gesunden Gegenstück von entscheidender Bedeutung für die abschließende Beurteilung des experimentellen Modell3.
Bezug auf die Verarbeitung von Gewebe testeten wir verschiedene Protokolle in der automatisierten Prozessor, die im Labor ausgeführt werden. Das hier beschriebene Protokoll gab solide und sehr konsistente Ergebnisse. Eine Zeit lang für das Protokoll reali- Da murine Proben menschlichen kleine biopsic Exemplare in der Größe vergleichbar waren, eine kürzere Protokoll genügte, Murine (Darm-, in diesem Fall) zu verarbeiten Gewebe. Schließlich reduziert das völlig automatisierte Verfahren der experimentellen Gesamtzeit. Von Beginn der Verarbeitung, das Mikrotom schneiden und die Scheiben Vorbereitung haben wir berechnet, dass die Gesamtzeit 5 h. Im Gegenteil, kann abhängig von den technischen Fähigkeiten des Betreibers, die Vollendung des dieselben Protokolle manuell erfordern mehr als doppelt so viel Zeit, vor allem während der Verarbeitung und die Einbettung. Ein Limit der Technik ist, dass es erfordert automatisierte Prozessoren und Embedder durchgeführt werden, um im Labor sein.
Zusammenfassend glauben wir, dass die Umsetzung dieser automatisierten Protokolle die Arbeit der translationalen Forscher Umgang mit murinen experimentelle Modelle menschlicher Erkrankungen erheblich verbessern könnte.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken der Abteilung für Pathologie Klinikum IRCCS Poliklinik, Mailand für den technischen Support, IEO Animal Facility für Unterstützung in der Tierhaltung.
Materialien
| Name | Company | Catalog Number | Comments |
| Absolute Ethanol anhydrous | Carlo Erba | 414605 | reagent |
| Absolute ETOH | Honeywell | 02860-1L | reagent |
| Aluminium Potassium Sulfate | SIGMA | A6435 | reagent |
| Aniline Blue | SIGMA | 415049 | reagent |
| carbol Fuchsin | SIGMA | C4165 | reagent |
| CD11b (clone M1/70) | TONBO biosciences | 35-0112-U100 | antibody |
| CD20 IHC (clone SA275A11) | Biolegend | 150403 | antibody |
| CD3 (17A2) | TONBO biosciences | 35-0032-U100 | antibody |
| CD4 (GK1.5) | BD Biosciences | 552051 | antibody |
| CD45.2 (clone 104) | BioLegend | 109837 | antibody |
| CD8 (53-6.7) | BD Biosciences | 553031 | antibody |
| Citrate Buffer pH 6 10x | SIGMA | C9999 | reagent |
| Dab | Vector Laboratories | SK-4100 | reagent |
| DPBS 1x | Microgem | L0615-500 | reagent |
| DSS | TdB Consultancy | DB001 | reagent |
| EDTA | SIGMA | E9884 | reagent |
| EnVision Flex Peroxidase-Blocking Reagent | DAKO | compreso in GV80011-2 | |
| EnVision Flex Substrate | DAKO | compreso in GV80011-2 | |
| EnVision Flex/HRP | DAKO | compreso in GV80011-2 | |
| EnVision Flex+ Rat Linker | DAKO | compreso in GV80011-2 | |
| Eosin | VWR | 1.09844 | reagent |
| F4/80 (clone BM8) | BioLegend | 123108 | antibody |
| Formalin | PanReac | 2,529,311,215 | reagent |
| glacial acetic acid | SIGMA | 71251 | reagent |
| Goat-anti-Rat-HRP | Agilent DAKO | P0448 | antibody |
| Haematoxylin | DIAPATH | C0303 | reagent |
| LEICA Rotary microtome (RM2255) | Leica | RM2255 | equipment |
| Ly6g (clone 1A8) | BD Biosciences | 551459 | antibody |
| Mercury II Oxide | SIGMA | 203793 | reagent |
| Omnis Clearify Clearing Agent | DAKO | CACLEGAL | reagent |
| Omnis EnVision Flex TRS | DAKO | GV80011-2 | reagent |
| Orange G | SIGMA | O3756 | reagent |
| Paraffin | Sakura | 7052 | reagent |
| Peloris | LEICA | equipment | |
| Percoll | SIGMA | P4937 | reagent |
| RPMI 1640 without L-Glutamine | Microgem | L0501-500 | reagent |
| STS020 | Leica | equipment | |
| Tissue-Teck Paraform Sectionable Cassette | SAKURA | 7022 | equipment |
| Tissue-Tek Automated paraffin embedder | Sakura | equipment | |
| Xylene | J.T.Baker | 8080.1000 | reagent |
Referenzen
- Gibson-Corley, K. N., et al. Successful Integration of the Histology Core Laboratory in Translational Research. Journal of histotechnology. 35, 17-21 (2012).
- Olivier, A. K., et al. Genetically modified species in research: Opportunities and challenges for the histology core laboratory. Journal of histotechnology. 35, 63-67 (2012).
- Gibson-Corley, K. N., Olivier, A. K., Meyerholz, D. K. Principles for valid histopathologic scoring in research. Veterinary pathology. 50, 1007-1015 (2013).
- Stolfi, C., et al. Involvement of interleukin-21 in the regulation of colitis-associated colon cancer. The Journal of experimental medicine. 208, 2279-2290 (2011).
- Begley, C. G., Ellis, L. M. Drug development: Raise standards for preclinical cancer research. Nature. 483, 531-533 (2012).
- Peters, S. R. A Practical Guide to Frozen Section Technique. , New York, N.S.N.Y. (2010).
- Rosai, J. Rosai and Ackerman's Surgical Pathology. , Elsevier. (2011).
- Blumberg, R. S., Saubermann, L. J., Strober, W. Animal models of mucosal inflammation and their relation to human inflammatory bowel disease. Current opinion in immunology. 11, 648-656 (1999).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature. 2, 541-546 (2007).
- Kaser, A., Zeissig, S., Blumberg, R. S. Inflammatory bowel disease. Annual review of immunology. 28, 573-621 (2010).
- Cribiù, F. M., Burrello, C., et al. Implementation of an automated inclusion system for the histological analysis of murine tissue samples: A feasibility study in DSS-induced chronic colitis. European Journal of Inflammation. 16, 1-12 (2018).
Erratum
Formal Correction: Erratum: Using Robotic Systems to Process and Embed Colonic Murine Samples for Histological Analyses
Posted by JoVE Editors on 2/03/2019. Citeable Link.
An erratum was issued for: Using Robotic Systems to Process and Embed Colonic Murine Samples for Histological Analyses. An author affiliation was updated.
The affiliation for Claudia Burrello and Federica Facciotti was updated from:
Department of Experimental Oncology, European Institute of Oncology
to:
Department of Experimental Oncology, IEO, European Institute of Oncology IRCCS
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten