Method Article
Cell-based Assay учиться антитела опосредованной Тау Распродажа по Микроглия
В этой статье
Резюме
Здесь мы описываем на основе ячеек пробирного чтобы количественно оценить Тау поглощение микроглии с целью создания исследуемого инструмент лучше характеризуют механизмы действия антител анти Тау.
Аннотация
Болезнь Альцгеймера (AD) является прогрессивным нейродегенеративных состояние, в котором объединяются Тау и амилоидные белки накапливаются в мозг, вызывая нейрональных дисфункции, которая в конечном итоге приводит к когнитивными. Hyperphosphorylated Тау агрегатов в нейронах, что вызывают большую часть патологии, связанные с AD. Эти агрегаты предполагается, что будет выпущен в внеклеточной отсек и занимают соседние здоровые нейронов где они побудить далее Тау агрегации. Этот «китовая птичка как» распространение могут быть прерваны антитела способны привязки и «нейтрализации» внеклеточной Тау агрегатов, как показано в доклинических мыши модели AD. Одной из предлагаемых механизмов, которые терапевтических антител уменьшить патологии является антитела опосредованной поглощения и распродажа патологических форм агрегированных Тау, микроглии. Здесь мы описываем количественных на основе ячеек анализа для оценки поглощения Тау микроглии. Этот assay использует мышь Микроглии клеток линии БВ-2, позволяет высокая специфичность, низкой изменчивости и средней пропускной способности. Данные, полученные с этот assay может способствовать лучше характеристика антитела анти Тау эффекторных функций.
Введение
Болезнь Альцгеймера (AD) это прогрессивный нейродегенеративных состояние характеризуется конформационные изменения и самостоятельной сборки пептида и Тау белка амилоида β в патологических агрегаты. Нормальный растворимый β амилоида пептид преобразуется в олигомерных и фибриллярного амилоида β, хотя аномально фосфорилированных Тау накапливается олигомеров и нейрофибриллярных клубков1,2. Эти агрегаты белка причиной нейрональных смерти, приводит к потери памяти и последующего постепенного когнитивными. Другие факторы, включая непроизводственной neuroinflammation и снижение способности очистить смятых протеинов, могут усилить и ускорить заболевания. В настоящее время стратегии вмешательства против AD-основном симптоматическая облегчение, но нет Болезнь модифицирующие лечения или профилактики.
Все больше фактов предполагает ключевую роль hyperphosphorylated Тау агрегатов в патологии AD. В его не патологическое состояние Тау является изначально развернулось белок, который связывается с микротрубочками и способствует их сборку в нейрональных цитоскелета. Когда Тау становится hyperphosphorylated, он отсоединяется от цитоскелета и кластеров в Тау агрегаты в нейронах, которые полагают, вызывают большую часть патологии, связанные с AD3. Агрегированные Тау начинает накапливаться сначала внутриклеточно, но как болезнь прогрессирует, то предполагается, выйдет из пострадавших нейронов во внеклеточное пространство, из которого он может быть take up прилегающих или синаптически подключенных здорового нейронов в» китовая птичка как образом». После того, как внутреннюю, Тау агрегатная вызывает дальнейшие Тау агрегации через шаблонного конформационные изменения4.
Согласно этой гипотезе терапии, способных прерывая Тау посева может замедлить или обратить вспять курс Тау опосредованной нейродегенеративных заболеваний. В поддержку этого мышей сделал восприимчивыми к Таупатия генетической мутации и пассивно вводили с антитела анти Тау показывают снижение Тау патологии и улучшение когнитивных функций5,6,7,8 ,9. Однако механизмы, которыми терапевтических антител уменьшить патологии по-прежнему остаются недостижимой.
Одной из предлагаемых механизмов является антитела опосредованной поглощения и распродажа патологических агрегированных форм Тау, микроглии, резидентов иммунных клеток мозга. Недавние публикации предполагают, что микроглии может эффективно усвоить и ухудшить патологических Тау видов, и эта способность усиливается антитела анти Тау через Fc зависимых механизма с участием ФК рецепторов, выраженные на поверхности Микроглия и рецептор опосредованного фагоцитоза10,11. Эти данные определяют микроглии как потенциально важных эффекторов терапевтических антител.
Мы опишем здесь на основе ячеек пробирного чтобы количественно оценить Тау поглощение микроглии. Данные, полученные с этот assay может помочь определить механизмы действий антител анти Тау, таким образом представляя полезным инструментом для продвижения анти Тау антитела для дальнейших шагов по их развития в качестве возможного лечения AD.
протокол
1. БВ-2 клетки культуры
Примечание: Ручка БВ-2 клетки под 2-го уровня биобезопасности сдерживания. БВ-2 клеточная линия производит запечатанная рекомбинантных ecotropic ретровируса (способных инфицировать мышиных клетки только)12; такие вирусы известны их в vitro преобразование способности и в естественных условиях онкогенной потенциал.
- Культура БВ-2 клетки в высокой глюкозы Дульбекко изменение орел среднего (DMEM) с 10% плода бычьим сывороточным (ФБС), пенициллин 100 ед/мл, 100 мкг/мл стрептомицина и 2 мм L-глютамин (именуемый культивирования средних теперь) дополнены заполнения ячеек в 4 x 104 клеток/мл.
- Поддержания культур в атмосфере увлажненные 5% CO2 при 37 ° C.
Примечание: клетки растут слабо прилагается и во взвешенном состоянии.
2. этикетка рекомбинантных Тау агрегатов с рН чувствительных Люминесцентная краска
Примечание: Тау агрегаты были подготовлены как описано в Apetri и др. 13 с той разницей, что не Тиофлавин Т (ThT) был добавлен в буфер реакции. Агрегированные образцы были собраны в 1,5 мл пробирок. Заключительном флуоресцирования сигнала была проверена путем смешивания 118 мкл пример бассейн с 12 мкл раствора ThT 50 мкм. Агрегаты были отделены центрифугированием агрегации реакционную смесь на 20000 x g за 1 час при 4 ° C. Супернатант был проанализирован SEC-МЭЛС подтвердить, что все мономерных Тау был преобразован в агрегатах. Пеллеты (Тау агрегатов) были оснастки заморозить и хранить в холодильнике при температуре-80 ° C.
- Ресуспензируйте Тау агрегатов в буфере бикарбоната натрия 0,1 М (NaHCO3) при рН 8,5 до концентрации 1 мг/мл (~ 20 мкм).
Примечание: Концентрация Тау агрегатов основывается на концентрации первоначального мономеров, оцениваться поглощение Тау мономеров в 280 Нм, используя коэффициент вымирания 0.31 mLmg-1см-1. - Sonicate ресуспензированы агрегатами с помощью зонда sonicator при сохранении на льду во избежание перегрева.
- Используйте амплитудой 65% (с sonicator питания 250 Вт).
- Выполнять 8 импульсы 3 s с интервалами 15 s между импульсами, чтобы избежать перегрева.
- Подготовьте 8,9 мм раствор красителя (отныне ссылку как краситель рН) рН чувствительных в диметилсульфоксида (ДМСО) следуя инструкции производителя.
Примечание: Всегда готовить свежий раствор и использовать его только на тот день, когда она готова. - Добавьте 10 моль красителя на моль белка к окончательной краситель концентрации 0,2 мм.
- Смешайте нежно закупорить вверх и вниз.
- Инкубируйте реакционную смесь на 45-60 минут при комнатной температуре, в защищенном от света.
- В то же время соберите сшитого декстрана гель обессоливания столбец, следуя инструкциям производителя.
- Сбалансировать столбец с 25 мл 0,1 М NaHCO3 буфера рН 8,5 содержащие 3% ДМСО. Слейте через поток.
- Добавьте продукт Тау агрегатная маркировки реакции к столбцу в суммарный объем 2,5 мл. Если образец менее чем 2,5 мл, добавьте буфер до тех пор, пока общий объем 2,5 мл достигается.
- Пусть образца введите Упакованные гель полностью, выбросьте потока через.
- Элюировать с 3,5 мл 0,1 М NaHCO3 буфера рН 8,5 содержащие 3% ДМСО и собирать элюата в 4 эквивалентные фракций в 2 мл пробирок.
- Определите концентрацию белка 4 фракций, bicinchoninic кислоты (BCA) анализа.
- Помечены белка Храните в морозильной камере-20 ° C.
3. поглощение Assay с активированной флуоресценции клеток сортируя (FACS) считывания
-
День 1 – семя клетки
- Мыть БВ-2 клетки в колбу, удалив культивирования средних и добавление 1 x фосфат амортизированное saline (PBS).
Примечание: Стиральная объем будет меняться в зависимости от размера ячейки настой используется. Например для T175 колбу, мыть с 10 мл ПБС. - Вынуть колбу PBS и отсоединение клетки путем инкубации с трипсина Этилендиаминтетрауксусная кислота (ЭДТА) 0,05% при 37 ° C и 5% CO2 , до тех пор, пока клетки оторваться от колбу (примерно 5 минут).
Примечание: Объем трипсина ЭДТА 0,05% зависит от размера ячеек настой используется. Например для T175 колбу, используйте 2 мл 0,05% трипсина ЭДТА. - Ресуспензируйте клетки в культивировании среднего, закупорить вверх и вниз, три-пять раз.
Примечание: Объем культивирования среднего варьируется в зависимости от размера ячейки настой используется и, таким образом, общее количество клеток в колбу. Например для T175 колбу, используйте 8 мл культивирования среднего. - Подсчитать ячейки и создайте суспензию клеток с конечной концентрации 1 х 105 клеток/мл в культурной среде, содержащей 200 мкг/мл гепарина.
- Пластина 250 мкл суспензии клеток (2,5 х 104 клетки) за хорошо в 96-луночных тканевой культуры плоской нижней плиты.
- Инкубируйте пластины на ночь при 37 ° C и 5% CO2.
- Мыть БВ-2 клетки в колбу, удалив культивирования средних и добавление 1 x фосфат амортизированное saline (PBS).
-
День 1 – готовить Immunocomplexes
- Оттепель рН краситель Тау на льду.
- Подготовка 65 мкл на состояние 500 Нм раствора рН краситель Тау агрегатов в среде свободной от сыворотки (УЛП) (высокая глюкозы DMEM дополнена 100 ед/мл пенициллин, стрептомицин 100 мкг/мл и 200 мкг/мл гепарина).
- Подготовка антител разведений в 65 мкл УЛП и в концентрации двойной последний. Mix рН краситель Тау агрегатов и антител в 96-ну u-днище. Окончательный объем в условие теперь составляет 130 мкл и концентрация агрегатов краситель Тау рН 250 Нм. Уплотнение пластину разрежения и инкубировать на ночь в 37 ° C.
-
День 2 – Immunocomplexes поглощения
- Удаление культивирования среднего от BV-2 клетки. Вымойте клетки один раз с 100 мкл комнатной температуре ПБС.
- Передать 125 мкл immunocomplexes клетки, с помощью многоканальных дозаторов. Инкубируйте клетки с immunocomplexes за 2 ч при 37 ° C и 5% CO2.
- Удалите средство инкубации из клеток и выбросьте его. Вымойте клетки один раз с 100 мкл комнатной температуре ПБС.
- Удаление ПБС и лечить клетки с 50 мкл трипсина ЭДТА 0,25% для 20 минут при 37 ° C и 5% CO2.
- Добавить 200 мкл культивирования среды и Ресуспензируйте, хорошо закупорить вверх и вниз, чтобы отсоединить клетки. Клетки перехода к 96-Ну U-нижней плиты. Центрифуга пластины на 400 x g 5 мин при 4 ° C.
- Установите пластину на льду, удалить культивирования клетки средних и мыть дважды, resuspending клетки окатышей в 150 мкл лед холодной ПБС. Центрифуга пластины на 400 x g 5 мин при 4 ° C.
- Клетки на льду, удалить добавил 1 x PBS и мыть их, resuspending клетки окатышей в 150 мкл буфера холодной СУИМ (ПБС, 0,5% бычьим сывороточным альбумином (БСА), 2 мм ЭДТА). Центрифуга пластины на 400 x g 5 мин при 4 ° C.
- Положите клетки на льду, удалить добавленные СУИМ буфера и Ресуспензируйте клетки в 200 мкл холодной СУИМ буфера.
- Анализировать образцы сразу СУИМ, приобретение 2 х 104 события в ворота живых клеток (см. шаг 4.1).
4. СУИМ анализ
Примечание: Обратитесь к рис 1 для стробирования стратегии.
- С помощью области вперед точечной (FSC-A) против стороны точечной области плотности (SSC-A), ворота на живые клетки, за исключением события с более низким уровнем вперед точечной (то есть, мусор и мертвые клетки).
- В популяции живых клеток, используйте FSC-A против вперед разброс высота (FSC-H), чтобы исключить Дуплеты ячейку и агрегатах. Это ворота синглет.
- С помощью событий в ворота синглет, генерировать рН краска один параметр Гистограмма.
- Определите интенсивность средняя флуоресценции. Определите, что процент положительных клеток рН краситель Тау, исключив отрицательные клетки как определяется с использованием только управления БВ-2.
5. Immunocomplexes поглощение с микроскопии считывания
-
День 1 – семя клетки
- Подготовка клетки БВ-2, как описано в шагах 3.1.1, 3.1.2 и 3.1.3.
- Подсчитать ячейки и Ресуспензируйте их в культивировании среднего до конечной концентрации 104 клеток/мл.
- Пластина 150 мкл суспензии клеток (1,5 х 103) за хорошо в поли D-лизин покрытием Черный 96-луночных пластины с четкой с плоским дном.
- Инкубируйте пластины при 37 ° C и 5% CO2 в течение 48 часов.
-
День 3 – готовить Immunocomplexes
Примечание: Мягкий sonication помечены Тау агрегатов до инкубации с антителом, была исполнена улучшить результаты микроскопии.- Оттепель рН краситель Тау на льду и sonicate с помощью зонда sonicator при сохранении на льду. Используйте амплитудой 15% (sonicator мощность 250 Вт). Выполните 30 импульсов 2 s и s ждать 20 между импульсами.
- Подготовка 65 мкл на состояние 500 Нм раствора рН краситель Тау агрегатов в УЛП.
- Разбавьте антитела в 65 мкл к концентрации двойной последний УЛП. Mix рН краситель Тау агрегатов и антител в 96-ну u-днище. Окончательный объем в условие теперь составляет 130 мкл и концентрация агрегатов краситель Тау рН 250 Нм. Уплотнение пластину разрежения и инкубировать на ночь в 37 ° C.
- Удаление средних от пластины и ячейки и заменить 150 мкл культивирования среды с 200 мкг/мл гепарина. Инкубируйте пластины на ночь при 37 ° C и 5% CO2.
-
День 4 – Immunocomplexes поглощения
- Удаление культивирования среднего из клеток, БВ-2. Передать 125 мкл immunocomplexes клетки, с помощью многоканальных дозаторов.
- Инкубируйте клетки с immunocomplexes за 1 час и 45 минут при 37 ° C с 5% CO2.
Пятно клеточных ядер с ДНК конкретных краситель и кислой органеллы с зондом, которая выборочно пятна низкого pH сотовой отсеков. Инкубируйте 15 мин при 37 ° C с 5% CO2клетки.
Примечание: Разбавьте краски в целях обеспечения УЛП. - Помощью клеток изображений с высоким содержанием скрининг конфокальный системы. Установите температуру до 37 ° C и 5% CO2. Для высокого качества изображения использовать объектив погружения воды 63 X и приобрести 0,5 мкм плоскостей (20 на Z-стека) одного образа поля.
Результаты
Агрегированные рекомбинантных Тау ковалентно помечены рН чувствительных зеленый краситель. Этот краситель резко увеличивает его флуоресценции после его интернализации в кислой органеллы, тем самым позволяя внутриклеточных количественной оценки. Приклеенные этикетку Тау агрегатов инкубировали с анти Тау моноклональных антител. В частности мы использовали химерных версию CBTAU-28.1 (регион ФК IgG1 мыши). Это человеческое антитело привязывается к N-терминала Вставка региона Тау и способны связывать в пробирке создан Тау фибриллами13. В этот assay мы также протестировали сродство улучшенная версия CBTAU-28,1 – dmCBTAU-28.1. ВСБ фрагменты CBTAU-28.1, в родительский и высокоспецифичные мутант формат, и IgG1 мыши изотипа управления были использованы в качестве контроля.
BV-2 клетки инкубировали с предварительно сформированных immunocomplexes или агрегируются только на два часа в присутствии гепарина для блокирования поглощения антитела независимые Тау Тау. После инкубации клетки были trypsinized для удаления Тау, привязан к внеклеточным мембраны и были проанализированы для поглощения Тау проточной цитометрии. Как мы недавно описал13, мы наблюдали что поглощение варианты повышен CBTAU-28,1 Тау в клетках БВ-2 в зависимости от дозы. Поглощение было ФК опосредованной, поскольку CBTAU-28,1 Fab фрагментов не увеличивают поглощение базальной Тау (рис. 2). Кроме того высокое сродство антитела dmCBTAU 28,1 опосредованной Тау поглощения в БВ-2 клетки в большей степени, чем антитела одичал типа (рис. 2).
Антитела опосредованной Тау поглощения и локализации Тау агрегатов в endolysosomal отсеке был подтвержден confocal микроскопии (рис. 3) где кислой сотовой отсек был окрашенных с помощью селективного зонда для низкого pH органеллы. Внутриклеточные puncta рН зеленый краситель помечены Тау агрегатов наблюдались внутри клетки, которые инкубировали с CBTAU-28.1. Кроме того внутриклеточный Тау агрегаты часто colocalized с низким рН отсека селективного красного красителя таким образом предлагая присутствие Тау агрегатов в кислой органеллы. CBTAU-28,1 Fab фрагментов не увеличивают поглощение Тау, снова указывающее механизмом Fc рецептор опосредованного интернализации (рис. 3).
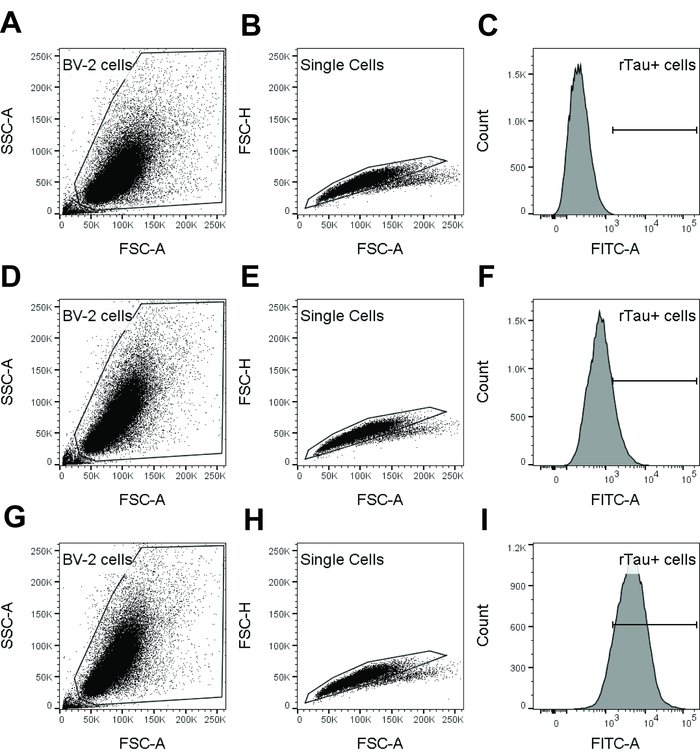
Рисунок 1: стробирования стратегия используется в поток cytometry анализ для выявления Тау интернализации клетками БВ-2. Образец данных из БВ-2 только управления (A-C), изотипа управления (D-F) и dmCBTAU 28,1 (G-я) показано. Популяции клеток БВ-2 был воротами на участке плотность SSC-A против FSC-A, за исключением мусор и мертвые клетки (А, D, G). BV-2 клетки были затем Далее закрытого на участке плотность FSC-A против FSC-H исключить Дуплеты клеток и агрегатов (B, E, H). Одноячеистый ворота был использован для создания гистограммы один параметр краситель (FITC в этих результатах представительных) рН (C, F, я) и определения интенсивности флуоресценции геометрическое среднее. Кроме того процент рН краситель Тау позитивных клеток было рассчитано, исключая отрицательные клетки как определяется с использованием только управления БВ-2. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: CBTAU-28,1 опосредует поглощение Тау агрегатов в клетки микроглии БВ-2. Агрегированные рекомбинантных Тау ковалентно маркировку с зеленой флуоресценцией рН чувствительных краситель и инкубировали с помощью мыши химерных версии человека антитела анти Тау CBTAU-28.1, его сродство Улучшенный формат, dmCBTAU-28.1, соответствующий Fab фрагментов, антитело управления изотипа IgG1 мыши или нет антител (Тау агрегаты только). Immunocomplexes впоследствии инкубировали с БВ-2 клетки на два часа в присутствии гепарина блокировать антитела независимые Тау поглощения. Освоение immunocomplexes был оценен проточной цитометрии и выражена как геометрическое (ГМ) интенсивность флуоресценции (A) или процент положительных Тау (Тау +) клетки (B). Планки погрешностей в (A) указать стандартное отклонение двух независимых экспериментов, а (B) показывает один эксперимент. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
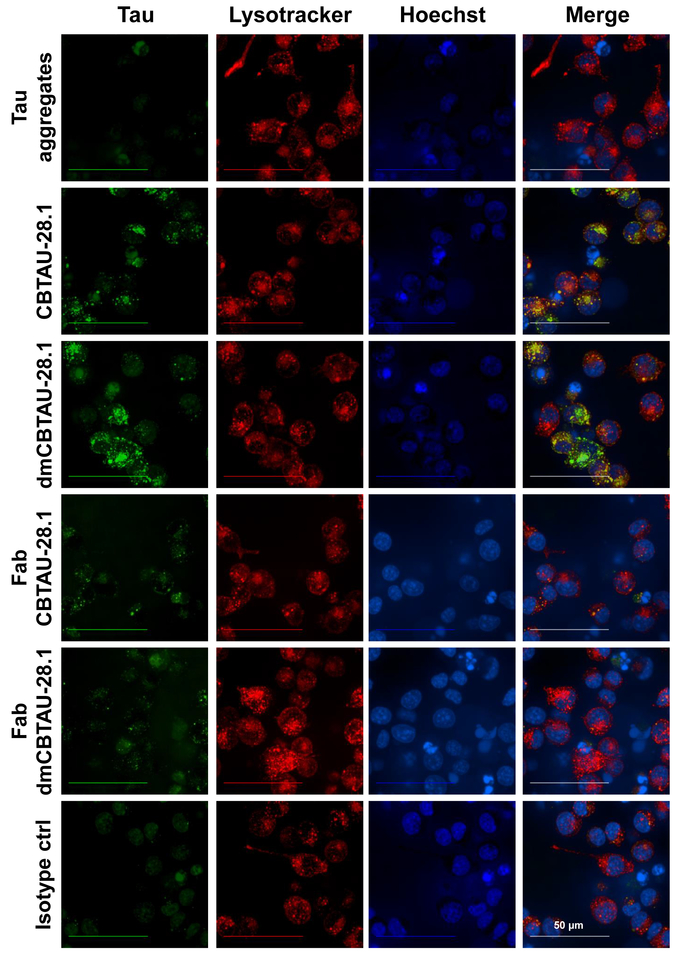
Рисунок 3: Тау агрегаты внутреннюю БВ-2 клетки и локализовать в кислой клеточных органелл. Предварительно Тау антитела immunocomplexes инкубировали с БВ-2 клетки на два часа в присутствии гепарина блокировать антитела независимые поглощения. После инкубации ядер окрашивали ДНК конкретного синий краситель и кислой сотовой отсек с низким рН отсека селективного красного красителя. Клеток показали внутриклеточных puncta помечены Тау агрегатов (зеленый) внутри клетки, которые инкубировали с CBTAU-28,1 и dmCBTAU-28.1, но не с изотипа управления. Кроме того внутриклеточный Тау агрегаты часто colocalized с красной краски (желтый), таким образом предлагая присутствие Тау агрегатов в отсеке кислой сотовой. CBTAU-28,1 Fab фрагментов не увеличивают поглощение Тау, указывающее механизмом Fc рецептор опосредованного интернализации. Образы представляют собой прогнозы максимальная интенсивность 20 самолетов Z-стека (0,5 мкм самолеты) приобретены с целью погружения воды 63 X. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Микроглии, иммунные клетки мозга-резидентов, недавно были признаны важными игроками в антитела опосредованной терапевтические подходы для tauopathies10,11. Антитела опосредованной Тау Распродажа по микроглии, а также блокирует поглощение нейронов9, ингибирование или дестабилизации фибриллярных формирования13,14 и распродажа инактивируемых фибриллами через лизосомальных все пути15, могли бы способствовать эффективности антитела анти Тау, наблюдается в мышиной модели Таупатия5,6,,78,9.
Мы описали здесь на основе ячеек пробирного чтобы количественно оценить Тау поглощение микроглии с целью создания исследуемого инструмент лучше характеризуют механизмы действия антител анти Тау.
Этот assay, взято из фанка и др. 11, использует БВ-2 клетки, которые являются увековечен мышиных Микроглии клеток. Хотя они не могут полностью по сравнению с первичной Микроглии клеток, они оснащены многие из характеристик первичных микроглии, включая способность надежно фагоцитировать значения и Тау фибриллами11,16,17 ,18,19. Кроме того они показали воспроизводимое поведение в vitro который сделал их хорошо подходит для анализа развития и количественных исследований, требующих минимальной экспериментальной изменчивости. Кроме того увековечен клеточных линий позволяют более пробирного высокую пропускную способность и устранить необходимость для жертвоприношения животных, по сравнению с использованием первичных микроглии.
Тау агрегатов, которые мы использовали в этом assay были получены с помощью высоко воспроизводимые в vitro агрегации описанные что мы недавно13и показать, аналогичными морфологии для парных винтовой нитей (PHFs), изолированных от мозги AD пациентов. Хотя мы не наблюдали любые неожиданные результаты, которые возможно были вызваны Тау приверженность агрегатов в пластиковых или стеклянных поверхностей, использование агрегатов стабильной и хорошо характеризуется Тау играет важную роль в воспроизводимость этот assay.
Другой аспект, который значительно способствовали пробирного воспроизводимость был плотность клеток. Число ячеек на хорошо описано в протоколе представляют плотность оптимальный клеток в описанных условиях.
По-разному чем фанк и др. 11 описал, мы помечены Тау агрегатов с рН чувствительных краски, что значительно увеличивает его флуоресценции после интернализации в кислой органеллы, что позволило внутриклеточные количественной оценки. Это, вместе с Пищеварение трипсина поверхности связаны immunocomplexes и/или Тау, гарантии, что флуоресценции сигнал измеряется проточной цитометрии является результатом Тау поглощения, вместо того, чтобы привязки на клеточной поверхности. Кроме того использования рН чувствительных краситель облегчает обнаружение интернализированных Тау агрегатов в микроскопии экспериментов без необходимости переваривания поверхности связаны immunocomplexes/Тау агрегатов, которые будут затем требуется повторно гальванических клеток и восстановления.
Мы также оптимизировали микроскопии считыванию нашего анализа, по сравнению с того, что ранее было описано11, с использованием высокоселективных краситель для кислых органеллы в наших экспериментах микроскопии, которые позволили нам не только для подтверждения антител опосредованной Тау поглощения, но и локализации Тау агрегатов в endolysosomal отсеке.
Assay, которую мы разработали, имеет оптимальную специфику, которая приводит к хорошее экспериментальной окно, позволяя строгого разделения между положительным и отрицательным образцы. Интересно, что assay косвенно обнаруживает различия в сродство антитела таким образом представляет собой мощный инструмент для исследования антител анти Тау эффекторных функций.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы хотели бы поблагодарить Альберто Carpinteiro Соареш за его ценную техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| BV-2 cells | ICLC Interlab Cell Line Collection | ATL03001 | |
| Phosphate Buffered Saline (PBS) (1x) | Gibco | 10010-015 | |
| Trypsin-EDTA 0.05% | Gibco | 25300-054 | |
| DMEM 4.5 g/dL glucose | Gibco | 41966-029 | |
| Fetal Bovine Serum | Gibco | 10091-148 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| L-Glutamine 200 mM | Lonza | 17-605E | |
| EasYFlask | Nunc | 156499 / 159910 | |
| pHrodo Green STP ester | Life Technologies | P35369 | |
| Sodium Bicarbonate pH 8.5 100 mM | |||
| DMSO | Sigma | D2650-100ml | |
| PD10 columns | GE Healthcare | 17-0851-01 | |
| BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Greiner CELLSTAR multiwell culture plates | Greiner | 665180 | |
| Falcon 96-Well Assay Plates | Falcon | 353910 | |
| Heparin | Sigma | H3393-50KU | |
| Trypsin-EDTA 0.25% | Sigma | T4049-100ml | |
| BSA | Sigma | A7030-100G | |
| EDTA 0.5 M, pH8 | |||
| FACS Canto II | BD | ||
| Hoechst 33342 Solution (20 mM) | Thermo Fisher Scientific | 62249 | |
| LysoTracker Deep Red | Thermo Fisher Scientific | L12492 | |
| Opera Phenix | Perkin Helmer | HH14000000 |
Ссылки
- Hefti, F., Goure, W. F., Jerecic, J., Iverson, K. S., Walicke, P. A., Krafft, G. A. The case for soluble Aβ oligomers as a drug target in Alzheimer's disease. Trends in Pharmacological Sciences. 34 (5), 261-266 (2013).
- Castillo-Carranza, D. L., Lasagna-Reeves, C. A., Kayed, R. Tau aggregates as immunotherapeutic targets. Frontiers in bioscience (Scholar edition). 5, 426-438 (2013).
- Martin, L., Latypova, X., Terro, F. Post-translational modifications of tau protein: Implications for Alzheimer's disease. Neurochemistry International. 58 (4), 458-471 (2011).
- Holmes, B. B., Diamond, M. I. Prion-like properties of Tau protein: The importance of extracellular Tau as a therapeutic target. Journal of Biological Chemistry. 289 (29), 19855-19861 (2014).
- Giacobini, E., Gold, G. Alzheimer disease therapy--moving from amyloid-beta to tau. Nature Reviews Neurology. 9 (12), 677-686 (2013).
- Asuni, A. A., Boutajangout, A., Quartermain, D., Sigurdsson, E. M. Immunotherapy targeting pathological tau conformers in a tangle mouse model reduces brain pathology with associated functional improvements. Journal of Neuroscience. 27 (34), 9115-9129 (2007).
- Boutajangout, A., Ingadottir, J., Davies, P., Sigurdsson, E. M. Passive immunization targeting pathological phospho-tau protein in a mouse model reduces functional decline and clears tau aggregates from the brain. Journal of Neurochemistry. 118 (4), 658-667 (2011).
- Chai, X., et al. Passive immunization with anti-Tau antibodies in two transgenic models: reduction of Tau pathology and delay of disease progression. Journal of Biological Chemistry. 286 (39), 34457-34467 (2011).
- Yanamandra, K., et al. Anti-tau antibodies that block tau aggregate seeding in vitro markedly decrease pathology and improve cognition in vivo. Neuron. 80 (2), 402-414 (2013).
- Luo, W., Liu, W., Hu, X., Hanna, M., Caravaca, A., Paul, S. M. Microglial internalization and degradation of pathological tau is enhanced by an anti-tau monoclonal antibody. Scientific Reports. 5, 11161 (2015).
- Funk, K. E., Mirbaha, H., Jiang, H., Holtzman, D. M., Diamond, M. I. Distinct Therapeutic Mechanisms of Tau Antibodies: Promoting Microglial Clearance Versus Blocking Neuronal Uptake. Journal of Biological Chemistry. 290 (35), 21652-21662 (2015).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf/v-myc carrying retrovirus. Journal of neuroimmunology. 27 (2-3), 229-237 (1990).
- Apetri, A., et al. A common antigenic motif recognized by naturally occurring human VH5-51/VL4-1 anti-tau antibodies with distinct functionalities. Acta neuropathologica communications. 6 (1), 43 (2018).
- Schneider, A., Mandelkow, E. Tau-based treatment strategies in neurodegenerative diseases. Neurotherapeutics. 5 (3), 443-457 (2008).
- Congdon, E. E., Gu, J., Sait, H. B., Sigurdsson, E. M. Antibody uptake into neurons occurs primarily via clathrin-dependent Fcgamma receptor endocytosis and is a prerequisite for acute tau protein clearance. Journal of Biological Chemistry. 288 (49), 35452-35465 (2013).
- Bocchini, V., Mazzolla, R., Barluzzi, R., Blasi, E., Sick, P., Kettenmann, H. An immortalized cell line expresses properties of activated microglial cells. Journal of Neuroscience Research. 31 (4), 616-621 (1992).
- Koenigsknecht, J. Microglial Phagocytosis of Fibrillar β-Amyloid through a β1 Integrin-Dependent Mechanism. Journal of Neuroscience. 24 (44), 9838-9846 (2004).
- Kopec, K. K., Carroll, R. T. Alzheimer's β-Amyloid Peptide 1-42 Induces a Phagocytic Response in Murine Microglia. Journal of Neurochemistry. 71 (5), 2123-2131 (2002).
- Marsh, S. E., et al. The adaptive immune system restrains Alzheimer's disease pathogenesis by modulating microglial function. Proceedings of the National Academy of Sciences of the United States of America. 113 (9), E1316-E1325 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены