Method Article
Ensayo basado en células para estudiar despacho Tau anticuerpo-mediada por la microglía
En este artículo
Resumen
Aquí describimos un ensayo basado en células para evaluar cuantitativamente la absorción tau por microglia con el objetivo de crear una herramienta de investigación para caracterizar mejor los mecanismos de acción de los anticuerpos anti-tau.
Resumen
Enfermedad de Alzheimer (EA) es una condición neurodegenerativa progresiva en la cual agrega los tau y las proteínas amiloides se acumulan en el cerebro causando una disfunción neuronal que eventualmente conduce a deterioro cognitivo. Agregados de tau hiperfosforilada en las neuronas se creen que causan la mayoría de la patología asociada con enfermedad de Alzheimer. Estos agregados son asumidos para ser lanzado en el compartimiento extracelular y tomados por las neuronas sanas adyacentes donde además inducen la agregación de tau. Este "prion-como" separarse puede ser interrumpido por los anticuerpos capaces de atar y "neutralizar" agregados de tau extracelular como se muestra en modelos de ratón preclínico de la EA. Uno de los mecanismos propuestos por el cual los anticuerpos terapéuticos reducen patología es anticuerpo-mediada de la absorción y limpieza de formas patológicas agregadas de tau por la microglia. Aquí, describimos un ensayo basado en células para evaluar la absorción de tau por la microglia. Este ensayo utiliza la línea de ratón microglia células BV-2, permite la alta especificidad y baja variabilidad de rendimiento medio. Datos generados con este análisis pueden contribuir a una mejor caracterización de funciones efectoras de los anticuerpos anti-tau.
Introducción
Enfermedad de Alzheimer (EA) es una condición neurodegenerativa progresiva caracterizada por el cambio conformacional y autoensamblaje de la proteína de amiloide β péptido y tau en agregados patológicos. El péptido β amiloide soluble normal se convierte en oligomérica y fibrilar amiloide β, mientras que el tau anormalmente fosforilada se acumula como oligómeros y los enredos de neurofibrillary1,2. Estos agregados de proteína causan muerte neuronal que conduce a la pérdida de memoria y deterioro cognitivo progresivo posterior. Otros factores, incluyendo la neuroinflamación no productivos y una capacidad reducida para eliminar proteínas mal plegadas, pueden agravar y acelerar la enfermedad. En la actualidad, estrategias de intervención contra AD proporcionan alivio sintomático en gran parte, pero no hay modificadores de la enfermedad curación o prevención.
Creciente evidencia sugiere un papel clave de los agregados de tau hiperfosforilada en la patología de la EA. En su estado no patológico, tau es una proteína nativa desplegada que se une a los microtúbulos y promueve a su montaje en el citoesqueleto neuronal. Cuando tau hiperfosforilada, se separa del citoesqueleto y clusters en agregados de tau en las neuronas, que se creen que causan la mayoría de la patología asociada AD3. Agregados de tau empieza primero acumular intracelularmente, pero conforme avanza la enfermedad, se supone para ser lanzado de las neuronas afectadas en el espacio extracelular, desde donde se puede tomar por neuronas sanas adyacentes o synaptically conectadas en un " PRION-como manera". Una vez internalizado, el agregado de tau induce más tau agregación via cambio conformacional con plantilla4.
Según esta hipótesis, terapias capaces de interrumpir tau siembra podrían ralentizar o invertir el curso de la enfermedad neurodegenerativa tau-mediada. En apoyo de esto, ratones susceptibles a tauopathy de mutación genética y pasivo inyectado con anticuerpos anti-tau Mostrar patología tau reducido y mejora la función cognitiva5,6,7,8 ,9. Sin embargo, los mecanismos por el cual los anticuerpos terapéuticos reducen patología sigue siendo esquivos.
Uno de los mecanismos propuestos es anticuerpo-mediada de la absorción y separación de formas agregadas patológicas de tau por microglía, las células inmunes residentes del cerebro. Publicaciones recientes sugieren que la microglia eficientemente puede internalizar y degradar la especie patológica tau y esta capacidad se ve reforzada por anticuerpos anti-tau a través de una Fc-dependiente mecanismo implicando receptores Fc expresados sobre la superficie de microglía y receptor mediaron fagocitosis10,11. Estos datos identifican microglia como importantes generadores de anticuerpos terapéuticos.
Describimos adjunto un ensayo basado en células para evaluar cuantitativamente la absorción tau por microglia. Datos generados con este análisis pueden ayudar a dilucidar los mecanismos de acción de los anticuerpos anti-tau lo que representa una herramienta útil para avanzar en los anticuerpos anti-tau para pasos posteriores de su desarrollo como tratamiento potencial del anuncio.
Protocolo
1. cultura de células BV-2 de
Nota: La manija BV-2 células en contención de bioseguridad nivel 2. La línea de células BV-2 produce un envuelto ecotropic recombinante retrovirus (capaz de infectar a las células murinas sólo)12; esos virus son conocidos por su en vitro transforma la capacidad y el potencial tumorígeno de en vivo .
- Las células BV-2 de cultura en glucosa alta Dulbecco modifican medio de águila (DMEM) suplementado con 10% suero bovino fetal (FBS), 100 U/mL de penicilina, 100 estreptomicina μg/mL y 2 mM L-glutamina (denominado cultivo medio en adelante) por la siembra de células en 4 x 104 células/mL.
- Mantener las culturas en un ambiente humidificado de 5% CO2 a 37 ° C.
Nota: las células crecen libremente conectados y en suspensión.
2. etiqueta recombinante agregados de Tau con colorante fluorescente sensible al pH
Nota: Agregados de Tau se prepararon como se describe en Apetri et al. 13 con la diferencia que no tioflavina T (ThT) fue agregado al buffer de reacción. Se colectaron muestras agregadas en tubos de centrífuga de 1.5 mL. Señal de fluorescencia final se comprobó mediante la mezcla de 118 μl de la muestra de la piscina con 12 μl de una solución a 50 μm ThT. Agregados fueron separados por centrifugación de la mezcla de reacción de agregación a 20.000 x g durante 1 h a 4 ° C. El sobrenadante fue analizado por SEC-MALS para confirmar que tau monomérica se convirtió en agregados. Pellets (agregados de tau) fueron complemento congelados y almacenados en un congelador a-80 ° C.
- Resuspender agregados de tau en 0.1 M tampón de bicarbonato de sodio (NaHCO3) a pH 8.5 a una concentración de 1 mg/mL (~ 20 μm).
Nota: Concentración de agregados de tau se basa en la concentración de monómeros iniciales según lo determinado por la absorción de monómeros de tau a 280 nm con un coeficiente de extinción de 0.31 mLmg-1cm-1. - Someter a ultrasonidos los agregados resuspendidos con un sonicador sonda manteniendo en hielo para evitar sobrecalentamiento.
- Utilizar una amplitud de 65% (con el sonicador de potencia 250 W).
- Realizar 8 pulsos de 3 s con pausas de 15 s entre pulsos para evitar el sobrecalentamiento.
- Preparar una solución stock de 8,9 mM de tinte pH-sensible (en adelante referencia a como colorante de pH) en dimetil sulfóxido (DMSO) siguiendo las instrucciones del fabricante.
Nota: Siempre preparar una solución fresca y utilizarlo solamente en el día que se prepara. - Añadir 10 moles de colorante por mol de proteína a una concentración del tinte final de 0,2 mM.
- Mezclar mediante pipeteo suavemente hacia arriba y hacia abajo.
- Incubar la mezcla de reacción durante 45 – 60 min a temperatura ambiente, protegido de la luz.
- Mientras tanto, montar un gel dextran reticulado columna siguiendo las instrucciones del fabricante de la desalación.
- Equilibrar la columna con 25 mL de 0.1 M NaHCO3 buffer pH 8,5 conteniendo DMSO de 3%. Deseche el flujo a través.
- Añadir el producto de la suma total de tau etiquetado reacción a la columna en un volumen total de 2,5 mL. Si la muestra es inferior a 2,5 mL, añadir tampón hasta alcanza un volumen total de 2,5 mL.
- Deje que la muestra ingrese completamente el gel envasado, deseche el flujo a través.
- Eluir con 3,5 mL de 0.1 M NaHCO3 buffer pH 8,5 conteniendo DMSO de 3% y recoger el eluido en 4 fracciones equivalentes en tubos de 2 mL.
- Determinar las concentraciones de proteína de las 4 fracciones ensayo de (BCA) ácido bicinchoninic.
- Almacenar la proteína marcada en un congelador de-20 ° C.
3. absorción ensayo con células activado por fluorescencia (FACS) de clasificación lectura
-
Día 1 – semilla de las células
- Células de lavado BV-2 en el matraz quitando cultivo mediano y agregar 1 x solución salina tamponada con fosfato (PBS).
Nota: Volumen de lavado variará según el tamaño del matraz celular utilizado. Por ejemplo, para un matraz T175, lavar con 10 mL de PBS 1 x. - Retire el frasco de PBS y separar células por incubación con ácido (EDTA) de etilendiaminotetracético tripsina 0,05% a 37 ° C y 5% CO2 hasta separan las células del frasco (aproximadamente 5 min).
Nota: Volumen de tripsina-EDTA 0.05% depende del tamaño del matraz celular utilizado. Por ejemplo, para un matraz T175, use 2 mL de tripsina-EDTA 0,05%. - Resuspender las células en medio de cultivo mediante pipeteo arriba y abajo de tres a cinco veces.
Nota: Volumen de medio de cultivo varía según el tamaño del matraz celular utilizado y número total de células en el frasco. Por ejemplo, para un matraz T175 use 8 mL de medio de cultivo. - Contar las células y crear una suspensión con una concentración final de 1 x 105 células/mL en medio de cultivo que contiene 200 μg/mL heparina.
- 250 μl de suspensión celular (2.5 x 104 células) por pozo en una placa de cultivo de tejidos de 96 pozos fondo plano de la placa.
- Incube la placa durante la noche a 37 ° C y 5% CO2.
- Células de lavado BV-2 en el matraz quitando cultivo mediano y agregar 1 x solución salina tamponada con fosfato (PBS).
-
Día 1 – preparar Immunocomplexes
- Descongelar el tinte pH-tau en el hielo.
- Preparar 65 μl por condición de solución 500 nM de pH agregados de tau tinte en medio libre de suero (SFM) (glucosa alta DMEM suplementado con 100 U/mL de penicilina, estreptomicina μg/mL 100 y 200 μg/mL de heparina).
- Preparar las diluciones de anticuerpo en 65 μl de la OFS y a una concentración doble a la final uno. Mezcla de agregados de tau colorante de pH y los anticuerpos en una placa de 96 pocillos de fondo u. Volumen final por condición es ahora 130 μl y la concentración de agregados de tau colorante de pH es de 250 nM. Sellar la placa de dilución e incubar durante la noche a 37 ° C.
-
Día 2 – absorción de Immunocomplexes
- Retire el medio de cultivo de células BV-2. Lavar las células una vez con 100 μl temperatura 1 x PBS.
- 125 μl de immunocomplexes de transferencia a las células utilizando una pipeta multicanal. Incubar las células con los immunocomplexes por 2 h a 37 ° C y 5% CO2.
- Retire el medio de incubación de las células y deséchelo. Lavar las células una vez con 100 μl temperatura 1 x PBS.
- Eliminar 1 x PBS y tratar las células con 50 μl de tripsina-EDTA 0.25% por 20 min a 37 ° C y 5% CO2.
- Añadir 200 μL de medio de cultivo y resuspender bien transfiriendo hacia arriba y hacia abajo para separar las células. Transferir las células a un fondo de U 96 pocillos placa. Centrifugar la placa a 400 x g durante 5 min a 4 ° C.
- Poner la placa de hielo, retire el cultivo de células medianas y lavar dos veces por Resuspender el pellet celular en 150 μL hielo frío 1 x PBS. Centrifugar la placa a 400 x g durante 5 min a 4 ° C.
- Poner las células en hielo, quitar agregado 1 x PBS y lavado por resuspender células pellets en 150 μL frío FACS de tampón (1 x PBS, 0,5% albúmina sérica bovina (BSA), 2 mM EDTA). Centrifugar la placa a 400 x g durante 5 min a 4 ° C.
- Poner las células en hielo, elimine el agregado de tampón FACS y resuspender las células en 200 μL de tampón FACS frío.
- Analizar las muestras inmediatamente por FACS adquirir 2 x 104 eventos en la puerta de células vivas (ver paso 4.1).
4. FACS análisis
Nota: Consulte la figura 1 para la estrategia bloquea.
- Utilizando la zona de forward scatter (FSC-A) versus lado dispersión área densidad (SSC-A) parcela puerta en células vivas excluyendo eventos con menores niveles de dispersión hacia adelante (es decir, residuos y células muertas).
- Dentro de la población de células vivas, uso de FSC-A versus altura de forward scatter (FSC-H) dobletes de célula y agregados. Esta es la puerta de la camiseta.
- Con los acontecimientos en la puerta de la camiseta, generar un histograma de parámetro único colorante de pH.
- Determinar la intensidad de fluorescencia media. Determinar el porcentaje de células positivas de pH tinte-tau excluyendo las células negativas como determinó BV-2 control único.
5. Immunocomplexes absorción con lectura de microscopía
-
Día 1 – semilla de las células
- Preparar las células BV-2 como se describe en los puntos 3.1.1, 3.1.2 y 3.1.3.
- Contar las células y resuspender en medio a una concentración final de 104 células/mL de cultivo.
- Placa de 150 μL de suspensión celular (1.5 x 103) por pozo en una poly-D-lisina revestido de placa negra de 96 pocillos con fondo plano claro.
- Incubar la placa a 37 ° C y 5% de CO2 durante 48 h.
-
Día 3 – preparación de Immunocomplexes
Nota: Suave sonicación de agregados de tau etiquetados antes de la incubación con el anticuerpo, se realizó para mejorar los resultados de la microscopia.- Descongelar el tinte pH-tau en el hielo y someter a ultrasonidos con un sonicador sonda manteniendo en el hielo. Utilizar una amplitud de 15% (sonicador potencia de 250 W). Realizar 30 pulsos de 2 s y s de espera 20 entre pulsos.
- Preparar 65 μl por condición de solución 500 nM de agregados de tau tinte pH en SFM.
- Diluir los anticuerpos en 65 μl de SFM a una concentración doble a la final uno. Mezcla de agregados de tau colorante de pH y los anticuerpos en una placa de 96 pocillos de fondo u. Volumen final por condición es ahora 130 μl y la concentración de agregados de tau colorante de pH es de 250 nM. Sellar la placa de dilución e incubar durante la noche a 37 ° C.
- Retirar medio de placa de la célula y reemplazar con 150 μL de medio de cultivo suplementado con 200 heparina μg/mL. Incube la placa durante la noche a 37 ° C y 5% CO2.
-
Día 4 – absorción de Immunocomplexes
- Retire el medio de cultivo de las células BV-2. 125 μl de immunocomplexes de transferencia a las células utilizando una pipeta multicanal.
- Incubar las células con los immunocomplexes durante 1 h y 45 min a 37 ° C con 5% CO2.
Mancha de núcleos celulares con tinte específico DNA y orgánulos ácidos con una sonda que tiñe selectivamente compartimentos celulares de bajo pH. Incube las células 15 min a 37 ° C con 5% CO2.
Nota: Diluir los colorantes en SFM. - Realizar células vivas imágenes con un alto contenido de sistema confocal. Temperatura a 37 ° C y 5% CO2. Para imágenes de alta calidad, utilice un objetivo de inmersión de agua X 63 y adquirir planos de 0,5 μm (20 por Z-stack) por campo de imagen.
Resultados
Agregados tau recombinante era covalente etiquetado con un tinte verde sensible al pH. Este colorante aumenta dramáticamente su fluorescencia a su internalización en organelos ácidos, permitiendo para la cuantificación intracelular. Agregados de tau etiquetados se incubaron con anticuerpos monoclonales de anti-tau. En particular, se utilizó una versión quimérica (región de Fc de IgG1 de ratón) de CBTAU-28.1. Este anticuerpo humano se une a la región N-terminal de inserción de tau y es capaz de enlazar en vitro generado tau fibrillas13. En este ensayo, también probamos una versión mejorada de afinidad de CBTAU-28.1-28.1 dmCBTAU. Fragmentos fabulosos de CBTAU-28.1, en el mutante parental y alta afinidad, y el formato de un mouse IgG1 control de isotipo fueron utilizados como controles.
Células BV-2 se incubaron con los immunocomplexes preformadas o agregaron solo durante dos horas en presencia de heparina para bloquear la absorción independiente de anticuerpo tau tau. Después de la incubación, las células se tripsinizaron para eliminar al tau a la membrana extracelular y se analizaron por citometría de flujo para la captación de tau. Como recientemente descrito13, observamos absorción de variantes promovidas CBTAU 28.1 de tau en células BV-2 de forma dosis-dependiente. La absorción fue Fc mediada desde fragmentos Fab CBTAU 28.1 no aumentó la absorción tau basal (figura 2). Por otra parte, los anticuerpos de alta afinidad dmCBTAU 28.1 mediada por absorción de tau en células BV-2 a un grado más alto que el anticuerpo de tipo salvaje (figura 2).
Absorción de anticuerpo-mediada de la tau y la localización de agregados de tau en el compartimiento de endolysosomal fue confirmada por microscopía confocal (figura 3) donde el compartimiento celular ácido fue manchado con una sonda selectiva de organelos de pH bajo. Puncta intracelular de tinte verde pH etiquetado tau agregados fueron observados dentro de las células que se incubaron con CBTAU-28.1. Por otra parte, los agregados de tau intracelular a menudo colocalized con el pH bajo compartimiento selectivo rojo tinte así sugiriendo la presencia de agregados de tau en los orgánulos ácidos. Fragmentos Fab CBTAU 28.1 no aumentó la absorción tau otra vez, lo que indica un mecanismo de internalización mediada por los receptores Fc (figura 3).
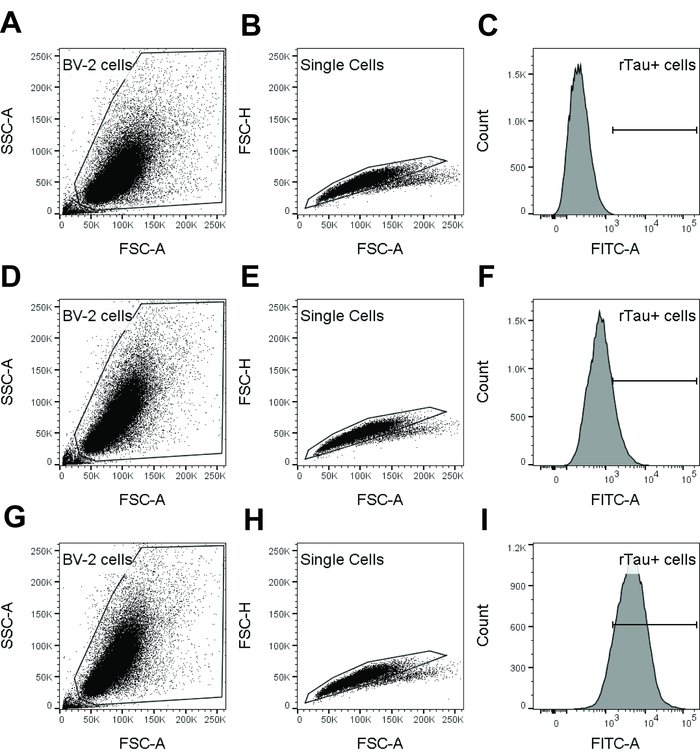
Figura 1: bloquear la estrategia utilizada en el análisis de citometría de flujo para detectar internalización de tau por células BV-2. Muestra los datos de control sólo BV-2 (A-C), isotipo (D-F) y dmCBTAU-28.1 (G-I) se muestran. Población de células BV-2 fue cerrado en una parcela de SSC-A densidad de FSC-A vs excluyendo desechos y células muertas (A, D, G). Las células BV-2 entonces fueron más cerradas en una parcela de densidad de FSC-A vs FSC-H dobletes de célula y agregados (B, E, H). Puerta de célula fue utilizada para generar un histograma de parámetro único de tinte (FITC en estos resultados representativos) pH (C, F, I) y determinar la intensidad de fluorescencia media geométrica. Como alternativa, porcentaje de células positivas de pH-tau tinte calculó excluyendo las células negativas según lo determinado mediante control sólo BV-2. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: 28.1 CBTAU interviene en la absorción de los agregados de tau en células microgliales BV-2. Agregados tau recombinante covalente se etiquetados con tinte pH-sensible de fluorescencia verde y se incubó con una versión del ratón quimérica del anticuerpo anti-tau humana CBTAU-28.1, su formato mayor afinidad, dmCBTAU-28.1, fragmentos de Fab correspondiente, un anticuerpo de control de isotipo IgG1 de ratón o ningún anticuerpo (agregados de tau solo). Immunocomplexes posteriormente se incubaron con células BV-2 durante dos horas en presencia de heparina para bloquear la absorción independiente de anticuerpo tau. Absorción de immunocomplexes se evaluó por citometría de flujo y expresados como la media geométrica (GM) de intensidad de fluorescencia (A) o el porcentaje de positivos de tau (tau +) células (B). Barras de error en (A) indican la desviación estándar de dos experimentos independientes, mientras (B) muestra un sencillo experimento. Haga clic aquí para ver una versión más grande de esta figura.
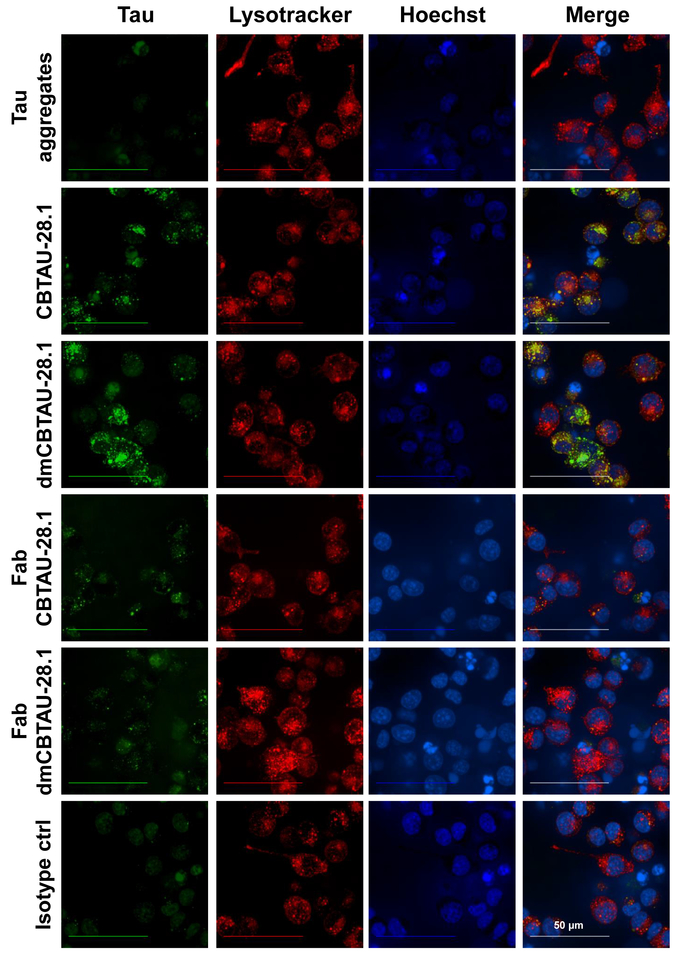
Figura 3: agregados de Tau son internalizadas por células BV-2 y localizar en organelos celulares ácidos. Tau-anticuerpo preformado immunocomplexes se incubaron con células BV-2 durante dos horas en presencia de heparina para bloquear la absorción del anticuerpo-independiente. Después de la incubación, los núcleos fueron teñidos con un colorante azul específico del ADN y el compartimento celular ácido con pH bajo compartimiento selectivo rojo tinta. Células vivas la proyección de imagen reveló puncta intracelular de agregados de tau etiquetados (verde) dentro de las células que se incubaron y CBTAU-28.1 28.1 dmCBTAU, pero no con el control de isotipo. Por otra parte, agregados de tau intracelular a menudo colocalized con el rojo tinte (amarillos), así sugiriendo la presencia de agregados de tau en el compartimiento celular ácido. Fragmentos Fab CBTAU 28.1 no aumentó absorción de tau que indica un mecanismo de internalización mediada por los receptores Fc. Imágenes representan las proyecciones de máxima intensidad de una planos 20 Z-stack (planos de 0,5 μm) adquiridas con un objetivo de inmersión de agua X 63. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Microglia, las células inmunes del cerebro residente, han sido recientemente identificados como jugadores importantes en los enfoques terapéuticos anticuerpo-mediada de Tauopatías10,11. Separación de tau anticuerpo-mediada por microglía, junto con bloqueo de la captación neuronal9, inhibición o desestabilización de fibrilla formación13,14 y separación de las fibrillas intraneuronales vía los lisosomales camino15, podría contribuir a la eficacia de los anticuerpos anti-tau observada en modelo de ratón de tauopathy5,6,7,8,9.
Describimos aquí un ensayo basado en células para evaluar cuantitativamente la absorción tau por microglia con el objetivo de crear una herramienta de investigación para caracterizar mejor los mecanismos de acción de los anticuerpos anti-tau.
Este test, adaptado de Funk et al. 11, utiliza células BV-2, que son las células microgliales murinas inmortalizado. Mientras que totalmente no pueden compararse a las células microgliales primaria, cuentan con muchas de las características de microglia primaria, incluyendo la capacidad de contundencia fagocitar Aβ y tau fibrillas11,16,17 ,18,19. Por otra parte, mostraron un comportamiento reproducible en vitro que hacía muy conveniente para el desarrollo de ensayos y estudios cuantitativos, que requieren mínima variabilidad experimental. Al lado de esto, líneas celulares inmortalizadas permiten un mayor rendimiento de ensayo y eliminan la necesidad de sacrificio de animales en comparación con el uso de microglia primaria.
Los agregados de tau que se utilizó en este análisis fueron obtenidos usando el procedimiento de agregación altamente reproducibles en vitro que recientemente descrito13y mostrar morfología similar a emparejado filamentos helicoidales (PHFs) aislados de cerebros de AD pacientes. Si bien no observamos ninguna resultados inesperados que podrían haber sido causados por agregados de tau adherencia a las superficies de plástico o vidrio, el uso de agregados de tau estable y bien caracterizado desempeñó un papel crucial en la reproducibilidad de este ensayo.
Otro aspecto que contribuyó significativamente a la reproducibilidad del análisis fue la densidad celular. El número de células por pozo que se describe en el protocolo representa la densidad celular óptima en las condiciones descritas.
Diferentemente de lo que Funk et al. 11 descrito, etiquetamos agregados de tau con un colorante sensible de pH que aumenta significativamente su fluorescencia sobre internalización en organelos ácidos, lo que permite cuantificación intracelular. Esto, junto con la digestión de la tripsina de superficie límite immunocomplexes o tau, garantías que señal de fluorescencia se mide por citometría de flujo es el resultado de la absorción de tau en lugar de unión a la superficie celular. Además, el uso de una facilita de tinte sensible de pH límite de detección de agregados de tau internalizada en los experimentos de microscopia sin la necesidad de digerir la superficie agregados de immunocomplexes/tau que luego requiere de células re-galjanoplastia y la recuperación.
Usando un tinte altamente selectivo para organelos ácidos en nuestros experimentos de microscopía que nos permitieron no sólo confirmar anticuerpo-mediada, asimismo optimizada la lectura microscopía de nuestro análisis, en comparación con lo que ha sido previamente descrito11 absorción de TAU, sino también de localización de agregados de tau en el compartimiento de endolysosomal.
El análisis que desarrollamos, tiene especificidad óptima que resulta en una buena ventana experimental que permite una separación fuerte entre muestras positivas y negativas. Curiosamente, el ensayo indirectamente detecta diferencias en la afinidad de anticuerpos, lo que representa una poderosa herramienta para el estudio de funciones efectoras de los anticuerpos anti-tau.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a Alberto Carpinteiro Soares por su valiosa asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| BV-2 cells | ICLC Interlab Cell Line Collection | ATL03001 | |
| Phosphate Buffered Saline (PBS) (1x) | Gibco | 10010-015 | |
| Trypsin-EDTA 0.05% | Gibco | 25300-054 | |
| DMEM 4.5 g/dL glucose | Gibco | 41966-029 | |
| Fetal Bovine Serum | Gibco | 10091-148 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| L-Glutamine 200 mM | Lonza | 17-605E | |
| EasYFlask | Nunc | 156499 / 159910 | |
| pHrodo Green STP ester | Life Technologies | P35369 | |
| Sodium Bicarbonate pH 8.5 100 mM | |||
| DMSO | Sigma | D2650-100ml | |
| PD10 columns | GE Healthcare | 17-0851-01 | |
| BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Greiner CELLSTAR multiwell culture plates | Greiner | 665180 | |
| Falcon 96-Well Assay Plates | Falcon | 353910 | |
| Heparin | Sigma | H3393-50KU | |
| Trypsin-EDTA 0.25% | Sigma | T4049-100ml | |
| BSA | Sigma | A7030-100G | |
| EDTA 0.5 M, pH8 | |||
| FACS Canto II | BD | ||
| Hoechst 33342 Solution (20 mM) | Thermo Fisher Scientific | 62249 | |
| LysoTracker Deep Red | Thermo Fisher Scientific | L12492 | |
| Opera Phenix | Perkin Helmer | HH14000000 |
Referencias
- Hefti, F., Goure, W. F., Jerecic, J., Iverson, K. S., Walicke, P. A., Krafft, G. A. The case for soluble Aβ oligomers as a drug target in Alzheimer's disease. Trends in Pharmacological Sciences. 34 (5), 261-266 (2013).
- Castillo-Carranza, D. L., Lasagna-Reeves, C. A., Kayed, R. Tau aggregates as immunotherapeutic targets. Frontiers in bioscience (Scholar edition). 5, 426-438 (2013).
- Martin, L., Latypova, X., Terro, F. Post-translational modifications of tau protein: Implications for Alzheimer's disease. Neurochemistry International. 58 (4), 458-471 (2011).
- Holmes, B. B., Diamond, M. I. Prion-like properties of Tau protein: The importance of extracellular Tau as a therapeutic target. Journal of Biological Chemistry. 289 (29), 19855-19861 (2014).
- Giacobini, E., Gold, G. Alzheimer disease therapy--moving from amyloid-beta to tau. Nature Reviews Neurology. 9 (12), 677-686 (2013).
- Asuni, A. A., Boutajangout, A., Quartermain, D., Sigurdsson, E. M. Immunotherapy targeting pathological tau conformers in a tangle mouse model reduces brain pathology with associated functional improvements. Journal of Neuroscience. 27 (34), 9115-9129 (2007).
- Boutajangout, A., Ingadottir, J., Davies, P., Sigurdsson, E. M. Passive immunization targeting pathological phospho-tau protein in a mouse model reduces functional decline and clears tau aggregates from the brain. Journal of Neurochemistry. 118 (4), 658-667 (2011).
- Chai, X., et al. Passive immunization with anti-Tau antibodies in two transgenic models: reduction of Tau pathology and delay of disease progression. Journal of Biological Chemistry. 286 (39), 34457-34467 (2011).
- Yanamandra, K., et al. Anti-tau antibodies that block tau aggregate seeding in vitro markedly decrease pathology and improve cognition in vivo. Neuron. 80 (2), 402-414 (2013).
- Luo, W., Liu, W., Hu, X., Hanna, M., Caravaca, A., Paul, S. M. Microglial internalization and degradation of pathological tau is enhanced by an anti-tau monoclonal antibody. Scientific Reports. 5, 11161 (2015).
- Funk, K. E., Mirbaha, H., Jiang, H., Holtzman, D. M., Diamond, M. I. Distinct Therapeutic Mechanisms of Tau Antibodies: Promoting Microglial Clearance Versus Blocking Neuronal Uptake. Journal of Biological Chemistry. 290 (35), 21652-21662 (2015).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf/v-myc carrying retrovirus. Journal of neuroimmunology. 27 (2-3), 229-237 (1990).
- Apetri, A., et al. A common antigenic motif recognized by naturally occurring human VH5-51/VL4-1 anti-tau antibodies with distinct functionalities. Acta neuropathologica communications. 6 (1), 43 (2018).
- Schneider, A., Mandelkow, E. Tau-based treatment strategies in neurodegenerative diseases. Neurotherapeutics. 5 (3), 443-457 (2008).
- Congdon, E. E., Gu, J., Sait, H. B., Sigurdsson, E. M. Antibody uptake into neurons occurs primarily via clathrin-dependent Fcgamma receptor endocytosis and is a prerequisite for acute tau protein clearance. Journal of Biological Chemistry. 288 (49), 35452-35465 (2013).
- Bocchini, V., Mazzolla, R., Barluzzi, R., Blasi, E., Sick, P., Kettenmann, H. An immortalized cell line expresses properties of activated microglial cells. Journal of Neuroscience Research. 31 (4), 616-621 (1992).
- Koenigsknecht, J. Microglial Phagocytosis of Fibrillar β-Amyloid through a β1 Integrin-Dependent Mechanism. Journal of Neuroscience. 24 (44), 9838-9846 (2004).
- Kopec, K. K., Carroll, R. T. Alzheimer's β-Amyloid Peptide 1-42 Induces a Phagocytic Response in Murine Microglia. Journal of Neurochemistry. 71 (5), 2123-2131 (2002).
- Marsh, S. E., et al. The adaptive immune system restrains Alzheimer's disease pathogenesis by modulating microglial function. Proceedings of the National Academy of Sciences of the United States of America. 113 (9), E1316-E1325 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados