Method Article
Zellbasierte Assays, Antikörper-vermittelten Tau Clearance von Mikroglia zu studieren
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine zellbasierte Assays um Tau Aufnahme von Mikroglia mit dem Ziel der Schaffung einer investigational Tool besser zu charakterisieren, die Mechanismen der Wirkung von Anti-Tau-Antikörpern quantitativ zu bewerten.
Zusammenfassung
Alzheimer-Krankheit (AD) ist eine progressive Neurodegenerative Zustand, in dem aggregiert Tau und Amyloid Proteine im Gehirn verursacht neuronale Dysfunktion führt schließlich zu kognitiven Fähigkeiten zu sammeln. Hyperphosphoryliertem Tau Aggregate in der Nervenzelle werden geglaubt, um die meisten der Pathologie mit Anzeige verbundenen verursachen. Diese Aggregate sind davon ausgegangen, dass in den extrazellulären Raum abgegeben werden und von angrenzenden gesunden Neuronen wo induzieren sie weitere Tau Aggregation. Diese "Prion-Like" Verbreitung kann durch Antikörper in der Lage zu binden und "Neutralisierung" extrazelluläre Tau Aggregate wie in präklinischen Mausmodelle der AD unterbrochen werden. Eines der vorgeschlagenen Mechanismen mit denen therapeutische Antikörper Pathologie reduzieren ist Antikörper-vermittelte Aufnahme und Clearance von pathologischen aggregierten Formen der Tau von Mikroglia. Hier beschreiben wir eine quantitative zellbasierte Assays Tau Aufnahme von Mikroglia bewerten. Dieser Assay nutzt die Maus Mikroglia Zellinie BV-2, ermöglicht eine hohe Spezifität, geringe Variabilität und mittleren Durchsatz. Mit diesem Test gewonnenen Daten können zu eine bessere Charakterisierung der Antikörper Anti-Tau-Effektor-Funktionen beitragen.
Einleitung
Alzheimer-Krankheit (AD) ist eine progressive Neurodegenerative Bedingung gekennzeichnet durch die Konformationsänderung und Selbstmontage von Amyloid-β-Peptid und Tau-Protein in pathologischen Aggregate. Das normale lösliche Amyloid-β-Peptid wird in Oligomere und fibrillären Amyloid β umgewandelt, während ungewöhnlich phosphorylierten Tau als Oligomere und neurofibrillären Verschlingungen1,2ansammelt. Diese Protein-Aggregate verursachen neuronalen Tod führt zu Gedächtnisverlust und anschließenden progressive kognitive Abnahme. Andere Faktoren, einschließlich nicht-produktiven Neuroinflammation und eine reduzierte Fähigkeit, fehlgefaltete Proteine zu löschen möglicherweise verschärfen und Krankheit zu beschleunigen. Derzeit, Interventionsstrategien gegen AD weitgehend symptomatische Linderung, aber es gibt keine Disease modifying Heilung oder Prävention.
Erhöhung der Beweis schlägt eine zentrale Rolle des hyperphosphoryliertem Tau Aggregate in der Pathologie des AD. In seinem nicht-pathologischen Zustand ist Tau ein nativ entfaltet Protein, bindet an die Mikrotubuli und fördert deren Montage in neuronalen Zytoskeletts. Wenn Tau hyperphosphoryliertem wird, trennt das Zellskelett und Cluster in Tau-Aggregate in der Nervenzelle, die geglaubt werden, dazu führen, dass die meisten der Pathologie AD3zugeordnet. Aggregiert Tau beginnt zuerst intrazellulär ansammeln, aber Fortschreiten der Krankheit, es wird angenommen, dass von betroffenen Neuronen in den Extrazellulärraum freigesetzt werden aus denen es durch angrenzende oder synaptisch verbunden gesunde Neuronen in aufgegriffen werden kann eine " Prion-Manier". Einmal verinnerlicht, induziert das Tau-Aggregat weitere Tau Aggregation über templated Konformationsänderung4.
Nach dieser Hypothese Therapien in der Lage, Tau Aussaat zu unterbrechen möglicherweise verlangsamen oder den Lauf der Tau-vermittelten Neurodegenerative Erkrankung umzukehren. Zu diesem zeigen Mäuse anfällig für Tauopathie durch genetische Mutation und passiv mit Anti-Tau-Antikörper injiziert reduzierte Tau Pathologie und verbesserte kognitive Funktion5,6,7,8 ,9. Die Mechanismen, mit denen therapeutische Antikörper Pathologie reduzieren, bleiben jedoch nach wie vor schwer.
Eines der vorgeschlagenen Mechanismen ist Antikörper-vermittelte Aufnahme und Clearance von pathologischen aggregierten Formen der Tau von Mikroglia, resident Immunzellen des Gehirns. Aktuelle Publikationen legen nahe, dass Mikroglia effizient verinnerlichen und pathologischen Tau Arten beeinträchtigen kann und diese Fähigkeit wird durch Anti-Tau-Antikörper über eine Fc-abhängigen Mechanismus mit Fc-Rezeptoren auf der Oberfläche des ausgedrückt Mikroglia und Rezeptor vermittelt Phagozytose10,11. Diese Daten identifizieren Mikroglia als potentiell wichtige Effektoren von therapeutischen Antikörpern.
Wir beschreiben hier eine zellbasierte Assays um Tau Aufnahme von Mikroglia quantitativ zu bewerten. Mit diesem Test gewonnenen Daten helfen Aufklärung der Mechanismen der Wirkung von Anti-Tau-Antikörper, die stellvertretend für eines nützlichen Werkzeugs, um weitere Schritte ihrer Entwicklung als mögliche AD Behandlung Anti-Tau-Antikörper zu gelangen.
Protokoll
1. BV-2 Zellen Kultur
Hinweis: Griff BV-2 Zellen unter Einschließung der Biosafety Level 2. Die Zellinie BV-2 erzeugt eine umhüllten rekombinante Ecotropic Retrovirus (fähig nur murine Zellen zu infizieren)12; solche Viren sind bekannt für ihre in-vitro- Fähigkeit und in Vivo tumorigenic Potenzial verwandeln.
- Kultur-BV-2-Zellen im hohen Glukose Dulbecco geändert Eagle Medium (DMEM) ergänzt mit 10 % fetalen bovine Serum (FBS), 100 U/mL Penicillin, 100 µg/mL Streptomycin und 2 mM L-Glutamin (bezeichnet als Medium der Kultivierung von nun an) durch Aussaat Zellen 4 x 104 Zellen/mL.
- Pflegen Sie Kulturen in eine feuchte Atmosphäre 5 % CO2 bei 37 ° C.
Hinweis: die Zellen wachsen locker befestigt und in der Schwebe.
(2) Label rekombinante Tau-Aggregate mit pH-sensitiven Fluoreszenzfarbstoff
Hinweis: Tau Aggregate wurden vorbereitet, wie in Apetri Et Al. beschrieben 13 mit dem Unterschied, dass keine Thioflavin T (ThT) Reaktion Puffer hinzugefügt wurde. Aggregierte Proben wurden in 1,5 mL Zentrifuge Rohre gesammelt. Endgültige Fluoreszenzsignal wurde durch das Mischen von 118 µL der Probe Pool mit 12 µL einer 50 µM ThT Lösung überprüft. Aggregate wurden getrennt durch Zentrifugieren der Aggregation Reaktionsmischung bei 20.000 X g für 1 h bei 4 ° C. Der Überstand wurde analysiert von SEC-MALS zu bestätigen, dass die Monomere Tau in Aggregate umgewandelt wurde. Pellets (Tau Aggregate) wurden Snap eingefroren und in einer Tiefkühltruhe bei-80 ° c gelagert
- Aufschwemmen Tau Aggregate in 0,1 M Sodium Bicarbonat Puffer (Nahco33) bei pH 8,5 zu einer Konzentration von 1 mg/mL (~ 20 µM).
Hinweis: Konzentration der Tau Aggregate basiert auf der ursprünglichen Monomere Konzentration durch die Aufnahme von Tau Monomere bei 280 nm mit einem Aussterben Koeffizienten von 0,31 mLmg-1cm-1. - Beschallen Sie die resuspendierte Aggregate mit einer Sonde Sonikator dabei auf Eis, um Überhitzung zu vermeiden.
- Verwenden Sie eine Amplitude von 65 % (mit Sonikator Leistung 250 W).
- Führen Sie 8 Impulse von 3 s mit Pausen von 15 s zwischen den Pulsen eine Überhitzung zu vermeiden.
- Bereiten Sie eine 8,9 mM Stammlösung pH-sensitiven Farbstoffs (fortan Verweis auf als pH-Farbstoff) in Dimethyl Sulfoxid (DMSO) nach Anweisungen des Herstellers.
Hinweis: Immer bereiten Sie eine frische Lösung vor und verwenden Sie es nur auf den Tag, die, den Sie bereit ist. - Fügen Sie 10 Mol Farbstoff pro Mol des Proteins zu einer endgültigen Farbstoff-Konzentration von 0,2 mM.
- Mischen Sie, indem Sie sanft auf und ab pipettieren.
- Inkubieren Sie das Reaktionsgemisch für 45 – 60 min bei Raumtemperatur, vor Licht geschützt werden.
- In der Zwischenzeit montieren Sie eine vernetztes Dextran Gel Entsalzung Spalte nach Anweisungen des Herstellers.
- Equilibrate der Spalte mit 25 mL 0,1 M Nahco33 Puffer pH 8,5 mit 3 % DMSO. Die Durchströmung zu verwerfen.
- Fügen Sie das Produkt des Tau-Aggregats Kennzeichnung Reaktion auf die Spalte in einem Gesamtvolumen von 2,5 mL. Wenn die Probe weniger als 2,5 mL, fügen Sie Puffer hinzu, bis ein Gesamtvolumen von 2,5 mL erreicht ist.
- Lassen Sie die Probe geben Sie das gepackte Gel vollständig, den Durchfluss zu verwerfen.
- Eluieren mit 3,5 mL 0,1 M Nahco33 Puffer pH 8,5 mit 3 % DMSO und sammeln das Eluat in 4 gleichwertige Brüche in 2 mL-Tuben.
- Bestimmen Sie Proteinkonzentrationen von 4 Fraktionen durch Bicinchoninic Säure (BCA) Assay.
- Speichern Sie das markierte Protein in einem Gefrierschrank-20 ° C.
3. Aufnahme-Assay mit Fluoreszenz-aktivierte Zelle sortieren (FACS) auslesen
-
Tag 1 – Samen der Zellen
- Wash-BV-2 Zellen in den Kolben durch Kultivierung Mittel- und Hinzufügen von 1 x Phosphat-gepufferte Kochsalzlösung (PBS) entfernen.
Hinweis: Waschen Volumen variiert je nach der Größe der Zelle Küvette verwendet. Z. B. für ein T175 Fläschchen mit 10 mL 1 X PBS waschen. - Entfernen Sie PBS aus der Flasche zu und lösen Sie Zellen durch Inkubation mit Trypsin-Ethylenediaminetetraacetic Säure (EDTA) 0,05 % bei 37 ° C und 5 % CO2 , bis die Zellen aus der Flasche (ca. 5 min) lösen.
Hinweis: Volumen von Trypsin-EDTA 0,05 % richtet sich nach der Größe der Zelle Küvette verwendet. Für eine Flasche T175, z. B. 2 mL Trypsin-EDTA 0,05 %. - Aufschwemmen Sie Zellen in Kultivierung Medium durch Pipettieren nach oben und unten drei bis fünf Mal.
Hinweis: Volumen der Kultivierung Medium variiert je nach Größe der Zelle Küvette verwendet und somit Gesamtzahl der Zellen in den Kolben. Für eine Flasche T175, z. B. 8 mL Medium kultiviert. - Zählen von Zellen und erstellen eine Zellsuspension mit einer Endkonzentration von 1 x 105 Zellen/mL in Kulturmedium mit 200 μg/mL Heparin.
- 250 µL Zellsuspension (2,5 x 104 Zellen) pro Bohrloch in einer 96-Well-Zellkultur-Flachboden-Platte-Platte.
- Inkubieren Sie Platte über Nacht bei 37 ° C und 5 % CO2.
- Wash-BV-2 Zellen in den Kolben durch Kultivierung Mittel- und Hinzufügen von 1 x Phosphat-gepufferte Kochsalzlösung (PBS) entfernen.
-
Tag 1 – Vorbereitung Immunocomplexes
- PH Farbstoff-Tau auf dem Eis auftauen.
- Bereiten Sie 65 μl pro Zustand einer 500 nM-Lösung von pH Farbstoff-Tau-Aggregate in serumfreien Medium (SFM) (hohe Glukose DMEM ergänzt mit 100 U/mL Penicillin, 100 µg/mL Streptomycin und 200 µg/mL Heparin).
- Bereiten Sie Antikörper-Verdünnungen in 65 µl der SFM und bei einer Konzentration verdoppeln die endgültige ein. Mischen Sie pH-Farbstoff-Tau-Aggregate und Antikörper in einer 96-Well u-Boden-Platte. Endvolumen pro Zustand ist jetzt 130 µl und die pH-Wert Farbstoff-Tau Aggregate Konzentration beträgt 250 nM. Die Verdünnung Dichtplatte und über Nacht bei 37 ° c inkubieren
-
Tag 2 – Immunocomplexes Aufnahme
- BV-2 Zellen entfernen Sie Kultivierung Medium. Waschen Sie Zellen mit 100 µL Raumtemperatur 1 X PBS.
- Übertragen Sie 125 µL des Immunocomplexes auf die Zellen mit einer Mehrkanal-Pipette. Inkubieren Sie die Zellen mit Immunocomplexes für 2 h bei 37 ° C und 5 % CO2.
- Die Inkubation Medium aus den Zellen zu entfernen und entsorgen. Waschen Sie Zellen mit 100 µL Raumtemperatur 1 X PBS.
- 1 X PBS zu entfernen und behandeln von Zellen mit 50 µL Trypsin-EDTA 0,25 % für 20 min bei 37 ° C und 5 % CO2.
- 200 µL der Kultivierung Medium hinzufügen und erneut gut durch Pipettieren rauf und runter um die Zellen zu lösen. Übertragung von Zellen auf einer 96-Well U-Boden Platte. Zentrifuge Platte 400 X g für 5 min bei 4 ° C.
- Die Platte auf Eis gelegt, Kultivierung Mittel- und waschen Zellen zweimal durch die Zelle Pellets in 150 µL Eis kalt 1 X PBS resuspending zu entfernen. Zentrifuge Platte 400 X g für 5 min bei 4 ° C.
- Zellen auf Eis gelegt, zusätzliche 1 x PBS und waschen sie von resuspending Zellen Pellets in 150 µL kalter FACS Puffer (1 X PBS, 0,5 % Rinderserumalbumin (BSA), 2 mM EDTA) zu entfernen. Zentrifuge Platte 400 X g für 5 min bei 4 ° C.
- Zellen auf Eis gelegt, zusätzliche FACS-Puffer zu entfernen und Aufschwemmen Zellen in 200 µL kalter FACS-Puffer.
- Analysieren Sie Proben sofort durch FACS Erwerb von 2 x 104 Veranstaltungen in lebenden Zellen Tor (siehe Punkt 4.1).
4. FACS Analyse
Hinweis: Siehe Abbildung 1 für die gating-Strategie.
- Mit dem forward Scatter-Bereich (FSC-A) im Vergleich zu Seite Bereich (SSC-A) Dichte Streudiagramm, Tor auf lebende Zellen durch den Ausschluss von Veranstaltungen mit geringerer forward Scatter (d.h., Schmutz und abgestorbene Zellen).
- Innerhalb der live Zellpopulation verwenden FSC-A im Vergleich zu forward Scatter Höhe (FSC-H) Zelle Dubletten und Aggregate werden nicht berücksichtigt. Dies ist das Singulett-Tor.
- Mit den Ereignissen in der Singulett-Tor, ein pH-Wert Farbstoff einzelne Parameter Histogramm erzeugen.
- Mittlere Fluoreszenzintensität zu bestimmen. Bestimmen der pH-Wert Farbstoff-Tau positive Zellen durch den Ausschluss von negativen Zellen als bestimmt mit BV-2 nur.
5. Immunocomplexes Aufnahme mit Mikroskopie auslesen
-
Tag 1 – Samen der Zellen
- Bereiten Sie BV-2 Zellen wie in den Schritten 3.1.1, 3.1.2 und 3.1.3 beschrieben vor.
- Zellen zu zählen und sie in Kultivierung Medium, eine Endkonzentration von 104 Zellen/mL Aufschwemmen.
- Platte 150 µL Zellsuspension (1,5 x 103) pro Bohrloch in einer Poly-D-Lysin beschichtet schwarz 96-Well Platte mit klaren flachen Boden.
- Inkubieren Sie Platte bei 37 ° C und 5 % CO2 für 48 h.
-
Tag 3 – Vorbereitung Immunocomplexes
Hinweis: Milde Beschallung der gekennzeichneten Tau Aggregate vor der Inkubation mit Antikörper, wurde durchgeführt, um die Mikroskopie-Ergebnisse zu verbessern.- PH Farbstoff-Tau auf dem Eis auftauen und beschallen mit einer Sonde Sonikator dabei auf Eis. Verwenden Sie eine Amplitude von 15 % (Sonikator Leistung von 250 W). 30 Pulse 2 s und s warten 20 zwischen den Pulsen durchführen.
- Bereiten Sie 65 μl pro Zustand einer 500 nM-Lösung von pH-Farbstoff-Tau-Aggregate in SFM.
- Verdünnten Antikörper in 65 µl SFM zu einer Konzentration verdoppeln endgültig. Mischen Sie pH-Farbstoff-Tau-Aggregate und Antikörper in einer 96-Well u-Boden-Platte. Endvolumen pro Zustand ist jetzt 130 µl und die pH-Wert Farbstoff-Tau Aggregate Konzentration beträgt 250 nM. Die Verdünnung Dichtplatte und über Nacht bei 37 ° c inkubieren
- Zellplatte entfernen Sie Medium und ersetzen Sie mit 150 µL Kultivierung Medium mit 200 µg/mL Heparin ergänzt. Inkubieren Sie Platte über Nacht bei 37 ° C und 5 % CO2.
-
Tag 4 – Immunocomplexes Aufnahme
- Die BV-2 Zellen entfernen Sie Kultivierung Medium. Übertragen Sie 125 µL des Immunocomplexes auf die Zellen mit einer Mehrkanal-Pipette.
- Inkubieren Sie die Zellen mit den Immunocomplexes für 1 h und 45 min bei 37 ° C mit 5 % CO2.
Zellkerne mit spezifischen DNA-Farbstoff und sauren Organellen mit einer Sonde, die selektiv niedrigen pH-Wert zellulären Kompartimenten Flecken Fleck. Inkubieren Sie die Zellen 15 min bei 37 ° C mit 5 % CO2.
Hinweis: Verdünnen Sie die Farbstoffe in SFM. - Live-Cell imaging mit einem hohen Gehalt an screening-konfokale System durchführen. Stellen Sie die Temperatur auf 37 ° C und 5 % CO2. Verwenden Sie für qualitativ hochwertige Bilder ein 63 X Wasser eintauchen Ziel und erwerben Sie 0,5 µm Flugzeuge (20 pro Z-Stapel) pro abgebildeten Feld zu.
Ergebnisse
Aggregierte rekombinante Tau wurde kovalent mit einem pH-Sensitive grüne Farbstoff markiert. Dieser Farbstoff erhöht drastisch die Fluoreszenz auf seine Internalisierung in sauren Organellen, wodurch intrazelluläre Quantifizierung. Beschriftete Tau Aggregate wurden mit Anti-Tau monoklonalen Antikörpern inkubiert. Insbesondere haben wir eine Chimäre CBTAU-28,1-Version (Maus IgG1 Fc Region). Dieser menschliche Antikörper bindet an der N-terminalen einfügen Region von Tau und ist in der Lage, in Vitro generierten Tau Fibrillen13zu binden. In diesem Test haben wir auch eine Affinität-verbesserte Version des CBTAU-28,1 – DmCBTAU-28,1 getestet. Fab Fragmente des CBTAU-28,1 in der Eltern- und hoher Affinität Mutante formatieren, und eine Maus IgG1 Isotype Kontrolle dienten als steuert.
BV-2 Zellen inkubiert mit vorgeformten Immunocomplexes oder aggregiert Tau allein für zwei Stunden in Anwesenheit von Heparin, Antikörper-unabhängigen Tau Aufnahme zu blockieren. Nach der Inkubation Zellen wurden trypsiniert um das Tau gebunden an die extrazelluläre Membran zu entfernen und wurden für die Tau-Aufnahme durch Durchflusszytometrie analysiert. Wie wir vor kurzem13beschrieben, haben wir beobachtet, dass CBTAU-28,1 Varianten gefördert Aufnahme von Tau in BV-2 Zellen in einer Dosis-abhängigen Weise. Die Aufnahme war Fc vermittelt, da CBTAU-28,1 Fab-Fragmente nicht basalen Tau Aufnahme (Abbildung 2) zu erhöhen. Darüber hinaus vermittelt die hohe Affinität DmCBTAU-28,1 Antikörper Tau Aufnahme in BV-2 Zellen in einem höheren Ausmaß als der Wildtyp Antikörper (Abbildung 2).
Antikörper-vermittelten Tau Aufnahme und Lokalisierung von Tau-Aggregate in der Endolysosomal-Fach wurde bestätigt durch konfokale Mikroskopie (Abbildung 3) wo die saure zelluläre Fach war voller Flecken, mit einer Sonde selektiv für niedrige pH-Wert Organellen. Intrazelluläre Puncta des grünen pH Farbstoff beschriftet Tau Aggregate innerhalb der Zellen beobachtet wurden, die mit CBTAU-28,1 inkubiert wurden. Intrazelluläre Tau Aggregate colocalized darüber hinaus oft mit dem niedrigen pH-Wert Fach selektive roten Farbstoff Präsenz der Tau-Aggregate in der sauren Organellen hindeutet. CBTAU-28,1 Fab-Fragmente nicht Tau Aufnahme zeigt wieder einen Fc-Rezeptor vermittelt Internalisierung Mechanismus (Abbildung 3) zu erhöhen.
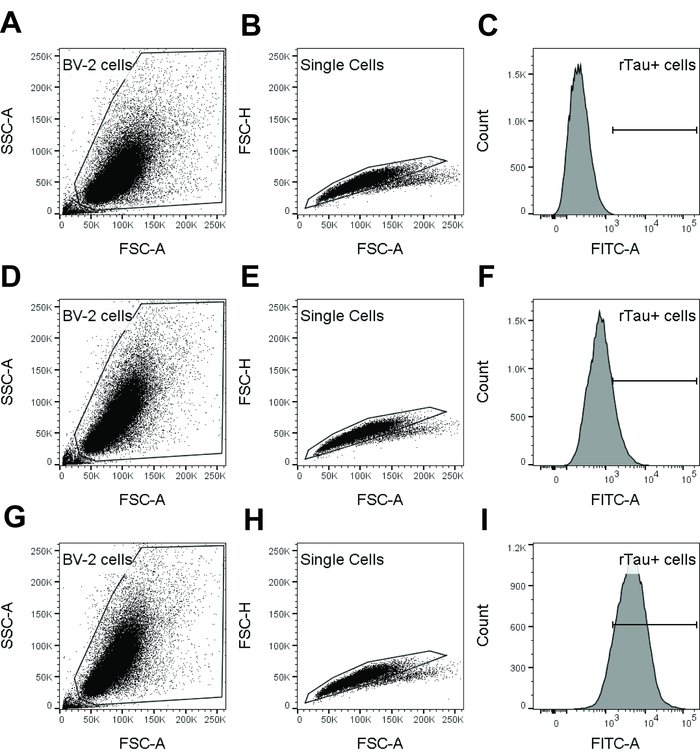
Abbildung 1: Strategie in Flow-Zytometrie-Analyse verwendet, um Tau Internalisierung von BV-2 Zellen erkennen Gating. Beispieldaten von BV-2 nur Steuerung (A-C), Isotype-Steuerung (D-F) und DmCBTAU-28,1 (G-ich) werden angezeigt. BV-2-Zell-Population wurde auf einem FSC-A Vs SSC-A Dichte Grundstück ohne Schmutz und abgestorbenen Zellen (A, D, G) bewachte. BV-2 Zellen wurden dann weiter auf einem FSC-A Vs FSC-H Dichte Grundstück auszuschließende Zelle Dubletten und Aggregate (B, E, H) bewachte. Einzelne Zelle Tor wurde verwendet, um ein pH-Wert Farbstoff (FITC in diese repräsentative Ergebnisse) einzelne Parameter Histogramm generieren (C, F, ich) und geometrische Mittel Fluoreszenzintensität zu bestimmen. Alternativ war der pH-Farbstoff-Tau-positive Zellen berechnet negative Zellen bestimmt mithilfe von BV-2 nur Kontrolle ausgenommen. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: CBTAU-28,1 vermittelt Aufnahme von Tau Aggregate in Zellen der Mikroglia BV-2. Aggregierte rekombinante Tau war kovalent mit grünen Fluoreszenz pH-Sensitive Farbstoff gekennzeichnet und inkubiert mit einer Maus Chimären Version der humanen Antikörpers Anti-Tau CBTAU-28,1, seine Affinität verbesserte Format, DmCBTAU-28,1, die entsprechenden Fab Fragmente, ein Maus IgG1 Isotype Kontrolle Antikörper oder keine Antikörper (Tau Aggregate allein). Immunocomplexes wurden anschließend für zwei Stunden in Anwesenheit von Heparin Antikörper-unabhängigen Tau Aufnahme blockieren mit BV-2 Zellen inkubiert. Aufnahme des Immunocomplexes wurde durch Durchflusszytometrie beurteilt und ausgedrückt als das geometrische Mittel (GM) der Fluoreszenzintensität (A) oder einen Prozentsatz der positiven Tau (Tau +) Zellen (B). Fehlerindikatoren in (A) geben Sie die Standardabweichung der zwei unabhängigen Experimenten, während (B) zeigt ein einziges experiment. Bitte klicken Sie hier für eine größere Version dieser Figur.
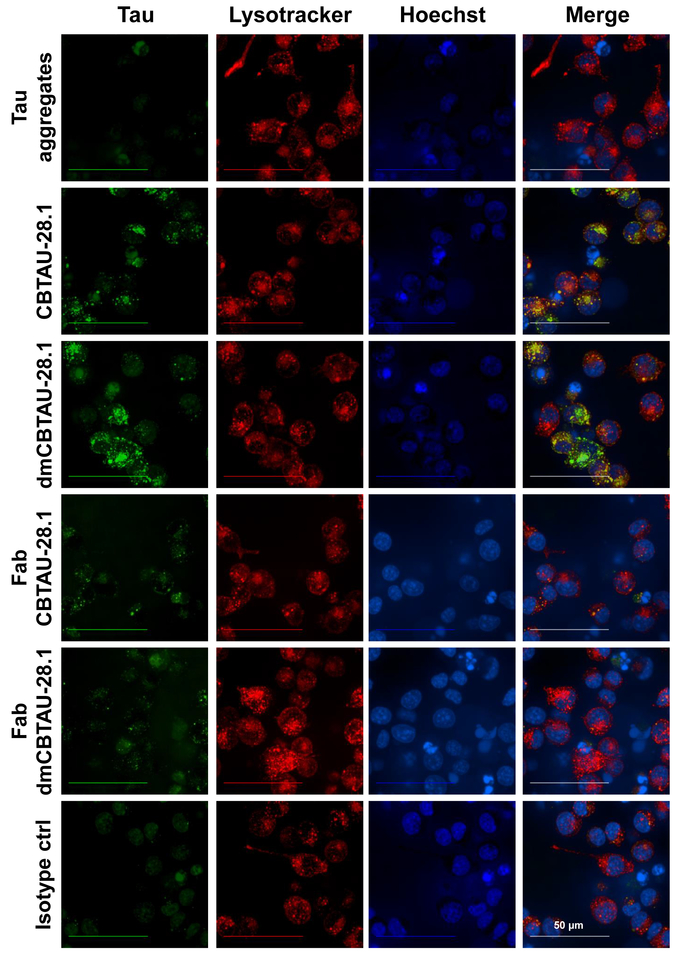
Abbildung 3: Tau Aggregate sind durch BV-2 Zellen verinnerlicht und lokalisieren in zellulären sauren Organellen. Vorgeformte Tau-Antikörper Immunocomplexes wurden für zwei Stunden in Anwesenheit von Heparin Antikörper-unabhängigen Aufnahme blockieren mit BV-2 Zellen inkubiert. Nach der Inkubation wurden Kerne mit einem DNA-spezifischen blauen Farbstoff und die sauren zellulären Fach mit einem niedrigen pH-Wert Fach selektive roten Farbstoff gefärbt. Live Cell Imaging offenbart intrazellulären Puncta beschrifteten Tau Aggregate (grün) in den Zellen, die mit CBTAU-28,1 und DmCBTAU-28,1, aber nicht mit dem Isotype-Steuerelement inkubiert wurden. Außerdem färben intrazellulären Tau-Aggregate, oft mit dem roten colocalized (gelb) Vorhandensein von Tau Aggregate im sauren zellulären Fach hindeutet. CBTAU-28,1 Fab-Fragmente nicht Tau-Aufnahme zeigt einen Fc-Rezeptor vermittelt Internalisierung Mechanismus zu erhöhen. Bilder stellen maximale Intensität Projektionen von einem 20 Flugzeuge Z-Stapel (0,5 µm Ebenen) mit 63 X Wasser eintauchen Zielsetzung erworben. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Mikroglia, der Wohnsitz des Gehirns Immunzellen, vor kurzem wurden als wichtige Akteure bei Antikörper-vermittelten Therapieansätze für Tauopathies10,11. Antikörper-vermittelten Tau Freigabe durch Mikroglia, zusammen mit Sperrung der neuronalen Aufnahme9, Hemmung oder Destabilisierung der Fibrille Bildung13,14 und Abstand der intraneuronal Fibrillen über die lysosomale Weg15, könnten alle die Antikörper Anti-Tau-Wirksamkeit beobachtet im Mausmodell der Tauopathie5,6,7,8,9beitragen.
Wir beschrieben hier eine zellbasierte Assays um Tau Aufnahme von Mikroglia mit dem Ziel der Schaffung einer investigational Tool besser zu charakterisieren, die Mechanismen der Wirkung von Anti-Tau-Antikörpern quantitativ zu bewerten.
Dieser Assay, adaptiert von Funk Et al. 11, verwendet BV-2 Zellen, die unsterblich murinen Mikroglia-Zellen sind. Während sie voll mit primären Mikroglia-Zellen verglichen werden können, verfügen viele der Eigenschaften des primären Mikroglia, einschließlich der Möglichkeit der robust phagozytieren Aβ und Tau Fibrillen11,16,17 ,18,19. Darüber hinaus zeigten sie ein reproduzierbares Verhalten in Vitro machte sie sehr gut geeignet für Assay-Entwicklung und quantitative Studien, die minimale experimentelle Variabilität erfordern. Neben diesem immortalisierte Zelllinien ermöglichen höhere Assay-Durchsatz und beseitigen die Notwendigkeit für Tieropfer gegenüber dem Einsatz von primären Mikroglia.
Die Tau-Aggregate, die wir in diesem Test verwendet wurden erhalten mit dem hoch reproduzierbare in-vitro- Aggregation Verfahren, dass wir vor kurzem beschrieben13und zeigen ähnliche Morphologie, spiralförmigen Filamente (PHFs) isoliert von Gehirnen von AD gepaart Patienten. Während wir keine unerwartete Ergebnisse beobachten, die durch Tau Aggregate Einhaltung Kunststoff oder Glas Oberflächen verursacht worden sein könnte, Rolle die Verwendung von stabilen und gut charakterisierten Tau Aggregate eine entscheidende in der Reproduzierbarkeit des Assays.
Ein weiterer Aspekt, der wesentlich dazu beigetragen, die Reproduzierbarkeit assay war Zelldichte. Die Zahl der Zellen pro Bohrloch im Protokoll beschrieben stellen die optimale Zelldichte in den beschriebenen Bedingungen.
Anders als das, was Funk Et al. 11 beschrieben, mit der Bezeichnung wir Tau-Aggregate mit einem pH empfindlichen Farbstoff, der deutlich erhöht seine Fluoreszenz auf Internalisierung in sauren Organellen, wodurch intrazelluläre Quantifizierung. Dies, zusammen mit Trypsin-Verdauung der Oberfläche gebunden, Immunocomplexes und/oder Tau, Garantien, dass Fluoreszenzsignal Durchflusszytometrie gemessen ist das Ergebnis der Tau Aufnahme anstatt Bindung an der zellularen Oberfläche. Darüber hinaus erfordert die Verwendung von ein pH empfindlichen Farbstoff erleichtert Erkennung von verinnerlichten Tau Aggregate in Mikroskopie Experimente ohne die Notwendigkeit der Verdauung Oberfläche Immunocomplexes/Tau Aggregate gebunden, die dann würde Zelle neu Plattieren und Erholung.
Wir auch weiter optimiert das Mikroskopie-Auslesen von unserem Assay, im Vergleich zu den bisher beschriebenen11, mithilfe eines hochselektiven Farbstoffs für sauren Organellen in unseren Mikroskopie-Experimenten, die uns nicht erlaubt, nur um zu bestätigen, Antikörper-vermittelten Tau-Aufnahme, sondern auch Lokalisierung von Tau Aggregate im Fach Endolysosomal.
Der Test, den wir entwickelt haben, hat optimale Besonderheit, die Ergebnisse in eine gute experimentelle Fenster, so dass eine starke Trennung zwischen positiven und negativen Proben. Interessant ist, erkennt der Assay indirekt Unterschiede in der Antikörper-Affinität, die stellvertretend für eines mächtigen Werkzeugs um Antikörper Anti-Tau-Effektor-Funktionen zu studieren.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir möchten Alberto Carpinteiro Soares für seine wertvolle technische Hilfe danken.
Materialien
| Name | Company | Catalog Number | Comments |
| BV-2 cells | ICLC Interlab Cell Line Collection | ATL03001 | |
| Phosphate Buffered Saline (PBS) (1x) | Gibco | 10010-015 | |
| Trypsin-EDTA 0.05% | Gibco | 25300-054 | |
| DMEM 4.5 g/dL glucose | Gibco | 41966-029 | |
| Fetal Bovine Serum | Gibco | 10091-148 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| L-Glutamine 200 mM | Lonza | 17-605E | |
| EasYFlask | Nunc | 156499 / 159910 | |
| pHrodo Green STP ester | Life Technologies | P35369 | |
| Sodium Bicarbonate pH 8.5 100 mM | |||
| DMSO | Sigma | D2650-100ml | |
| PD10 columns | GE Healthcare | 17-0851-01 | |
| BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Greiner CELLSTAR multiwell culture plates | Greiner | 665180 | |
| Falcon 96-Well Assay Plates | Falcon | 353910 | |
| Heparin | Sigma | H3393-50KU | |
| Trypsin-EDTA 0.25% | Sigma | T4049-100ml | |
| BSA | Sigma | A7030-100G | |
| EDTA 0.5 M, pH8 | |||
| FACS Canto II | BD | ||
| Hoechst 33342 Solution (20 mM) | Thermo Fisher Scientific | 62249 | |
| LysoTracker Deep Red | Thermo Fisher Scientific | L12492 | |
| Opera Phenix | Perkin Helmer | HH14000000 |
Referenzen
- Hefti, F., Goure, W. F., Jerecic, J., Iverson, K. S., Walicke, P. A., Krafft, G. A. The case for soluble Aβ oligomers as a drug target in Alzheimer's disease. Trends in Pharmacological Sciences. 34 (5), 261-266 (2013).
- Castillo-Carranza, D. L., Lasagna-Reeves, C. A., Kayed, R. Tau aggregates as immunotherapeutic targets. Frontiers in bioscience (Scholar edition). 5, 426-438 (2013).
- Martin, L., Latypova, X., Terro, F. Post-translational modifications of tau protein: Implications for Alzheimer's disease. Neurochemistry International. 58 (4), 458-471 (2011).
- Holmes, B. B., Diamond, M. I. Prion-like properties of Tau protein: The importance of extracellular Tau as a therapeutic target. Journal of Biological Chemistry. 289 (29), 19855-19861 (2014).
- Giacobini, E., Gold, G. Alzheimer disease therapy--moving from amyloid-beta to tau. Nature Reviews Neurology. 9 (12), 677-686 (2013).
- Asuni, A. A., Boutajangout, A., Quartermain, D., Sigurdsson, E. M. Immunotherapy targeting pathological tau conformers in a tangle mouse model reduces brain pathology with associated functional improvements. Journal of Neuroscience. 27 (34), 9115-9129 (2007).
- Boutajangout, A., Ingadottir, J., Davies, P., Sigurdsson, E. M. Passive immunization targeting pathological phospho-tau protein in a mouse model reduces functional decline and clears tau aggregates from the brain. Journal of Neurochemistry. 118 (4), 658-667 (2011).
- Chai, X., et al. Passive immunization with anti-Tau antibodies in two transgenic models: reduction of Tau pathology and delay of disease progression. Journal of Biological Chemistry. 286 (39), 34457-34467 (2011).
- Yanamandra, K., et al. Anti-tau antibodies that block tau aggregate seeding in vitro markedly decrease pathology and improve cognition in vivo. Neuron. 80 (2), 402-414 (2013).
- Luo, W., Liu, W., Hu, X., Hanna, M., Caravaca, A., Paul, S. M. Microglial internalization and degradation of pathological tau is enhanced by an anti-tau monoclonal antibody. Scientific Reports. 5, 11161 (2015).
- Funk, K. E., Mirbaha, H., Jiang, H., Holtzman, D. M., Diamond, M. I. Distinct Therapeutic Mechanisms of Tau Antibodies: Promoting Microglial Clearance Versus Blocking Neuronal Uptake. Journal of Biological Chemistry. 290 (35), 21652-21662 (2015).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf/v-myc carrying retrovirus. Journal of neuroimmunology. 27 (2-3), 229-237 (1990).
- Apetri, A., et al. A common antigenic motif recognized by naturally occurring human VH5-51/VL4-1 anti-tau antibodies with distinct functionalities. Acta neuropathologica communications. 6 (1), 43 (2018).
- Schneider, A., Mandelkow, E. Tau-based treatment strategies in neurodegenerative diseases. Neurotherapeutics. 5 (3), 443-457 (2008).
- Congdon, E. E., Gu, J., Sait, H. B., Sigurdsson, E. M. Antibody uptake into neurons occurs primarily via clathrin-dependent Fcgamma receptor endocytosis and is a prerequisite for acute tau protein clearance. Journal of Biological Chemistry. 288 (49), 35452-35465 (2013).
- Bocchini, V., Mazzolla, R., Barluzzi, R., Blasi, E., Sick, P., Kettenmann, H. An immortalized cell line expresses properties of activated microglial cells. Journal of Neuroscience Research. 31 (4), 616-621 (1992).
- Koenigsknecht, J. Microglial Phagocytosis of Fibrillar β-Amyloid through a β1 Integrin-Dependent Mechanism. Journal of Neuroscience. 24 (44), 9838-9846 (2004).
- Kopec, K. K., Carroll, R. T. Alzheimer's β-Amyloid Peptide 1-42 Induces a Phagocytic Response in Murine Microglia. Journal of Neurochemistry. 71 (5), 2123-2131 (2002).
- Marsh, S. E., et al. The adaptive immune system restrains Alzheimer's disease pathogenesis by modulating microglial function. Proceedings of the National Academy of Sciences of the United States of America. 113 (9), E1316-E1325 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten