Method Article
Идентификация, Гистологическая характеристика и рассечение мыши простаты лопастями для в Vitro 3D сфероида культура модели
В этой статье
Резюме
Генетически модифицированные мыши являются полезными моделями для изучения механизмов рака простаты. Здесь мы представляем протокол идентификации и вскрыть простаты долей от мыши мочеполовой системы, дифференцировать их по гистологии и изолировать и культуры первичной клетки простаты в vitro как сфероидов течению анализа.
Аннотация
Генетически модифицированные мыши модели (GEMMs) служат эффективным доклинических моделей для расследования большинства видов человеческого рака, включая рак простаты (PCa). Понимание анатомии и гистология предстательной железы мыши имеет важное значение для эффективного использования и надлежащего описания таких животных моделей. Простаты мышь имеет четыре различных пар лопастями, каждый с их собственными характеристиками. Эта статья демонстрирует метод надлежащего вскрытия и идентификации мыши простаты лопастями для анализа заболеваний. После вскрытия, клетки простаты может быть далее культивировали в vitro механистического понимания. Начиная с мышь первичной клетки простаты, как правило, теряют их обычных характеристик когда культивировали в пробирке, мы приводим здесь метод для изоляции клеток и рост их как 3D сфероида культуры, который является эффективным для сохранения физиологических характеристики клеток. Эти 3D культуры могут использоваться для анализа морфологии клеток и поведение в рядом физиологических условиях, расследование изменены уровни и локализации основных белков и участвовать в разработке путей и прогрессирование болезни и глядя на Ответы на медикаментозного лечения.
Введение
Научное сообщество предпринимает попытки прояснить сложный механизм развития человеческого рака на протяжении десятилетий. В то время как выявление потенциальных ключевых игроков и лекарственных препаратов начинается с пациентом клеток и тканей исследования, поступательные применение таких результатов часто требует использования доклинические животных моделей. Использование генной инженерии мышей, модели (GEMMs) модели человеческого рака неуклонно возросла с момента создания консорциума мыши модели из человеческого рака (NCI-MMHCC), Комитет, который попытался описать и унифицировать характеристики мыши рака модели для ученых во всем мире1,2. Удовлетворить потребность в механистической исследования в доклинических исследованиях большинства типов рака, для понимания развития, прогрессии, ответ на лечение и приобрела сопротивление3мыши модели.
Рак предстательной железы является наиболее часто встречающиеся рака у мужчин, затрагивающих более 160 тысяч людей каждый год4. Агрессивные формы болезни утверждают десятки тысяч жизней каждый год. Однако механизм прогрессирования заболевания еще плохо поняты. Это приводит к серьезной нехватки вариантов эффективного лечения для продвинутых и метастазами рака простаты, что подтверждается высокой смертности больных раком простаты4. Следовательно существует растущая потребность в доклинических моделей для изучения рака простаты. Однако вследствие присущего различия между предстательной железы человека и мыши, моделирование рака простаты в GEMMs не набрали популярность до тех пор, пока система классификации Бар Харбор была введена в 2004 году, который изложил гистопатологические изменения мыши простаты генетической манипуляции, идентификация опухолевых изменений и их связь с этапы прогрессирования рака в людей5. Одной важной характеристикой мыши простаты, что должны быть приняты во внимание при изучении любого простаты ГЭММ модели является наличие четырех отдельных пар лопастями: передний, боковой, брюшной и спинной. Долей представляют существенные различия в шаблон6выражение гистопатология и ген. Probasin белок выражению может варьироваться между лопастями в молодых мышей после полового созревания7, которые должны рассматриваться так, как модели на основе Cre ГЭММ предназначены главным образом с помощью probasin на основе promotor называется Pb-Cre47. Результате пространственные и временные различия в Cre выражение часто приводят к различия в сроки инициирования и прогрессии опухоли, а также различия в опухолевые изменения между лопастями. Следовательно важно учитывать такие различия во время учебы развитие опухоли в предстательной железе GEMMs и индивидуальных долей может потребоваться оцениваться отдельно для достижения воспроизводимость результатов. В первой части этой статьи описывает методы вскрыть мыши простаты, идентифицировать и отдельно каждого лепестка, и признать гистологические различия между лопастями.
В то время как анализ роста опухоли и гистопатологии могут предоставить ценную информацию в развитие опухоли, они не предоставляют больше информации о молекулярных механизмов. Чтобы изучить механизм развития опухоли и прогрессии, часто полезно для анализа клеток опухоли в пробирке. С годами, которые включают культур этих клеток, включая подвеска культур, 3D культур8 были предложены несколько методов и недавно, регулярные 2D культур9. В то время как большинство из этих методов приводит к хорошо ячейку выживания и распространения ставок, 3D культур предоставляют среду, которая ближе всего к физиологических условиях. В 3D или сфероида культур, выращенных в базальной мембраны внеклеточного матрикса (ECM) полностью дифференцированной Люминал клетки обычно имеют очень низкой выживаемости; Однако базальную и промежуточные клетки (в основном, стволовые клетки) способны размножаться и производить кластеры клеток называется сфероидов10. Это делает его пригодным для исследования рака, поскольку считается, что эпителиального рака происходят из стволовых клеток, (известный как рак стволовых клеток)11. Второй частью этот протокол описывает метод для культивирования клеток простаты мыши в 3D культур. Результате сферах может использоваться для нескольких типов течению анализов, включая изучение органоид морфологии и поведение живых клеток, изображений, иммунофлюоресценции, пятнать для различных белков и изучение ответов на химиотерапевтическое лечение.
В целом целью настоящего Протокола является наметить оптимальные методы использования мыши модели рака простаты, описывая анатомии и рассечение методы мыши простаты и обработки ткани на сфероиде культур и в пробирке анализа .
протокол
Согласно рекомендациям, приведенным в институциональных IACUC утверждения протоколов медицинского университета SUNY Upstate были проведены все мыши эксперименты, описанные здесь.
1 рассечение мочеполовой системы (ПХГ)
Примечание: Схема представлена на рисунке 1.
- Усыпить 3-месячного мужчины C57BL/6 мыши с помощью метода ингаляционных эвтаназии CO2 или другого утвержденного технику.
Примечание: Мышей в возрасте от 3 до 12 месяцев может успешно использоваться для эксперимента. Старых мышей (> 6 месяцев) будет скорее имеют больше жира вокруг ПХГ, который нужно будет очищен. Идентификация и разделения долей часто бывает трудно в мышей, моложе, чем 3 месяца. Другие штаммы могут использоваться для эксперимента, а также. - Поместите курсор мыши на его обратно и зафиксируйте ноги с помощью булавки, так что подвергается вентральной стороне животного.
- Spray 70% этанол на животе мыши и протрите его.
Примечание: Брить волосы на животе до вскрытия не требуется. - Поднимите кожу от живота, а также слой мышц, с парой средних тупым щипцов и сделать Перевернутый Y-образный разрез на животе с помощью ножниц.
- Во-первых сделать прямой разрез с острыми ножницами от чуть выше полового члена к грудине (Рисунок 2a).
- Вырежьте из основания разреза на каждый палец, до бедер (рис. 2b). Загнуть кожи с обеих сторон и в нижней части для просмотра всей брюшной области (рис. 2 c-e).
Примечание: Сократить размер меняет зависеть на мыши возраст и размер. Размер первоначальных прямой разрез может варьироваться от 1,5 до 4 см, в зависимости от размера мыши.
- Переместите другие органы подвергать ПХГ. Поднять и переместить Браун желтый кишечника (Рисунок 2f). Подобрать брюшной жир колодки (непрозрачный белый Губчатая ткань) с щипцами и переместить их в стороны (рис. 2г).
Примечание: ПХГ состоит из семенных пузырьков, уретры, простаты, ductus deferens (семяпроводов) и мочевого пузыря. Он может быть идентифицирован характерные пары непрозрачной белой полукруглые арки, (которые являются семенных пузырьков), с мочевого пузыря, заполненные жидкостью мешочек крепится к основанию. Полупрозрачные ткани, расположенной прямо под семенных пузырьков является простаты. - Найдите ПХГ, прочно удерживайте мочевого пузыря с тупым щипцами и поднять весь ПХГ вверх от мыши живота.
Примечание: Если мочевой пузырь полон, слейте ее сначала с небольшой шприц обеспечивают лучшее сцепление с щипцами и уменьшить риск разрыва мочевого пузыря. - Продолжая тянуть на мочевой пузырь, слайд ножницами под мочевого пузыря и простаты вплоть до позвоночника и сделать разрез. Прорваться через любые оставшиеся подключения к брюшной полости (Рисунок 2 h и 2i). Будьте осторожны, чтобы не отрезать слишком близко для ПХГ, чтобы избежать случайного резки через любой простаты ткани.
Примечание: Делая разрез под ПХГ, ножницы следует включить всю дорогу до задней части мыши, таким образом, чтобы вырезать снимки с позвоночником. Этот метод приводит к разрыву почти все соединения между ПХГ и брюшной полости в одной СНиП, сократить время, необходимое для извлечения ткани из мыши. - Удаление ПХГ и поместить его в 2-6 мл, (достаточно, чтобы покрыть ткани) фосфат буфер солевой раствор (PBS) или Дульбекко изменение среднего (DMEM, высокие глюкоза) орел в 6 см Петри (Рисунок 2j и 2 k) и переместить его в рассечение микроскопа (10 X увеличение).
Примечание: Измените рассечения средств массовой информации, требуемой в оставшиеся шаги.
2. Пройдя простаты
- Очистите все жир от дорсальной и вентральной стороны с парой тонкой щипцы и microdissection ножницы (рис. 3a). Используйте подобные хирургические инструменты для остальной части протокола вскрытия.
Примечание: Жир часто тесно переплетается с ПХГ (может быть идентифицирован его белый губчатый внешний вид); Таким образом этот шаг необходимо выполнить тщательно во избежание случайно отсекая от любой ткани простаты. Это может занять до 10-15 мин, чтобы очистить весь жир. - Проводить и тянуть мочевого пузыря с щипцами и СНиП на базе с ножницами (рис. 3b).
- Поместите оставшиеся вентральной стороне ткани вверх. Удерживайте одну ductus deferens пинцетом, проследить его на базу с ножницами и резать его (рис. 3 c), затем повторить на другой стороне. Удаление ductus deferens, теперь оставив простаты (полупрозрачные и гитарная), семенных пузырьков (непрозрачный и белый, полукруглые) и уретры (розово красный и непрозрачные трубка) (рис. 3d и 3e).
- Вставьте щипцы между Внутренняя арка семенных пузырьков и предстательной железы ткани передней долей. Подглядывать врозь семенных пузырьков и предстательной железы и СНиП любой соединительной ткани как необходимое (Рисунок 3f). Trace семенных пузырьков на их базу в уретре и удалить их (рис. 3 g и 3 ч). Будьте осторожны, чтобы не прокалывать их.
- Перейти к вскрыть из отдельных простаты лопастями.
3. Гросс Анатомия предстательной железы и отдельных лепестков Microdissection (рисунки 3i-n, рис. 4)
- Флип ткани с парой тупым щипцов, так что спинной сторона была обращена вверх, показаны спинной лопастями, которые будут похожи на крылья бабочки.
- Соберите спинной лопастями, удерживая мочку пинцетом и ножниц на базе с ножницами (Рисунок 3j).
- Переверните оставшиеся ткани на брюшную сторону.
- Собирать боковых лепестков, которые являются небольшими и обычно обернуть мочеиспускательного канала на стороне, который вклинивается между передней, брюшной и спинной лопастями (рис. 3 k).
- Далее, собирать вентральной лопастями, которые больше, чем боковых лепестков и лежат на уретру вентрально (рис. 3 l).
- Последний, урожай передней долей, самый крупный из четырех, резки и отбрасывая мочеиспускательного канала (рис. 3 m).
- Процесс куски ткани экспериментальных нужд. Перейти к разделу 4 для гистологии, или к разделу 5 для сфероида культуры.
4. Лобе идентификации и морфология гематоксилином и эозином окрашенных слайды
- Исправьте простаты ткани и вставлять его в парафин. Приступайте к пятнать слайды с гематоксилином и эозином (H & E) для просмотра и выявления различий в простаты лопастями, основанный на гистологию, используя характеристики, изложенные Оливейра и др. 12 (рис. 5).
5. обработка ткани для 3D культуры10
Примечание: Это приводится на рисунке 6.
- Продолжите культивирования целом простаты или индивидуальных долей в соответствии с потребностями экспериментальной. Передать 10 см блюдо, содержащий 2-3 мл DMEM простаты ткани. С помощью скальпеля фарш простаты трубочки как мелко и равномерно, как можно скорее под микроскопом рассечение.
- Выполните оставшиеся действия под капотом культуры ткани, в стерильных условиях.
- Передача части ткани вместе с DMEM в 15 мл трубку и увеличить объём 9 мл с DMEM. Добавьте 1 mL 10 x коллагеназы Стоковый раствор смеси DMEM-ткани и вихревой смешивать.
Примечание: Коллагеназа Стоковый раствор 10 мг/мл в Розуэлле парк Мемориальный институт (RPMI) среде, и конечная концентрация в 15 мл-1 мг/мл. - Поместите трубку на вращательный шейкер или трубки ротатор втечение 2 ч при 37 ° C, для коллагеназы к деградации внеклеточного матрикса.
- Центрифуга трубки на 400 g x 5 мин при комнатной температуре.
- Отменить супернатант и Ресуспензируйте в 2 мл теплой 0,05% трипсина ЭДТА к расщеплять-клеток и клеток матрица спайки. Передать трубку до 37 ° C за 5 мин.
Примечание: Если куски ткани слишком велики, чтобы перемешать, Отрежьте кончик пипетку с лезвием бритвы, чтобы сделать более широкое отверстие. - Разбейте любой ткани сгустки, дозирование с пипеткой P1000 8 - 10 раз, а затем повторять с пипеткой P200.
- Нейтрализовать трипсина с 3 мл полной DMEM. Добавьте 500 U DNAase я и хорошо перемешать.
- Пройти через шприц 5 мл 5 - 10 раз с иглой 18 G. Затем пройти через 5 раз с иглой 20 G.
- Повторите шаги 4-8 еще раз, если решение по-прежнему содержит куски большой ткани.
- Фильтр суспензию клеток через фильтр 40 мкм, размещены на тюбик 50 мл. Промойте 15 мл тюбик с 5 мл DMEM и пройти через тот же фильтр. Повторите полоскание.
- Отменить фильтр и центрифуги трубка, содержащая потока через на 400 g x 5 мин при комнатной температуре.
6. покрытие и культивирования клеток
- Ресуспензируйте гранулы в 0,5 мл полной простаты эпителиальных клеток роста среднего (PrEGM). Граф плотность клеток, используя счетчик соматических клеток или Горяева и разбавленных клетки 5 x 105 клеток/мл в полной PrEGM.
Примечание: Доходность от 3-месячного мышь всей предстательной железы может варьироваться от 3 x 105-106 клеток. Следовательно важно сначала Ресуспензируйте Пелле в не более чем 0,5 мл PrEGM (как упоминалось выше) тем, что плотность нужной ячейки может быть достигнута, даже с низкой доходностью. - Mix необходимый объем клеток с базальной мембраны ECM в отношение объема (60% базальной мембраны ECM и 40% суспензию клеток) 2:3 и пластины в нескольких хорошо пластины или слайд палаты в соответствии с потребностями экспериментальной.
Примечание: Для иммуноокрашивания, пластины на стекло дно тарелки или камеры слайды, охватывающих весь хорошо или средней скважины. Пластина вокруг обода хорошо если подсчет результате organoids, или пластины как несколько капель во всем хорошо, если покрытие более высоких объемах. Помните, что не распространять его слишком толстым или слишком тонким. Пластины по меньшей мере 100 мкл ячейки матрицы смеси на 1 см2 покрытие области; Например, в камеру слайд с 2 см2-хорошо площадь поверхности, следует покрытие 200 мкл смеси ячейку матрицы, содержащей 5 х 104 клетки. - Передать пластины/слайд 37 ° C инкубатор с 5% CO2 за 30 минут для базальной мембраны ECM затвердеть. Затем добавьте подогретым полный PrEGM для покрытия колодец, стараясь не нарушить вилку базальной мембраны ECM.
- Удаление половины средств массовой информации и добавить свежие СМИ каждые 2-3 дня. Растут сфероидов на 5-10 дней.
- Продолжите с уборки (шаг 7), иммуноокрашивания (шаг 8), и/или изображений для нисходящие приложения.
7. заготовка сферы
- Чтобы собрать сферах, аспирационная СМИ тщательно не нарушая вилку гель базальной мембраны ECM и добавьте 1 mL 1 мг/мл dispase раствора в PrEGM за 100 мкл базальной мембраны ECM.
Примечание: Это легче урожай сфероидов, если они покрыты в середине колодец или обода (вместо охватывающих весь хорошо), чтобы убедиться что достаточное количество раствора dispase могут быть добавлены к колодцу. - Скрип в нижней части пластины с ячейки скребок для подъема базальной мембраны ECM гель в dispase-PrEGM раствор.
- Пипетки все решение вверх и вниз раз с широким родила 1000 мкл наконечник пипетки или 5 мл пипетки сломать вверх вилку гель на более мелкие куски.
Примечание: Отрежьте кончик кончика пипетки 1000 мкл с лезвием бритвы, чтобы сделать большой родила подсказка. - Инкубируйте в инкубатор 37 ° C с 5% CO2 для 1-2 ч до базальной мембраны ECM полностью не растворится.
Примечание: Это может обеспечиваться путем визуального осмотра при наклона пластины для подтверждения, что нет больше фрагментов геля остаются хорошо дна. - Соберите суспензию клеток в 15 мл Конические трубки.
- Центрифуга сферах на 250 x g 5 мин при комнатной температуре и продолжают с нижнем приложениями.
8. иммуноокрашивания сферах13
Примечание: После сфероидов выросли на нужное количество времени, базальной мембраны ECM может быть распущен и сферах могут быть окрашены, как описано в Colicino и др. 13.
- Кратко промойте культур с PBS и добавьте параформальдегида 4% (PFA) непосредственно в вилку гель базальной мембраны ECM. Инкубируйте 30-90 мин при комнатной температуре с медленно покачивая, пока полностью не растворится базальной мембраны ECM, заменяя свежими PFA каждые 30 мин.
Примечание: PFA растворяют гель вилку и исправить сфероидов во время этого процесса. - Далее мыть с PBS 3 раза и добавление хлорида аммония 50 мм за 10 мин утолить любой аутофлюоресценция из PFA. Повторите для 3 стирок с PBS.
- Разрушения с 0.1% неионные моющее средство для 5 мин и блок с PBSAT (PBS, BSA 1%, 0,5% X-100 Тритон) за 30 мин.
- Проинкубируйте с основного антитела в PBSAT на ночь при 4 ° C, следуют 3 стирок с PBSAT и вторичное антитело в PBSAT втечение 2 ч при комнатной температуре.
- При необходимости повторите автомойки с PBSAT и пятно с DAPI согласно протоколу производителя. Вымойте 3 или более раз с PBS.
- Добавить PBS с 200 мм 1,4-diazabicyclo [2.2.2] октана (DABCO) antifade реагента и приступить к визуализации.
Результаты
Простаты лопастями мыши могут быть определены и расчлененный, используя их расположения относительно семенных пузырьков и мочеиспускательного канала. Мышь простаты состоит из 4 пар лопастями расположен дорсально и вентрально семенных пузырьков и мочеиспускательного канала. На рисунке 4a и 4b (вверху) Показать дорсальной и вентральной представления нетронутыми предстательной железы, семенных пузырьков и мочеиспускательного канала. Нижней панели (рис. 4 c и 4 d) показывают различные лопастями, изложенных для идентификации. Лепестки могут быть отделены от мышей в возрасте 3 месяцев.
Различные простаты лопастями значительно отличаются в гистологии (рис. 5). Все мыши простаты лопастями состоят из нескольких профилей железы состоит из просвета, окруженный секреторных клеток эпителия; Однако форма лепестков, Организация клеток и характер секреции варьируются от доли доли. Идентифицирующие характеристики от H & E-окрашенных мыши которые простат эффективно предложенный Оливейра и др. 12, кратко изложенных здесь. Передней долей имеют умеренно крупных Ацинусы с частым infoldings и сильно Эозинофильный секреции. Дорсальная лопастями появляются как передней с Эозинофильный секреции, но имеют намного меньше Ацинусы и менее infoldings. Боковые лепестки имеют малых и больших ацинусов, с характерной плоской Люминал границ и Эозинофильный секреции. Вентральной лопастями структурно похожи на боковых лепестков, также с плоской Люминал границ, но имеют уникальный Пале не эозинофильная Люминал секрецию.
Предстательной железы клетки мыши могут быть культивировали как сфероидов в базальной мембраны ECM и exhibit эпителия как характеристики. Это изложена как схема на рисунке 6. Клетки были изолированы от мыши простаты, как описано выше и культивировали в базальной мембраны ECM. Клетки начинают расти в organoids в 4 дней культуры в кратчайшие сроки. Рисунок 7 (вверху) показывает представитель поля от 8-дневных культур показаны organoids в базальной мембраны ECM. В условиях вышеупомянутых культуры большинство клеток превращаются в твердых сфер, с долей с частичной или полной люмен внутри. Эти organoids обычно имеют даже сферические морфологии. Organoids собрано и immunostained как описано в Colicino и др. 13. рис 7 (Нижняя панель) показывает органоид без просвета (слева) и с люмен (справа), окрашенных с Фаллоидин (F-актина маркер, зеленый) и DAPI (ядро, синий). Β-катенина является маркером адгезии клеток сильно выражена в ячейке интерфейсов в эпителиальных клетках. Рисунок 8 показывает сильный β-катенина окрашивание (зеленый) на перекрестках ячеек в сфероидов, которые совместно локализовать с F-актина (красный). Сфероидов также выразить Цитокератины 5, Цитокератины 8, p63 и андрогенов рецептор белков, которые предоставляют доказательства того, что сфероидов действительно являются производными от клеток, происходящих из простаты10.
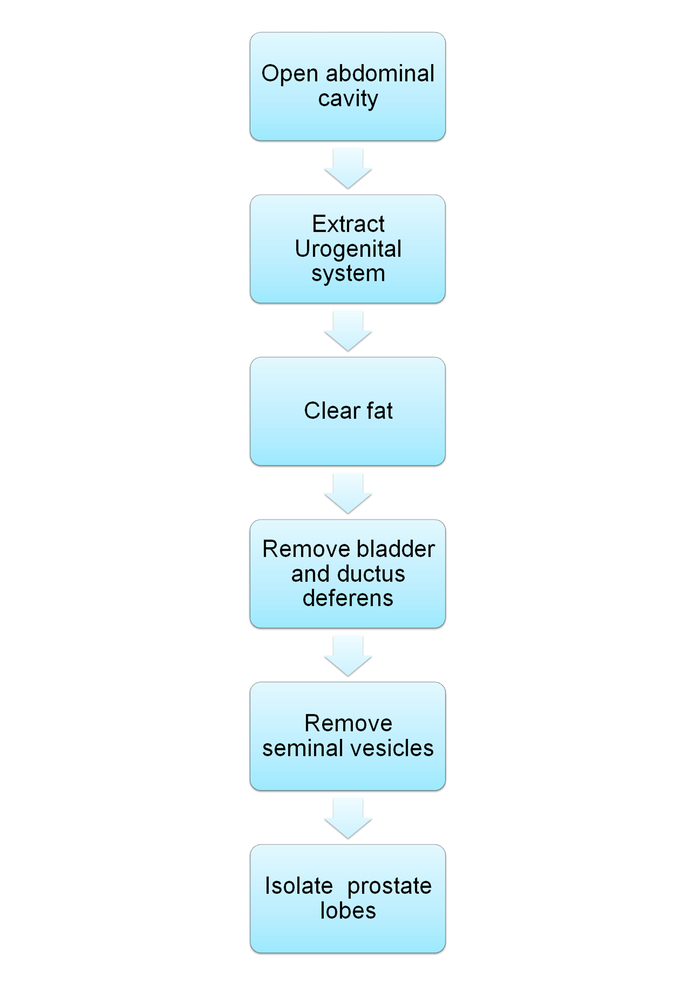
Рисунок 1: схема схема, демонстрируя рассечение мыши мочеполовой системы и изоляции простаты. Схема для протокола шаги, описанные в разделах 1-2. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
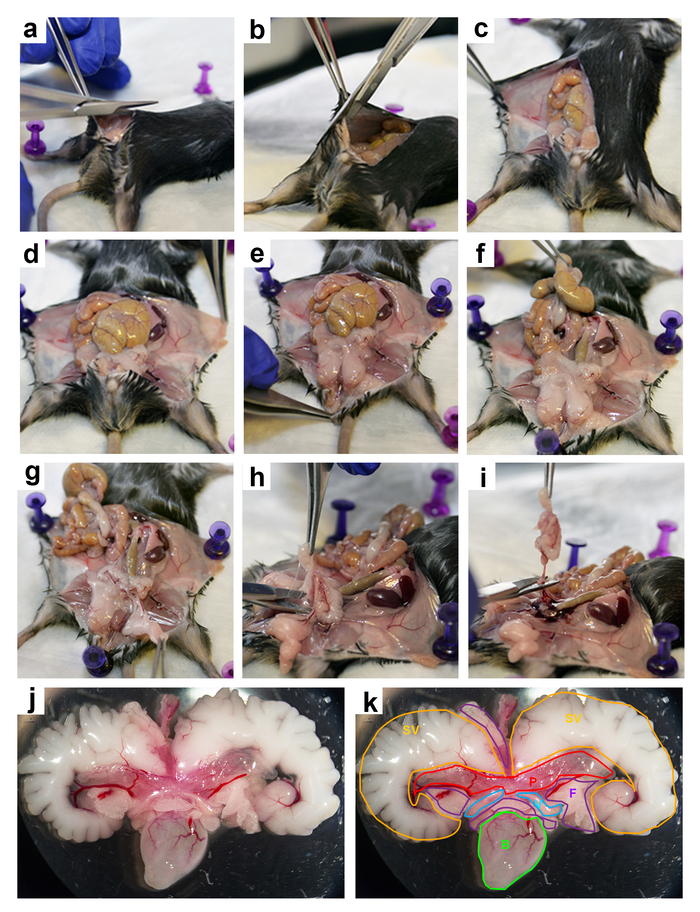
Рисунок 2: рассечение мыши ПХГ. Шаг за шагом изображения из рассечение ПХГ с 3-месячного мыши: (и b) разрезов (c-e) отходили кожу подвергать брюшной области, ветра (f) кишечника, (g) Перемещение живота жировых отложений, (h и i) Извлечение ПХГ из брюшной полости, (j) извлеченный ПХГ, (k) извлеченный ПХГ с различных органов и тканей помечены следующим образом: SV (желтый) = семенных пузырьков; P (красный) = простаты; F (фиолетовый) = жира; V (светло-голубой) = семяпроводов; и B (зеленый) = мочевого пузыря. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: рассечение мыши простаты. Шаг за шагом изображений для рассечения мыши простаты из ПХГ: (a) удаление жира, (b) удаление мочевого пузыря, (c) удаление семявыносящих, (d) брюшной вид простаты с уретры, (e) спинной мнение простаты с уретры, (f-h) Удаление семенных пузырьков, (i) брюшной вид простаты, рассекает (j) спинной лепестка, (k) рассекает боковых лепестков, рассекает (l) брюшной лепестка, (м) рассечения передней доле и лопастями (n) расчлененных простаты: передней = AP, спинной = DP, боковой = LP и брюшной = VP. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Анатомия мыши простаты лопастями. Представитель изображения с 3-месячного мыши ПХГ после удаления жира, мочевого пузыря и семяпроводов. Изображения показывают простаты лопастями с семенных пузырьков и уретры, с спинной (a и c) и вентральный (b и d). Топ групп (и b) показывают нетронутой изображения, в то время как нижней панели (c и d) показывают долей изложенные в голубой (спины), красный (передняя), желтый (вентральной) и зеленый (латеральный). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
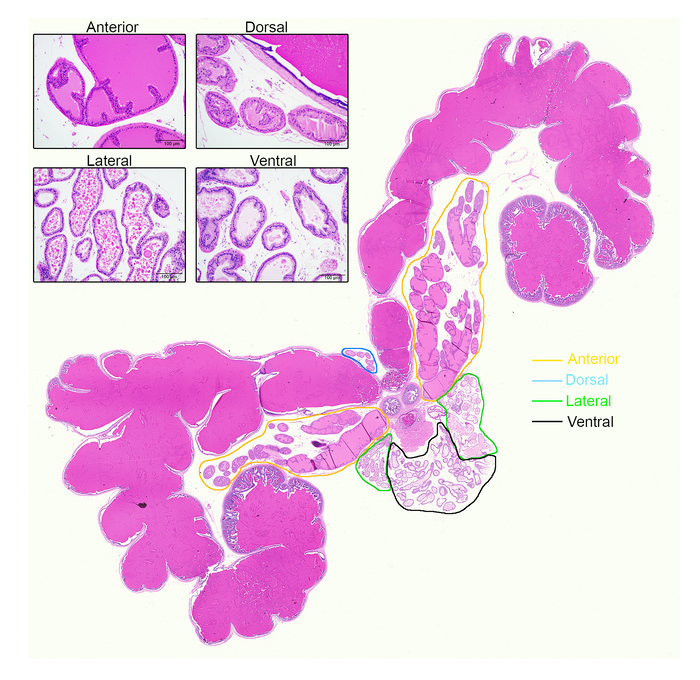
Рисунок 5: различные простаты лопастями значительно различаются по гистологии. Вот H & E-окрашенных целом простаты изображением семенных пузырьков, уретры и четыре простаты лопастями. Лопастями изложены в оранжевый (передняя), синий (спины), зеленый (латеральный) и черный (вентральной). Вставка: представитель изображения от каждого лепестка, под объектив 10 x. Представляет линейку 100 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
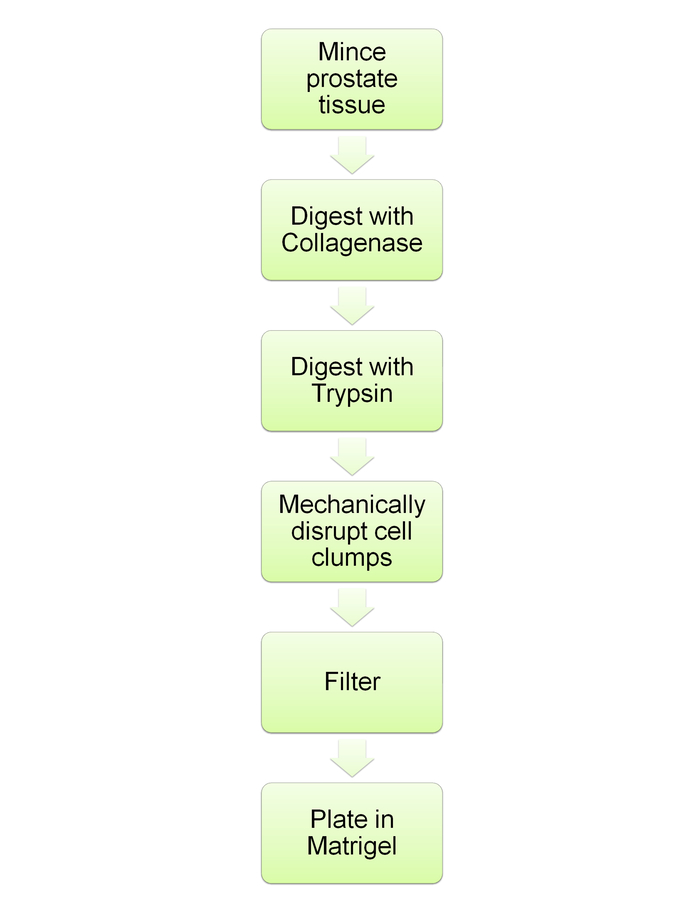
Рисунок 6: схема схема, демонстрируя пищеварение предстательной и последующих сфероида культур. Схема для протокола шаги описаны в разделах 5 и 6. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
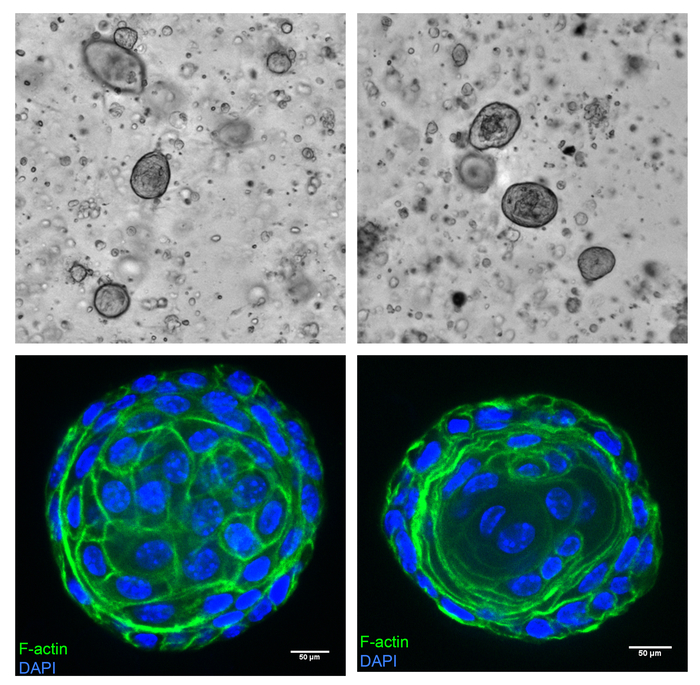
Рисунок 7: предстательной железы клетки растут в даже сферические сфероидов с или без просвета. Простаты ткани заготавливаемым от мыши одичал тип 3-месяц старый был культивированный согласно протоколу. Культур были образы на тарелку тепловизор под объектив 4 X, 8 дней после культуры, показаны формирования сфероидов (вверху). Сфероидов были собраны и витражи, как описано в протоколе с Флюоресцентная краска конъюгированных Фаллоидин для F-актина (зеленый) и DAPI для ядер (синий), затем записи образа на диск Конфокальный микроскоп спиннинг под 40 X воды цель (внизу). Сфероида справа показывает свидетельство люмен. Масштаб бары представляют 50 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 8: мыши простаты organoids Показать соединительной локализации β-катенина. Сфероидов заготавливаемым от 6-дневных 3D культур были пятнами, используя основное антитело против β-катенина и флуоресцентные краски конъюгированных вторичное антитело и записи образа на диск Конфокальный микроскоп спиннинг под 40 X воды цели. Представитель изображения показывают иммуноокрашивания β-Катенин (зеленый, слева), F-актина (красный, средний) и DAPI (синий). Правая панель показывает все 3 каналы объединены. Линейки шкалы представляет 20 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
В этом документе изложены методы для рассечения мыши простаты и идентификации отдельных лепестков. Также описано это протокол для культивирования клеток простаты мыши в 3D культуре для анализа в пробирке .
Важнейшим шагом в протоколе вскрытия-(1) сбор всей ПХГ из мыши и разделения отдельных органов под микроскопом рассечение. Простаты ткани очень маленький и окружен остальной части ПХГ; Таким образом практически невозможно собрать орган непосредственно от полости тела авиаперевозкам все четыре пары лопастями нетронутыми. Следовательно важно собрать весь ПХГ от мыши и затем приступить к Экстракт простаты. Это также важно в настоящем Протоколе (2) выполните своевременно, но остаются дотошный. Время имеет существенное значение во время вскрытия для сведения к минимуму деградации ткани. Конкретные методики, описанные здесь для извлечения ПХГ от мыши быстрее по сравнению с альтернативами и настоятельно рекомендуется. Вся процедура диссекции и доли изоляции обычно занимает 35-40 мин, который может быть снижена до 25 мин с более практике. Наиболее сложной частью диссекция является очистка жира окружающих ПХГ, который занимает большую часть времени всего рассечение. Жир должны быть тщательно удалены, чтобы убедиться, что ни один из его остается с предстательной железы, но важно быть осторожны, чтобы не потерять случайно любой простаты ткани в процессе. Другим важным шагом является (3) не удалять уретры до разделения простаты лопастями. Уретры по существу формирует основание на которой все четыре пары предстательной железы расположены лопастями. Это легче идентифицировать долей, если они по-прежнему привязаны к уретры, основанный на их пространственного распределения в отношении мочеиспускательного канала.
Важным шагом в протоколе культуры сфероид — (1) мясорубки ткани хорошо. Мясорубки в ткани простаты с помощью скальпеля ведь утомительный шаг, особенно простаты ткани имеет липкий характер. Однако мясорубки ткани как можно меньше имеет важное значение для получения максимальной урожайности. Еще одним важным шагом является (2) закупорить после trypsinization и проходящей через шприцы размеров указанных post-neutralization. Оба эти шаги должны выполнена правильно и повторяется, при необходимости, для достижения оптимальной клеток доходность. Наконец это важный (3) чтобы не пластины базальной мембраны ECM слишком толстым или слишком тонким. Если базальной мембраны ECM является слишком тонким покрытием (т.е., меньше, чем 100 мкл/см2), клетки не будет расти в надлежащее organoids в середине колодец, где гель будет тонкий. Обшивка слишком толстая (т.е., более чем 250 мкл/см2) приведет к базальной мембраны ECM не укрепляя должным образом и скольжения покинуть во время изменения средств массовой информации. Покрытие в середине также поможет добиться наиболее даже гель толщины.
Протокол, в описанный может быть слегка изменен экспериментальной нужд. Техника для извлечения ПХГ из брюшной полости требует крепко на мочевого пузыря с щипцами. В случае, если пузырь переполнен, это важно для слива мочевого пузыря с 1 мл шприца и тонкой (26G или аналогичные) иглы, обеспечить надлежащее сцепление, перед началом для извлечения ткани. Ткани следует держать влажным с PBS или DMEM на протяжении всего процесса рассечение. Использование DMEM является предпочтительным, если ткань будет использоваться для сфероида культур. Суспензию заготовленных клеток могут быть отсортированы по проточной цитометрии изолировать суб популяции клеток перед покрытием, при желании, как описано в Лукачем и др. 10.
Гистологические характеристики различных простаты мочки были изложены в настоящем Протоколе, и один должен уметь идентифицировать долей в здоровой ткани простаты, следуя эти руководящие принципы. Однако есть определенные ограничения процесса. В случаях гиперплазия или агрессивные опухоли нарушается эпителиальных морфологии, которые могут сделать это значительно труднее проводить различие между лопастями, основанный на H & E окрашивания. В таких случаях разделение лопастями (как говорится в настоящем протоколе) до встраивания и окрашивания необходимо при необходимости сведения о доле. Даже в здоровой ткани это часто необходимо для анализа долей отдельно, поскольку они представляют большой изменчивости в анатомии и гистологии и дифференциального выражение подписей6. Однако могут обсуждаться трансляционная актуальность разделения долей в мыши простаты, так как человеческий простаты не разделен лопастями. Несмотря на это мыши остается наилучшей моделью для изучения ППТС в естественных условиях, и несколько моделей мышей были развитые14,15. Метод 3D культуры особенно является ключевой метод, который может использоваться для изучения механизмов болезни. Однако одно предостережение метода культуры сфероида возникает от дифференциального шаблон выражения probasin, который является часто используемым промоутер для рекомбиназа КРР в моделях мыши рака простаты. Probasin промоутер преимущественно активируется в Люминал и промежуточные клетки, но не в базальных клеток7. В условиях культуры, описанных здесь способствуем формированию сфероида преимущественно от базальной и промежуточные клетки, но не от Люминал клетки10. Таким образом, результирующая культур на самом деле производят смесь Cre выражая и не выражая Cre сфероидов (т.е., смесь управления и нокаут-сфероидов). В результате в ходе анализа, важно для имунноконтраст для протеина интереса для выявления organoids нокаут- и сделать выводы на органоид поведение на основе гена стук аутов.
Значимость этих методов заключается в многогранный приложения использования GEMMs в исследованиях рака простаты. Рассечение метода, описанного подробно шаги, которые позволят исследователям для извлечения простат, быстрее и более эффективно. Последовательность процесса рассечение предназначен для обеспечения что индивидуальных долей могут быть определены и добытых, даже тех, кто с минимальным опытом работы в простаты вскрытия. Культуры метод конспектированный может использоваться для дальнейшего анализа ГЭММ модели рака простаты. Культуры должны условия для роста и выживания как управления, так и опухолевых клеток. В нашем опыте мы успешно использовали простат ГЭММ, которые демонстрируют mPIN16. Простат мыши с выше класс опухоли также были использованы для анализа культуры сфероида17. Элемент управления мыши сфероидов экспонат даже сферические морфологии; Однако сфероидов, полученные из клеток опухоли простаты могут демонстрировать различия в морфологии и поведении вследствие их неопластических потенциал. Таким образом, изучая органоид поведения в экстракорпорального предоставит расширенную заглянуть в характеристики этих клеток и, возможно, замечания сфероида поведения в режиме реального времени через клеток.
В заключение простаты диссекции и культуры методов, описанных в настоящем Протоколе может включаться в различные типы исследований с участием GEMMs продолжать представлять информацию о рака простаты во всех приложениях, вниз по течению.
Раскрытие информации
Авторы заявляют, что они не имеют никаких финансовых интересов.
Благодарности
Эта работа была поддержана грант от национального института рака, R01CA161018 в ЛК.
Материалы
| Name | Company | Catalog Number | Comments |
| Mouse surgical instruments (Mouse Dissecting kit) | World Precision Instruments | MOUSEKIT | |
| Dissection microscope | |||
| RPMI medium | Thermofisher Scientific | 11875093 | |
| Dissection medium (DMEM + 10%FBS) | Thermofisher Scientific | 11965-084 | |
| Fetal Bovine Serum | Thermofisher Scientific | 10438018 | |
| PBS (Phosphate buffered saline) | Thermofisher Scientific | 10010031 | |
| Collagenase | Thermofisher Scientific | 17018029 | Make 10x stock (10mg/ml) in RPMI, filter sterilize, aliquot and store at -20 °C |
| Trypsin-EDTA (0.05%) | Thermofisher Scientific | 25300054 | |
| DNase I | Sigma-Aldrich | 10104159001 ROCHE | |
| Syringes and Needles | Fisher Scientific | ||
| Fisherbran Sterile Cell Strainers, 40μm | Fisher Scientific | 22-363-547 | |
| PrEGM BulletKit | Lonza | CC-3166 | Add all componenets, aliquot and store at -20 °C. |
| Matrigel membrane matrix | Thermofisher Scientific | CB-40234 | |
| Dispase II powder | Thermofisher Scientific | 17105041 | Make 10x stock (10mg/ml) in PrEGM, filter sterilize, aliquot and store at -20 °C |
Ссылки
- Marks, C. L. Mouse Models of Human Cancers Consortium (MMHCC) from the NCI. Cancer Research. 65 (9 Supplement), 242-243 (2005).
- Marks, C. Mouse Models of Human Cancers Consortium (MMHCC) from the NCI. Disease Models & Mechanisms. 2 (3-4), 111(2009).
- Day, C. P., Merlino, G., Van Dyke, T. Preclinical mouse cancer models: a maze of opportunities and challenges. Cell. 163 (1), 39-53 (2015).
- Society, A. C. Cancer Facts and Figures. , (2018).
- Shappell, S. B., et al. Prostate Pathology of Genetically Engineered Mice: Definitions and Classification. The Consensus Report from the Bar Harbor Meeting of the Mouse Models of Human Cancer Consortium Prostate Pathology Committee. Cancer Research. 64 (6), 2270-2305 (2004).
- Berquin, I. M., Min, Y., Wu, R., Wu, H., Chen, Y. Q. Expression signature of the mouse prostate. Journal of Biological Chemistry. 280 (43), 36442-36451 (2005).
- Wu, X., et al. Generation of a prostate epithelial cell-specific Cre transgenic mouse model for tissue-specific gene ablation. Mechanisms of Development. 101 (1-2), 61-69 (2001).
- Xin, L., Lukacs, R. U., Lawson, D. A., Cheng, D., Witte, O. N. Self-renewal and multilineage differentiation in vitro from murine prostate stem cells. Stem Cells. 25 (11), 2760-2769 (2007).
- Hofner, T., et al. Defined conditions for the isolation and expansion of basal prostate progenitor cells of mouse and human origin. Stem Cell Reports. 4 (3), 503-518 (2015).
- Lukacs, R. U., Goldstein, A. S., Lawson, D. A., Cheng, D., Witte, O. N. Isolation, cultivation and characterization of adult murine prostate stem cells. Nature Protocols. 5 (4), 702-713 (2010).
- Clarke, M. F., Fuller, M. Stem cells and cancer: two faces of eve. Cell. 124 (6), 1111-1115 (2006).
- Oliveira, D. S., et al. The mouse prostate: a basic anatomical and histological guideline. Bosnian Journal of Basic Medical Sciences. 16 (1), 8-13 (2016).
- Colicino, E. G., et al. Gravin regulates centrosome function through PLK1. Molecular Biology of the Cell. 29 (5), 532-541 (2018).
- Ittmann, M., et al. Animal models of human prostate cancer: the consensus report of the New York meeting of the Mouse Models of Human Cancers Consortium Prostate Pathology Committee. Cancer Research. 73 (9), 2718-2736 (2013).
- Valkenburg, K. C., Williams, B. O. Mouse models of prostate cancer. Prostate Cancer. 2011, 895238(2011).
- Xiong, X., et al. Disruption of Abi1/Hssh3bp1 expression induces prostatic intraepithelial neoplasia in the conditional Abi1/Hssh3bp1 KO mice. Oncogenesis. 1, e26(2012).
- Liao, C. P., Adisetiyo, H., Liang, M., Roy-Burman, P. Cancer-associated fibroblasts enhance the gland-forming capability of prostate cancer stem cells. Cancer Research. 70 (18), 7294-7303 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены