Method Article
Identifikation, histologische Charakterisierung und Dissektion der Maus Prostata Lappen für In-vitro-3D Sphäroid Kultur Modelle
In diesem Artikel
Zusammenfassung
Gentechnisch veränderte Mäuse sind nützliche Modelle für die Untersuchung von Prostata-Krebs-Mechanismen. Hier präsentieren wir ein Protokoll zur Identifizierung und sezieren Prostate Lappen aus einer Maus Urogenitales System, basierend auf Histologie, zu unterscheiden und zu isolieren und als Sphäroide für nachgelagerte Analysen der primären Prostata-Zellen in Vitro Kultur.
Zusammenfassung
Gentechnisch veränderte Mausmodelle (GEMMs) dienen als effektive präklinischen Modellen zur Untersuchung von den meisten Arten von menschlichen Krebsarten, einschließlich Prostatakrebs (PCa). Verständnis der Anatomie und Histologie der Maus Prostata ist wichtig für die effiziente Nutzung und richtige Charakterisierung von solchen Tiermodellen. Die Maus-Prostata hat vier verschiedene Paare von Lappen, mit jeweils eigenen Merkmalen. Dieser Artikel beschreibt die richtige Methode der Dissektion und Identifikation der Maus Prostata Lappen für Krankheit-Analyse. Post-Dissektion der Prostata-Zellen weiter kultiviert in Vitro zum mechanistischen Verständnis kann. Seit Maus Prostata Primärzellen neigen dazu, ihre normale Eigenschaften verlieren wenn kultivierte in Vitro, beschreiben wir hier eine Methode für die Zellen zu isolieren und wächst sie als 3D Sphäroid Kulturen, die effektiv für die Erhaltung der physiologischen Eigenschaften der Zellen. Diese 3D Kulturen einsetzbar für Zellmorphologie und Verhalten in der Nähe von physiologischen Bedingungen untersuchen verändert Ebenen und Lokalisierungen der wichtigsten Proteine und Bahnen an der Entwicklung beteiligt und Verlauf der Krankheit zu analysieren und mit Blick auf Antworten auf medikamentöse Behandlungen.
Einleitung
Die wissenschaftliche Gemeinschaft hat versucht, die komplexen Mechanismen der menschlichen Krebsentstehung jahrzehntelang aufzuklären. Während Identifizierung von potenziellen Akteure und Drogeziele mit Patienten Zellen und Gewebe-Studien beginnt, erfordert die translatorische Anwendung solcher Befunde oft die Verwendung von präklinischen Tiermodellen. Die Verwendung von gentechnisch veränderten Mäusen Modelle (GEMMs) bis Modell menschlichen Krebsarten ist kontinuierlich gestiegen, seit der Gründung des Maus Modelle der menschlichen Krebserkrankungen Consortium (NCI-MMHCC), ein Ausschuss, der versucht, zu beschreiben und zu vereinheitlichen Eigenschaften von Maus-Krebs Modelle für Wissenschaftler weltweit1,2. Maus-Modelle erfüllen die Notwendigkeit mechanistische Studien in präklinischen Studien für die meisten Krebsarten, für das Verständnis von Entwicklung, Fortschritt, Reaktion auf Behandlungen, und Resistance3erworben.
Prostatakrebs ist die am häufigsten auftretende Krebserkrankung bei Männern, betrifft mehr als 160.000 Männer jedes Jahr4. Aggressivere Formen der Erkrankung Anspruch auf Zehntausende von Leben jedes Jahr. Allerdings ist der Mechanismus des Fortschreitens der Krankheit immer noch schlecht verstanden. Dies führt zu einem gravierenden Mangel an effektiven Behandlungsmöglichkeiten für fortgeschrittenen und metastasierten Prostata-Krebs, wie die hohe Sterblichkeitsrate in fortgeschrittenem Prostatakrebs Patienten4belegt. Daher gibt es ein wachsendes Bedürfnis nach präklinischen Modellen, Prostata-Krebs zu studieren. Allerdings aufgrund der inhärenten Unterschiede zwischen der Maus und der menschlichen Prostata, Modellierung von Prostatakrebs bei GEMMs nicht Popularität gewinnen bis Bar Harbor Klassensystem im Jahr 2004 eingeführt wurde, die histopathologischen in der Maus Veränderungen Prostata auf Genmanipulation, Identifikation von neoplastischen Veränderungen und ihre Beziehung zu Stadien der Krebsentwicklung im Menschen5. Ein wichtiges Merkmal der Maus Prostata, die während des Studiums Prostata GEMM-Modell berücksichtigt werden muss ist das Vorhandensein von vier verschiedene Paare von Lappen: anterior, seitliche, ventral und dorsal. Die Lappen zeigen signifikante Unterschiede in der Histopathologie und Gen Ausdruck Muster6. Probasin Protein Expressionsmuster variiert zwischen Lappen in jungen Post-Pubertät Mäusen7, die da GEMM Cre-basierte Modelle meist sollen berücksichtigt werden müssen, mit einer probasin-basierte Promotor Pb-Cre4-7genannt. Die daraus resultierenden unterschiedlichen räumlichen und zeitlichen Cre Ausdruck oft führen zu Unterschieden im Tumor Initiation und Progression Timelines sowie Unterschiede in neoplastischen Veränderungen zwischen den Lappen. Also, es ist wichtig, um diese Unterschiede zu berücksichtigen, während seines Studiums der Tumorentstehung in der Prostata GEMMs, und die einzelnen Lappen müssen separat bewertet werden, um reproduzierbare Ergebnisse zu erzielen. Der erste Teil dieses Artikels beschreibt die richtigen Methoden, um eine Maus Prostata zu sezieren, identifizieren und jeder Lappen zu trennen und erkennen die histologischen Unterschiede zwischen den Lappen.
Während die Analyse von Tumorwachstum und Histopathologie wertvolle Einblicke in die Entwicklung von Tumoren bereitstellen kann, bieten sie nicht viele Informationen über molekulare Mechanismen. Um den Mechanismus der Tumorentstehung und Progression zu studieren, ist es oft sinnvoll, die Tumor-Zellen in Vitrozu analysieren. Im Laufe der Jahre, die Kulturen dieser Zellen, einschließlich Suspensionskulturen, 3D Kulturen8 beinhalten verschiedene Methoden vorgeschlagen worden und vor kurzem, regelmäßigen 2D Kulturen9. Während die meisten dieser Methoden gute Zelle überleben und Verbreitung Preise führen, bieten 3D Kulturen eine Umgebung, die physiologischen Bedingungen am nächsten kommt. In 3D oder Sphäroid Kulturen in einer Basalmembran extrazelluläre Matrix (ECM) angebaut haben der luminalen ausdifferenzierten Zellen in der Regel sehr geringe Überlebensrate; die basalen und mittleren Zellen (meist Stammzellen) sind jedoch in der Lage zu propagieren und zellcluster namens Sphäroide10zu produzieren. Dies macht es geeignet für eine Krebs-Studie, da epitheliale Krebsarten werden geglaubt, um aus Stammzellen (im Volksmund bekannt als Krebs-Stammzellen)11stammen. Der zweite Teil dieses Protokolls beschreibt eine Methode für die Kultivierung der Maus Prostatazellen in 3D Kulturen. Die daraus resultierende Sphären können für verschiedene Arten von nachgeschalteten Analysen, einschließlich das Studium der organoide Morphologie und Verhalten von live Cell imaging, Immunfluoreszenz-Färbung für verschiedene Proteine und das Studium der Antworten auf Chemotherapeutika verwendet werden Behandlungen.
Insgesamt ist das Ziel dieses Protokolls, optimale Methoden für die Verwendung von Maus-Modellen bei Prostatakrebs durch die Beschreibung der Anatomie und Dissektion Techniken der Maus Prostata und die Verarbeitung des Gewebes für Sphäroid Kulturen und in-vitro- Analyse zu skizzieren .
Protokoll
Alle hier beschriebenen Maus-Experimente wurden nach den Richtlinien in der institutionellen IACUC zugelassene Protokolle SUNY Upstate Medical University durchgeführt.
(1) die Dissektion des Urogenitalsystems (UGS)
Hinweis: Der Schaltplan ist in Abbildung 1dargestellt.
- Einschläfern Sie eine 3-Monate-alten männliche C57BL/6-Maus mit CO2 inhalativer Euthanasie Methode oder eine andere anerkannte Technik.
Hinweis: Mäuse im Alter von 3 bis 12 Monaten können erfolgreich für das Experiment verwendet werden. Ältere Mäuse (> 6 Monate) haben wahrscheinlich mehr Fett rund um die UGS, die gelöscht werden müssen. Identifizierung und Trennung der Lappen ist oft schwierig bei Mäusen, die jünger als 3 Monate. Andere Stämme können für das Experiment, sowie verwendet werden. - Platzieren Sie den Mauszeiger auf dem Rücken und sichern Sie die Beine mit Stiften, so dass die ventrale Seite des Tieres ausgesetzt ist zu.
- Sprühen Sie 70 % igem Ethanol auf der Maus Bauch und wischen Sie es sauber.
Hinweis: Rasur der Bauch Haare bevor Dissektion nicht erforderlich ist. - Heben Sie die Haut aus dem Bauch, zusammen mit der Muskelschicht mit ein paar mittlere stumpfe Pinzette und machen Sie einen umgekehrten Y-shaped Schnitt auf dem Bauch mit einer Schere.
- Stellen Sie zunächst einen geraden Schnitt mit einer scharfen Schere aus knapp oberhalb des Penis auf dem Brustbein (Abbildung 2a).
- Schneiden Sie von der Basis des Schnittes in Richtung jeder Zehe bis zu den Oberschenkeln (Abb. 2 b). Klappen Sie die Haut auf beiden Seiten und an der Unterseite der gesamten Bauchbereich (Abbildung 2 c-e) anzeigen.
Hinweis: Die Schnittgröße variiert abhängig von der Maus Alter und Größe. Die Größe der ursprünglichen geraden Schnitt reichen von 1,5 bis 4 cm, abhängig von der Größe der Maus.
- Bewegen Sie über die anderen Organe, UGS verfügbar zu machen. Heben Sie und bewegen Sie den Braun-Gelb Darm (Abb. 2f). Holen Sie die Abdominal-Fettpölsterchen (die undurchsichtige weiße Schwammgewebe) mit Zange und verschieben Sie sie auf den Seiten (Abbildung 2 g).
Hinweis: Die UGS besteht aus den Samenbläschen, der Harnröhre, Prostata, Ductus Deferens (Vas Deferens) und Harnblase. Es kann identifiziert werden durch die charakteristischen paar undurchsichtige weiße Rundbögen (die die Samenbläschen sind), mit Flüssigkeit gefüllte Blase Sac an der Basis befestigt. Das durchscheinende Gewebe befindet sich direkt unter der Samenbläschen ist die Prostata. - Suchen Sie UGS, fest halten Sie der Harnblase mit stumpfen Pinzette, und heben Sie die gesamte UGS nach oben aus dem Maus-Bauch.
Hinweis: Wenn die Blase voll ist, abtropfen lassen Sie es zuerst mit einer kleinen Spritze sorgen für einen besseren Halt mit der Zange und reduzieren das Risiko einer Ruptur der Blase. - Weiter auf die Blase, Folie der Schere unterhalb der Blase und Prostata bis hin zu der Wirbelsäule hochziehen und machen Sie einen Schnitt. Alle übrigen Verbindungen in den Bauchraum (Abbildung 2 h und 2i) durchschneiden. Achten Sie darauf, nicht zu nah, UGS, versehentliche durchschneiden jede Prostatagewebe zu vermeiden schneiden.
Hinweis: Während machen den Schnitt unter der UGS, sollte die Schere ganz an das Ende der Maus eingefügt werden, dass der Schnitt der Wirbelsäule sowie schnappt. Diese Methode führt durchtrennen fast alle Verbindungen zwischen UGS und der Bauchhöhle in einem Snip, reduzieren den Zeitaufwand für das Gewebe von der Maus zu extrahieren. - UGS zu entfernen und legen Sie sie in 2 bis 6 mL (genug, um das Gewebe zu bedecken) von Phosphat gepufferte Kochsalzlösung (PBS) oder Dulbeccos geändert Eagle Medium (DMEM, hohe Glukose) in einem 6 cm Petrischale (Abbildung 2j und 2 k) und verschieben Sie ihn auf eine Dissektion Mikroskop (10 X (Vergrößerung).
Hinweis: Ändern Sie die sezierenden Medien je nach Bedarf in den verbleibenden Schritten.
(2) sezieren die Prostata
- Deaktivieren Sie das Fett von den dorsalen und ventralen Seiten mit einer feinen Pinzette und Mikrodissektion Schere (Abb. 3a). Verwenden Sie ähnliche chirurgische Instrumente für den Rest des Protokolls Dissektion.
Hinweis: Das Fett ist oft eng mit UGS verflochten (erkennbar durch seine weißen schwammigen aussehen); Daher muss dieser Schritt sorgfältig durchgeführt werden, um zu vermeiden, versehentlich aus jedem Prostatagewebe schnippeln. Es dauert bis zu 10-15 min um das Fett zu löschen. - Halten Sie und ziehen Sie die Blase mit der Zange und schneiden Sie es an der Basis mit der Schere (Abb. 3 b).
- Legen Sie die restlichen Gewebe Bauchseite nach oben. Halten ein Ductus Deferens mit einer Pinzette, mit der Schere, an der Basis zu verfolgen und snip (Abb. 3 c), dann auf der anderen Seite wiederholen. Entfernen der Ductus Deferens, verlassen jetzt hinter der Prostata (durchscheinend und Ungeziefer), Samenbläschen (deckend und weiß, halbrunde) und Harnröhre (rosa-rot und undurchsichtig Röhre) (Abbildung 3d und 3e).
- Legen Sie die Zange zwischen den inneren Bogen der Samenbläschen und Prostata-Gewebe vorderen Lappen. Hebeln auseinander die Samenbläschen und Prostata und schnippeln alle Bindegewebe als benötigt (Abbildung 3f). Verfolgen Sie die Samenbläschen zu ihrer Basis in die Harnröhre zu und zu entfernen Sie (Abbildung 3 g und 3 h). Achten Sie darauf, dass Sie nicht sie zu durchbohren.
- Fahren Sie mit den einzelnen Prostata Lappen zu sezieren.
(3) Gross Anatomie der Prostata und einzelnen Lappen Mikrodissektion (Abb. 3i-n, Abbildung 4)
- Drehen Sie das Gewebe mit einer stumpfen Pinzette, so dass die dorsale Seite, Gesichter zeigen die dorsalen Lappen, die einen Schmetterling Flügel ähneln werden.
- Sammeln Sie die dorsalen Lappen durch halten des Lappens mit Pinzette und schnippeln an der Basis mit einer Schere (Abbildung 3j).
- Drehen Sie das restliche Gewebe auf der Bauchseite.
- Sammeln Sie die seitlichen Lappen, die klein sind und in der Regel wickeln Sie die Harnröhre auf der Seite, die sind eingekeilt zwischen den vorderen ventralen und dorsalen Lappen (Abbildung 3-k).
- Sammeln Sie als nächstes die ventralen Lappen, die sind größer als die seitlichen Lappen und legen Sie sich auf die Harnröhre ventral (Abbildung 3 l).
- Letzte, ernten die vorderen Lappen, die größten der vier, durch Ausschneiden und verwerfen die Harnröhre (Abbildung 3 m).
- Die Gewebe-Stücke nach experimentellen Bedürfnissen zu verarbeiten. Fahren Sie mit Abschnitt 4 für Histologie oder Abschnitt 5 der Sphäroid-Kultur.
4. Lobe Identifikation und Morphologie von Hämatoxylin und Eosin-gefärbten Folien
- Das Prostatagewebe zu beheben und Binde sie in Paraffin. Fahren Sie mit der Färbung der Folien mit Hämatoxylin und Eosin (H & E) zu sehen und erkennen Unterschiede in der Prostata Lappen anhand der Histologie, mit den Merkmalen von Oliveira Et al.beschrieben. 12 (Abbildung 5).
5. Verarbeitung des Gewebes für 3D Culture10
Hinweis: Dies ist in Abbildung 6dargestellt.
- Fahren Sie mit der Kultivierung der ganzen Prostata oder einzelnen Lappen gemäß den experimentellen Bedürfnisse. Übertragen Sie das Prostatagewebe auf eine 10 cm Schale mit ca. 2-3 mL DMEM. Mit einem Skalpell die Prostata Tubuli Hackfleisch als fein und gleichmäßig wie möglich unter dem Mikroskop Dissektion.
- Fahren Sie mit den verbleibenden Schritten unter einer Gewebekultur-Haube, unter sterilen Bedingungen.
- Übertragen Sie die Gewebe-Stücke zusammen mit der DMEM auf eine 15 mL Tube und erhöhen Sie die Lautstärke bis 9 mL mit DMEM. Am DMEM-Gewebe Mischung und Vortex mischen fügen Sie 1 mL 10 X Kollagenase Stammlösung hinzu.
Hinweis: Kollagenase-Stammlösung ist 10 mg/mL in Roswell Park Memorial Institute (RPMI) Medium und die Endkonzentration in der 15 mL Tube ist 1 mg/mL. - Legen Sie das Rohr auf einen gyratory Shaker oder tube Rotator für 2 h bei 37 ° C für die Kollagenbildung, die extrazelluläre Matrix zu vermindern.
- Zentrifugieren Sie das Rohr auf 400 X g für 5 min bei Raumtemperatur.
- Den überstand verwerfen und Aufschwemmen in 2 mL warmen 0,05 % Trypsin-EDTA, die Zell-Zell und Zellmatrix Verwachsungen zu Spalten. Übertragen Sie das Rohr auf 37 ° C für 5 min.
Hinweis: Wenn die Gewebe-Stücke zu groß, um gut zu mischen sind, schneiden Sie die PIPETTENSPITZE mit einer Rasierklinge, eine weitere Mensur zu machen. - Brechen Sie alle Gewebe Klumpen durch Pipettieren mit einer Pipette P1000 8-10 Mal, dann wiederholt mit einer Pipette P200.
- Die Trypsin mit 3 mL komplette DMEM zu neutralisieren. Hinzufügen von DNAase 500 U ich und gut mischen.
- Durchlaufen einer 5 mL Spritze 5-10 mal mit einer 18 G-Nadel. Dann durchlaufen Sie 5 Mal mit einer Nadel 20 G.
- Wiederholen Sie die Schritte 4-8 einmal mehr, wenn die Lösung noch große Gewebe Stücke enthält.
- Filtern Sie die Zellsuspension durch einen 40 μm-Filter auf eine 50 mL-Tube gelegt. Spülen Sie die 15 mL Tube mit 5 mL DMEM und denselben Filter durchlaufen. Wiederholen Sie die Spülung.
- Verwerfen Sie den Filter und Zentrifugieren Sie die Röhrchen mit den Durchfluss bei 400 X g für 5 min bei Raumtemperatur.
(6) Beschichtung und Kultivierung der Zellen
- Aufschwemmen Sie das Pellet in 0,5 mL komplette Prostata epitheliale Zelle Wachstumsmedium (PrEGM). Zählen Sie die Zelldichte mit einer Zelle Zähler oder Hemocytometer und verdünnen Sie die Zellen bis 5 x 105 Zellen/mL in kompletten PrEGM.
Hinweis: Der Ertrag aus einem 3-Monate-alten Maus ganze Prostata reichen von 3 x 105-106 Zellen. Daher ist es wichtig, zunächst das Pellet in nicht mehr als 0,5 mL PrEGM Aufschwemmen (siehe oben), so dass die gewünschte Zelldichte kann, auch mit geringer Ausbeute erreicht werden. - Mix die erforderliche Menge von Zellen mit der Basalmembran ECM in eine 2:3 Volumenverhältnis (60 % Basalmembran ECM und 40 % Zellsuspension) und Platte in einem Multi-well-Platte oder Folie Kammer gemäß den experimentellen Bedürfnisse.
Hinweis: Für Immunostaining, Platte auf Glas-Bodenplatten oder Kammer Folien, die das gesamte gut oder in der Mitte des Brunnens. Platte rund um den Rand des Brunnens, wenn die resultierenden Organellen zu zählen, oder Platte mehrere Tropfen ganz gut, wenn höhere Volumina Plattieren. Achten Sie darauf, nicht zu dick oder zu dünn verbreiten. Platte mindestens 100 µL Matrixzelle Mischung pro 1 cm2 von galvanischen Bereich; zum Beispiel in einer Kammer-Folie mit einer 2 cm2-gut Fläche, 200 µL Matrixzelle Gemisch mit 5 x 104 Zellen sollte vergoldet. - Übertragen Sie die Platte/Folie in einen Inkubator 37 ° C mit 5 % CO2 für 30 min für die Basalmembran ECM zu festigen. Fügen Sie dann die vorgewärmte komplette PrEGM zur Deckung den Brunnen, kümmert sich nicht um die Basalmembran ECM Stecker zu stören.
- Entfernen Sie die Hälfte der Medien und fügen Sie alle 2-3 Tage frische Medien hinzu. Wachsen Sie Sphäroide für 5-10 Tage.
- Fahren Sie mit der Ernte (Schritt 7), Immunostaining (Schritt 8) und/oder imaging für downstream-Anwendungen.
7. die Ernte der Sphären
- Um Kugeln zu ernten, Aspirieren Sie die Medien sorgfältig ohne zu stören des Basalmembran ECM Gel Steckers und 1 mL 1 mg/mL Dispase Lösung in PrEGM pro 100 µL der Basalmembran ECM.
Hinweis: Es ist einfacher, Sphäroide zu ernten, wenn sie in der Mitte der Brunnen oder die Felge (statt deckt den ganzen Brunnen), überzogen sind, sicherzustellen, dass eine ausreichende Menge an die Dispase-Lösung zum Brunnen hinzugefügt werden kann. - Kratzen Sie die Unterseite der Platte mit einem Schaber Zelle abheben der Basalmembran ECM Gel in die Dispase-PrEGM-Lösung.
- Pipette die gesamte Lösung nach oben und unten einmal mit einer großen Bohrung 1000 µL PIPETTENSPITZE oder 5-mL-Pipette, die Gel-Stecker in kleinere Stücke brechen.
Hinweis: Schneiden Sie die Spitze von einer 1000 µL PIPETTENSPITZE mit einer Rasierklinge, einen große Bohrung Tipp zu machen. - Brüten Sie in einem Inkubator 37 ° C mit 5 % CO2 für 1-2 h bis der Basalmembran ECM vollständig aufgelöst hat.
Hinweis: Dies kann sichergestellt werden, durch visuelle Inspektion der gut unten beim Kippen der Platte zu bestätigen, dass keine weitere Stücke von Gel bleiben. - Die Zellsuspension in einem 15 mL konische Röhrchen zu sammeln.
- Zentrifugieren Sie Kugeln bei 250 X g für 5 min bei Raumtemperatur und mit downstream-Anwendungen weiter.
8. Immunostaining Sphären13
Hinweis: Nach Sphäroide für den gewünschten Zeitraum hinweg gewachsen sind, löst sich der Basalmembran ECM und Kugeln können gebeizt werden, wie in Colicino Et Al. beschrieben 13.
- Kurz, spülen Sie die Kulturen mit PBS und fügen Sie 4 % Paraformaldehyd (PFA hinzu) der Basalmembran ECM Gel Stecker direkt. Inkubieren Sie 30-90 min. bei Raumtemperatur langsam zu schütteln, bis der Basalmembran ECM vollständig aufgelöst ist, frische PFA alle 30 min. zu ersetzen.
Hinweis: Die PFA löst den Gel-Stecker und die Sphäroide während dieses Prozesses zu beheben. - Als nächstes mit PBS 3 Mal waschen Sie und fügen Sie 50 mM Ammoniumchlorid für 10 min Autofluoreszenz aus der PFA zu stillen hinzu. Wiederholen Sie für 3 Waschgänge mit PBS.
- Permeabilize mit 0,1 % nicht-ionische Reinigungsmittel für 5 min und Block mit PBSAT (PBS, 1 % BSA, 0,5 % Triton x-100) für 30 min.
- Mit einem primären Antikörper in PBSAT über Nacht bei 4 ° C, gefolgt von 3 Wäschen mit PBSAT und einem Sekundärantikörper in PBSAT für 2 h bei Raumtemperatur inkubieren.
- Wiederholen Sie die Waschungen mit PBSAT und Fleck mit DAPI laut Protokoll des Herstellers, falls gewünscht. Waschen Sie 3 oder mehr Mal mit PBS.
- PBS mit 200 mM 1,4-Diazabicyclo [2.2.2] Oktan (DABCO) antifade Reagenz hinzufügen und weiter zur Bildgebung.
Ergebnisse
Die Maus Prostata Lappen identifiziert werden können und seziert mit ihren Standorten in Bezug auf die Samenbläschen und der Harnröhre. Die Maus-Prostata besteht aus 4 Paare der Lappen liegt dorsal und ventral, der Samenbläschen und der Harnröhre. Abbildung 4a und 4 b (oben) zeigen den dorsalen und ventralen intakt Prostata, zusammen mit der Samenbläschen und der Harnröhre. Die unteren Verkleidungen (Abbildung 4 c und 4D) zeigen die verschiedenen Lappen für Identifikation skizziert. Lappen können Mäuse im Alter von 3 Monaten getrennt werden.
Die verschiedenen Prostata Lappen unterscheiden sich deutlich in der Histologie (Abbildung 5). Alle Maus Prostata Lappen bestehen aus mehreren Drüse Profilen, bestehend aus einem Lumen von sekretorische Epithelzellen umgeben; die Form der Lappen, Organisation der Zellen und Art der Sekretion variieren jedoch von Lappen, Lappen. Die kennzeichnende Merkmale von H & E-gefärbten Maus von Prostata effizient von Oliveira Et Al. dargelegten 12, hier kurz skizziert. Vordere Lappen haben Moderate bis große Azini mit häufigen Infoldings und stark eosinophile Sekretion. Dorsale Lappen erscheinen mag anterior mit Eosinophilen Sekretion aber habe viel kleiner Azini und weniger Infoldings. Seitlichen Lappen haben kleine und große Azini mit charakteristischen flachen luminalen Grenzen und eosinophile Sekretion. Ventrale Lappen sind strukturell wie seitlichen Lappen, auch mit flachen luminalen Grenzen, sondern haben ein einzigartiges blass nicht eosinophile luminalen Sekret.
Maus-Prostate-Zellen können als Sphäroide in der Basalmembran ECM gezüchtet werden und epithelialen-ähnliche Eigenschaften aufweisen. Dies ist als eine schematische Darstellung in Abbildung 6dargestellt. Zellen wurden isoliert von der Maus Prostata wie oben und kultiviert in der Basalmembran ECM beschrieben. Die Zellen wachsen in Organellen in bereits 4 Tage der Kultur beginnen. Abbildung 7 (oben) zeigt repräsentative Felder aus 8 Tage alten Kulturen zeigt die Organellen in der Basalmembran ECM. Unter den oben genannten Kulturbedingungen wachsen die meisten Zellen in festen Kugeln, mit einem Bruchteil mit einer teilweisen oder vollständigen Lumen im Inneren. Diese Organellen haben in der Regel eine auch sphärische Morphologie. Organellen wurden geerntet und Immunostained als in Colicino Et Al. beschrieben 13. Abbildung 7 (Bodenplatte) zeigt eine organoide ohne ein Lumen (links) und mit einem Lumen (rechts), gebeizt mit Phalloidin (F-Aktin Marker, grün) und DAPI (Zellkern, blau). Β-Catenin ist ein Zell-Zell-Adhäsion-Marker an Zell-Zell-Schnittstellen in epithelialen Zellen stark zum Ausdruck. Abbildung 8 zeigt starke β-Catenin Färbung (grün) an den Zell-Zell-Verbindungen in Sphäroide, die Zusammenarbeit mit F-Aktin (rot) zu lokalisieren. Auch Ausdruck der Sphäroide Cytokeratin 5, Cytokeratin 8, p63 und Androgen-Rezeptor-Proteine, die nachweisen können, dass die Sphäroide mit Ursprung in der Prostata10Zellen in der Tat abgeleitet werden.
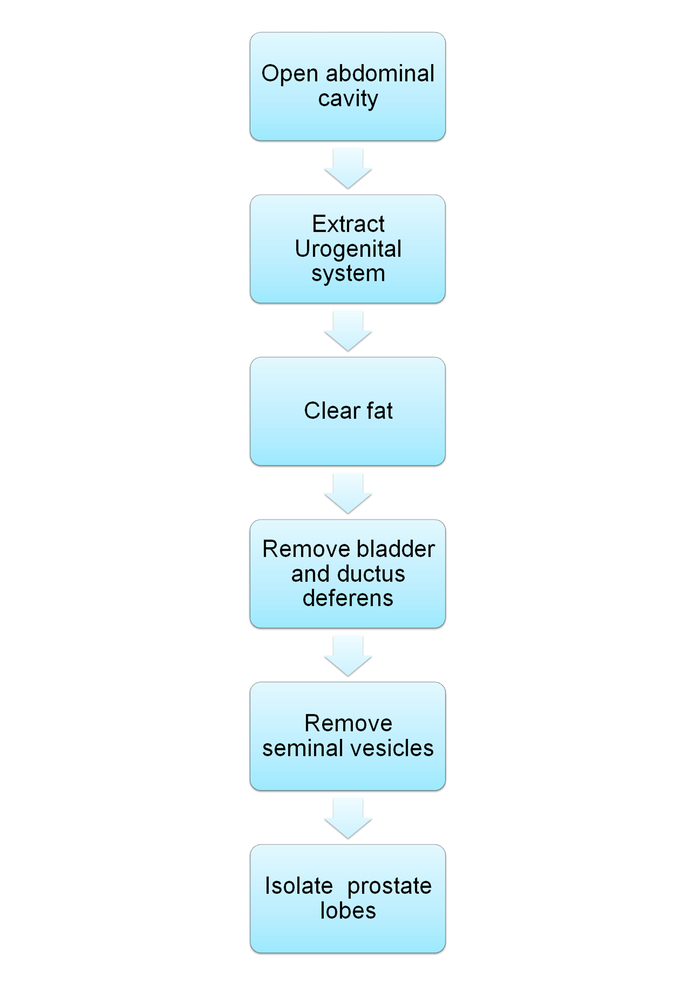
Abbildung 1: Schematische Flussdiagramm zeigt Dissektion des Urogenitalsystems Maus und Isolation der Prostata. Flussdiagramm Abschnitte für die Protokoll-Schritte beschrieben 1-2. Bitte klicken Sie hier für eine größere Version dieser Figur.
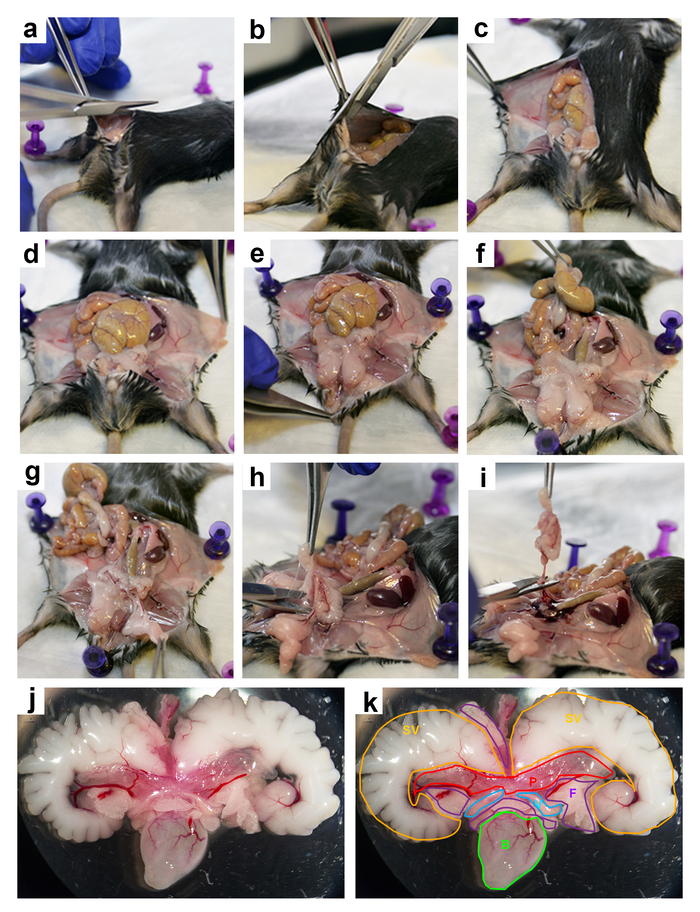
Abbildung 2: Präparation der Maus UGS. Schritt für Schritt Bilder aus das Sezieren von UGS von einer 3-Monate-alten Maus: (ein und b) machen die Einschnitte (c-e) zurückziehen der Haut um den Bauchbereich verfügbar zu machen (f) Verschiebung Darm, (g) verschieben die Abdominal-Fettpölsterchen, (h und i) Gewinnung von UGS von der Bauchhöhle, (j) die extrahierten UGS (k) die extrahierten UGS mit den verschiedenen Organen und Geweben wie folgt gekennzeichnet: SV (gelb) = Samenbläschen; P (rot) = Prostata; F (violett) = Fett; V (hellblau) = Vas Deferens; und B (grün) = Blase. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Dissektion der Maus Prostata. Schritt für Schritt Bilder für die Zerlegung der Maus Prostata von UGS: (a) Entfernen von Fett, (b) der Harnblase, (C) die Samenleiter, (d) ventrale Ansicht der Prostata mit der Harnröhre, (e) dorsale Ansicht der Prostata mit der Harnröhre zu entfernen, entfernen (f-h) entfernen die Samenbläschen (i) ventrale Ansicht der Prostata, (j) sezieren einer dorsalen Lappen, (k) sezieren einer seitlichen Lappen (l) sezieren eine ventrale Lappen, (m) sezieren eines vorderen Lappen und (n) seziert Prostata Lappen: anterior = AP, dorsal = DP, seitliche = LP und ventralen = VP. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Anatomie der Prostata Lappen Maus. Repräsentative Bilder von 3-Monate-alten Maus UGS nach der Entfernung von Fett, Blase und Samenleiter. Bilder zeigen Prostate Lappen mit Samenbläschen und der Harnröhre mit dorsalen (a und C) und Ventral (b und d) Ansichten. Top-Platten (ein und b) unberührte Bilder zeigen, während die untere Verkleidungen (c und d) zeigen die Lappen skizziert in blau (dorsale), rot (anterior), gelb (Ventral) und grün (Lateral). Bitte klicken Sie hier für eine größere Version dieser Figur.
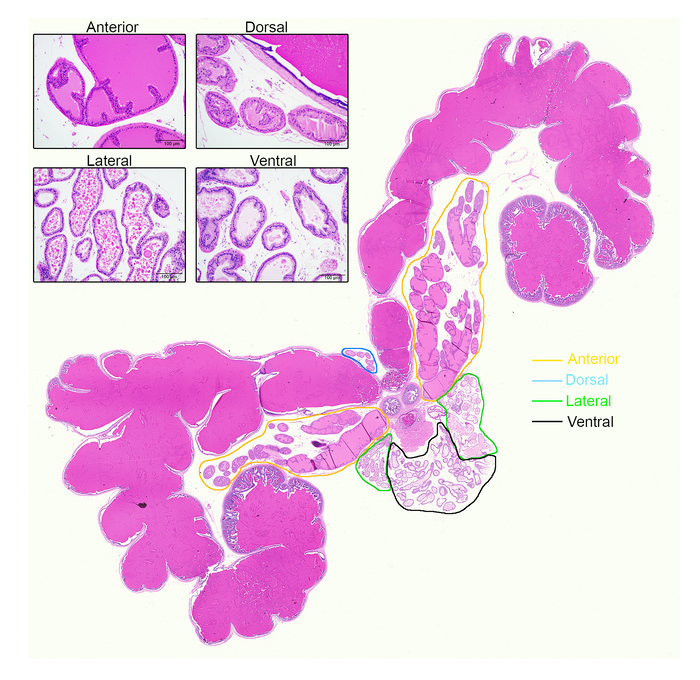
Abbildung 5: die verschiedenen Prostata Lappen unterscheiden sich erheblich in Histologie. Hier ist ein H & E-gefärbten ganze Prostata-Bild zeigt die Samenbläschen, Harnröhre und der Prostata vier Lappen. Lappen in Orange (anterior), beschrieben werden (dorsale), blaugrün (Lateral) und schwarz (Ventral). Einschub: Repräsentative Bilder aus jeder Lappen, unter einem 10 X-Objektiv aufgenommen. Maßstabsleiste repräsentiert 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
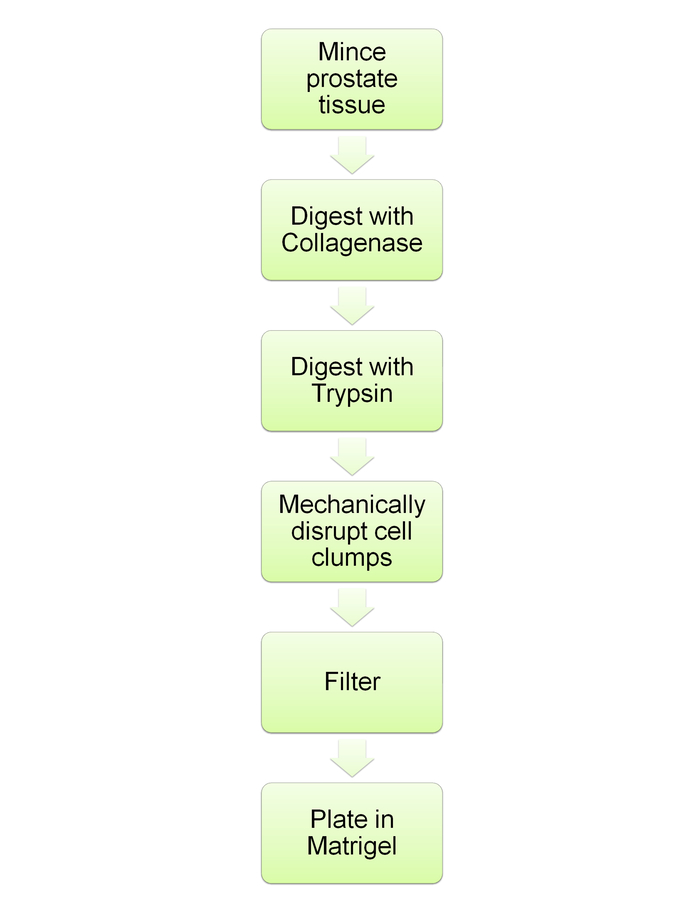
Abbildung 6: Schematische Flussdiagramm zeigt Verdauung der Prostata und anschließende Sphäroid Kulturen. Flussdiagramm für die Protokoll-Schritte beschrieben in den Abschnitten 5 und 6. Bitte klicken Sie hier für eine größere Version dieser Figur.
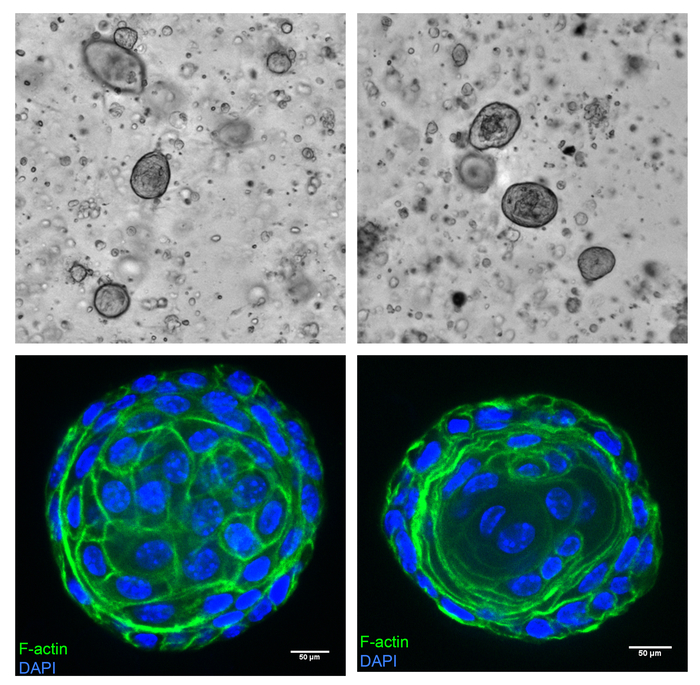
Abbildung 7: die Prostata-Zellen wachsen in sogar sphärischen Sphäroide mit oder ohne ein Lumen. Prostatagewebe geerntet von Wildtyp 3-Monate-alten Maus wurde entsprechend dem Protokoll kultiviert. Kulturen wurden auf einen Teller Imager unter einer 4 X Objektiv, 8 Tage Post-Kultur, zeigt die Entstehung der Sphäroide (oben) abgebildet. Die Sphäroide wurden geerntet und befleckt, wie beschrieben in das Protokoll mit einem fluoreszierenden Farbstoff konjugiert Phalloidin für F-Aktin (grün) und DAPI für Kerne (blau), dann auf eine drehende Scheibe confocal Mikroskop unter einen 40 X Wasser Ziel (unten) abgebildet. Das Sphäroid auf der rechten Seite zeigt Anzeichen von einem Lumen. Maßstabsleisten repräsentieren 50 μm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 8: die Maus Prostata Organellen zeigen Knoten Lokalisierung von β-Catenin. Sphäroide geerntet aus 6 Tage alten 3D Kulturen waren voller Flecken, mit einem primären Antikörper gegen β-Catenin und einen fluoreszierenden Farbstoff-konjugierten Sekundärantikörper und abgebildet auf eine drehende Festplatte confocal Mikroskop unter einen 40 X Wasser Ziel. Repräsentative Bilder zeigen Immunostaining für β-Catenin (grün, Links), F-Aktin (rot, Mitte) und DAPI (blau). Im Rechte Bereich zeigt alle 3 Kanäle zusammengeführt. Maßstabsleiste stellt 20 μm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Dieses Papier beschreibt die Methoden zur Präparation der Maus Prostata und Identifikation der einzelnen Lappen. Auch beschrieben, ist das Protokoll für die Kultivierung der Maus Prostata-Zellen in einer 3D Kultur für in-vitro- Analyse.
Ein wichtiger Schritt bei der Dissektion-Protokoll ist (1) Ernte die gesamte UGS aus der Maus und trennen die einzelnen Organe unter dem Mikroskop Dissektion. Das Prostatagewebe ist sehr klein und umgeben von den Rest des UGS; So ist es praktisch unmöglich, das Organ direkt aus der Körperhöhle zu ernten, bei der Beschaffung von alle vier Paare der Lappen intakt. Daher ist es wichtig, die gesamte UGS von der Maus zu ernten und fahren anschließend mit die Prostata zu extrahieren. Es ist auch entscheidend in diesem Protokoll (2) führen Sie die Schritte in einer zeitgemäßen Weise aber akribisch zu bleiben. Es ist von entscheidender Bedeutung während der Präparation um Gewebe Abbau zu minimieren. Die spezifische Technik, die hier beschriebenen für die Gewinnung von UGS von der Maus ist schneller im Vergleich zu alternativen und ist sehr zu empfehlen. Das gesamte Verfahren zur Isolierung von Dissektion und Lappen dauert in der Regel 35-40 min, die auf 25 min mit mehr Übung gesenkt werden können. Der schwierigste Teil der Dissektion reinigt das Fett rund um die UGS, die einen großen Teil der gesamten Dissektion Zeit nimmt. Das Fett muss sorgfältig entfernt werden, um sicherzustellen, dass nichts davon bleibt mit der Prostata, aber es ist wichtig, sehr darauf achten, nicht versehentlich irgendwelche Prostatagewebe in den Prozess verlieren. Ein weiterer entscheidender Schritt soll (3) nicht die Harnröhre vor der Trennung der Prostata Lappen entfernen. Die Harnröhre bildet im Wesentlichen die Basis, auf welcher alle vier Paare der Prostata Lappen angeordnet sind. Es ist am einfachsten, die Lappen zu identifizieren, wenn sie noch an der Harnröhre, basierend auf deren räumliche Verteilung in Bezug auf die Harnröhre befestigt sind.
Ein wichtiger Schritt in der Sphäroid-Kultur-Protokoll ist (1) das Gewebe gut zerkleinern. Zerkleinerung der Prostata-Gewebes mit einem Skalpell geht mühsam, zumal das Prostatagewebe eine klebrige Natur hat. Jedoch ist das Gewebe so klein wie möglich Hacken für maximale Ausbeute zu erhalten. Ein weiterer wesentlicher Schritt ist, dass (2) nach Trypsinization pipettieren und Spritzen die Größen auf der Durchreise Post-neutralization angegeben. Beide dieser Schritte müssen korrekt durchgeführt und wiederholt, bei Bedarf optimale Zellausbeute zu erreichen. Schließlich ist es wichtig (3) nicht auf der Platte der Basalmembran ECM zu dick oder zu dünn. Wenn der Basalmembran ECM zu dünn plattiert ist (zB., weniger als 100 µL/cm2), Zellen wachsen nicht in richtige Organellen in der Mitte der Brunnen, wo das Gel die dünnsten werden. Plattieren es zu dick (i.e., mehr als 250 µL/cm2) wird in der Basalmembran ECM nicht richtig festigen und abrutschen während Medien Änderungen führen. Beschichtung in der Mitte der Brunnen wird helfen, um die meisten sogar Gel Dicke zu erreichen.
Das Protokoll beschrieben kann leicht experimentelle Bedürfnissen geändert werden. Die Technik zur Gewinnung von UGS aus der Bauchhöhle erfordert einen festen Griff auf die Harnblase mit einer Pinzette. Für den Fall, dass die Blase zu voll ist, ist es wichtig, Entleeren die Blase mit einer 1 mL Spritze und dünn (26G o.ä.) Nadel, um einen richtigen Griff zu gewährleisten, bevor Sie beginnen, das Gewebe zu extrahieren. Das Gewebe sollte mit PBS oder DMEM Verlauf der Dissektion feucht gehalten werden. Mit DMEM wird bevorzugt, wenn das Gewebe für Sphäroid Kulturen verwendet werden soll. Die geernteten Zellsuspension kann durch Durchflusszytometrie, Sub-Populationen von Zellen vor der Beschichtung, zu isolieren, falls gewünscht, wie von Lukacs Et al.beschrieben sortiert werden. 10.
Histologischen Merkmale der verschiedenen Prostata Lappen haben in diesem Protokoll umrissen worden, und sollte man in der Lage, die Lappen in gesundes Prostatagewebe zu identifizieren, indem Sie diese Richtlinien befolgen. Es gibt jedoch gewisse Einschränkungen des Prozesses. In Fällen von Hyperplasie oder aggressive Tumoren ist die epitheliale Morphologie gestört, die deutlich härter machen es zu unterscheiden zwischen Lappen basierend auf der H & E Färbung. In solchen Fällen ist Trennung von Lappen (wie in diesem Protokoll beschrieben) vor dem Einbetten und Färbung notwendig Lappen-spezifische Informationen benötigt werden. Auch im gesunden Gewebe ist es oft notwendig, Lappen separat zu analysieren, da sie große Variabilität in der Anatomie und Histologie zu präsentieren und differentielle Expression Signaturen6. Jedoch kann die translationale Relevanz des Trennens Lappen in Maus Prostata diskutiert werden, da die menschliche Prostata nicht in Lappen unterteilt ist. Trotzdem die Maus bleibt das beste Modell PCa in Vivozu studieren, und mehrere Maus-Modellen wurden entwickelten14,15. 3D Culture-Methode ist vor allem eine wichtige Technik, die verwendet werden, um die Mechanismen der Erkrankung zu untersuchen. Es stellt sich jedoch eine Einschränkung der Sphäroid-Kultur-Methode aus dem differentielle Expression-Muster von probasin, das häufig verwendete Promoter für Cre-Rekombinase in Prostatakrebs-Maus-Modellen ist. Der probasin Veranstalter wird überwiegend in den luminalen und zwischen-Zellen aber nicht in Basalzellen7aktiviert. Die hier beschriebenen Kulturbedingungen fördern Sphäroid Bildung vorwiegend aus basalen und mittleren Zellen, aber nicht von der luminalen Zellen10. Daher, die daraus resultierenden Kulturen tatsächlich produzieren eine Mischung aus Cre-mit dem Ausdruck und nicht-Cre Sphäroide (i.e., eine Mischung aus Kontrolle und Knock-out-Sphäroide). Infolgedessen während der Analyse ist es wichtig, Immunostain für das Protein des Interesses zu identifizieren Knock Out Organellen und Schlüsse auf organoide Verhalten basiert auf Gen-Knock-Outs.
Die Bedeutung dieser Methoden liegt in der facettenreichen Anwendungen mit GEMMs in Prostata-Krebs-Studien. Die Dissektion beschriebene Methode hat detaillierte Schritte, die erlauben wird, die Prostata schneller und effektiver zu extrahieren. Die Reihenfolge der Dissektion Prozess soll sicherstellen, dass einzelne Lappen können identifiziert und, auch von denen mit minimaler Erfahrung in Prostata Sezierungen extrahiert. Beschriebene Kultur-Methode kann verwendet werden, zur weiteren Analyse GEMM Modelle von Prostata-Krebs. Die Kulturbedingungen sollte für Wachstum und Überleben von Kontrolle und Tumor-Zellen ermöglichen. Nach unserer Erfahrung haben wir erfolgreich GEMM Prostata verwendet, die mPIN16aufweisen. Maus-Prostata mit höheren Grade Tumoren werden auch Sphäroid Kultur Analyse17eingesetzt. Die Steuerung Maus Sphäroide zeigen eine sogar sphärische Morphologie; Sphäroide abgeleitet von Prostata-Tumor-Zellen zeigen jedoch Unterschiede in der Morphologie und Verhalten aufgrund von neoplastischen entfalten. Daher studieren organoide Verhalten in Vitro wird bieten einen längeren Blick in die Merkmale dieser Zellen, und möglicherweise Beobachtungen der Sphäroid Verhalten in Echtzeit über live Cell Imaging.
Zusammenfassend können die Prostata Dissektion und in diesem Protokoll beschriebenen Kulturmethoden in verschiedene Arten von Studien mit GEMMs um den Vorgang fortzusetzen, Bereitstellung von Informationen über Prostatakrebs in allen downstream-Anwendungen aufzunehmen.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Diese Arbeit wurde durch den Zuschuss vom National Cancer Institute, R01CA161018, LK unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Mouse surgical instruments (Mouse Dissecting kit) | World Precision Instruments | MOUSEKIT | |
| Dissection microscope | |||
| RPMI medium | Thermofisher Scientific | 11875093 | |
| Dissection medium (DMEM + 10%FBS) | Thermofisher Scientific | 11965-084 | |
| Fetal Bovine Serum | Thermofisher Scientific | 10438018 | |
| PBS (Phosphate buffered saline) | Thermofisher Scientific | 10010031 | |
| Collagenase | Thermofisher Scientific | 17018029 | Make 10x stock (10mg/ml) in RPMI, filter sterilize, aliquot and store at -20 °C |
| Trypsin-EDTA (0.05%) | Thermofisher Scientific | 25300054 | |
| DNase I | Sigma-Aldrich | 10104159001 ROCHE | |
| Syringes and Needles | Fisher Scientific | ||
| Fisherbran Sterile Cell Strainers, 40μm | Fisher Scientific | 22-363-547 | |
| PrEGM BulletKit | Lonza | CC-3166 | Add all componenets, aliquot and store at -20 °C. |
| Matrigel membrane matrix | Thermofisher Scientific | CB-40234 | |
| Dispase II powder | Thermofisher Scientific | 17105041 | Make 10x stock (10mg/ml) in PrEGM, filter sterilize, aliquot and store at -20 °C |
Referenzen
- Marks, C. L. Mouse Models of Human Cancers Consortium (MMHCC) from the NCI. Cancer Research. 65 (9 Supplement), 242-243 (2005).
- Marks, C. Mouse Models of Human Cancers Consortium (MMHCC) from the NCI. Disease Models & Mechanisms. 2 (3-4), 111(2009).
- Day, C. P., Merlino, G., Van Dyke, T. Preclinical mouse cancer models: a maze of opportunities and challenges. Cell. 163 (1), 39-53 (2015).
- Society, A. C. Cancer Facts and Figures. , (2018).
- Shappell, S. B., et al. Prostate Pathology of Genetically Engineered Mice: Definitions and Classification. The Consensus Report from the Bar Harbor Meeting of the Mouse Models of Human Cancer Consortium Prostate Pathology Committee. Cancer Research. 64 (6), 2270-2305 (2004).
- Berquin, I. M., Min, Y., Wu, R., Wu, H., Chen, Y. Q. Expression signature of the mouse prostate. Journal of Biological Chemistry. 280 (43), 36442-36451 (2005).
- Wu, X., et al. Generation of a prostate epithelial cell-specific Cre transgenic mouse model for tissue-specific gene ablation. Mechanisms of Development. 101 (1-2), 61-69 (2001).
- Xin, L., Lukacs, R. U., Lawson, D. A., Cheng, D., Witte, O. N. Self-renewal and multilineage differentiation in vitro from murine prostate stem cells. Stem Cells. 25 (11), 2760-2769 (2007).
- Hofner, T., et al. Defined conditions for the isolation and expansion of basal prostate progenitor cells of mouse and human origin. Stem Cell Reports. 4 (3), 503-518 (2015).
- Lukacs, R. U., Goldstein, A. S., Lawson, D. A., Cheng, D., Witte, O. N. Isolation, cultivation and characterization of adult murine prostate stem cells. Nature Protocols. 5 (4), 702-713 (2010).
- Clarke, M. F., Fuller, M. Stem cells and cancer: two faces of eve. Cell. 124 (6), 1111-1115 (2006).
- Oliveira, D. S., et al. The mouse prostate: a basic anatomical and histological guideline. Bosnian Journal of Basic Medical Sciences. 16 (1), 8-13 (2016).
- Colicino, E. G., et al. Gravin regulates centrosome function through PLK1. Molecular Biology of the Cell. 29 (5), 532-541 (2018).
- Ittmann, M., et al. Animal models of human prostate cancer: the consensus report of the New York meeting of the Mouse Models of Human Cancers Consortium Prostate Pathology Committee. Cancer Research. 73 (9), 2718-2736 (2013).
- Valkenburg, K. C., Williams, B. O. Mouse models of prostate cancer. Prostate Cancer. 2011, 895238(2011).
- Xiong, X., et al. Disruption of Abi1/Hssh3bp1 expression induces prostatic intraepithelial neoplasia in the conditional Abi1/Hssh3bp1 KO mice. Oncogenesis. 1, e26(2012).
- Liao, C. P., Adisetiyo, H., Liang, M., Roy-Burman, P. Cancer-associated fibroblasts enhance the gland-forming capability of prostate cancer stem cells. Cancer Research. 70 (18), 7294-7303 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten