Method Article
Identification, Caractérisation histologique et Dissection des Lobes de la Prostate souris pour modèles In Vitro sphéroïde 3D Culture
Dans cet article
Résumé
Souris génétiquement modifiées sont des modèles utiles pour l’étude des mécanismes du cancer de la prostate. Nous présentons ici un protocole en vue d’identifier et de disséquer les lobes de la prostate depuis un système urogénital de la souris, de différencier basé sur l’histologie et d’isoler et de culture primaire de cellules prostatiques in vitro comme sphéroïdes pour analyses en aval.
Résumé
Modèles de souris génétiquement modifiées (edged) servent de modèles précliniques efficaces pour enquêter sur la plupart des types de cancers humains, y compris le cancer de la prostate (PCa). Comprendre l’anatomie et l’histologie de la prostate de souris est important pour l’utilisation efficace et bien qualifier ces modèles animaux. La prostate de souris a quatre paires distinctes des lobes, chacun avec leurs propres caractéristiques. Cet article illustre la bonne méthode de dissection et l’identification des lobes de la prostate souris pour l’analyse de la maladie. Après dissection, les cellules de la prostate peuvent être davantage cultivés in vitro pour interprétation mécaniste. Depuis la souris la prostate cellules primaires ont tendance à perdre leurs caractéristiques normales lorsque cultivées in vitro, nous présentons ici une méthode pour isoler les cellules et leur culture en tant que cultures 3D sphéroïde, qui est efficace pour préserver la physiologique caractéristiques des cellules. Ces cultures 3D peuvent être utilisés pour analyser la morphologie des cellules et des niveaux de comportement dans des conditions physiologiques près, enquêter sur modifié et localisations des protéines clés et voies impliquées dans le développement et la progression d’une maladie et en regardant réponses aux traitements médicamenteux.
Introduction
La communauté scientifique a tenté d’élucider le mécanisme complex de développement de cancer chez l’homme depuis des décennies. Considérant que l’identification des acteurs potentiels et des cibles de médicaments commence avec les cellules de patients et les études sur les tissus, l’application translationnelle de telles conclusions souvent nécessite l’utilisation de modèles animaux précliniques. L’utilisation de souris génétiquement modifiées (edged) des modèles de cancers humains modèle a régulièrement augmenté depuis la mise en place de la souris modèles de humaine Cancers Consortium (NCI-MMHCC), un comité qui a cherché à décrire et d’unifier les caractéristiques du cancer de la souris modèles de scientifiques dans le monde1,2. Modèles murins combler le besoin d’études mécanistes dans des études précliniques de la plupart des types de cancer, pour comprendre le développement, la progression, la réponse aux traitements et acquis de résistance3.
Cancer de la prostate est le cancer plus fréquents chez les hommes, qui affectent plus 160 000 hommes chaque année4. Les formes agressives de la maladie réclamer des dizaines de milliers de vies chaque année. Toutefois, le mécanisme de la progression de la maladie est encore mal compris. Cela se traduit par un sérieux manque d’options de traitement efficace pour le cancer de la prostate avancé ou métastatique, comme en témoigne le taux élevé de mortalité dans les patients de cancer de la prostate avancé4. Par conséquent, il y a un besoin croissant de modèles précliniques étudier le cancer de la prostate. Toutefois, en raison des différences inhérentes entre la souris et l’homme la prostate, modélisation du cancer de la prostate en edged n’a pas gagné popularité jusqu'à ce que le système de Classification de Bar Harbor a été introduit en 2004, qui décrit les changements histopathologiques chez la souris prostate lors de la manipulation génétique, identification des modifications néoplasiques et leur relation aux étapes de la progression du cancer dans les humains5. Une caractéristique importante de la prostate de souris qui doit être prise en considération pendant ses études à n’importe quel modèle GEMM la prostate est la présence de quatre paires distinctes des lobes : antérieure, latérale, ventrale et dorsale. Les lobes présentent des différences significatives dans l’histopathologie et gene expression modèle6. Modèle d’expression des protéines probasin peut varier entre les lobes chez les jeunes souris après puberté7, qui doit être considérée puisque des modèles axés sur les Cre GEMM visent principalement à l’aide d’un promoteur axée sur le probasin appelé Pb-Cre47. Les différences spatiales et temporelles qui en résulte dans l’expression de Cre souvent conduisent à des différences dans les chronologies d’initiation et progression tumorale ainsi que les différences dans les modifications néoplasiques entre les lobes. Par conséquent, il est important de tenir compte de ces différences tout en étudiant le développement de tumeurs de la prostate edged, et les lobes individuels peuvent doivent être évalués séparément pour obtenir des résultats reproductibles. La première partie de cet article décrit les méthodes appropriées pour disséquer une prostate de souris, identifier et séparer chaque lobe et reconnaître les différences histologiques entre les lobes.
Si l’analyse de la croissance tumorale et l’histopathologie peut fournir des renseignements précieux dans le développement de la tumeur, ils ne fournissent pas beaucoup d’informations sur les mécanismes moléculaires. Pour étudier le mécanisme de développement de la tumeur et la progression, il est souvent utile d’analyser la tumeur des cellules in vitro. Plusieurs méthodes ont été proposées au cours des années qui impliquent des cultures de ces cellules, y compris les cultures en suspension, cultures 3D8 et récemment, 2D ordinaire cultures9. Considérant que la plupart de ces méthodes aboutissent à des taux de survie et la prolifération cellulaire bonne, les cultures 3D fournissent un environnement plus proche des conditions physiologiques. Dans les cultures 3D ou sphéroïde dans une membrane basale de la matrice extracellulaire (ECM), les cellules luminales complètement différenciées ont généralement des taux de survie très faible ; Cependant, les cellules basales et intermédiaires (pour la plupart des cellules souches) sont capables de se propager et produisent des grappes de cellules appelées sphéroïdes10. Cela le rend approprié pour une étude sur le cancer puisque les cancers épithéliaux sont censés provenir de cellules souches (populairement connus comme les cellules souches cancéreuses)11. La deuxième partie du présent protocole décrit une méthode pour cultiver les cellules de la prostate de souris dans les cultures 3D. Les sphères qui en résulte peuvent être utilisés pour plusieurs types d’analyses en aval, y compris l’étude de la morphologie organoïde et le comportement de cellules vivantes, imagerie, immunofluorescence souillant pour différentes protéines et l’étude des réponses à la chimiothérapie traitements.
Dans l’ensemble, le but du présent protocole est de définir des méthodes optimales pour l’utilisation de modèles de souris dans le cancer de la prostate en décrivant les techniques d’anatomie et de dissection de la prostate de la souris et le traitement du tissu pour les cultures de sphéroïde et in vitro d’analyse .
Protocole
Toutes les souris expériences décrites ici ont été effectuées conformément aux lignes directrices énoncées dans les protocoles approuvés par IACUC institutionnels à SUNY Upstate Medical University.
1. la Dissection de l’appareil génito-urinaire (UGS)
Remarque : Le schéma est présenté dans la Figure 1.
- Euthanasier une souris C57BL/6 mâle de 3 mois à l’aide de la méthode d’euthanasie par inhalation de CO2 ou une autre technique approuvée.
Remarque : Les souris âgés de 3 à 12 mois peuvent être utilisés avec succès pour l’expérience. Les souris âgées (> 6 mois) aura vraisemblablement plus de graisse autour de l’UGS, qui devra être effacée. Identification et la séparation des lobes est souvent difficile chez les souris âgés de moins de 3 mois. Autres souches peuvent être utilisés pour l’expérience, aussi bien. - Placez la souris sur le dos et fixer les jambes à l’aide d’épingles pour que la face ventrale de l’animal est exposée.
- Pulvériser de l’éthanol à 70 % sur l’abdomen de la souris et l’essuyer.
Remarque : Raser les poils de l’abdomen avant la dissection n’est pas nécessaire. - Soulever la peau de l’abdomen, ainsi que de la couche musculaire, avec une paire de pinces émoussé moyen et faire une incision en forme de Y renversée sur l’abdomen à l’aide de ciseaux.
- Tout d’abord, faire une incision rectiligne avec une paire de ciseaux pointus de juste au-dessus du pénis au sternum (Figure 2 a).
- Couper de la base de l’incision vers chaque orteil, jusqu'à les cuisses (Figure 2 b). Repliez la peau des deux côtés et en bas pour voir toute la zone abdominale (Figure 2 c-e).
Remarque : La taille de coupe varie dépend de la taille et d’âge de la souris. La taille de l’incision initiale droite peut varier de 1,5 à 4 cm selon la taille de la souris.
- Survolez les autres organes d’exposer l’UGS. Soulever et déplacer les intestins brun-jaune (Figure 2f). Ramasser les coussinets adipeux abdominales (le tissu spongieux blanc opaque) avec une pince et déplacez-les vers les côtés (Figure 2 g).
Remarque : L’UGS comprend les vésicules séminales, urètre, prostate, canal déférent (vas deferens) et la vessie. Il peut être identifié par la paire caractéristique d’opaques blancs arcs en plein cintre (qui sont des vésicules séminales), avec le sac de la vessie remplie de liquide fixé à la base. Le tissu translucide situé sous les vésicules séminales est la prostate. - Localiser l’UGS, fermement tenir la vessie avec une pince émoussée et soulevez l’UGS ensemble vers le haut de l’abdomen de la souris.
Remarque : Si la vessie est pleine, vider tout d’abord avec une petite seringue de fournir une meilleure adhérence avec la pince et réduire le risque de rupture de la vessie. - Continuer de tirer vers le haut sur la vessie, glisser une paire de ciseaux sous la vessie et la prostate complètement vers la colonne vertébrale et faites une coupe. Couper à travers les connexions restantes dans la cavité abdominale (Figure 2 h et 2i). Veillez à ne pas couper trop près à l’UGS pour éviter une coupe accidentelle par le biais de n’importe quel tissu de la prostate.
Remarque : Tout en faisant la coupe sous l’UGS, les ciseaux doivent être insérés complètement vers l’arrière de la souris, afin que la coupe s’enclenche ainsi la colonne vertébrale. Cette méthode se traduit par la rupture presque toutes les connexions entre l’UGS et la cavité abdominale dans un snip, réduire le temps nécessaire pour extraire le tissu de la souris. - Supprimer l’UGS et le placer dans 2 à 6 mL (assez pour couvrir le tissu) de phosphate buffered saline (PBS) ou de Dulbecco modifié le milieu Eagle (DMEM, hyperglycémie) dans une boîte de Pétri (Figure 2j et 2 k) de 6 cm et le mettre dans un microscope à dissection (10 X grossissement).
Remarque : Changer les dissection médias tel que requis dans les étapes restantes.
2. dissection de la Prostate
- Effacer toute la graisse de deux côtés dorsales et ventrales avec une paire de pinces fines et microdissection ciseaux (Figure 3 a). Utiliser des instruments chirurgicaux similaires pour le reste du protocole de dissection.
Remarque : La graisse est souvent étroitement liée avec l’UGS (peut être identifié par son aspect spongieux blanc) ; par conséquent, cette étape doit être exécutée avec soin pour éviter la capture accidentellement au large de n’importe quel tissu de la prostate. Cela peut prendre jusqu'à 10-15 min pour effacer toutes les matières grasses. - Organiser et tirer la vessie avec la pince et snip il à la base avec les ciseaux (Figure 3 b).
- Placer la face ventrale restant de tissu vers le haut. Maintenez un canal déférent avec une pince, il trace à la base avec des ciseaux et snip (Figure 3C), puis répéter de l’autre côté. Supprimer le deferens de ductus, maintenant laissant derrière la prostate (translucide et verminous), des vésicules séminales (opaque et blanc, plein cintre) et de l’urètre (tube opaque et rose-rouge) (Figure 3d et 3F).
- Insérer la pince entre l’arche interne du lobe antérieur de tissu prostatique et vésicules séminales. Dégager dehors les vésicules séminales et la prostate et découper n’importe quel tissu conjonctif comme nécessaire (Figure 3f). Tracer les vésicules séminales à leur base à l’urètre, puis retirez-les (Figure 3 g et 3 h). Veillez à ne pas perforer les.
- Passez à disséquer sur les lobes de la prostate individuels.
3. anatomie générale de la Microdissection Lobe de la Prostate et individuels (Figures 3i-n, Figure 4)
- Retourner le tissu avec une paire de pinces émoussé pour que la face dorsale vers le haut, montrant le lobe dorsal, ressemblant à des ailes d’un papillon.
- Recueillir les lobes dorsaux en tenant le lobe avec une pince et coupe à la base avec des ciseaux (Figure 3j).
- Retournez le tissu restant à la face ventrale.
- Recueillir les lobes latéraux, qui sont petits et habituellement envelopper l’urètre sur le côté, qui sont coincées entre le lobe antérieur, ventral et dorsal (Figure 3 k).
- Ensuite, recueillir le lobe ventral, qui est plus grandes que les lobes latéraux et se situent sur l’urètre sur le ventre (Figure 3 l).
- Dernier, récolter le lobe antérieur, le plus important des quatre, en coupant et en jetant l’urètre (Figure 3 m).
- Traiter les morceaux de tissu selon besoins expérimentaux. Passez à la section 4 pour histologie, ou à l’article 5 pour la culture de sphéroïde.
4. lobe d’Identification et de la morphologie de l’hématoxyline et éosine-lames
- Fixer le tissu prostatique et incorporez-le à la paraffine. Procéder à la coloration les diapositives à l’hématoxyline et éosine (H & E) pour visualiser et identifier les différences dans les lobes de la prostate basés sur l’histologie, en utilisant les caractéristiques énoncées par Oliveira et al. 12 (figure 5).
5. traitement du tissu pour Culture 3D10
Remarque : Cela est décrit à la Figure 6.
- Procéder à la mise en culture les lobes entiers la prostate ou individuelles selon les besoins expérimentaux. Transférer le tissu prostatique dans un plat de 10 cm contenant de 2 à 3 mL de DMEM. Avec un scalpel, émincer les tubules de la prostate comme finement et uniformément que possible sous le microscope à dissection.
- Passez aux étapes restantes sous une hotte de culture de tissus, dans des conditions stériles.
- Transférer les morceaux de tissus avec le DMEM dans un tube de 15 mL et augmenter le volume jusqu'à 9 mL avec DMEM. Ajouter 1 mL de solution mère de collagénase x 10 au mélange de DMEM-tissus et vortex de mélanger.
Remarque : La solution mère de collagénase est 10 mg/mL dans le milieu de Roswell Park Memorial Institute (RPMI), et la concentration finale dans le tube de 15 mL est de 1 mg/mL. - Placer le tube sur un agitateur giratoire ou tube rotator pendant 2 h à 37 ° C, pour la collagénase de dégrader la matrice extracellulaire.
- Centrifuger le tube à 400 x g pendant 5 min à température ambiante.
- Jeter le surnageant et remettre en suspension dans 2 mL de chaud 0.05 % trypsine-EDTA pour cliver les adhérences cellule-cellule et cellule-matrice. Transférer le tube à 37 ° C pendant 5 min.
Remarque : Si les morceaux de tissus sont trop gros pour bien mélanger, couper avec une lame de rasoir pour faire un alésage plus large de la pipette. - Briser tout amas de tissus par pipetage avec une pipette P1000 8 - 10 fois, puis répéter avec une pipette de P200.
- Neutraliser la trypsine avec 3 mL de DMEM complet. Ajouter 500 U de DNAase j’et bien mélanger.
- Passer par une seringue de 5 mL à 5 - 10 fois avec une aiguille 18 G. Puis passer par 5 fois avec une aiguille de 20 G.
- Répétez les étapes 4 à 8 une fois de plus si la solution contient encore des morceaux de tissu gros.
- La suspension cellulaire filtrer sur un filtre de 40 μm placé sur un tube de 50 mL. Rincer le tube de 15 mL avec 5 mL de DMEM et passer à travers le même filtre. Répétez le rinçage.
- Jeter le filtre et centrifuger le tube contenant le cheminement à 400 x g pendant 5 min à température ambiante.
6. placage et mise en culture des cellules
- Resuspendre le culot dans 0,5 mL de Prostate complet milieu épithéliale de la croissance cellulaire (PrEGM). Compter la densité des cellules à l’aide d’un compteur de cellules ou un hémocytomètre et diluer les cellules à 5 x 105 cellules/mL dans le PrEGM complet.
Remarque : Le rendement d’un souris 3 mois entier de la prostate peut varier de 3 x 105-106 cellules. Par conséquent, il est important d’initialement Resuspendre le culot dans pas plus de 0,5 mL de PrEGM (comme mentionné ci-dessus), alors que la densité de la cellule souhaitée est possible, même avec faibles rendements. - Mix le volume requis de cellules avec la membrane basale ECM dans un rapport volumétrique (suspension de cellules des ECM et 40 % 60 % membrane de sous-sol) 2:3 et la plaque dans un plaque multipuit ou une diapositive de chambre selon les besoins expérimentaux.
Remarque : Pour immunostaining, plaque sur les plaques de fond en verre ou les glissements de chambre, couvrant tout le bien ou le milieu du puits. Plaque sur le pourtour du puits si le compteur l’organoïdes qui en résulte, ou plaque que plusieurs gouttes partout dans le puits si la hausse des volumes de placage. Être attentif à ne étaler pas trop épais ou trop mince. Plaque d’au moins 100 µL du mélange de la cellule de la matrice par 1 cm2 de placage de zone ; par exemple, dans une diapositive de chambre avec une de 2 cm2-bien surface habitable, 200 µL du mélange de cellule de la matrice contenant 5 x 104 cellules doit être plaqué. - Transférer la plaque/diapositive dans un incubateur à 37 ° C avec 5 % de CO2 pendant 30 min pour la membrane basale ECM se solidifier. Ensuite, ajoutez préchauffé PrEGM complet pour couvrir le puits, en prenant soin de ne pas pour déranger la fiche membrane basale ECM.
- Supprimez la moitié des médias et supports neufs tous les 2-3 jours. Pousse sphéroïdes pendant 5-10 jours.
- Procéder à la récolte (étape 7), immunomarquage (étape 8), et/ou d’imagerie pour les applications en aval.
7. récolter les sphères
- Pour récolter les sphères, aspirer les médias soigneusement sans déranger la prise de gel de membrane basale ECM et ajouter 1 mL de solution a 1 mg/mL en PrEGM par 100 µL de la membrane basale ECM.
Remarque : Il est plus facile de récolter les sphéroïdes si elles sont plaquées au milieu du puits ou de la jante (au lieu de couvrir le puits ensemble), pour s’assurer qu’une quantité adéquate de la solution a peut être ajoutée dans le puits. - Gratter le fond de la plaque avec un grattoir de cellules de décoller le gel de la membrane basale ECM dans la solution d’a-PrEGM.
- Pipette de l’ensemble de la solution et descendre une fois avec un grand alésage pointe de 1000 µL pipette ou d’une pipette de 5 mL pour casser vers le haut de la fiche de gel en petits morceaux.
Remarque : Couper l’extrémité d’une pointe de pipette 1000 µL avec une lame de rasoir pour faire un bout de grand alésage. - Incuber dans un incubateur à 37 ° C avec 5 % de CO2 pendant 1-2 h jusqu'à ce que la membrane basale ECM est entièrement dissout.
Remarque : Ceci peut être assurée par une inspection visuelle du fond du puits en l’inclinant la plaque pour confirmer qu’aucun morceaux plus de gel ne demeurent. - Recueillir la suspension de cellules dans un tube conique de 15 mL.
- Centrifuger les sphères à 250 x g pendant 5 min à température ambiante et continuer les applications en aval.
8. Immunostaining des sphères13
Remarque : Après que les sphéroïdes ont augmenté pour la durée souhaitée, la membrane basale ECM peut être dissous et sphères peuvent être souillés comme décrit dans Colicino et al. 13.
- En bref, rincer les cultures avec du PBS et ajouter 4 % de paraformaldéhyde (PFA) directement à la fiche de gel de membrane basale ECM. Incuber pendant 30 à 90 min à température ambiante sous agitation lente, jusqu'à ce que la membrane basale ECM est entièrement dissous, remplaçant PFA frais toutes les 30 minutes.
Remarque : L’IFP va dissoudre le bouchon de gel et fixer les sphéroïdes au cours de ce processus. - Ensuite, laver avec du PBS 3 fois et ajouter le chlorure d’ammonium 50 mM pendant 10 min étancher tout autofluorescence de la PFA. Répétez pour 3 lavages avec du PBS.
- Permeabilize avec un détergent non ionique 0,1 % pendant 5 min et bloc avec PBSAT (PBS, BSA 1 %, 0,5 % Triton X-100) pendant 30 min.
- Incubez avec un anticorps primaire en PBSAT toute la nuit à 4 ° C, suivie de 3 lavages avec PBSAT et un anticorps secondaire dans PBSAT pendant 2 h à température ambiante.
- Répétez les lavages avec PBSAT et la tache avec du DAPI selon le protocole du fabricant, si vous le souhaitez. Lavez 3 ou plusieurs fois avec du PBS.
- Ajouter des PBS avec le réactif antifade de 200 mM 1, 4-diazabicyclo [2.2.2] octane (DABCO) et passez à l’imagerie.
Résultats
Les lobes de la prostate de souris peuvent être identifiés et découpé à l’aide de leur emplacement en ce qui concerne les vésicules séminales et l’urètre. La prostate de souris est composée de 4 paires de lobes situés sur le dos et sur le ventre pour les vésicules séminales et l’urètre. Figure 4 a et 4 b (en haut) montrent des vues dorsales et ventrales de la prostate intacte, ainsi que les vésicules séminales et l’urètre. Les panneaux de fond (Figure 4C et 4D) montrent les différents lobes décrites pour l’identification. Lobes peuvent être séparés de souris dès l’âge de 3 mois.
Les différents lobes de la prostate se distinguent en histologie (Figure 5). Tous les lobes de la prostate de souris sont composées de plusieurs profils de glande composées d’un lumen entouré par les cellules épithéliales sécrétoires ; Cependant, la forme des lobes, Organisation des cellules et la nature de la sécrétion varient d’un lobe à un lobe. Les caractéristiques d’identification de H & E-teint souris prostates ont été efficacement décrites par Oliveira et al. 12, brièvement décrites ici. Lobe antérieur ont modéré à grande acini avec fréquents replis et sécrétion fortement éosinophile. Lobes dorsaux apparaissent comme antérieur avec sécrétion éosinophile mais ont des acini beaucoup plus petite et moins des replis. Lobes latéraux ont des acini petites et grandes, avec des frontières plat luminales caractéristiques et sécrétion éosinophile. Lobes ventraux sont structurellement comme des lobes latéraux, également avec des bordures plates luminales, mais ont une unique pâle sécrétion luminale des éosinophiles.
Cellules de la prostate de souris peuvent être cultivées en sphéroïdes dans les membranes basales ECM et présentent des caractéristiques épithéliales semblables. Ceci est décrit comme une représentation schématique à la Figure 6. Les cellules ont été isolées de la prostate de souris comme décrit ci-dessus et cultivées dans les membranes basales ECM. Les cellules commencent devenant organoïdes en dès 4 jours de culture. Figure 7 (en haut) affiche les champs représentatifs de cultures âgées de 8 jours montrant l’organoïdes dans la membrane basale ECM. Dans les conditions susmentionnées de la culture, la plupart des cellules se développent dans des sphères solides, avec une fraction ayant un lumen partiel ou total à l’intérieur. Ces organoïdes ont habituellement une morphologie sphérique même. Organoïdes ont été récoltés et immunomarquage comme décrit dans Colicino et al. 13. la figure 7 (panneau inférieur) montre un organoïde sans un lumen (à gauche) et avec une lumière (à droite), coloré avec la phalloïdine (marqueur de l’actine F, vert) et DAPI (noyau, bleu). Β-caténine est un marqueur d’adhérence de cellules fortement exprimé aux interfaces de cellules en cellules épithéliales. Figure 8 montre les β-caténine forte coloration (vert) au niveau des jonctions cellule-cellule en sphéroïdes que Localisez conjointement avec l’actine F (rouge). Les sphéroïdes expriment aussi la cytokératine 5, cytokératine 8, p63 et protéines du récepteur aux androgènes, qui prouvent que les sphéroïdes sont en effet issues de cellules provenant de la prostate10.
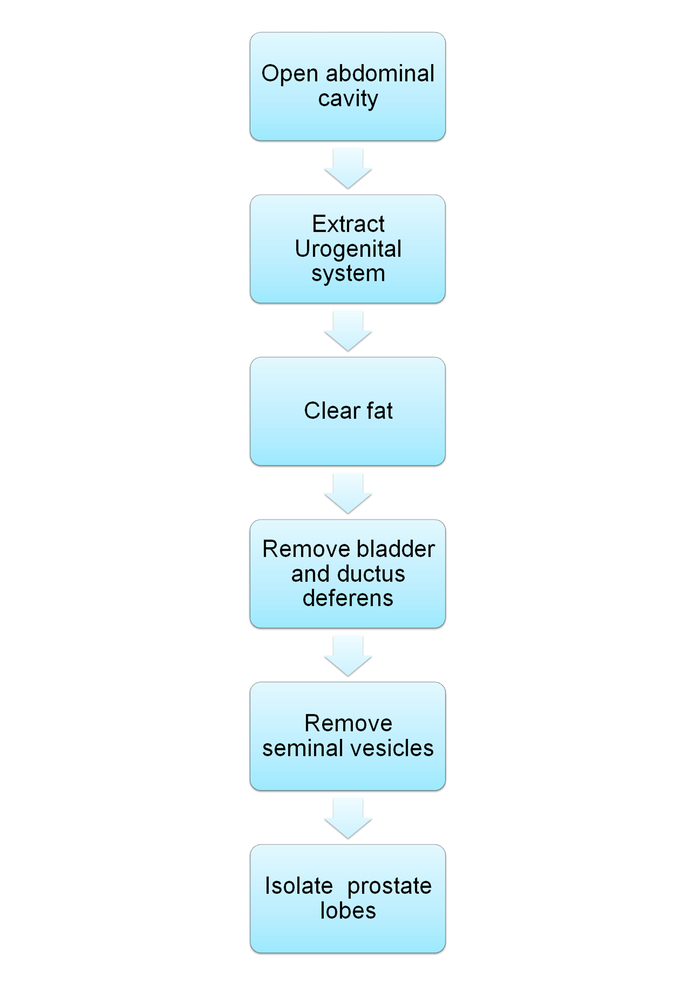
Figure 1 : diagramme schématique démontrant la dissection du système urogénital souris et l’isolement de la prostate. Organigramme pour les étapes du protocole décrit dans les sections 1-2. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
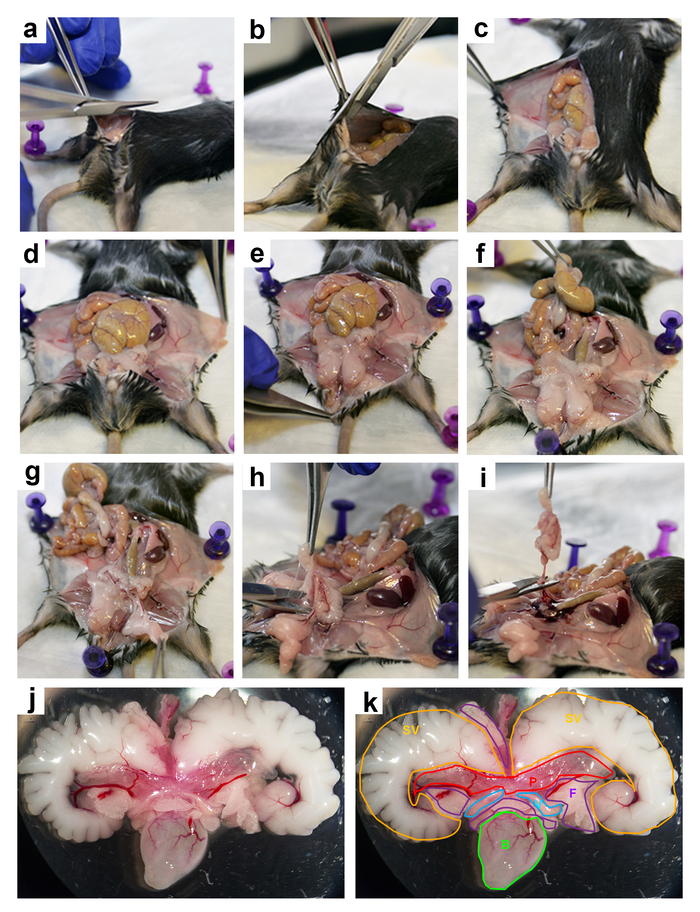
Figure 2 : Dissection de la souris UGS. Des images détaillées de la dissection de l’UGS d’une souris de 3 mois : (un et b) faire des incisions, (c-e) tirant vers l’arrière la peau afin d’exposer la région abdominale, déplacement (f) les intestins, (g) passer les coussinets adipeux abdominales, (h et i) extraction de l’UGS de la la cavité abdominale, de (j) l’extrait UGS, (k) l’UGS extrait avec les différents organes et de tissus marqué comme suit : SV (jaune) = vésicules séminales ; P (rouge) = la prostate ; F (violet) = matières grasses ; V (bleu clair) = canal déférent ; et B (vert) = vessie. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Dissection de la prostate souris. Les images étape par étape pour la dissection de la prostate de souris de l’UGS : (a) retrait de matière grasse, (b) enlever la vessie, (c) enlever le canal déférent, vue d ventrale de la prostate avec l’urètre, vue e dorsale de la prostate avec l’urètre, (f.-h.) enlever les vésicules séminales, (i) vue ventrale de la dissection de la prostate, (j) un lobe dorsal, (k) disséquant un lobe latéral, dissection (l) un lobe ventral, (m) disséquant un lobe antérieur et (n) la prostate disséquée lobes : antérieur = AP, dorsale = DP, latérale = LP et ventrale = VP. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : anatomie des lobes de la prostate souris. Images représentatives de la souris UGS de 3 mois après l’enlèvement de la graisse, la vessie et le canal déférent. Les images montrent des lobes de la prostate avec vésicules séminales et de l’urètre, avec dorsale (a et c) et une vue ventrale (b et d). Albums de panneaux (a et b) montrer des images intactes, alors que les panneaux inférieurs (c et d) montrent les lobes décrites en bleu (dorsale), rouge (antérieur), jaune (ventrales) et vert (latérale). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
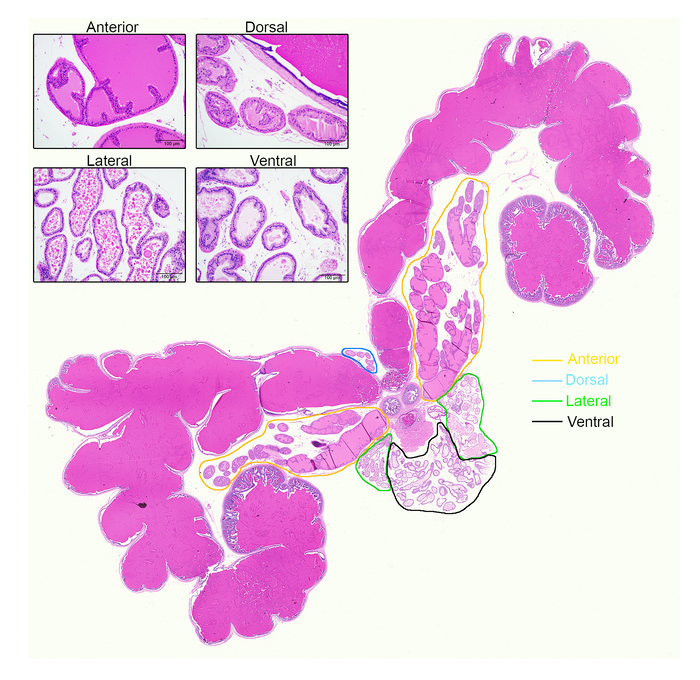
Figure 5 : les différents lobes de la prostate varient considérablement en histologie. Voici un H & E-teint toute la prostate image montrant les quatre lobes de la prostate, les vésicules séminales et urètre. Lobes figurent en orange (antérieur), vert (dorsale), bleu (latérale) et noir (ventrale). En médaillon : images représentatives de chaque lobe, prises en vertu d’un objectif 10 x. Barre d’échelle représente 100 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
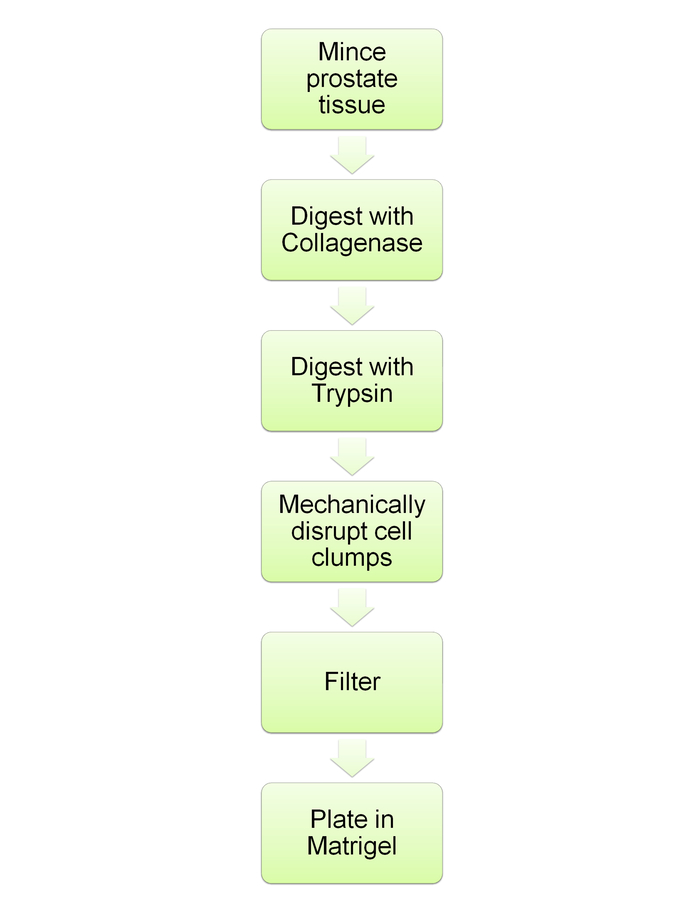
Figure 6 : diagramme schématique démontrant la digestion des prostates et des cultures ultérieures sphéroïde. Organigramme pour les étapes du protocole décrit dans les sections 5 et 6. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
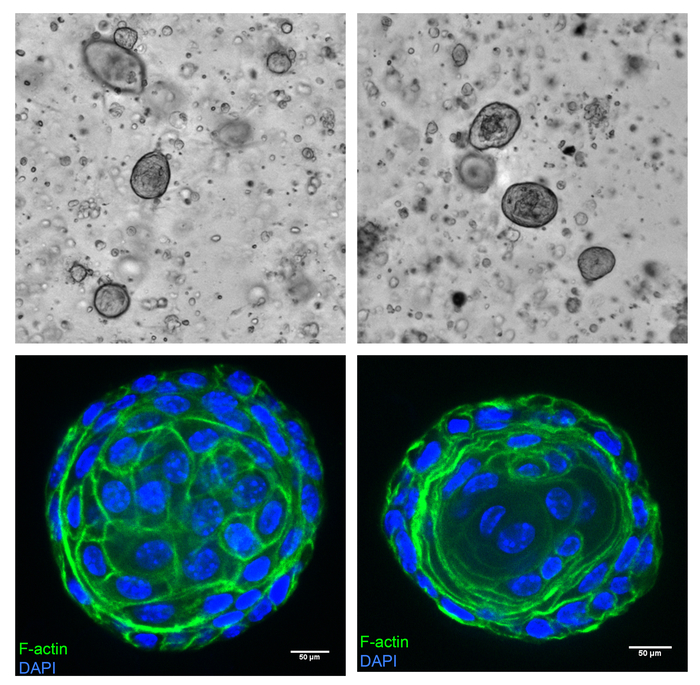
Figure 7 : les cellules de la prostate se transformer en sphéroïdes même sphériques avec ou sans un lumen. Les tissus prostatiques récoltées sur une souris de 3 mois de type sauvage a été cultivée selon le protocole. Cultures ont été projetés sur un imageur de plaque sous un objectif 4 X, 8 jours après culture, montrant la formation des sphéroïdes (en haut). Les sphéroïdes ont été récoltés et colorées comme décrit dans le protocole avec un colorant conjugué phalloïdine fluorescente pour l’actine F (vert) et DAPI pour les noyaux (bleu), puis copié sur un microscope confocal de disque tournant sous un 40 X objectif de l’eau (en bas). L’ellipsoïde sur la droite montre des signes d’un lumen. Barres d’échelle représentent 50 μm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 8 : les organoids de la prostate de souris montrent jonctionnelle localisation de β-caténine. Sphéroïdes récoltées sur les 3D cultures âgées de 6 jours ont été colorés, à l’aide d’un anticorps primaire contre β-caténine et un anticorps secondaire conjugué colorant de fluorescent et imagés sur un microscope confocal de disque tournant sous un 40 X objectif de l’eau. Images représentatives montrent immunostaining des β-caténine (vert, gauche), F-actine (rouge, milieu), DAPI (bleu). Le panneau de droite montre tous les 3 canaux ont fusionné. Barre d’échelle représente 20 μm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Cet article décrit les méthodes pour l’identification des lobes individuels et dissection de la prostate de souris. Également décrit est le protocole pour la culture des cellules de la prostate de souris dans une culture 3D pour l’analyse in vitro .
Une étape cruciale dans le protocole de la dissection est récolte l’UGS ensemble hors de la souris (1) et séparer les organes individuels sous un microscope à dissection. Le tissu prostatique est très petit et entouré par le reste de l’UGS ; ainsi, il est pratiquement impossible de récolter l’organe directement à partir de la cavité du corps tout en procurant les quatre paires de lobes intacts. Par conséquent, il est important de récolter l’UGS entier de la souris, puis procéder pour extraire la prostate. Il est également essentiel dans ce protocole (2) effectuer les étapes de façon opportune, mais rester méticuleuse. Temps est de l’essence au cours de la dissection afin de minimiser la dégradation des tissus. La technique spécifique décrite ici pour extraire l’UGS de la souris est plus rapide par rapport aux alternatives et est fortement recommandée. La technique d’isolation dissection et lobe entier prend habituellement 35 à 40 min, qui peut être abaissé à 25 min avec plus de pratique. La partie la plus difficile de la dissection est le nettoyage de la graisse qui entoure l’UGS, qui reprend une grande partie du temps de dissection totale. La graisse doit être méticuleusement retirée pour s’assurer que rien de tout cela reste avec la prostate, mais il est important d’être extrêmement prudent pour ne pas perdre accidentellement n’importe quel tissu de la prostate dans le processus. Une autre étape cruciale doit (3) ne supprime ne pas l’urètre avant la séparation entre les lobes de la prostate. L’urètre forme essentiellement la base sur laquelle tous les quatre paires de prostate lobes sont disposés. Il est plus facile d’identifier les lobes si ils sont toujours attachés à l’urètre, basé sur leur répartition spatiale à l’égard de l’urètre.
Une étape cruciale dans le protocole de culture sphéroïde est un hachage (1) le tissu bien. Hacher le tissu prostatique avec un scalpel est une étape fastidieuse, surtout depuis le tissu prostatique a une nature collante. Toutefois, il est essentiel d’obtenir un rendement maximal d’hacher le tissu aussi petit que possible. Une autre étape essentielle est (2) pipetage après trypsinisation et passant par seringues des tailles spécifiées post-neutralization. Ces deux étapes doivent être exécutées correctement et répétées, si nécessaire, pour atteindre le rendement cellulaire optimale. Enfin, il est important (3) ne pas de plaque de la membrane basale ECM trop mince ou trop épais. Si la membrane basale ECM est plaquée trop mince (i.e., moins de 100 µL/cm2), les cellules ne seront développera pas en bon organoïdes au milieu du puits, où le gel sera la plus fine. Placage c’est trop épais (i.e., plus de 250 µL/cm2) se traduira par l’ECM de la membrane basale pas solidifier correctement et glissement lors des changements de médias. Placage au milieu du puits aideront à réaliser le plus la même épaisseur de gel.
Le protocole décrit peut être légèrement modifié selon besoins expérimentaux. La technique pour l’extraction de l’UGS de la cavité abdominale nécessite une prise ferme sur la vessie avec une pince. Dans le cas où la vessie est trop pleine, il est important de vider la vessie avec une seringue de 1 mL et mince (26G ou similaire) aiguille, afin d’assurer une bonne prise en main avant de commencer à extraire le tissu. Le tissu doit être maintenu humide avec PBS ou DMEM pendant tout le processus de dissection. À l’aide de DMEM est préférable si le tissu est destiné à être utilisé pour les cultures de sphéroïde. La suspension de cellules récoltées peut être triée par cytométrie de flux pour isoler les sous-populations de cellules avant l’ensemencement, si vous le souhaitez, tel que décrit par Lukacs et al. 10.
Les caractéristiques histologiques des différents lobes la prostate ont été soulignées dans le présent protocole, et on devrait pouvoir identifier les lobes dans les tissus de la prostate en bonne santé en suivant ces directives. Cependant, il existe certaines limitations du processus. En cas d’hyperplasie ou de tumeurs agressives, la morphologie épithéliale est perturbée, ce qui peut rendre beaucoup plus difficile d’établir une distinction entre les lobes basés sur la coloration H & E. Dans de tels cas, séparation des lobes (telles que décrites dans le présent protocole) avant enrobage et de coloration est nécessaire si des informations spécifiques à lobe sont nécessaire. Même dans les tissus sains, il est souvent nécessaire d’analyser les lobes séparément car ils présentent la grande variabilité de l’anatomie et l’histologie et ont l’expression différentielle des signatures6. Toutefois, la pertinence translationnelle de séparer les lobes de la prostate souris peut être débattue, depuis que l’homme la prostate n’est pas divisée en lobes. Malgré cela, la souris reste le meilleur modèle pour étudier la PCa in vivo, et plusieurs modèles de souris ont été développés14,15. La méthode de culture 3D est surtout une technique clée qui peut être utilisée pour étudier les mécanismes de la maladie. Toutefois, une mise en garde de la méthode de culture de sphéroïde découle le modèle de l’expression différentielle de probasin, qui est le promoteur couramment utilisé pour la recombinase Cre dans des modèles murins de cancer de la prostate. Le promoteur probasin intervient principalement dans les cellules luminales et intermédiaires, mais pas dans les cellules basales7. Les conditions de culture décrites ici promouvoir formation sphéroïde principalement des cellules basales et intermédiaires, mais pas à partir de cellules luminales10. Par conséquent, les cultures qui en résultent produisent effectivement un mélange des sphéroïdes exprimant le Cre et non Cre-exprimant le (i.e., un mélange de contrôle et knock-out sphéroïdes). Ainsi, pendant l’analyse, il est important de réagissent pour la protéine d’intérêt pour identifier knock out organoïdes et tirer des conclusions sur le comportement d’organoïde issu du gène défonçables.
L’importance de ces méthodes réside dans les applications aux multiples facettes de l’utilisation de Gregory en études sur le cancer de la prostate. La méthode de dissection décrite a détaillé les étapes qui permettront aux chercheurs extraire la prostate plus rapidement et plus efficacement. La séquence du processus dissection est conçue pour s’assurer que les lobes individuels peuvent être identifiés et extrait, même par des personnes ayant une expérience minimale dans la dissection de la prostate. La méthode de culture décrite peut servir à poursuivre l’analyse des modèles de cancer de la prostate GEMM. Les conditions de culture doivent permettre la croissance et la survie des cellules tumorales et contrôle. Dans notre expérience, nous avons utilisé avec succès les prostates GEMM que pièce NIPP16. Prostates de souris présentant des tumeurs de grade plus élevés ont également été utilisés pour la culture de sphéroïde analyse17. Les sphéroïdes de souris de contrôle présentent une morphologie sphérique de même ; Cependant, sphéroïdes issus de cellules de tumeur de la prostate peuvent démontrer la différences de morphologie et de comportement en raison de leur potentiel néoplasique. Par conséquent, étudier le comportement organoïde in vitro fournira une étendue examiner les caractéristiques de ces cellules et éventuellement des observations de comportement sphéroïde dans en temps réel grâce à l’imagerie de cellules vivantes.
En conclusion, la dissection de la prostate et des méthodes de culture décrites dans le présent protocole peuvent être incorporés dans divers types d’études impliquant edged pour continuer à fournir des informations sur le cancer de la prostate dans toutes les applications en aval.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrentes.
Remerciements
Ce travail a été soutenu par la subvention du National Cancer Institute, R01CA161018 de LK.
matériels
| Name | Company | Catalog Number | Comments |
| Mouse surgical instruments (Mouse Dissecting kit) | World Precision Instruments | MOUSEKIT | |
| Dissection microscope | |||
| RPMI medium | Thermofisher Scientific | 11875093 | |
| Dissection medium (DMEM + 10%FBS) | Thermofisher Scientific | 11965-084 | |
| Fetal Bovine Serum | Thermofisher Scientific | 10438018 | |
| PBS (Phosphate buffered saline) | Thermofisher Scientific | 10010031 | |
| Collagenase | Thermofisher Scientific | 17018029 | Make 10x stock (10mg/ml) in RPMI, filter sterilize, aliquot and store at -20 °C |
| Trypsin-EDTA (0.05%) | Thermofisher Scientific | 25300054 | |
| DNase I | Sigma-Aldrich | 10104159001 ROCHE | |
| Syringes and Needles | Fisher Scientific | ||
| Fisherbran Sterile Cell Strainers, 40μm | Fisher Scientific | 22-363-547 | |
| PrEGM BulletKit | Lonza | CC-3166 | Add all componenets, aliquot and store at -20 °C. |
| Matrigel membrane matrix | Thermofisher Scientific | CB-40234 | |
| Dispase II powder | Thermofisher Scientific | 17105041 | Make 10x stock (10mg/ml) in PrEGM, filter sterilize, aliquot and store at -20 °C |
Références
- Marks, C. L. Mouse Models of Human Cancers Consortium (MMHCC) from the NCI. Cancer Research. 65 (9 Supplement), 242-243 (2005).
- Marks, C. Mouse Models of Human Cancers Consortium (MMHCC) from the NCI. Disease Models & Mechanisms. 2 (3-4), 111(2009).
- Day, C. P., Merlino, G., Van Dyke, T. Preclinical mouse cancer models: a maze of opportunities and challenges. Cell. 163 (1), 39-53 (2015).
- Society, A. C. Cancer Facts and Figures. , (2018).
- Shappell, S. B., et al. Prostate Pathology of Genetically Engineered Mice: Definitions and Classification. The Consensus Report from the Bar Harbor Meeting of the Mouse Models of Human Cancer Consortium Prostate Pathology Committee. Cancer Research. 64 (6), 2270-2305 (2004).
- Berquin, I. M., Min, Y., Wu, R., Wu, H., Chen, Y. Q. Expression signature of the mouse prostate. Journal of Biological Chemistry. 280 (43), 36442-36451 (2005).
- Wu, X., et al. Generation of a prostate epithelial cell-specific Cre transgenic mouse model for tissue-specific gene ablation. Mechanisms of Development. 101 (1-2), 61-69 (2001).
- Xin, L., Lukacs, R. U., Lawson, D. A., Cheng, D., Witte, O. N. Self-renewal and multilineage differentiation in vitro from murine prostate stem cells. Stem Cells. 25 (11), 2760-2769 (2007).
- Hofner, T., et al. Defined conditions for the isolation and expansion of basal prostate progenitor cells of mouse and human origin. Stem Cell Reports. 4 (3), 503-518 (2015).
- Lukacs, R. U., Goldstein, A. S., Lawson, D. A., Cheng, D., Witte, O. N. Isolation, cultivation and characterization of adult murine prostate stem cells. Nature Protocols. 5 (4), 702-713 (2010).
- Clarke, M. F., Fuller, M. Stem cells and cancer: two faces of eve. Cell. 124 (6), 1111-1115 (2006).
- Oliveira, D. S., et al. The mouse prostate: a basic anatomical and histological guideline. Bosnian Journal of Basic Medical Sciences. 16 (1), 8-13 (2016).
- Colicino, E. G., et al. Gravin regulates centrosome function through PLK1. Molecular Biology of the Cell. 29 (5), 532-541 (2018).
- Ittmann, M., et al. Animal models of human prostate cancer: the consensus report of the New York meeting of the Mouse Models of Human Cancers Consortium Prostate Pathology Committee. Cancer Research. 73 (9), 2718-2736 (2013).
- Valkenburg, K. C., Williams, B. O. Mouse models of prostate cancer. Prostate Cancer. 2011, 895238(2011).
- Xiong, X., et al. Disruption of Abi1/Hssh3bp1 expression induces prostatic intraepithelial neoplasia in the conditional Abi1/Hssh3bp1 KO mice. Oncogenesis. 1, e26(2012).
- Liao, C. P., Adisetiyo, H., Liang, M., Roy-Burman, P. Cancer-associated fibroblasts enhance the gland-forming capability of prostate cancer stem cells. Cancer Research. 70 (18), 7294-7303 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon