Method Article
Мышь жировой ткани сбора и обработки для анализа РНК
В этой статье
Резюме
Цель данного документа – представить пошаговые процедуры для сбора различных белой жировой ткани от мышей, обработки жира образцов и извлечь РНК.
Аннотация
По сравнению с другими тканями, белой жировой ткани имеет значительно меньше РНК и белков содержание для вниз по течению приложений, таких как реальном масштабе времени PCR и западной помарки, поскольку он главным образом содержит липиды. РНК изоляции от образцах адипозных тканей также сложной, как избежать эти липиды требуются дополнительные шаги. Здесь мы представляем процедура собрать три анатомически разные белой жировой ткани от мышей, чтобы обрабатывать эти образцы и выполнять РНК изоляции. Далее мы опишем синтез cDNA и ген выражение экспериментов с использованием ПЦР в реальном времени. Настоящим описывается протокол позволяет сокращение загрязнения от волос и кровь на жировых отложений, а также загрязнения между различными жировых отложений во время сбора ткани животного. Он также был оптимизирован обеспечить достаточное количество и качество РНК извлечены. Этот протокол может широко применяться к любой модели мыши, где жировой ткани образцы требуются для обычных экспериментов например ПЦР в реальном времени, но не предназначен для изоляции от первичных адипоцитов клеточной культуры.
Введение
Ожирение является всемирной эпидемии, которая может привести к осложнениям, например, тип 2 диабет1. Диета индуцированной ожирением и генетически модифицированных животных модели часто используются для исследования в ожирения и его осложнений связанные. Традиционно белой жировой ткани известен как отсек для избыток энергии и в основном состоит из липидов, в то время как коричневая жировая ткань преобразует энергию в тепло2,3. Жировой ткани является динамичным и будет расширять и сокращаться в зависимости от многих факторов, таких, как прием пищи и физической активности. Таким образом чтобы определить факторы, способствующие эти изменения, адекватные жировой ткани сбор и обработка являются требуется4.
Среди белой жировой ткани общепризнано, что подкожно и висцерального жира склады имеют различные свойства, такие как анатомической локализации и функционируют2,5. Следовательно чтобы избежать противоречивых результатов или большой изменчивостью, внимание необходимо предпринять во избежание перекрестного загрязнения между этими различными жировых отложений при сборе жировых отложений.
Кроме того есть три основных проблемы, при изоляции RNA или протеина от мышей белой жировой ткани. Во-первых собирая жировых отложений в ожирением мышей является не является легкой задачей, как граница, которая отделяет различные белый жировых депо не всегда ясно, в отличие от других органов, как почки и сердце6. Во-вторых из-за высоких липидов содержание жировой ткани, при изоляции RNA или протеина, слой липидов плавает на вершине и предотвращает прямой доступ к образцу. В-третьих, белой жировой ткани в отличие от коричневая жировая ткань или другие ткани, имеет значительно меньше РНК и белков содержание и это серьезной проблемой при использовании молодых мышей, мышей кормили нормальной диете (N) и мышей, которые должны иметь низкий жировой массы (т.е. KO модели, лечение препаратами, осуществлять подготовку, и т.д.) 7 , 8.
Таким образом важно выбрать подходящий метод, чтобы изолировать РНК из жировой ткани. Альтернативные методы для извлечения фенольных/хлороформ являются коммерческие наборы. Они обычно основаны на первоначальный фенола извлечения шаг, затем РНК на столбец9. Эти наборы являются более дорогостоящими, как правило дают образцы ниже доходности, в то время как качество РНК может быть переменная однако и менее затратным по времени. Однако один из самых больших преимуществ для фенола раствор/хлороформ извлечения описанных здесь является возможность изолировать РНК, ДНК и белка от одного образца10. Поскольку мышь жировых отложений обычно малы и дать небольшое количество белков и РНК (особенно в худой мыши модели), эти протоколы максимально данных, которую можно получить из небольшой пример.
Цель настоящего документа заключается в подробно описать метод для обеспечения адекватного проб из трех мышей белой жировой ткани складов, а также количество и качество изоляции РНК. РНК, получены этот протокол может использоваться для выполнения в реальном времени анализы ПЦР. Этот протокол не предназначен для изоляции RNA от искусственного первичной адипоцитов.
протокол
Уход мышей, используемые в процедурах соблюдали стандарты ухода и использования экспериментальных животных, установленные канадским Советом по защите животных. Все процедуры были утверждены университета животное уход и использование Комитетом на чум научно-исследовательский центр.
1. Вскрытие и жировой ткани коллекции от самцов мышей
- Сделайте экспериментальных групп в зависимости от целей исследования. В этом исследовании, пробы были взяты две группы самцов мышей на фоне C57Bl/6 (n = 12-14/группа). Убедитесь, что мышей, используемый здесь возраст 12-15 недель и ведутся на 12-h свет/темно цикла с доступом к нормальной (N) или высоким содержанием жиров (HF) и воды в течение 10 недель11 ad libitum .
- Усыпить мыши, поместив мышь в герметичной камере, где он подвергается 6% CO2 в течение 10 мин.
- Выполните сердечной прокол, медленно вставляя 1 мл шприц с иглой 1/2po 26G слева от грудины животного и медленно потянув поршень удалить большую часть крови животного. Убедитесь, что шприц параллельно тела животного. Медленно поверните шприц потянув поршень, если кровь не приходят в шприц.
Примечание: Успешных сердца пункция (между 0,8 и 1 мл крови объем) будет уменьшаться загрязнение жировой ткани с кровью. - Положите мыши на его обратно и ПИН-код каждой лапой на клавиатуре с помощью иглы 22G, как показано на рисунке 1.
- С марлей натирать кожу мыши с алкоголем несколько раз начиная от шеи все, вплоть до половых органов, следуя однонаправленного движения, поскольку это гарантирует, что волос остается неизменным и уменьшает загрязнение волос образцов жировой ткани без удаления волос.
- С помощью чистой, но не стерильный пинцет и Ножницы хирургические, поднять центральной кожи возле половых органов и сделать разрез небольшой 0,3 мм.
- Вставьте ножницы горизонтально в открытых отверстие и отсоединение брюшной кожу от брюшной стенки.
Примечание: Это делается путем тупого рассечение в пространстве между кожей и брюшной стенки и не резки оболочек, нашли в этом пространстве. - С помощью щипцов, поднять центральной кожи возле открытые отверстия и вырезать кожу над linea alba до тех пор, пока вы находитесь вблизи грудной клетки (~ 4 см в зависимости от размера мыши).
Примечание: Избегайте резки брюшной мышцы, как это может подвергнуть висцеральных жировой ткани в воздух и привести к сушке жировых отложений, которые могут изменить целостности тканей и его содержание. - С середины грудной клетки, порезать кожу к правой рукой на ~ 2 см. От около половых органов, вырезать кожу над правой задних конечностей на ~ 2 см.
- Растянуть один угол открытой кожи и контактный его на клавиатуре, с помощью иглой 22G. Повторите с другой угол.
Примечание: Жировой ткани, выставленные на коже является брюшной подкожной жировой клетчатки (SCF) (рис. 1А). - Соберите SCF тупым рассечения и резки его от кожи, используя Ножницы хирургические, позиционируется как плоский как можно на коже. После сбора, надел SCF заранее сформированных алюминиевой фольги.
Примечание: Сбор или заражение жировой ткани с кожи или волос будет изменить образец качества и урожайности РНК за счет полиадениновый. Если слишком много времени тратится на сбор жировой ткани, образец может также сухой, который также может изменить качество образца. - Повторите шаги с 1,9 до 1.11 на левой стороне животного. Бассейн левой и правой жира колодки в алюминиевой фольги и заморозить образца в жидком азоте.
- Чтобы получить доступ к висцерального жировой ткани, вырезать брюшной мышцы, с использованием чистой, но не стерильные хирургические ножницы и щипцы вдоль linea alba, на ~ 4 см, в зависимости от размера мыши, от гениталии к грудной клетке. Затем сделайте разрез в брюшной мышцы от гениталии к задней части мыши на ~2.5 см, чтобы иметь доступ к стороне брюшной полости.
- Жир вокруг половых органов является Пери гонадной жира (PGF) (рис. 1Б). PGF прикреплена к придатка, яички и ductus deferens, тщательно снимите левый жировой ткани из этих структур и положил на предварительно выявленных алюминиевой фольги. Повторите для правой стороны. После того, как оба PGFs собраны, заморозить образца в жидком азоте.
- Начиная с левой стороны, предоставлять почки, перемещая кишечник от брюшной полости с правой стороны. Жировой ткани, окружающие почек является Пери почечная жира (PRF) (рис. 1C). Также PRF окружает надпочечники (рис. 1D).
- Изоляции и удаления надпочечников перед сбором PRF. Это может быть утомительно, поскольку они являются просто немного pinker чем жировой ткани.
Примечание: Почки не быть удалены во время этого шага, как кровь может загрязнить жировой ткани и сделать его более трудно определить надпочечников в пределах этой жировой ткани. - Изолируйте PRF от обратно мышечной стенки, заканчивая путем разрезания мочеточника, почечных артерий и вен, который отделяет PRF и почек от остальной части тела. Изолируйте PRF из почек резки и удаления почечных капсулу. ПРФ остается прикрепленной к капсуле.
- Повторите шаги 1.15 и 1,17 для правой стороны. Поставьте обе PRF в алюминиевой фольги и замораживания образца в жидком азоте.
- Повторите процедуру от шагов 1.2 в 1.18 для всех мышей, чтобы быть собраны.
- На данный момент приступить шлифования жировой ткани или хранить образцы в морозильной камере-80 ° C для последующего извлечения. Образцы могут храниться стабильно на-80 ° C в течение нескольких лет4.
2. Подготовка земли белый жировой ткани для изоляции RNA
Примечание: Надевайте перчатки для каждого шага, как кожа содержит полиадениновый, который может способствовать деградации РНК и как таковой, изменяет образец качества и урожайности РНК после изоляции.
- Готовить и определить три бесплатно РНКазы коническая винтовая крышка 1,5 мл трубки на мышь, один для каждого типа, белой жировой ткани и поместите их на стойке.
Примечание: Ожирением животных может потребовать дополнительные пробирки, увеличением жировой массы. Это особенно верно для SCF для которого до 7 трубок для одной мыши был получен. - Очистить скамейке с 70% этанола и положить бумагу чистой и новой скамейке на поверхности.
- Жировой ткани были свеже собранных от мышей или заранее храниться в морозильной камере-80 ° C, соберите все образцы в одном контейнере жидкого азота заполнены до начала процедуры.
- Замораживания раствора, пестик и шпатель, поместив их в контейнере жидкого азота. Когда жидкий азот останавливается '' варить '', шлифовка жировой ткани может быть запущен.
Примечание: Этот шаг, минометов, шпатель Конические трубки и жировой ткани нужно оставаться охлажденным в течение всего процесса. Любое тепла будет таяния жировой ткани и сделать это труднее извлечь РНК. Кроме того при использовании керамической ступку и пестик, можно использовать сухой лед или жидкий азот держать холодно. - Поместите все бесплатно РНКазы 1,5 мл коническая винтовая крышка подготовлен на шаге 2.2 на сухой лед для охлаждения их трубы.
- Чтобы избежать обморожений на руках, используйте несколько слоев коричневой бумаги поднять раствор из жидкого азота и положил его на скамейке рабочих.
- Используйте щипцы для сбора образцов жировой ткани из жидкого азота и положил его в ступке. Быстро развернуть алюминиевой фольги и падение образца в центре раствора.
Примечание: Если образец жировой ткани является слишком большой, как в случае с ожирением мышей, разорвать образцы в малых частях в алюминиевой фольги, используя пальцы и распылить каждую часть отдельно. - Используйте несколько слоев коричневой бумаги снять толкатель из жидкого азота и вписать его в раствор. Удерживая пестик с коричневой бумаги, используйте молоток ударил в верхней части пестик один или два раза. Нажимайте толкателем против раствора с вращательные движения перетереть образца до получения мелкодисперсного порошка.
Примечание: Этот шаг очень важен для получения надлежащей изоляции РНК. Действительно наличие крупных фрагментов будет препятствовать РНК изоляции и снижения урожайности. - После получения мелкодисперсного порошка, удалите пестиком и забрать шпатель из жидкого азота и использовать его для передачи образца в соответствующие предварительно охлажденные 1,5 мл Конические трубки.
Примечание: Окуните шпатель обратно в жидкий азот, время от времени для того, чтобы предотвратить образца от таяния. Кроме того Имейте конические пробки в сухой лед всегда во избежание образца от таяния. Конические трубки заполнены с землей образца около 2/3 мощности (~ 1 мл) необходима для адекватного РНК урожайность и количество. - После того, как заполнены около 1 мл, закройте трубку и поместите его в жидкого азота заполненный контейнер.
Примечание: Избыток образцы можно поместить в отдельный предварительно охлажденные конические трубы с 1,5 мл, RNase бесплатно и храниться в морозильной камере-80 ° C для последующего использования. - Чистота раствора, пестик и шпатель с коричневой бумаги чтобы избежать переноса в следующий образец жировой ткани. Положить пестик и шпатель обратно в жидкий азот, чтобы охладить. Несмотря на коричневой бумаге не РНКазы бесплатно, мы используем свежезаваренным открытых пакет оберточной бумаги для каждый день РНК изоляции.
- Повторите шаги 2.4 в 2.11 с следующий пример.
- После того, как обрабатываются все образцы, начать РНК изоляции или хранить образцы в морозильной камере-80 ° C для последующего использования.
Примечание: Для предотвращения разрыва трубки, заморозить поле образец полностью погружаясь в контейнере жидкого азота. Когда остынет, достаточно удалить избыток азота из коробки и пусть она плавать поверх жидкого азота. Сортировка образцов в коробку и положить его в морозильник-80 ° С.
3. РНК изоляции от земли жировой ткани
Осторожностью: Фенола раствор вреден для кожи. Носите пальто лаборатории, перчатки, защитные очки и выполнения процедуры под химические вытяжки. Пошаговая схема показана на рисунке 2.
- Готовить и определяют два набора свободных РНКазы 1,5 мл конические трубы и положить их в шкаф.
- Жировой ткани были свежезаваренным молотый или предварительно хранится в холодильнике-80 ° C, соберите все образцы в контейнере жидкого азота заполнены до начала процедуры, которая осуществляется главным образом при комнатной температуре.
- Используйте корнцанг выборку местах жировой ткани из жидкого азота и положил его в стойку трубки. Трубы должны содержать ~ 1 мл порошка, который соответствует около 100 мг порошка ткани.
- Медленно откройте трубку.
Примечание: Оставляя закрытой трубке при комнатной температуре или открытие крышки трубка слишком быстро может привести к образца убытки или травма как давление от азота, как правило, бежать из трубки. - Добавить 500 мкл раствора фенола в образце (соотношение 1:2 раствора фенола: порошок ткани).
- Закройте крышку трубки и вихревой максимальной скоростью около 5 s. медленно и тщательно открытая трубка, выпустить давление азота (можно услышать звук воздуха, поступающего из трубки).
- Повторите шаги 3.5 и 3.6. Окончательный фенола раствор добавляется образец управлене 1 мл.
- Повторите шаг 3,6 до тех пор, пока образец полностью не растворится.
Примечание: Важно освободить все давление из трубки, прежде чем продолжить работу, чтобы не допустить разрыва трубки. - Пусть стоять при комнатной температуре, повторяя шаги 3.4 до 3,8 для следующих образцов образца.
- После того как все образцы обрабатываются, кратко вихря на максимальной скорости и Инкубируйте все образцы 5 мин при комнатной температуре.
- Центрифуга 10 мин на 12 000 x g при 4 ° C. Вернуть трубы в комнатной температуре.
Примечание: После центрифугирования, 3 фазы, присутствуют, как показано на рисунке 2: fat (вверху), РНК (в середине) и Пелле (внизу). - Для каждого образца передачи столько РНК (средний слой розовый) как можно скорее в первый набор соответствующих трубок с пипеткой P1000, используя подсказку отфильтрованного. Изменить советы между выборками.
- Чтобы обеспечить минимальное загрязнение РНК (средний слой), липидов (верхний слой), прокалывают этапа Топ с кончика вблизи стороне трубки. Отказаться от РНК в новой конические трубы без касатьться стороны новой трубки для предотвращения передачи липиды, которые могут быть на внешней стороне кончика.
- 200 мкл чистого метилхлороформа для каждой выборки и перемешать путем инверсии 15 s. инкубировать 10 мин при комнатной температуре.
- Центрифуга 15 мин на 12 000 x g при 4 ° C и вернуть трубы в комнатной температуре.
Примечание: После центрифугирования, присутствуют 3 фазы: РНК (вверху), интерфаза, которая содержит ДНК (в середине) и красный фенол хлороформ, которая содержит белки (внизу). - Для каждого образца передачи как много водные прозрачные РНК содержащих фаза (Топ) как можно на второй набор соответствующих конические трубы с P1000 пипетки с помощью отфильтрованных советы. Изменить советы между выборками.
Примечание: Интерфаза хрупок и может загрязнить Верхний этап, если стремление сделать слишком быстро. В качестве альтернативы используйте пипетки Р200 уменьшить шансы тревожные интерфазе. - 500 мкл 100% изопропиловый спирт для каждой выборки и перемешать путем инверсии на 15 сек.
- Инкубировать 10 мин при комнатной температуре
- Центрифуга 10 мин на 12 000 x g при 4 ° C и вернуть трубы в комнатной температуре. Отказаться от изопропиловый спирт, инвертирование каждой трубы.
Примечание: Маленький белый Пелле РНК обычно можно увидеть, но иногда не могут. - Добавить 1 мл 75% этанола (приготовленного из 100% этанола и РНКазы свободной воды) для каждого образца и кратко вихревой каждая трубка на максимальной скорости.
- Центрифуга 5 мин на 7 500 x g при 4 ° C и вернуть трубы в комнатной температуре.
- Отказаться от 75% этанола, инвертирование каждую пробирку и слегка постучите против коричневой бумаги, чтобы удалить любые остатки.
Примечание: При необходимости, используйте кончик фильтруется для удаления алкоголя вблизи Пелле РНК. Изменить отзыв между выборками. - Оставьте крышку открытым и воздуха сухие гранулы РНК для около 15-20 мин.
Примечание: РНК гранулы могут стать полупрозрачными во время этого шага. - Как солюбилизация РНК из гранул зависит от размера, оцените размер гранул для определения RNase свободной воды использоваться для солюбилизировать последнего РНК. Запишите объем (10-25 мкл) для каждого образца.
Примечание: Этот шаг является лишь качественный. Если гранулы РНК не может рассматриваться, мкл 10 РНК свободной воды на образец. - Добавьте 10-25 мкл РНКазы свободной воды каждый образец (заранее объем на шаге 3.24).
- Проинкубируйте образцы 5 мин в блоке тепла на 60 ° C. Кратко вихревых трубок.
- Проинкубируйте образцы дополнительные 5 минут в том же блоке тепла при температуре 60 ° C.
- Быстрый спина все образцы в мини спина центрифуги и немедленно положить на льду.
- Определение концентрации РНК и чистоты. Выполнение обратной транскрипции (RT) получать cDNA или хранить образцы в морозильной камере-80 ° C для последующего использования.
Примечание: Избегайте несколько циклов замораживания/оттаивания, поскольку это ухудшает RNA образцы.
4. Определение концентрации жировой ткани РНК и чистоты
- Образцах адипозных тканей РНК свежезаваренным были извлечены и солюбилизирован или предварительно хранится в холодильнике-80 ° C, собрать все образцы и позволяют им таять на льду до начала процедуры. Это должно быть сделано непосредственно перед началом следующего этапа или в конце изоляции, чтобы избежать нескольких циклов замораживания/оттаивания.
- Готовить и определяют два набора свободных РНКазы 1,5 мл конические трубы и положить их в шкаф трубки.
- Когда все образцы РНК полностью разморозить, вихревой образца для 1 s и положил обратно на льду.
- Разбавить решения TE 100-кратного в 1 x РНК в первом наборе РНКазы бесплатно 1,5 мл конические трубы с помощью отфильтрованных РНКазы бесплатные советы (99 мкл раствора 1 x TE и 1 мкл РНК положить трубку).
- Повторите для каждого образца.
Примечание: Тома может быть различным для каждого спектрофотометром в зависимости от используемых кювет. - После того, как обрабатываются все образцы, вихревой каждый разбавленный образца.
- Следуйте протокол спектрофотометр для калибровки инструмента, используя пустой (1 x TE) перед обработкой разреженных образцов РНК.
- Передавать образцы разреженных РНК кварцевые кюветы и определить концентрацию каждого образца в 260 Нм.
Примечание: Если прибору не обеспечивают конечной концентрации РНК, использовать эту формулу для вычисления: РНК (мкг/мкл) =260 OD х коэффициент разбавления x (40 мкг РНК/1 000 мкл). - Определите чистоту РНК каждого образца, вычисляя соотношение ОД260/OD280.
Примечание: Как правило, считается как чисто для РНК12соотношение ОД260/OD280 вокруг 2.0. Настоятельно рекомендуется, что проверяется качество РНК. Для того, чтобы сделать это, поместите 1 мкг на Отбеливание гель агарозы 1%, с 1 x TBE буфера (Tris база 89 мм, 89 мм борной кислоты и 2 мм ЭДТА, рН 8,0) РНК и 1% отбеливатель решение13 (рис. 3). РНК очень хорошего качества показывает 28S и 18S рРНК полос и 28S группы должен быть более интенсивным, чем 18 лет. РНК качество является приемлемым, когда оба рРНК полос видны на аналогичные интенсивности. РНК качество становится момент, когда группа 18S является более интенсивным, чем 28S-группы, и когда мазок является видимым, свидетельствует о деградации РНК недостаточно. - Для каждого образца Подготовьте 10 мкл 0,5 мкг/мкл РНК из запасов во втором наборе РНКазы бесплатно 1,5 мл конические трубы с использованием РНКазы свободной воды для разбавления пробы, при необходимости. Эти образцы используются для RT для получения cDNA.
- После того, как обрабатываются все образцы, начать RT или хранить образцы в морозильной камере-80 ° C для последующего использования.
5. Реверс транскрипция (RT)
- Ли жировой ткани РНК образцы были свежие разбавляют до 0,5 мкг/мкл или предварительно хранится в холодильнике-80 ° C, собрать все образцы и реагенты и позволяют им таять на льду до начала процедуры.
- Положите ПЦР трубки газа стойку на льду. После достаточно холодно подготовить и определить один набор свободных РНКазы ПЦР-пробирку полосы и положил их на стойке. Включать пустые.
- Подготовьте реакции для лечения DNase РНК: сделать главный микс (для необходимое количество образцов + 1 образец) следующих (количества для 1 образца): 1 мкл 10 X буфер реакции с MgCl2, 0.5 мкл DNase I (1 U/мкл) и 7,5 мкл РНКазы свободной воды с помощью отфильтрованные советы. Отказаться от 9 мкл в пробирки.
- Мкл 1 0,5 мкг/мкл РНК из каждого образца соответствующие трубы, поставить колпаки на каждой полосы и быстрой спина все полосы в мини-спин центрифуга принести образец в нижней части трубки. 1 мкл РНК свободной воды для пустой.
- Инкубируйте все полосы труба тепловая велосипедист или Отопление блока при 37 ° C на 30 мин, положить трубку газа обратно на стойку на льду.
- 1 мкл ЭДТА (50 мм) к каждой пробке и Инкубируйте все полосы труба тепловая велосипедист или Отопление блока при 65 ° C для 10 мин, положить трубку газа обратно на стойку на льду.
- Сделать главный микс (для требуемое количество образцов плюс 1 образец) следующих (количества для 1 образца): 1 мкл случайных hexamers (0,2 мкг/мкл) и 1 мкл dNTP смеси (содержит каждый из четырех deoxynucleotides в концентрации 10 мм). Лунки 2 мкл мастер смеси в каждую пробирку с помощью отфильтрованных советы. Изменить отзыв между выборками.
- Инкубируйте все полосы труба тепловая велосипедист или Отопление блока при 65 ° C за 5 минут, положить трубку газа обратно в стойку на льду.
- Сделать главный микс (для требуемое количество образцов плюс 1 образец) следующих (количества для 1 образца): 4 мкл 5 x RT буфер, 1 мкл АБС битор РНКазы (20 U/мкл), 0,25 мкл обратной транскриптазы (200 U/мкл) и 1,75 мкл воды, свободной от нуклеиназы. Отказаться от 7 мкл в пробирки с помощью отфильтрованных советы. Изменить отзыв между выборками.
- Выполняют RT в тепловая велосипедист, установив следующие программы: 10 мин при 25 ° C, 30 мин при 50 ° C, 5 мин при 85 ° C. Положите трубку полоски обратно на стойку на льду.
- Готовить и определить один набор свободных РНКазы ПЦР трубки полос и положил их на стойке.
- Для каждого образца Подготовьте желаемый объем разреженных cDNA 1:5 со склада в новой трубки полос с использованием ультрачистая вода. Образцы разреженных cDNA 1:5 будет использоваться для ПЦР в реальном времени.
- После того, как обрабатываются все образцы, начать ПЦР в реальном времени или хранить образцы (фондовых и разбавленных образцов) в морозильной камере-20 ° C для последующего использования.
6. в реальном масштабе времени PCR для экспрессии генов в жировой ткани
Примечание: Не подвергайте Люминесцентную краску на свет. Протокол ниже описывает амплификации ссылка гена s1614. Грунты и условия PCR должна быть изменена согласно ген интереса.
- Ли cDNA образцы свежезаваренным разводили 1:5 или предварительно хранятся в холодильнике-20 ° C, собрать все образцы и реагенты и позволяют им таять на льду до начала процедуры.
- Положите стойки для реального времени PCR трубки полоски на льду. После достаточно холодно подготовить и определить один набор в реальном времени ПЦР-пробирку полосы и положил их на стойке. Подготовка каждого образца и пробел в двух экземплярах.
- Сделать главный микс (для требуемое количество образцов плюс 1 образец) следующих (количества для 1 образца): 1.9 мкл ультрачистая вода, 5 мкл флуоресцентные краски (например, SYBR зеленый) и 0,3 мкл вперед грунтовка и 0,3 мкл обратный праймера. Отказаться от 7,5 мкл в пробирки.
- Мкл 2,5 1:5 разреженных cDNA от каждого образца соответствующие трубы. 2.5 мкл ультрачистая вода для заготовок. Поставьте заглушки на каждой полосе.
- Следуйте инструкциям производителя, чтобы настроить следующую программу в реальном масштабе времени PCR: 10 мин при 95 ° C и 40 циклов 15 s при 50 ° C, 30 s при 60 ° C, 30 сек при 70 ° C. Поместить образец полоски в ротор машины реального времени PCR и запустите программу.
Примечание: Тепловая велосипедист условия могут меняться в зависимости от аппарат используется и гена интереса. представленные в Рисунок 3 шоу лептина мРНК усиления нормализовать ссылка гена S16 mRNA амплификации14,15результаты выражение mRNA.
Результаты
После процедуры патанатомия три белой жировой ткани были собраны и взвешенной из двух групп мышей (N и ВЧ диета кормили мышей). Как и ожидалось, мышь на диеты ВЧ возросло окончательного веса и веса по сравнению с однопометники N диеты (Таблица 1). Эти замечания были сопровождается более чем два раза увеличение веса PGF, PRF и СКФ в ожирением мышей по сравнению с тех, кто на диете N.
Прежде чем выполнять любые эксперименты с изолированной РНК, ее чистоту оценивалась как описано в шаге 4.9. Для каждой белой жировой ткани РНК изоляции раствором фенола производства образцов с надлежащего качества как отношение OD260/OD280 был около 2,0, который рассматривается как чисто для РНК (Таблица 2). ПЦР в реальном времени данных показал, что выражение mRNA лептина значительно увеличилась в PGF и PRF, SCF ожирением мышей, по сравнению с тех, кто на диете N (рис. 4A). Действительно различия наблюдаются в выражение mRNA лептина были не из-за изменения s16, Гене ссылка используется для нормализации результаты, между двумя группами мышей, как КТ значения не были изменены (Рисунок 4B). Таким образом s16 может надежно использоваться как ссылка гена для экспрессии мРНК в PGF, PRF и SCF когда ВЧ диета является параметром в протокол исследования.
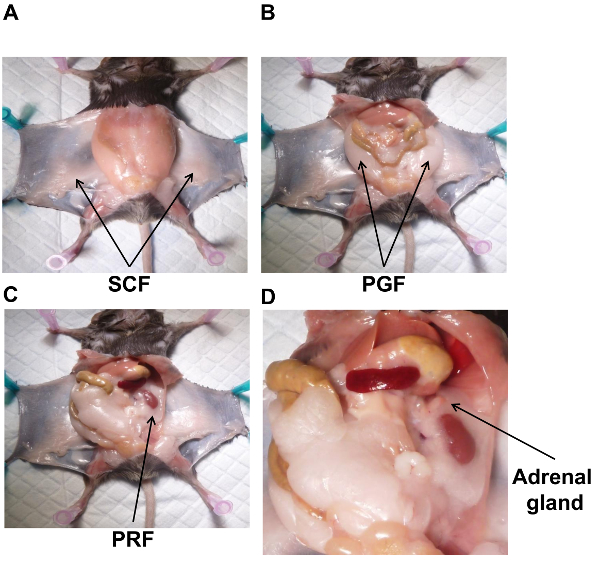
Рисунок 1 . Анатомическая локализация белой жировой ткани в мышах. Мужской мышь на диеты N был расчлененный Показать локализации каждого депо жировой ткани и надпочечники. SCF (A), PGF (B), (C) PRF и надпочечника (D). PGF, Пери гонадной жира; ЧПИ, Пери почечная жира; СКФ, брюшной подкожного жира. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
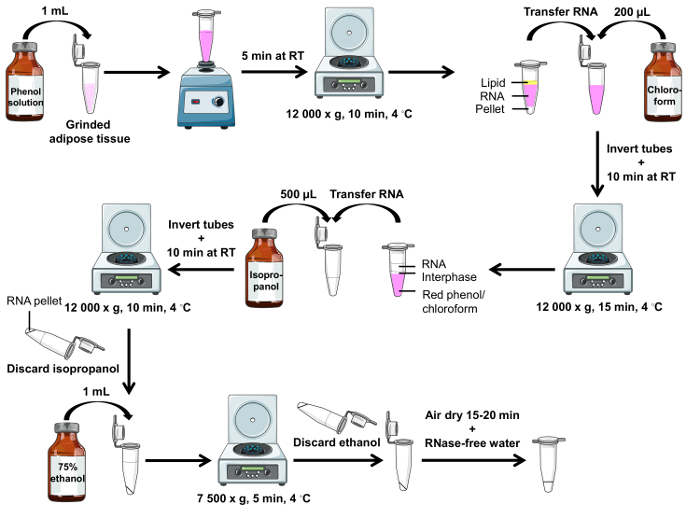
Рисунок 2 . РНК изоляции протокол схема с использованием раствора фенола. Схематическое представление шаги, необходимые для изолировать РНК от заземленной белой жировой ткани. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 . Оценка качества в РНК на Отбеливание гель. электрофорез на Отбеливание гель агарозы 1% отделена 1 ug РНК, изолированный от подкожного жира (SCF) и пери гонадной жира (PGF). 28S и 18s рРНК визуализируются УФ просвечивания. На геле РНК, изолированный от SCF и PGF мыши кормили нормальной диете. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 . Воздействие ВЧ диеты на лептина и s16 выражение mRNA в белой жировой ткани. Лептин (A) и s16 (Б) выражение mRNA. Данные для лептина нормализуются уровни mRNA s16, в то время как данные для s16 показываются как значение Ct и оба представлены как среднее ± SE с n = 12-13 для каждой группы. * по сравнению с диеты N p < 0,05. N, нормальный; ВЧ, высоким содержанием жиров; PGF, Пери гонадной жира; ЧПИ, Пери почечная жира; СКФ, брюшной подкожного жира. Эта цифра была изменена с Тан, P. et al, ожирение (2014) 22, 2201-2209. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| N диета | ВЧ диета | |
| Окончательный вес (г) | 37,5 ± 1,3 | 46.7 ± 1.7* |
| Увеличение веса (g) | 6.6 ± 0,7 | 16.7 ± 1.0* |
| PGF (g) | 1,08 ± 0,17 | 2.19 ± 0.15* |
| PRF (g) | 0,79 ± 0,15 | 1.71 ± 0,06 |
| СКФ (g) | 1.62 ± 0,35 | 3.55 ± 0.20* |
Таблицы 1. Влияние рациона питания ВЧ на веса тела и белой жировой ткани. Значения выражаются как средства ± SE с n = 14-15 для каждой группы. * по сравнению с диеты N p < 0,05. N, нормальный; ВЧ, высоким содержанием жиров; PGF, Пери гонадной жира; ЧПИ, Пери почечная жира; СКФ, брюшной подкожного жира. Эта цифра была изменена с Тан, P. et al, ожирение (2014) 22, 2201-2209.
| Образцы | Соотношение OD260/OD280 |
| PGF 1 | 2.04 |
| PGF 2 | 2.04 |
| PGF 3 | 2.02 |
| PRF 1 | 1.95 |
| PRF 2 | 2.08 |
| PRF 3 | 2.08 |
| SCF 1 | 2.04 |
| СКФ 2 | 2.02 |
| SCF 3 | 2.06 |
В таблице 2. РНК чистоты после изоляции от белой жировой ткани. n = 3 в жировой ткани. PGF, Пери гонадной жира; ЧПИ, Пери почечная жира; СКФ, брюшной подкожного жира.
Обсуждение
Следующие ВЧ диета питание, ожирением мышей были обнаружены увеличились тела и белой жировой ткани веса по сравнению с мышей кормили N диета. РНК, извлечены с помощью раствора фенола принесли образцы с хорошим чистоты. Лептин является АдипоКин главным образом производимые жировой ткани и известен положительно коррелируют с жировой массы16. Как и ожидалось, выражение mRNA лептина увеличилась в ожирением мышей в concomitance с их жировой массы.
Этот метод имеет несколько критических шагов. Основным является загрязнение одной белой жировой ткани депо с другой как стало известно, что различные жировой ткани склады имеют различные функции2,5. Загрязнение может принести заблуждение результаты в нисходящие приложения. Кроме того как жир, как правило, сухой раз при контакте с воздухом, собирая белой жировой ткани на регулярной и последовательной темп между мышей рекомендуется, если вес должен быть приняты. В противном случае общий вес жировой ткани могут быть неправильными. Для того чтобы получить РНК хорошего качества и урожайности, после недавно опубликованные MIQE руководящих принципов является определенным имуществом17. В частности что делает прекрасный образец порошка при шлифовании может помочь увеличить урожайность. Это максимизирует контакт между ткани порошок и фенола раствор во время изоляции РНК. Последнее, но не в последнюю очередь это изоляции РНК содержащих слой во время изоляции РНК (шаг 3.12). Как жира менее плотная, чем вода, он располагается поверх этап интереса. Сведение к минимуму переходящего остатка жира необходимо сократить вмешательство в нисходящие приложения.
Ограничение этого метода состоит навыки, необходимые для выполнения нескольких шагов в процедуре, а также необходимость работы с вредными реагентов при изоляции РНК. Кроме того весь процесс является трудоемким.
Есть не так много альтернатив для метода жировой ткани коллекции и образец обработки перед РНК изоляции помимо маленькие детали, которые обычно настраиваются на каждого пользователя. В случае изоляции РНК многие варианты доступны такие как извлечение фенола/хлороформ или РНК изоляции комплекты. Есть свои преимущества и недостатки каждого варианта, и это зависит от пользователя, чтобы выбрать лучший метод, основанный на нисходящие приложения. Фенол/хлороформ добыча является менее дорогостоящим, но требует использования вредных реагентов и трудоемкий. РНК изоляции комплекты, как правило, более дорогие, но процедура быстрее и обычно дает образцы с хорошим качеством и чистотой. Важно рассмотреть доходность и чистоту РНК, потому что материал является ограниченным в белой жировой ткани, которая состоит в основном из жиров. Основное преимущество в использовании фенола раствор для изоляции (извлечение фенола/хлороформ) является возможность изолировать РНК, ДНК и белка от одного образца18. Это эффективной стоимости и времени, как он уменьшает количество мышей, необходимых для получения достаточного материала. Как упоминалось ранее, в некоторых моделях мыши ограничено жировой массы. Для этих мышей разделение земли жировой ткани на три части отдельно получить РНК, ДНК и белка не рекомендуется как это может привести к недостаточной материал для нисходящие приложения. Чтобы обойти эту проблему, это также возможно для объединения аналогичных депо жировой ткани из нескольких мышей, основанные на критериях, определяемых пользователем, что приводит к увеличению числа животных необходимо.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана диабета Канады.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL seringes | |||
| 1X TE solution (10 mM Tris-HCl and 1 mM EDTA•Na2. pH 8.0) | |||
| 22 G needles | |||
| 26 G needles | |||
| 75% Ethanol | |||
| Block heater (dry bath) | |||
| Chloroform | Sigma | C2432-500mL | |
| dATP | Thermo scientific | R0141 | |
| dCTP | Thermo scientific | R0151 | |
| dGTP | Thermo scientific | R0161 | |
| DNase I (1 U/µl) | Thermo scientific | EN0521 | |
| dTTP | Thermo scientific | R0171 | |
| Faststart Universal SYBR green Master (Rox) | Roche | 4913922001 | |
| Faststart universal SYBR green master (Rox) fluorescent dye | Roche | 4913914001 | |
| Filtered tips | |||
| Forceps | Instrumentarium | HB275 | |
| Gauze | |||
| Hammer | |||
| High fat rodent diet | Bio-Serv, Frenchtown, NJ | F3282 | |
| Isopropanol | Laboratoire MAT | IH-0101 | |
| Leptin forward PCR primer (5’-GGGCTTCACCCCATTCTGA-3’) 10 uM | |||
| Leptin reverse PCR primer (5’-GGCTATCTGCAGCACATTTTG-3’) 10 uM | |||
| Liquid nitrogen | |||
| Maxima Reverse Transcriptase (enzyme and 5x buffer) | Thermo scientific | EP0742 | |
| Nanopure water (referred as ultrapure water) | |||
| Nitrile examination gloves | |||
| Nitrile gloves | |||
| Normal rodent diet | Harlan Laboratories, Madison, WI | Harlan 2018 | |
| P1000 pipetman | |||
| P2 pipetman | |||
| P20 pipetman | |||
| P200 pipetman | |||
| Phenol solution (TRIzol) | Ambion Life Technologies | 15598018 | |
| Pre-identified aluminium foil | |||
| Quartz spectrophotometer cuvette | |||
| Rack for PCR tube strips | |||
| Racks for RT-PCR tube strips | |||
| Random hexamers | Invitrogen | 58875 | |
| Real-time PCR Rotor Gene system | Corbett research | RG-3000 Rotor-Gene thermal cycler | |
| Refrigerated bench-top centrifuge | |||
| RiboLock RNase Inhibitor | Thermo scientific | EO0381 | |
| RNase-free 1.5 mL eppendorf tubes | |||
| RNase-free 1.5 mL screw cap tubes | |||
| RNase-free PCR tube strips (0.2 mL) and caps | |||
| RNase-free water | Hyclone | SH30538.02 | |
| RT-PCR machine | Qiagen | Rotor-Gene Corbett 3000 | |
| RT-PCR tube strips (0.1 mL) and caps | |||
| S16 forward PCR primer (5’-ATCTCAAAGGCCCTGGTAGC-3’) 10 uM | |||
| S16 reverse PCR primer (5’ ACAAAGGTAAACCCCGATCG-3’) 10 uM | |||
| Spectrophotometer | Biochrom | Ultrospec 3100 pro | |
| Stainless steel mortar and pestle | |||
| Surgical pads | Home made a foam board wrapped in a disposable absorbent underpad | ||
| Surgical scissors | Intrumentarium | 130.450.11 | |
| Thermal cycler | |||
| Thermal cycler | Biometra | Thermocycler | |
| Vortex mixer | |||
| Weighing spatula |
Ссылки
- Guh, D. P., et al. The incidence of co-morbidities related to obesity and overweight: a systematic review and meta-analysis. BMC. Public Health. 9, 88 (2009).
- Wronska, A., Kmiec, Z. Structural and biochemical characteristics of various white adipose tissue depots. Acta Physiol (Oxf). 205 (2), 194-208 (2012).
- Cannon, B., Nedergaard, J. Brown adipose tissue: function and physiological significance. Physiol Rev. 84 (1), 277-359 (2004).
- Holland, N. T., Smith, M. T., Eskenazi, B., Bastaki, M. Biological sample collection and processing for molecular epidemiological studies. Mutat Res. 543 (3), 217-234 (2003).
- Ibrahim, M. M. Subcutaneous and visceral adipose tissue: structural and functional differences. Obes Rev. 11 (1), 11-18 (2010).
- Mann, A., Thompson, A., Robbins, N., Blomkalns, A. L. Localization, identification, and excision of murine adipose depots. J Vis Exp. (94), (2014).
- Hemmrich, K., Denecke, B., Paul, N. E., Hoffmeister, D., Pallua, N. RNA Isolation from Adipose Tissue: An Optimized Procedure for High RNA Yield and Integrity. Laboratory Medicine. 41 (2), 104-106 (2010).
- Cirera, S. Highly efficient method for isolation of total RNA from adipose tissue. BMC Res Notes. 6, 472 (2013).
- Tan, S. C., Yiap, B. C. DNA, RNA, and protein extraction: the past and the present. J Biomed Biotechnol. 2009, 574398 (2009).
- Sellin Jeffries, M. K., Kiss, A. J., Smith, A. W., Oris, J. T. A comparison of commercially-available automated and manual extraction kits for the isolation of total RNA from small tissue samples. BMC Biotechnol. 14, 94 (2014).
- Tan, P., et al. Impact of the prorenin/renin receptor on the development of obesity and associated cardiometabolic risk factors. Obesity (Silver. Spring). 22 (10), 2201-2209 (2014).
- Taylor, S., Wakem, M., Dijkman, G., Alsarraj, M., Nguyen, M. A practical approach to RT-qPCR-Publishing data that conform to the MIQE guidelines. Methods. 50 (4), 1-5 (2010).
- Aranda, P. S., LaJoie, D. M., Jorcyk, C. L. Bleach gel: a simple agarose gel for analyzing RNA quality. Electrophoresis. 33 (2), 366-369 (2012).
- Mercure, C., Prescott, G., Lacombe, M. J., Silversides, D. W., Reudelhuber, T. L. Chronic increases in circulating prorenin are not associated with renal or cardiac pathologies. Hypertension. 53 (6), 1062-1069 (2009).
- Dusaulcy, R., et al. Adipose-specific disruption of autotaxin enhances nutritional fattening and reduces plasma lysophosphatidic acid. J. Lipid Res. 52 (6), 1247-1255 (2011).
- Nakamura, K., Fuster, J. J., Walsh, K. Adipokines: a link between obesity and cardiovascular disease. J Cardiol. 63 (4), 250-259 (2014).
- Taylor, S. C., Mrkusich, E. M. The state of RT-quantitative PCR: firsthand observations of implementation of minimum information for the publication of quantitative real-time PCR experiments (MIQE). J Mol Microbiol Biotechnol. 24 (1), 46-52 (2014).
- Hummon, A. B., Lim, S. R., Difilippantonio, M. J., Ried, T. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage. Biotechniques. 42 (4), 467-470 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены