Method Article
Maus Fettgewebe Erhebung und Verarbeitung für die RNA-Analyse
In diesem Artikel
Zusammenfassung
Dieses Papier soll eine schrittweise Anleitung zu sammeln verschiedene weißen Fettgewebe von Mäusen, die Fett Proben zu verarbeiten und RNA extrahieren zu präsentieren.
Zusammenfassung
Im Vergleich zu anderen Geweben, hat weißen Fettgewebe einen deutlich weniger RNA und Protein Inhalt für downstream-Anwendungen wie Real-Time PCR und Western-Blot, da es meist Lipide enthält. RNA Isolation aus Fettgewebe Proben ist auch herausfordernd, da zusätzliche Schritte erforderlich sind, um diese Lipide zu vermeiden. Hier präsentieren wir Ihnen ein Verfahren um drei anatomisch unterschiedlichen weißen Fettgewebe von Mäusen, verarbeiten diese Proben und durchführen von RNA Isolierung zu sammeln. Wir beschreiben weiter die Synthese der cDNA und gen-Ausdruck-Experimente mittels Real-Time PCR. Das hiermit beschriebene Protokoll ermöglicht die Reduzierung der Kontamination von Haar und Blut auf Fettpolster sowie Cross-Kontamination zwischen verschiedenen Fettpolster bei der Entnahme von Gewebe des Tieres. Es wurde auch optimiert, um angemessene Quantität und Qualität der extrahierten RNA zu gewährleisten. Dieses Protokoll kann weit angewendet werden, um jede Maus-Modell wo Fettgewebe Proben für routinemäßige Experimente wie Real-Time PCR erforderlich sind, aber ist nicht zur Isolation von primären Adipozyten Zellkultur.
Einleitung
Adipositas ist eine weltweite Epidemie Komplikationen wie Typ 2 Diabetes1führen kann. Diät-induzierten fettleibig und gentechnisch veränderten Tiermodelle sind häufig in Übergewicht und die damit verbundenen Komplikationen für die Forschung verwendet. Traditionell weißen Fettgewebe ist bekannt als ein Ablagefach für überschüssige Energie und besteht hauptsächlich aus Lipiden während braunes Fettgewebe Energie in Wärme2,3 wandelt. Fettgewebe ist dynamisch erweitern und verkleinern abhängig von vielen Faktoren wie Ernährung und körperliche Aktivität. Um Faktoren auf diese Veränderungen zu bestimmen, sind daher ausreichend Fettgewebe Erhebung und Verarbeitung erforderlich4.
Unter weißen Fettgewebe ist es allgemein anerkannt, dass viszeralen und subkutanen Fettdepots unterschiedliche Eigenschaften wie die anatomische Lokalisierung haben und Funktion2,5. Folglich muss zur Vermeidung von widersprüchlichen Ergebnissen oder große Variabilität Aufmerksamkeit getroffen werden, um Kreuzkontaminationen zwischen diesen verschiedenen Fettdepots beim Fettpolster zu sammeln.
Darüber hinaus gibt es drei große Herausforderungen, wenn Sie RNS oder Protein aus Mäusen weißen Fettgewebe zu isolieren. Erstens ist die Fettpolster bei fettleibigen Mäusen sammeln nicht leichte Aufgabe wie die Grenze trennt verschiedene weiße Fettdepots nicht immer klar, im Gegensatz zu anderen Organen wie Niere und Herz6. Zweitens wegen der hohen Fettgehalt des Fettgewebes, während RNS oder Protein isoliert, eine Schicht von Lipiden obenauf schwimmt und verhindert den direkten Zugriff auf die Probe. Drittens: im Gegensatz zu braunen Fettgewebe oder anderen Geweben, weißen Fettgewebe hat erheblich niedrigeren Gehalt an RNA und Protein und dies ist von großer Bedeutung bei der Verwendung von junger Mäusen, Mäuse eine normale (N) Diät gefüttert und Mäuse, die voraussichtlich haben geringe Dicke Massen (d.h. KO Modelle, Behandlung mit Medikamenten, Übung, Training, etc..) 7 , 8.
Daher ist es wichtig, auswählen der geeigneten Methode, die RNA aus Fettgewebe zu isolieren. Alternative Methoden zur Phenol/Chloroform Extraktion sind kommerzielle Kits. Sie basieren in der Regel auf eine anfängliche Phenol Extraktionsschritt, gefolgt von RNA-Reinigung auf eine Spalte9. Diese Kits sind in der Regel teurer und Proben von geringeren Ertrag zu geben, während die RNA-Qualität Variable möglicherweise jedoch sind weniger zeitaufwändig. Einer der größten Vorteile der Phenol-Lösung/Chloroform Extraktion hier beschriebene ist jedoch die Möglichkeit der Isolierung von RNA, DNA und Proteine aus einer einzigen Probe10. Da Mäuse Fettpolster meist klein sind und kleine Menge von RNA und Proteinen (insbesondere schlanke Maus-Modellen geben), maximieren Sie diese Protokolle die Daten, die man aus einer kleinen Probe abbekommt.
Das Ziel dieses Papiers ist es, im Detail beschreiben eine Methode, um adäquate Probenentnahme aus drei Mäuse weißen Fettgewebe Depots sowie Menge und Qualität der RNA Isolierung zu gewährleisten. RNA durch Anschluss an dieses Protokoll erhalten kann verwendet werden, um Echtzeit-PCR-Tests durchzuführen. Dieses Protokoll dient nicht zur RNA-Isolierung aus kultivierten primäre Adipozyten.
Protokoll
Pflege der Mäuse in den Prozeduren verwendet erfüllt Normen für die Pflege und Verwendung von Versuchstieren von Canadian Council für den Schutz von Tieren festgelegt. Alle Verfahren wurden von der Universität Animal Care und Einsatz-Ausschuss am Forschungszentrum für CHUM genehmigt.
(1) Sektions- und Fettgewebe Sammlung von männlichen Mäusen
- Versuchsgruppen nach Studienziele zu machen. In dieser Studie wurden Proben von zwei Gruppen von männlichen Mäusen auf einem Hintergrund C57Bl/6 (n = 12-14/Gruppe). Stellen Sie sicher, dass Mäuse, die hier verwendeten 12-15 Wochen alt sind und werden auf 12 h hell/dunkel-Zyklus mit Zugang zu Normal (N) "oder" (HF) fettreiche Ernährung und Wasser Ad Libitum für einen Zeitraum von 10 Wochen11.
- Einschläfern Sie eine Maus durch Platzieren des Cursors in einer verschlossenen Kammer, wo es in 10 min. 6 % CO2 ausgesetzt ist.
- Führen Sie Herzpunktion, indem langsam einfügen eine 1 mL Spritze mit einer 26G 1/2po Nadel einfach auf der linken Seite des Tieres Brustbein befestigt und langsam den Kolben um die meisten Blut des Tieres zu entfernen. Stellen Sie sicher, dass die Spritze parallel zum Körper des Tieres ist. Drehen Sie die Spritze langsam beim Ziehen des Kolbens, wenn Blut in die Spritze nicht kommt.
Hinweis: Erfolgreiche Herzpunktion (zwischen 0,8 und 1 mL Blutvolumen) verringert Verunreinigung von Fettgewebe mit Blut. - Legen Sie die Mäuse auf den Rücken und Heften Sie jede Pfote auf das Pad mit 22G Nadeln, wie in Abbildung 1dargestellt.
- Reiben Sie mit einer Gaze die Haut der Maus mit Alkohol mehrmals den Hals hinunter zu den Genitalien von einer unidirektionalen Bewegung nach, wie dies gewährleistet, dass Haar flach bleibt und die Haar-Kontamination der Proben Fettgewebe reduziert ab ohne Haarentfernung.
- Mit sauber, aber nicht sterilen Pinzette und chirurgische Scheren, die zentrale Haut in der Nähe der Geschlechtsorgane zu erhöhen und einen kleine 0,3 mm Einschnitt machen.
- Stecken Sie die Schere waagerecht in die geöffneten Bohrung und lösen Sie die Bauchhaut von der Bauchwand.
Hinweis: Dies geschieht durch stumpfe Dissektion im Bereich zwischen der Haut und der Bauchwand und nicht durch Schneiden die Membranen gefunden in diesem Raum. - Mit der Pinzette, erheben die zentrale Haut nahe dem geöffneten Loch und schneiden Sie die Haut über den Linea Alba bis Sie in der Nähe des Brustkorbs (~ 4 cm abhängig von der Größe der Maus) sind.
Hinweis: Zu vermeiden, schneiden die Bauchmuskulatur, da dies möglicherweise der viszerale Fettgewebe in die Luft aussetzen und führen zu trocknen die Fettpölsterchen, die die Integrität des Gewebes und deren Inhalt ändern können. - Schneiden Sie aus der Mitte des Brustkorbes die Haut in Richtung der rechten Arm auf ~ 2 cm. Aus in der Nähe der Geschlechtsorgane, die Haut über der rechten Hind Gliedmaßen auf ~ 2 cm geschnitten.
- Eine Ecke des geöffneten Haut dehnen und auf dem Pad mit einer 22G Nadel festzunageln. Wiederholen Sie dies mit der anderen Ecke.
Hinweis: Das Fettgewebe auf die Haut ausgesetzt ist die subkutane Bauchfett (SCF) (Abb. 1A). - Sammeln Sie die SCF durch stumpfe sezieren und schneiden es aus der Haut mit einer chirurgischen Schere positioniert, so flach wie möglich auf der Haut. Einmal gesammelt, setzen Sie das SCF die bereits identifizierten Aluminiumfolie auf.
Hinweis: Sammeln oder verunreinigen adipösen Gewebes mit Haut- oder Haarfarbe ändert probieren, Qualität und Ertrag der RNA durch RNases. Wenn zuviel Zeit sammelt das Fettgewebe kann die Probe auch trocknen, die auch die Qualität der Probe verändern kann. - Wiederholen Sie die Schritte 1,9 bis 1.11 auf der linken Seite des Tieres. Links und rechts Fett Pads in die Aluminiumfolie zu bündeln und Einfrieren der Probenmaterials in flüssigem Stickstoff.
- Um Zugriff auf das viszerale Fettgewebe zu erhalten, schneiden die Bauchmuskulatur mit sauber aber nicht steril Chirurgische Scheren und Pinzetten entlang der Linea Alba, ~ 4 cm, abhängig von der Größe der Maus, von den Genitalien auf den Brustkorb. Dann machen Sie einen Schnitt in die Abdominal-Muskeln von den Genitalien im hinteren Bereich der Maus auf ~2.5 cm auf der Seite der Bauchorgane zugreifen.
- Das Fett um die reproduktiven Organe ist das Peri-Gonaden Fett (PGF) (Abbildung 1B). PGF Ductus Deferens, der Nebenhoden und Hoden befestigt ist, lösen Sie sorgfältig linken Fettpolster aus diesen Strukturen und setzen Sie auf die bereits identifizierten Aluminiumfolie. Auf der rechten Seite wiederholen. Sobald beide TGF erhoben werden, frieren Sie die Probe in flüssigem Stickstoff ein.
- Ausgehend von der linken Seite, setzen Sie die Nieren durch eine Abkehr von den Darm von der Bauchhöhle auf der rechten Seite. Das Fettgewebe rund um die Niere ist das Peri-renal Fett (PRF) (Abbildung 1C). PRF umgibt auch die Nebennieren (Abbildung 1D).
- Isolieren Sie und entfernen Sie die Nebennieren vor PRF zu sammeln. Dies kann mühsam sein, da sie nur ein bisschen pinker als das Fettgewebe sind.
Hinweis: Nieren sollten nicht während dieses Schrittes entfernt werden, da Blut das Fettgewebe verunreinigen und erschweren die Nebennieren innerhalb dieser Fettlappen identifizieren kann. - Isolieren Sie die PRF aus die wieder muskuläre Wand endet durch schneiden den Harnleiter, die renale Arterie und Vene trennt die PRF und Niere vom Rest des Körpers. Isolieren Sie die PRF aus der Niere durch Schneiden und entfernen die renale Kapsel. Die PRF bleibt die Kapsel.
- Wiederholen Sie die Schritte 1.15 und 1.17 für die Rechte Seite. Setzen Sie beide PRF in die Alufolie und Einfrieren der Probenmaterials in flüssigem Stickstoff.
- Wiederholen Sie den Vorgang von Schritte 1.2 zu 1.18 für alle Mäuse gesammelt werden.
- An dieser Stelle fortfahren mit Fettgewebe zu Schleifen oder Proben in einem-80 ° C Gefrierschrank für spätere Extraktion zu speichern. Proben können bei-80 ° C für mehrere Jahre4stabil gelagert werden.
2. Vorbereitung des Bodens weißen Fettgewebe zur RNA-Isolierung
Hinweis: Tragen Sie Handschuhe für jeden Schritt, da Haut RNases enthält die RNA-Abbau fördern können und als solche ändert Probenqualität und RNA-Ausbeute nach Isolierung.
- Vorbereitung und identifizieren drei RNase-freie 1,5 mL konische Schraubverschluss Tuben pro Maus, eine für jede Art von weißen Fettgewebe, und legen Sie sie auf einem Gestell.
Hinweis: Übergewichtige Tiere erfordern zusätzliche Röhren, wie sie Fett Massen erhöht haben. Dies gilt insbesondere auch für SCF für die bis zu 7 Rohre für eine Maus gewonnen wurde. - Reinigen Sie die Bank mit 70 % Ethanol und legen Sie ein sauberes und neues Bank-Papier auf der Oberfläche.
- Ob Fettgewebe frisch gesammelt von Mäusen wurden oder vorher in einem-80 ° C Gefrierschrank gelagert, versammeln Sie sich alle Proben in einem flüssigen Stickstoff gefüllten Behälter bis zum Beginn des Verfahrens.
- Frieren Sie der Mörser, Pistill und Spatel indem man sie in den flüssigen Stickstoff Behälter ein. Stoppt der flüssige Stickstoff '' Kochen '', werden Schleifen von Fettgewebe gestartet kann.
Hinweis: Aus diesen Schritt, Mörtel, Spachtel konische Rohr und Fettgewebe gekühlt während des gesamten Prozesses bleiben müssen. Wärme wird das Fettgewebe zu schmelzen und machen es schwieriger, die RNA extrahieren. Auch, wenn eine Keramik Mörser und Stößel, einer Trockeneis oder flüssigem Stickstoff können um es kalt zu halten. - Legen Sie alle RNase-freie 1,5 mL konische Schraubverschluss Röhren bereit bei Schritt 2.2 auf Trockeneis, sie abkühlen.
- Um Erfrierungen an den Händen zu vermeiden, verwenden Sie einige Schichten Packpapier, heben Sie den Mörtel von flüssigem Stickstoff und legte es auf einen Arbeitstisch.
- Verwenden Sie die Zange, um ein Fettgewebe Probe aus dem flüssigen Stickstoff sammeln und steckte ihn in den Mörser. Schnell packen Sie die Alufolie und ziehen Sie das Sample in der Mitte des Mörtels.
Hinweis: Wenn die Fettgewebe Probe zu groß ist, wie bei fettleibigen Mäusen der Fall ist, brechen Sie die Proben in kleinere Teile in die Aluminium-Folie mit Ihrem Daumen und pulverisieren Sie jedes Teil separat zu. - Verwenden Sie ein paar Schichten aus braunem Papier zu heben die Stößel aus dem flüssigen Stickstoff und setzen Sie ihn in den Mörser. Halten Sie den Stößel mit braunen Papieren, verwenden Sie den Hammer auf den Spitzenplätzen der Stößel ein-oder zweimal. Drücken Sie den Stößel gegen den Mörtel mit rotierenden Bewegungen um die Probe zu mahlen, bis ein feines Pulver erhält.
Hinweis: Dieser Schritt ist wichtig, ausreichende RNA Isolierung zu erhalten. In der Tat, das Vorhandensein von größeren Fragmente behindern RNA Isolierung und Ertrag. - Sobald ein feines Pulver vorliegt, entfernen Sie den Stößel und holen Sie den Spatel aus dem flüssigen Stickstoff und verwenden Sie, um die Probe in das entsprechende vorgekühlt 1,5 mL konische Rohr übertragen.
Hinweis: Tauchen Sie den Spatel in flüssigem Stickstoff, von Zeit zu Zeit, um die Probe vor dem Schmelzen zu verhindern. Denken Sie auch, das konische Rohr Trockeneis immer zu verhindern, dass die Probe Auftauen. Eine konische Rohr gefüllt mit Boden-Probe zu etwa 2/3 Kapazität (~ 1 mL) ist für ausreichende RNA-Ausbeute und Menge erforderlich. - Wenn bis etwa 1 mL gefüllt, verschließen Sie das Röhrchen und legen Sie es in den anderen flüssigen Stickstoff gefüllten Behälter.
Hinweis: Überschüssige Proben können in separaten vorgekühlt RNase-freie 1,5 mL konische Rohre und in einem-80 ° C Gefrierschrank für die spätere Verwendung gespeichert werden. - Reinigen Sie die Mörser, Pistill und Spatel mit braunen Papieren zur Verschleppung in die nächste Fettgewebe Probe zu vermeiden. Setzen Sie Pistill und Spatel wieder in den flüssigen Stickstoff zum chillen. Obwohl das braune Papier ist nicht RNase-freie, verwenden wir eine frisch geöffnete Packung von braunem Papier für jeden Tag der RNA isoliert.
- Wiederholen Sie die Schritte 2,4 bis 2.11 mit der nächsten Probe.
- Sobald alle Proben bearbeitet sind, beginnen Sie RNA Isolierung oder speichern Sie Proben in einem-80 ° C Gefrierschrank für die spätere Verwendung zu.
Hinweis: Damit die Rohre nicht platzen, Einfrieren einer Musterbox komplett eintauchen in den Flüssigstickstoff-Behälter. Wenn kühl genug entfernen der überschüssigen Stickstoff aus der Schachtel und lassen Sie es schweben auf dem flüssigen Stickstoff. Sortieren Sie die Proben in das Feld ein und steckte es in eine-80 ° C Gefrierschrank.
3. RNA Isolation aus Fettgewebe Boden
Vorsicht: Phenol-Lösung ist schädlich für die Haut. Tragen Sie einen Kittel, Handschuhe, Schutzbrille und führen Sie die Prozedur unter einer chemischen Kapuze. Eine Schritt für Schritt Flussdiagramm ist in Abbildung 2dargestellt.
- Vorbereitung und zwei Sätze von RNase-freie 1,5 mL konische Röhrchen zu identifizieren und steckte sie in ein Rack.
- Ob Fettgewebe waren frisch gemahlen oder in einem-80 ° C Gefrierschrank vorgespeichert, versammeln Sie sich alle Proben in einem flüssigen Stickstoff gefüllten Behälter bis zum Beginn des Verfahrens die meist bei Raumtemperatur erfolgt.
- Verwenden Sie Zange, um eine Stichprobe Boden Fettgewebe aus dem flüssigen Stickstoff und steckte es in ein Rohr-Rack. Die Rohre sollte ~ 1 mL Pulver, das entspricht ca. 100 mg Gewebe Pulver enthalten.
- Öffnen Sie langsam das Rohr.
Hinweis: Verlassen eine geschlossene Röhre bei Raumtemperatur oder das Rohr Deckelöffnen zu schnell könnte zum Beispiel Verluste oder Verletzungen führen, da Druck vom Stickstoff tendenziell aus der Tube zu entkommen. - Die Probe 500 µL Phenol-Lösung hinzufügen (1:2 Verhältnis von Phenol-Lösung: Gewebe Pulver).
- Schließen der Deckel des Rohres und Strudel mit maximaler Geschwindigkeit für ca. 5 s. langsam und vorsichtig öffnen, das Rohr um den Druck vom Stickstoff (eine von Luft aus dem Schlauch kommt Ton) zu lösen.
- Wiederholen Sie die Schritte 3.5 und 3.6. Die endgültige Phenol Lösung Volumen hinzugefügt, um die Probe beträgt 1 mL.
- Wiederholen Sie Schritt 3.6, bis die Probe vollständig gelöst ist.
Hinweis: Es ist wichtig, den Druck aus der Tube zu entlasten, bevor Sie weiter fortfahren, um zu verhindern, dass den Schlauch platzen. - Lassen Sie die Probe bei Raumtemperatur stehen, während sich wiederholenden Schritte 3,4 bis 3,8 für die nächsten Proben.
- Sobald alle Proben sind verarbeitet, kurz Wirbel mit maximaler Geschwindigkeit und alle Proben 5 min bei Raumtemperatur inkubieren.
- Zentrifugieren Sie 10 min bei 12 000 x g bei 4 ° C. Bringen Sie die Rohre wieder auf Raumtemperatur.
Hinweis: Nach Zentrifugation, 3 Phasen sind vorhanden, wie in Abbildung 2dargestellt: Fett (oben), RNA (Mitte) und Pellets (unten). - Übertragen Sie für jede Probe so viel RNA (rosa Mittelschicht) wie möglich in die erste Reihe von entsprechenden Röhren mit einer P1000-Pipette mit einer gefilterten Spitze. Ändern Sie Tipps zwischen Proben.
- Um minimale Verschmutzung der RNA (Mittelschicht) durch die Lipid (oberste Schicht) zu gewährleisten, durchbohren Sie die obere Phase mit der Spitze in der Nähe von der Seite des Rohres. Verzichten die RNA Lipide, die möglicherweise auf der Außenseite der Spitze Übertragung in die neue konische Rohre ohne die Seiten des neuen Schlauches zu verhindern.
- Jede Probe 200 µL des reinen Chloroform hinzu und mischen durch Umkehrung für 15 S. inkubieren 10 min bei Raumtemperatur.
- 15 min bei 12 000 x g bei 4 ° C zentrifugiert und die Rohre wieder auf Raumtemperatur bringen.
Hinweis: Nach Zentrifugation, 3 Phasen vorhanden sind: RNA (oben), Interphase enthält DNA (Mitte) und rot Phenol-Chloroform enthält Proteine (unten). - Übertragen Sie für jede Probe als viel transparenter RNA-haltigen Wasserphase (obere Phase) wie möglich an die zweite Gruppe von entsprechenden konischen Rohren mit einer P1000-Pipette mit gefiltert-Tipps. Ändern Sie Tipps zwischen jeder Probe.
Hinweis: Die Interphase ist empfindlich und kann die obere Phase verunreinigen, wenn Anspruch zu schnell erfolgt. Als Alternative verwenden Sie eine P200 Pipette zur Verringerung der Chancen der Interphase zu stören. - Jede Probe 500 µL 100 % Isopropanol hinzu und mischen Sie durch Umkehrung 15 Sek. lang.
- 10 min bei Raumtemperatur inkubieren
- 10 min bei 12 000 x g bei 4 ° C zentrifugiert und die Rohre wieder auf Raumtemperatur bringen. Entsorgen Sie das Isopropanol durch invertieren jedes Rohr.
Hinweis: Einen kleinen weißen RNA-Pellets kann in der Regel gesehen werden aber gelegentlich möglicherweise nicht. - Jede Probe und kurz Vortex 1 mL 75 % Ethanol (hergestellt aus 100 % Ethanol und RNase-freies Wasser) hinzufügen jedes Rohr mit maximaler Geschwindigkeit.
- 5 min bei 7 500 x g bei 4 ° C zentrifugiert und die Rohre wieder auf Raumtemperatur bringen.
- Verwerfen Sie die 75 % Ethanol durch invertieren jedes Rohr und tippen Sie gegen einen braunen Papier gebliebene entfernen.
Hinweis: Falls erforderlich, verwenden Sie gefiltert-Tip, um Alkohol in der Nähe der RNA-Pellet zu entfernen. Wechseln Sie zwischen Proben. - Lassen Sie den Deckel öffnen und die RNA-Pellet für ca. 15-20 min lufttrocknen.
Hinweis: RNA-Pellets könnte bei diesem Schritt durchscheinend werden. - Da RNA Solubilisierung von Pellet größenabhängige ist, Werten Sie die Größe des Geschosses zu bestimmen, das Volumen der RNase-freies Wasser verwendet, um die RNA zu solubilisieren. Notieren Sie sich das Volumen (10 bis 25 µL) für jede Probe.
Hinweis: Dieser Schritt ist nur qualitative. Wenn RNA Pellet nicht sichtbar sind, fügen Sie 10 µL RNA-freies Wasser zur Probe. - Jede Probe (vorgegebene Volumen bei Schritt 3.24) 10-25 µL RNase-freies Wasser hinzufügen.
- Inkubation der Probe 5 min in einem Hitze-Block gesetzt bei 60 ° C. Kurz Wirbel der Rohre.
- Inkubation der Probe für eine zusätzliche 5 min in der gleichen Heizblock bei 60 ° C.
- Quick-Spin alle Proben in einer Mini-Zentrifuge drehen und sofort auf Eis gelegt.
- Bestimmen Sie die RNA-Konzentration und Reinheit. Führen Sie reversen Transkription (RT) cDNA abrufen oder Speichern von Proben in einem-80 ° C Gefrierschrank für die spätere Verwendung.
Hinweis: Vermeiden Sie mehrere Frost/Tau-Zyklen, wie dies verschlechtert sich RNA-Proben.
4. Bestimmung des Fettgewebes RNA-Konzentration und Reinheit
- Ob Fettgewebe RNA-Proben wurden frisch extrahiert und solubilisiert oder in einem-80 ° C Gefrierschrank vorgespeichert, sammeln Sie alle Proben zu und es ermöglichen Sie ihnen, bis zum Beginn des Verfahrens auf Eis auftauen. Dies sollte kurz vor dem Start des nächsten Schritts oder am Ende der Isolation, mehrere Frost/Tau-Zyklen zu vermeiden.
- Vorbereitung und zwei Sätze von RNase-freie 1,5 mL konische Röhrchen zu identifizieren und steckte sie in ein Rohr-Rack.
- Wenn alles, was die RNA-Proben sind vollständig aufgetaut, Wirbel eine Probe für 1 s und legte zurück auf dem Eis.
- Verdünnte Ihre RNA 100-fold in 1 X TE Lösung im ersten Satz der RNase-freie 1,5 mL konische Röhrchen mit gefiltert RNase-freie Tipps (99 µL 1 X TE Lösung und 1 µL RNA auf das Rohr setzen).
- Wiederholen Sie für jede Probe.
Hinweis: Die Bände können unterschiedlich für jede Spektralphotometer abhängig von der Küvette verwendet sein. - Sobald alle Proben bearbeitet werden, verdünnt Wirbel jeder Probe.
- Folgen Sie das Protokoll des Spektralphotometers um das Gerät zu kalibrieren, indem mit einem leeren (1 X TE) vor der Verarbeitung der verdünnten RNA-Proben.
- Übertragen der verdünnten RNA-Proben auf die Quarz-Küvetten und bestimmen die Konzentration von jeder Probe bei 260 nm.
Hinweis: Wenn das Spektralphotometer nicht die Endkonzentration RNA bereitstellt, verwenden Sie diese Formel um zu berechnen: RNA (µg/µL) = OD260 x Verdünnungsfaktor x (40 µg RNA/1 000 µL). - Bestimmen Sie die RNA-Reinheit jeder Probe durch Berechnung der Ratio OD260/OD280.
Hinweis: Eine Verhältnis OD260/OD280 um 2.0 gilt im Allgemeinen als reine RNA-12. Es wird dringend empfohlen, dass die RNA-Qualität überprüft wird. Um dies zu tun, legen Sie 1 µg RNA auf einem 1 % Bleichmittel Agarosegel mit 1 X TBE-Puffer (89 mM Tris-Base, Borsäure 89 mM und 2 mM EDTA, pH 8,0) gemacht und 1 % Chlorid Lösung13 (Abbildung 3). RNA von sehr guter Qualität zeigt 28 s und 18 s rRNA-Bänder und die 28 s-Band sollte intensiver als die 18-jährige. RNS-Qualität ist akzeptabel, wenn beide rRNA-Bands mit einer ähnlichen Intensität sichtbar sind. RNS-Qualität wird im Moment ist die 18-Band intensiver als die 28 s-Band, und wenn ein Abstrich ist sichtbar, bezeichnend für RNA-Abbau mangelhaft. - Bereiten Sie für jede Probe 10 µL 0,5 µg/µL RNA aus dem Bestand im zweiten Satz der RNase-freie 1,5 mL konische Röhrchen mit RNase-freies Wasser, um die Proben zu verdünnen, je nach Bedarf. Diese Beispiele dienen zur RT cDNA zu erhalten.
- Sobald alle Proben bearbeitet sind, beginnen Sie RT oder speichern Sie Proben in einem-80 ° C Gefrierschrank für die spätere Verwendung zu.
(5) Reverse Transkription (RT)
- Ob Fettgewebe RNA-Proben wurden frisch bis 0,5 µg/µL verdünnt oder in einem-80 ° C Gefrierschrank vorgespeichert, sammeln Sie alle Proben und Reagenzien und es ermöglichen Sie ihnen, bis zum Beginn des Verfahrens auf Eis auftauen.
- Die PCR-Röhrchen Streifen Rack auf Eis gelegt. Einmal kalt genug vorbereiten und identifizieren einen Satz von RNase-freie PCR-Röhrchen Streifen und legte sie auf die Zahnstange. Enthalten Sie ein Leerzeichen.
- Bereiten Sie die Reaktion für DNase-Behandlung der RNA: machen einen master-Mix (für die benötigte Menge der Probe + 1 Probe) der folgenden (Mengen für 1 Exemplar): 1 µL 10 X Reaktion Puffer mit MgCl2, 0,5 µL DNase I (1 U/µl) und 7,5 µL RNase-freies Wasser verwenden gefiltert-Tipps. 9 µL in jedem Röhrchen zu verzichten.
- Das entsprechende Rohr, setzen Sie die Kappen auf jedem Streifen und Quick-Spin alle Streifen in einem Mini Spin Zentrifugieren bringen die Probe auf den Boden des Röhrchens fügen Sie 1 µL 0,5 µg/µL RNA aus jeder Probe hinzu. Fügen Sie 1 µL RNA-freies Wasser für den Rohling.
- Inkubieren Sie alle Röhrchen Streifen in einem Thermocycler oder einem Heizblock bei 37 ° C für 30 min. in der Röhre Streifen das Gestell auf dem Eis wieder anziehen.
- Jedes Rohr 1 µL EDTA (50 mM) hinzu und inkubieren Sie alle Röhrchen Streifen in einem Thermocycler oder einem Heizblock bei 65 ° C für 10 min. den Rohr-Streifen das Gestell auf dem Eis wieder anziehen.
- Machen Sie einen master-Mix (für die erforderliche Anzahl von Proben plus 1 Probe) der folgenden (Mengen für 1 Exemplar): 1 µL zufällige Hexamers (0,2 µg/µL) und 1 µL dNTP-Mix (enthält jedes der vier Deoxynucleotides in einer Konzentration von 10 mM). 2 µL des master-Mix in jedem Röhrchen mit gefiltert-Tipps zu verzichten. Wechseln Sie zwischen Proben.
- Inkubieren Sie alle Röhrchen Streifen in einem Thermocycler oder einem Heizblock bei 65 ° C für 5 min., setzen Sie den Schlauch Streifen wieder in das Rack auf Eis.
- Machen Sie einen master-Mix (für die erforderliche Anzahl von Proben plus 1 Probe) der folgenden (Mengen für 1 Exemplar): 4 µL 5 x RT Puffer, 1 µL RNase-Inhibitor (20 U/µL), 0,25 µL Reverse Transkriptase (200 U/µL) und 1,75 µL Nuklease-freies Wasser. 7 µL in jedem Röhrchen mit gefilterten Tipps zu verzichten. Wechseln Sie zwischen Proben.
- RT in einem Thermocycler durchführen, indem Sie das folgende Programm einstellen: 10 min bei 25 ° C, 30 min bei 50 ° C, 5 min bei 85 ° C. Setzen Sie die Röhre Streifen zurück auf dem Gestell auf Eis.
- Vorbereiten und identifizieren einen Satz von RNase-freie PCR Schlauch Streifen und legte sie auf dem Gestell.
- Bereiten Sie die gewünschte Lautstärke von 1:5 verdünnt cDNA aus dem Lager in die neue Röhre Streifen mit Reinstwasser für jede Probe. 1:5 verdünnt cDNA Proben werden für Real-Time PCR verwendet werden.
- Sobald alle Proben bearbeitet sind, beginnen Sie Echtzeit-PCR oder speichern Sie Proben (Lager und verdünnten Proben) in einer Tiefkühltruhe-20 ° C für die spätere Verwendung zu.
(6) Real-Time PCR für die Genexpression im Fettgewebe
Hinweis: Aussetzen Sie der Fluoreszenzfarbstoff ans Licht. Das Protokoll unten beschreibt die Verstärkung der Referenz gen s1614. Das gen des Interesses sollte die Primer und die PCR-Bedingungen angepasst werden.
- Ob frisch cDNA Proben waren verdünnt 1:5 oder vorab in einem Gefrierschrank-20 ° C gelagert, sammeln Sie alle Proben und Reagenzien und es ihnen ermöglichen, bis zum Beginn des Verfahrens auf Eis auftauen.
- Der Ständer für Real-Time PCR-Röhrchen Streifen auf Eis gelegt. Einmal kalt genug vorbereiten und identifiziert eine Reihe von Echtzeit-PCR-Röhrchen Streifen und legte sie auf das Rack. Bereiten Sie jede Probe und der Rohling in zweifacher Ausfertigung.
- Machen Sie einen master-Mix (für die erforderliche Anzahl von Proben plus 1 Probe) der folgenden (Mengen für 1 Exemplar): 1,9 µL Reinstwasser, 5 µL Fluoreszenzfarbstoff (z. B. SYBR green) und 0,3 µL forward Primer und 0,3 µL der rückwärts-Primer. 7.5 µL in jedem Röhrchen zu verzichten.
- Das entsprechende Rohr 2,5 µL 1:5 verdünnt cDNA von jeder Probe hinzufügen. Fügen Sie 2,5 µL Reinstwasser für die Rohlinge. Setzen Sie die Kappen auf jedem Streifen.
- Folgen Sie den Anweisungen des Herstellers zum Einrichten des folgenden Programms auf der Real-Time PCR: 10 min bei 95 ° C und 40 Zyklen von 15 s bei 50 ° C, 30 s bei 60 ° C, 30 s bei 70 ° C. Legen Sie die Probe Streifen in den Rotor der Real-Time PCR-Maschine und starten Sie das Programm.
Hinweis: Thermocycler Bedingungen variieren je nach den Apparat verwendet und das gen des Interesses. mRNA Ausdrucksergebnisse in Abbildung 3 zeigen Leptin mRNA Verstärkung durch das Referenz-gen S16 mRNA Verstärkung14,15normiert.
Ergebnisse
Nach der Autopsie Prozedur wurden drei weißen Fettgewebe gesammelt und aus den zwei Gruppen von Mäusen (N und HF Diät gefüttert Mäuse) gewichtet. Wie erwartet, stieg Mäuse auf der HF-Diät endgültige Körpergewicht und Gewichtszunahme im Vergleich zu Wurfgeschwistern N Diät (Tabelle 1). Diese Beobachtungen wurden begleitet von mehr als eine 2-fache Erhöhung des Gewichts der SCF, PGF und PRF bei fettleibigen Mäusen im Vergleich zu den N-Diät.
Vor der Durchführung keine Experimente mit der isolierten RNA, wurde seine Reinheit bewertet, wie unter Punkt 4.9 beschrieben. Für jeden weißen Fettgewebe produziert RNA Isolierung von Phenol-Lösung Proben mit ausreichender Qualität als das Verhältnis war OD260/OD280 etwa 2,0 als reine RNA (Tabelle 2) gilt. Echtzeit-PCR-Daten zeigten, dass Leptin mRNA Expression in PGF, PRF und SCF von fettleibigen Mäusen im Vergleich zu den N-Diät (Abb. 4A) deutlich erhöht wurde. In der Tat waren die Unterschiede im Leptin mRNA Ausdruck nicht durch eine Variation der s16, das Referenz-gen verwendet, um die Ergebnisse zwischen den beiden Gruppen von Mäusen zu normalisieren, wie Ct-Werte nicht verändert wurden (Abbildung 4B). So können s16 zuverlässig einsetzbar als Referenz-gen für die mRNA Expression in PGF, PRF und SCF bei HF-Diät ein Parameter in einem Studienprotokoll ist.
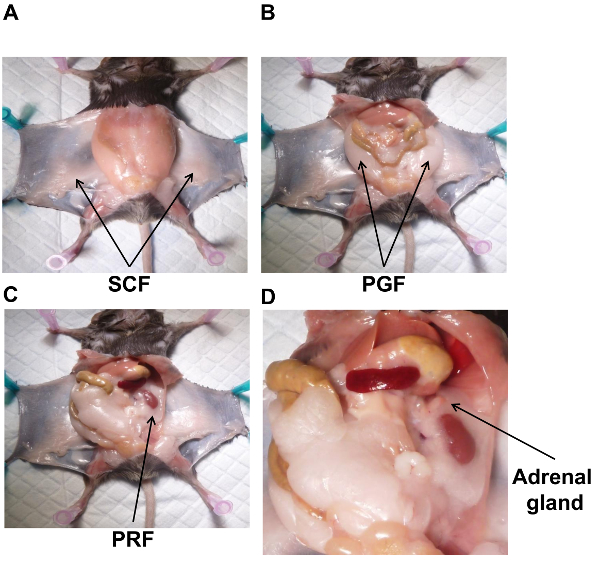
Abbildung 1 . Anatomische Lokalisation des weißen Fettgewebes an Mäusen. Eine männliche Maus N Diät hat seziert, um die Lokalisierung der einzelnen Fettgewebe Depot und Nebennieren zu zeigen. SCF (A), PGF (B), PRF (C) und Nebenniere (D). PGF, Peri-Gonaden Fett; PRF, Peri-renal Fett; SCF, subkutane Bauchfett. Bitte klicken Sie hier für eine größere Version dieser Figur.
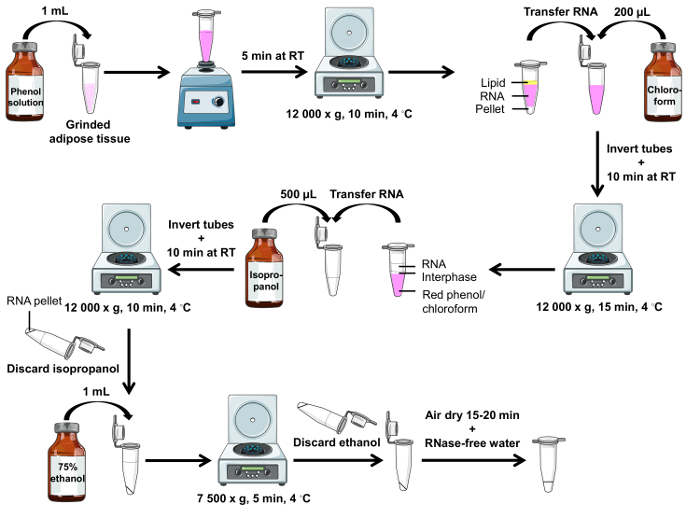
Abbildung 2 . RNA Isolation Protokoll Flussdiagramm mit Phenol Lösung. Schematische Darstellung der erforderlichen Schritte, um RNA von geerdeten weißen Fettgewebe zu isolieren. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 . RNA-Qualitätsbewertung auf Bleichmittel-Gel. 1 Ug RNA isoliert von subkutanen Fettgewebes (SCF) und Peri-Gonaden Fett (PGF) ist auf einer 1 % Agarosegel Bleichmittel durch Elektrophorese getrennt. 28 s und 18 s rRNA werden durch UV-Durchleuchtung visualisiert. Gel sind RNA isoliert vom SCF und PGF einer Maus eine normale Diät ernährt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 . Wirkung von HF-Diät auf Leptin und s16 mRNA Expression im weißen Fettgewebe. Leptin (A) und s16 (B) mRNA Ausdruck. Daten für Leptin sind normiert auf s16 mRNA-Niveaus, während Daten für s16 als Ct Wert dargestellt werden und sowohl als Mittelwert ± SE mit n = 12-13 pro Gruppe. * p < 0,05 im Vergleich zu N-Diät. N, normal; HF, fettreiche; PGF, Peri-Gonaden Fett; PRF, Peri-renal Fett; SCF, subkutane Bauchfett. Diese Zahl verändert wurde, von Tan, p. Et Al, Adipositas (2014) 22, 2201-2209. Bitte klicken Sie hier für eine größere Version dieser Figur.
| N-Diät | HF-Diät | |
| Endgültigen Körpergewicht (g) | 37,5 ± 1,3 | 46.7 ± 1.7* |
| Gewichtszunahme (g) | 6,6 ± 0,7 | 16,7 ± 1.0* |
| PGF (g) | 1,08 ± 0,17 | 2.19 ± 0.15* |
| PRF (g) | 0,79 ± 0.15 | 1.71 ± 0.06 |
| SCF (g) | 1,62 ± 0,35 | 3,55 ± 0.20* |
Tabelle 1. Wirkung von HF-Diät auf Körper und weißen Fettgewebe Gewichte. Werte werden ausgedrückt als Mittel ± SE mit n = 14-15 pro Gruppe. * p < 0,05 im Vergleich zu N-Diät. N, normal; HF, fettreiche; PGF, Peri-Gonaden Fett; PRF, Peri-renal Fett; SCF, subkutane Bauchfett. Diese Zahl verändert wurde, von Tan, p. Et Al, Adipositas (2014) 22, 2201-2209.
| Proben | Verhältnis OD260/OD280 |
| PGF 1 | 2.04 |
| PGF 2 | 2.04 |
| PGF 3 | 2.02 |
| PRF 1 | 1.95 |
| PRF 2 | 2.08 |
| PRF 3 | 2.08 |
| SCF 1 | 2.04 |
| SCF 2 | 2.02 |
| SCF 3 | 2.06 |
Tabelle 2: RNA-Reinheit nach Isolation von weißen Fettgewebe. n = 3 pro Fettgewebe. PGF, Peri-Gonaden Fett; PRF, Peri-renal Fett; SCF, subkutane Bauchfett.
Diskussion
Fettleibige Mäusen ergab folgenden HF-Diät ernähren, Körper und weißen Fettgewebe Gewichte im Vergleich zu Mäusen eine N-Diät gefüttert zugenommen haben. RNA mit Phenol Lösung ergab Proben mit guter Reinheit extrahiert. Leptin ist ein Adipokine produziert in erster Linie von Fettgewebe und positiv korrelieren mit fat mass16bekannt. Wie erwartet erhöht Leptin mRNA Ausdruck bei fettleibigen Mäusen in Tateinheit mit ihrer Fettmasse.
Diese Methode hat mehrere wichtige Schritte. Die große ist Verunreinigung von einem weißen Fettgewebe Depot mit einem anderen es ist bekannt, dass verschiedene Fettgewebe-Depots unterschiedliche Funktionen2,5 haben. Verunreinigungen kann irreführende Ergebnisse in downstream-Anwendungen bringen. Darüber hinaus als Fett neigt dazu, einmal in Kontakt mit Luft, weißen Fettgewebe eine regelmäßige und konsequente Tempo zwischen Mäuse sammeln trocknen ist empfehlenswert, wenn das Gewicht muss genommen werden. Andernfalls könnte das Gesamtgewicht von einem Fettpolster falsch sein. Um RNA von guter Qualität und Ertrag, nach der vor kurzem veröffentlichten MIQE Leitlinien ist eine Gewinn-17. Insbesondere kann sehr feine Probe Pulver beim Schleifen machen helfen Ertrag zu maximieren. Dies maximiert den Kontakt zwischen der Gewebe Pulver und Phenol-Lösung während RNA isoliert. Nicht zuletzt ist die Isolation der RNA-haltigen Schicht während die RNA-Isolierung (Schritt 3.12). Da Fett weniger dicht als Wasser ist, ist es am Anfang der Phase des Interesses positioniert. Minimierung der Verschleppung von Fett ist notwendig um Störungen mit downstream-Anwendungen zu verringern.
Eine Einschränkung dieser Methode ist die Fähigkeit erforderlich, um mehrere Schritte des Verfahrens sowie die Notwendigkeit, mit schädlichen Reagenzien während RNA Isolierung arbeiten durchführen. Darüber hinaus ist der gesamte Prozess arbeitsintensiv.
Es gibt nicht viele Alternativen, um die Methode der Fettgewebe Sammlung und Verarbeitung vor der RNA Isolierung abgesehen von Kleinigkeiten, die in der Regel vom jeweiligen Benutzer angepasst werden. Im Fall von RNA Isolierung gibt es viele Möglichkeiten wie das Phenol/Chloroform Extraktion oder RNA Isolierung Kits. Es gibt vor- und Nachteile für jede Option und es obliegt dem Benutzer, die beste Methode, basierend auf nachgelagerte Anwendungen auszuwählen. Phenol/Chloroform Extraktion ist weniger teuer, aber erfordert den Einsatz von schädlichen Reagenzien und ist mühsam. RNA-Isolierung-Kits sind in der Regel teurer, aber das Verfahren ist schneller und liefert in der Regel Proben mit guter Qualität und Reinheit. Es ist wichtig, den Ertrag und die Reinheit der RNA zu betrachten, da das Material im weißen Fettgewebe besteht, vor allem Fett begrenzt ist. Der große Vorteil bei der Verwendung von Phenol-Lösung für die Isolierung (Phenol/Chloroform Extraktion) besteht die Möglichkeit der Isolierung der RNA, DNA und Proteine aus einer einzigen Probe18. Dies ist kosteneffektiv und Zeit, da es die Anzahl der Mäuse erforderlich reduziert, um ausreichend Material zu erhalten. Wie bereits erwähnt, ist die Fettmasse in einige Mausmodelle begrenzt. Für diese Mäuse ist Spaltung Fettgewebe Boden in drei Teile getrennt RNA, DNA und Proteine zu erhalten nicht empfohlen, da dies zu nicht genügend Material für downstream-Anwendungen führen könnte. Um dieses Problem zu umgehen, ist es auch möglich zu bündeln ähnlich Fettgewebe Depot von mehreren Mäusen basierend auf benutzerdefinierten Kriterien führt zu einer erhöhten Anzahl von Tieren erforderlich.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde von Diabetes Kanada unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL seringes | |||
| 1X TE solution (10 mM Tris-HCl and 1 mM EDTA•Na2. pH 8.0) | |||
| 22 G needles | |||
| 26 G needles | |||
| 75% Ethanol | |||
| Block heater (dry bath) | |||
| Chloroform | Sigma | C2432-500mL | |
| dATP | Thermo scientific | R0141 | |
| dCTP | Thermo scientific | R0151 | |
| dGTP | Thermo scientific | R0161 | |
| DNase I (1 U/µl) | Thermo scientific | EN0521 | |
| dTTP | Thermo scientific | R0171 | |
| Faststart Universal SYBR green Master (Rox) | Roche | 4913922001 | |
| Faststart universal SYBR green master (Rox) fluorescent dye | Roche | 4913914001 | |
| Filtered tips | |||
| Forceps | Instrumentarium | HB275 | |
| Gauze | |||
| Hammer | |||
| High fat rodent diet | Bio-Serv, Frenchtown, NJ | F3282 | |
| Isopropanol | Laboratoire MAT | IH-0101 | |
| Leptin forward PCR primer (5’-GGGCTTCACCCCATTCTGA-3’) 10 uM | |||
| Leptin reverse PCR primer (5’-GGCTATCTGCAGCACATTTTG-3’) 10 uM | |||
| Liquid nitrogen | |||
| Maxima Reverse Transcriptase (enzyme and 5x buffer) | Thermo scientific | EP0742 | |
| Nanopure water (referred as ultrapure water) | |||
| Nitrile examination gloves | |||
| Nitrile gloves | |||
| Normal rodent diet | Harlan Laboratories, Madison, WI | Harlan 2018 | |
| P1000 pipetman | |||
| P2 pipetman | |||
| P20 pipetman | |||
| P200 pipetman | |||
| Phenol solution (TRIzol) | Ambion Life Technologies | 15598018 | |
| Pre-identified aluminium foil | |||
| Quartz spectrophotometer cuvette | |||
| Rack for PCR tube strips | |||
| Racks for RT-PCR tube strips | |||
| Random hexamers | Invitrogen | 58875 | |
| Real-time PCR Rotor Gene system | Corbett research | RG-3000 Rotor-Gene thermal cycler | |
| Refrigerated bench-top centrifuge | |||
| RiboLock RNase Inhibitor | Thermo scientific | EO0381 | |
| RNase-free 1.5 mL eppendorf tubes | |||
| RNase-free 1.5 mL screw cap tubes | |||
| RNase-free PCR tube strips (0.2 mL) and caps | |||
| RNase-free water | Hyclone | SH30538.02 | |
| RT-PCR machine | Qiagen | Rotor-Gene Corbett 3000 | |
| RT-PCR tube strips (0.1 mL) and caps | |||
| S16 forward PCR primer (5’-ATCTCAAAGGCCCTGGTAGC-3’) 10 uM | |||
| S16 reverse PCR primer (5’ ACAAAGGTAAACCCCGATCG-3’) 10 uM | |||
| Spectrophotometer | Biochrom | Ultrospec 3100 pro | |
| Stainless steel mortar and pestle | |||
| Surgical pads | Home made a foam board wrapped in a disposable absorbent underpad | ||
| Surgical scissors | Intrumentarium | 130.450.11 | |
| Thermal cycler | |||
| Thermal cycler | Biometra | Thermocycler | |
| Vortex mixer | |||
| Weighing spatula |
Referenzen
- Guh, D. P., et al. The incidence of co-morbidities related to obesity and overweight: a systematic review and meta-analysis. BMC. Public Health. 9, 88 (2009).
- Wronska, A., Kmiec, Z. Structural and biochemical characteristics of various white adipose tissue depots. Acta Physiol (Oxf). 205 (2), 194-208 (2012).
- Cannon, B., Nedergaard, J. Brown adipose tissue: function and physiological significance. Physiol Rev. 84 (1), 277-359 (2004).
- Holland, N. T., Smith, M. T., Eskenazi, B., Bastaki, M. Biological sample collection and processing for molecular epidemiological studies. Mutat Res. 543 (3), 217-234 (2003).
- Ibrahim, M. M. Subcutaneous and visceral adipose tissue: structural and functional differences. Obes Rev. 11 (1), 11-18 (2010).
- Mann, A., Thompson, A., Robbins, N., Blomkalns, A. L. Localization, identification, and excision of murine adipose depots. J Vis Exp. (94), (2014).
- Hemmrich, K., Denecke, B., Paul, N. E., Hoffmeister, D., Pallua, N. RNA Isolation from Adipose Tissue: An Optimized Procedure for High RNA Yield and Integrity. Laboratory Medicine. 41 (2), 104-106 (2010).
- Cirera, S. Highly efficient method for isolation of total RNA from adipose tissue. BMC Res Notes. 6, 472 (2013).
- Tan, S. C., Yiap, B. C. DNA, RNA, and protein extraction: the past and the present. J Biomed Biotechnol. 2009, 574398 (2009).
- Sellin Jeffries, M. K., Kiss, A. J., Smith, A. W., Oris, J. T. A comparison of commercially-available automated and manual extraction kits for the isolation of total RNA from small tissue samples. BMC Biotechnol. 14, 94 (2014).
- Tan, P., et al. Impact of the prorenin/renin receptor on the development of obesity and associated cardiometabolic risk factors. Obesity (Silver. Spring). 22 (10), 2201-2209 (2014).
- Taylor, S., Wakem, M., Dijkman, G., Alsarraj, M., Nguyen, M. A practical approach to RT-qPCR-Publishing data that conform to the MIQE guidelines. Methods. 50 (4), 1-5 (2010).
- Aranda, P. S., LaJoie, D. M., Jorcyk, C. L. Bleach gel: a simple agarose gel for analyzing RNA quality. Electrophoresis. 33 (2), 366-369 (2012).
- Mercure, C., Prescott, G., Lacombe, M. J., Silversides, D. W., Reudelhuber, T. L. Chronic increases in circulating prorenin are not associated with renal or cardiac pathologies. Hypertension. 53 (6), 1062-1069 (2009).
- Dusaulcy, R., et al. Adipose-specific disruption of autotaxin enhances nutritional fattening and reduces plasma lysophosphatidic acid. J. Lipid Res. 52 (6), 1247-1255 (2011).
- Nakamura, K., Fuster, J. J., Walsh, K. Adipokines: a link between obesity and cardiovascular disease. J Cardiol. 63 (4), 250-259 (2014).
- Taylor, S. C., Mrkusich, E. M. The state of RT-quantitative PCR: firsthand observations of implementation of minimum information for the publication of quantitative real-time PCR experiments (MIQE). J Mol Microbiol Biotechnol. 24 (1), 46-52 (2014).
- Hummon, A. B., Lim, S. R., Difilippantonio, M. J., Ried, T. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage. Biotechniques. 42 (4), 467-470 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten