Method Article
Coleção de tecido adiposo de mouse e processamento para análise de RNA
Neste Artigo
Resumo
O objetivo deste trabalho é apresentar um procedimento passo a passo para coletar os diferentes tecidos adiposo brancos de ratos, processar as amostras de gordura e extrair o RNA.
Resumo
Comparado a outros tecidos, tecido adiposo branco tem um teor consideravelmente menos RNA e proteína para aplicações a jusante, tais como a PCR em tempo real e Western Blot, desde que em sua maioria contém lipídios. Isolamento de RNA a partir de amostras de tecido adiposo é também um desafio como etapas adicionais são necessárias para evitar esses lipídios. Aqui, apresentamos um procedimento para coletar três anatomicamente diferentes brancos adiposo tecidos de ratos, para processar estas amostras e realizar o isolamento de RNA. Podemos descrever a síntese do cDNA e gene experimentos de expressão usando PCR em tempo real. O protocolo descrito por este meio permite a redução da contaminação de cabelo e sangue nas almofadas de gordura, bem como a contaminação cruzada entre diferentes almofadas de gordura durante a coleta de tecido do animal. Ele também foi otimizado para garantir adequada quantidade e qualidade do RNA extraído. Este protocolo pode ser amplamente aplicado a qualquer modelo de rato onde as amostras de tecido adiposo são necessárias para experimentos de rotina, tais como a PCR em tempo real, mas não deve ser isolada da cultura de células primárias de adipócitos.
Introdução
A obesidade é uma epidemia mundial que pode levar a complicações, tais como o tipo 2 diabetes1. Modelos animais induzida por dieta obesos e geneticamente modificados são frequentemente usados para investigação em obesidade e suas complicações associadas. Tradicionalmente, o tecido adiposo branco é conhecido como um compartimento de armazenamento para o excesso de energia e é principalmente composto de lipídios enquanto marrom tecido adiposo converte energia em calor2,3. Tecido adiposo é dinâmico e irá expandir e encolher dependendo de vários fatores tais como a ingestão de alimentos e atividade física. Portanto, para determinar os fatores que contribuem para essas alterações, manipulação e coleta adequada de tecido adiposo são necessários4.
Entre os brancos os tecidos adiposos, é geralmente aceite que os depósitos de gordura subcutâneos e viscerais possuem diferentes propriedades como localização anatômica e função2,5. Por conseguinte, para evitar resultados conflitantes ou grande variabilidade, atenção deve ser tomado para evitar a contaminação cruzada entre estes depósitos de gordura diferentes quando coletando almofadas de gordura.
Além disso, existem três grandes desafios quando isolando RNA ou proteína do tecido adiposo de ratos brancos. Primeiro, coletar almofadas de gordura em ratos obesos não é uma tarefa fácil como a fronteira que separa diferentes depósitos de gordura brancos nem sempre é clara, em contraste com outros órgãos como rins e coração6. Em segundo lugar, por causa do alto teor lipídico do tecido adiposo, durante o isolamento do RNA ou proteína, uma camada de lipídios flutua no topo e impede o acesso direto à amostra. Em terceiro lugar, em vez de marrom tecido adiposo ou outros tecidos, tecido adiposo branco tem consideravelmente mais baixo conteúdo de RNA e proteína e isso é de grande preocupação quando usando ratos jovens, ratos alimentados com uma dieta normal de (N) e ratos que deverão tem baixas gordura massas (ou seja, KO modelos, tratamento com medicamentos, exercem, treinamento, etc.) 7 , 8.
Portanto, escolher o método apropriado para isolar o RNA do tecido adiposo é crítico. Métodos alternativos para extração fenol/clorofórmio são jogos comerciais. Eles normalmente são baseados em uma etapa de extração do fenol inicial, seguida de purificação de RNA em uma coluna de9. No entanto, esses kits são tipicamente mais caros e dar amostras de rendimento mais baixo, enquanto a qualidade do RNA pode ser variável mas são menos demorados. No entanto, uma das maiores vantagens para extração de solução/clorofórmio fenol descrito aqui é a possibilidade de isolar o DNA, RNA e proteína de uma única amostra10. Desde almofadas de gordura de ratos são geralmente pequenas e dar uma quantidade pequena de RNA e proteínas (especialmente em modelos do rato magra), estes protocolos maximizam os dados um pode tirar uma pequena amostra.
O objetivo deste trabalho é descrever detalhadamente um método para garantir a coleta de amostra adequada de depósitos de tecido adiposo branco três ratos, bem como a quantidade e a qualidade da isolação do RNA. RNA obtido seguindo este protocolo pode ser usado para realizar ensaios PCR em tempo real. Este protocolo não se destina para isolamento de RNA de adipócitos primários culturas.
Protocolo
Cuidados dos ratos usados nos procedimentos respeitadas as normas para o cuidado e o uso de animais experimentais, fixado pelo Conselho canadense para a protecção dos animais. Todos os procedimentos foram aprovados pelo Comitê de uso no centro de pesquisa de CHUM e cuidado do Animal de universidade.
1. necropsia e coleta de tecido adiposo de ratos masculinos
- Fazer grupos experimentais, de acordo com os objectivos do estudo. Neste estudo, as amostras foram coletadas de dois grupos de camundongos machos em um fundo de C57Bl/6 (n = 12-14/grupo). Certifique-se que os ratos usados aqui são 12-15 semanas de idade e são mantidos no ciclo claro/escuro de 12-h com acesso a normal (N) ou dieta hiperlipídica (HF) e água ad libitum , durante um período de 10 semanas11.
- Eutanásia em um mouse, colocando o mouse em uma câmara selada, onde ele é exposto para 6% CO2 durante 10 min.
- Realizar punção cardíaca lentamente inserindo uma seringa de 1 mL, montada com agulha 26G 1/2po apenas à esquerda do esterno do animal e puxar lentamente o êmbolo, para remover a maioria do sangue do animal. Certifique-se que a seringa está paralela ao corpo do animal. Gire a seringa lentamente enquanto puxa o pistão se sangue não vem para a seringa.
Nota: Punção cardíaca bem sucedida (entre 0,8 e volume de 1 mL de sangue) irá diminuir a contaminação do tecido adiposo com sangue. - Coloque os ratos em suas costas e pin cada pata na almofada usando agulhas 22G, conforme mostrado na Figura 1.
- Com uma gaze, esfregue a pele do mouse com álcool várias vezes a partir do pescoço até os órgãos genitais, seguindo um movimento unidirecional, como isso garante que o cabelo permanece plano e reduz a contaminação do cabelo de amostras de tecido adiposo sem depilação.
- Usando limpa mas não esterilizado fórceps e a tesoura cirúrgica, elevar a pele central perto de órgãos genitais e faça uma incisão pequena 0,3 mm.
- Insira a tesoura na horizontal no orifício aberto e separe a pele abdominal da parede abdominal.
Nota: Isso é feito por dissecção romba no espaço entre a pele e a parede abdominal e não cortando as membranas encontradas neste espaço. - Usando a pinça, elevar a pele central perto do furo aberto e cortar a pele sobre o linea alba até que você esteja perto da caixa torácica (~ 4 cm dependendo do tamanho do mouse).
Nota: Evite cortar o músculo abdominal, como isso pode expor o tecido adiposo visceral para o ar e levar a secagem das almofadas do gordo que podem alterar a integridade do seu conteúdo e o tecido. - Do meio da caixa torácica, corte a pele para o braço direito em ~ 2 cm. De perto os órgãos genitais, corta a pele acima do membro hind direito em ~ 2 cm.
- Esticar um canto da pele aberta e fixá-lo na almofada usando uma agulha 22g. Repita com o outro canto.
Nota: O tecido adiposo exposto na pele é a gordura subcutânea abdominal (SCF) (Figura 1A). - Recolha o CCAH por dissecação romba e cortá-lo da pele usando uma tesoura cirúrgica posicionada tão liso quanto possível contra a pele. Uma vez recolhidos, ponha a folha de alumínio pré-identificadas CCAH.
Nota: Coletando ou contaminar o tecido adiposo com pele ou cabelo irá alterar amostra de qualidade e rendimento do RNA devido a RNases. Se muito tempo é gasto a coletar o tecido adiposo, a amostra também pode secar que também pode alterar a qualidade da amostra. - Repita as etapas de 1,9 para 1,11 no lado esquerdo do animal. Piscina à esquerda e direita gordas almofadas no papel de alumínio e congelar a amostra em nitrogênio líquido.
- Para obter acesso ao tecido adiposo visceral, cortar o músculo abdominal, usando uma tesoura cirúrgica limpa mas não estéril e a pinça ao longo da linea alba, em ~ 4 cm, dependendo do tamanho do mouse, desde os órgãos genitais para a caixa torácica. Em seguida, fazer uma incisão dos músculos abdominais de órgãos genitais em direção à traseira do mouse em ~2.5 cm para ter acesso ao lado dos órgãos abdominais.
- A gordura ao redor dos órgãos reprodutores é a gordura peri-gonadal (PGF) (Figura 1B). Como PGF é anexado para o epidídimo, do testículo e o ducto deferente, Retire cuidadosamente o esquerda do tecido dessas estruturas e coloque a folha de alumínio pré-identificadas. Repita para o lado direito. Uma vez que os dois PGFs são coletados, congele a amostra em nitrogênio líquido.
- A partir do lado esquerdo, expor os rins, afastar-se do intestino na cavidade abdominal do lado direito. O tecido adiposo em torno do rim é a gordura peri-renal (PRF) (Figura 1C). PRF também envolve as glândulas adrenais (Figura 1D).
- Isolar e remover as glândulas adrenais antes de coletar a PRF. Isto pode ser tedioso, como eles são apenas um pouco mais rosados que o tecido adiposo.
Nota: Os rins não devem ser removidos durante esta etapa como sangue pode contaminar o tecido adiposo e torná-lo mais difícil de identificar as glândulas adrenais dentro desta almofada gorda. - Isole a PRF da parede muscular volta, terminando por um corte do ureter, a artéria renal e veia que separa a PRF e o rim do resto do corpo. Isole a PRF do rim por corte e remoção da cápsula renal. A PRF permanece anexado para a cápsula.
- Repita as etapas de 1,15 e 1.17 para o lado direito. Colocar ambos os PRF no papel alumínio e congelar a amostra em nitrogénio líquido.
- Repita o procedimento de passos 1.2 para 1,18 para todos os ratos para ser coletado.
- Neste ponto, proceder com tecido adiposo moagem ou armazenar as amostras em um freezer-80 ° C para posterior extração. As amostras podem ser armazenadas estàvel a-80 ° C durante vários anos4.
2. preparação do solo branco tecido adiposo para isolamento de RNA
Nota: Use luvas para cada etapa como pele contém RNases que pode promover a degradação de RNA e como tal, altera a qualidade da amostra e o rendimento do RNA após o isolamento.
- Preparar e identificar três RNase-livre 1,5 mL tampa de rosca cônica tubos por rato, um para cada tipo de tecido adiposo branco e colocá-los em um rack.
Nota: Animais obesos podem exigir tubos adicionais como eles aumentaram a massa gorda. Isto é particularmente verdadeiro para SCF para os quais até 7 tubos para um rato foi obtido. - Limpar o banco com 70% de etanol e colocar um papel limpo e novo banco na superfície.
- Se os tecidos adiposos foram recentemente colhidos ratos ou previamente armazenadas em um freezer-80 ° C, reunir todas as amostras em um recipiente de nitrogênio líquido até o início do procedimento.
- Congele a espátula, pilão e almofariz, colocando-os no recipiente de nitrogênio líquido. Quando o nitrogênio líquido para a 'ferver ', moagem de tecido adiposo pode ser iniciado.
Nota: Nesta etapa, a argamassa, espátula, tubo cônico e tecido adiposo precisam ficar refrigeradas durante todo o processo. Qualquer calor vai derreter o tecido adiposo e torná-lo mais difícil de extrair o RNA. Também, se usando um pilão cerâmica, um pode usar gelo seco ou nitrogênio líquido para mantê-lo frio. - Coloque todos os livre de RNase 1,5 mL tampa de rosca cônica tubos preparados no passo 2.2 em gelo seco para esfriar.
- Para evitar gangrena nas mãos, use algumas camadas de papel pardo para levantar a argamassa de nitrogênio líquido e colocá-lo em uma bancada de trabalho.
- Use a pinça para coletar uma amostra de tecido adiposo de nitrogênio líquido e colocá-lo no almofariz. Rapidamente desembrulhar a folha de alumínio e deixar a amostra no centro do almofariz.
Nota: Se a amostra de tecido adiposo é muito grande, como é o caso com ratos obesos, quebrar as amostras em partes menores na folha de alumínio usando os polegares e pulverizar cada parte separadamente. - Use algumas camadas de papel pardo para levantar o pilão de nitrogênio líquido e encaixe-a argamassa. Mantendo o pilão com papéis marrons, use o martelo para tentar acertar o pilão uma vez ou duas vezes. Pressione o pilão contra a argamassa com rotação movimentos para moer a amostra até à obtenção de um pó fino.
Nota: Esta etapa é fundamental para obter o adequado isolamento do RNA. Com efeito, a presença de fragmentos maiores impedirá a isolação do RNA e reduzir a safra. - Uma vez obtido um pó fino, remover o pilão e buscar a espátula de nitrogênio líquido e usá-lo para transferir a amostra para o tubo cónico de pre-refrigerados 1,5 mL correspondente.
Nota: Mergulhe a espátula volta no nitrogênio líquido de vez em quando para evitar que a amostra de derretimento. Além disso, manter o tubo cônico em gelo seco sempre para impedir que a amostra de descongelamento. Um tubo cônico cheio de amostra de solo com capacidade de cerca de 2/3 (~ 1 mL) é necessário para o rendimento do RNA e a quantidade adequada. - Uma vez preenchido a cerca de 1 mL, fechar o tubo e deixá-los o outro recipiente líquido nitrogênio.
Nota: Amostras em excesso podem ser colocadas em separado pre-refrigerados RNase-livre 1,5 mL cônicos tubos e armazenadas em um freezer-80 ° C para uso posterior. - Limpe o almofariz, pilão e espátula com papéis marrons para evitar transitar para a próxima amostra de tecido adiposo. Pô pilão e espátula no nitrogênio líquido para relaxar. Apesar do papel marrom não RNase-livre, nós usamos um recém inaugurado maço de papel pardo para cada dia da isolação do RNA.
- Repita as etapas de 2.4 para 2.11 com a próxima amostra.
- Uma vez que todas as amostras são processadas, começar a isolação do RNA ou armazenar as amostras em um freezer-80 ° C para uso posterior.
Nota: Para impedir que os tubos estourando, congele uma caixa de amostra submergindo completamente dentro do recipiente de nitrogênio líquido. Quando arrefecer, basta remover o nitrogênio adicional da caixa e deixe ele flutuar por cima do nitrogênio líquido. Classificar as amostras em caixa e colocá-lo em um freezer-80 ° C.
3. o RNA isolado do tecido adiposo de chão
Atenção: Solução de fenol é prejudicial à pele. Vestir um jaleco, luvas, óculos de segurança e executar o procedimento sob uma capa de química. Um fluxograma passo a passo é mostrado na Figura 2.
- Preparar e identificar os dois conjuntos de tubos cônicos de 1,5 mL RNase-livre e colocá-los em um rack.
- Se os tecidos adiposos foram recentemente à terra ou previamente armazenados em um freezer-80 ° C, reunir todas as amostras em um contêiner de nitrogênio líquido até o início do procedimento que é feito, principalmente, à temperatura ambiente.
- Use fórceps para selecionar uma amostra de tecido adiposo de solo o nitrogênio líquido e colocá-lo em uma cremalheira do tubo. Os tubos devem conter ~ 1 mL de pó, o que corresponde a cerca de 100 mg de pó de tecido.
- Abra lentamente o tubo.
Nota: Deixando um tubo fechado à temperatura ambiente ou abrindo a tampa do tubo muito rapidamente pode levar a perda de amostra ou lesão como pressão de nitrogênio tende a escapar do tubo. - Adicionar 500 µ l de solução de fenol a amostra (proporção de 1:2 da solução de fenol: pó de tecido).
- Feche a tampa do tubo e vórtice na velocidade máxima por cerca de 5 s. lentamente e abra cuidadosamente o tubo para liberar a pressão do nitrogênio (um som do ar que sai do tubo pode ser ouvido).
- Repita os passos de 3.5 e 3.6. O volume de solução de fenol final adicionado à amostra é de 1 mL.
- Repita a etapa 3.6 até que a amostra é completamente dissolvida.
Nota: É importante que toda a pressão do tubo de lançamento antes de prosseguir, ainda mais, para evitar que o tubo estourando. - Deixe a amostra em temperatura ambiente ao repetir passos 3,4 para 3,8 para as amostras próximo.
- Uma vez que todas as amostras são processadas, brevemente vórtice na velocidade máxima e incubar todas as amostras de 5 min à temperatura ambiente.
- Centrifugar 10 min a 12 000 x g a 4 ° C. Trazer os tubos volta à temperatura ambiente.
Nota: Após a centrifugação, 3 fases estão presentes, como mostrado na Figura 2: gordura (topo), RNA (médio) e da pelota (parte inferior). - Para cada amostra, transferi tanto RNA (camada média rosa) possível para o primeiro conjunto de tubos correspondentes com uma pipeta P1000 usando uma dica filtrada. Trocar dicas entre amostras.
- Para garantir a mínima contaminação do RNA (camada média) pelo lipídico (camada superior), pierce a fase superior com a ponta perto do lado do tubo. Dispense o RNA nos novos tubos cónicos sem tocar os lados do tubo novo para evitar transferência de lipídios que podem ser do lado de fora da ponta.
- Adicionar 200 µ l de clorofórmio puro para cada amostra e misture por inversão durante 15 s. Incube 10 minutos à temperatura ambiente.
- Centrifugue a 15 min a 12 000 x g a 4 ° C e trazer os tubos volta à temperatura ambiente.
Nota: Após a centrifugação, 3 fases estão presentes: RNA (topo), interfase que contém DNA (médio) e vermelho fenol-clorofórmio que contém proteínas (em baixo). - Para cada amostra, transferi como muito transparente contendo RNA fase aquosa (fase superior) quanto possível para o segundo conjunto de tubos correspondentes cónicos com uma pipeta P1000 usando filtrada-dicas. Trocar dicas entre cada amostra.
Nota: A interfase é frágil e pode contaminar a fase superior se aspiração é feita muito rapidamente. Como alternativa, use uma pipeta P200 para reduzir as chances de perturbar a interfase. - Adicionar 500 µ l de isopropanol 100% para cada amostra e misture por inversão por 15 seg.
- Incube 10 min à temperatura ambiente
- Centrifugar 10 min a 12 000 x g a 4 ° C e trazer os tubos volta à temperatura ambiente. Descarte o isopropanol invertendo cada tubo.
Nota: Um pequeno sedimento branco de RNA geralmente pode ser visto, mas na ocasião não pode. - Adicione 1 mL de etanol a 75% (preparada a partir de 100% de etanol e água livre de RNase) para cada amostra e brevemente vórtice cada tubo na velocidade máxima.
- Centrifugar 5min a 7 500 x g a 4 ° C e trazer os tubos volta à temperatura ambiente.
- Descartar o etanol 75% invertendo cada tubo e bata levemente contra um papel marrom para remover qualquer resquício.
Nota: Se necessário, use uma ponta filtrada para remover álcool perto a pelota do RNA. Dica de mudança entre as amostras. - Deixe a tampa aberta e o ar seco a pelota do RNA por cerca de 15-20 min.
Nota: Pelotas de RNA podem se tornar translúcidas durante esta etapa. - Como a solubilização de RNA da pelota é dependente do tamanho, avalie o tamanho da pelota para determinar o volume de água livre de RNase a ser usado para solubilizar o RNA. Anote o volume (10 a 25 µ l) para cada amostra.
Nota: Este passo é meramente qualitativo. Se não pode ser vista a pelota do RNA, adicione 10 µ l de água livre de RNA para a amostra. - Adicione 10-25 µ l de água livre de RNase para cada amostra (volume pré-determinado no passo 3.24).
- Incubar a amostra 5 min em um bloco de calor definido a 60 ° C. Vórtice brevemente os tubos.
- Incubar a amostra para um adicional 5 min no mesmo bloco calor a 60 ° C.
- Rápido-girar todas as amostras em um mini spin centrífuga e coloque imediatamente no gelo.
- Determine a concentração de RNA e a pureza. Execute a transcrição reversa (RT) para obter o cDNA ou armazenar as amostras em um freezer-80 ° C para uso posterior.
Nota: Evite múltiplos ciclos de congelamento/descongelamento pois isso degrada amostras do RNA.
4. a determinação da concentração de tecido adiposo RNA e pureza
- Amostras de tecido adiposo RNA recém foram extraídas e solubilizadas ou pre-armazenadas em um freezer-80 ° C, reunir todas as amostras e permitir-lhes a descongelar no gelo até o início do procedimento. Isso deve ser feito antes do início da etapa seguinte, ou no final do isolamento para evitar vários ciclos de congelamento/descongelamento.
- Preparar e identificar os dois conjuntos de tubos cônicos de 1,5 mL RNase-livre e colocá-los em uma cremalheira do tubo.
- Quando todas as amostras de RNA são totalmente descongelado, vórtice uma amostra para 1 s e colocar de volta no gelo.
- Diluir a solução de TE seu RNA 100 vezes em 1 x no primeiro conjunto de RNase-livre 1,5 mL cônicos tubos usando filtrada dicas RNase-livre (colocar 99 µ l da solução de TE 1 x e 1 µ l de RNA ao tubo).
- Repita para cada amostra.
Nota: Os volumes podem ser diferentes para cada espectrofotômetro dependendo a cubeta do usado. - Uma vez que todas as amostras são processadas, o vórtice cada diluído amostra.
- Siga o protocolo do espectrofotómetro para calibrar o instrumento usando um espaço em branco (1 x TE) antes de processar as amostras diluídas do RNA.
- As amostras diluídas do RNA de transferência para a cubeta de quartzo e determinar a concentração de cada amostra em 260 nm.
Nota: Se o espectrofotômetro não fornece a concentração final de RNA, use esta fórmula para calcular: RNA (µ g / µ l) = OD260 x fator de diluição x (40 µ g RNA/1 000 µ l). - Determine a pureza de RNA de cada amostra calculando o rácio OD260/OD280.
Nota: Uma relação OD260/OD280 em torno de 2.0 é geralmente considerada como pura para RNA12. É altamente recomendável que a qualidade do RNA é verificada. Para isso, colocar 1 µ g de RNA em um gel de lixívia de agarose 1% feito com 1 x TBE buffer (89 mM Tris base, o ácido bórico 89 mM e 2 mM EDTA, pH 8.0) e 1% lixívia solução13 (Figura 3). RNA de muito boa qualidade mostra bandas de ambos 28S e 18S rRNA e a banda de 28S deve ser mais intensa do que os 18. Qualidade do RNA é aceitável quando as duas bandas de rRNA são visíveis em uma intensidade semelhante. Qualidade do RNA torna-se deficiente no momento que a banda 18S é mais intensa do que a banda 28S, e quando um esfregaço é visível, indicativo de degradação de RNA. - Para cada amostra, prepare-se 10 µ l de 0,5 µ g / µ l de RNA do estoque no segundo conjunto de RNase-livre 1,5 mL cônicos tubos usando água livre de RNase para diluir as amostras conforme necessário. Estas amostras são usadas para RT para obter o cDNA.
- Uma vez que todas as amostras são processadas, iniciar RT ou armazenar as amostras em um freezer-80 ° C para uso posterior.
5. transcrição reversa-(RT)
- Amostras de tecido adiposo RNA foram recentemente diluídas a 0,5 µ g / µ l ou pre-armazenadas em um freezer-80 ° C, reunir todas as amostras e reagentes e permitir-lhes a descongelar no gelo até o início do procedimento.
- Coloque o suporte do PCR tira no gelo. Depois de frio o suficiente preparar e identificar um conjunto de tubo de RNase-livre PCR tiras e colocá-los na prateleira. Inclua um espaço em branco.
- Preparar a reação para o tratamento de DNase do RNA: fazer uma mistura de mestre (para a quantidade necessária de amostra + 1 amostra) das seguintes (quantidades para 1 amostra): 1 µ l de 10 X amortecedor da reação com MgCl2, 0,5 µ l de DNase I (1 U / µ l) e 7,5 µ l de RNase-livre da água usando pontas do filtrado. Dispense a 9 µ l em cada tubo.
- Adicione 1 µ l de 0,5 µ g / µ l de RNA de cada amostra para o tubo correspondente, coloque as tampas em cada tira e rápido-girar todas as tiras em uma rotação mini centrífuga para trazer a amostra no fundo do tubo. Adicione 1 µ l de água livre de RNA para o espaço em branco.
- Incube todas as tiras de tubo em um termociclador ou um bloco de aquecimento a 37 ° C por 30 min. colocar a tira do tubo volta na prateleira no gelo.
- Adicionar 1 µ l de EDTA (50 mM) para cada tubo e incubar todas as tiras de tubo em um termociclador ou um bloco de aquecimento a 65 ° C durante 10 min. voltar a pôr a tubo tira a cremalheira no gelo.
- Faça uma mistura de mestre (para o número requerido de amostras mais 1 amostra) das seguintes (quantidades para 1 amostra): 1 µ l de hexâmeros aleatórios (0,2 µ g / µ l) e 1 µ l de dNTP mix (contém cada uma os quatro desoxinucleótidos numa concentração de 10 mM). Dispense a 2 µ l da mistura em cada tubo utilizando filtrada-dicas mestre. Dica de mudança entre as amostras.
- Incube todas as tiras de tubo em um termociclador ou um bloco de aquecimento a 65 ° C por 5 min. colocar a tira do tubo de volta dentro do rack no gelo.
- Faça uma mistura de mestre (para o número requerido de amostras mais 1 amostra) das seguintes (quantidades para 1 amostra): 4 µ l de 5 x RT buffer, 1 µ l de inibidor de RNase (20 U / µ l), 0,25 µ l de transcriptase reversa (200 U / µ l) e 1,75 µ l de água livre de nuclease. Dispense a 7 µ l em cada tubo utilizando dicas filtradas. Dica de mudança entre as amostras.
- Executar RT em um termociclador, definindo o seguinte programa: 10 min a 25 ° C, 30 min a 50 ° C, 5 min a 85 ° C. Coloque as tiras de tubo a cremalheira no gelo.
- Preparar e identificar um conjunto de tiras de tubo PCR livre de RNase e colocá-los na prateleira.
- Para cada amostra, prepare o volume desejado de cDNA de diluído 1:5 do estoque nas tiras tubo novo usando água ultrapura. As amostras de cDNA diluído 1:5 serão usadas para o PCR em tempo real.
- Uma vez que todas as amostras são processadas, começar a PCR em tempo real ou armazenar amostras (estoque e amostras diluídas) em um congelador-20 ° C para uso posterior.
6. real-time PCR para expressão gênica em tecido adiposo
Nota: Evite expor o corante fluorescente à luz. O protocolo abaixo descreve a amplificação do gene s16 referência14. Os primers e as condições PCR devem ser modificadas de acordo com o gene de interesse.
- Amostras de cDNA foram recentemente diluída 1:5 ou previamente guardadas no congelador-20 ° C, reunir todas as amostras e reagentes e permitir-lhes a descongelar no gelo até o início do procedimento.
- Coloque a grelha para tiras de tubo PCR em tempo real no gelo. Depois de frio o suficiente preparar e identificar um conjunto de tempo real tubo do PCR de tiras e colocá-los na prateleira. Prepare cada amostra e o espaço em branco em duplicado.
- Faça uma mistura de mestre (para o número requerido de amostras mais 1 amostra) das seguintes (quantidades para 1 amostra): 1,9 µ l de água ultrapura, 5 µ l de tintura fluorescente (por exemplo, SYBR verde) e 0,3 µ l de uma cartilha para a frente e 0,3 µ l do primer reverso. Dispense a 7,5 µ l em cada tubo.
- Adicione 2,5 μL de cDNA diluído 1:5 de cada amostra para o tubo correspondente. Adicione 2,5 µ l de água ultrapura para os espaços em branco. Coloque as tampas de cada tira.
- Siga as instruções do fabricante para configurar o programa a seguir sobre o PCR em tempo real: 10 min a 95 ° C e 40 ciclos de 15 s a 50 ° C, 30 s a 60 ° C, 30 s a 70 ° C. Coloque as tiras de amostra para o rotor da máquina do PCR em tempo real e iniciar o programa.
Nota: Condições do termociclador podem variar dependendo do aparelho utilizado e o gene de interesse. resultados de expressão do mRNA apresentados no programa de Figura 3 amplificação de mRNA de leptina normalizada pelo gene referência S16 mRNA amplificação14,15.
Resultados
Após o processo de necropsia, os três tecidos adiposo brancos foram coletados e ponderados de dois grupos de ratos (N e HF dieta-alimentou ratos). Como esperado, os ratos na dieta de HF tinham aumentado de peso final e ganho de peso em comparação com littermates dieta N (tabela 1). Estas observações foram acompanhadas por mais do que um aumento de 2 vezes no peso da PGF, PRF e SCF em ratos obesos em comparação com aqueles na dieta de N.
Antes de executar quaisquer experimentos com o RNA isolado, sua pureza foi avaliada como descrito na etapa 4.9. Para cada tecido adiposo branco, isolamento de RNA pela solução de fenol produzido amostras com qualidade adequada, como a relação OD260/OD280 foi em torno de 2.0, que é considerada como puro para o RNA (tabela 2). Dados PCR em tempo real mostram que a expressão de RNAm de leptina aumentou significativamente em PGF, PRF e SCF de ratos obesos em comparação com aqueles na dieta de N(Figura 4). Com efeito, as diferenças observadas na expressão de RNAm de leptina não eram devido a uma variação de s16, o gene de referência usado para normalizar os resultados, entre os dois grupos de ratos, como valores de Ct não foram alterados (Figura 4B). Assim, s16 pode ser confiável usado como um gene de referência para a expressão de RNAm de PGF, PRF e SCF quando dieta HF é um parâmetro em um protocolo de estudo.
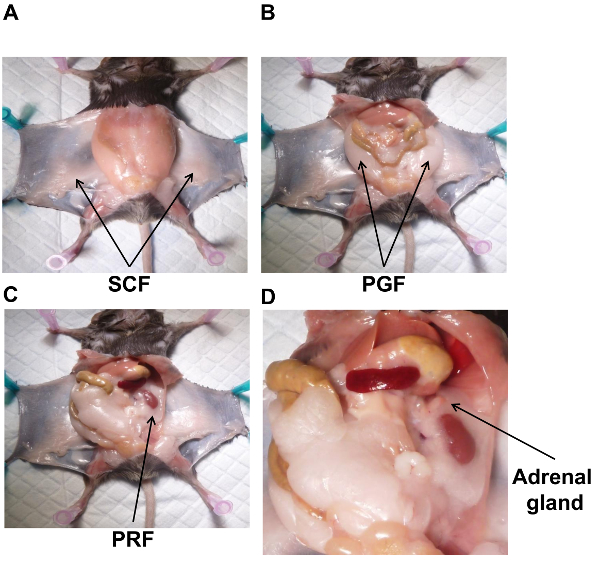
Figura 1 . Localização anatômica do tecido adiposo branco em camundongos. Um rato masculino na dieta de N tem sido dissecado para mostrar a localização de cada depósito de tecido adiposo e glândulas adrenais. SCF (A), PGF (B), PRF (C) e glândula adrenal (D). PGF, gordura peri-gonadal; PRF, gordura peri-renal; SCF, gordura subcutânea abdominal. Clique aqui para ver uma versão maior desta figura.
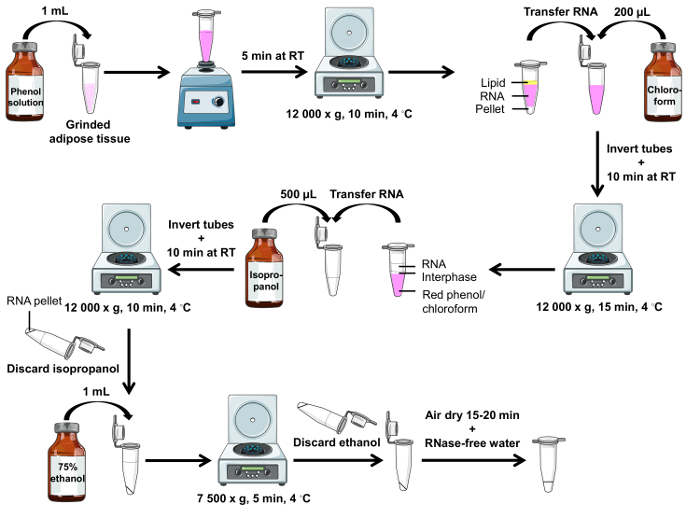
Figura 2 . Carta de fluxo do protocolo isolamento do RNA usando solução de fenol. Representação esquemática das etapas necessárias para isolar o RNA do aterrado tecido adiposo branco. Clique aqui para ver uma versão maior desta figura.

Figura 3 . Avaliação da qualidade do RNA em gel de lixívia. 1 µ g de RNA isolado de gordura subcutânea (SCF) e gordura peri-gonadal (PGF) é separado em um gel de agarose a 1% lixívia por eletroforese. 28s e 18s rRNA são visualizados por UV-transiluminação. Em gel é RNA isolado do SCF e PGF de um rato alimentado uma dieta normal. Clique aqui para ver uma versão maior desta figura.

Figura 4 . Efeito da dieta de HF na expressão de RNAm de leptina e s16 no tecido adiposo branco. Leptina (A) e s16 (B) a expressão de RNAm. Dados de leptina são normalizados para os níveis do mRNA s16 enquanto dados para s16 são mostrados como valor de Ct e ambos são apresentados como média ± SE com n = por grupo de 12-13. * p < 0.05 comparado a dieta N. N, normal; HF, alto teor de gordura; PGF, gordura peri-gonadal; PRF, gordura peri-renal; SCF, gordura subcutânea abdominal. Esta figura foi modificada de Tan, p. et al, obesidade (2014) 22, 2201-2209. Clique aqui para ver uma versão maior desta figura.
| Dieta N | Dieta de HF | |
| Peso corporal final (g) | 37,5 ± 1.3 | 46.7 ± 1.7* |
| Ganho de peso (g) | 6,6 ± 0,7 | 16,7 ± 1.0* |
| PGF (g) | 1.08 ± 0,17 | 2.19 ± 0.15* |
| PRF (g) | 0,79 ± 0,15 | 1,71 ± 0.06 |
| SCF (g) | 1,62 ± 0.35 | 3,55 ± 0.20* |
Tabela 1. Efeito da dieta de HF em pesos de tecido adiposo do corpo e branco. Valores são expressos como média ± SE com n = 14-15 por grupo. * p < 0.05 comparado a dieta N. N, normal; HF, alto teor de gordura; PGF, gordura peri-gonadal; PRF, gordura peri-renal; SCF, gordura subcutânea abdominal. Esta figura foi modificada de Tan, p. et al, obesidade (2014) 22, 2201-2209.
| Amostras | Relação OD260/OD280 |
| PGF 1 | 2,04 |
| PGF 2 | 2,04 |
| PGF 3 | 2.02 |
| PRF 1 | 1.95 |
| PRF 2 | 2.08 |
| PRF 3 | 2.08 |
| SCF 1 | 2,04 |
| SCF 2 | 2.02 |
| SCF 3 | 2.06 |
Tabela 2. Pureza de RNA após isolamento branco tecido adiposo. n = 3 por tecido adiposo. PGF, gordura peri-gonadal; PRF, gordura peri-renal; SCF, gordura subcutânea abdominal.
Discussão
Seguir HF-dieta alimentar, ratos obesos foram encontrados para ter aumentado o corpo e os pesos de tecido adiposo branco em comparação com ratos alimentados com uma dieta de N. RNA extraído usando solução de fenol rendeu amostras com boa pureza. Leptina é uma adipokine primeiramente produzido pelo tecido adiposo e é conhecida por correlacionar-se positivamente com a massa gorda16. Como esperado, a expressão de RNAm de leptina aumentou em ratos obesos em concomitância com sua massa gorda.
Este método tem várias etapas críticas. O importante é contaminação de um depósito de tecido adiposo branco com outro como é conhecido que depósitos diferentes de tecido adiposo têm funções diferentes,2,5. Contaminação pode trazer resultados enganosos em aplicações a jusante. Além disso, como a gordura tende a secar uma vez em contacto com o ar, coletando o tecido adiposo branco em um ritmo regular e consistente entre ratos recomenda-se o peso precisa ser tomada. Caso contrário, o peso total de uma almofada de gordura pode estar incorreto. A fim de obter RNA de boa qualidade e rendimento, seguindo o recentemente publicado MIQE diretrizes é um trunfo definitivo17. Em particular, fazendo pó muito fino de amostra durante a moagem pode ajudar a maximizar o rendimento. Isso maximiza o contato entre a solução de pó e fenol de tecido durante o isolamento de RNA. Por último mas não menos importante é o isolamento da camada contendo RNA durante o isolamento de RNA (etapa 3.12). Como a gordura é menos densa que a água, ele está posicionado na parte superior da fase de interesse. Minimizar o reporte de gordura é necessário para reduzir a interferência com aplicações a jusante.
Uma limitação deste método é a habilidade necessária para executar várias etapas do procedimento, bem como a necessidade de trabalhar com reagentes prejudiciais durante o isolamento de RNA. Além disso, todo o processo é trabalhoso.
Não há muitas alternativas ao método de coleta de tecido adiposo e amostra transformação antes do isolamento do RNA, além de pequenos detalhes que normalmente são ajustados por cada usuário. No caso de isolamento de RNA, muitas opções estão disponíveis, tais como a extração fenol/clorofórmio ou kits de isolamento de RNA. Há vantagens e desvantagens de cada opção e cabe ao usuário selecionar o melhor método baseado em aplicações a jusante. Extração fenol/clorofórmio é menos cara, mas requer o uso de reagentes prejudiciais e é trabalhosa. Kits de isolamento de RNA são geralmente mais caros, mas o procedimento é mais rápido e normalmente produz amostras com boa qualidade e pureza. É importante considerar o rendimento e a pureza do RNA, porque o material é limitado em branco tecido adiposo que é composto principalmente de gordura. A principal vantagem em usar a solução de fenol para isolamento (extração fenol/clorofórmio) é a possibilidade de isolar o DNA, RNA e proteína de uma única amostra18. Este é o custo - e tempo-eficaz que reduz o número de ratos exigidas para a obtenção de material suficiente. Como mencionado anteriormente, massa gorda é limitada em alguns modelos do rato. Para estes ratos, dividindo o tecido adiposo de terra em três partes para obter separadamente o RNA, DNA e proteína não é recomendado pois isso pode levar à material insuficiente para aplicações a jusante. Para contornar esse problema, também é possível juntar semelhante depósito de tecido adiposo de vários ratos com base em critérios definidos pelo usuário, que leva a um aumento do número de animais necessários.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Canadá de Diabetes.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL seringes | |||
| 1X TE solution (10 mM Tris-HCl and 1 mM EDTA•Na2. pH 8.0) | |||
| 22 G needles | |||
| 26 G needles | |||
| 75% Ethanol | |||
| Block heater (dry bath) | |||
| Chloroform | Sigma | C2432-500mL | |
| dATP | Thermo scientific | R0141 | |
| dCTP | Thermo scientific | R0151 | |
| dGTP | Thermo scientific | R0161 | |
| DNase I (1 U/µl) | Thermo scientific | EN0521 | |
| dTTP | Thermo scientific | R0171 | |
| Faststart Universal SYBR green Master (Rox) | Roche | 4913922001 | |
| Faststart universal SYBR green master (Rox) fluorescent dye | Roche | 4913914001 | |
| Filtered tips | |||
| Forceps | Instrumentarium | HB275 | |
| Gauze | |||
| Hammer | |||
| High fat rodent diet | Bio-Serv, Frenchtown, NJ | F3282 | |
| Isopropanol | Laboratoire MAT | IH-0101 | |
| Leptin forward PCR primer (5’-GGGCTTCACCCCATTCTGA-3’) 10 uM | |||
| Leptin reverse PCR primer (5’-GGCTATCTGCAGCACATTTTG-3’) 10 uM | |||
| Liquid nitrogen | |||
| Maxima Reverse Transcriptase (enzyme and 5x buffer) | Thermo scientific | EP0742 | |
| Nanopure water (referred as ultrapure water) | |||
| Nitrile examination gloves | |||
| Nitrile gloves | |||
| Normal rodent diet | Harlan Laboratories, Madison, WI | Harlan 2018 | |
| P1000 pipetman | |||
| P2 pipetman | |||
| P20 pipetman | |||
| P200 pipetman | |||
| Phenol solution (TRIzol) | Ambion Life Technologies | 15598018 | |
| Pre-identified aluminium foil | |||
| Quartz spectrophotometer cuvette | |||
| Rack for PCR tube strips | |||
| Racks for RT-PCR tube strips | |||
| Random hexamers | Invitrogen | 58875 | |
| Real-time PCR Rotor Gene system | Corbett research | RG-3000 Rotor-Gene thermal cycler | |
| Refrigerated bench-top centrifuge | |||
| RiboLock RNase Inhibitor | Thermo scientific | EO0381 | |
| RNase-free 1.5 mL eppendorf tubes | |||
| RNase-free 1.5 mL screw cap tubes | |||
| RNase-free PCR tube strips (0.2 mL) and caps | |||
| RNase-free water | Hyclone | SH30538.02 | |
| RT-PCR machine | Qiagen | Rotor-Gene Corbett 3000 | |
| RT-PCR tube strips (0.1 mL) and caps | |||
| S16 forward PCR primer (5’-ATCTCAAAGGCCCTGGTAGC-3’) 10 uM | |||
| S16 reverse PCR primer (5’ ACAAAGGTAAACCCCGATCG-3’) 10 uM | |||
| Spectrophotometer | Biochrom | Ultrospec 3100 pro | |
| Stainless steel mortar and pestle | |||
| Surgical pads | Home made a foam board wrapped in a disposable absorbent underpad | ||
| Surgical scissors | Intrumentarium | 130.450.11 | |
| Thermal cycler | |||
| Thermal cycler | Biometra | Thermocycler | |
| Vortex mixer | |||
| Weighing spatula |
Referências
- Guh, D. P., et al. The incidence of co-morbidities related to obesity and overweight: a systematic review and meta-analysis. BMC. Public Health. 9, 88 (2009).
- Wronska, A., Kmiec, Z. Structural and biochemical characteristics of various white adipose tissue depots. Acta Physiol (Oxf). 205 (2), 194-208 (2012).
- Cannon, B., Nedergaard, J. Brown adipose tissue: function and physiological significance. Physiol Rev. 84 (1), 277-359 (2004).
- Holland, N. T., Smith, M. T., Eskenazi, B., Bastaki, M. Biological sample collection and processing for molecular epidemiological studies. Mutat Res. 543 (3), 217-234 (2003).
- Ibrahim, M. M. Subcutaneous and visceral adipose tissue: structural and functional differences. Obes Rev. 11 (1), 11-18 (2010).
- Mann, A., Thompson, A., Robbins, N., Blomkalns, A. L. Localization, identification, and excision of murine adipose depots. J Vis Exp. (94), (2014).
- Hemmrich, K., Denecke, B., Paul, N. E., Hoffmeister, D., Pallua, N. RNA Isolation from Adipose Tissue: An Optimized Procedure for High RNA Yield and Integrity. Laboratory Medicine. 41 (2), 104-106 (2010).
- Cirera, S. Highly efficient method for isolation of total RNA from adipose tissue. BMC Res Notes. 6, 472 (2013).
- Tan, S. C., Yiap, B. C. DNA, RNA, and protein extraction: the past and the present. J Biomed Biotechnol. 2009, 574398 (2009).
- Sellin Jeffries, M. K., Kiss, A. J., Smith, A. W., Oris, J. T. A comparison of commercially-available automated and manual extraction kits for the isolation of total RNA from small tissue samples. BMC Biotechnol. 14, 94 (2014).
- Tan, P., et al. Impact of the prorenin/renin receptor on the development of obesity and associated cardiometabolic risk factors. Obesity (Silver. Spring). 22 (10), 2201-2209 (2014).
- Taylor, S., Wakem, M., Dijkman, G., Alsarraj, M., Nguyen, M. A practical approach to RT-qPCR-Publishing data that conform to the MIQE guidelines. Methods. 50 (4), 1-5 (2010).
- Aranda, P. S., LaJoie, D. M., Jorcyk, C. L. Bleach gel: a simple agarose gel for analyzing RNA quality. Electrophoresis. 33 (2), 366-369 (2012).
- Mercure, C., Prescott, G., Lacombe, M. J., Silversides, D. W., Reudelhuber, T. L. Chronic increases in circulating prorenin are not associated with renal or cardiac pathologies. Hypertension. 53 (6), 1062-1069 (2009).
- Dusaulcy, R., et al. Adipose-specific disruption of autotaxin enhances nutritional fattening and reduces plasma lysophosphatidic acid. J. Lipid Res. 52 (6), 1247-1255 (2011).
- Nakamura, K., Fuster, J. J., Walsh, K. Adipokines: a link between obesity and cardiovascular disease. J Cardiol. 63 (4), 250-259 (2014).
- Taylor, S. C., Mrkusich, E. M. The state of RT-quantitative PCR: firsthand observations of implementation of minimum information for the publication of quantitative real-time PCR experiments (MIQE). J Mol Microbiol Biotechnol. 24 (1), 46-52 (2014).
- Hummon, A. B., Lim, S. R., Difilippantonio, M. J., Ried, T. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage. Biotechniques. 42 (4), 467-470 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados