Method Article
Иммуно люминесцентные маркировки микротрубочек и Centrosomal белков в Ex Vivo кишечных тканей и 3D в Vitro кишечных Organoids
В этой статье
Резюме
Мы представляем протоколы для изоляции кишечных 3D конструкций из ткани в естественных условиях и в пробирке подвале матрица встроенного organoids и подробно различные фиксации и пятная протоколы, оптимизированный для иммуно маркировки микротрубочек, centrosomal и соединительной белки также как ячейки маркеры, включая стволовых клеток белка Lgr5.
Аннотация
Появлением organoids 3D в пробирке , которые имитируют в vivo ткани архитектуры и морфогенез значительно расширить возможности для изучения ключевых биологических вопросов в клетке и биологии развития. Кроме того organoids вместе с последних технических достижений в ген редактирования и вирусных генов доставки обещает продвижения медицинских исследований и разработки новых препаратов для лечения заболеваний. Organoids выращенных в пробирке в подвале матрицы обеспечивают мощную модель системы для изучения поведения и функции различных белков и хорошо подходят для жить изображений меткой флуоресцентных белков. Однако создание выражения и локализации эндогенного белков в ex vivo ткани и в пробирке organoids имеет важное значение для проверки поведения тегами белков. С этой целью мы разработали и изменения тканей изоляции, фиксации и иммуно маркировки протоколы для локализации микротрубочек, centrosomal и связанных с ней белков в ex vivo кишечника ткани и в пробирке кишечных organoids. Целью было для фиксатором для сохранения 3D архитектура organoids/ткани также сохраняя антигенностью антитела и позволяет хорошее проникновение и распродажа фиксатором и антител. Воздействие холода depolymerizes все, но стабильные микротрубочки и это является ключевым фактором при изменении различных протоколов. Мы обнаружили, что увеличение Этилендиаминтетрауксусная кислота (ЭДТА) концентрации от 3 мм до 30 мм дал эффективное отряд ворсинки и склепы в тонкой кишке, в то время как ЭДТА 3 мм было достаточно для толстой склепы. Протокол фиксации развитых формальдегида/метанола дали очень хорошие структурных сохранения сохраняя при этом антигенностью для эффективного нанесения этикеток микротрубочек, актина и конец связывающих белков (EB). Он также работал для centrosomal белка ninein, хотя протокол метанола работал более последовательно. Далее мы установили, что фиксация и иммуно маркировки микротрубочек и связанных белков может быть достигнуто с organoids изолированы от или оставаясь в подвале матрицы.
Введение
Формирование эпителия с apico базальной полярности является основополагающим процесс развития и включает в себя драматической реорганизации микротрубочек и centrosomal белков. Массив радиальные микротрубочек, вытекающих из расположен centrosomal микротрубочки, организует центр (КТВМ) видно в многих животных клеток, и это хорошо подходит для сравнительно плоские клетки. В противоположность этому столбчатых эпителиальных клеток, таких, как те из кишечника, собрать-радиальная transcellular микротрубочки массивы, которые лучше поддерживать форму и специализированные функции этих клеток. Это драматической реорганизации микротрубочек достигается Центросома, переход к вершине и апикальной не centrosomal MTOCs (n-MTOCs) формирования, который становится ответственным за Анкоридж микротрубочек transcellular,1,,2 , 3 , 4 , 5.
Большая часть наших знаний эпителиальных дифференциации и связанные микротрубочек реорганизации пришла из исследования 2D в vitro слои клеток, которые не отображаются в vivo ткани архитектуры. Разработка 3D в vitro органоид культур, впервые,6Clevers и коллегами, представляет собой крупные технологические улучшения как они имитируют в vivo архитектуры и развития. Иерархия эпителиальных дифференциация проявляется в кишечнике; Стволовые клетки в нижней части склепы порождают незрелых транзита, усиливая клетки, которые размножаются и постепенно дифференцировать как они мигрируют вверх склеп на небольшой кишечных ворсинок или толстой поверхность, где они становятся полностью дифференцированной до того, как сарай в просвете7. Важно отметить, что это реплицируется в кишечных organoids, где клетки от ниши стволовых клеток пролиферировать образуя кисты, которые впоследствии сформировать бутоны склеп как с помощью стволовых клеток на дне и дифференциации, постепенно продвигается к кисты региона, который становится ворсинок как8. Кишечные органоид поэтому представляет мощную модель для изучения не только микротрубочек и centrosomal реорганизации во время дифференцировки эпителия, но многочисленные другие белки, а также обеспечивая идеальную платформу для скрининга наркотиков и продовольствия соединений потенциал терапевтические преимущества9,10.
Organoids хорошо подходят для жить изображений меткой флуоресцентных белков и оба забивные и organoids нокаут-может быть создан с помощью ТРИФОСФАТЫ/Cas9 гена редактирования11,12. Однако создание выражения и локализации эндогенного белков для изучения важно, особенно для проверки поведения тегами белков. Иммуно маркировки 3D organoids, выращенных в подвале матрицы или ex vivo изолированные ткани является более сложным, чем клетки выросли в культуре блюда в 2D. Протокол фиксации необходимо сохранить деликатные 3D архитектура organoids сохраняя антигенностью антитела (то есть, epitopes для связывания антител). К примеру параформальдегида 4% (PFA) обычно используется как фиксатор, но пока это относительно быстрый обязанности фиксатором и дает хорошие морфологические сохранения, в наш опыт это часто приводит к потере антигенностью и не подходит для многих centrosomal антител. Следует также рассмотреть фиксатором и антител способность проникать 3D конструкций и тканей. С этой целью мы изменили и развитых протоколы для изоляции тканей и косвенные иммуно маркировки 3D в vitro organoids и ex vivo изолированных кишечных тканей. Мы опишем, как изолировать малого кишечника склепы и ворсинки и толстой ткани, и включить протокол для изоляции 3D organoids как альтернатива для фиксации и иммуно маркировки в матрице подвале. Мы представляем три альтернативных фиксации протоколы для иммуно маркировки микротрубочек и centrosomal белков, таких как ninein, и микротрубочек плюс конец отслеживания белков (+ советы), таких как белки EB и клип-170 (см. также ссылки8, 13). Мы также обсудить достоинства и недостатки, связанные с каждым протоколом.
протокол
Все методы, описанные здесь проводились согласно руководящим принципам учрежденческой лицензии университета Восточной Англии.
1. изоляция кишечника ткани
- Изоляция толстой склепы иммуно-маркировки (см. рис. 1, схема)
- Усыпить мыши (с использованием CO2 асфиксия) и удалите двоеточие (начало в caecum и извлечение каудально) с рассечения ножницы и щипчики14.
- Очистка содержимого толстой кишки с фосфатный буфер (PBS) с помощью стеклянной пипетки с резиновую грушу. PBS: натрия хлорид (8,0 г/Л), хлорид калия (0,2 г/Л), динатрия гидрогенфосфат (1,15 г/Л) и калия дигидрогенфосфат (0,2 г/Л), при pH 7,3.
- Используя металлический стержень (2,4 мм) или в конце стеклянной пипетки, удерживая один конец толстой трубе мягко скользящие ткани через стержень/пипетки, таким образом everting толстой ткани, так что эпителия в настоящее время на улице.
Примечание: Если это не представляется возможным откройте толстой кишки с ножницами и нарезать на кусочки 5 мм. - Передавать everted толстой кишки или куски конические Тюбик 50 мл, содержащие 40 мл PBS.
- Инвертировать трубки несколько раз для дальнейшего удаления кишечного содержимого, слизи и т.д.
- Передача части толстой кишки до 40 мл 3 мм ЭДТА в PBS и инкубации при комнатной температуре (RT) за 15 мин.
Примечание: Разбавляют 0,5 М ЭДТА рН 8,0 шток с PBS. - Встряхните, чтобы удалить слизь и передачи части толстой кишки на 50 мл Конические трубки, содержащий свежие 40 мл 3 мм ЭДТА в PBS. Инкубируйте 35 мин на RT.
- Передача части толстой кишки до 10 мл PBS в 50 мл Конические трубки и встряхнуть для 30 s выпустить склепы (склеп дробь).
- Удаление части толстой кишки из трубки и место обратно в 3 мм ЭДТА, в случае, если требуется дальнейшая изоляция. Центрифуга оставшиеся фракции склеп на 300 g x 5 мин.
- Удаление 5 мл супернатант и Ресуспензируйте Пелле склеп в остальные тома 5 мл.
- Соблюдайте под стереомикроскопом с зумом (50-100 крат) проверить наличие толстой склепы.
Примечание: Если есть не склепы настоящее затем инкубировать Колон/штук в 3 мм ЭДТА в PBS для еще 30 минут и повторите шаги 1.1.8 - 1.1.11. - Центрифуга склеп дроби на 300 g x 5 мин.
- Удалите все супернатант для получения гранул склеп и немедленно приступить к фиксации (раздел 3).
- Изоляции малых кишечные крипты и Вилли для иммуно маркировки (рис. 2)
- Усыпить мыши (с использованием CO2 асфиксия) и удалить тонкой кишки (проксимальной двенадцатиперстную кишку до терминала подвздошной кишки) с рассечения ножницы и щипчики14.
Примечание: для просмотра различных секций тонкой кишки, то на данном этапе отделить и рассматривать отдельно. Смотрите Рисунок 1 и Таблица 1 схема и сроки. - Очистить содержимое тонкой кишки с PBS с помощью стеклянной пипетки с резиновую грушу.
- Разрезать тонкой кишки с рассечения ножницами и место в 15 мл PBS в чашке Петри.
- Осторожно промойте intestine в PBS для удаления Люминал содержание не повреждая поверхность слизистой оболочки. Передать свежие Петри блюдо ткани и повторить PBS мыть.
- Кишечник нарезать 3-5 мм и передачи до 100 мм Петри, содержащих 15 мл 30 мм ЭДТА в PBS и инкубировать на 5 мин на RT. Альтернативно Инкубируйте 30 мин в 3 мм ЭДТА в PBS.
- Часть 1 (Villi изоляции): передача части кишечника в 10 мл PBS в 50 мл Конические трубки, shake энергично для 10 s и вылейте в 100 мм Петри. Проверьте дроби для изолированных Вилли под стереомикроскопом. На данном этапе главным образом Вилли должны присутствовать, но это может варьироваться от изоляции.
Примечание: Для предотвращения изолированных Вилли/склепы придерживаться пластика, чашки Петри и коллекции трубы должна быть предварительно покрытых с плода Bovine сыворотки (ФБС). Налейте FBS блюда или трубы и немедленно удалить его. Приведена Таблица 1 сроки направляющие для каждой фракции. - Передача части кишечника обратно в 30 мм ЭДТА в PBS и инкубировать в течение 5 мин. Во время инкубации Соберите часть 1 в 15 мл Конические трубки (ветротурбин с FBS) и центрифуги на 300 x g 5 мин.
- Часть 2: Кишечные штук передать конические Тюбик 50 мл, содержащие 10 мл PBS, shake энергично для 20 s, а затем налить в чашку Петри 100 мм. Проверьте часть под микроскопом. Как правило, на данном этапе смешанной культуре ворсинки и склепы присутствуют (рисунок 2A).
- Передача кишечных куски обратно в 30 мм ЭДТА в PBS и инкубировать еще 5 мин. Во время этой инкубации Пелле фракция 2 в 15 мл Конические трубки (ветротурбин с FBS) на 300 x g 5 минут удалить супернатант из фракций 1 и 2 не нарушая гранулы и немедленно приступить к фиксации (шаг 3).
- Часть 3 (склеп изоляции): передача части кишечника в 10 мл PBS в 50 мл трубки, встряска для 20 s и вылейте в 100 мм Петри. Проверьте часть под микроскопом. На данном этапе часть будет содержать преимущественно склепы (рис. 2B).
- Часть 4: Передача части кишечника в 10 мл PBS, трясти за 20 сек и вылейте в 100 мм Петри. Проверьте часть под микроскопом. На этом этапе должны присутствовать только склепы.
- Часть 5: Передача части кишечника в 10 мл PBS, трясти за 20 сек и вылейте в 100 мм Петри. Проверьте часть под микроскопом. Обычно на этом этапе, очень немногие склепы извлекаются. Если извлекаются более нескольких склепов, затем продолжите с малую 6тыс .
Примечание: Если чистая склеп населения (например, для генерации органоид), затем используйте стрейнер ячейки 70 мкм для удаления любых нетронутыми Вилли из склепа обогащенный фракции. - Соберите фракции 3-5 в отдельных 15 мл конические трубы и центрифуги на 300 x g за 5 мин.
- Проверьте гранулы фракции 3 - 5 и удалить supernatants не нарушая гранулы и немедленно приступить к фиксации (раздел 3).
- Усыпить мыши (с использованием CO2 асфиксия) и удалить тонкой кишки (проксимальной двенадцатиперстную кишку до терминала подвздошной кишки) с рассечения ножницы и щипчики14.
2.Изоляция кишечных Organoids с подвале матрица куполов в 24-ну пластины
Примечание: Формирование organoids в подвале матрица купола было описано в других разделах12.
- Герб скважин с куполом матрица подвале согласно инструкциям производителя.
- Мыть Уэллс, содержащие подвале матрица купола с 500 мкл PBS.
- Добавьте холодной 250 мкл раствора восстановления клеток (4 ° C) для каждой скважины (см. Таблицу материалы).
Примечание: Решение восстановления холодной камере будет деполимеризуют но все стабильные микротрубочки. - Скрип подвале матрица купола с помощью микропипеткой P1000 и тщательно Пипетка вверх и вниз на протяжении также распад и удалить подвале матрица из пластика.
- Соберите супернатант в 1,5 мл низкой привязки microcentrifuge трубы.
- Инвертировать 1,5 мл трубки низкого привязки несколько раз и проверьте под микроскопом, organoids были изолированы и свободного перемещения и не в кусты. Держите трубку под стереомикроскопом и просмотр под увеличением низкой (50 X).
- Пелле organoids центрифугированием на 1000 x g 5 мин на RT.
- Удаление восстановления реагента и немедленно приступить к фиксации (шаг 3).
3. Фиксация изолированных кишечных тканей и Organoids
- Фиксация метанола
- Ресуспензируйте фракции изолированных кишечные крипты/ворсинок в 10 мл и organoids в 1 мл метанола при-20 ° C.
- Инкубировать склепы/Вилли/organoids при-20 ° C в морозильник на 15 мин и инвертировать трубки каждые 5 мин.
- Пелле склепы, ворсинки и organoids центрифугированием на 1000 x g за 5 мин.
- Удаление метанола и добавление моющего раствора (1 мл для organoids и 10 мл для отдельных крипта/ворсинок фракций). Моющий раствор либо может состоять из PBS с 1% сыворотки или PBS с 0.1% моющего средства и 1% сыворотки.
Примечание: Использование сыворотки от того же вида, что и вторичные антитела. Например если вторичные антитела были сформированы в козла затем используйте козьего сыворотки. - Сразу же центрифуга склепы/Вилли/organoids на 1000 x g 5 мин в гранулах.
- Удаление моющего раствора и Ресуспензируйте склепы, ворсинки и organoids в свежих моющий раствор.
- Место на вращателе трубки с скорость, равным 20 об/мин. Вымойте клетки для в общей сложности 1 h, гранулирование склепы, ворсинки и organoids центрифугированием (1000 x g 5 мин) каждые 15 мин и Замена промывочного раствора.
Примечание: Если трубка ротатор недоступен затем Инвертируйте трубы вручную каждые 5 мин до Ресуспензируйте отдельных культур.
- Фиксация формальдегида/метанола
Примечание: Ручка фиксативов и формальдегида в зонта.- Ресуспензируйте изолированных склепы/Вилли в 10 мл или organoids в 1 мл-20 ° C фиксирующие раствора (9.2 мл метанола с 800 мкл раствора формальдегида).
- Исправьте склепы, ворсинки и organoids при-20 ° C в морозильник на 15 мин и перевернуть трубку каждые 5 мин.
- Пелле склепы, ворсинки и organoids центрифугированием на 1000 x g за 5 мин.
- Удаление формальдегида/метанола и добавить моющий раствор (1 мл для organoids или 10 мл для фракции изолированных склепы/ворсинок). Моющий раствор либо может состоять из PBS с 1% козьего сыворотки или PBS с 0.1% моющего средства и 1% сыворотки.
- Центрифуга на 1000 x g за 5 мин до Пелле склепы, ворсинки и organoids.
- Удаление моющего раствора и Ресуспензируйте в свежих моющий раствор.
- Место на вращателе трубки с скорость, равным 20 об/мин. Вымойте клетки для в общей сложности 1 h, гранулирование склепы, ворсинки и organoids центрифугированием (1000 x g 5 мин) каждые 15 мин и Замена промывочного раствора.
- Фиксация PFA
Предупреждение: PFA порошок и решения должны обрабатываться в зонта.
Примечание: В большинстве случаев 4% используется ПФА в PBS, но в зависимости от сохранения антитела антигенностью, могут быть использованы более низкой концентрации.- Ресуспензируйте изолированных гранулированных склепы/Вилли в 10 мл 4% PFA и Инкубируйте на RT 1 h, и изолированных гранулированных organoids в 1 мл 4% PFA и Инкубируйте 30 мин. В обоих случаях Инвертируйте трубки каждые 10 мин.
- Пелле склепы, ворсинки и organoids центрифугированием на 1000 x g за 5 мин.
- Удаление PFA и добавление моющего раствора (1 мл для organoids и 10 мл для изолированных склепы/Вилли). Моющий раствор состоит из PBS с 0.1% моющего средства и 1% сыворотки.
- Центрифуга на 1000 x g за 5 мин до Пелле склепы/Вилли/organoids.
- Удаление моющего раствора и Ресуспензируйте в свежих моющий раствор.
- Место на вращателе трубки с скоростью, равным 20 об/мин. Вымойте клетки для в общей сложности 1 h, гранулирование склепы, ворсинки и organoids центрифугированием (1000 x g 5 мин) каждые 15 мин и Замена промывочного раствора.
Примечание: Если трубка ротатор недоступен затем Инвертируйте трубки вручную каждые 5 мин до Ресуспензируйте отдельных культур. - Антиген извлечение (необязательный шаг рекомендуется для фиксации PFA)
- Пелле склепы, ворсинки и organoids центрифугированием на 1000 x g 5 минут и удалить супернатант.
- Добавление 1-10 мл 10 мм цитрат натрия pH 6.0 (предварительно нагревают до 80 ° C) и Инкубируйте на 80 ° C в течение 20 мин.
- Пелле склепы, ворсинки и organoids центрифугированием на 1000 x g 5 минут и удалить супернатант.
- Добавление 1-10 мл свежего 10 мм цитрат натрия pH 6.0 (предварительно нагревают до 80 ° C) и Инкубируйте на RT на 20 мин.
- Пелле склепы, ворсинки и organoids центрифугированием на 1000 x g 5 минут и удалить супернатант.
- Стирать в 1-10 мл PBS с 1% сыворотки и повторять, далее 3 раза грануляции склепы, ворсинки и organoids центрифугированием (1000 x g 5 минут) перед добавлением свежей промывочного раствора.
4. Блокирование шаг
- Сделать блокировки решение: добавить 10% видов вторичного антитела сыворотки крови в PBS (необязательно: добавить 0,1% моющего средства).
- Пелле склепы, ворсинки и organoids центрифугированием (1000 x g 5 мин) и удалить супернатант.
- Добавить 5-10 мл блокирования решения в зависимости от количества необходимых образцов (см. Примечание ниже). На данном этапе разделение склепы/Вилли/organoids решение отдельных труб (1,5 мл низкой привязки microcentrifuge трубки с пробирки, содержащие 0,2 - 1 мл) для окрашивания с различных антител.
Примечание: Каждой фракции изолированных склепы/Вилли даст между 5-10 примеров, которые могут быть использованы для различных меток комбинации в зависимости от размера гранул. В идеале размером гранул от 2-4 мм требуется для каждого образца.
5. основное антитело инкубации
- Разбавьте первичного антитела (см. Таблицу материалы) в PBS, содержащие 10% сыворотки и 0,1% моющего средства. Между 100-200 мкл на сэмпл пробки microcentrifuge требуется решение основное антитело.
- Удалите блокирующие решение центрифугированием (1000 x g 5 мин).
- Ресуспензируйте склепы/Вилли/органоид Пелле в решении основного антитела и Инкубируйте на 4 ° C на ночь с помощью трубки ротатор (20 мин) держать склепы, ворсинки и organoids в суспензии.
- Следующий день: вернуть образцы RT 1 h на вращателе трубки (20 мин).
- Пелле образца центрифугированием (1000 x g 5 мин) и удалите решение основное антитело.
- Добавить 1 мл моющего раствора и Ресуспензируйте склеп/ворсинок/органоид окатышей.
- Немедленно удалите решение центрифугированием (1000 x g 5 мин).
- Добавить свежие промывочного раствора 1 мл и спина клетки на вращателе трубки (20 мин) 2 часа. Измените промывочный раствор центрифугированием каждые 30 мин как шаг 5.7.
6. Вторичное антитело инкубации
- Разбавленных вторичных антител (см. Таблицу материалы) в PBS с 10% сыворотки и 0,1% моющего средства. За образец пробки microcentrifuge требуется около 200 мкл раствора вторичного антитела.
Примечание: Высоко кросс поглощается антитела должны использоваться для снижения реактивности вторичных антител в мыши склеп/ворсинок/органоид. - Центрифуга на 1000 x g 5 мин Пелле склепы, ворсинки и organoids и Ресуспензируйте гранулы в 200 мкл раствора вторичного антитела.
- Спин трубы на вращателе трубки (20 мин) на RT 1 h.
- Центрифуга на 1000 x g 5 мин Пелле склепы, ворсинки и organoids и удалить supernatants (без привязки к вторичные антитела).
- Ресуспензируйте гранулы в промывочный раствор и немедленно центрифуги на 1000 x g за 5 мин до Пелле склепы, ворсинки и organoids.
- Удалить супернатант и Ресуспензируйте гранулы в 1 мл свежего промывочного раствора.
- Спина на трубку ротатор (20 мин) на RT для 1,5-2 ч, изменив промывочного раствора каждые 20-30 мин, как описано ранее 6,3-6,6.
7. Ядерная пятно
- Разбавьте ядерной пятно в промывочный раствор (в соответствии с протоколом производителя), например DAPI или "Хёхст". Например: DAPI Стоковый раствор (20 мг/мл), разбавленных 1:10 000. Стоковый раствор может храниться в аликвоты при-20 ° C.
- Центрифуга на 1000 x g 5 мин для пеллет склепы, ворсинки и organoids и удаления моющего раствора.
- Ресуспензируйте гранулы в решении ядерных изображение.
- Спина на трубку ротатор (20 мин) на RT за 10 мин.
- Центрифуга на 1000 x g 5 мин Пелле склепы, ворсинки и organoids, удалить решение ядерных пятно и Ресуспензируйте гранулы в промывочный раствор.
- Спина на трубку ротатор (20 мин) на RT за 30-60 мин, изменив промывочного раствора каждые 10 мин.
8. Монтаж изоляции склепы, ворсинки и Organoids
- Центрифуга на 1000 x g 5 мин Пелле склепы, ворсинки и organoids и удалить все промывочного раствора.
Примечание: Если гранулы расходится, затем центрифуга для снова. - Добавьте 2 капли установления жесткий монтаж СМИ с antifade агента в гранулы.
- Вырезать в конце микропипеткой Р200 и тщательно Ресуспензируйте гранулы в средствах массовой информации монтажа. Избегайте возникновения пузырей.
Примечание: Изолированные органоид культуры очень важно; Убедитесь в том, чтобы Ресуспензируйте полностью. - Используйте микропипеткой для передачи смесь склепы/Вилли/organoids в СМИ решения монтажа и распределять в линию вдоль центра микроскопа.
Примечание: Линия не должны быть длиннее, чем Стекло покровное, которая должна использоваться. Проверьте с помощью стереомикроскопом ли склепы, ворсинки и organoids хорошо распространилась на слайде и не слипаются. - Осторожно поместите крышку стекло над верхней частью; Избегайте возникновения пузырей.
- Место стеклянное скольжение в слайд книги и хранить в холодильнике на ночь для монтажа СМИ установить до анализа на конфокального микроскопа.
Примечание: Для антитела мыши окрашивание ткани мыши, использовать коммерческие иммунофлюоресценции комплекта (см. Таблицу материалы). Замените блок 10 мин с белком, блокирующие решение следуют 1 ч инкубации с блокировки реагент, который поставляется с комплектом блокировки шаг (раздел 4). Затем на шаге 5,8 (в середине стирка) добавьте 1 ч инкубации с флуоресцентным сигнала усилитель реагента. Затем используйте комплект реагентов в люминесцентных разрежающего (другие вторичные антитела могут также использоваться в сочетании с этого реагента). Инкубировать как указано выше и исходить из шаг 6 с остальной частью протокола.
9. Фиксация и иммуно маркировки Organoids в подвале матрица
Примечание: Organoids предназначенные для фиксации и иммуно маркировки оставаясь в пределах матрицы подвале были получены в подвале матрица купола на вершине круглые стекло coverslips в 24-ну пластине (один купол на хорошо). Органоид подвале матрица купола были обработаны в течение 24-ну пластины путем добавления и удаления различных решений.
- Удалите носитель из скважин и добавить фиксатором; Оставьте на 1 час.
- Снимите фиксатор и стирать в PBS, содержащей 1% сыворотки и 0,1% моющего средства для 2 h, меняется каждые 30 мин.
- Удаление промывочный раствор и блока в PBS с моющим средством сыворотки и 0.1% 10% за 1 час.
- Разбавьте антитела в PBS с 1% сыворотки или PBS с 1% сыворотки и 0,1% моющего средства.
- Удалять блокирующие решение и добавить 100-200 мкл основное антитело решение (см. Таблицу материалов) для каждой скважины.
Примечание: важно удалить все блокирующие решение не для разбавления антитела далее. - Установите пластину в холодильнике и инкубировать на ночь при 4 ° C
- Затем оставьте на RT для 1-2 ч.
- Удалите раствор антител и мыть за 2-3 ч, изменяя промывочного раствора каждые 20 мин.
- Удалите все промывочный раствор и добавить 100-200 мкл вторичные антитела разбавленного (см Таблицы материалы) в PBS с 1% сыворотки; инкубировать 1 час на RT.
- Удалите раствор вторичных антител и мыть за 2 ч, меняется каждые 20 мин.
- Удаление промывочный раствор и добавить DAPI решение; Оставьте на 10 мин на RT. использования DAPI Стоковый раствор (20 мг/мл) разводят в 1:10, 000.
Результаты
Изоляция кишечных тканей для иммуно маркировки
Протоколы изоляции описанных ткани для толстой и тонкой кишки были оптимизированы для сохранения и иммуно маркировки микротрубочек и связанных белков, но не для жизнеспособности стволовых клеток и органоид поколения (рис. 1 и Таблица 1 ). Цель состояла в том, чтобы генерировать склеп и ворсинок фракций, которые были как очистить (лишенная слизи и другие ткани) как можно скорее, при сведении к минимуму воздействия ЭДТА и холодной для сохранения структуры и предотвращения деполимеризацию микротрубочек с лед холодной решениями, которые вызывают деполимеризации но все стабильные микротрубочки. Рисунок 2 показывает примеры изображений фракции 2 и 3 от изолированных малого кишечника ткани, с фракция 2, содержащий смесь ворсинки и склепы (рисунок 2A, B), а часть 3 содержит главным образом склепы (рис. 2 c D).
Фиксация и иммуно маркировки изолированных кишечника ткани
Отдельных или комбинированных фракций были затем обработаны для фиксации и иммуно обозначенного через ряд шагов, включая фиксацию, моющих средств, блокирование, антител и мытья решения, прежде чем вновь приостановить окончательное Вилли/склепы Пелле в СМИ монтажа, перенос к слайдам и покрытие с coverslips стекла. Склепы и Вилли были затем отражаться на конфокального микроскопа.
Хорошее сохранение и маркировки микротрубочек и актина ворсинки и склепы было достигнуто следующим: сочетание фиксации формальдегида/метанола при-20 ° C, повторил мытья в PBS, содержащие 0,1% моющего средства и 1% сыворотки и блокирование в PBS с 0.1% моющее и 10% сыворотки, следуют ночи инкубации на 4 ° C в первичных антител, а затем 2 h в вторичные антитела при комнатной температуре (рис. 3). Формальдегид/метанола фиксации также работал хорошо для маркировки + советы как EBs и клип-170 в изолированных склепы и Вилли (рис. 4). EB3 накопления в конце плюс микротрубочек (известный как кометы) были очевидны в склепы (рис. 4A), в то время как Ассоциация вдоль решетки стабильные микротрубочки могут рассматриваться в образцах Вилли (рис. 4 c). Собственный локализация клип-170 и p150клееный (подразделение dynactin) было очевидно в апикальной n-MTOCs в изолированных Вилли (рис. 4В). Фиксация с протоколом формальдегида/метанола последовательно не работает для ninein локализации в изолированных кишечных тканей, с использованием нашего Pep3 антитела против мыши ninein. Однако фиксация метанола при-20 ° C, после чего же стирки и блокирования решения как формальдегид/метанола дали очень хорошие локализации ninein в изолированных склепы и Вилли (рис. 5; ссылка8). Интересно, что в то время как ninein сосредоточена на апикальной большое некоторые накопления на базе ячеек очевидно в некоторых ячейках изолированных склепы (рис. 5). Является ли это из-за неспецифичный Этикетировочный или следствием задержки процедуры изоляции фиксации (и таким образом затрагивающих сохранение) будет требуют дальнейшего изучения. Однако метанол исправлена (-20 ° C) криостат разделы Вилли (см. Рисунок 3bi ,8) также показал, что ninein в ячейке базы в некоторых клетках, предполагая, что ninein может также связать с базальной населением микротрубочек.
Фиксация и иммуно маркировки organoids изолированы от подвала матрица
Малые кишечника organoids были генерируется и вырос в подвале матрицы для трех недель или дольше (рис. 6A; ссылка6,15). Холодный (4 ° C) решение восстановления клеток был использован для изолировать organoids из подвала матрицы. Depolymerized подвале решение матрица с organoids был передан трубы и центрифугируют до фиксации и иммуно маркировки. Это производства препаратов очень чистый и хороший доступ к organoids для различных решений. Дифференцированных клеток в пределах органоид ворсинок домены содержат стабильные микротрубочки apico базальная; они помечены хорошо в большинстве случаев (Рисунок 6B, C) и EB1 может также рассматриваться вдоль решетка микротрубочек (Рисунок 6E; ссылка13). Однако решение восстановления холодной камере может привести к деполимеризацию микротрубочек динамического, который был очевидным в некоторых образцах отсутствием EB1 комет (которые связывают к концу плюс растущий микротрубочек) в пределах базальной склеп доменов (Рисунок 6F ). В других образцах Астрал (динамический) микротрубочек были сохранены (рис. 6 d). Органоид изоляции до фиксации и иммуно маркировки также работал на соединительной белки, ninein, клип-170 и ячейки маркеры, такие как муцина бокаловидных клеток и chromogranin A для enteroendocrine клеток.
Фиксация и иммуно маркировки organoids в подвале матрица
Рисунок 7 показывает органоид на этапе кисты (CA–) и на ранней стадии развития склеп (D), фиксированного в формальдегид/метанола и иммуно меченых микротрубочек и ninein. Сохранение хорошего микротрубочек и маркировки, а также маркировки для ninein в апикальной n-MTOCs были очевидны. Рис. 8А, B показывает домен склеп в течение дня 6 органоид фиксированной с протоколом метанола и помечены для микротрубочки и EB1. Хорошее сохранение микротрубочек и EB1 комет было очевидно, предполагая Сохранение динамических микротрубочек.
Organoids были также фиксированной и иммуно меченых оставаясь в пределах матрицы подвале. Недостатки этой процедуры может быть плохое проникновение фиксатором и треппинг антител в подвале матрицы (рис. 8Б), хотя в обоих случаях менее часто когда 0,1% моющего средства был включен в фиксатором или вымойте решения. Кроме того, 4% PFA не заповедник подвале матрица хорошо но причиной его распустить, хотя это было не столь с 1% PFA.С другой стороны, фиксация метанола, иногда индуцированной органоид краха.
Маркировка с некоторые антитела такие как против стволовых клеток маркер Lgr5 и Paneth ячейке маркер CD24 оказались безуспешными с протоколами PFA, метанола или формальдегид/метанола 4%. Однако, фиксации organoids в матрице подвал с 1% ПФА в PBS с 0.1% моющего средства при комнатной температуре в результате никто маркировки для Lgr5 и CD24 (рис. 9).
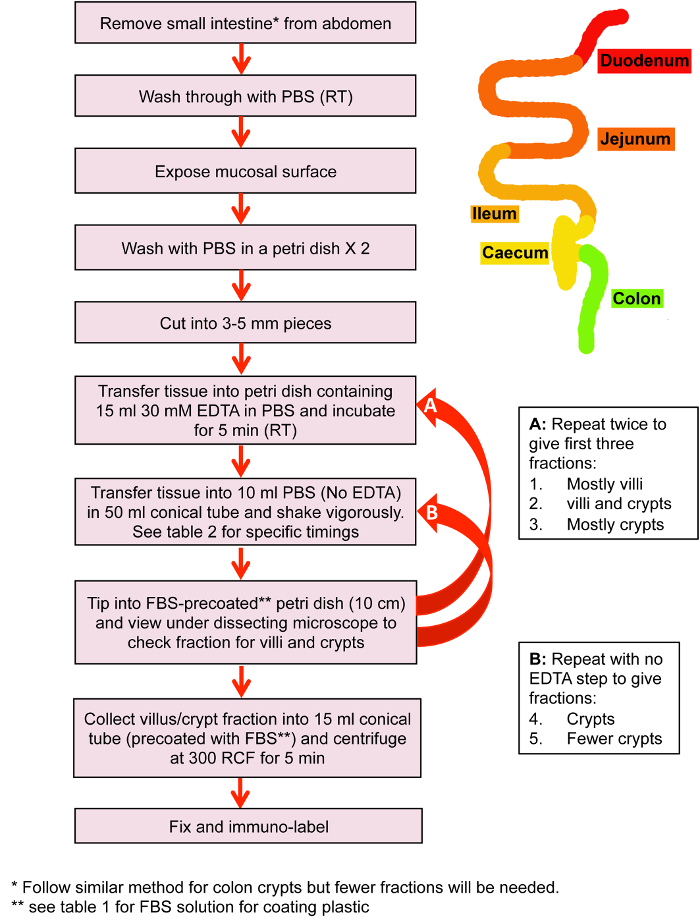
Рисунок 1: изоляции малых кишечные ворсинки и склепы. Схема из ключевых шагов в склепе изоляции до фиксации и иммуно маркировки и небольших кишечных ворсинок. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: изолированные ворсинки и склепы от мыши кишечник. Brightfield Микроскоп изображения кишечных фракций, показывая Вилли (большие стрелки) и склепы (маленькие стрелки). (A, B) Часть 2 содержит смесь ворсинки и склепов, и сохранение морфологии ворсинок и склеп проявляется в B. (C, D) Дробь 3 показывает изоляции склепы и отсутствие ворсинки и нетронутыми склепы, включая отделенные склеп в C. Масштаб баров = 500 мкм (A, C); 100 мкм (B, D). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: изолированные небольшие кишечных ворсинок и склеп фиксированной в формальдегид/метанола и иммуно меченых микротрубочек и актина. (A) схема эпителия ворсинок и склеп с различных типов клеток указано. Выделенные элементы указывают представителей регионов, отображаемого в B и C. (B, C) Конфокальный оптических разделы через часть ворсинок (B) и базальной склеп (C), изолированных от тонкой кишки с помощью 30 мм ЭДТА и фиксированной в формальдегид/метанола, промывают в PBS, содержащей 1% козьего сыворотки и 0,1% моющего средства, заблокированные в PBS содержит 10% козьего сыворотки и 0,1% моющего средства и помечены для микротрубочек с крыса моноклональные антитела анти тубулин (зеленый) и актина с кролика polyclonal антитела анти β-актина (красный). Хорошо сохранившиеся apico базальной связки микротрубочек очевидны в клетках ворсинок и склеп, и актина можно увидеть сосредоточены в регионе верхушечный, стоящих перед люмен (стрелка). Масштаб баров = 5 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
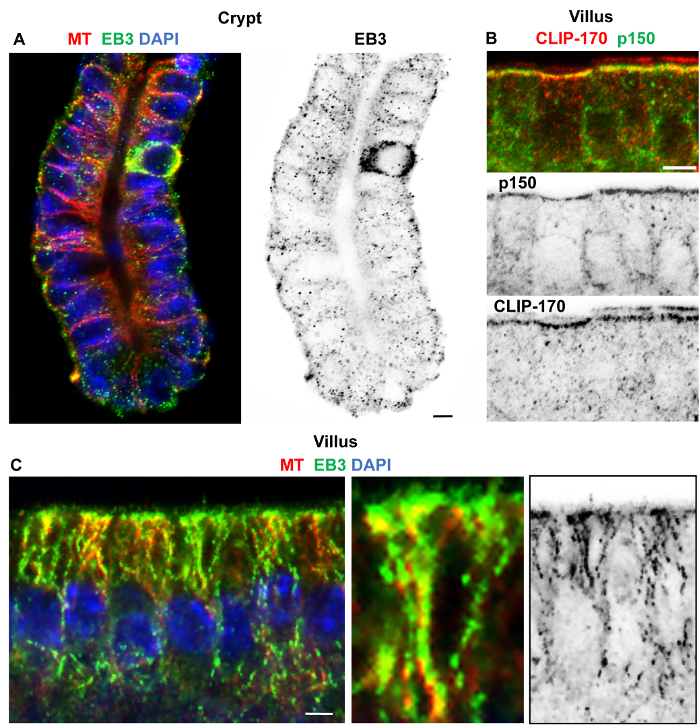
Рисунок 4: Изолированные небольшие кишечные крипты и Вилли фиксированной в формальдегид/метанола и иммуно меченых микротрубочек, EB3, p150клееныйи клип-170. Конфокальный оптических секции склеп и Вилли регионов изолированы от тонкой кишки с использованием 30 мм ЭДТА и зафиксированный в формальдегид/метанола, промывают в PBS, содержащие 10% козьего сыворотки и 0.1% моющего средства, заблокированные в PBS, содержащие 10% козьего сыворотки и 0.1% моющего средства, и иммуно помечены. (A) помечены кролика polyclonal α-тубулина антитела (красный) и крыса моноклональных антител EB3KT36 (зеленый) и витражи для ДНК с DAPI (синий) показаны apico базальной микротрубочки и EB3 комет. Перевернутый один канал изображения ясно показывает EB3 комет во всем клеток базальной склеп, предлагая хорошее сохранение динамики, а также стабильные микротрубочки. (B) ворсинок, эпителиальные клетки помечены кролика polyclonal антитела клип-170 (красный, см. также ссылка16) и мыши моноклональные p150клееный антитела (зеленый) показаны апикальной Сопредседатель локализации. Ниже приведены изображения Перевернутый один канал. (C) клетки ворсинок помечены кролика polyclonal α-тубулина антитела (красный) и крыса моноклональные антитела EB3-KT36 (зеленый) и витражи для ДНК с DAPI (синий) показаны apico базальной микротрубочек с EB3 вдоль решетки. EB3 решетки Ассоциация выделяется увеличенного изображения в то время как перевернутый один канал изображения предлагает EB3 комет и решетки ассоциации. Масштаб баров = 5 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: изолированной толстой склеп фиксированной в метаноле, иммуно меченых ninein и E-Кадгерины и витражи с DAPI. Конфокальный оптическая часть базальной и усилительных транзита региона склепа изолированы от толстой кишки с помощью 3 мм ЭДТА и фиксированной в метаноле, промывают в PBS, содержащей 1% козьего сыворотки и 0.1% моющего средства и заблокировали в PBS, содержащие 10% козьего сыворотки и 0,1% моющего средства. Склеп был назван с кролика polyclonal ninein антител (Pep3, см. также ссылка8, красный) и мыши моноклональные антитела E-Кадгерины (зеленый) и витражи с DAPI (синий). Перевернутый одноканальный изображение показывает только ninein. На рисунке хорошо сохранившийся склеп с E-Кадгерины выявление наброски отдельных клеток и ninein сосредоточены на апикальной большое. Он предлагает хорошее проникновение фиксатором и антител и сохранение антигенностью. Шкалы бар = 5 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6: развитие органоид, фиксации и иммуно маркировки изолированных organoids. (A) этап контраст фото показаны различные стадии развития органоид из клеток агрегатов кисты с Бад посвящения и полностью сформирован organoids с доменами, крипта и ворсинок.(FB–) Конфокальный оптических разделы через organoids изолированы от подвала матрицы с помощью решения восстановления клеток при 4 ° C (10 мин) следуют фиксации формальдегида/метанола, промывание в PBS, содержащие 10% козьего сыворотки и 0.1% моющего средства, блокирование в PBS, содержащие 10% козий сыворотки и 0,1% моющего средства и иммуно маркировки микротрубочек, β-катенина и EB1. (B) киста органоид помечены микротрубочек (синий) и β-Катенин (красный) выявление сохранение хорошего микротрубочек и маркировки в большинстве клеток. (C) собственный apico базальной микротрубочек очевидны в эти увеличенные эпителиальных клеток от кисты органоид. (D) деления клеток, помечены для микротрубочек, показаны шпинделей, включая Астрал (динамический) микротрубочек (стрелка). (E, F) Ворсинок домен (E) и склеп домена (F) органоид регионы показаны некоторые EB1 маркировки вдоль решетки стабильные микротрубочки, особенно в ворсинок, в то время как очень немногие EB1 комет видны даже в пределах базальной склеп, предполагая, что dynamic микротрубочки не сохранились. Масштаб баров = 20 мкм (A); 2 мкм (D); 5 мкм (B, C, E-F). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 7: Organoids фиксированной в подвале матрицы в формальдегид/метанола и иммуно меченых микротрубочек и ninein. Конфокальный оптических разделы organoids фиксированной в формальдегид/метанола, промывают и заблокирован в PBS, содержащие 10% козьего сыворотки и 0.1% моющего средства и помечены оставаясь в матрице подвале. (CA–) Органоид кисты помечены микротрубочек (зеленый) и ninein (Pep3; ссылка8, красный) и витражи с DAPI (синий) показаны объединенного изображения в A и перевернутый один канал изображения для микротрубочек (B) и ninein (C). Изображения показывают apico базальной микротрубочки и локализации апикального ninein, предлагая очень хорошо структурных сохранение органоид и проникновением антител, а также очистка свободного антител. (D, E) Органоид с разработкой склеп фиксированной и помечены как указано выше и снова показаны Потрясающе структурных сохранения, маркировки и Очистка антител. Собственный apico базальной микротрубочки и апикального n КТВМ ninein Локализация является очевидным и подчеркивается в увеличенного изображения (E) в штучной упаковке региона в D. Масштаб баров = 10 мкм (A-D); 5 мкм (E). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 8: Organoids фиксированной в матрице подвал в метаноле и иммуно меченых микротрубочек и EB1. Конфокальный оптических разделы organoids фиксированной в метаноле, промывают и заблокирован в PBS, содержащие 10% козьего сыворотки и 0.1% моющего средства и помечены, оставаясь при этом в подвале матрицы. (A) киста домена с полностью развитой органоид помечены кролика polyclonal α-тубулина (красный) и мыши моноклональные антитела EB1 (зеленый), показаны apico базальной микротрубочек, шпиндели (стрелка) в два деления клеток и собственный EB1 комет. Очевидно, некоторые треппинга несвязанных EB1 антител. Однако наблюдается хорошая структурных сохранения и маркировки микротрубочек и EB1. Наличие EB1 комет предполагает, что динамические микротрубочек сохранились (A, Инвертировать). (B) изображение инвертированный органоид кисты региона показаны α-тубулина антитела маркировки с значительным антител в ловушке внутри окружающие подвале матрица (стрелка). Масштаб баров = 5 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 9: Organoids фиксированной в подвале матрицы в 1% PFA и иммуно меченых Lgr5 и CD24. Конфокальный оптических секции organoids фиксированной в подвале матрицы в 1% ПФА в PBS, содержащие 0,1% моющего средства, промывают в PBS с 1% козьего сыворотки и 0.1% моющего средства и помечены антител против Lgr5 и CD24. (A, B) Ниши стволовых клеток в пределах домена склеп показаны положительные Paneth клетки для CD24 (красный). Конфокальный и фазы контрастность изображения были объединены в A. B показывает, один канал CD24 маркировки. (C) стволовых клеток региона в пределах домена склеп показаны положительные Lrg5 стволовых клеток. Масштаб баров = 10 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Таблица 1: Хронология малых кишечные крипты и Вилли изоляции и фиксация. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Изоляция кишечника ткани
Изоляция малого кишечника склепы и ворсинки и толстой склепы предполагает, подвергая поверхность слизистой оболочки, лечение с ЭДТА решение ослабить ячейку контакты, фракционирование (встряхивания) и центрифугирования. Протокол изоляции представленных кишечных ворсинок/склеп был изменен от Belshaw et al. и Уайтхед и др. 17 , 18
Подвергая поверхность слизистой оболочки
Мы экспериментировали с целый ряд подходов к разоблачить поверхности слизистой оболочки желудочно-кишечного тракта в развитии этой процедуры. Классический подход является Эверт (поворот наизнанку) трубка, обычно в сегментах около 100 мм в длину, с помощью металлического стержня которое перехватывается в складку ткани на одном конце, а затем оставшиеся трубки скользнул через трубу19. Для мыши ткани идеально металлический стержень (2,4 мм) с закругленными кончиками. Этот подход имеет преимущество расширения поверхности слизистой оболочки, позволяя более широкого доступа к PBS и ЭДТА. Мы изначально используется этот подход, но переехал в резки трубки в короткой длины (около 5 см) и открытия каждой секции с рассечения ножницы, как это оказалось проще. Этот способ уместен, если только несколько кишечника требуется; но если больше животных должны были быть использованы в эксперименте затем устройство специально для резки открыть трубку продольно, как описано в Йонеды et al. 14 будет более эффективным.
Отряд ворсинки и склепы из мышечных слоя
Сначала мы использовали 3 мм ЭДТА в PBS и относительно длительный инкубационный период до 60 мин ослабить поверхности слизистой оболочки из основной ткани17,18. На этой концентрации ЭДТА мы обнаружили, что время инкубации 30 минут было достаточно, чтобы ослабить склепы из мыши кишки. Однако для изоляции склеп/ворсинок тонкой кишки мы стараемся, используя более концентрированной ЭДТА за более короткое время, которое оказалось эффективным подходом. Все последующие работа была проведена с ткани, извлеченные с помощью метода ЭДТА 30 мм, создания соответствующих фракций ворсинки или склепы. Для склепы мы обычно объединяют фракции 3-5 до фиксации, но важно проверить, являются ли эти соответствующих фракций как таймингов будет зависеть от ряда факторов, таких как положение вдоль желудочно-кишечного тракта, возраст мышь, воспаление, Предыдущая диета , и т.д. аналогичным образом, продолжительность времени, ткани необходимо быть поколеблен после ЭДТА лечение эффективным могут отличаться в различных условиях. В результате получается фракции изолированных ткани, содержащие смесь ворсинки и склепы или главным образом ворсинки или склепы (рис. 2). Как есть нет ворсинки в толстой кишке, склеп добыча может быть достижимыми в один шаг путем встряхивания ткани в тубе 30 s. Эти фракции можно затем фиксированной и обрабатываются для иммуно маркировки.
Изоляция кишечных organoids из подвала матрицы
Изоляция organoids с подвале матрица куполов можно достичь с помощью решения восстановления клеток. Решение работает на depolymerizing матрице загущенное подвал, но температура должна быть 2-8 ° C. Предостережение что динамический микротрубочки не могут быть сохранены. Таким образом, для иммуно маркировки динамических микротрубочек и + советы как EBs клеток, восстановления от подвала матрицы до фиксации не рекомендуется. Однако большинство микротрубочек в дифференциации органоид клетки являются относительно стабильными, и они были сохранены (рис. 6). Он также работал хорошо для иммуно маркировки centrosomal и соединительной белков, а также ячейки маркеры.
Фиксация протоколы
Формальдегид (свежеприготовленные из PFA) является относительно быстрого действия фиксатором, который формирует реверсивные cross-links, и 4% PFA работает хорошо для, например, в иммуно маркировки микротрубочек и гамма тубулина и окрашивания нитей актина с Фаллоидин. Более разбавлять PFA решения, такие как 1% хорошо работала для иммуно маркировки например, маркером стволовых клеток маркеры Lgr5 и Paneth ячейки CD24 в склепе ниши стволовых клеток, в то время как более высокие концентрации PFA не работает.
Добавление глютаральдегид дает лучшее сохранение микротрубочек и так называемые PHEMO фиксации, которая состоит из смеси 3,7% PFA, глютаральдегид 0,05% и 0,5% моющего средства в PHEMO буфера (68 мм трубы, мм 25 HEPES, 15 мм EGTA и 3 мм MgCl2)2 без ущерба для антигенностью дает отличную сохранность микротрубочек. Он также хорошо работает для иммуно маркировки гамма тубулина, β-катенина и E-Кадгерины и окрашивания нитей актина с Фаллоидин. Однако в 3D ткани и органоид культур, PHEMO фиксации несогласованные результаты и поэтому не использовался.
Метанол является коагулянта фиксатором, который дает относительно хорошее проникновение и стремится сохранить антигенностью. Фиксация с 100% метанола (-20 ° C) вводит некоторые усадка, дает умеренный морфология сохранение и работает микротрубочек, + советы и много centrosomal антител, включая ninein в 2D клеточных культур. Однако некоторые organoids рухнул при использовании этого метода фиксации. Кроме того проникновение антител через весь склепы, ворсинки или organoids первоначально было проблемой, но добавление 0,1% моющего средства промывочный раствор и длительное Стиральная достигнуты лучшие результаты.
Сочетание формальдегида и метанола ранее использовалось Роджерс и др. 20 -иммуно лейбл EB1 в дрозофила. Протокол фиксации на основе смеси формальдегида и метанола, поэтому был разработан для кишечных тканей и organoids, основанные на 3% формальдегида и 97% метанола охлажденным до-20 ° C, но пропуск карбонат натрия 5 мм из смеси, которая использовалась Роджерс и др. 20 Кроме того, образцы были установлены в холодильнике при температуре-20 ° C. Это работает особенно хорошо для маркировки immuno + советы, например КЛИПА-170 и EBs, но доказано также отлично подходит для фиксации и иммуно маркировки микротрубочек и актина в ткани и 3D organoids. Очень хорошо структурных сохранение было очевидным и антигенностью сохранилось несколько белков цитоскелета и связанных с ними, а также centrosomal белков, таких как гамма тубулина и ninein, хотя маркировки для ninein более последовательно работал с метанолом Фиксация.
Раскрытие информации
Авторы заявляют не конкурирующих финансовых интересов.
Благодарности
Авторы благодарят Пол Томас за микроскопом консультации и помощь. Эта работа, здесь была поддержана СИББН (Грант нет. BB/J009040/1 м.м.м. и Т.У).
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma | D8537-500ML | washing and PFA |
| Cell Recovery Solution | Corning | 354253 | isolate organoids |
| lobind microcentrifuge tubes | Eppendorf | 30108116 | prevent cells sticking |
| 0.5 M EDTA solution, pH 8.0 | Sigma | 03690-100ML | Crypt isolation |
| 70 μm cell strainer | Fisher Scientific | 11517532 | Isolate crypts from villi |
| Triton X-100 | Sigma | T8787 | detergent |
| goat serum | Sigma | G6767 | blocking agent |
| Fetal Bovine Serum (FBS) | Sigma | used as non-stick agent | |
| Paraformaldehyde, 4% in PBS | Alfa Aesar | J61899 | fixative |
| Formaldehyde solution (36.5–38% in H2O) | Sigma | F8775 | used as fixative |
| Methanol 99.9% Analytical grade | Fisher | M/4000/17 | used as fixative |
| MaxFluor Mouse on Mouse Immunofluorescence Detection Kit | Maxvision Biosciences | MF01-S | commercial immunofluorescence kit; to reduce non-specific labelling |
| Rotator SB2 or SB3 | Stuart | microcentrifuge tube rotator | |
| Sodium citrate | antigen retrieval | ||
| Hydromount | National Diagnostics | HS-106 | mountant |
| DABCO - 1,4-diazabicyclo[2.2.2]octane | Sigma | D27802 | anti-fade agent |
| Permanent Positive Charged, Pre-Washed, 90 Degree Ground Edges | Clarity | N/C366 | slides |
| Glass coverslip - thickness no. 1, 22 x 50 mm | Clarity | NQS13/2250 | coverslips |
| Matrigel | Corning | 356231 | Basement matrix for 3D organoid culture |
| 50 mL conical tubes | Sarstedt | 62.547.254 | for processing tissue/organoids |
| 15 mL conical tubes | Sarstedt | 62.554.502 | for processing tissue/organoids |
| 1.5 mL LoBind tubes | Eppendorf | 30108051 | for isolated organoids |
| Mouse monoclonal anti-E-cadherin antibody | BD Biosciences | 610181 | primary antibody 1:500 |
| Rat monoclonal anti-tubulin YL1/2 antibody | Abcam | ab6160 | primary antibody 1:100 |
| Rabbit alpha-tubulin antibody | Abcam | ab15246 | primary antibody 1:100 |
| Rabbit anti-beta-actin antibody | Abcam | ab8227 | primary antibody 1:100 |
| Rat monoclonal anti-p150Glued antibody | BD Bioscience | 610473/4 | primary antibody 1:100 |
| Rat monoclonal EB3KT36 antibody | Abcam | ab53360 | primary antibody 1:200 |
| Mouse monoclonal EB1 antibody | BD Bioscience | 610535 | primary antibody 1:200 |
| Rabbit anti-Lgr5 antibody | Abgent | AP2745d | primary antibody 1:100 |
| Dylight anti-rat 488 | Jackson | 112545167 | seconday antibody 1:400 |
| Dylight anti-mouse 488 | Jackson | ST115545166 | seconday antibody 1:400 |
| Dylight anti-rabbit 647 | Jackson | 111605144 | seconday antibody 1:400 |
Ссылки
- Bacallao, R., Antony, C., Dotti, C., Karsenti, E., Stelzer, E. H., Simons, K. The subcellular organization of Madin-Darby canine kidney cells during the formation of a polarized epithelium. J Cell Biol. 109 (6 Pt 1), 2817-2832 (1989).
- Bellett, G., et al. Microtubule plus-end and minus-end capture at adherens junctions is involved in the assembly of apico-basal arrays in polarised epithelial cells. Cell Motil Cytoskeleton. 66 (10), 893-908 (2009).
- Mogensen, M. M., Tucker, J. B., Mackie, J. B., Prescott, A. R., Nathke, I. S. The adenomatous polyposis coli protein unambiguously localizes to microtubule plus ends and is involved in establishing parallel arrays of microtubule bundles in highly polarized epithelial cells. J Cell Biol. 157 (6), 1041-1048 (2002).
- Mogensen, M. M., Tucker, J. B., Stebbings, H. Microtubule polarities indicate that nucleation and capture of microtubules occurs at cell surfaces in Drosophila. J Cell Biol. 108 (4), 1445-1452 (1989).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Curr Opin Cell Biol. , (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- van der Flier, L. G., Clevers, H. Stem cells, self-renewal, and differentiation in the intestinal epithelium. Annu Rev Physiol. 71, 241-260 (2009).
- Goldspink, D. A., et al. Ninein is essential for apico-basal microtubule formation and CLIP-170 facilitates its redeployment to non-centrosomal microtubule organizing centres. Open Biol. 7 (2), (2017).
- Verissimo, C. S., et al. Targeting mutant RAS in patient-derived colorectal cancer organoids by combinatorial drug screening. Elife. 5, (2016).
- Young, M., Reed, K. R. Organoids as a Model for Colorectal Cancer. Curr Colorectal Cancer Rep. 12 (5), 281-287 (2016).
- Andersson-Rolf, A., et al. One-step generation of conditional and reversible gene knockouts. Nat Methods. 14 (3), 287-289 (2017).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Goldspink, D. A., et al. The microtubule end-binding protein EB2 is a central regulator of microtubule reorganisation in apico-basal epithelial differentiation. Journal of Cell Science. 126 (17), 4000-4014 (2013).
- Yoneda, M., Molinolo, A. A., Ward, J. M., Kimura, S., Goodlad, R. A. A Simple Device to Rapidly Prepare Whole Mounts of the Mouse Intestine. J Vis Exp. (105), e53042 (2015).
- Andersson-Rolf, A., Fink, J., Mustata, R. C., Koo, B. K. A video protocol of retroviral infection in primary intestinal organoid culture. J Vis Exp. (90), e51765 (2014).
- Coquelle, F. M., et al. LIS1, CLIP-170's key to the dynein/dynactin pathway. Mol Cell Biol. 22 (9), 3089-3102 (2002).
- Belshaw, N. J., et al. Patterns of DNA methylation in individual colonic crypts reveal aging and cancer-related field defects in the morphologically normal mucosa. Carcinogenesis. 31 (6), 1158-1163 (2010).
- Whitehead, R. H., VanEeden, P. E., Noble, M. D., Ataliotis, P., Jat, P. S. Establishment of conditionally immortalized epithelial cell lines from both colon and small intestine of adult H-2Kb-tsA58 transgenic mice. Proc Natl Acad Sci U S A. 90 (2), 587-591 (1993).
- Hamilton, K. L., Butt, A. G. Glucose transport into everted sacs of the small intestine of mice. Adv Physiol Educ. 37 (4), 415-426 (2013).
- Rogers, S. L., Rogers, G. C., Sharp, D. J., Vale, R. D. Drosophila EB1 is important for proper assembly, dynamics, and positioning of the mitotic spindle. J Cell Biol. 158 (5), 873-884 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены