Method Article
Immuno-fluoreszierende Etikettierung von Mikrotubuli und Centrosomal Proteine in Ex Vivo Darmgewebe und 3D In-vitro- Darm Organellen
In diesem Artikel
Zusammenfassung
Wir präsentieren Protokolle zur Isolierung der intestinalen 3D-Strukturen aus in-Vivo -Gewebe und in-vitro- Keller-Matrix eingebettet, Organellen, und Detail verschiedene Fixierung und Färbung Protokolle für Immuno-Kennzeichnung von Mikrotubuli optimiert, centrosomal und Knoten Proteine sowie Handy-Marken einschließlich des Stammzell-Proteins Lgr5.
Zusammenfassung
Das Aufkommen von 3D in-vitro- Organellen, die in Vivo Gewebearchitektur und Morphogenese imitieren hat die Fähigkeit, wichtige biologische Fragestellungen in Zell- und Entwicklungsbiologie stark vorangetrieben. Darüber hinaus verspricht Organellen zusammen mit technischen Fortschritten in gen bearbeiten und virale gen Lieferung, medizinische Forschung und Entwicklung neuer Medikamente zur Behandlung von Krankheiten zu gelangen. Organellen in Vitro im Keller Matrix gewachsen bieten leistungsstarke Modellsysteme für das Studium, das Verhalten und die Funktion von verschiedenen Proteinen und eignen sich gut für live-Aufnahmen von Leuchtstoff-markierten Proteine. Allerdings ist zur Gründung der Ausdruck und die Lokalisierung der körpereigene Proteine in Gewebe Ex Vivo und in Vitro Organellen wichtig, das Verhalten der tagged Proteine zu überprüfen. Zu diesem Zweck haben wir entwickelt und modifiziert Gewebe Isolierung, Fixierung und Immuno-Kennzeichnung Protokolle für die Lokalisierung von Mikrotubuli, centrosomal und damit verbundenen Proteine im Darmgewebe Ex Vivo und in Vitro Darm Organellen. Das Ziel war, dass das Fixiermittel, 3D-Architektur der Organellen/Gewebe zu bewahren und auch gleichzeitig Antikörper Antigenität und ermöglicht gute Penetration und Räumung von Fixativ und Antikörper. Kälteexposition depolymerizes alle, aber stabilen Mikrotubuli und dies war ein Schlüsselfaktor, wenn Sie die verschiedenen Protokolle ändern. Wir fanden, dass die Erhöhung der Ethylenediaminetetraacetic Säuren (EDTA) Konzentration von 3 mM bis 30 mM effiziente Ablösung der Zotten und Krypten im Dünndarm gab, während 3 mM EDTA für Kolon Krypten ausreichte. Die entwickelten Formaldehyd/Methanol-Fixierung-Protokoll gab sehr guten baulichen Erhaltung Beibehaltung auch Antigenität für wirksame Kennzeichnung von Mikrotubuli, Actinfilamente und Ende-Bindeproteine (EB). Er arbeitete auch für das centrosomal Protein-Ninein, obwohl das Methanol-Protokoll konsequenter gearbeitet. Wir ergab weiter, dass Fixierung und Immuno-Kennzeichnung der Mikrotubuli und damit verbundenen Proteine mit Organellen von isoliert oder im Keller Matrix bleibt erreicht werden konnte.
Einleitung
Bildung von Epithelien mit Apico-basale Polarität ist ein fundamentaler Prozess in der Entwicklung und beinhaltet eine dramatische Reorganisation von Mikrotubuli und centrosomal Proteine. Eine radiale Mikrotubuli Array ausgehend von einer zentral gelegenen centrosomal Mikrotubuli Organisation Zentrum (MTOC) ist prominent in vielen tierischen Zellen, und das ist gut geeignet für relativ flache Zellen. Im Gegensatz dazu montieren säulenartige Epithelzellen, wie diejenigen des Darms, nicht Radial transzelluläre Mikrotubuli-Arrays, die die Form und die spezielle Funktionen dieser Zellen besser zu unterstützen. Diese dramatische Reorganisation der Mikrotubuli wird durch den Umzug in die Spitze und apikalen nicht centrosomal MTOCs (n-MTOCs) bilden, Centrosome erreicht, die verantwortlich für die Verankerung des transzelluläre Mikrotubuli1,2 , 3 , 4 , 5.
Ein Großteil unseres Wissens über epithelialen Differenzierung und der damit verbundenen Mikrotubuli Reorganisation kommt aus Untersuchungen von 2D in Vitro Zellschichten, die die Gewebearchitektur in Vivo nicht angezeigt werden. Entwicklung von 3D in Vitro organoide Kulturen, vorangegangen durch Clevers und Kollegen6, stellt einen großen technologischen Fortschritt dar, wie sie in Vivo Architektur und Entwicklung imitieren. Eine Hierarchie der epithelialen Differenzierung spiegelt sich im Darm; Stammzellen am unteren Krypten geben Anlass zu unreif Transit verstärkt Zellen, die sich vermehren und allmählich zu unterscheiden, da sie die Gruft auf dem kleinen Darm Villus oder Kolon Oberfläche wandern wo sie vollständig vor unterschieden werden Schuppen Sie in das Lumen-7. Wichtig ist, ist dies im Darm Organellen repliziert, wo Zellen aus der Stammzellnische bildende Zysten wuchern, die anschließend Krypta-wie Knospen mit Stammzellen an der Unterseite und Differenzierung allmählich Fortschritte auf dem Weg der Zyste Region erzeugen, die Villus-wie8wird. Der Darm organoide stellt daher ein leistungsfähiges Modell, nicht nur Mikrotubuli und centrosomal Reorganisation bei epithelialen Differenzierung aber zahlreiche andere Proteine, sowie bietet eine ideale Plattform für das Screening von Medikamenten und Lebensmitteln zu studieren Verbindungen des therapeutischen Potentials nutzen9,10.
Organellen sind gut geeignet für live-Aufnahmen von Leuchtstoff-markierten Proteine und beide Knock-in und Knock Out Organellen mit CRISPR/Cas9 gen11,12Bearbeitung erzeugt werden können. Jedoch ist es wichtig, vor allem um das Verhalten der tagged Proteine überprüfen, zur Gründung der Ausdruck und die Lokalisierung der körpereigene Proteine untersucht werden. Immuno-Beschriftung 3D Organellen gewachsen in Keller Matrix oder Ex Vivo isolierte Gewebe ist komplexer als Zellen in Kultur Gerichte in 2D angebaut. Die Fixierung-Protokoll muss die zarte 3D Architektur der Organellen zu erhalten Beibehaltung noch Antikörper Antigenität (d.h. die Epitope für die Bindung von Antikörpern). Beispielsweise 4 % Paraformaldehyd (PFA) wird allgemein als ein Fixiermittel verwendet, aber während es ein relativ schnelles Handeln Fixiermittel ist und guten morphologische Erhaltung gibt, nach unserer Erfahrung es häufig führt zu Verlust der Antigenität und eignet sich nicht für viele centrosomal Antikörper. Die Fähigkeit von Fixativ und Antikörpern 3D Strukturen und Gewebe eindringen sollte auch berücksichtigt werden. Zu diesem Zweck haben wir modifiziert und entwickelten Protokolle für Gewebe isoliert und indirekte Immuno-Kennzeichnung der 3D in Vitro Organellen und Ex Vivo isoliert Darmgewebe. Wir beschreiben, wie kleine Darm Krypten und Zotten und Kolon Gewebe zu isolieren, und beinhalten ein Protokoll für die Isolierung von 3D Organellen als Alternative zur Festsetzung und Immuno-Kennzeichnung innerhalb der Keller-Matrix. Wir präsentieren Ihnen drei Alternativen Fixierung-Protokolle für die Immuno-Kennzeichnung von Mikrotubuli und centrosomal, wie Ninein, und Mikrotubuli Plus-Ende Tracking-Proteine (+ Tipps), wie die EB Proteine und CLIP-170 (siehe auch Referenzen8, 13). Wir diskutieren auch die vor- und Nachteile jedes Protokoll zugeordnet.
Protokoll
Alle hier beschriebene Methoden wurden nach der University of East Anglia Institutslizenz Richtlinien durchgeführt.
1. Isolierung von Darmgewebe
- Isolierung von Kolon Krypten für Immuno-Beschriftung (siehe Abbildung 1: Schematische)
- Einschläfern die Maus (mit CO2 Erstickung) und entfernen Sie den Doppelpunkt (beginnend mit dem Blinddarm und Extrahieren von kaudal) mit Scheren und Pinzetten14sezieren.
- Spülen Sie den Inhalt des Dickdarms mit Phosphat gepufferte Kochsalzlösung (PBS) mit einer Glaspipette mit Gummiball. PBS: Natriumchlorid (8,0 g/L), Kaliumchlorid (0,2 g/L), Binatrium Wasserstoff Phosphat (1,15 g/L) und Kalium Dihydrogen Phosphat (0,2 g/L), bei pH 7,3.
- Festhalten Sie ein Ende des Kolon Rohr und mit einem Metallstab (2,4 mm Durchmesser) oder zum Jahresende eine Glaspipette, gleiten sanft das Gewebe über den Stab/Pipette so everting das Kolon Gewebe, so dass das Epithel jetzt auf der Außenseite ist.
Hinweis: Wenn dies nicht möglich ist dann öffnen des Dickdarms mit Schere und Schnitt in 5 mm Stücke. - Übertragen Sie die ausladenden Doppelpunkt oder Stücke auf eine 50 mL konische Röhrchen mit 40 mL PBS.
- Kehren Sie den Schlauch mehrmals auf weiter entfernen Darminhalt, Schleim usw.
- Der Doppelpunkt/Stück auf 40 mL von 3 mM EDTA mit PBS-Puffer übertragen und bei Raumtemperatur (RT) für 15 min inkubieren.
Hinweis: Verdünnen Sie 0,5 M EDTA pH 8.0 Lager mit PBS. - Schütteln Sie, um den Schleim zu entfernen und den Doppelpunkt/Stücke auf eine 50 mL konische Röhrchen mit frisch 40 mL von 3 mM EDTA mit PBS-Puffer übertragen. 35 min bei RT inkubieren
- Der Doppelpunkt/Stücke auf 10 mL PBS in einem 50 mL konische Rohr übertragen und schütteln Sie kräftig für 30 s Krypten (Krypta Bruch) zu veröffentlichen.
- Entfernen Sie den Doppelpunkt/Stücke aus der Tube und setzen Sie wieder 3 mM EDTA, für den Fall, dass weitere Isolierung erforderlich ist. Zentrifugieren Sie die restlichen Krypta Bruchteil bei 300 X g für 5 min.
- Entfernen Sie 5 mL des Überstands und Aufschwemmen der Krypta Pellet in den verbleibenden 5 mL Volumen.
- Unter einem Stereomikroskop mit Zoom (50-100 X Vergrößerung) zu prüfen auf Vorhandensein von Kolon Krypten beobachten.
Hinweis: Es gibt keine Krypten vorhanden dann Doppelpunkt/Stücke in 3 mM EDTA mit PBS-Puffer für weitere 30 min inkubieren und dann wiederholen Sie Schritte 1.1.8 - 1.1.11. - Zentrifugieren Sie die Krypta Bruchteil bei 300 X g für 5 min.
- Entfernen Sie alle Überstand zum Abrufen eines Krypta Pellets und gehen sofort zu einer Fixierung (Abschnitt 3).
- Isolierung der kleinen Darm Krypten und Zotten für Immuno-Kennzeichnung (Abbildung 2)
- Einschläfern Sie Maus (mit CO2 Erstickung) und entfernen Sie den Dünndarm (proximalen Duodenum zu terminal Ileum) mit Scheren und Pinzetten14sezieren.
Hinweis: zur Ansicht verschiedene Abschnitte des Dünndarms dann zu diesem Zeitpunkt zu trennen und separat zu behandeln. Siehe Abbildung 1 und Tabelle 1 für ein Ablaufdiagramm und Timings. - Spülen Sie den Inhalt des Dünndarms mit PBS mit einer Glaspipette mit Gummiball.
- Schneiden Sie der Dünndarm mit sezierenden Schere auf und in 15 mL PBS in einer Petrischale.
- Waschen Sie vorsichtig den Darm mit PBS-Puffer luminalen Inhalte zu entfernen, während die Schleimhautoberfläche nicht zu beschädigen. Übertragen Sie das Gewebe auf eine frische Petrischale und wiederholen Sie PBS waschen zu.
- Geschnitten Sie Darm in 3-5 mm Stücke und mit einem 100 mm Petrischale mit 15 mL 30 mM EDTA mit PBS-Puffer übertragen Sie und inkubieren Sie für 5 min bei RT. Alternativ in 3 mM EDTA in PBS 30 min inkubieren.
- Teil 1 (Villi Isolierung): übertragen Sie die intestinale Stücke in 10 mL PBS in einer 50 mL konische Rohr, schütteln energisch für 10 s und in einem 100 mm Petrischale gießen. Überprüfen Sie den Bruch für isolierte Zotten unter einem Stereomikroskop. In diesem Stadium meist Zotten sollte vorhanden sein, aber dies kann variieren zwischen Isolationen.
Hinweis: Zur Vermeidung von isolierten Zotten/Krypten festhalten an Kunststoff, Petrischalen und Röhrchen vorbeschichtete mit fetalen Bovine Serum (FBS) sollte. FBS in Gerichte / Schläuche gießen und sofort zu entfernen. Siehe Tabelle 1 für Timing-Guides für jede Fraktion. - Die intestinale Stücke zurück auf 30 mM EDTA in PBS überweisen und 5 min inkubieren. Während diese Inkubation sammeln Sie Bruchteil 1 in einem 15 mL konische Rohr (vorbeschichteten mit FBS) und Zentrifuge bei 300 X g für 5 Minuten.
- Teil 2: Übertragen Sie Darm Stücke auf eine 50 mL konische Röhrchen mit 10 mL PBS, schütteln energisch für 20 s, und gießen Sie dann in eine 100 mm Petrischale. Überprüfen Sie den Bruch unter die Lupe genommen. In der Regel zu diesem Zeitpunkt eine Mischkultur aus Zotten und Krypten sind (Abbildung 2A) zu präsentieren.
- Intestinale Stücke zurück auf 30 mM EDTA in PBS überweisen und weitere 5 min inkubieren. Während diese Inkubation pellet Teil 2 in einem 15 mL konische Röhrchen (vorbeschichteten mit FBS) bei 300 X g für 5 min. Überstand von Fraktionen 1 und 2 entfernen, ohne das Pellet zu stören und gehen Sie sofort zu einer Fixierung (Schritt 3).
- Teil 3 (Krypta Isolierung): übertragen Sie die intestinale Stücke in 10 mL PBS in 50 mL-Tube, Shake für 20 s und in einem 100 mm Petrischale gießen. Überprüfen Sie Bruch unter die Lupe genommen. In diesem Stadium wird der Bruch überwiegend Krypten (Abb. 2 b) enthalten.
- Teil 4: Übertragen der intestinalen Stücke in 10 mL PBS, schütteln für 20 s und in einem 100 mm Petrischale gießen. Überprüfen Sie Bruch unter die Lupe genommen. In diesem Stadium sollte nur Krypten vorhanden sein.
- Teil 5: Übertragen Sie die intestinale Stücke in 10 mL PBS, schütteln für 20 s und in einem 100 mm Petrischale gießen. Überprüfen Sie Bruch unter die Lupe genommen. In dieser Phase werden in der Regel sehr wenige Krypten extrahiert. Wenn mehr als ein paar Krypten extrahiert sind, fahren Sie mit einem 6th Bruchteil.
Hinweis: Wenn eine reine Krypta Bevölkerung (z. B. für organoide Generation) gewünscht wird, verwenden Sie ein 70 µm Zelle Sieb dann intakten Zotten aus der Gruft angereicherte Fraktion zu entfernen. - Bruchteile von 3-5 in separaten 15 mL konische Röhrchen und Zentrifuge bei 300 X g für 5 min zu sammeln.
- Überprüfen Sie die Pellets Brüche 3 - 5 und entfernen Sie die Überstände zu, ohne die Pellets zu stören, und gehen Sie sofort zu einer Fixierung (Abschnitt 3).
- Einschläfern Sie Maus (mit CO2 Erstickung) und entfernen Sie den Dünndarm (proximalen Duodenum zu terminal Ileum) mit Scheren und Pinzetten14sezieren.
2.Isolierung der intestinalen Organellen von Keller Matrix Domes in 24-Well-Platten
Hinweis: Die Bildung von Organellen im Keller Matrix Kuppeln wurde an anderer Stelle12beschrieben.
- Mantel-Brunnen mit Keller Matrix Kuppel nach den Anweisungen des Herstellers.
- Wash-Brunnen mit Keller Matrix Kuppeln mit 500 µL PBS.
- Jedes gut kalt 250 µL Zelle-Recovery-Lösung (4 ° C) hinzufügen (siehe Tabelle der Materialien).
Hinweis: Die kalte Zelle-Recovery-Lösung wird alles andere als stabil Mikrotubuli depolymerisieren. - Kratzen Sie die Keller-Matrix-Kuppeln mit einer Mikropipette P1000 pipette rauf und runter in den Brunnen zur Trennung und entfernen Sie die Keller-Matrix aus Kunststoff.
- Den Überstand in 1,5 mL geringe Bindung Mikrozentrifugenröhrchen zu sammeln.
- Invertieren Sie der 1,5 mL geringe Bindung Tube mehrmals und unter dem Mikroskop zu überprüfen Sie, ob die Organellen isoliert wurden und sind frei bewegen und nicht in Klumpen. Halten Sie das Rohr unter einem Stereomikroskop und Ansicht unter niedrig (50 X) Vergrößerung.
- Pellet-die Organellen durch Zentrifugation bei 1.000 x g für 5 min bei RT
- Entfernen Sie das Recovery-Reagenz und gehen Sie sofort zu einer Fixierung (Schritt 3).
(3) Fixierung der isolierten Darmgewebe und Organellen
- Methanol-Fixierung
- Aufschwemmen der isolierten Darm Krypta/Villus Bruch in 10 mL und Organellen in 1 mL Methanol bei-20 ° C.
- Die Krypten/Zotten/Organellen bei-20 ° C im Gefrierschrank für 15 min inkubieren und Tube(n) alle 5 min. zu invertieren.
- Pellet-die Krypten, Zotten/Organellen durch Zentrifugation bei 1.000 x g für 5 Minuten.
- Das Methanol zu entfernen und Waschlösung (1 mL für Organellen und 10 mL für isolierte Krypta/Villus Brüche) hinzufügen. Die Waschlösung kann entweder der PBS mit 1 % Serum oder PBS mit 0,1 % Waschmittel und 1 % Serum bestehen.
Hinweis: Verwendung von derselben Art wie die von der Sekundärantikörper Serum. Wenn die sekundäre Antikörper bei Ziege generiert wurden dann z. B. Ziegenserum. - Sofort Zentrifugieren der Krypten/Zotten/Organellen bei 1.000 x g für 5 min zu Pellets.
- Entfernen Sie die Waschlösung und Aufschwemmen der Krypten, Zotten/Organellen in frische Reinigungslösung.
- Legen Sie auf ein Rohr-Rotator mit der Geschwindigkeit bis 20 u/min eingestellt. Waschen Sie die Zellen für eine Gesamtmenge von 1 h, Pelletierung der Krypten, Zotten/Organellen durch Zentrifugieren (1.000 x g für 5 min) alle 15 min. und die Waschlösung zu ersetzen.
Hinweis: Wenn ein Rohr Rotator nicht verfügbar ist dann invertieren Sie die Rohre manuell alle 5 min um die isolierten Kulturen aufzuwirbeln.
- Formaldehyd/Methanol-Fixierung
Hinweis: Behandeln Sie die Fixiermittel und Formaldehyd unter einem Abzug.- Aufschwemmen der isolierten Krypten/Zotten in 10 mL oder Organellen in 1 mL von-20 ° C Fixativ Lösung (9,2 mL Methanol mit 800 µL Formaldehyd-Lösung).
- Beheben Sie die Krypten, Zotten/Organellen bei-20 ° C im Gefrierschrank für 15 min und invertieren Sie das Rohr alle 5 min. zu.
- Pellet-die Krypten, Zotten/Organellen durch Zentrifugation bei 1.000 x g für 5 Minuten.
- Entfernen Sie das Formaldehyd/Methanol zu und fügen Sie Waschlösung (1 mL für Organellen oder 10 mL für isolierte Krypten/Villus Brüche). Die Waschlösung kann entweder der PBS mit 1 % Ziegenserum oder PBS mit 0,1 % Waschmittel und 1 % Serum bestehen.
- Zentrifugieren Sie bei 1.000 x g für 5 min zu die Krypten, Zotten/Organellen Pellets.
- Entfernen Sie die Waschlösung und in frische Waschlösung Aufschwemmen.
- Legen Sie auf ein Rohr-Rotator mit der Geschwindigkeit bis 20 u/min eingestellt. Waschen Sie die Zellen für eine Gesamtmenge von 1 h, Pelletierung der Krypten, Zotten/Organellen durch Zentrifugieren (1.000 x g für 5 min) alle 15 min. und die Waschlösung zu ersetzen.
- PFA-Fixierung
Achtung: PFA Pulver und Lösungen sollten unter einem Abzug gehandhabt werden.
Hinweis: In den meisten Fällen 4 % PFA mit PBS-Puffer verwendet, ist aber je nach Erhaltung der Antikörper Antigenität, niedrigere Konzentrationen verwendet werden.- Aufschwemmen die isolierten gebeizte Krypten/Zotten in 10 mL 4 % PFA 1 h bei RT inkubieren und den isolierten pelleted Organellen in 1 mL 4 % PFA und 30 min inkubieren. Kehren Sie in beiden Fällen die Tube(n) alle 10 Minuten.
- Pellet-die Krypten, Zotten/Organellen durch Zentrifugation bei 1.000 x g für 5 Minuten.
- Entfernen der PFA und Waschlösung (1 mL für Organellen und 10 mL für isolierte Krypten/Zotten). Die Waschlösung besteht aus PBS mit 0,1 % Waschmittel und 1 % Serum.
- Zentrifugieren Sie bei 1.000 x g für 5 min zum pellet-Krypten, Zotten/Organellen.
- Entfernen Sie die Waschlösung und in frische Waschlösung Aufschwemmen.
- Legen Sie auf ein Rohr-Rotator mit Geschwindigkeit bis 20 u/min eingestellt. Waschen Sie die Zellen für eine Gesamtmenge von 1 h, Pelletierung der Krypten, Zotten/Organellen durch Zentrifugieren (1.000 x g für 5 min) alle 15 min. und die Waschlösung zu ersetzen.
Hinweis: Wenn ein Rohr Rotator nicht verfügbar ist dann invertieren Sie Röhren manuell alle 5 min um die isolierten Kulturen aufzuwirbeln. - Antigen-Retrieval (optionaler Schritt für PFA Fixierung empfohlen)
- Pellet-die Krypten, Zotten/Organellen durch Zentrifugation bei 1.000 x g für 5 min und den Überstand zu entfernen.
- 1-10 mL 10 mM Natriumcitrat pH 6.0 (bis 80 ° C vorgewärmt) und bei 80 ° C für 20 min inkubieren.
- Pellet-die Krypten, Zotten/Organellen durch Zentrifugation bei 1.000 x g für 5 min und den Überstand zu entfernen.
- 1-10 mL frisches 10 mM Natriumcitrat pH 6.0 (bis 80 ° C vorgewärmt) und 20 min bei RT inkubieren.
- Pellet-die Krypten, Zotten/Organellen durch Zentrifugation bei 1.000 x g für 5 min und den Überstand zu entfernen.
- 1-10 mL PBS mit 1 % Serum waschen und eine weitere 3 Mal Pelletierung der Krypten, Zotten/Organellen durch Zentrifugieren (1.000 x g für 5 min) vor der Zugabe frischer Waschlösung wiederholen.
4. blockieren Schritt
- Machen die blockierende Lösung: Fügen Sie 10 % Sekundärantikörper Arten Serum mit PBS-Puffer (optional: 0,1 % Waschmittel).
- Pellet-die Krypten, Zotten/Organellen durch Zentrifugieren (1.000 x g für 5 min) und den Überstand zu entfernen.
- Hinzufügen von 5-10 mL der blockierenden Lösung je nach Anzahl der Proben erforderlich (siehe Hinweis unten). In diesem Stadium die Krypten, Zotten/Organellen Lösung in Einzelrohre (1,5 mL geringe Bindung Mikrozentrifugenröhrchen mit jedem Röhrchen mit 0,2 - 1 mL) zum Beizen mit verschiedenen Antikörpern aufgeteilt.
Hinweis: Jede isolierte Krypten/Villi-Fraktion wird zwischen 5-10 Proben geben, die für unterschiedliche Kennzeichnung Kombinationen je nach Größe des Pellets verwendet werden können. Im Idealfall ist eine Pellet-Größe zwischen 2-4 mm für jede Probe erforderlich.
5. Primärantikörper Inkubation
- Verdünnen Sie die primären Antikörper (siehe Tabelle der Materialien) in PBS mit 10 % Serum und 0,1 % Waschmittel. Zwischen 100 bis 200 µL ist Primärantikörper Lösung pro Microcentrifuge Schlauch Probe erforderlich.
- Entfernen Sie die blockierende Lösung durch Zentrifugieren (1.000 x g für 5 min).
- Aufschwemmen der Krypten, Zotten/organoide Pellet in der primären Antikörper-Lösung und inkubieren Sie bei 4 ° C über Nacht mit einer Rohr-Rotator (20 u/min), um die Krypten, Zotten/Organellen in der Schwebe zu halten.
- Nächsten Tag: bringen Sie die Proben zurück zu RT für 1 h am Rohr Rotator (20 u/min).
- Pellet-Probe durch Zentrifugieren (1.000 x g für 5 min) und entfernen Sie die primären Antikörper-Lösung.
- Fügen Sie 1 mL Waschlösung und Aufschwemmen Sie die Krypta/Villus/organoide Pellets.
- Entfernen Sie sofort die Lösung durch Zentrifugieren (1.000 x g für 5 min).
- Fügen Sie 1 mL frische Waschlösung und drehen Sie die Zellen auf ein Rohr Rotator (20 u/min) für 2 Stunden. Ändern Sie die Waschlösung durch Zentrifugation alle 30 min wie in Schritt 5.7.
(6) Sekundärantikörper Inkubation
- Verdünnen Sie die sekundäre Antikörper (siehe Tabelle der Materialien) in PBS mit 10 % Serum und 0,1 % Waschmittel. Etwa 200 µL Sekundärantikörper Lösung ist pro Microcentrifuge Schlauch Probe erforderlich.
Hinweis: Reaktivität der Sekundärantikörper in Maus Krypta/Villus/organoide reduzieren sollte hoch Kreuz absorbiert Antikörper verwendet werden. - Zentrifugieren Sie bei 1.000 x g für 5 min zu Pellets die Krypten, Zotten/Organellen und Aufschwemmen der Pellets in 200 µL Sekundärantikörper Lösung.
- Drehen Sie die Röhren auf ein Rohr-Rotator (20 u/min) bei RT für 1 h.
- Zentrifugieren Sie bei 1.000 x g für 5 min pellet die Krypten, Zotten/Organellen und entfernen die Überstände (nicht gebundenen Sekundärantikörper).
- Das Pellet in Waschlösung Aufschwemmen und sofort Zentrifugieren bei 1.000 x g für 5 min zu die Krypten, Zotten/Organellen Pellets.
- Den Überstand zu entfernen und das Pellet in 1 mL frische Waschlösung Aufschwemmen.
- Drehen Sie auf ein Rohr-Rotator (20 u/min) bei RT für 1,5-2 h, ändern der Waschlösung alle 20-30 min, wie zuvor in 6.3-6.6 beschrieben.
(7) nukleare Fleck
- Verdünnen Sie den nuklearen Fleck in Waschlösung (entsprechend des Herstellers Protokoll), z. B. DAPI oder Hoechst. Zum Beispiel: DAPI-Stammlösung (20 mg/mL) ist das verwässerte 01:10, 000. Die Stammlösung kann in Aliquote bei-20 ° c aufbewahrt werden
- Zentrifugieren Sie bei 1.000 x g für 5 min zu Pellets die Krypten, Zotten/Organellen und Waschlösung zu entfernen.
- Das Pellet in nuklearen Gegenfärbung Lösung aufzuwirbeln.
- Auf ein Rohr-Rotator (20 u/min) bei RT für 10 min drehen.
- Zentrifugieren Sie bei 1.000 x g für 5 min pellet die Krypten, Zotten/Organellen, die nukleare Fleck-Lösung entfernen und das Pellet in Waschlösung Aufschwemmen.
- Drehen Sie auf ein Rohr-Rotator (20 u/min) bei RT für 30-60 min, ändern die Waschlösung alle 10 Minuten.
8. Montage isoliert, Krypten, Zotten und Organellen
- Zentrifugieren Sie bei 1.000 x g für 5 min pellet die Krypten, Zotten/Organellen und entfernen die Waschlösung.
Hinweis: Wenn das Pellet verteilt, anschließend Zentrifugieren Sie wieder. - Tropfen Sie 2 harte Einstellung Montage Medien mit antifade-Agent zum Pellet.
- Schneiden Sie das Ende einer Mikropipette P200 und sorgfältig Aufschwemmen der Pellets in den Montage-Medien. Vermeiden Sie Luftblasen erzeugen.
Hinweis: Die isolierte organoide Kulturen sind sehr klebrig; Stellen Sie sicher, vollständig aufzuwirbeln. - Verwenden Sie die Mikropipette, übertragen Sie die Mischung der Krypten/Zotten/Organellen in der Montage-Media-Lösung, und in einer Linie entlang der Mitte der einen Objektträger zu verzichten.
Hinweis: Die Zeile sollte nicht länger als das Deckglas sein, die verwendet werden soll. Überprüfen Sie mit einem Stereomikroskop, ob die Krypten, Zotten/Organellen sind gut auf Folie verteilt und nicht verklumpt. - Legen Sie ein Deckglas vorsichtig über den Rand; vermeiden Sie Luftblasen erzeugen.
- Legen Sie den Objektträger in eine Folie Buch und speichern im Kühlschrank über Nacht für die Montage Medien festlegen, bevor die Analyse auf einem confocal Mikroskop.
Hinweis: Für Maus-Antikörper Färbung im Maus-Gewebe, verwenden Sie die kommerzielle Immunfluoreszenz kit (siehe Tabelle der Materialien). Blockierungsschritt (Abschnitt 4) mit einem 10 min Block mit Protein blockieren Lösung gefolgt von einer 1 h Inkubation mit dem blockierenden Reagenz, das mit dem Kit kommt zu ersetzen. Fügen Sie dann bei Schritt 5.8 (in der Mitte waschen) eine 1 h Inkubation mit Fluoreszenz-Signal-Enhancer-Reagenz. Verwenden Sie dann das Kit Reagenz in fluoreszierenden dilutant (andere sekundäre Antikörper können auch in Kombination mit diesem Reagens verwendet werden). Inkubieren Sie wie oben beschrieben und fahren Sie ab Schritt 6 mit dem Rest des Protokolls.
9. Befestigung und Immuno-Kennzeichnung von Organellen in Keller-Matrix
Hinweis: Organellen bestimmt zur Fixierung und Immuno-Kennzeichnung innerhalb der Matrix Keller im Untergeschoss Matrix Kuppeln auf Runde Glasdeckgläser in einer 24-Well-Platte (eine Kuppel pro Well) generiert wurden. Die organoide Keller Matrix Kuppeln wurden durch das Hinzufügen und Entfernen von verschiedenen Lösungen innerhalb der 24-Well-Platte verarbeitet.
- Entfernen Sie das Medium aus Brunnen und fügen Sie das Fixiermittel; lassen Sie für 1 h.
- Das Fixiermittel entfernen und waschen in PBS mit 1 % Serum und 0,1 % Waschmittel für 2 h, ändern alle 30 Minuten.
- Entfernen Sie die Waschlösung und blockieren in PBS mit 10 % Serum und 0,1 % Reinigungsmittel für 1 h.
- Verdünnen Sie die Antikörper in PBS mit 1 % Serum oder PBS mit 1 % Serum und 0,1 % Waschmittel.
- Die blockierende Lösung entfernen und Hinzufügen von 100-200 μl Primärantikörper (siehe Tabelle der Materialien) Lösung in jede Vertiefung.
Hinweis: Es ist wichtig, die blockierende Lösung um Antikörper weiter verdünnen nicht zu entfernen. - Teller in den Kühlschrank stellen und über Nacht bei 4 ° C inkubieren
- Dann lassen Sie für 1-2 h bei RT.
- Entfernen Sie die Antikörperlösung und Wäsche für 2-3 h ändern die Waschlösung alle 20 Minuten.
- Entfernen Sie alle Waschlösung und fügen Sie 100-200 μl Sekundärantikörper verdünnt (siehe Tabelle of Materials) in PBS mit 1 % Serum; 1 h bei RT inkubieren
- Entfernen Sie den Sekundärantikörper Lösung und Wäsche für 2 h, ändern alle 20 Minuten.
- Entfernen Sie die Waschlösung und fügen Sie DAPI-Lösung hinzu; lassen Sie für 10 min bei RT. Verwendung DAPI-Stammlösung (20 mg/mL) 01:10, 000 verdünnt.
Ergebnisse
Isolierung von Darmgewebe für Immuno-Beschriftung
Die beschriebenen Gewebe isoliert Protokolle für Dickdarm und Dünndarm wurden für Erhaltung und Immuno-Etikettierung von Mikrotubuli und damit verbundenen Proteine, aber nicht für Stammzell-Lebensfähigkeit und organoide Generation (Abbildung 1 und Tabelle 1 optimiert. ). Ziel war es, die Krypta zu generieren und Villus Splittergruppen, die als waren sauber (frei von Schleim und andere Gewebe) wie möglich, bei gleichzeitiger Minimierung der Exposition gegenüber EDTA und Kälte Struktur beibehalten und verhindern Depolymerisation von Mikrotubuli mit Eis kalt Lösungen, die bewegen Depolymerisation von Mikrotubuli alles andere als stabil. Abbildung 2 zeigt Beispiele von Bildern der Brüche 2 und 3 aus isolierten kleinen Darmgewebe mit Teil 2 mit einer Mischung aus Zotten und Krypten (Abb. 2A, B), während der Teil 3 enthält hauptsächlich Krypten (Abbildung 2 D).
Fixierung und Immuno-Kennzeichnung von isolierten Darmgewebe
Die einzelnen oder kombinierten Fraktionen wurden dann zur Fixierung verarbeitet und Immuno-gekennzeichnet durch eine Reihe von Schritten, einschließlich Fixierung, Waschmittel, Sperrung, Antikörper und Waschlösungen, bevor erneut Aussetzung der endgültigen Zotten/Krypten pellet in Montage-Medien, auf Folien zu übertragen, und mit Glasdeckgläser abdecken. Die Krypten und Zotten wurden dann auf einem confocal Mikroskop abgebildet.
Gute Erhaltung und Kennzeichnung der Mikrotubuli und Aktin in Zotten und Krypten wurde durch Folgendes erreicht: eine Kombination von Formaldehyd/Methanol-Fixierung bei-20 ° C, wiederholt waschen in PBS mit 0,1 % Waschmittel und 1 % Serum und blockieren mit PBS-Puffer mit 0,1 % Waschmittel und 10 % Serum, gefolgt von Übernachtung Inkubation bei 4 ° C im primären Antikörper und dann 2 h in Sekundärantikörper bei Raumtemperatur (Abbildung 3). Formaldehyd/Methanol Fixierung auch funktionierte gut für Kennzeichnung + Tipps wie die EBs und CLIP-170 in isolierten Krypten und Zotten (Abbildung 4). EB3 Ansammlungen am Plus-Ende von Mikrotubuli (bekannt als Kometen) zeigten sich in Krypten (Abb. 4A), während Vereinigung entlang der Gitter von stabilen Mikrotubuli in Zotten Proben (Abbildung 4) gesehen werden könnte. Eindeutige Lokalisierung des CLIP-170 und p150geklebt (Untereinheit des Dynactin) war klar ersichtlich an der apikalen n-MTOCs in isolierten Zotten (Abbildung 4 b). Fixierung mit dem Formaldehyd/Methanol-Protokoll funktionierte nicht konsequent für die Lokalisierung der Ninein in isolierten Darmgewebe mit unseren Pep3 Antikörper gegen Maus Ninein. Jedoch Methanol Fixierung bei-20 ° C, gefolgt von der gleichen waschen und blockiert Lösungen für Formaldehyd/Methanol gab sehr gute Lokalisierung von Ninein in isolierten Krypten und Zotten (Referenz8;Abbildung 5). Interessant ist, während Ninein in der apikalen Zentrosomen konzentriert zeigte einige Ansammlung an der Basis der Zelle in einigen Zellen innerhalb von isolierten Krypten (Abbildung 5). Ob dies aufgrund unspezifischer Beschriftung oder eine Folge der Isolation Verfahren zu verzögern ist benötigen Fixierung (und damit auf Erhaltung) weitere Untersuchung. Methanol-behoben (-20 ° C) Kryostat Abschnitte von Villi (siehe Abbildung 3bi in8) zeigte jedoch auch, dass Ninein an der Zelle Basis in einigen Zellen, was darauf hindeutet, dass Ninein auch eine basale Bevölkerung von Mikrotubuli zuordnen kann.
Fixierung und Immuno-Kennzeichnung der Organellen von Keller Matrix isoliert
Kleinere Darm Organellen wurden generiert und im Keller Matrix für drei Wochen oder länger (Abbildung 6A; Referenz6,15) angebaut. Ein kalt (4 ° C) Zelle-Recovery-Lösung wurde zur Organellen aus der Keller-Matrix zu isolieren. Depolymerisiert Keller-Matrix-Lösung mit Organellen wurde nach Röhrchen überführt und vor der Fixierung und Immuno-Kennzeichnung zentrifugiert. Dies produziert sehr saubere Vorbereitungen und erlaubt guten Zugang zu den Organellen für die verschiedenen Lösungen. Die differenzierte Zellen innerhalb der organoide Villus Domains enthalten stabile Apico-basale Mikrotubuli; Diese Bezeichnung auch in den meisten Fällen (Abb. 6 b, C) und EB1 könnte auch entlang der Mikrotubuli-Gitter (Abbildung 6E; Referenz13) gesehen werden. Jedoch kann die kalte Zelle-Recovery-Lösung führen Depolymerisation von dynamischen Mikrotubuli, die zeigte sich in einigen Proben durch das Fehlen von EB1 Kometen (die an das Plus-Ende des wachsenden Mikrotubuli binden) innerhalb der basalen Krypta-Domains (Abbildung 6F ). In anderen Proben blieben astral (dynamischen) Mikrotubuli (Abbildung 6). Organoide Isolierung vor der Fixierung und Immuno-Kennzeichnung arbeitete auch für Knoten Proteine, Ninein, CLIP-170 und Zelle Marker wie Mucin Becherzellen und Chromogranin A für Enteroendocrine Zellen.
Fixierung und Immuno-Kennzeichnung der Organellen im Keller-matrix
Abbildung 7 zeigt eine organoide Stadium der Zyste (A–C) und in einem frühen Stadium der Entwicklung der Krypta (D), feste in Formaldehyd/Methanol und Immuno-Label für Mikrotubuli und Ninein. Gute Mikrotubuli Erhaltung und Kennzeichnung sowie die Kennzeichnung für Ninein am apikalen n-MTOCs zeigten. Abbildung 8A, B zeigt eine Krypta Domain innerhalb eines Tages 6 organoide mit Methanol-Protokoll fixiert und mit der Bezeichnung für Mikrotubuli und EB1. Guter Erhaltung von Mikrotubuli und EB1 Kometen war offensichtlich darauf hindeutet Erhaltung der dynamischen Mikrotubuli.
Organellen waren auch feste und Immuno-Label gleichzeitig innerhalb der Keller-Matrix. Die Nachteile dieses Verfahrens können Lösungen zu waschen und/oder werden schlechte Penetration Fixativ und Trapping von Antikörpern in der Keller-Matrix (Abbildung 8 b), obwohl in beiden Fällen weniger häufig als 0,1 % Waschmittel in das Fixiermittel enthalten war. Zusätzlich 4 % PFA nicht beibehalten das Keller-Matrix gut aber verursacht es aufzulösen, obwohl dies weniger so mit 1 % PFA.Methanol-Fixierung, induziert auf der anderen Seite manchmal organoide Zusammenbruch.
Etikettierung mit einige Antikörper wie z. B. gegen die Stammzell-Marker Lgr5 und Paneth Zelle Marker erfolglos CD24 mit den 4 % PFA, Methanol oder Formaldehyd/Methanol-Protokollen. Jedoch Befestigung der Organellen innerhalb der Keller-Matrix mit 1 % PFA in PBS mit 0,1 % Waschmittel bei Raumtemperatur führte zu Kennzeichnung für Lgr5 und CD24 (Abbildung 9).
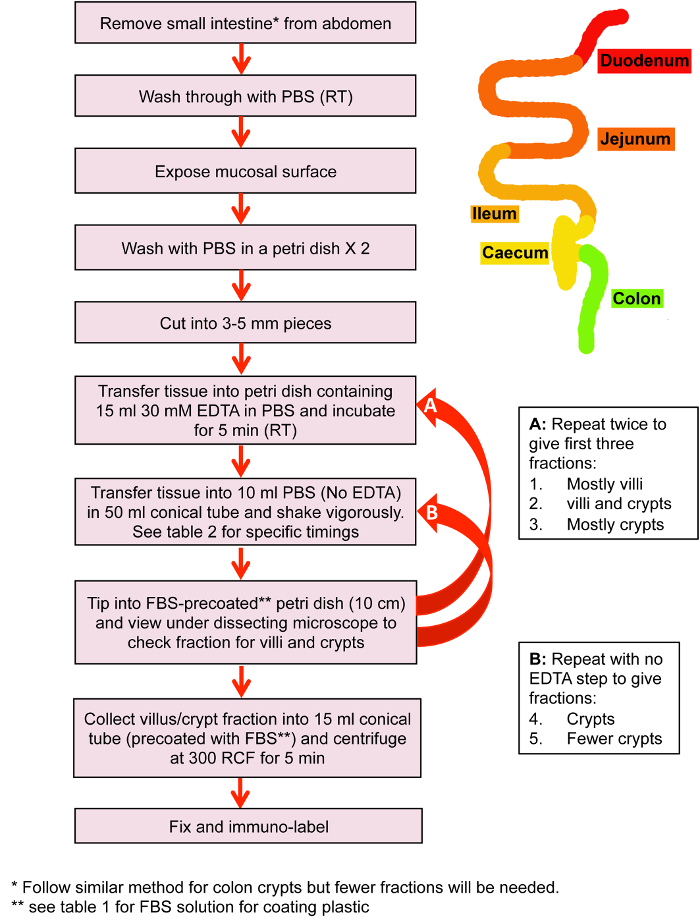
Abbildung 1: Isolierung von kleinen Darmzotten und Krypten. Flussdiagramm der wichtigsten Schritte im kleinen Darm Villus und Krypta Isolation vor der Fixierung und Immuno-Kennzeichnung. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: isolierter Zotten und Krypten aus Maus Dünndarm. Hellfeld-Mikroskop-Bilder der intestinalen Brüche zeigen (große Pfeile) Zotten und Krypten (kleine Pfeile). (A, B) Teil 2 enthält eine Mischung aus Zotten und Krypten und Erhaltung der Morphologie auf die Villus und Krypta ist offensichtlich in B. (C, D) Teil 3 zeigt Isolierung der Krypten und Abwesenheit von Zotten und intakten Grüfte unter anderem eine gegabelte Krypta in C. Skalieren von Balken = 500 μm (A, C); 100 μm (B, D). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: isolierter kleiner Darm Villus und Krypta in Formaldehyd/Methanol fixiert und Immuno-Label für Mikrotubuli und Actin. (A) schematische Darstellung der Villus und Krypta Epithel mit verschiedenen Zelltypen angegeben. Die hervorgehobenen Felder zeigen die repräsentativen Regionen abgebildet in B und C. (B, C) Konfokalen optischen Abschnitte durch Bestandteil eines Villus (B) und basalen Krypta (C) isoliert aus dem Dünndarm mit 30 mM EDTA und in Formaldehyd/Methanol fixiert, in PBS mit 1 % Ziege Serum und 0,1 % Waschmittel gewaschen, mit PBS-Puffer blockiert enthält 10 % Ziegenserum und 0,1 % Waschmittel und beschriftet für Mikrotubuli mit Ratte monoklonalen Anti-Tubulin Antikörper (grün) und Actin mit Kaninchen polyklonale Anti-β-Aktin-Antikörper (rot). Gut erhaltene Apico-basale Mikrotubuli-Bündel sind offensichtlich in Villus und Krypta Zellen und Aktin kann gesehen werden, konzentriert sich in der apikalen Region mit Blick auf das Lumen (Pfeil). Skalieren von Balken = 5 μm. Bitte klicken Sie hier für eine größere Version dieser Figur.
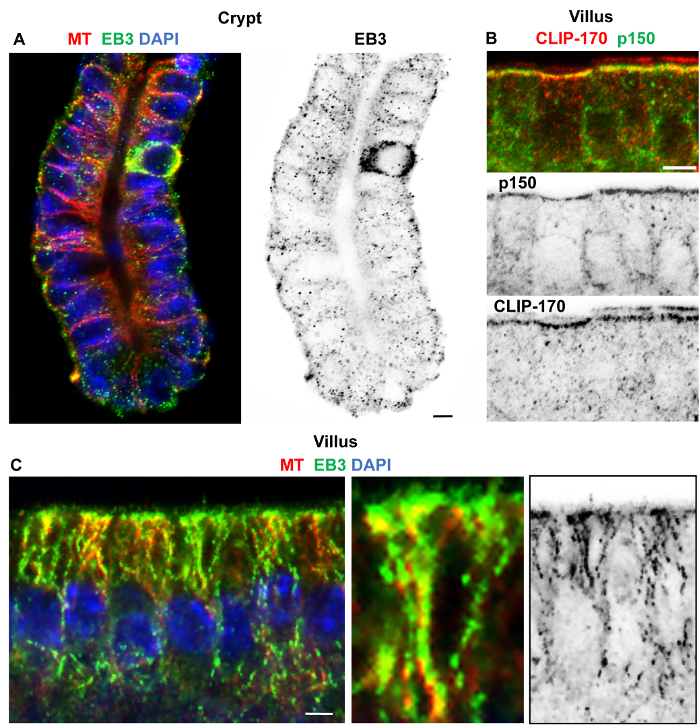
Abbildung 4: Isoliert, kleine Darm Krypta und Zotten in Formaldehyd/Methanol fixiert und Immuno-Label für Mikrotubuli, EB3, p150geklebtund CLIP-170. Konfokalen optischen Teile der Krypta und Zotten Regionen aus dem Dünndarm mit 30 mM EDTA isoliert und fixiert in Formaldehyd/Methanol in PBS mit 10 % Ziegenserum und 0,1 % Waschmittel gewaschen in PBS mit 10 % Ziegenserum und 0,1 % Waschmittel, blockiert und Immuno-beschriftet. (A) Gruft mit Kaninchen α-Tubulin polyklonalen Antikörper (rot) und Ratte monoklonalen EB3KT36 Antikörper (grün) gekennzeichnet und gebeizt für DNA mit DAPI (blau) zeigt Apico-basale Mikrotubuli und EB3 Kometen. Das invertierte Einkanal-Bild zeigt deutlich EB3 Kometen in der basalen Krypta Zellen darauf hindeutet gute Erhaltung der dynamischen sowie stabile Mikrotubuli. (B) Villus Epithelzellen mit Kaninchen polyklonale CLIP-170-Antikörper beschriftet (rot, siehe auch verweisen16) und die Maus monoklonalen p150geklebt Antikörper (grün) zeigt apikalen Co Lokalisierung. Invertierte Einkanal-Bilder sind unten dargestellt. (C) Villus Zellen mit Kaninchen α-Tubulin polyklonalen Antikörper (rot) und Ratte monoklonalen EB3-KT36 Antikörper (grün) gekennzeichnet und gebeizt für DNA mit DAPI (blau) zeigt Apico-basale Mikrotubuli mit EB3 entlang der Gitter. Vereins EB3 Gitter ist in das vergrößerte Bild hervorgehoben, während das umgekehrte Einkanal-Bild EB3 Kometen und Gitter Verband schlägt. Skalieren von Balken = 5 μm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: isolierte Doppelpunkt Krypta in Methanol, Immuno-Label für Ninein und E-Cadherin, fixiert und gefärbt mit DAPI. Konfokalen optischen Teil der basalen und Transit-Verstärkung Region eine Krypta isoliert aus dem Dickdarm mit 3 mM EDTA in Methanol fixiert, in PBS mit 1 % Ziegenserum und 0,1 % Waschmittel gewaschen und blockiert in PBS mit 10 % Ziege Serum und 0,1 % Waschmittel. Die Krypta wurde mit Kaninchen Ninein polyklonalen Antikörper beschriftet (Pep3, siehe auch Referenz8, rot) und Maus monoklonalen Antikörper in E-Cadherin (grün) und gefärbt mit DAPI (blau). Das invertierte Einkanal-Bild zeigt nur Ninein. Das Bild zeigt eine gut erhaltene Krypta mit E-Cadherin enthüllt die Umrisse der einzelnen Zellen und Ninein an der apikalen Zentrosomen konzentriert. Es schlägt gute Penetration von Fixativ und Antikörpern und Erhaltung der Antigenität. Maßstabsleiste = 5 μm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6: Entwicklung, Fixierung und Immuno-Kennzeichnung von organoide isoliert Organellen. (A) Phase Kontrast zeigen verschiedene Entwicklungsstadien organoide von Zelle Aggregaten zur Zyste mit Knospe Einleitung und voll Bilder ausgebildet Organellen mit Krypta und Villus Domains.(B–F) Konfokalen optischen Abschnitte durch Organellen von Keller-Matrix mit Zelle-Recovery-Lösung bei 4 ° C (10 min), gefolgt von Formaldehyd/Methanol-Fixierung, waschen in PBS mit 10 % Ziegenserum und 0,1 % Waschmittel, Sperrung in PBS mit 10 % Ziege isoliert Serum und 0,1 % Waschmittel und Immuno-Kennzeichnung für Mikrotubuli, β-Catenin und EB1. (B) organoide Zyste für Mikrotubuli (blau) und β-Catenin (rot) zeigen gute Mikrotubuli Erhaltung und Kennzeichnung in den meisten Zellen beschriftet. (C) unterschiedliche Apico-basale Mikrotubuli sind offensichtlich in dieser erweiterten Epithelzellen aus eine organoide Zyste. (D) teilenden Zellen für Mikrotubuli zeigt Spindeln einschließlich astral (dynamischen) Mikrotubuli (Pfeil) beschriftet. (E, F) Villus Domäne (E) und Krypta (F) Domäne organoide Regionen zeigen einige EB1 Kennzeichnung entlang das Gitter aus stabilen Mikrotubuli, vor allem in der Villus, während sehr wenige EB1 Kometen auch innerhalb der basalen Krypta, was darauf hindeutet, dass Dynamik zu sehen sind Mikrotubuli sind nicht erhalten geblieben. Skalieren von Balken = 20 μm (A); 2 μm (D); 5 μm (B, C, E-F). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 7: Organellen innerhalb der Keller-Matrix in Formaldehyd/Methanol fest- und Immuno-Label für Mikrotubuli und Ninein. Konfokalen optischen Teile der Organellen in Formaldehyd/Methanol fixiert, gewaschen und in PBS mit 10 % Ziegenserum und 0,1 % Waschmittel blockiert und beschriftet, während die übrigen in der Keller-Matrix. (A–C) Organoide Zyste für Mikrotubuli (grün) und Ninein (Pep3 Referenz;8, rot) beschriftet und befleckt mit DAPI (blau) zeigt das zusammengefügte Bild a und invertiert einkanalige Bilder für Mikrotubuli (B) und Ninein (C). Die Bilder zeigen Apico-basale Mikrotubuli und apikalen Ninein Lokalisierung, was darauf hindeutet, sehr gute bauliche Erhaltung der die organoide und Durchdringung von Antikörpern sowie clearing von ungebundenen Antikörper. (D, E) Organoide mit Krypta fixiert und mit dem Label wie oben und wieder zeigt hervorragende bauliche Erhaltung zu entwickeln, Kennzeichnung und clearing von Antikörpern. Unterschiedliche Apico-basale Mikrotubuli und apikalen n-MTOC Ninein Lokalisierung ist offensichtlich und in das vergrößerte Bild (E) die boxed Region in Dhervorgehoben. Skalieren von Balken = 10 μm (A-D); 5 μm (E). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 8: Organellen feste innerhalb der Keller-Matrix in Methanol und Immuno-Label für Mikrotubuli und EB1. Konfokalen optischen Teile der Organellen in Methanol fixiert, gewaschen und in PBS mit 10 % Ziegenserum und 0,1 % Waschmittel blockiert und gekennzeichnet, während die übrigen in der Keller-Matrix. (A) Zyste Domäne von einer voll entwickelten organoide beschriftet mit Kaninchen polyklonale α-Tubulin (rot) und Maus monoklonalen EB1 (grün) Antikörper zeigen Apico-basale Mikrotubuli Spindeln (Pfeil) in zwei teilenden Zellen und unterschiedlichen EB1 Kometen. Einige fangen von ungebundenen EB1 Antikörper ist offensichtlich. Allerdings sind gute bauliche Erhaltung und Kennzeichnung der Mikrotubuli und EB1 beobachtet. Das Vorhandensein von EB1 Kometen schlägt vor, dass dynamische Mikrotubuli erhalten geblieben sind (A, invertieren). (B) Invertiertes Bild organoide Zyste Region zeigt α-Tubulin Antikörper Etikettierung mit erheblichen Antikörper innerhalb der umgebenden Matrix Keller (Pfeil) gefangen. Skalieren von Balken = 5 μm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 9: Organellen, die fest in der Keller-Matrix in 1 % PFA und Immuno-Label für Lgr5 und CD24. Konfokalen optischen Teile der Organellen, die fest in der Keller-Matrix in 1 % PFA in PBS mit 0,1 % Waschmittel in PBS mit 1 % Ziegenserum und 0,1 % Waschmittel gewaschen und beschriftet mit Antikörpern gegen Lgr5 und CD24. (A, B) Stammzellnische innerhalb einer Krypta Domäne zeigt Paneth Zellen positiv für CD24 (rot). Die konfokale und Phase Kontrast-Bilder wurden in Averschmolzen. B zeigt die einzelnen Kanal CD24 Kennzeichnung. (C) Stammzellen in einer Krypta Domäne zeigt eine positive Stammzelle Lrg5 Region. Skalieren von Balken = 10 μm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Tabelle 1: Timeline der kleinen Darm Krypta und Zotten Isolation und Fixierung. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Isolierung von Darmgewebe
Isolierung der kleinen Darm Krypten und Zotten und Kolon Krypten beinhaltet Freilegung der Schleimhautoberfläche, Behandlung mit EDTA Lösung Zellkontakte, Fraktionierung (schütteln) und Zentrifugation lösen. Die vorgestellten intestinalen Darmzotten/Krypta Isolierung Protokoll wurde von Belshaw Et Al. und Whitehead Et Al. modifiziert 17 , 18
Verfügbarmachen der Schleimhautoberfläche
Wir haben mit einer Reihe von Ansätzen, die Schleimhautoberfläche des Verdauungstraktes bei der Entwicklung dieses Verfahrens aussetzen experimentiert. Ein klassischer Ansatz soll evert (innen nach außen drehen) das Rohr, in der Regel in Segmente ca. 100 mm lang, mit einem Metallstab, der in einer Falte des Gewebes an einem Ende und dann die restlichen Röhre gefangen ist glitt über die u-19. Für Maus Gewebe eignet sich ein Metallstab (2,4 mm Durchmesser) mit abgerundeten Enden. Dieser Ansatz hat den Vorteil der Schleimhautoberfläche ermöglicht besseren Zugang zu PBS und EDTA zu erweitern. Wir hatten ursprünglich verwendet diesen Ansatz aber zog in die Röhre in kurzen Längen (ca. 5 cm) schneiden und öffnen jeden Abschnitt mit Präparierscheren, wie dies erwies sich einfacher als. Diese Methode eignet sich, wenn nur wenige Darm erforderlich sind; aber wenn mehr Tiere werden in einem Experiment dann ein speziell gebaute Gerät verwendet für aufschneiden das Rohr längs, wie von Yoneda Et Al. beschrieben 14 wäre effizienter.
Ablösung der Zotten und Krypten von der Muskelschicht
Zunächst haben wir 3 mM EDTA in PBS und relativ langen Inkubationszeiten von bis zu 60 min um der Schleimhautoberfläche aus den zugrunde liegenden Gewebe17,18zu lösen. Bei dieser Konzentration von EDTA fanden wir eine Inkubationszeit von 30 min ausreichend, Krypten von Maus Colon zu lösen war. Jedoch für die kleinen Darm Krypta/Villus Isolierung haben wir versucht, mit konzentrierter EDTA für eine kürzere Zeit, die einen effizienten Ansatz erwiesen. Alle nachfolgenden Arbeiten erfolgte mit Gewebe extrahiert, mit der 30 mM-EDTA-Technik Generierung von relevanten Fraktionen für Zotten und Krypten. Für Krypten wir gebündelt normalerweise 3-5 Fraktionen vor der Befestigung, aber es ist wichtig zu prüfen, ob diese die entsprechenden Fraktionen sind, wie die Zeiten eine Reihe von Faktoren wie z. B. Position entlang den Darm-Trakt, Alter der Maus, Entzündung, vorherige Diät hängen , etc. in ähnlicher Weise kann die Länge der Zeit, die das Gewebe muss im Anschluss an die EDTA Behandlung effektiv zu geschüttelt werden unter verschiedenen Bedingungen variieren. Das Ergebnis ist isolierte Gewebe Brüche mit einer Mischung aus Zotten und Krypten oder hauptsächlich Zotten oder Krypten (Abbildung 2). Da gibt es keine Zotten im Dickdarm, die Krypta-Extraktion kann erreichbar in einem Schritt durch Schütteln des Gewebes in der Röhre für 30 s. Diese Fraktionen können dann fixiert und für Immuno-Kennzeichnung verarbeitet werden.
Isolierung der intestinalen Organellen von Keller-matrix
Isolierung der Organellen von Keller Matrix Domes kann mithilfe von Zelle-Recovery-Lösung erreicht werden. Die Lösung funktioniert, indem depolymerizing die gelierte Keller-Matrix, sondern die Temperatur um 2 bis 8 ° c betragen. Ein Wort der Warnung ist, dass dynamische Mikrotubuli nicht beibehalten werden können. Also, für Immuno-Kennzeichnung von dynamischen Mikrotubuli und + Tipps, wie die EBs-Zelle, Erholung von Keller-Matrix vor der Fixierung ist nicht zu empfehlen. Jedoch die meisten der Mikrotubuli in den differenzierenden organoide Zellen sind relativ stabil und diese blieben (Abbildung 6). Es funktionierte auch gut für Immuno-Kennzeichnung von centrosomal und Knoten Proteine sowie Zellenmarkierungen.
Fixierung-Protokolle
Formaldehyd (frisch hergestellt aus PFA) ist ein relativ schnell wirkende Fixiermittel, die reversible Formen Vernetzungen und 4 % PFA eignet sich gut für z.B. in Immuno-Kennzeichnung Mikrotubuli und Gamma-Tubulin und Färbung Actinfilamente mit Phalloidin. Mehr verdünnen PFA Lösungen wie 1 % funktionierte gut für Immuno-Beschriftung z. B. mit der Stammzell-Marker Lgr5 und Paneth Zelle Marker CD24 innerhalb der Krypta Stammzellnische, während höhere Konzentrationen von PFA nicht funktioniert hat.
Der Zusatz von Glutaraldehyd gibt bessere Konservierung von Mikrotubuli und die so genannte PHEMO Fixierung besteht aus einer Mischung von 3,7 % PFA, 0,05 % Glutaraldehyd und 0,5 % Waschmittel in PHEMO Puffer (68-mM-Rohre, 25 mM HEPES, EGTA 15 mM und 3 mM MgCl2)2 bietet ausgezeichnete Erhaltungszustand der Mikrotubuli ohne Antigenität. Es funktioniert auch gut für Immuno-Kennzeichnung Gamma-Tubulin, β-Catenin und E-Cadherin und Färbung Actinfilamente mit Phalloidin. Jedoch in 3D Gewebe und organoide Kulturen, die PHEMO Fixierung inkonsistente Ergebnisse produziert und wurde deshalb nicht verwendet.
Methanol ist ein Gerinnungsmittel Fixiermittel, das relativ gute Penetration und tendenziell Antigenität zu bewahren. Fixierung mit 100 % Methanol (-20 ° C) führt einige Schrumpfung, gibt moderate Morphologie Erhaltung und arbeitet für Mikrotubuli, + Tipps und viele centrosomal Antikörper einschließlich Ninein in 2D Zellkulturen. Jedoch brach einige Organellen bei Verwendung dieser Methode der Fixierung. Darüber hinaus Eindringen von Antikörpern durch gesamte Krypten, Zotten oder Organellen war zunächst ein Problem aber die Zugabe von 0,1 % Waschmittel der Waschlösung und längeren waschen bessere Ergebnisse erzielt.
Eine Kombination von Formaldehyd und Methanol hatte früher von Rogers Et al. 20 , Immuno-Label EB1 in Drosophila. Eine Fixierung-Protokoll basiert auf einer Mischung aus Formaldehyd und Methanol wurde daher für Darmgewebe und Organellen basierend auf 3 % Formaldehyd und 97 % Methanol,-20 ° C gekühlt, aber weglassen der 5 mM Natriumcarbonat aus der Mischung, die von Rogers verwendet wurde Et Al. 20 Außerdem wurden Proben in der Tiefkühltruhe bei-20 ° c fixiert Dies funktioniert besonders gut für Immuno-Kennzeichnung + Tipps, wie CLIP-170 und der EBs, sondern erwies sich auch hervorragend für die Befestigung und Immuno-Kennzeichnung Mikrotubuli und Aktin in Gewebe und 3D Organellen. Sehr guter baulicher Erhaltung zeigte und Antigenität blieb für mehrere Zellskelett und assoziierte Proteine sowie centrosomal Proteine wie Gamma-Tubulin und Ninein, obwohl Kennzeichnung für Ninein konsequenter mit Methanol gearbeitet. Fixierung.
Offenlegungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Danksagungen
Die Autoren danken Paul Thomas für Mikroskop-Beratung und Unterstützung. Dieses hier wurde unterstützt durch die BBSRC (keine zu gewähren. BB/J009040/1, M.M.M. und t.w.).
Materialien
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma | D8537-500ML | washing and PFA |
| Cell Recovery Solution | Corning | 354253 | isolate organoids |
| lobind microcentrifuge tubes | Eppendorf | 30108116 | prevent cells sticking |
| 0.5 M EDTA solution, pH 8.0 | Sigma | 03690-100ML | Crypt isolation |
| 70 μm cell strainer | Fisher Scientific | 11517532 | Isolate crypts from villi |
| Triton X-100 | Sigma | T8787 | detergent |
| goat serum | Sigma | G6767 | blocking agent |
| Fetal Bovine Serum (FBS) | Sigma | used as non-stick agent | |
| Paraformaldehyde, 4% in PBS | Alfa Aesar | J61899 | fixative |
| Formaldehyde solution (36.5–38% in H2O) | Sigma | F8775 | used as fixative |
| Methanol 99.9% Analytical grade | Fisher | M/4000/17 | used as fixative |
| MaxFluor Mouse on Mouse Immunofluorescence Detection Kit | Maxvision Biosciences | MF01-S | commercial immunofluorescence kit; to reduce non-specific labelling |
| Rotator SB2 or SB3 | Stuart | microcentrifuge tube rotator | |
| Sodium citrate | antigen retrieval | ||
| Hydromount | National Diagnostics | HS-106 | mountant |
| DABCO - 1,4-diazabicyclo[2.2.2]octane | Sigma | D27802 | anti-fade agent |
| Permanent Positive Charged, Pre-Washed, 90 Degree Ground Edges | Clarity | N/C366 | slides |
| Glass coverslip - thickness no. 1, 22 x 50 mm | Clarity | NQS13/2250 | coverslips |
| Matrigel | Corning | 356231 | Basement matrix for 3D organoid culture |
| 50 mL conical tubes | Sarstedt | 62.547.254 | for processing tissue/organoids |
| 15 mL conical tubes | Sarstedt | 62.554.502 | for processing tissue/organoids |
| 1.5 mL LoBind tubes | Eppendorf | 30108051 | for isolated organoids |
| Mouse monoclonal anti-E-cadherin antibody | BD Biosciences | 610181 | primary antibody 1:500 |
| Rat monoclonal anti-tubulin YL1/2 antibody | Abcam | ab6160 | primary antibody 1:100 |
| Rabbit alpha-tubulin antibody | Abcam | ab15246 | primary antibody 1:100 |
| Rabbit anti-beta-actin antibody | Abcam | ab8227 | primary antibody 1:100 |
| Rat monoclonal anti-p150Glued antibody | BD Bioscience | 610473/4 | primary antibody 1:100 |
| Rat monoclonal EB3KT36 antibody | Abcam | ab53360 | primary antibody 1:200 |
| Mouse monoclonal EB1 antibody | BD Bioscience | 610535 | primary antibody 1:200 |
| Rabbit anti-Lgr5 antibody | Abgent | AP2745d | primary antibody 1:100 |
| Dylight anti-rat 488 | Jackson | 112545167 | seconday antibody 1:400 |
| Dylight anti-mouse 488 | Jackson | ST115545166 | seconday antibody 1:400 |
| Dylight anti-rabbit 647 | Jackson | 111605144 | seconday antibody 1:400 |
Referenzen
- Bacallao, R., Antony, C., Dotti, C., Karsenti, E., Stelzer, E. H., Simons, K. The subcellular organization of Madin-Darby canine kidney cells during the formation of a polarized epithelium. J Cell Biol. 109 (6 Pt 1), 2817-2832 (1989).
- Bellett, G., et al. Microtubule plus-end and minus-end capture at adherens junctions is involved in the assembly of apico-basal arrays in polarised epithelial cells. Cell Motil Cytoskeleton. 66 (10), 893-908 (2009).
- Mogensen, M. M., Tucker, J. B., Mackie, J. B., Prescott, A. R., Nathke, I. S. The adenomatous polyposis coli protein unambiguously localizes to microtubule plus ends and is involved in establishing parallel arrays of microtubule bundles in highly polarized epithelial cells. J Cell Biol. 157 (6), 1041-1048 (2002).
- Mogensen, M. M., Tucker, J. B., Stebbings, H. Microtubule polarities indicate that nucleation and capture of microtubules occurs at cell surfaces in Drosophila. J Cell Biol. 108 (4), 1445-1452 (1989).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Curr Opin Cell Biol. , (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- van der Flier, L. G., Clevers, H. Stem cells, self-renewal, and differentiation in the intestinal epithelium. Annu Rev Physiol. 71, 241-260 (2009).
- Goldspink, D. A., et al. Ninein is essential for apico-basal microtubule formation and CLIP-170 facilitates its redeployment to non-centrosomal microtubule organizing centres. Open Biol. 7 (2), (2017).
- Verissimo, C. S., et al. Targeting mutant RAS in patient-derived colorectal cancer organoids by combinatorial drug screening. Elife. 5, (2016).
- Young, M., Reed, K. R. Organoids as a Model for Colorectal Cancer. Curr Colorectal Cancer Rep. 12 (5), 281-287 (2016).
- Andersson-Rolf, A., et al. One-step generation of conditional and reversible gene knockouts. Nat Methods. 14 (3), 287-289 (2017).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Goldspink, D. A., et al. The microtubule end-binding protein EB2 is a central regulator of microtubule reorganisation in apico-basal epithelial differentiation. Journal of Cell Science. 126 (17), 4000-4014 (2013).
- Yoneda, M., Molinolo, A. A., Ward, J. M., Kimura, S., Goodlad, R. A. A Simple Device to Rapidly Prepare Whole Mounts of the Mouse Intestine. J Vis Exp. (105), e53042 (2015).
- Andersson-Rolf, A., Fink, J., Mustata, R. C., Koo, B. K. A video protocol of retroviral infection in primary intestinal organoid culture. J Vis Exp. (90), e51765 (2014).
- Coquelle, F. M., et al. LIS1, CLIP-170's key to the dynein/dynactin pathway. Mol Cell Biol. 22 (9), 3089-3102 (2002).
- Belshaw, N. J., et al. Patterns of DNA methylation in individual colonic crypts reveal aging and cancer-related field defects in the morphologically normal mucosa. Carcinogenesis. 31 (6), 1158-1163 (2010).
- Whitehead, R. H., VanEeden, P. E., Noble, M. D., Ataliotis, P., Jat, P. S. Establishment of conditionally immortalized epithelial cell lines from both colon and small intestine of adult H-2Kb-tsA58 transgenic mice. Proc Natl Acad Sci U S A. 90 (2), 587-591 (1993).
- Hamilton, K. L., Butt, A. G. Glucose transport into everted sacs of the small intestine of mice. Adv Physiol Educ. 37 (4), 415-426 (2013).
- Rogers, S. L., Rogers, G. C., Sharp, D. J., Vale, R. D. Drosophila EB1 is important for proper assembly, dynamics, and positioning of the mitotic spindle. J Cell Biol. 158 (5), 873-884 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten