Method Article
微小管と 3 D培養腸 Organoids とEx Vivo腸組織における Centrosomal 蛋白質の免疫蛍光ラベリング
要約
体内組織から腸管の 3 D 構造の隔離のためのプロトコルを提案して地下行列体外埋め込み organoids、ディテールの異なる固定と、微小管の免疫分類のために最適化されたプロトコルを汚すcentrosomal、および接合部のタンパク質だけでなく細胞マーカー Lgr5 幹細胞タンパク質を含みます。
要約
体内の組織構造や形態形成を模倣する 3 Dの in vitroオルガノイドの出現細胞と発生生物学の主要な生物学的質問を勉強する能力は大きく進歩しました。さらに、遺伝子編集とウイルス遺伝子導入の技術進歩と共にオルガノイド医学研究と疾患の治療のための新薬の開発を進めることを約束します。Organoids 栽培体外地下行列の動作と様々 なタンパク質の機能を研究するため強力なモデル システムを提供して、蛍光付けられた蛋白質のライブ イメージングに適しています。ただし、 ex vivo体内と体外式と内因性のタンパク質の局在を確立する organoids はタグ付きタンパク質の動作を確認することが重要。この目的のために開発し、組織の分離、固定および腸オルガノイド培養 ex vivo腸管組織に微小管、centrosomal、および関連付けられている蛋白質の局在の免疫分類のプロトコルを変更します。また抗体抗原性を維持し、良好な浸透と定着剤および抗体のクリアランスを有効にしながらオルガノイド培養用の 3 D 構造を維持する定着剤の目的であった。寒さへの暴露は、安定した微小管がすべて depolymerizes し、さまざまなプロトコルを変更する場合、これは重要な要因だった。エチレンジアミン酸 (EDTA) 濃度 3 mM から 30 mM に絨毛と小腸の陰窩の効率的な剥離を与えたこと 3 ミリメートルの EDTA はでしたが体液がわかった。開発したホルムアルデヒド ・ メタノール固定プロトコルは、微小管、アクチン、および結合 (EB) 蛋白質の効果的な分類のための抗原性を維持しながら非常に良い構造保全を与えた。メタノールのプロトコルはより一貫して働いていたが、また centrosomal タンパク質 ninein の働いた。さらに、固定と微小管と関連するタンパク質の免疫標識を organoids から分離したまたは地下マトリックス内に残ると達成できることを設立しました。
概要
政井上皮の形成は開発における基本的なプロセスを微小管と centrosomal 蛋白質の劇的な再構成が含まれます。放射状の微小管配列整理センター位置 centrosomal 微小管から発せられる (脂質) は多くの動物細胞で顕著で、比較的フラット電池に適して。対照的に、腸のような円柱状の上皮細胞より良い形状とこれらの細胞の特別な機能をサポートしている非ラジアル transcellular 微小管配列を組み立てます。Transcellular 微小管1,2のアンカレッジの責任となる頂点とを形成し、根尖部の非 centrosomal MTOCs (n MTOCs) へ移動体による微小管のこの劇的な再編を実現します。,3,4,5。
上皮細胞の分化と関連する微小管再構成の私達の知識の多くは、生体内で組織アーキテクチャを表示しない 2 Dの in vitro細胞層の調査から来ています。Clevers や同僚6、によって開拓された organoid 文化 3 D培養の開発はように模倣体内アーキテクチャと開発主要な技術の進歩を表します。上皮細胞の分化の階層は腸; で明らか陰窩の下部に幹細胞増殖し、徐々 に、彼らは完全に前に差別になる小さな腸粘膜や大腸の表面にクリプトを移行するを区別するためのセルを増幅未熟なトランジットを生じ7ルーメンに流した。重要なは、これがどこ幹細胞のニッチから細胞増殖形成嚢胞その後下部と嚢胞領域に向かって徐々 に進んで分化細胞とクリプトのような芽を生成する腸 organoids にレプリケートされます。絨毛のような8になります。腸器官毛細のためだけでなく微小管と薬と食品のスクリーニングのための理想的なプラットフォームを提供することと同様に、上皮細胞の分化が、他の多くの蛋白質の中に centrosomal の再編を検討する強力なモデルを表す化合物の潜在的な治療の利点9,10。
Organoids、蛍光付けられた蛋白質のライブ イメージングに適して両方ノック- と編集11,12CRISPR/Cas9 遺伝子を用いたノックアウト オルガノイドを生成できます。しかし、式と勉強する内因性のタンパク質の局在化の確立は重要な特にタグ付きタンパク質の動作を確認します。免疫標識 3 D organoids 地下マトリックスまたはex vivo分離の成長組織は 2 D で培養皿で育った細胞よりも複雑です。固定のプロトコルは (すなわち、結合の抗体のエピトープ) 抗体の抗原性を維持したままオルガノイドの繊細な 3 D 構造を維持する必要があります。たとえば、4% パラホルムアルデヒド (PFA)、定着剤として使用されますが、比較的迅速な演技の定着剤と形態のよい保存を与える、私たちの経験でそれ頻繁抗原性が失われる結果、多くには適していませんcentrosomal 抗体。3 D 構造と組織に浸透する定着剤および抗体の能力を考慮も必要があります。このためには、我々 が変更し、組織分離と 3 Dの in vitro organoids とex vivoの間接免疫標識の開発されたプロトコルが腸組織を分離しました。固定して地下マトリックス内免疫標識の代替として 3 D オルガノイドの隔離のためのプロトコルで、小さい腸陰窩と絨毛と大腸の組織を分離する方法をについて説明します。微小管と、ninein などの centrosomal 蛋白質 (参照も参照8、EB タンパク質やクリップ 170 など微小管プラス端までトラッキング蛋白質 (+ ヒント) 免疫標識の 3 つの代替固定のプロトコルを提案します。 13)。各プロトコルに関連付けられている賛否両論についても述べる。
プロトコル
ここで説明したすべてのメソッドは、イーストアングリア大学の機関のライセンス ガイドラインに従って行われました。
1. 腸組織の分離
- 体液免疫標識のための分離 (図 1、図を参照してください)
- 大腸 (盲腸で先頭と尾の方を抽出) を外し (CO2窒息を使用して) マウスを安楽死させるハサミとピンセット14解離性大。
- リン酸緩衝生理食塩水 (PBS) ガラス ピペットのゴム球を用いた結腸の内容をフラッシュします。PBS: (8.0 g/L) 塩化ナトリウム、塩化カリウム (0.2 g/L)、リン酸水素二ナトリウム (1.15 g/L)、および ph 7.3 カリウム リン酸 (0.2 g/L)。
- 金属棒 (直径 2.4 mm) またはガラス ピペットの末尾を使用して、軽くロッド/ピペット、上皮が外側に今こうして大腸組織を裏返すことで組織をスライドしながら大腸の管の一方の端を保持します。
注: これが可能でない場合を開き、コロンをはさみ、スライス 5 mm 幅。 - 40 mL の PBS を含む 50 mL の円錐管にすぼまりコロンまたは部分を転送します。
- さらに腸の内容を削除、粘液等を数回チューブを反転します。
- コロン/部分を 3 mM PBS の EDTA の 40 mL に転送し、部屋の温度 (RT) 15 分間インキュベートします。
注: は、PBS で 0.5 M EDTA pH 8.0 株式を希釈します。 - 粘液を取り除き 3 mM PBS の EDTA の 40 mL の新鮮なを含む 50 mL の円錐管にコロン/部分を転送を振る。室温 35 分間インキュベートします。
- 50 mL の円錐管に 10 mL の PBS にコロン/部分を転送、30 のため積極的に振る地下聖堂 (クリプト分数) を公表します。
- チューブからコロン/部分を取り外し、さらに分離が必要な場合に 3 mM EDTA に置きます。5 分間 300 x g で残りの地下室部分を遠心します。
- 上清の 5 mL を削除し、残りの 5 mL ボリュームでクリプト ペレットを再懸濁します。
- 体液の存在を確認する (50-100 倍) ズーム実体顕微鏡下で観察します。
注: がある場合ない地下室の存在、コロン/作品別の 30 分の 3 ミリメートルの PBS で EDTA をインキュベートし、手順 1.1.8 - 1.1.11。 - 5 分間 300 x g でクリプト分数を遠心します。
- クリプト ペレットを取得してすぐに固定 (セクション 3) に進むすべての上清を除去します。
- 小さな腸陰窩および免疫標識の絨毛の分離 (図 2)
- (CO2窒息を使用して) マウスを安楽死させるし、はさみとピンセット14解離性大小腸 (回腸末端に近位十二指腸) を削除します。
注: 異なるビューに小腸のこの段階でのセクションが分離し、別々 に扱います。フロー図とタイミングの図 1と表 1を参照してください。 - ゴム球、ガラス ピペットを使用して PBS で小腸の内容をフラッシュします。
- 解剖はさみで小腸を切開、ペトリ皿で 15 mL の PBS の場所します。
- 優しく粘膜表面を破損していない間腔のコンテンツを削除する PBS で腸を洗浄します。新鮮なシャーレに組織を転送し、PBS 洗浄を繰り返します。
- 腸を 3 〜 5 mm に切ると 100 mm 30 mM PBS の EDTA の 15 mL を含むシャーレに移し、PBS で 3 mM EDTA で 30 分インキュベートする RT。 また、5 分の間孵化させなさい。
- 分数 1 (絨毛の分離): 50 mL の円錐管、10 s、および 100 mm ペトリ皿に注ぐのため積極的に振るで 10 mL の PBS に腸の部分を転送します。顕微鏡下で孤立した絨毛の一部を確認します。この段階でほとんど絨毛が存在する必要がありますが、分離によって異なります。
注: 孤立した絨毛/陰窩を防ぐためにプラスチック、ペトリ皿、コレクション チューブに付着する必要がありますプレコート胎仔ウシ血清 (FBS)。料理および/またはチューブに FBS を注ぐし、すぐにそれを削除します。各画分のタイミング ガイドの表 1を参照してください。 - 30 mM PBS で EDTA に腸の部分を転送し、5 分間インキュベートします。この潜伏中に 15 mL の円錐管 (FBS のプレコート) と 300 × g で 5 分間遠心する分数 1 を収集します。
- 分数 2: は、100 mm のペトリ皿に 10 mL の PBS、20 s とし、注ぐのため積極的に振ることを含む 50 mL の円錐管に腸の部分を転送します。顕微鏡下で分数を確認します。通常、この段階の絨毛と陰窩の混合培養では、(図 2 a) を提示します。
- 30 mM PBS で EDTA に腸の部分を転送し、さらに 5 分間インキュベートします。この潜伏中にペレット分数 2 (FBS のプレコート) 15 mL コニカル チューブに 300 x g で 5 分ペレットを乱すことがなく分数 1 と 2 から上清を除去し、すぐに固定 (手順 3.) に進みます。
- 分数 3 (地下室の分離): 50 mL のチューブ、20 s、および 100 mm のペトリ皿に注ぐのための手ふれで 10 mL の PBS に腸の部分を転送します。顕微鏡下での割合を確認します。この段階で、分数は陰窩 (図 2 b) 主に含まれます。
- 分数 4: は、10 mL の PBS、20 s、および 100 mm のペトリ皿に注ぐのための手ふれに腸の部分を転送します。顕微鏡下での割合を確認します。この段階で陰窩のみが表示されます。
- 分数 5: は、10 mL の PBS、20 s、および 100 mm のペトリ皿に注ぐのための手ふれに腸の部分を転送します。顕微鏡下での割合を確認します。通常、この段階で非常に少数の陰窩が抽出されます。場合よりも、いくつかの地下室を抽出、6th分数を続行します。
注: 純粋なクリプトの人口が必要な場合 (たとえば、organoid 世代)、し、70 μ m の細胞のストレーナーをクリプト豊か画分から任意のままの絨毛を削除する使用します。 - 別の 15 mL の円錐管で 300 × g で 5 分間遠心する分数 3-5 を収集します。
- 分数 3 - 5 のペレットをチェックしペレットを乱すことがなく培養上清を削除し、すぐに固定 (セクション 3) に進みます。
- (CO2窒息を使用して) マウスを安楽死させるし、はさみとピンセット14解離性大小腸 (回腸末端に近位十二指腸) を削除します。
2。24 ウェル プレートの地下行列ドームから腸オルガノイドの分離
注: 地下行列ドーム内オルガノイドの形成されている12を他の場所で説明されています。
- 製造元の指示に従って地下行列ドームと井戸をコートします。
- 500 μ L の PBS を基底行列ドームを含む洗浄井戸。
- 携帯復旧ソリューション (4 ° C) の 250 μ L 冷たいを各ウェルに追加 (材料の表を参照してください)。
注: 冷たいセル復旧ソリューションはすべてが安定している微小管を外界します。 - P1000 マイクロ ピペットを使用して地下行列ドームをこすりと慎重にピペットの上下に分裂する中、プラスチックから地下の行列を取り外します。
- 1.5 mL 低結合マイクロ遠心チューブ用の上澄みを収集します。
- 数回 1.5 mL 低バインド チューブを反転し、organoids は隔離し自由自在にかどうか、塊ではなく顕微鏡下で確認します。顕微鏡下でチューブを押しながら低 (50 倍) の倍率で表示。
- 右で 5 分間 1,000 × g で遠心分離によって、オルガノイドをペレットします。
- 回復剤を削除し、すぐに固定 (手順 3.) に進みます。
3. 分離腸組織とオルガノイドの固定
- メタノール固定
- -20 ° C で 10 mL に分離された腸のクリプト/絨毛率と 1 mL のメタノールでオルガノイドを再懸濁します
- 15 分間冷凍庫で-20 ° C で陰窩/絨毛/オルガノイドをインキュベートし、尿管 5 分ごとを反転します。
- 5 分間 1,000 × g で遠心分離によって陰窩/絨毛/オルガノイドのペレットします。
- メタノールを削除し、洗浄溶液 (1 mL オルガノイドの隔離された地下室/絨毛分数の 10 mL) を追加します。洗浄液かで構成される PBS 1% 血清または PBS で 0.1% の洗剤と 1% の培地。
注: は、二次抗体のと同じ種からの血清を使用します。たとえば、二次抗体はヤギで生成されたヤギ血清を使用しています。 - すぐに、ペレットに 5 分間、1,000 x g で陰窩/絨毛/オルガノイドを遠心分離機します。
- 洗濯ソリューションを削除し、新鮮な洗浄液で陰窩/絨毛/オルガノイドを再懸濁します。
- 20 rpm に設定速度で管回転子に配置します。1 時間、15 分毎 (5 分 1,000 x g) 遠心分離によって陰窩/絨毛/オルガノイドをペレット化し、洗浄液の交換の合計のセルを洗浄します。
注: チューブ回転子が利用できない場合、反転チューブ手動で 5 分ごとに孤立した文化を再懸濁します。
- ホルムアルデヒド ・ メタノール固定
注: は、ヒューム フードにおけるホルムアルデヒドと定着剤を処理します。- 10 mL で隔離された地下室/絨毛または-20 ° C 固定液 (800 μ L のホルムアルデヒド溶液とメタノールの 9.2 mL) 1 mL に organoids 再懸濁します。
- -20 ° C で 15 分間冷凍庫で陰窩/絨毛/オルガノイドを修正し、5 分ごとのチューブを反転します。
- 5 分間 1,000 × g で遠心分離によって陰窩/絨毛/オルガノイドのペレットします。
- ホルムアルデヒド ・ メタノールを削除し、洗浄溶液 (1 mL オルガノイドのまたは隔離された地下室/絨毛分数の 10 mL) を追加します。洗浄液かで構成される PBS 1% ヤギ血清または PBS で 0.1% の洗剤と 1% の培地。
- 陰窩/絨毛/オルガノイドをペレットに 5 分間、1,000 × g で遠心分離機します。
- 洗濯ソリューションを削除し、新鮮な洗浄液で再懸濁します。
- 20 rpm に設定速度で管回転子に配置します。1 時間、15 分毎 (5 分 1,000 x g) 遠心分離によって陰窩/絨毛/オルガノイドをペレット化し、洗浄液の交換の合計のセルを洗浄します。
- PFA 固定
注意: 粉体 PFA とソリューション ヒューム フードで処理する必要があります。
メモ: は、PBS に PFA を使用ほとんどの場合 4% が抗体抗原性の保存によって低濃度を使用可能性があります。- 10 mL の 4% で孤立した小球形にされた地下聖堂/絨毛を再懸濁します PFA と RT で 1 時間インキュベートし、免震ペレット 1 ml organoids 4 %pfa と 30 分間インキュベートします。両方のケースで尿管の 10 分毎を反転します。
- 5 分間 1,000 × g で遠心分離によって陰窩/絨毛/オルガノイドのペレットします。
- PFA を削除し、洗浄溶液 (1 mL オルガノイドの隔離された地下室/絨毛の 10 mL) を追加します。洗浄液は、0.1% の洗剤と 1% の血清で PBS で構成されます。
- 陰窩/絨毛/オルガノイドをペレットに 5 分間、1,000 × g で遠心分離機します。
- 洗濯ソリューションを削除し、新鮮な洗浄液で再懸濁します。
- 速度 20 rpm にセットとチューブ回転子に配置します。1 時間、15 分毎 (5 分 1,000 x g) 遠心分離によって陰窩/絨毛/オルガノイドをペレット化し、洗浄液の交換の合計のセルを洗浄します。
注: チューブ回転子が利用できない場合、反転管手動で 5 分ごとに孤立した文化を再懸濁します。 - 抗原検索 (PFA 固定用推奨オプションの手順)
- 5 分間 1,000 × g で遠心分離によって陰窩/絨毛/オルガノイドをペレットし、上澄みを除去します。
- 10 mM クエン酸ナトリウム pH 6.0 (80 ° C に加温) の 1-10 mL を追加し、20 分で 80 ° C で孵化させなさい。
- 5 分間 1,000 × g で遠心分離によって陰窩/絨毛/オルガノイドをペレットし、上澄みを除去します。
- 新鮮な 10 mM クエン酸ナトリウム pH 6.0 (80 ° C に加温) の 1-10 mL を追加し、室温で 20 分間インキュベートします。
- 5 分間 1,000 × g で遠心分離によって陰窩/絨毛/オルガノイドをペレットし、上澄みを除去します。
- 1% 血清と 1-10 mL PBS で洗浄し、さらに 3 回ペレット陰窩/絨毛/オルガノイド (5 分 1,000 x g) 遠心分離によって新鮮な洗浄ソリューションを追加する前に繰り返します。
4 ステップのブロッキング
- ブロッキング液を作る: PBS で 10% 二次抗体種血清を追加 (オプション: 0.1% 洗剤を追加)。
- 遠心分離 (5 分間 1,000 g x) によって陰窩/絨毛/オルガノイドをペレットし、上澄みを除去します。
- 必要なサンプルの数によってブロッキング溶液 5-10 mL を追加 (下のメモを参照してください)。この段階では、異なる抗体の汚損のため個々 のチューブ (0.2 - 1 mL を含む各管の 1.5 mL の低結合マイクロ遠心チューブ用) に陰窩/絨毛/オルガノイド ソリューションを分割します。
注: 各分離陰窩/絨毛の一部をペレットのサイズに応じてさまざまなラベリング組み合わせに使える 5 10 サンプル間与えます。理想的には、ペレット サイズ 2-4 mm の間は、各サンプルに必要です。
5. 一次抗体の孵化
- 10% 血清と 0.1% 洗剤を含む PBS で一次抗体 (材料の表を参照) を希釈します。100 に 200 μ L の間一次抗体の解決策は、遠心チューブ サンプルごとに必要です。
- 遠心分離 (5 分間 1,000 g x) ブロック ・ ソリューションを取り外します。
- 第一抗体溶解液で陰窩/絨毛/organoid ペレットを再懸濁します、一晩チューブ回転子 (20 RPM) を使用して懸濁液の陰窩/絨毛/オルガノイドを維持する 4 ° C で孵化させなさい。
- 次の日: チューブ回転子 (20 rpm) 1 h の RT に戻るサンプルをもたらします。
- 遠心分離 (5 分間 1,000 g x) によってサンプルをペレットし、一次抗体ソリューションを削除します。
- 洗浄ソリューションの 1 つの mL を追加し、クリプト/絨毛/organoid ペレットを再懸濁します。
- すぐに (5 分 1,000 x g) 遠心分離によってソリューションを削除します。
- 1 ミリリットル新鮮な洗浄ソリューションを追加し、2 時間チューブ回転子 (20 rpm) のセルをスピンします。遠心分離手順 5.7 のように 30 分毎の洗浄ソリューションを変更します。
6. 二次抗体の孵化
- 二次抗体 (材料の表を参照してください) PBS で 10% 血清と 0.1% 洗剤を希釈します。二次抗体の解決の約 200 μ L 遠心チューブ サンプルごとに必要です。
注: 強くクロス吸収される抗体は、マウス/地下室/絨毛 organoid で二次抗体の反応性を減らすために使用ください。 - 陰窩/絨毛/オルガノイドをペレットし、二次抗体溶液を 200 μ l 添加でペレットを再懸濁しますに 5 分間、1,000 × g で遠心分離機します。
- 1 時間常温管回転子 (20 rpm) にチューブをスピンします。
- ペレット陰窩/絨毛/オルガノイド培養上清 (非バインド二次抗体) を削除し 5 分間 1,000 × g で遠心分離機します。
- 洗浄ソリューションでペレットを再懸濁します、陰窩/絨毛/オルガノイドをペレットに 5 分間、1,000 x g ですぐに遠心力場します。
- 上澄みを除去し、新鮮な洗浄溶液 1 mL にペレットを再懸濁します。
- 6.3 6.6 の手順で前述した洗浄液を 20-30 分毎変更、1.5-2 時間常温管回転子 (20 rpm) でスピンします。
7. 核染色
- DAPI やヘキストなど (製造元のプロトコル)、に従って洗浄ソリューションで核染色を希釈します。たとえば: DAPI 原液 (20 mg/mL) は希釈 1:10, 000。原液は、-20 ° C で因数で保つことができます。
- 陰窩/絨毛/オルガノイドのペレットを外し、洗浄液に 5 分間、1,000 × g で遠心分離機します。
- ーシス ソリューションでペレットを再懸濁します。
- 10 分間常温管回転子 (20 rpm) でスピンします。
- 陰窩/絨毛/オルガノイドのペレット、核染色ソリューションを削除し、洗浄ソリューションでペレットを再懸濁します 5 分 1,000 × g で遠心分離機します。
- 30-60 分、10 分毎の洗浄ソリューションを変更する RT でチューブ回転子 (20 rpm) でスピンします。
8. 取付分離 Organoids、絨毛、陰窩
- 陰窩/絨毛/オルガノイドのペレットを外し、すべての洗浄液に 5 分間 1,000 × g で遠心分離機します。
注: 場合は、ペレットを分散させる、遠心分離再び。 - ハードの設定がペレットに antifade エージェントとメディアのマウントの 2 滴を追加します。
- P200 ピペットの端をカットし、慎重にメディアをマウントでペレットを再懸濁します。泡の生成を避けます。
メモ: 分離における文化は非常に粘着性がある;必ず完全に再懸濁します。 - 陰窩/絨毛/オルガノイド マウント メディア ソリューションでの混合物を転送し、顕微鏡スライドの中央に沿ってラインの分配にマイクロ ピペットを使用します。
注: ラインは使用されるカバーガラスより長くしないでください。顕微鏡を使用して陰窩/絨毛/オルガノイドのスライドにも広がるし、群生しないかどうかを確認します。 - 慎重にカバー ガラスをトップに置きます泡の生成を避けます。
- スライド本と共焦点顕微鏡で分析する前に設定するメディアをマウント一晩冷蔵庫でストアのガラス スライドを配置します。
注: マウス抗体の商業の蛍光を使用マウス組織染色キット (材料の表を参照してください)。ブロッキング (セクション 4) を蛋白質ブロッキング液のキットに付属しているブロッキング試薬で 1 時間培養で 10 分ブロックに置き換えます。(洗濯) の真中でステップ 5.8 で、蛍光シグナルの増強物試薬で 1 時間培養を追加します。蛍光液 (他の二次抗体も使えますこの試薬との組み合わせで) のキットの試薬を使用します。上記のように孵化させなさいし、プロトコルの残りのステップ 6 から続行します。
9. 固定と地下マトリックス内オルガノイドの免疫標識
注: Organoids 運命固定用、24 ウェル プレート (ウェルあたり 1 つドーム) の丸いガラス coverslips 上に地下行列ドームで生成された地下マトリックス内に残っている間免疫標識します。Organoid 地下行列ドームは、24 ウェル プレート内追加と様々 なソリューションの削除によって処理されました。
- 井戸からメディアを削除し、追加定着剤;1 h のままにします。
- 固定を外し、PBS 2 時間 1% 血清と 0.1% 洗剤を含む、30 分毎の変更で洗います。
- 洗浄ソリューションを削除し、1 時間 10% 血清と 0.1% 洗剤で PBS でブロックします。
- 1% 血清と PBS または 1% の血清および 0.1% の洗剤で PBS で抗体を希釈します。
- ブロッキング液を削除し、100-200 μ L 一次抗体を追加各ウェルに (参照材料表) ソリューション。
注: さらに抗体を希釈しないようにすべてのブロッキング ソリューションを削除することが重要です。 - 冷蔵庫の中にプレートを置き、4 ° C で一晩インキュベート
- RT に 1-2 h のまま。
- 抗体溶解液と洗浄液 20 分毎の変更 2-3 h の洗浄を削除します。
- すべての洗浄ソリューションを削除し、PBS で 1% 血清; 100-200 μ L 二次抗体希釈 (参照材料表) を追加室温 1 時間インキュベートします。
- 二次抗体の解決および洗浄 2 時間、20 分毎の変更を削除します。
- 洗浄ソリューションを削除し、DAPI 溶液を追加1:10, 000 で希釈した使用 DAPI 原液 (20 mg/mL) で 10 分のままにします。
結果
免疫標識の腸組織の分離
大腸と小腸の記述されていた組織の隔離のプロトコルは、保全と微小管と関連するタンパク質の免疫標識ではなく、幹細胞と器官毛細世代 (図 1と表 1を最適化しました。).目的は、クリプトを生成して絨毛の派閥としてされたが構造を保持し、氷冷ソリューションは、誘導する微小管の脱重合を防ぐために EDTA と寒さへの暴露を最小限に抑えながら、できるだけ (粘液および他の組織) に欠けているきれいすべてが安定している微小管の脱重合。分離の小さい腸の組織から分画 2 と 3 のイメージの例を図 2に示します絨毛と陰窩 (図 2 a, B)、分数 3 の両方の混合物を含む分数 2 で主に陰窩 (図 2 が含まれます、D)。
固定と分離の腸組織の免疫標識
個別または組み合わせての分数が固定のため処理されたと一連の固定を含む手順によって免疫標識、洗剤、ブロック、抗体、および再最終絨毛/陰窩を中断する前に洗浄溶液、メディアをマウントでペレットスライドに転送してガラス coverslips にカバーします。絨毛と陰窩、共焦点顕微鏡をイメージしました。
良い保全と絨毛と陰窩でのアクチンと微小管の標識は、次によって達成された: 0.1% 洗剤と 1% 血清を含むと PBS で 0.1% を使用してブロックの PBS で洗浄を繰り返し、-20 ° C でホルムアルデヒド ・ メタノール固定の組み合わせ洗剤と 10% 血清、一次抗体に 4 ° C、常温 (図 3) 二次抗体の 2 h で一晩インキュベート続きます。ホルムアルデヒド ・ メタノール固定してもラベル付けのためによく働いた + EBs など隔離された地下聖堂と絨毛 (図 4) クリップ 170 のヒントします。格子に沿って安定した微小管協会は、絨毛のサンプル (図 4) で見ることができる (彗星として知られている) 微小管プラス端 EB3 蓄積が陰窩 (図 4 a) で明白であります。異なるローカライズ クリップ 170 と p150 の接着(ダイナクチンのサブユニット) が分離絨毛 (図 4 b) 頂 n MTOCs で明らかであります。ホルムアルデヒド ・ メタノールのプロトコルの固定は、一貫してマウス ninein 私たち Pep3 抗体を用いた分離の腸組織における ninein のローカリゼーションのため動作しませんでした。-20 ° C でメタノール固定は続いて同じ洗濯し、隔離された地下聖堂と絨毛 (図 5; 参照8) 内にある ninein の非常に良いローカリゼーションを与えたホルムアルデヒド ・ メタノールとしてソリューションをブロックします。興味深いことに、ninein が根尖部の中心に集中している間、細胞ベースでいくつかの蓄積は、隔離された地下聖堂 (図 5) 内のいくつかのセルに明らかだった。これは非固有のラベル付けや分離のプロシージャを遅らせる結果によるものかどうか固定・保存に影響を与える必要がありますさらに調査。しかし、絨毛 (8の図 3biを参照) のメタノール固定 (-20 ° C) クライオスタット切片は、ninein その ninein を示唆しているいくつかの細胞の基本細胞の微小管の基底人口も関連付けることができますを明らかにしました。
固定と organoids 地下マトリックス由来の免疫標識
小さな腸 organoids は生成され、地下行列は、3 週間以上 (図 6A; 参照6,15) で栽培します。風邪 (4 ° C) 細胞回復ソリューションは、地下行列からオルガノイドを分離する使用されました。オルガノイドの者地下マトリックス ソリューション チューブを移管・固定および免疫標識の前に遠心分離します。これは非常にきれいな準備を生産し、organoids 様々 なソリューションの良いアクセスを許可しました。Organoid 絨毛ドメイン内で分化した細胞を含む安定の切端基底微小管;これらの標識はほとんどの場合 (図 6 bC) まあ、EB1 は、微小管の格子 (図 6 e; 参照13) に沿っても見ることができます。しかし、冷たいセル復旧ソリューション可能性があります動的微小管の脱重合 (図 6 階基底のクリプト ドメイン内で (これは成長している微小管プラス端にバインド) EB1 彗星の欠如によっていくつかのサンプルで明らかだった).他のサンプルでアストラル (動的) 微小管には (図 6) が保存されていた。Organoid 分離固定する前に、免疫標識はまた付着蛋白質、ninein、クリップ-170、杯細胞と enteroendocrine セルのクロモグラニン A のムチンなどの細胞マーカーに勤務。
固定と地下マトリックス内オルガノイドの免疫標識
図 7嚢胞段階 (A-C) では、地下開発 (D)、ホルムアルデヒド ・ メタノールで固定し微小管と ninein の免疫標識の初期段階で、organoid を示しています。良い微小管保全ラベルと頂 n MTOCs で ninein のラベルが目立ちました。図 8 a, B は、微小管と EB1 の日 6 におけるメタノールのプロトコルで固定し、ラベル内クリプト ドメインを示しています。微小管と EB1 彗星のよい保存動的微小管の保全を示唆して明らかにされました。
地下マトリックス内に残っている間も Organoids された固定および免疫標識します。このプロシージャの不利な点が定着剤の不溶と地下マトリックス (図 8 b) 内抗体の捕捉がどちらの場合より少ない頻繁とき 0.1% 洗剤に含まれていた固定されたり、ソリューションを洗っています。さらに、4 %pfa していない保持よく地下の行列が原因に溶かすために、これは以下のように 1% が PFA。メタノール固定は、他の一方で、時々 organoid 崩壊を誘発しました。
幹細胞のマーカー Lgr5、パネート細胞のマーカーに対してなど、いくつかの抗体を標識 CD24 4 %pfa、メタノール、またはホルムアルデヒド ・ メタノールのプロトコルの失敗を証明しました。ただし、1% 地下マトリックス内固定、organoids 室温で 0.1% 洗剤で PBS で PFA は、Lgr5 と CD24 のラベリングの結果でした (図 9)。
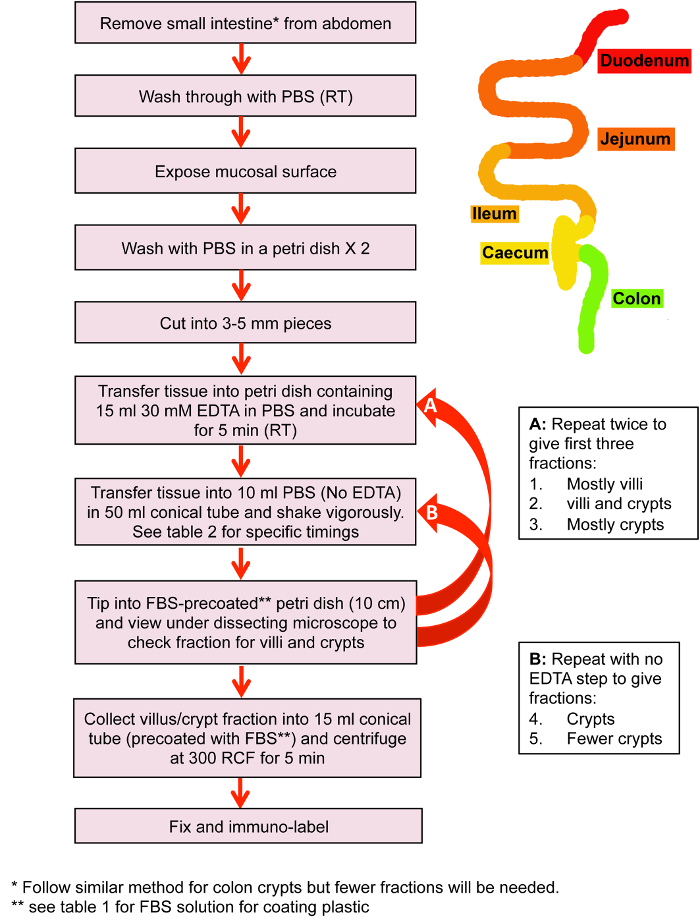
図 1: 小さな腸絨毛と陰窩の分離します。小さな腸絨毛および固定および免疫標識の前にクリプト分離の主な手順のフロー図。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 絨毛と陰窩マウス小腸から分離します。(大きい矢) 絨毛と陰窩 (小さな矢印) を示す腸の分数の明視野顕微鏡画像。(A, B)分数 2 は絨毛と陰窩の混合物を含み、絨毛と地下室の形態の保存ですBで明らか。(C, D)分数 3 は、陰窩の分離と絨毛とCで分岐されたクリプトを含むそのまま地下室がないことを示しています。スケール バー = 500 μ m (, C);100 μ m (B, D)。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 小さい腸絨毛とホルムアルデヒド ・ メタノールで固定し微小管とアクチンの免疫標識の地下室を分離します。(A) 示されている異なったセルタイプに絨毛およびクリプト上皮の模式図。強調表示されているボックスは、 BとCで画像化された代表的な領域を示しています。(B、C)絨毛 (B) と 30 mM EDTA を使用して、ホルムアルデヒド ・ メタノールで固定、1% ヤギ血清および 0.1% 洗剤を含む PBS で洗浄、PBS でブロックされて小腸から分離された基底の地下室 (C) の部分を共焦点光学セクション10% ヤギ血清および 0.1% 洗剤、およびラット モノクローナル抗チューブリン抗体 (緑) と微小管とアクチン ウサギ ポリクローナル抗 β-アクチン抗体 (赤) とラベル付きを含みます。手入れが行き届いた切端基底微小管束は、絨毛と地下の両方のセル明らかとアクチンは内腔 (矢印) に直面して根尖部に集中するいると見なすことができます。スケール バー 5 μ m を =。この図の拡大版を表示するのにはここをクリックしてください。
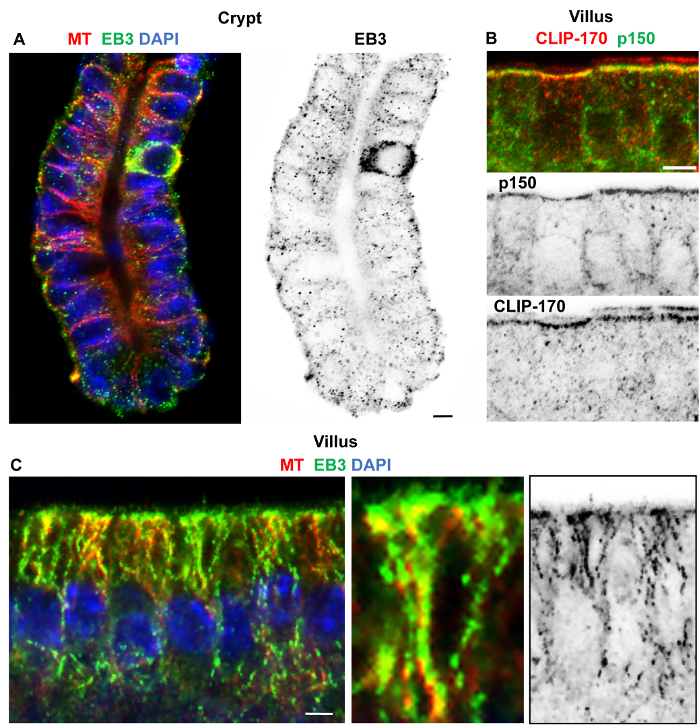
図 4: 分離小腸陰窩および絨毛ホルムアルデヒド ・ メタノールで固定、微小管、EB3、p150 の接着、およびクリップ 170 免疫ラベルします。クリプトおよび絨毛地域の共焦点光学セクション 30 mM EDTA を用いた小腸から分離した、ホルムアルデヒド/メタノール 10% ヤギ血清および 0.1% 洗剤を含む PBS で洗浄で修正 10% ヤギ血清および 0.1% 洗剤を含む PBS でブロックと免疫標識。(A) 地下室 (赤) ウサギ ポリクローナル α-チューブリン抗体およびラット モノクローナル抗体 EB3KT36 抗体 (緑) の付いたし、切端基底微小管や EB3 彗星を示す DAPI (青) が付いている DNA の染色します。逆シングル チャンネルの画像は明らかに安定した微小管だけでなく、動的のよい保存を示唆している基底の陰窩細胞を通して EB3 彗星を示しています。(B) 絨毛上皮細胞の付いたウサギ抗体クリップ 170 (赤色でも16を参照) とマウスのモノクローナル抗体 p150接着頂を示す抗体 (緑) の共局在。逆シングル チャンネルの画像は次のとおりです。(C) 絨毛細胞ウサギ ポリクローナル α-チューブリン抗体 (赤) とラット モノクローナル EB3 KT36 抗体 (緑) が付いた、DAPI (ブルー) 格子に沿って EB3 切端基底微小管の表示が付いている DNA の染色します。逆シングル チャンネルの画像は、EB3 彗星と格子協会を示唆している、EB3 格子協会は拡大画像でハイライトされます。スケール バー 5 μ m を =。この図の拡大版を表示するのにはここをクリックしてください。

図 5: 孤立した大腸クリプト メタノール、ninein と E-カドヘリンの免疫標識で修正、DAPI 染色します。基底の共焦点光学セクションと地下室のトランジット増幅領域 3 mM EDTA を用いた大腸から分離されたとメタノールで固定、1% ヤギ血清および 0.1% 洗剤を含む PBS で洗浄し、10% ヤギ血清および 0.1% 洗剤を含む PBS でブロックされています。地下室はウサギ ポリクローナル ninein 抗体が付いていた (Pep3 も参照参照8、赤) と E-カドヘリン マウスモノクローナル抗体 (緑) と染色 DAPI (青)。逆シングル チャンネルの画像は、ninein のみを示しています。画像は、個々 のセルおよび根尖部の中心に集中している ninein の概要を明らかに E-カドヘリンとよく保存されたクリプトを示しています。良い浸透定着剤と、抗体と抗原性の保存を示唆しています。スケール バー 5 μ m を =。この図の拡大版を表示するのにはここをクリックしてください。

図 6: organoids 免震における開発、固定との免疫ラベルします。(A) 位相コントラスト画像を示す発達の異なる段階における細胞集塊から花芽分化と完全には嚢胞を形成 organoids クリプトと絨毛のドメインを持つ。(B-F)ホルムアルデヒド ・ メタノール固定、ブロック 10% ヤギを含む PBS で 10% ヤギ血清および 0.1% 洗剤を含む PBS で洗浄後、4 ° C (10 分) で細胞の回復ソリューションを使用して地下行列から分離されたオルガノイドを共焦点光学セクション血清および 0.1% 洗剤、および微小管、β-カテニンは、EB1 に免疫ラベル付け。(B) というラベルの付いた微小管 (青) と β-カテニン (赤) 良い微小管保全を明らかにし、大部分の細胞ラベリングにおける嚢胞。(C) 異なる切端基底微小管は、organoid 嚢胞からこれらの拡大された上皮細胞明らかです。(D) というラベルの付いたアストラル (動的) 微小管 (矢印) を含むスピンドルを示す微小管細胞分裂します。(E, F)絨毛ドメイン (E) およびいくつか EB1 ラベリングの絨毛、特に安定した微小格子に沿って動的を示唆している基底のクリプトの中でも非常に少数の EB1 彗星を見ている間示すクリプト ドメイン (F) における地域微小管が保存されていません。スケール バー = 20 μ m (A);2 μ m (D);5 μ m (B, C, E-F)。この図の拡大版を表示するのにはここをクリックしてください。

図 7: Organoids ホルムアルデヒド ・ メタノールで地下マトリックス内に固定されて、微小管と ninein の免疫ラベルします。オルガノイドの共焦点光学セクション、ホルムアルデヒド ・ メタノールで固定、洗浄し 10% ヤギ血清および 0.1% 洗剤を含む PBS でブロックし、地下行列のままラベル付け。(A-C)Organoid 嚢胞というラベルの付いた微小管 (緑) と ninein (Pep3; 参照8赤) (青)で結合されたイメージを示す DAPI 染色し、微小管 (B) と (C) ninein のシングル チャンネル画像を反転します。画像を見せる切端基底微小管と頂 ninein ローカリゼーション、非連結の抗体のクリアし同様に、organoid の非常に良い構造保全および抗体の侵入を示唆しています。(D, E)クリプト固定し、上記のようにラベル付けと再び表示優れた構造保全開発、ラベル付け、および抗体のクリアと Organoid。異なる切端基底微小管と根尖部 n 脂質 ninein ローカリゼーションは明らかであり、 Dのボックス化された領域の拡大画像 (E) で強調されています。スケール バー = 10 μ m (A ~ D);5 μ m (E)。この図の拡大版を表示するのにはここをクリックしてください。

図 8: Organoids メタノール中で地下マトリックス内に固定されて、微小管と EB1 の免疫ラベルします。オルガノイドの共焦点光学セクションは、メタノールで固定、洗浄し 10% ヤギ血清および 0.1% 洗剤を含む PBS でブロックし、地下の行列に残っている間、ラベル付け。(A) 嚢胞完全に開発された organoid からドメイン ラベルの付いたウサギ ポリクローナル α-チューブリン (赤) とマウスのモノクローナル抗体 (緑) EB1 抗体切端基底微小管を示す 2 つの分裂細胞で異なる EB1 彗星スピンドル (矢印)。非連結 EB1 の抗体のいくつかのトラップは、明らかです。しかし、良い構造保全と微小管と EB1 の標識が観察されます。EB1 彗星の存在は、動的微小管が残っていることを示唆している (が反転)。(B) 周囲地下行列 (矢印) 内に閉じ込められたかなりの抗体を持つ α-チューブリン抗体の分類を示す organoid 嚢胞領域の反転画像。スケール バー 5 μ m を =。この図の拡大版を表示するのにはここをクリックしてください。

図 9: Organoids 1% 地下マトリックス内固定 PFA Lgr5 と CD24 免疫ラベル。Organoids 1% 地下マトリックス内固定の共焦点光学セクション 0.1% 洗剤を含む PBS で PFA 1% ヤギ血清と 0.1% 洗剤、PBS で洗浄し、Lgr5 と CD24 抗体にラベル付け。(A, B)陽性パネート細胞 CD24 の (赤) クリプト ドメイン内幹細胞ニッチ。共焦点および位相コントラストの画像にマージされています。Bは、CD24 単一チャネルの表示を示しています。(C) Lrg5 肯定的な幹細胞を示すクリプト ドメイン内の幹細胞領域。スケール バー = 10 μ m。この図の拡大版を表示するのにはここをクリックしてください。

表 1: 小さい腸のクリプトおよび絨毛の分離・固定タイムライン。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
腸組織の分離
小さな腸陰窩と絨毛と体液の分離には、粘膜面、遠心分離、分別 (揺れ) 細胞の接触を緩和する EDTA 溶液処理を公開することが含まれます。提示された腸絨毛/地下室の隔離のプロトコルは、補酵素 aらとホワイト ヘッドらから変更されています。17,18
粘膜面を公開します。
我々 は、この手順の開発で腸管の粘膜表面を公開する方法の数を試しましたが。古典的なアプローチは (ターン内側) を片脚に管では、通常約 100 mm 長い、セグメントは 1 つの端をクリックし、残りのチューブで組織のひだでキャッチ金属の棒を使用してチューブ19に下落しました。マウス組織、角の丸い金属の棒 (直径 2.4 mm) が理想的です。このアプローチには、PBS と EDTA へのアクセスを許可する粘膜の表面を拡大しての利点があります。我々 は当初、このアプローチを使用が、移動距離が短い (約 5 cm) に、管を切断しこれは容易に証明されるようにはさみを解剖と各セクションを開きます。このアプローチは、適切な場合にのみ、いくつかの腸が必要です。多くの動物がするかどうか、デバイスを使用実験で、専用切削オープン チューブ縦、米田らによって記述されました。14はより効率的になります。
絨毛と陰窩筋層からの剥離
最初基になる組織17,18から粘膜を緩める 3 mM PBS と比較的長い潜伏時間最大 60 分の EDTA を使用しました。EDTA のこの集中でわかったインキュベーション時間は 30 分マウス結腸から陰窩を緩めるのに十分です.ただし、小腸クリプト/絨毛隔離のため我々 は効率的な方法であることを証明する短い時間のより集中 EDTA を使用してみました。すべての後の作品は、絨毛やへんとう陰窩に関連する分数を生成する 30 mM EDTA 法を用いて抽出した組織で行われました。陰窩、我々 は通常、修正する前に分数 3-5 をプール、それはタイミングが腸管に沿って位置などの要因の数、マウス、炎症、以前ダイエットの年齢に依存しているので、適切な分数がこれらかどうかを確認することが重要、など同様に、組織は次の効果を発揮する EDTA 処理に動揺するのに必要な時間の長さが異なる条件下で異なる場合があります。結果は絨毛と陰窩または主に絨毛または陰窩 (図 2) の混合物を含む分離組織画分です。クリプト抽出が 30 の管の組織を揺することによって 1 つのステップで達成可能かもしれない大腸に絨毛がない、s。これらの画分は固定および免疫ラベリング処理できます。
地下の行列から腸オルガノイドの分離
地下行列ドームからオルガノイドの分離は、細胞の回復ソリューションを使用して実現できます。低ゲル化地下行列が 2-8 ° c. に温度のニーズによってソリューションの作品注意は動的微小管が保持されないがあります。したがって、動的微小管の免疫標識のように、+ EBs セルなどのヒントは、固定する前に地下の行列からの回復はお勧めしません。しかし、器官毛細細胞における微小管のほとんどが比較的安定している、これらの保存された (図 6)。また、centrosomal と接合部のタンパク質として細胞マーカーの免疫標識のためによく働いた。
固定のプロトコル
(新鮮な PFA 製) ホルムアルデヒドはリバーシブルを形成する比較的速効定着剤クロスリンクし、4 %pfa 免疫標識の微小管と γ-チューブリンとファロイジンで染色のアクチン フィラメントの例のためによく働きます。希薄 PFA の高濃度が動作しませんでした、クリプト幹細胞ニッチ内幹細胞マーカー Lgr5 およびパネート細胞マーカー CD24 など免疫標識のためによく働いた 1% など PFA 溶液です。
グルタルアルデヒドの追加を与える微小管と 3.7 %pfa、0.05% グルタルアルデヒド PHEMO バッファー (68 mM パイプ、25 mM HEPES、15 mM グリコールエーテルジアミン四酢酸 3 mM MgCl2)2で 0.5% 洗剤の混合物から成っているいわゆる PHEMO 固定のより良い保全抗原性を損なうことがなく微小管の優れた保護を提供します。それはまたファロイジンで染色のアクチン フィラメントと E-カドヘリン、β-カテニンは、γ-チューブリンの免疫標識のためによく働きます。ただし、3 D ティッシュ、器官毛細文化 PHEMO 固定は矛盾した結果を生成、使用されませんでしたので。
メタノールは、比較的良好な浸透を与える、抗原性を維持するために傾向がある凝集剤の定着剤です。100% メタノール (-20 ° C) の固定いくつかの収縮を紹介し、適度な形態保全と微小管、+ のヒント、および 2 D 細胞培養で ninein を含む多くの centrosomal の抗体のために働きます。ただし、この固定方法を使用する場合、いくつか organoids が崩壊しました。また、全体の陰窩、絨毛、または organoids を介して抗体の浸透は当初、問題が、洗浄ソリューションおよび長期の洗濯に洗剤を 0.1% 添加がより良い結果を達成しました。
ホルムアルデヒド ・ メタノールの組み合わせは、ロジャースらによって以前使用されていた20で免疫ラベル EB1ショウジョウバエ。ホルムアルデヒドの混合物に基づいて固定プロトコルとメタノールしたがって腸組織と 3% ホルムアルデヒドと 97% メタノール-20 ° C に冷やしてがロジャースによって使用された混合物から炭酸ナトリウム 5 mM を省略に基づくオルガノイドのため開発されました。ら。20また、サンプル-20 ° C で冷凍庫で修正されましたこれは特に免疫標識の井戸 + クリップ 170 など、EBs のヒントを働いたが、固定と免疫標識の微小管とアクチン組織と 3 D organoids 内の優れたはまた証明しました。非常に良い構造保全は明らかと抗原性が γ-チューブリンなど ninein、centrosomal 蛋白質と同様、いくつかの細胞骨格と関連付けられているタンパク質の維持されたメタノールより一貫して働いた ninein のラベルが固定。
開示事項
著者は競合する金銭的な利益を宣言しません。
謝辞
著者は、顕微鏡のアドバイスと支援ありがとうポール ・ トーマス。ここに関与するこの仕事は、BBSRC によって支えられた (付与なし。M.M.M. と t. w. BB/J009040/1)。
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma | D8537-500ML | washing and PFA |
| Cell Recovery Solution | Corning | 354253 | isolate organoids |
| lobind microcentrifuge tubes | Eppendorf | 30108116 | prevent cells sticking |
| 0.5 M EDTA solution, pH 8.0 | Sigma | 03690-100ML | Crypt isolation |
| 70 μm cell strainer | Fisher Scientific | 11517532 | Isolate crypts from villi |
| Triton X-100 | Sigma | T8787 | detergent |
| goat serum | Sigma | G6767 | blocking agent |
| Fetal Bovine Serum (FBS) | Sigma | used as non-stick agent | |
| Paraformaldehyde, 4% in PBS | Alfa Aesar | J61899 | fixative |
| Formaldehyde solution (36.5–38% in H2O) | Sigma | F8775 | used as fixative |
| Methanol 99.9% Analytical grade | Fisher | M/4000/17 | used as fixative |
| MaxFluor Mouse on Mouse Immunofluorescence Detection Kit | Maxvision Biosciences | MF01-S | commercial immunofluorescence kit; to reduce non-specific labelling |
| Rotator SB2 or SB3 | Stuart | microcentrifuge tube rotator | |
| Sodium citrate | antigen retrieval | ||
| Hydromount | National Diagnostics | HS-106 | mountant |
| DABCO - 1,4-diazabicyclo[2.2.2]octane | Sigma | D27802 | anti-fade agent |
| Permanent Positive Charged, Pre-Washed, 90 Degree Ground Edges | Clarity | N/C366 | slides |
| Glass coverslip - thickness no. 1, 22 x 50 mm | Clarity | NQS13/2250 | coverslips |
| Matrigel | Corning | 356231 | Basement matrix for 3D organoid culture |
| 50 mL conical tubes | Sarstedt | 62.547.254 | for processing tissue/organoids |
| 15 mL conical tubes | Sarstedt | 62.554.502 | for processing tissue/organoids |
| 1.5 mL LoBind tubes | Eppendorf | 30108051 | for isolated organoids |
| Mouse monoclonal anti-E-cadherin antibody | BD Biosciences | 610181 | primary antibody 1:500 |
| Rat monoclonal anti-tubulin YL1/2 antibody | Abcam | ab6160 | primary antibody 1:100 |
| Rabbit alpha-tubulin antibody | Abcam | ab15246 | primary antibody 1:100 |
| Rabbit anti-beta-actin antibody | Abcam | ab8227 | primary antibody 1:100 |
| Rat monoclonal anti-p150Glued antibody | BD Bioscience | 610473/4 | primary antibody 1:100 |
| Rat monoclonal EB3KT36 antibody | Abcam | ab53360 | primary antibody 1:200 |
| Mouse monoclonal EB1 antibody | BD Bioscience | 610535 | primary antibody 1:200 |
| Rabbit anti-Lgr5 antibody | Abgent | AP2745d | primary antibody 1:100 |
| Dylight anti-rat 488 | Jackson | 112545167 | seconday antibody 1:400 |
| Dylight anti-mouse 488 | Jackson | ST115545166 | seconday antibody 1:400 |
| Dylight anti-rabbit 647 | Jackson | 111605144 | seconday antibody 1:400 |
参考文献
- Bacallao, R., Antony, C., Dotti, C., Karsenti, E., Stelzer, E. H., Simons, K. The subcellular organization of Madin-Darby canine kidney cells during the formation of a polarized epithelium. J Cell Biol. 109 (6 Pt 1), 2817-2832 (1989).
- Bellett, G., et al. Microtubule plus-end and minus-end capture at adherens junctions is involved in the assembly of apico-basal arrays in polarised epithelial cells. Cell Motil Cytoskeleton. 66 (10), 893-908 (2009).
- Mogensen, M. M., Tucker, J. B., Mackie, J. B., Prescott, A. R., Nathke, I. S. The adenomatous polyposis coli protein unambiguously localizes to microtubule plus ends and is involved in establishing parallel arrays of microtubule bundles in highly polarized epithelial cells. J Cell Biol. 157 (6), 1041-1048 (2002).
- Mogensen, M. M., Tucker, J. B., Stebbings, H. Microtubule polarities indicate that nucleation and capture of microtubules occurs at cell surfaces in Drosophila. J Cell Biol. 108 (4), 1445-1452 (1989).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Curr Opin Cell Biol. , (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- van der Flier, L. G., Clevers, H. Stem cells, self-renewal, and differentiation in the intestinal epithelium. Annu Rev Physiol. 71, 241-260 (2009).
- Goldspink, D. A., et al. Ninein is essential for apico-basal microtubule formation and CLIP-170 facilitates its redeployment to non-centrosomal microtubule organizing centres. Open Biol. 7 (2), (2017).
- Verissimo, C. S., et al. Targeting mutant RAS in patient-derived colorectal cancer organoids by combinatorial drug screening. Elife. 5, (2016).
- Young, M., Reed, K. R. Organoids as a Model for Colorectal Cancer. Curr Colorectal Cancer Rep. 12 (5), 281-287 (2016).
- Andersson-Rolf, A., et al. One-step generation of conditional and reversible gene knockouts. Nat Methods. 14 (3), 287-289 (2017).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Goldspink, D. A., et al. The microtubule end-binding protein EB2 is a central regulator of microtubule reorganisation in apico-basal epithelial differentiation. Journal of Cell Science. 126 (17), 4000-4014 (2013).
- Yoneda, M., Molinolo, A. A., Ward, J. M., Kimura, S., Goodlad, R. A. A Simple Device to Rapidly Prepare Whole Mounts of the Mouse Intestine. J Vis Exp. (105), e53042 (2015).
- Andersson-Rolf, A., Fink, J., Mustata, R. C., Koo, B. K. A video protocol of retroviral infection in primary intestinal organoid culture. J Vis Exp. (90), e51765 (2014).
- Coquelle, F. M., et al. LIS1, CLIP-170's key to the dynein/dynactin pathway. Mol Cell Biol. 22 (9), 3089-3102 (2002).
- Belshaw, N. J., et al. Patterns of DNA methylation in individual colonic crypts reveal aging and cancer-related field defects in the morphologically normal mucosa. Carcinogenesis. 31 (6), 1158-1163 (2010).
- Whitehead, R. H., VanEeden, P. E., Noble, M. D., Ataliotis, P., Jat, P. S. Establishment of conditionally immortalized epithelial cell lines from both colon and small intestine of adult H-2Kb-tsA58 transgenic mice. Proc Natl Acad Sci U S A. 90 (2), 587-591 (1993).
- Hamilton, K. L., Butt, A. G. Glucose transport into everted sacs of the small intestine of mice. Adv Physiol Educ. 37 (4), 415-426 (2013).
- Rogers, S. L., Rogers, G. C., Sharp, D. J., Vale, R. D. Drosophila EB1 is important for proper assembly, dynamics, and positioning of the mitotic spindle. J Cell Biol. 158 (5), 873-884 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved