Method Article
Измерения биомолекулярных DSC профили с термолабильных лигандами быстро характеризовать складывания и привязки взаимодействия
В этой статье
Резюме
Мы представляем собой протокол для быстрого характеристика биомолекулярных складывания и привязки взаимодействия с термолабильных лигандов с помощью дифференциальной сканирующей калориметрии.
Аннотация
Дифференциальной сканирующей калориметрии (ДСК) – это мощный метод для количественной оценки термодинамических параметров, регулирующих биомолекулярных складывания и привязки взаимодействия. Эта информация имеет решающее значение в разработке новых фармацевтических соединений. Однако многие фармацевтически соответствующих лигандов являются химически неустойчивыми при высоких температурах, используемых в ДСК анализов. Таким образом измерения привязки взаимодействия сложным, потому что концентраций лигандов и термически преобразованы продукции постоянно меняются в ячейке калориметра. Здесь мы представляем протокол, с помощью термолабильных лигандов и ДСК для быстрого получения термодинамические и кинетические информации о складывания, привязки и лигандом процессов преобразования. Мы применили метод к ДНК aptamer MN4, которая связывает термолабильных лигандом кокаина. С помощью новой глобальной установки анализа, который приходится термолабильных лигандом преобразования, полный набор складывания и привязки параметров получаются из пару DSC экспериментов. Кроме того мы показываем, что константа скорости термолабильных лигандом преобразования могут быть получены с только один дополнительный набор DSC. Представлены руководящие принципы выявления и анализа данных из нескольких более сложных сценариев, включая необратимой агрегации биомолекулы, медленно складывающиеся, медленно привязки, и быстрое истощение запасов термолабильных лиганда.
Введение
Дифференциальной сканирующей калориметрии (ДСК)-это мощный метод для quantitating биомолекулярных привязки и складной взаимодействия1,2,3. Сильные ДСК включают способность для уточнения привязки и складные механизмы и давать соответствующие термодинамических параметров2,3. Кроме того DSC может быть выполнена в растворе рядом физиологических условиях и не требует маркировки биомолекулы или лиганд, например, с флуорофоров, спин этикетки или ядерные изотопы4. Инструмент сканирует температуры, измерять количество тепла, необходимое чтобы денатурировать биомолекулы в присутствии и отсутствии лиганда. Результате термограммы используются для извлечения термодинамических параметров, управляющих лигандом привязки и складывающиеся процессов. Информацию, представленную ДСК или других термодинамических методов имеет решающее значение для руководства дизайн наркотиков ориентации биомолекул1,5,6,,78. Однако повторное сканирование для высоких температур (~ 60-100 ° C) может быть проблематичным. Например многие фармацевтически важных соединений проходят перегруппировки или разложение после устойчивого воздействия высокой температуры9,10,11, т.е., они термолабильных. Экспертиза привязки взаимодействия, DSC, обычно требует несколько вперед и обратного сканирования для проверки воспроизводимости термограммы термодинамический анализ12. Термический первоначального лигандом для вторичной формой с характеристиками измененной привязки приводит к заметными различиями в форму и положение последовательных термограммы, так как концентрация первоначального лигандом уменьшается с каждой проверки во время Термический продуктов накапливаются. Эти наборы данных не поддаются традиционным анализом.
Мы недавно разработали метод глобальные установки для термолабильных лигандом DSC наборов данных, что дает полный набор термодинамических параметров регулирующих биомолекулярных складывания и привязки взаимодействия от одного лиганд прыгните эксперимент, связанный с требуемой термограммы для свободного биомолекулы4. Анализ уменьшает время экспериментальных и образец требует ~ 10 раз по сравнению с стандартным DSC подходов. Мы составили для лигандом термический, предполагая, что это происходит во время высокой температуры часть каждого сканирования, где термограммы не зависит от концентрации лиганда. Таким образом концентрация лиганд — константа, в части термограммы, который используется для извлечения термодинамических параметров. Дополнительно мы продемонстрировали, как константа скорости лигандом термический можно получить, выполнив один дополнительный эксперимент с более длительный период уравновешивания высокой температуры. Для систем, где лигандом термический менее зависит от температуры (т.е., в значительной степени происходит при всех температурах), анализ может быть изменен для включения переменной лигандом концентрации. Здесь мы показываем эту процедуру для ДНК aptamer MN4 присутствии термолабильных лигандом кокаина, который быстро преобразует бензилэкгоин при высоких температурах (> 60 ° C). Хинин используется как отрицательный контроль для лигандом thermolability, поскольку она не претерпела преобразования при этих температурах экспериментально и также связывает MN4. Мы описываем приобретение термолабильных лигандом DSC наборов данных и их анализа, уступая термодинамические и кинетические параметры складывания, привязки и лигандом процессов преобразования.
протокол
1. Пробоподготовка
- Очищайте желаемого биомолекулы13.
Примечание: Этот протокол использует приобретенные кокаина связывания ДНК aptamer MN4 после обмена против 2 М NaCl, три раза после трех раундов деионизованной воды с помощью центробежного фильтра с мембраной отсечения молекулярный вес 3 кДа. - Синтезировать и очистить или приобрести желаемый термолабильных лигандом13.
Примечание: MN4 связывает термолабильных лигандом кокаина. MN4 также связывает хинин, который используется в качестве отрицательного контроля для thermolability лиганда при этих температурах экспериментально. - Подготовьте буферов для диализа очищенный биомолекулы и растворения лигандов (20 мм фосфат натрия и 140 мм NaCl буфера, рН 7,4, MN4 и лигандами использовали здесь).
- Dialyze биомолекулы против по крайней мере 2 Л буфера с помощью диализа трубы с 0,5 - 1,0 кДа отсечения.
- Через фильтр 0.2 мкм, который тщательно сбалансирован с буфером фильтр окончательный буфера (именуемый рабочего буфера).
- Весят из желаемых массы лигандами и растворить их в фильтрованной рабочей буфера. Если желаемый лигандом концентрации требуют масс, которые слишком малы для точного взвешивания, сделайте Стоковый раствор концентрированный лиганда (10 x для примера).
Примечание: Важно, что все эксперименты DSC использовать тот же буфер Рабочая для образца и лигандом, т.е., никогда не выполняют эксперимент, где лигандом растворяется в другой пакет рабочего буфера, чем биомолекулы, как это вызовет буфера артефакты несоответствия в данных. - Биомолекулы Стоковый раствор процеживают через 0,2 мкм фильтр, который тщательно сбалансирован с рабочего буфера.
- Определить концентрацию биомолекулы путем измерений оптической плотности (260 Нм для нуклеиновые кислоты как MN4 и 280 Нм для белков).
- Требуется-80 ° C, если биомолекулы и лигандами терпеть замораживания и длительного хранения или хранения подготовленных биомолекулы и лиганд в холодильнике 4 ° C (подходит для MN4 и лигандами использовали здесь), или на -20. Дега, буфер, биомолекулы и лигандом решения в верхней таблице degasser (см. Таблицу материалы) до загрузки в DSC.
Примечание: Дегазация помогает предотвратить образование пузыря в ДСК при более высоких температурах. Пузырьки вызывают сигнал артефактов, которые скрывать ДСК пик формы и базовых показателей.
2. DSC подготовка
- Отвинтить рукоятку давления от DSC (см. Таблицу материалы).
- Запуск силиконовой трубки из буфера рабочей и прикрепить его к переднего фланца (металлические открытие) ссылка капилляра.
- Создание моста между ссылку и образец капилляров, подключив к передней образца фланец фланец задний ссылки.
- Прикрепите кусок кремния трубы фланец задний образца, который бежит к отходов колбу с вакуумной линией.
- Включите линии вакуумные для очистки DSC 200 мл рабочего буфера.
- Загрузите ссылку капиллярные DSC с буфера рабочей. Придают примерно 3-5 см секций труб кремния ссылка капиллярного фланцы.
- Вставьте наконечник пипетки 1 мл в задний фланец силиконовой трубки. Нарисуйте 0,8 мл рабочего буфера с пипетки и вставьте наконечник пипетки с буфером в передней ссылки фланец силиконовой трубки.
- Аккуратно нажмите пипеткой поршень вниз переходят буфера рабочей через трубку передней кремния в капиллярной ссылку и вверх в задний фланец придает наконечник пипетки. Нажмите вниз пипеткой поршень пока не достигает уровня буфера рабочей чуть выше передних силиконовой трубки, а затем отпустите пипетки поршень пока не достигает уровня буфера рабочей чуть выше задней силиконовой трубки.
- Повторите, передача буфера рабочей взад и вперед, чтобы очистить тома в ссылку капилляра пузырей.
Примечание: Как правило, 10 проходит решения и обратно достаточно, чтобы очистить все пузырьки.
- Повторите, передача буфера рабочей взад и вперед, чтобы очистить тома в ссылку капилляра пузырей.
- Cap кончик задние пипетку с пальца и осторожно потяните на задней пипеткой подсказки и передней пипетку, чтобы удалить их из ссылок фланцы с силиконовой трубки прилагается.
- Загрузите образец капилляра с рабочего буфера как шаги 2,6-2,9. Поместите пластмассовый черный колпачок на задней ссылке и образцы фланцы, оставляя передние фланцы обнаружили.
- Приложите давление ручку.
- Откройте программное обеспечение DSC (см. Таблицу материалы) и оказать давление на инструмент, нажав красный вверх стрелку в верхней части интерфейса после стабилизации мощности чтения; DSC мощность указывается в поле в верхней правой части интерфейса вместе с инструментом температуры и давления.
Примечание: Монитор власть, чтение как DSC герметиков. Изменения в мощности более чем ~ 10 мкВт указывают формирования пузыря в капиллярах, которые могут вызывать помехи в данных. Решения должны быть удалены и дегазации далее прежде чем продолжить. - Сбалансировать DSC с рабочего буфера, выполняя прямого и обратного сканирования. На вкладке «Экспериментальный метод» на левой стороне экрана убедитесь, что выбран параметр «Сканирования» для запуска DSC в режиме сканирования температуры.
Примечание: Экспериментальные параметры являются температура, сканирование диапазона, скорость сканирования, время уравновешивания низких и высоких температур и количество сканов.- В врезные «Температуры параметры» на вкладке «Экспериментальный метод» нажмите на кнопку для «Отопление». Введите 1 и 100 ° C для нижнего и верхнего экспериментальной температур, 1 ° C/мин скорость сканирования, и 60 s на период уравновешивания.
- Нажмите кнопку «Добавить серии» под полем ввода для уравновешивания период. Введите 2 в поле «Шаги для добавления» во всплывающем окне (один отопления и охлаждения одно сканирование) и установите флажок «альтернативное Отопление/охлаждение». Нажмите кнопку «ОК»; Добавлено сканирование появляются в нижней части интерфейса. Убедитесь, что параметры для каждого сканирования как желаемого.
- Запустите эксперимент, нажав на зеленую кнопку «играть» в верхней части интерфейса. Перейдите к нужной папке и введите имя файла для сохранения эксперимент во всплывающем окне. Просмотреть ход эксперимента, нажав на вкладке «Данные» справа от вкладки «Эксперимент метод».
3. сбор термолабильных лигандом DSC наборов данных
Примечание: Минимальная процедура состоит из пяти экспериментов: буфера ссылка эксперименты с и без лиганда (используется для вычитание, см. обсуждение), образец эксперименты с бесплатным биомолекулы, лиганд прыгните биомолекулы и биомолекулы лиганд граница с более длительный период уравновешивания высокой температуры.
- Запуск ссылку эксперименты для вычитание образца данных. Перезагрузить DSC с рабочего буфера в обоих капилляров и собирать несколько вперед и обратного сканирования в диапазоне подходящей температуры на 1 ° C мин-1 с верхней (высокая температура) время уравновешивания 120 s.
- Удаление предыдущих проверок уравновешивания буфера из нижней части интерфейса, выделив каждый индивидуально и нажав красный крестик справа в середине интерфейса. Добавьте новое сканирование, нажав на кнопку «Добавить серии», введя 20 в поле «Шаги, чтобы добавить» и установив флажок «альтернативное Отопление/охлаждение». Нажмите кнопку ОК и запустите эксперимент, нажав на зеленую кнопку как указано выше.
- Повторите шаги 3.1 - 3.1.1 с рабочей буфер, содержащий нужную концентрацию лиганд в обоих капилляров для получения ссылки на эксперименты для лигандом (собирать два отдельных экспериментов с использованием 120 s и 600 s высокой температуры уравновешивания раз соответственно, чтобы использоваться в приобретении константа скорости преобразования термолабильных лигандом).
Примечание: Скорость сканирования, используемых здесь гарантирует, что биомолекулы в последующих экспериментах в термально уравновешение в прямого и обратного сканирования (см. обсуждение). Проверка ставок < 0.1-0.2 ° C мин-1 привести к шумной термограммы и не применимы в экспериментах DSC. Температура должна распространяться от значительно ниже температуры плавления бесплатно биомолекулы хорошо выше температуры плавления лиганд насыщенный биомолекулы (~ 20-80 ° C для MN4). Проверьте воспроизводимость результатов сканирования (например, 10 вперед и 10 обратного сканирования для 20 всего достаточно). - При использовании нескольких лигандов (таких, как кокаин и хинин), промойте DSC 200 мл рабочего буфера (повтор с шагом 2.5) между запусками, чтобы удалить лигандом из капилляров и предотвращения перекрестного загрязнения.
Примечание: Это полезно для выполнения репликации эксперимент на бесплатный биомолекулы после запуска лиганд прыгните для того, чтобы проверить, если предыдущий лигандом сильно адсорбируется почвой стенки капилляров и не удаляется надлежащим образом с промывкой буфера. Если термограммы для свободного биомолекулы, как представляется, быть перенесен в более крупные масштабы и выше температура денатурации после того, как лиганд прыгните эксперимент, вполне вероятно, что предыдущий лигандом все еще присутствует в калориметре после промывки. Удалите адсорбированных лигандов, инкубации капилляров с 20% Contrad-70 за 1 ч, при 60 ° C с пластиковых колпачков и давления ручку выключения. В программном обеспечении DSC измените экспериментальный режим на «Изотермические» под экспериментального метода tab. s 3600 выбрать продолжительность и 60 ° C для изотермические температуры, с нуля, для уравновешивания время вступил. Нажмите кнопку «Добавить в экспериментальный метод». Изотермическая эксперимент появляется в нижней части экрана. После завершения промойте прибор с 2 Л деионизированной водой и повторите шаг 2,5.
- Запустите образец эксперименты с использованием тех же DSC загрузки процедуры и экспериментальные параметры как ссылку сканирование. Для набора данных бесплатно биомолекулы убедитесь, что капилляр ссылка содержит буфера рабочей, а образца капиллярной бесплатно биомолекулы на желаемой концентрации рабочего буфера.
- Для экспериментов лиганд граница убедитесь, что лиганд в буфере рабочих в капиллярной ссылка, и биомолекулы плюс лиганд в буфере рабочих в образца капиллярной. Потолочные системы между дополнения различных лигандов как шаг 2,5.
- Выполните один дополнительный эксперимент с биомолекулы привязан к термолабильных лиганд, где период уравновешивания высокой температуры увеличивается до 600 s и все другие экспериментальные параметры такие же, как шаг 3.2.1.
Примечание: Продолжительность периода уравновешивания высокой температуры для эксперимента вторым лиганд прыгните просто решили обеспечить более быстро истощены, чем короткие уравновешивания время эксперимент лиганд. Если лиганд прыгните пики от первого эксперимента распад медленно, как функция проверки числа (например, различия в последовательных пик Максима являются ≤ 0,5 ° C), 10 - 20 раз увеличивается в период уравновешивания высокой температуры, для того чтобы оценить адекватно разрушающим лиганд в ходе второго эксперимента. Точный расчет константа скорости преобразования лигандом требует, что второй эксперимент имеет быстрого истощения лигандом относительно первого. Лиганд концентрации, извлеченные из глобального анализа двух экспериментов будет аналогичные и поэтому непригодны для использования, если истощение лигандом достаточно не ускоряется во втором эксперименте.
4. обработка данных
- Открытый DSC эксперимент файлы в программное обеспечение для анализа данных ДСК (см. Таблицу материалы) и экспортировать данные грубой силы в виде таблицы.
- Импорт таблиц, содержащих данные грубой силы в программное обеспечение для установки данных.
- Базовые вычесть образец данных путем вычитания буфера данных мощности от свободных и лиганд прыгните биомолекулы экспериментов.
Примечание: Для термолабильных лигандом эксперимента, концентрация первоначальных лигандом уменьшается с каждой проверки. Таким образом он идеально подходит для вычитания сканирования буфер 1 из образца проверки 1 и так далее. Мы нашли, что буфер сканирования с кокаином не меняются значительно лигандом преобразования продолжается и поэтому сканирования буфер одного термолабильных лиганд может использоваться для вычесть все термолабильных лигандом привязанных данных. - Преобразуйте данные мощности вычитается базовый образец теплоемкости.
Примечание: Преобразование требует частичной удельный объем биомолекулы, который может быть примерно14,,1516. Уравнение для преобразования энергии в теплоёмкость был ранее описанные17.
5. анализ данных
- Глобально подходят короткие уравновешивания время термолабильных лиганд прыгните теплоемкости набора данных с одним набором базовых, лигандом концентрации, складные и лигандом привязки параметров, как описано ранее4.
- Повторяйте, что глобальной подходят для набора данных время длинный уравновешивания для того чтобы вычислить константа скорости преобразования термолабильных лиганд, как описано ранее4.
Результаты
Репрезентативных данных для термолабильных лигандом DSC показаны на рисунке 1. Положение и высоту термолабильных пик лиганд прыгните последовательно сдвигает вниз к что несвязанных биомолекулы как обедненный термолабильных лиганда с каждого сканирования (рис. 1a). Бесплатный денатурации профиль используется в качестве ссылки для конечной точки преобразования термолабильных лиганда (рис. 1b). Данные для MN4 обязан хинина показаны как отрицательный контроль для преобразования термолабильных лиганда (рис. 1b). Окончательный термолабильных лигандом сканирует имеют несколько выше переход средние и высоты пика относительно свободные MN4, о том, что продукт преобразования термолабильных лиганда (бензилэкгоин) имеет слабый сродство MN4. Термодинамических параметров, в результате глобального анализа наборов данных на рисунке 1 , перечислены в таблице 1. Складной параметры MN4 присутствии кокаина или хинина идентичны в пределах ошибки, как ожидалось, поскольку разбавляют малых молекул, как ожидается, не возмущают складной Термодинамика бесплатно биомолекулы. Параметры привязки находятся в хорошем согласии с теми из изотермических титрования калориметрии (ЦМТ)18 и показывают, что MN4 в предпочтение хинина над кокаина управляется более благоприятные энтальпии привязки. Рисунок 2увеличение в период высоких температур уравновешивания дает более выраженный сокращения концентрации термолабильных лиганда с каждого сканирования относительно короткие уравновешивания периода dataset. С помощью оптимизированного глобальной концентрации подходят параметров из двух наборов данных, константа скорости преобразования лиганда при температуре высоких уравновешивания рассчитывается от наклон линии в рисунке 2 врезные.
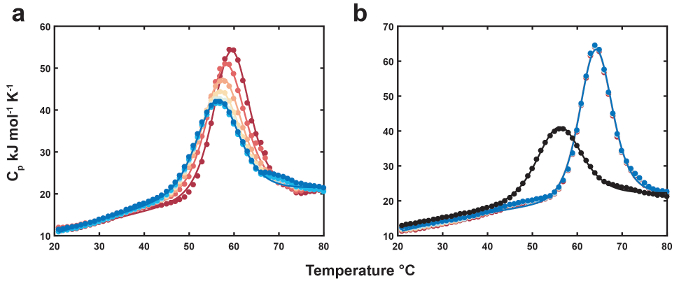
Рисунок 1. Термолабильных лигандом DSC. () термограммы MN4 (83 мкм) граница кокаина (начальной концентрации 778 мкм). Первый и последний сканирует MN4 присутствии лигандом показываются как темно красные и синие круги, в то время как соответствующий подходит отображаются в виде цветных линий. (b) термограммы бесплатно MN4 (83 мкм, черные круги) и последовательных сканирований обязан хинина (880 мкм, цветные круги). Подходит для свободного и хинин прыгните наборы данных отображаются как цветные и черные линии, соответственно. Воспроизводится из ссылки4 с разрешением от Королевского общества химии. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
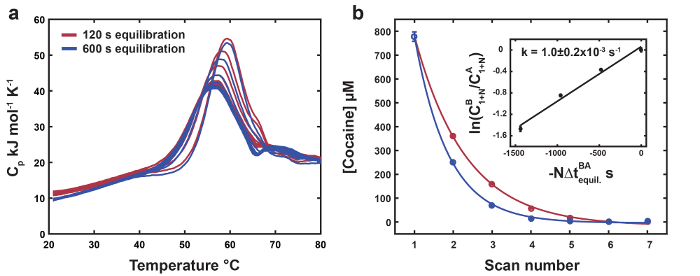
Рисунок 2. Измерение константа скорости для преобразования термолабильных лиганда. () наборы термограммы MN4 обязан кокаина с коротким (120 s, темно-красный) и уравновешивания Лонг (600 s, темно-синий) раз в 80 ° C, соответственно. (b) концентрация кокаина, извлеченные из глобального анализа наборов данных в () как функция проверки числа. Экспериментальных точек и экспоненциальная подходит отображаются как цветные круги и линии соответственно. Врезные показывает линейное fit ранее описанных дополнительного эквалайзера 19 от Харкнесс et al. с помощью оптимизированного глобальной подходят кокаина концентрации для двух наборов данных4. Константа скорости термический лиганда при 80 ° C вычисляется как наклон линии. Ошибка для константа скорости преобразования термолабильных лигандом дается как ± двух стандартных отклонений. Воспроизводится из ссылки4 с разрешением от Королевского общества химии. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Fit параметры | Кокаин добавил | Хинин добавлены |
| ∆Hоф | 271.3±1.8 | 272.5±4.0 |
| ∆SUF | 824.4±5.1 | 827.9±10.9 |
| ∆GUF | 21.6±0.2 | 21.6±0.9 |
| ∆HB1F | -75.2±1.6 | -101.0±4.0 |
| ∆SB1F | -154.2±5.0 | -213.7±12.0 |
| ∆CpB1F | -1.5±0.1 | -1.2±0.1 |
| ∆GB1F | -28.5±0.2 | -36.2±0.7 |
| ∆HB2F | -33.7±1.8 | - |
| ∆SB2F | -49.9±5.2 | - |
| ∆CpB2F | -2.2±0.1 | - |
| ∆GB2F | -18.6±0.3 | - |
Таблицы 1. Термодинамические параметры извлечены из глобального анализа MN4 DSC наборов данных с использованием кокаина и хинин лигандами. Параметры были рассчитаны на 30 ° C. B1F относится к кокаин или хинина привязкой сложенном государств и B2F относится к бензилэкгоин прыгните сложенном состоянии. ΔH и ΔG выражаются в кДж/моль, ΔS выражается в моль/J/K и ΔCp выражается в кДж/моль/K. ошибки были рассчитаны по данным дисперсии/co-variance метод19.
Обсуждение
Модификации и устранение неполадок
Данные анализа глобальной установки, используемых в Рисунок 1 и 2 были описаны ранее4. Здесь мы приводим практические аспекты выполнения и анализа ДСК привязки эксперименты с термолабильных лигандами. Обратите внимание, что базовый DSC получены для термолабильных лигандом только вычитается из лигандом + биомолекулы набора данных, эффективно гасят тепла освобождены или поглощается термический сам процесс. Анализ глобальной установки стандартная термолабильных лиганда (рис. 1 и рис. 2) предполагается, что система находится в термодинамическое равновесие всей сканирования температуры и что концентрация термолабильных лигандом является постоянным на протяжении каждого термограммы, уменьшение исключительно в период высоких температур уравновешивания. Мы ранее показали, что это предположение относится к кокаин прыгните MN4 и ожидается проведение для любой системы, термолабильных лигандом/биомолекулы с кинетики похож на них.
Однако, существуют некоторые ситуации, в которых предполагается, что система не может быть термодинамического равновесия и/или концентрация лигандом не может считаться постоянной на протяжении одного сканирования. К ним относятся i) когда лигандом термически быстро преобразует относительно температуры скорость сканирования, ii) когда биомолекулы подвергается необратимой агрегации при высокой температуре, iii) когда ставки складные/разворачивается медленно по сравнению с скорость сканирования, и iv). когда ставки ассоциации/диссоциации лигандом медленно по сравнению с скорость сканирования. В этих случаях система находится под контролем кинетическая вместо термодинамических и анализ в ссылка 4 строго не могут быть применены. Данные могут имитироваться количественно после Рисунок 3, как описано в дополнительный файл 1. В принципе эти расчеты, основанные на кинетику может использоваться для неравновесного ДСК данных, потенциально приносит кинетического и термодинамических данных, однако этот анализ выходит за рамки настоящего документа. Вместо этого мы представляем некоторые представитель смоделированных данных ДСК чтобы помочь читателю в определении неравновесного ситуаций.
Идеальный пример термодинамических управления показано на рисунке 4aб. DSC термограммы бесплатно биомолекулы superimposable (рис. 4a) и сканирование с термолабильных ligand не показывать гистерезиса, таким образом, что температура плавления наблюдается на вверх сканирования соответствует складной температура предыдущих (вниз сканирования Рисунок 4b). Когда термолабильных лигандом преобразует быстро по сравнению с скорость сканирования, большие искажения появляются в термограммы и термодинамические уравнения не приходится пик формы, как показано на рисунке 4 c, d. Это может быть несколько смягчены, увеличивая скорость сканирования. Когда агрегатов биомолекулы в зависимости от температуры, DSC следы для последовательных шоу бесплатно биомолекулы в величины (Рисунок 4e), уменьшается во время добавления термолабильных лигандом производит шаблон снижения тепловой повышенную Аналогично, в идеальном случае, но масштабируется путем снижения концентрации биомолекулы (Рисунок 4f). Когда складывающиеся/разворачивается кинетики медленно по сравнению с скорость сканирования, гистерезис проявляется в DSC следы бесплатно биомолекулы таким образом, что очевидным денатурации температуры на вверх сканирования выше, чем температура очевидной выемка (вниз сканирования Рисунок 4 g). Добавление термолабильных лигандом приводит к знакомой схеме уменьшения тепловой повышенную, особенно для вверх сканов (рис. 4 h). Наконец системах с быстрым складывания и медленно привязки производят гистерезис бесплатно термограммы ДСК для свободного биомолекулы (Рисунок 4i), однако данные с термолабильных ligand Показать гистерезиса, где явно температура плавления вверх-сканирования выше, чем очевидной складной температура предыдущих вниз-Scan (Рисунок 4j). Тем не менее типичная схема снижения тепловой повышенную очевидны в вверх сканов и вниз сканов. Неравновесная поведение в случае медленно складывающиеся или привязки кинетики может быть облегчено несколько уменьшая скорость сканирования, хотя это рискует не ничтожно малый лигандом теплового преобразования, происходящие в течение сканирования. На практике сканирования скорость и верхних уравновешивания температуру можно регулировать вручную для получения данных, похожее на рисунке 4a, b.
Ограничения метода
Наши термодинамический анализ для ДСК привязки эксперименты с термолабильных лигандами требует что складывания и привязки процессы являются относительно быстрое и что термолабильных лигандом преобразования медленно до высокой температуры часть каждого сканирования. Когда время жизни государства, сложить и/или связанных больше около 30 s (kвыкл, ku < 0,03 s-1), гистерезис становится заметной в сканирования проводятся на 1 ° C мин-1. Кроме того, когда константа скорости конверсии лигандом превышает примерно kc = 10-4 s-1 до денатурации перехода, может быть значительное истощение лиганд в течение одного сканирования. Применение нашей анализа также является неуместным при возникновении необратимой агрегации. В этих случаях более продвинутых моделирование может применяться к данным. Не сродство информация доступна, если преобразование лигандом настолько быстро, что он достигает завершения до первого перехода денатурации.
Значение в отношении существующих методов
Наш метод в первый раз позволяет DSC использоваться для измерения привязки Термодинамика высоким сродством, термолабильных лигандами. Выполняя глобальный одновременный анализ всех проверок, термодинамических параметров извлекаются с высокой точностью20. Дополнительным преимуществом является, что полного набора данных могут быть собраны в качестве лишь один эксперимент, если термический продукт имеет не сродство для свободного биомолекулы. В отличие от этого, производство типичный экспериментальной серии DSC для не термолабильных лигандом требует ~ 7-10 всего экспериментов.
Будущие приложения
Этот подход имеет прямого применения в характеристике туго, термолабильных ингибиторы в кампаниях обнаружения наркотиков. Несколько терапевтических соединения, такие как антибиотики и бензодиазепинов, как известно, термолабильных, переживает быстрый гидролиз на или вблизи физиологических рН и температуры ~ 60-70 ° C11. Этот метод DSC вполне может идентифицировать и охарактеризовать многие другие. Также модификация установки протокола для учета систем под кинетической, а не термодинамический контроль, как обсуждалось выше, имеет потенциал, чтобы открыть двери для многих более систем биологической значимости.
Важнейшие шаги в рамках протокола
Одним из наиболее важных экспериментальных процедур для рассмотрения является диализа или обмен биомолекулы и лиганд в одинаковых рабочих буферных растворов (протокол шаги 1.3-1.6). Буфер несоответствие между лиганда и биомолекулы решения может привести к большой артефакты в базовых и образец сканирования, которая полностью скрывать складной соответствующих данных. Кроме того важно, мощность чтения стабилизируется до DSC находится под давлением, так что он может контролироваться во время наддува (шаг 2.3 протокол). Если чтение мощность изменяется более чем ~ 10 мкВт во время наддув, пузыри вероятно сформировал в капиллярах и может вызвать большие артефакты в данных. В этом случае решения должны быть более тщательно дегазации.
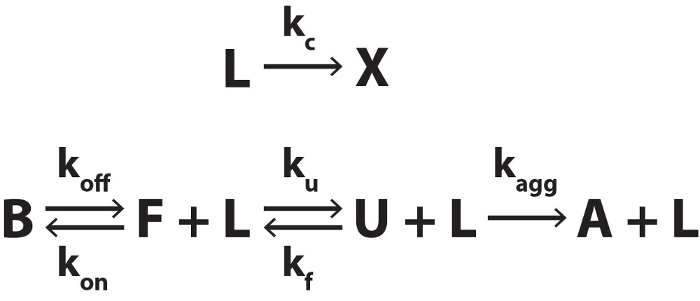
Рисунок 3. Биомолекулярных складные, привязку к термолабильных лиганд и необратимой агрегации. Термолабильных лиганда (L) преобразует продукта (X) с скорость константа kc. X имеет не сродство для биомолекулы. Связанного состояния (B) биомолекулы обменов с бесплатным сложить государства (F) с скорость константы koff и kна. F обмен с разложенном состоянии (U) с скорость константы ku и kf. U необратимо преобразует в состояние агрегированных (A) с скорость константа kобщ. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4. Компьютерное моделирование равновесия и кинетически контролируемой DSC эксперименты в отсутствие и наличие термолабильных лиганда. () равновесия биомолекулярных складывания. складные (b) равновесия, термолабильных лигандом привязки и преобразования медленно термолабильных лиганда. (c) равновесия биомолекулярных складывания. складные (d) равновесия, термолабильных лигандом привязки и преобразования быстро термолабильных лиганда. (e) равновесия биомолекулярных складывания и медленно необратимой агрегации. (f) равновесия складывания, привязки, медленно термолабильных лигандом преобразования и медленно необратимой агрегации. (g) медленное биомолекулярных складывания. (h) медленно складывающиеся, равновесия привязки и преобразования медленно термолабильных лиганда. (я) равновесия биомолекулярных складывания. складные (j) равновесия, медленно термолабильных лигандом привязки и преобразования медленно термолабильных лиганда. Все панели первый и последний моделирование сканирует в темно красный и синий, соответственно. Панели, которые показывают только светло- и темно синий термограммы указывают, что наложение все моделирование сканирует, и только последние два являются видимыми в заговоре. DSC эксперименты были смоделированы с 20 сканирует (10 плавления и 10 отжига) на скорость сканирования-1 мин 1 ° C, с диапазоном температур 0-80 ° C. Некоторые панели отображения более узкий температурные диапазоны, чтобы позволить лучше визуализация тенденций моделирования. Биомолекулы и лигандом концентрации в моделирования были 200 мкм и 10 мм, соответственно. Каждый эксперимент был смоделирован с 600 s уравновешивания время при 0 ° С перед сканированием и 60 s время уравновешивания между каждой из последующих проверок. Были Аррениус параметры для равновесия привязки и складывающиесяна = 5 x 10-1 M-1 s-1,у = 1 х 1019 s-1, Eна =-20 кДж моль-1, E Off = 120 кДж моль-1,сложите = 1 х 10-14 s-1,разворачиваться = 5 x 1018, Eскладывать =-80 кДж моль-1и Eразворачиваться = 120 кДж моль-1 . Были Аррениус параметры кинетически контролируемой привязки и складывающиесяна = 5 x 10-3 M-1 s-1,у = 1 х 1016 s-1, Eна =-20 кДж моль-1, E Off = 120 кДж моль-1,сложите = 1 х 10-16 s-1,разворачиваться = 5 x 1016, Eскладывать =-80 кДж моль-1и Eразворачиваться = 120 кДж моль-1 . Аррениус параметры для медленных и быстрых термолабильных лигандом преобразования былимедленно = 7.509 x 1010 s-1, Eмедленно = 94,65 кДж моль-1ибыстро = 1 s-1, E Быстрый = 10 кДж моль-1. Были Аррениус параметры для медленных необратимой агрегацииобщ. = 5 x 10-7 s-1 и Еобщ. = 80 кДж моль-1. Избыток тепла потенциала были рассчитаны с ΔHUF (разворачивается), ΔHBF (привязка) и ΔHAF (агрегирование) = 200, -140 и 50 кДж моль-1, соответственно. Теоретическое описание кинетически контролируемой DSC экспериментов с термолабильных лигандами и сценарий для выполнения моделирования (и необходимые параметры) доступны в дополнительного файла 1. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Раскрытие информации
Авторы заявляют отсутствие конфликта интересов.
Благодарности
R. W. H. V был поддержан МакГилл естественных наук и инженерных исследований Совет Канады (СЕНТИ) программа обучения в Bionanomachines. А. к. м. и P. E. J. были поддержаны Сенти грантов 327028-09 (A. K. М) и 238562 (P. E. J.).
Материалы
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Chem Impex | #00829 | |
| Sodium phosphate monobasic dihydrate | Sigma Aldrich | 71502 | |
| Sodium phosphate dibasic | Sigma Aldrich | S9763 | |
| Deioinized water for molecular biology | Millipore | H20MB1001 | |
| 0.2 micron sterile syringe filters | VWR | CA28145-477 | |
| 3 kDa centrifugal filters | Millipore | UFC900324 | |
| Dialysis tubing 0.5-1.0 kDa cutoff | Spectrum Laboratories | 131048 | |
| Silicon tubing | VWR | 89068-474 | |
| Plastic DSC flange caps | TA Instruments | 6111 | |
| DNA aptamer MN4 | Integrated DNA Technologies | https://www.idtdna.com/site/order/menu | |
| Cocaine | Sigma Aldrich | C008 | |
| Quinine | Sigma Aldrich | 22620 | |
| NanoDSC-III microcalorimeter | TA Instruments | http://www.tainstruments.com/nanodsc/ | |
| DSCRun software | TA Instruments | http://www.tainstruments.com/support/software-downloads-support/instruments-by-software/ | |
| NanoAnalyze software | TA Instruments | http://www.tainstruments.com/support/software-downloads-support/instruments-by-software/ | |
| Contrad-70 | VWR | 89233-152 |
Ссылки
- Bruylants, G., Wouters, J., Michaux, C. Differential scanning calorimetry in life science: thermodynamics, stability, molecular recognition and application in drug design. Curr Med Chem. 12 (17), 2011-2020 (2005).
- Privalov, P. L., Dragan, A. I. Microcalorimetry of biological macromolecules. Biophys Chem. 126 (1-3), 16-24 (2007).
- Brandts, J. F., Lin, L. N. Study of strong to ultratight protein interactions using differential scanning calorimetry. Biochemistry. 29 (29), 6927-6940 (1990).
- Harkness, R. W., Slavkovic, S., Johnson, P. E., Mittermaier, A. K. Rapid characterization of folding and binding interactions with thermolabile ligands by DSC. Chem Commun. 52 (92), 13471-13474 (2016).
- Garbett, N. C., Chaires, J. B. Thermodynamic studies for drug design and screening. Expert Opin Drug Dis. 7 (4), 299-314 (2012).
- Holdgate, G. A., Ward, W. H. J. Measurements of binding thermodynamics in drug discovery. Drug Discov Today. 10 (22), 1543-1550 (2005).
- Plotnikov, V., et al. An autosampling differential scanning calorimeter instrument for studying molecular interactions. Assay Drug Dev Technol. 1 (1), 83-90 (2002).
- Schon, A., Lam, S. Y., Freire, E. Thermodynamics-based drug design: strategies for inhibiting protein-protein interactions. Future Med Chem. 3 (9), 1129-1137 (2011).
- Periánez Parraga, L., G-L, A., Gamón Runnenberg, I., Seco Melantuche, R., Delgado Sánchez, O., Puigventós Latorre, F. Thermolabile Drugs. Operating Procedure In the Event of Cold Chain Failure. Farmacia Hospitalaria. 35 (4), 1-28 (2011).
- Murray, J. B., Alshora, H. I. Stability of Cocaine in Aqueous-Solution. J Clin Pharmacy. 3 (1), 1-6 (1978).
- Waterman, K. C., et al. Hydrolysis in pharmaceutical formulations. Pharm. Dev. Technol. 7 (2), 113-146 (2002).
- Mergny, J. L., Lacroix, L. Analysis of thermal melting curves. Oligonucleotides. 13 (6), 515-537 (2003).
- Neves, M. A., Reinstein, O., Johnson, P. E. Defining a stem length-dependent binding mechanism for the cocaine-binding aptamer. A combined NMR and calorimetry study. Biochemistry. 49 (39), 8478-8487 (2010).
- Bonifacio, G. F., Brown, T., Conn, G. L., Lane, A. N. Comparison of the electrophoretic and hydrodynamic properties of DNA and RNA oligonucleotide duplexes. Biophys J. 73 (3), 1532-1538 (1997).
- Durchschlag, H., Hinz, H. -. J. Chapter 3. Thermodynamic Data for Biochemistry and Biotechnology. , 45-128 (1986).
- Hellman, L. M., Rodgers, D. W., Fried, M. G. Phenomenological partial-specific volumes for G-quadruplex DNAs. Eur Biophys J Biophy. 39 (3), 389-396 (2010).
- Farber, P., Darmawan, H., Sprules, T., Mittermaier, A. Analyzing Protein Folding Cooperativity by Differential Scanning Calorimetry and NMR Spectroscopy. J Am Chem Soc. 132 (17), 6214-6222 (2010).
- Reinstein, O., et al. Quinine binding by the cocaine-binding aptamer. Thermodynamic and hydrodynamic analysis of high-affinity binding of an off-target ligand. Biochemistry. 52 (48), 8652-8662 (2013).
- Tellinghuisen, J. Statistical error propagation. J Phys Chem. A. 105 (15), 3917-3921 (2001).
- Drobnak, I., Vesnaver, G., Lah, J. Model-based thermodynamic analysis of reversible unfolding processes. J Phys Chem B. 114 (26), 8713-8722 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены