Method Article
Messprofile biomolekularen DSC mit thermolabilen Liganden schnell zu charakterisieren, Falt- und bindende Wechselwirkungen
In diesem Artikel
Zusammenfassung
Wir präsentieren Ihnen ein Protokoll für schnelle Charakterisierung der biomolekularen Faltung und Interaktionen mit thermolabilen Liganden mit differential scanning Kalorimetrie verbindlich.
Zusammenfassung
Differential scanning-Kalorimetrie (DSC) ist ein leistungsfähiges Verfahren zur Quantifizierung der thermodynamischen Parameter für biomolekulare Falt- und bindender Wechselwirkungen. Diese Information ist entscheidend bei der Gestaltung neuer Arzneimittel zur Behandlung. Allerdings sind viele pharmazeutisch relevante Liganden chemisch instabil bei den hohen Temperaturen im DSC-Analysen verwendet. So messen bindender Wechselwirkungen wird schwierig, da die Konzentrationen von Liganden und thermisch umgewandelt Produkte innerhalb der Kalorimeter Zelle ständig in Bewegung sind. Hier präsentieren wir ein Protokoll mit thermolabilen Liganden und DSC für schnell Informationsbeschaffung thermodynamischen und kinetischen auf die Falten, Bindung und Liganden Konvertierungsprozesse. Wir haben unsere Methode auf die DNA-Aptamer MN4 angewandt, die das Kokain thermolabilen Liganden bindet. Verwenden eine neue globale Fitting-Analyse, die Konten für thermolabile Liganden Umwandlung, die Gesamtheit der Faltung und Bindungsparameter stammen aus ein paar DSC Experimente. Darüber hinaus zeigen wir, dass die Geschwindigkeitskonstante für thermolabile Liganden Konvertierung mit nur einem zusätzlichen DSC Dataset bezogen werden kann. Die Leitlinien für die Identifizierung und Analyse von Daten aus mehreren komplizierter Szenarien werden vorgestellt, einschließlich irreversible Aggregation der Biomolekül, langsam Falten, langsame verbindliche und schnelle Entleerung des thermolabilen Liganden.
Einleitung
Differential scanning-Kalorimetrie (DSC) ist eine leistungsfähige Methode zur Quantifizierung biomolekularen Bindung und faltende Wechselwirkungen1,2,3. Die Stärken der DSC gehören seine Fähigkeit zur Bindung und Falten Mechanismen aufzuklären und zu der entsprechenden thermodynamischen Parameter2,3. Darüber hinaus DSC kann in Lösung in der Nähe von physiologischen Bedingungen durchgeführt werden und erfordert keine Kennzeichnung der Biomolekül oder Liganden, z. B.mit Fluorophore, Spin-Etiketten oder nuklearen Isotope4. Das Gerät scannt in Temperatur, Messung der Menge an Wärme benötigt, um das Biomolekül in an- und Abwesenheit des Liganden zu denaturieren. Die daraus resultierende Thermogramme werden verwendet, um die thermodynamischen Parameter den Liganden binden und Faltung Prozesse zu extrahieren. DSC oder anderen thermodynamischen Verfahren übermittelten Informationen ist entscheidend für die Führung der Gestaltung der Medikamente gegen Biomoleküle1,5,6,7,8. Jedoch das wiederholte Scannen zu hohen Temperaturen (~ 60-100 ° C) kann problematisch sein. Zum Beispiel viele pharmazeutisch wichtige Verbindungen zu unterziehen, Rearrangement oder Zersetzung auf anhaltende Exposition gegenüber hohen Temperaturen9,10,11, d. h., sie sind thermolabilen. Prüfung von verbindlichen Interaktionen von DSC in der Regel erfordert Mehrfachscans vorwärts und rückwärts um die Reproduzierbarkeit der Thermogramm für thermodynamische Analysen12zu überprüfen. Thermische Umwandlung von einer anfänglichen Liganden an einen sekundären Formen mit veränderten Bindungseigenschaften führt zu ausgeprägten Unterschiede in Form und Position der aufeinanderfolgenden Thermogramme, da verringert sich die Konzentration des ersten Liganden mit jedem Scan während der thermische Umwandlungsprodukte ansammeln. Diese Datensätze sind nicht traditionelle Analysen zugänglich.
Vor kurzem haben wir eine globale Anpassungsmethode für thermolabile Liganden DSC-Datasets, die die Gesamtheit der thermodynamischen Parameter für die biomolekularen Faltung und bindende Wechselwirkungen aus einem einzigen Liganden gebundenes Experiment bezogen auf ergibt die erforderlichen Thermogramm für die kostenlose Biomolekül-4. Die Analyse reduziert den experimentellen Probe vorgeschriebenen ~ 10-fach im Vergleich zu standard-DSC-Ansätze. Wir haben entfielen für Liganden thermische Umwandlung von vorausgesetzt, dies geschieht während der Hochtemperatur-Teil für jeden Scan wo das Thermogramm nicht Liganden-Konzentration hängt. Daher ist die Liganden-Konzentration eine konstante innerhalb des Teils des Thermogramm, die verwendet wird, um thermodynamische Parameter zu extrahieren. Wir zusätzlich gezeigt, wie die Geschwindigkeitskonstante für Ligand thermische Umwandlung erreicht werden kann, durch eine ergänzende Experiment mit Hochtemperatur Gleichgewichtherstellung länger ausführen. Für Systeme, wo Liganden thermische Umwandlung weniger temperaturabhängig (d.h.auftretenden spürbar bei allen Temperaturen), die Analyse kann geändert werden, um Variable Liganden Konzentrationen enthalten. Hier zeigen wir dieses Verfahren zur DNA-Aptamer MN4 in Anwesenheit von thermolabilen Liganden Kokain, die schnell zum Benzoylecgonin bei hohen Temperaturen Konvertiten (> 60 ° C). Chinin wird als Negativkontrolle für Liganden Thermolability verwendet, da es Konvertierung bei diesen experimentellen Temperaturen nicht unterziehen und auch an MN4 bindet. Wir beschreiben den Erwerb von thermolabilen Liganden DSC Datasets und ihre Analyse nachgeben thermodynamischen und kinetischen Parameter der Faltung, Bindung und Liganden Konvertierungsprozesse.
Protokoll
1. die Probenvorbereitung
- Reinigen Sie die gewünschte Biomolekül13.
Hinweis: Dieses Protokoll verwendet gekauft Kokain-Bindung DNA-Aptamer MN4 nach dem Austausch gegen 2 M NaCl dreimal gefolgt von drei Runden von entionisiertem Wasser mit einem zentrifugalen Filter mit einer 3 kDa Molekulargewicht Cut-off Membran. - Synthetisieren Sie und zu reinigen Sie, oder kaufen Sie die gewünschte thermolabilen Liganden-13.
Hinweis: MN4 bindet die thermolabilen Liganden Kokain. MN4 bindet auch Chinin, das als Negativkontrolle für Liganden Thermolability bei diesen experimentellen Temperaturen verwendet wird. - Bereiten Sie Puffer für die Dialyse von gereinigten Biomolekül und Auflösung des Liganden (20 mM Natriumphosphat und 140 mM NaCl-Puffer, pH 7,4, für MN4 und die hier verwendeten Liganden vor).
- Dialyse das Biomolekül gegen mindestens 2 L Puffer mit Dialyse Schläuche mit 0,5 - 1,0 kDa Cutoff.
- Filtern Sie die endgültige Puffer (arbeiten Puffer genannt) durch einen 0,2 µm-Filter, der gründlich mit Puffer equilibriert wurde.
- Abwiegen der gewünschten Massen der Liganden und in gefilterten arbeiten Puffer auflösen. Wenn die gewünschte Liganden Konzentrationen Massen, die zu klein erfordern, genau abzuwägen, stellen Sie eine konzentrierte Liganden-Stammlösung (z. B. 10 X).
Anmerkung: Es ist wichtig, dass alle DSC Experimente die gleichen Arbeiten-Puffer für die Probe nutzen und Liganden, d.h.führen Sie niemals ein Experiment wo ist der Liganden in einer anderen Charge arbeiten Puffer als das Biomolekül aufgelöst, als Puffer dadurch Mismatch-Artefakte in den Daten. - Filtern Sie die Biomolekül-Stammlösung durch einen 0,2 µm-Filter, der gründlich mit arbeiten Puffer equilibriert worden.
- Bestimmen Sie die Biomolekül-Konzentration durch Absorption Messungen (260 nm Nukleinsäuren wie MN4 und 280 nm für Proteine).
- Lagern Sie das vorbereitete Biomolekül und Liganden im Kühlschrank (geeignet für MN4 und die hier verwendeten Liganden) 4 ° C oder-20 oder-80 ° C Wenn die Biomolekül und Liganden Einfrieren und langfristige Lagerung tolerieren erforderlich ist. Degas die Puffer, Biomolekül und Liganden Lösungen in eine Tischplatte vor der Verladung in die DSC degasser (siehe Tabelle der Materialien).
Hinweis: Entgasung verhindert Blasenbildung in der DSC bei höheren Temperaturen. Luftblasen verursachen Signal Artefakte, die DSC Spitze Formen und Basislinien verdunkeln.
2. DSC Vorbereitung
- Schrauben Sie den Druck-Griff von der DSC (siehe Tabelle der Materialien).
- Führen Sie Silikon Schlauch aus dem Puffer arbeiten und befestigen Sie es an den vorderen Flansch (Metall Öffnung) der Referenz-Kapillare.
- Erstellen Sie eine Brücke zwischen der Referenz und Sample Kapillaren durch den Anschluss des hinteren Referenz-Flansches an der vorderen Probe-Flansch.
- Bringen Sie ein Stück Silikon Schlauch an den hinteren Probe-Flansch, der mit einer Vakuumleitung angebracht zu einem Abfall Kolben läuft.
- Schalten Sie die Vakuumleitung die DSC mit 200 mL arbeiten Puffer geleert.
- Laden Sie die Referenz-Kapillare der DSC mit Puffer arbeiten. Legen Sie etwa 3-5 cm Abschnitte von Silicon Schläuche auf die Referenz Kapillare Flansche.
- Legen Sie eine 1 mL-Pipettenspitze in den hinteren Flansch Silicon Schläuche. Zeichnen Sie 0,8 mL Puffer arbeiten mit einer Pipette zu und setzen Sie die Pipettenspitze mit Puffer in der vorderen Referenz Flansch Silikon Schlauch.
- Drücken Sie vorsichtig die Pipette Kolben bis auf Pass arbeiten Puffer durch den vorderen Silikon Schlauch in der Referenz-Kapillare und hinauf in des hinteren Flansches befestigt Pipettenspitze. Der Pipette Kolben herunterdrücken Sie, bis die Puffer Arbeitsebene oberhalb der vorderen Silikon Schlauch erreicht, dann lassen Sie die Pipette Kolben bis Puffer Arbeitsebene oberhalb der hinteren Silikon Schlauch erreicht.
- Wiederholen Sie, vorbei an der Arbeit Puffer hin und her, um die Lautstärke in der Referenz-Kapillare blasenfrei zu bereinigen.
Hinweis: In der Regel reichen 10 Pässe der Lösung hin und her um alle Bläschen klar.
- Wiederholen Sie, vorbei an der Arbeit Puffer hin und her, um die Lautstärke in der Referenz-Kapillare blasenfrei zu bereinigen.
- Verschließen Sie die hinteren Pipettenspitze mit dem Daumen und ziehen Sie vorsichtig auf die hinteren Pipettenspitze und vorderen Pipette zu entfernen aus der Referenz-Flansche mit dem Silikon-Schlauch befestigt.
- Laden Sie die Probe-Kapillare mit Puffer arbeiten wie in den Schritten 2,6-2,9. Die hinteren Referenz setzen Sie eine schwarzen Kunststoff-Kappe auf und probieren Sie Flansche, verlassen die vorderen Flansche aufgedeckt.
- Befestigen Sie den Druck-Griff.
- Öffnen Sie die DSC Software (siehe Tabelle der Materialien) und das Instrument unter Druck zu setzen, indem Sie auf den roten Pfeil am oberen Rand der Schnittstelle nach oben, nach der Stabilisierung der macht Lesung; die DSC-Kraft wird in ein Feld an der Spitze direkt von der Schnittstelle zusammen mit dem Instrumententemperatur und Luftdruck.
Hinweis: Monitor unter Druck setzt die Macht als der DSC zu lesen. Änderungen an der Macht von mehr als ~ 10 µW zeigen Blasenbildung in den Kapillaren, die Artefakte in den Daten verursachen können. Die Lösungen müssen entfernt und entgast weiter, bevor Sie fortfahren. - Equilibrate der DSC mit Puffer arbeiten durch eine Forward- und reverse-Scan durchführen. Sicherstellen Sie im Register "Experimentelle Methode" auf der linken Seite des Bildschirms, dass die "Scan"-Option ausgewählt ist, die DSC im scanning-Modus Temperatur ausgeführt.
Hinweis: Experimentelle Parameter sind die Temperatur, die Scan-Bereich, Scan-Rate, niedriger und hoher Temperatur Gleichgewichtherstellung Zeit und Anzahl der Scans.- Klicken Sie im "Temperaturparameter" Einschub "Experimentelle Methode" auf der Registerkarte zum "Heizen". Geben Sie 1 bis 100 ° C für die untere und obere experimentellen Temperaturen, 1 ° C/min für die Abtastrate und 60 s lang Gleichgewichtherstellung.
- Klicken Sie auf "Hinzufügen-Serie" unter dem Eingabefeld für den Zeitraum entnehmen. Geben Sie 2 im Feld "Schritte zum Hinzufügen" in das Popup-Fenster (für eine Heizung und eine Kühlung Scan) und aktivieren Sie das Kontrollkästchen "Alternative Heizung/Kühlung". Klicken Sie auf "OK"; die zusätzlichen Scans erscheinen im unteren Teil der Schnittstelle. Kontrollieren, ob die Parameter für jeden Scan als gewünscht.
- Starten Sie das Experiment durch Klicken auf den grünen "play" Knopf an der Spitze der Schnittstelle. Navigieren Sie zu dem gewünschten Ordner und geben Sie einen Dateinamen für die Rettung des Experiments in das Popup-Fenster. Zeigen Sie den Experiment Fortschritt, indem Sie auf die Registerkarte "Daten" auf der rechten Seite der Registerkarte "Experimentieren-Methode".
3. Sammeln von thermolabilen Liganden DSC Datasets
Hinweis: Die minimale Verfahren besteht aus fünf Experimente: Puffer Referenz Experimente mit und ohne Liganden (verwendet für die Basislinie Subtraktion, siehe Diskussion), probieren Sie Experimente mit kostenlosen Biomolekül, das Biomolekül Liganden gebunden und die Liganden gebundenes Biomolekül mit Hochtemperatur Gleichgewichtherstellung länger.
- Führen Sie Referenz-Experimente für die Basislinie Subtraktion der Beispieldaten. Laden die DSC mit Puffer arbeiten in beiden Kapillaren und sammeln Mehrfachscans vorwärts und rückwärts über einen geeigneten Temperaturbereich bei 1 ° C min-1 mit einer oberen (hohe Temperatur) Gleichgewichtherstellung Zeit von 120 s.
- Löschen Sie die bisherigen Puffer Gleichgewichtherstellung Scans aus dem unteren Teil der Schnittstelle durch jeweils einzeln markieren und auf das rote X in der Mitte rechts der Schnittstelle. Fügen Sie die neue Scans durch Klicken auf die Schaltfläche "Hinzufügen-Serie", 20 im Feld für "Schritte zum Hinzufügen" eingeben und das Kontrollkästchen "Alternative Heizung/Kühlung". Klicken Sie auf "OK" und führen Sie das Experiment, indem Sie auf den grünen Play-Button wie oben beschrieben.
- Wiederholen Sie die Schritte 3.1 - 3.1.1 mit arbeiten Puffer, enthält die gewünschte Konzentration des Liganden in beiden Kapillaren der Verweis abrufen Experimente für den Liganden (sammeln Sie zwei separate Experimente mit 120 s und s Hochtemperatur Gleichgewichtherstellung 600-fache bzw. bei Erwerb der Geschwindigkeitskonstante für thermolabile Liganden Konvertierung verwendet werden).
Hinweis: Die hier verwendete Abtastrate sorgt dafür, dass das Biomolekül in späteren Experimenten im thermischen Gleichgewicht in den forward und reverse-Scans (siehe Diskussion). Scannen Sie Preise < 0,1-0,2 ° C min-1 zu laut Thermogramme führen und sind nicht anwendbar bei DSC-Experimenten. Die Temperaturen sollten reichen von weit unter der Schmelztemperatur der freien Biomolekül oberhalb der Schmelztemperatur des Liganden gesättigt Biomolekül gut (~ 20-80 ° C für MN4). Überprüfen Sie die Reproduzierbarkeit der Scans (z. B. 10 nach vorn und 10 reverse Scans für insgesamt 20 ist ausreichend). - Wenn mehrere Liganden (z. B. Kokain und Chinin), Spülen der DSC mit 200 mL arbeiten Puffer (Wiederholung von Schritt 2.5) zwischen den Läufen zur Liganden aus den Kapillaren zu entfernen und zur Vermeidung von Kreuzkontamination.
Hinweis: Es ist hilfreich, um festzustellen, ob die vorherigen Liganden stark, die Kapillarwände absorbiert und ist nicht hinreichend mit Puffer spülen entfernt replizieren Experiment auf das kostenlose Biomolekül nach einem Liganden gebundenes Lauf durchführen. Wenn die Thermogramme für das kostenlose Biomolekül erscheinen zu einem größeren Ausmaßes und höhere Denaturierung Temperatur verschoben werden, nachdem der Liganden-gebunden experimentieren, ist es wahrscheinlich, dass die vorherigen Liganden in der Kalorimeter nach dem Spülvorgang noch vorhanden ist. Entfernen den adsorbierten Liganden durch Inkubation der Kapillaren mit 20 % Contrad-70 für 1 h bei 60 ° C mit Kunststoffkappen und Druck Griff aus. In der DSC-Software ändern der experimentellen Modus in "Isotherm" unter die Versuchsmethode Registerkarte und wählen Sie 3.600 s für die Dauer und 60 ° C für die Isotherme Temperatur mit Null zum Gleichgewichtherstellung Mal betrat. Klicken Sie auf "Experimentelle Methode hinzufügen". Die Isotherme Experiment erscheint im unteren Teil des Bildschirms. Spülen Sie nach Beendigung wird das Instrument mit 2 L entionisiertem Wasser und wiederholen Sie ab Schritt 2.5.
- Durchführen Sie Probe Experimente unter Verwendung derselben DSC laden Prozedur und experimentellen Parameter wie die Referenz scans. Sicherstellen Sie für den kostenlosen Biomolekül Datensatz, dass die Referenz-Kapillare der Arbeit Puffer enthält, während die Probe Kapillare das kostenlose Biomolekül in der gewünschten Konzentration in Arbeit Puffer enthält.
- Sicherzustellen Sie für die Liganden gebundenes Experimente, dass die Liganden im Puffer arbeiten in der Referenz-Kapillare, und das Biomolekül plus Liganden in Arbeit-Puffer in der Probe-Kapillare sind. Spülen Sie das System zwischen den Zugaben von verschiedenen Liganden wie in Schritt 2.5.
- Führen Sie eine zusätzliche Experiment mit das Biomolekül an thermolabilen Liganden gebunden, wo ist die hohe Temperatur Gleichgewichtherstellung auf 600 erhöht s und anderen experimentellen Parameter sind identisch mit Schritt 3.2.1.
Hinweis: Die Dauer der Hochtemperatur Gleichgewichtherstellung für das zweite Liganden gebundenes Experiment ist einfach um sicherzustellen, dass die Liganden schneller erschöpft als das kurze Gleichgewichtherstellung Zeit Experiment ausgewählt. Wenn die Liganden gebundenes Gipfel vom ersten Verfall langsam als Funktion des Scan-Nummer experimentieren (z. B.die Unterschiede zwischen aufeinanderfolgenden Peak Maxima sind ≤ 0,5 ° C), 10 bis 20 fache erhöht in der Hochtemperatur Gleichgewichtherstellung Periode zur Schätzung adäquat zum Abbau des Liganden während des zweiten Versuchs. Die genaue Berechnung der Rate konstant für die Liganden Konvertierung erfordert, dass das zweite Experiment schnelleren Erschöpfung des Liganden relativ zur ersten hat. Die Liganden-Konzentrationen extrahiert aus der globalen Analyse der zwei Experimente werden ähnliche und daher unbrauchbar, wenn die Liganden Erschöpfung nicht ausreichend in das zweite Experiment beschleunigt wird.
4. Datenverarbeitung
- Öffnen die DSC experimentieren Dateien in der DSC-Daten-Analyse-Software (siehe Tabelle der Materialien) und die rohe Kraft-Daten als Tabellen exportieren.
- Importieren Sie die Tabellen mit den rohen Leistungsdaten in Software für Daten passend.
- Grundlinie subtrahieren Sie die Beispieldaten durch Subtraktion Puffer Leistungsdaten von der freien und gebundenen Liganden Biomolekül Experimente.
Hinweis: Für das Experiment thermolabilen Liganden sinkt die Konzentration der ersten Liganden mit jedem Scan. Daher ist es ideal, um den Puffer Scan 1 Probe Scan 1 subtrahieren, und so weiter. Wir haben festgestellt, dass die Puffer-Scans mit Kokain nicht merklich ändern wie die Liganden-Konvertierung wird fortgesetzt und kann daher ein einzigen thermolabilen Liganden Puffer Scan alle thermolabilen Liganden gebundene Daten subtrahieren verwendet werden. - Konvertieren Sie die Grundlinie abgezogen macht Beispieldaten in Wärmekapazität.
Hinweis: Die Konvertierung erfordert das Biomolekül teilweise spezifische Volumen, das schätzungsweise14,15,16sein können. Die Gleichung für die Umwandlung von Strom zu Wärmekapazität wurde zuvor17beschrieben.
(5) Datenanalyse
- Weltweit passen Sie das kurze Gleichgewichtherstellung Zeit thermolabilen Liganden gebundenes Wärmekapazität Dataset mit einem einzigen Satz der Basislinie, Liganden-Konzentration, Falt- und Ligand verbindliche Parameter wie zuvor beschrieben4.
- Wiederholen Sie die globale fit für die langen Gleichgewichtherstellung Zeit Dataset zur Berechnung der Rate konstant für thermolabile Liganden Konvertierung wie zuvor beschrieben4.
Ergebnisse
Repräsentative Daten für den DSC thermolabilen Liganden sind in Abbildung 1dargestellt. Die Position und Höhe des thermolabilen Liganden gebundenes Peaks rückt sukzessive nach unten, die das ungebundene Biomolekül thermolabile Liganden mit jedem Scan (Abbildung 1a) erschöpft ist. Das kostenlose Denaturierung-Profil dient als Referenz für den Endpunkt der thermolabilen Liganden Umwandlung (Abbildung 1 b). Daten für MN4 an Chinin gebunden sind als Negativkontrolle für thermolabile Liganden Konvertierung (Abbildung 1 b) gezeigt. Die endgültige thermolabilen Liganden-Scans haben etwas höhere Übergang Mittelpunkte und Peak-Höhen im Verhältnis zu den ungebundenen MN4 darauf hinweist, dass die thermolabilen Liganden Konvertierung Produkt (Benzoylecgonin) hat eine schwache Affinität für MN4. Die thermodynamischen Parameter infolge der globalen Analyse der Datasets in Abbildung 1 sind in Tabelle 1aufgeführt. Die klappbare Parameter für MN4 in Anwesenheit von Kokain oder Chinin sind innerhalb Fehler, identisch, wie erwartet, da verdünnte kleine Moleküle nicht erwartet, dass die Faltung Thermodynamik das kostenlose Biomolekül durcheinanderbringen. Die Bindungsparameter sind in guter Übereinstimmung mit denen von isothermen Titration Kalorimetrie (ITC)18 und zeigen, dass MN4s Vorliebe für Chinin über Kokain durch eine günstigere Bindung Enthalpie angetrieben wird. In Abbildung 2liefert der Hochtemperatur Gleichgewichtherstellung Zeitraum deutlicher Reduzierung der thermolabilen Liganden-Konzentration mit jedem Scan relativ kurzen Gleichgewichtherstellung Periode Dataset. Die Geschwindigkeitskonstante für die Liganden Konvertierung bei hohen Gleichgewichtherstellung Temperatur errechnet sich aus die Steigung der Linie in der Abbildung 2 Einschub mit den Parametern optimierte globale Fit Konzentration von zwei Datasets.
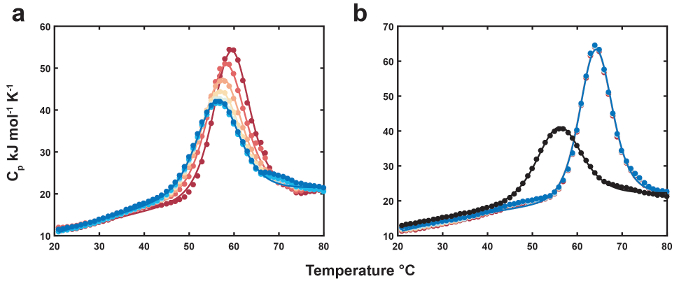
Abbildung 1: Thermolabilen Liganden DSC. (ein) Thermogramme MN4 (83 µM) an Kokain (Ausgangskonzentration 778 µM) gebunden. Ersten und letzten Scans von MN4 in Anwesenheit von Liganden sind als rote und blaue Augenringe gezeigt, während die entsprechenden passt als farbige Linien angezeigt werden. (b) Thermogramme der freien MN4 (83 µM, schwarze Kreise) und aufeinander folgende Scans an Chinin (880 µM, farbige Kreise) gebunden. Passt auf die freie und Chinin-gebundenen Datasets erscheinen als schwarze und farbige Linien. Übernommen aus: Referenz4 mit freundlicher Genehmigung von der Royal Society of Chemistry. Bitte klicken Sie hier für eine größere Version dieser Figur.
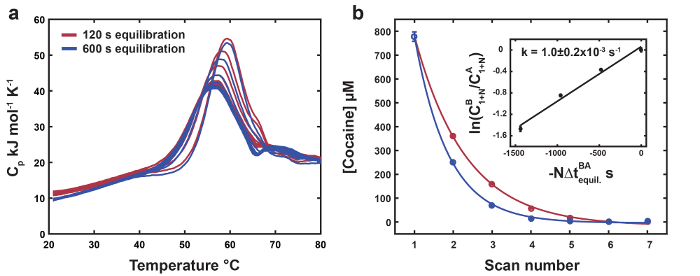
Abbildung 2: Messung der Rate konstant für Thermolabile Liganden Konvertierung. (ein) Sätze von Thermogramme für MN4 verpflichtet, Kokain mit kurzen (120 s, dunkelrot) und lange (600 s, dunkelblau) Gleichgewichtherstellung Mal bei 80 ° C, beziehungsweise. (b) Konzentrationen von Kokain globale Analyse der Datasets in (einem) als Funktion der Scan Nummer entnommen. Experimentellen Punkte und exponentielle passt werden als farbige Kreise und Linien angezeigt. Der Inset zeigt eine lineare Anpassung der zuvor beschriebenen ergänzenden GL. 19 vom Harkness Et Al. mit der optimierten globalen Fit Kokain-Konzentrationen für die zwei Datasets4. Die Geschwindigkeitskonstante für thermische Umwandlung Liganden bei 80 ° C errechnet sich aus der Steigung der geraden. Der Fehler für die Geschwindigkeitskonstante für thermolabile Liganden Umwandlung wird als ± 2 Standardabweichungen angegeben. Übernommen aus: Referenz4 mit freundlicher Genehmigung von der Royal Society of Chemistry. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Anpassungsparameter | Kokain hinzugefügt | Chinin hinzugefügt |
| ∆HUF | 271.3±1.8 | 272.5±4.0 |
| ∆SUF | 824.4±5.1 | 827.9±10.9 |
| ein∆GUF | 21.6±0.2 | 21.6±0.9 |
| ein∆HB1F | -75.2±1.6 | -101.0±4.0 |
| ein∆SB1F | -154.2±5.0 | -213.7±12.0 |
| ∆CpB1F | -1.5±0.1 | -1.2±0.1 |
| ein∆GB1F | -28.5±0.2 | -36.2±0.7 |
| ein∆HB2F | -33.7±1.8 | - |
| ein∆SB2F | -49.9±5.2 | - |
| ∆CpB2F | -2.2±0.1 | - |
| ein∆GB2F | -18.6±0.3 | - |
Tabelle 1. Thermodynamischen Parameter extrahiert aus globalen Analyse der MN4 DSC Datasets mit Kokain und Chinin Liganden. Parameter wurden berechnet, bei 30 ° C. B1F bezieht sich auf Kokain - oder Chinin-Bound gefalteten Staaten und B2F auf Benzoylecgonin-gebundenen zusammengeklappten Zustand. ΔH und ΔG in kJ/Mol ausgedrückt werden, ΔS wird ausgedrückt in J/Mol/K und ΔCp drückt sich in kJ/Mol/K. Fehler wurden gemäß der Varianz/co-variance Methode19berechnet.
Diskussion
Modifikationen und Fehlerbehebung
Die Details der globalen passende Analyse verwendet in Abbildung 1 und Abbildung 2 wurden4beschrieben. Hier beschreiben wir die praktischen Aspekte der Durchführung und Analyse von DSC verbindliche Experimente mit thermolabilen Liganden. Beachten Sie, dass Basispläne DSC erhalten für thermolabile Liganden allein von den Liganden subtrahiert wird + Biomolekül Dataset, effektiv die Wärme freigesetzt oder aufgenommen durch die thermische Umwandlung zunichte selbst verarbeiten. Die standard thermolabilen Liganden globale passende Analyse (Abbildung 1 und Abbildung 2) wird davon ausgegangen, dass das System im thermodynamischen Gleichgewicht in der Temperatur-Scan und die thermolabilen Liganden-Konzentration konstant ist in jedem Thermogramm, ausschließlich den Zeitraum Hochtemperatur Gleichgewichtherstellung abnimmt. Wir haben bereits gezeigt, dass diese Annahme für Kokain-gebundenen MN4 gilt und dürfte für alle thermolabilen Ligand/Biomolekül-System mit Kinetik ähnlich wie diese zu halten.
Es gibt jedoch einige Situationen, in denen das System kann nicht davon ausgegangen werden, werden im thermodynamischen Gleichgewicht bzw. die Konzentration des Liganden kein einzelner Scan konstant angesehen werden. Dazu gehören (i) wenn die Liganden thermisch schnell relativ zur Temperatur-Scan-Rate umwandelt, (Ii) wenn das Biomolekül irreversible Aggregation bei hoher Temperatur, erfährt (Iii) wenn der Faltung/Entfaltung Raten langsam im Vergleich zu den Scan-Rate sind und iv). Wenn die Liganden Verband/Dissoziation Preise sind langsam im Vergleich zu den Scan-Rate. In diesen Fällen das System ist unter kinetischen als thermodynamische Kontrolle und Analyse in Referenz 4 nicht strikt angewendet werden. Daten können nach Abbildung 3, quantitativ simuliert werden, wie in der ergänzenden Datei 1beschrieben. Im Prinzip könnte diese Kinetik basierenden Berechnungen verwendet werden, passen nicht-Gleichgewichts-DSC-Daten, kinetische und thermodynamische Daten potenziell nachgeben, aber diese Analyse würde den Rahmen dieses Papiers ist. Stattdessen präsentieren wir Ihnen einige repräsentativen simulierten DSC-Daten um den Leser bei der Identifizierung von nicht-Gleichgewichts-Situationen zu helfen.
Ein ideales Beispiel für thermodynamische Kontrolle zeigt Abbildung 4ab. DSC Thermogramme der freien Biomolekül sind deckungsgleichen (Abb. 4a) und Scans mit der thermolabilen Liganden zeigen keine Hysterese, so dass die Schmelztemperatur auf beobachtet Up-Scan passt die klappbare Temperatur des vorherigen Down-Scan ( Abbildung 4 b). Wenn der thermolabile Liganden schnell konvertiert im Vergleich zu den Scan-Rate große Verzerrungen in dem Thermogramm erscheinen und die thermodynamischen Gleichungen berücksichtigen nicht für die Peak-Form, wie in Abbildung 4 c, d. Dies kann sein etwas gemildert durch die Erhöhung der Scan-Rate. Wenn die Biomolekül-Aggregate in gewissem Sinne temperaturabhängig, DSC-Spuren für die kostenlose Biomolekül-Show aufeinander folgenden verringert in der Größe (Abb. 4e), während der Zugabe von erzeugt thermolabile Liganden ein Muster der abnehmenden thermische Hochschalten ähnlich wie bei der Idealfall, aber durch die abnehmende Biomolekül-Konzentration (Abbildung 4f) skaliert. Als Faltung/Entfaltung Kinetik sind langsam im Vergleich zu der Scan-Rate Hysterese zeigt sich in DSC Spuren von freien Biomolekül derart, dass die scheinbare Denaturierung Temperatur auf dem Up-Scan höher als die scheinbare Renaturierung Temperatur auf den Down-Scan ( Abbildung 4 g). Zusatz eines thermolabilen Liganden führt zu das vertraute Muster abnehmender thermische Hochschalten, vor allem für den Up-Scans (Abbildung 4 h). Schließlich produzieren Systeme mit schnellen Faltung und langsam Bindung frei von Hysterese DSC Thermogramme für das kostenlose Biomolekül (Abbildung 4i), jedoch Daten mit thermolabilen Liganden Hysterese zeigen, wo die scheinbare Schmelztemperatur des Up-scan höher als die scheinbare klappbare Temperatur des vorherigen Down-Scan (Abbildung 4j). Das typische Muster der abnehmenden thermische Hochschalten sind jedoch offensichtlich in Up-Scans und Down-Scans. Non-Gleichgewicht Verhalten bei langsamen Falt- oder verbindliche Kinetik kann sein etwas durch Verringerung der Scanrate vermindert, obwohl dies das Risiko einer nicht zu vernachlässigenden Liganden thermische Umwandlung auftritt während des Scans läuft. In der Praxis kann die Scan-Rate und oberen Gleichgewichtherstellung Temperatur manuell eingestellt werden, um Daten ähnlich Abbildung 4a, bzu erhalten.
Grenzen der Technik
Unsere thermodynamischen Analyse für DSC verbindliche Experimente mit thermolabilen Liganden erfordert, dass die Faltung und verbindliche Prozesse relativ rasche sind und thermolabilen Liganden Konvertierung langsam vor dem Hochtemperatur-Teil für jeden Scan ist. Wenn die Lebensdauer des gefalteten und/oder gebundenen Staates ist größer als etwa 30 s (kausku < 0,03 s-1), Hysterese wird erkennbar in Scans durchgeführt bei 1 ° C min-1. Darüber hinaus wird die Liganden Conversion Rate konstant über etwa kc = 10-4 s-1 vor dem Übergang Denaturierung kann erhebliche Dezimierung des Liganden im Laufe eines einzigen Scans. Anwendung unserer Analyse ist auch unangemessen, wenn irreversible Aggregation auftritt. In diesen Fällen könnte die erweiterte Modellierung auf die Daten angewendet werden. Keine Informationen zur Affinität zwischen ist verfügbar, wenn Liganden Umwandlung so schnell ist, dass es Abschluss vor dem ersten Denaturierung Übergang erreicht.
Bedeutung im Hinblick auf bestehende Methoden
Unsere Methode zum ersten Mal können DSC verwendet werden, um die Bindung Thermodynamik hohe Affinität, thermolabile Liganden zu messen. Durch eine gleichzeitige Gesamtanalyse aller Scans durchführen, werden mit hoher Genauigkeit20thermodynamischen Parameter extrahiert. Ein weiterer Vorteil ist, dass das gesamte Dataset in weniger als einem Experiment gesammelt werden kann, wenn die thermische Umwandlung Produkt keine Affinität für das kostenlose Biomolekül hat. Im Gegensatz dazu erfordert eine typische experimentelle DSC Serie für eine nicht-thermolabilen Liganden ~ 7-10 total Experimente.
Zukünftige Anwendungen
Dieser Ansatz hat direkte Anwendungen zur Charakterisierung von enger, thermolabile Inhibitoren in Drogen-Entdeckung-Kampagnen. Verschiedene therapeutische Substanzen wie Antibiotika und Benzodiazepine sind bekanntermaßen thermolabilen, einer schnellen Hydrolyse bei oder nahe bei physiologischen pH-Wert und Temperatur von ~ 60-70 ° C11. Diese DSC-Methode ist gut positioniert, um zu identifizieren und zu charakterisieren, vieles mehr. Ebenso hat Änderung des Protokolls Armatur für Systeme unter kinetischen als thermodynamische Kontrolle Konto wie oben beschrieben das Potenzial zum Öffnen der Tür auf viele weitere Systeme von biologischen Relevanz.
Wichtige Schritte im Rahmen des Protokolls
Eines der wichtigsten experimentellen Verfahren zu prüfen ist Dialyse oder Austausch der Biomolekül und Liganden in identischen arbeiten Pufferlösungen (Protokoll Schritte 1,3-1,6). Puffer Missverhältnis zwischen den Liganden und Biomolekül Lösungen führen zu großen Artefakte in die Grundlinie und Probe-Scans die klappbaren relevanten Daten vollständig verdecken. Darüber hinaus ist es wichtig, dass der Stromverbrauch-Ablesung stabilisiert, bevor die DSC unter Druck gesetzt wird, so dass es während der Druckbeaufschlagung (Protokoll Schritt 2.3) überwacht werden kann. Ändert sich der Stromverbrauch-Ablesung von mehr als ~ 10 µW während der Druckbeaufschlagung Bläschen gebildet haben wahrscheinlich in den Kapillaren und können dazu führen, dass große Artefakte in den Daten. Die Lösungen müssen in diesem Fall gründlicher entgast werden.
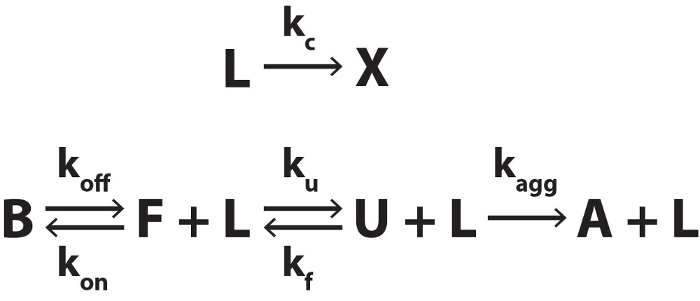
Abbildung 3. Biomolekulare Falzen, binden an eine Thermolabile Liganden und Irreversible Aggregation. Die thermolabile Liganden (L) wandelt Produkt (X) mit einer Rate Konstante kc. X hat keine Affinität für das Biomolekül. Bindungszustand (B) die Biomolekül-Austausch mit dem kostenlosen gefalteten Zustand (F) mit Rate Konstanten koff und kauf. F-Austausch mit aufgefalteten Zustand (U) mit Rate Konstanten ku und kf. U wandelt irreversibel in den aggregierten Zustand (A) mit der Rate Konstante kAgg. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4. Computersimulation des Gleichgewichts und der DSC kinetisch kontrollierte Experimente in Abwesenheit und Anwesenheit eines thermolabilen Liganden. (ein) Gleichgewicht biomolekularen Falten. (b) Gleichgewicht zu Falten, thermolabile Liganden Bindung und langsam thermolabilen Liganden Konvertierung. (c) Gleichgewicht biomolekularen Falten. (d) Gleichgewicht zu Falten, thermolabile Liganden Bindung und schnell thermolabilen Liganden Konvertierung. (e) Gleichgewicht biomolekularen Falten und langsam irreversible Aggregation. (f) Gleichgewicht Falzen, binden, langsam thermolabilen Liganden Konvertierung und langsam irreversible Aggregation. (g) Slow biomolekularen Falten. (h) langsam Falten, Gleichgewicht Bindung und langsam thermolabilen Liganden Konvertierung. (ich) Gleichgewicht biomolekularen Falten. (j) Gleichgewicht zu Falten, langsame thermolabilen Liganden Bindung und langsam thermolabilen Liganden Konvertierung. In allen Gremien sind die vor- und Nachnamen simulierten Scans bzw. dunkel rot und blau. Panels, die nur hell und dunkel blaue Thermogramme zeigen zeigen, dass alle simulierten Scans überlagern, und nur die letzten beiden sichtbar in der Handlung sind. DSC-Experimente wurden mit 20 Scans (10 schmelzen und 10 Glühen) simuliert, bei 1 ° C min-1 Scan-Rate, mit einem Temperaturbereich von 0-80 ° C. Bestimmte Fenster zeigen schmaler Temperaturbereiche um bessere Visualisierung der Simulation Trends zu ermöglichen. Die Biomolekül und Liganden-Konzentrationen in den Simulationen wurden 200 µM und 10 mM, jeweils. Jedes Experiment wurde mit einer 600 s Gleichgewichtherstellung Zeit bei 0 ° C vor dem Scannen und eine 60 s Gleichgewichtherstellung Zeit zwischen jedem der nachfolgenden Scans simuliert. Arrhenius-Parameter für das Gleichgewicht verbindlich und Falten waren einauf = 5 x 10-1 M-1 s-1, einaus = 1 x 1019 s-1, Eeineauf =-20 kJ Mol-1, Eeine off = 120 kJ Mol-1, einfold = 1 x 10-14 s-1, einnicht entfalten = 5 x 1018, Eeinfold =-80 kJ Mol-1und Eeinnicht entfalten = 120 kJ Mol -1 . Arrhenius-Parameter für die Bindung und Faltung kinetisch kontrollierten waren einauf = 5 x 10-3 M-1 s-1, einaus = 1 x 1016 s-1, Eeineauf -20 kJ Mol-1, E = ein off = 120 kJ Mol-1, einfold = 1 x 10-16 s-1, einnicht entfalten = 5 x 1016, Eeinfold =-80 kJ Mol-1und Eeinnicht entfalten = 120 kJ Mol -1 . Arrhenius-Parameter für langsame und schnelle thermolabilen Liganden Umwandlung waren einelangsame = 7.509 x 1010 s-1, Eeinelangsam = 94.65 kJ Mol-1und eineschnelle = 1 s-1, Eeine schnell = 10 kJ Mol-1. Arrhenius-Parameter für die langsame irreversible Aggregation wurdenAgg. = 5 x 107 s-1 und EeinAgg. = 80 kJ Mol-1. Überschüssige Hitze Kapazitäten wurden berechnet mit ΔHUF (Entfaltung), ΔHBF (Bindung) und ΔHAF (Aggregation) = 200,-140 und 50 kJ Mol-1, beziehungsweise. Die theoretische Beschreibung von kinetisch kontrollierten DSC experimentiert mit thermolabilen Liganden und Skript für die Durchführung von Simulationen (und die erforderlichen Parameter) gibt es in ergänzende Datei 1. Bitte klicken Sie hier für eine größere Version dieser Figur.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
R. W. H. V wurde von der McGill Naturwissenschaften und Engineering Research Council of Canada (NSERC) Schulungsprogramm in Bionanomachines unterstützt. A. K. M. und P. E. J. wurden von NSERC Zuschüsse 327028-09 (A. K. M) und 238562 (P. E. J.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Chem Impex | #00829 | |
| Sodium phosphate monobasic dihydrate | Sigma Aldrich | 71502 | |
| Sodium phosphate dibasic | Sigma Aldrich | S9763 | |
| Deioinized water for molecular biology | Millipore | H20MB1001 | |
| 0.2 micron sterile syringe filters | VWR | CA28145-477 | |
| 3 kDa centrifugal filters | Millipore | UFC900324 | |
| Dialysis tubing 0.5-1.0 kDa cutoff | Spectrum Laboratories | 131048 | |
| Silicon tubing | VWR | 89068-474 | |
| Plastic DSC flange caps | TA Instruments | 6111 | |
| DNA aptamer MN4 | Integrated DNA Technologies | https://www.idtdna.com/site/order/menu | |
| Cocaine | Sigma Aldrich | C008 | |
| Quinine | Sigma Aldrich | 22620 | |
| NanoDSC-III microcalorimeter | TA Instruments | http://www.tainstruments.com/nanodsc/ | |
| DSCRun software | TA Instruments | http://www.tainstruments.com/support/software-downloads-support/instruments-by-software/ | |
| NanoAnalyze software | TA Instruments | http://www.tainstruments.com/support/software-downloads-support/instruments-by-software/ | |
| Contrad-70 | VWR | 89233-152 |
Referenzen
- Bruylants, G., Wouters, J., Michaux, C. Differential scanning calorimetry in life science: thermodynamics, stability, molecular recognition and application in drug design. Curr Med Chem. 12 (17), 2011-2020 (2005).
- Privalov, P. L., Dragan, A. I. Microcalorimetry of biological macromolecules. Biophys Chem. 126 (1-3), 16-24 (2007).
- Brandts, J. F., Lin, L. N. Study of strong to ultratight protein interactions using differential scanning calorimetry. Biochemistry. 29 (29), 6927-6940 (1990).
- Harkness, R. W., Slavkovic, S., Johnson, P. E., Mittermaier, A. K. Rapid characterization of folding and binding interactions with thermolabile ligands by DSC. Chem Commun. 52 (92), 13471-13474 (2016).
- Garbett, N. C., Chaires, J. B. Thermodynamic studies for drug design and screening. Expert Opin Drug Dis. 7 (4), 299-314 (2012).
- Holdgate, G. A., Ward, W. H. J. Measurements of binding thermodynamics in drug discovery. Drug Discov Today. 10 (22), 1543-1550 (2005).
- Plotnikov, V., et al. An autosampling differential scanning calorimeter instrument for studying molecular interactions. Assay Drug Dev Technol. 1 (1), 83-90 (2002).
- Schon, A., Lam, S. Y., Freire, E. Thermodynamics-based drug design: strategies for inhibiting protein-protein interactions. Future Med Chem. 3 (9), 1129-1137 (2011).
- Periánez Parraga, L., G-L, A., Gamón Runnenberg, I., Seco Melantuche, R., Delgado Sánchez, O., Puigventós Latorre, F. Thermolabile Drugs. Operating Procedure In the Event of Cold Chain Failure. Farmacia Hospitalaria. 35 (4), 1-28 (2011).
- Murray, J. B., Alshora, H. I. Stability of Cocaine in Aqueous-Solution. J Clin Pharmacy. 3 (1), 1-6 (1978).
- Waterman, K. C., et al. Hydrolysis in pharmaceutical formulations. Pharm. Dev. Technol. 7 (2), 113-146 (2002).
- Mergny, J. L., Lacroix, L. Analysis of thermal melting curves. Oligonucleotides. 13 (6), 515-537 (2003).
- Neves, M. A., Reinstein, O., Johnson, P. E. Defining a stem length-dependent binding mechanism for the cocaine-binding aptamer. A combined NMR and calorimetry study. Biochemistry. 49 (39), 8478-8487 (2010).
- Bonifacio, G. F., Brown, T., Conn, G. L., Lane, A. N. Comparison of the electrophoretic and hydrodynamic properties of DNA and RNA oligonucleotide duplexes. Biophys J. 73 (3), 1532-1538 (1997).
- Durchschlag, H., Hinz, H. -. J. Chapter 3. Thermodynamic Data for Biochemistry and Biotechnology. , 45-128 (1986).
- Hellman, L. M., Rodgers, D. W., Fried, M. G. Phenomenological partial-specific volumes for G-quadruplex DNAs. Eur Biophys J Biophy. 39 (3), 389-396 (2010).
- Farber, P., Darmawan, H., Sprules, T., Mittermaier, A. Analyzing Protein Folding Cooperativity by Differential Scanning Calorimetry and NMR Spectroscopy. J Am Chem Soc. 132 (17), 6214-6222 (2010).
- Reinstein, O., et al. Quinine binding by the cocaine-binding aptamer. Thermodynamic and hydrodynamic analysis of high-affinity binding of an off-target ligand. Biochemistry. 52 (48), 8652-8662 (2013).
- Tellinghuisen, J. Statistical error propagation. J Phys Chem. A. 105 (15), 3917-3921 (2001).
- Drobnak, I., Vesnaver, G., Lah, J. Model-based thermodynamic analysis of reversible unfolding processes. J Phys Chem B. 114 (26), 8713-8722 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten