Method Article
Повторил забора крови из Вены хвост-наркоз крыс с системой сбора механотронное крови
В этой статье
Резюме
Здесь мы описываем метод простой хвост Вены кровь выборки-наркоз крыс с помощью системы трубки вакуум-экстракции. Этот метод уменьшает риск прямого контакта с кровью и упрощает, принимая несколько образцов из одной венепункции.
Аннотация
Кровь может быть собрана из крыс в ряде мест отбора проб. К примеру хвост вен является превосходное местоположение для забора крови. Однако вен хвост тонкий так что иногда бывает трудно для прокола. Кроме того хвост вен имеет низкий кровоток и требует длительного отбора проб время, чтобы получить достаточно крови. В настоящем докладе описывается простой крови методом выборки, метод коллекции механотронное крови, который обычно используется для получения образцов крови от пациентов, здесь используется для крыс наркозом. Кончик иглы бабочка 22 G был вставлен в одной из боковых хвост вен, которые приблизительно 2-3 см от кончика хвоста под углом примерно 20 °, и кровь была собрана в трубки вакуумные коллекции, вставив резиновый конец Бабочка иглы в ва cuum пробирка. Настоящий экспериментальные результаты показывают, что уровень успеха был в экспериментальной группе 95% и 90% в группе начинающих. Коэффициент успеха и прокол раз были похожи между двумя группами. Продолжительность выборки был значительно короче в экспериментальной группе, по сравнению с группой начинающих. В заключение этот метод коллекции механотронное крови для выборки последовательных крови из Вены хвост не - наркотизированных крыс является осуществимым и легко узнать, которые могли бы служить надежной альтернативой для других условно используются методы выборки крови для крысы.
Введение
Забор крови крыс необходим для широкого ряда экспериментальных исследований. Методы для сбора крови от крысы включают пункции сердца, ретро орбиталь сплетения, яремную Вену, подкожной вены, хвост кровеносных сосудов, сонной артерии, брюшной аорты и верхней полой вены. Большинство методов (за исключением подкожной вены и хвост кровеносный сосуд прокол) требуют анестезии1,2. Вен хвост крысы регулярно прокола для забора крови и сосудистых инъекций. После лечения хвост с теплой водой, кровеносные сосуды являются также расширены и подходит для манипуляции, даже когда крысы наркотизированных3.
Несмотря на развитие новых и усовершенствованных методов для получения образцов крови в небольших лабораторных животных2это не всегда легко получить достаточно крови, при отборе проб на мелких животных. Духе хвост крысы является превосходное местоположение для взятия проб крови4. Однако вен хвост тонкий, поэтому иногда трудно пункции и займет много времени, чтобы получить достаточное количество крови из-за его кровоснабжения. Сбора крови через систему трубки вакуум-экстракции является типичным методом в повседневной клинической практике. Это закрытая система для сбора крови снижает риск прямого контакта с кровью и сделал проще взять несколько образцов из одной венепункции5. В настоящем докладе описывается метод простой хвост Вены кровь выборки-наркоз крыс с помощью системы трубки вакуум-экстракции. Этот метод очень легко освоить и может быть использован для получения большой объем крови неоднократно в крыс.
протокол
Все процедуры были утверждены Советом медицинского колледжа Тунцзи на животное уход Комитет из Huazhong университета науки и технологии (Ухань, Китай). Манускрипт был подготовлен согласно прибытия (животное исследования: отчетности экспериментов In Vivo ) рекомендации6.
1. Животноводство
- Используйте крысах Sprague-Dawley (SD) (n = 20, 10 мужчин, 8 недели старый, весом 261-291 g, означает = 272.85 ±9.07 g) от экспериментальных животных центр Huazhong университета науки и технологии и поддерживать крыс в соответствии с руководство по уходу и использования Лабораторных животных, опубликованных нами национального института здравоохранения (низ публикации №85-23, редакция 1996)
- Дом в стандартных условиях с бесплатным доступом к продовольствию и питьевой воде. Держать крыс в клетках2 530 см с древесно стружечные постельные принадлежности. Дом двух крыс в каждой клетке. Закрывайте все клетки номер окружающей среде (не микро изоляции или вентилируемые останов)
- Обеспечение сотрудников, участвующих в экспериментальный протокол регулярно обрабатывать крыс.
- Поддерживать комнатной температуры 21 ° C до 23 ° C. Дать цены нормальные соли диетические (0,3% NaCl) на протяжении всего исследования.
2. Процедура сбора крови
Примечание: Система сбора механотронное крови состоит из двойной остроконечные иглы [22 G (0.7 мм x 25 мм)], пластиковый держатель и серии вакуумных трубок (2 мл) с резиновыми пробками (рис. 1).
- Крыса в пластиковый держатель запретительного и мыть хвост с теплой водой (20-30 ° C), чтобы удалить любой видимой грязи или Кале. В то время как помощник держит хвост в выдвинутом положении, протрите хвост с 70% этиловом спирте и чистой марлей, чтобы очистить вен.
- Вставьте один из боковых хвост вен (около 5 мм) в позиции кончик иглы бабочка 22 G примерно 2-3 см от кончика хвоста под углом примерно 20 ° (рис. 2). Сбор крови в трубки вакуумные коллекции, вставив резиновый конец Бабочка иглы в вакуумной пробирки (рис. 3).
Примечание: Объем крови максимального сбора-1,2 мл7. - После сбора крови удалите иглу и осторожно применять давление на прокол сайт с марлей для 15-30 s, чтобы остановить поток крови. Затем отпустите крысы из держателя запретительного и вернуть его клетке крыса.
- Используйте трубы, содержащие ЭДТА как антикоагулянт для сбора плазмы крови. Аккуратно Инвертируйте трубки несколько раз перемешать антикоагулянта в крови и поместить образцы на льду по вертикали.
- Центрифугуйте образцы пробирки в центрифугу охлажденных в 2000 g x 10 мин для отделения сыворотки или плазмы.
- Извлеките плазменный/сыворотки, стараясь не нарушить слои красных и белых кровяных клеток. Для сбора сыворотки крови, используйте трубы без антикоагулянта. Оба типа образца можно использовать сразу, или температуре-80 ° C на срок до одного года.
Примечание: Успешное крови коллекции был определен как получение крови 1,2 мл каждый раз. Максимальная прокол время было установлено три испытания, если объем всего крови был ниже, чем 1.2 мл после третьего прокол, он был определен как неудачной крови коллекции. Продолжительность выборки начинается от пункции Вены хвост для удаления Бабочка иглы после забора крови. -
Сбор крови дважды в течение двух недель7.
- Чтобы протестировать и проверить осуществимость этого метода, поезд два медицинских студентов (для начинающих) за 2 ч перед выполнением этот протокол сбора крови. Используйте 20 крыс и обратить крови от 10 крыс 2 опытных стипендиатов (экспериментальная группа) и 10 крыс, 2 студентов-медиков (Группа новичков).
3. Статистический анализ
- Экспресс данных как среднее значение ± стандартное отклонение и анализировать с 17 статистики SPSS. Значение α 0,05 был выбран, поэтому p < 0,05 считался статистически значимой.
Результаты
Продолжительность выборки, массы тела и объем сбора крови двух групп
Кровь была собрана из 10 крыс (5 кобелей) дважды в течение двух недель в каждой группе. Средняя тела массы в обеих группах был похож (272.00 ±9.66 g и g 273.70 ±8.87). Отбор проб продолжительность было значительно короче в экспериментальной группе, по сравнению с группой начинающих (2.77 ±0.53 мин против 3.28 ±0.83 min, p < 0,05) (Таблица 1).
Успех оценить и прокол раз двух групп
Коэффициент успеха было 95% (19/20) в экспериментальной группе и 90% (18/20) в группе начинающих (p > 0,05). Прокол времена не были значительно отличаются между двумя группами (1.50 мин ±0.61 vs. 1,85 ±0.75 мин, p > 0.05) (Таблица 2). Эти результаты показывают, этот метод очень легко учиться, и техника может быть освоен после обучения за 2 ч.
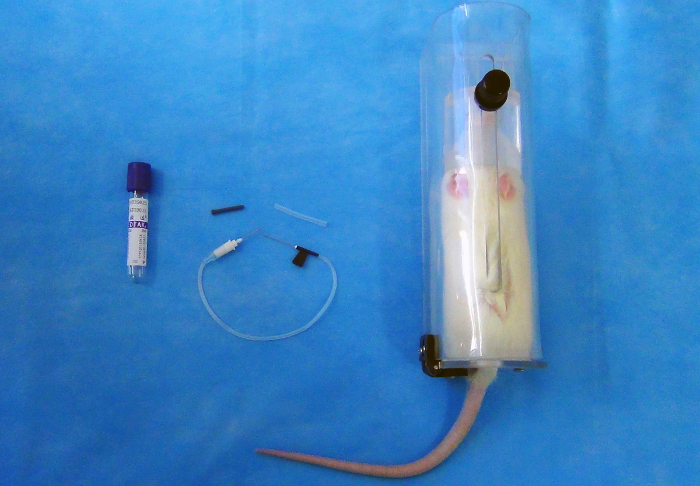
Рисунок 1 : 2 мл вакуумной пробирки (слева); 22 G Бабочка иглы (в центре) держателя запретительных (справа). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Кончик иглы был вставлен в Вену боковой хвост (около 5 мм) в положении примерно 2-3 см от кончика хвоста под углом приблизительно 20 °. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : Успешно венепункции. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Экспериментальная группа | Начальная группа | |||||||||
| Пол | Вес (г) | Объем собранной крови (мл) | выборки длительность (мин) | Пол | Вес (г) | Объем собранной крови (мл) | выборки длительность (мин) | |||
| E1-1 | мужчины | 291 | 1.2 | 3.12 | B1-1 | мужчины | 282 | 1.2 | 3.18 | |
| E1-2 | мужчины | 291 | 1.2 | 2.73 | B1-2 | мужчины | 282 | 1.2 | 2.18 | |
| E2-1 | мужчины | 276 | 1.2 | 2.3 | B2-1 | мужчины | 264 | 1.2 | 3.73 | |
| E2-2 | мужчины | 276 | 1.2 | 2.37 | B2-2 | мужчины | 264 | 1.2 | 2.47 | |
| E3-1 | мужчины | 267 | 1.2 | 2.73 | B3-1 | мужчины | 265 | 1.2 | 3.52 | |
| E3-2 | мужчины | 267 | 1.0 | 3.88 | B3-2 | мужчины | 265 | 1.2 | 2,53 | |
| Е4-1 | мужчины | 263 | 1.2 | 2.41 | B4-1 | мужчины | 289 | 1.2 | 2.32 | |
| Е4-2 | мужчины | 263 | 1.2 | 2.52 | B4-2 | мужчины | 289 | 1.2 | 3.62 | |
| E5-1 | мужчины | 265 | 1.2 | 3.61 | B5-1 | мужчины | 277 | 1.2 | 3.48 | |
| E5-2 | мужчины | 265 | 1.2 | 2.42 | B5-2 | мужчины | 277 | 1.2 | 3.12 | |
| E6-1 | девушки | 285 | 1.2 | 3.33 | B6-1 | девушки | 274 | 0.9 | 4.87 | |
| E6-2 | девушки | 285 | 1.2 | 3.03 | B6-2 | девушки | 274 | 1.2 | 3.37 | |
| Е7-1 | девушки | 271 | 1.2 | 2.82 | B7-1 | девушки | 268 | 1.0 | 3.93 | |
| Е7-2 | девушки | 271 | 1.2 | 2.42 | B7-2 | девушки | 268 | 1.2 | 3.82 | |
| E8-1 | девушки | 268 | 1.2 | 1.93 | B8-1 | девушки | 262 | 1.2 | 2.07 | |
| Е8-2 | девушки | 268 | 1.2 | 3.05 | B8-2 | девушки | 262 | 1.2 | 3.67 | |
| E9-1 | девушки | 273 | 1.2 | 2.52 | B9-1 | девушки | 281 | 1.2 | 4.38 | |
| E9-2 | девушки | 273 | 1.2 | 3.17 | B9-2 | девушки | 281 | 1.2 | 4.57 | |
| E10-1 | девушки | 261 | 1.2 | 1.82 | B10-1 | девушки | 275 | 1.2 | 2,53 | |
| E10-2 | девушки | 261 | 1.2 | 3.25 | B10-2 | девушки | 275 | 1.2 | 2.28 | |
| Среднее | 2.77 | 3.28 | ||||||||
| Ан-1: серийный номер в экспериментальной группе для первого сбора крови крыс. | ||||||||||
| Ан-2: серийный номер в экспериментальной группе для второй коллекции крови крыс. | ||||||||||
| BN-1: серийный номер в группе начинающих для первого сбора крови крыс. | ||||||||||
| BN-2: серийный номер в группе начинающих для второй коллекции крови крыс. | ||||||||||
Таблица 1: Результаты крови, собранные в экспериментальной группе и группе начинающих.
| Время сбора крови | Средняя прокол раз | Один раз прокол | Прокол в два раза | Прокол в три раза | Не удалось | Показатель успеха | |
| Экспериментальная группа | 20 | 1.50 ±0.61 | 11 | 8 | 0 | 1 | 95% |
| Начальная группа | 20 | 1,85 ±0.75 | 7 | 9 | 2 | 2 | 90% |
| Один раз прокол: количество крыс с успешным крови коллекции после первого прокола | |||||||
| Два раза пункция: количество крыс с успешным крови коллекции после второй прокол | |||||||
| Три раза пункция: количество крыс с успешным крови коллекции после третьего пункция | |||||||
| Ошибка: количество крыс с сбой сбора крови после третьего пункция | |||||||
Таблица 2: Сравнение раз прокол и показатели успеха экспериментальной группы и группы начинающих.
Обсуждение
В настоящем докладе описывается метод коллекции легко научиться крови крыс. Наши результаты показали, что этот метод является возможным для неоднократно собирать большой объем крови от крыс. Кроме того этот метод может быть легко освоен с краткосрочной кривой обучения. Эта процедура может быть выполнена в-наркоз крыс и только вызывает минимальный стресс для животных.
Кровь может быть собрана от крыс в различных местах. Хвост вен-это превосходное место для взятия проб крови4. Однако это не всегда легко получить достаточный объем крови из вен хвост потока тонких и низкого крови крыс. Система сбора механотронное крови обычно используется для сбора проб крови у пациентов в повседневной клинической практике. Эта система сбора механотронное крови был использован в больных и исследования животных для долгое время8,9,10. Эта система состоит из вакуумной пробирки с силиконовым покрытием внутренней трубки стены и Бабочка иглы. Он основан на принципе вакуумные отрицательное давление и позволяет непрерывное рисунок крови без риска сбора крови, что также снижает вероятность загрязнения и гемолиз11. Объем крови в катетер составляет около 0,3 мл. После снятия иглу из Вены хвост, прольется кровь, заблокирован в катетер в собирая ламповый вследствие вакуума. Этот метод применяется также для сбора крови от крыс, весом менее 100 g с помощью небольших проколов иглы.
Этот метод сбора крови имеет несколько преимуществ. Эта процедура вызывает только минимальной травмы крыс и забора крови могут быть выполнены без применения обезболивающих средств, таким образом можно избежать влияния реакции на стресс и анестетиков на крови. Наши наблюдения показали, что крысы были тихо в пластиковый держатель запретительного во время процедуры и в ходе этих экспериментов не погибли. Во-вторых, повторил сбора крови, каждый один или два дня возможна, что позволяет часто проб крови с адекватной томом для различных научно-исследовательских целей. Наконец этот метод прост в освоении и легко освоено начинающих после периода коротких (2 h) обучения, как указано на аналогичные показатели успеха и прокол раз между экспериментальной и начинающих группами в настоящем докладе. В предыдущем докладе Lee et al. продемонстрировал аналогичный метод отбора проб крови из Вены боковой хвост крысы4. Наш метод проще, чем сообщенные Lee et al. 4 в том, что мы непосредственно вставьте прокола иглы в Вену хвост и другой конец трубки подключен непосредственно к вакуумной трубки для сбора крови, без использования дополнительных шприц и ручной аспирации крови и без необходимости ' молоко ING' Вены, чтобы облегчить поток крови. Сбор крови с этой закрытой системы уменьшает вероятность заражения крови. Использование запретительного держателя также уменьшает стресс для крыс и облегчает фиксацию хвост.
Следующие два действия имеют решающее значение для успешного применения этого метода. 1) расширить хвост и избежать движения хвоста; 2) осторожно пункции Вены под углом 20 °, чтобы избежать пункции через Вену и держать прокола иглы в Вену.
В заключение метод сбора принимается механотронное крови крыс является безопасным, это возможно и легко практике. Этот метод позволяет часто проб крови с Томом адекватных крови, полученных от крыс наркозом.
Раскрытие информации
Авторы не имеют ничего сообщать
Благодарности
Авторы имеют без подтверждений сделать.
Материалы
| Name | Company | Catalog Number | Comments |
| a double-pointed needle | Shanghai Kang Nong medical instrument co., LTD, China | 22G | (0.7×25mm) |
| vacuum tubes | Wuhan Zhi Yuan, medical science and technology co., LTD, China | 2 ml | |
| rat restraining holder | Shanghai Kang Nong medical instrument co., LTD, China | 250g rat hoder model | |
| normal salt diet for rats | Rats received a normal salt diet (0.3% NaCl) throughout the study | ||
| SPSS software for statistical analysis | SPSS Inc, Chicago; USA | Version 17.0. |
Ссылки
- Brown, C. Blood collection from the tail of a rat. Lab Anim (NY). 35 (8), 24-25 (2006).
- Parasuraman, S., Raveendran, R., Kesavan, R. Blood sample collection in small laboratory animals. J Pharmacol Pharmacother. 1 (2), 87-93 (2010).
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: a histological re-examination with respect to blood vessel puncture methods. Lab Anim. 37 (2), 121-125 (2003).
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. J. Vis. Exp. (99), (2015).
- . . WHO Guidelines on Drawing Blood: Best Practices in Phlebotomy WHO Guidelines Approved by the Guidelines Review Committee. , (2010).
- Kilkenny, C., Altman, D. G. Improving bioscience research reporting: ARRIVE-ing at a solution. Lab Anim. 44 (4), 377-378 (2010).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Eder, J. M., Cutter, G. R. A new device for collecting cord blood. Obstet Gynecol. 86 (5), 850-852 (1995).
- Reynolds, B. S., et al. Comparison of a new device for blood sampling in cats with a vacuum tube collection system - plasma biochemistry, haematology and practical usage assessment. J Feline Med Surg. 9 (5), 382-386 (2007).
- Wiwanitkit, V. Comparison of blood specimens from plain and gel vacuum blood collection tubes. J Med Assoc Thai. 84 (5), 723-726 (2001).
- Wollowitz, A., Bijur, P. E., Esses, D., John Gallagher, E. Use of butterfly needles to draw blood is independently associated with marked reduction in hemolysis compared to intravenous catheter. Acad Emerg Med. 20 (11), 1151-1155 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены