Method Article
Wiederholte Blutentnahme aus Tail Vene nicht betäubt Ratten mit einem Vakuum Blut-Sammelsystem
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine einfache Rute Vene Blut Sampling-Methode in nicht betäubt Ratten mit einer Absauganlage Rohr. Diese Methode verringert das Risiko der direkten Kontakt mit Blut und vereinfacht, wobei mehrere Proben aus einem einzigen Venenpunktion.
Zusammenfassung
Blut kann bei Ratten in einer Reihe von Probenahme Standorten abgeholt. Zum Beispiel ist die Rute Vene eine erstklassige Lage für die Blutabnahme. Allerdings ist die Rute Vene dünn, so, dass es manchmal schwer zu durchstechen. Darüber hinaus die Rute Vene hat geringe Durchblutung und erfordert eine lange Abtastzeit, ausreichend Blut zu bekommen. Der vorliegende Bericht beschreibt eine einfache Blut-Sampling-Methode, die Erfassungsmethode Vakuum Blut, das normalerweise verwendet wird, um Blutproben von Patienten, die hier verwendet für Ratten nicht betäubt zu erhalten. Die 22 G Schmetterling Nadelspitze wurde in einer der seitlichen Schweif Venen eingefügt, ca. 2-3 cm von der Spitze der Rute in einem Winkel von ca. 20° und Blut in das Vakuum Sammelröhrchen gesammelt wurden, indem man Kautschuk Ende der Schmetterling Nadel in die va Cuum Blutsammelröhrchen. Die vorliegenden experimentellen Ergebnisse zeigen, dass die Erfolgsquote bei 95 % in der experimentellen Gruppe und 90 % in der Anfängergruppe war. Die Erfolgsquote und Punktion Zeiten waren zwischen beiden Gruppen ähnlich. Die Dauer der Probenahme war deutlich kürzer in der experimentellen Gruppe im Vergleich zur Anfängergruppe. Zusammenfassend ist dieses Vakuum Blut Erfassungsmethode für sequentielle Blutentnahme aus der Vene Schweif nicht anästhesierten Ratten möglich und einfach zu erlernen, die könnte als eine zuverlässige Alternative zu konventionell Blut Stichprobenverfahren für verwendet dienen Ratten.
Einleitung
Die Blutabnahme von Ratten ist für eine Vielzahl von experimentellen Untersuchungen erforderlich. Techniken für die Blutentnahme aus der Ratte gehören Punktion des Herzens, Retro-Orbital Plexus, Halsschlagader, Stammvenen, Tail Blutgefäße, Halsschlagader, Bauchschlagader und Vena Cava. Die meisten Techniken (außer Stammvenen und Schweif Blutgefäß Punktion) erfordern Anästhesie1,2. Adern von den Rattenschwanz werden routinemäßig für Blutabnahme und vaskuläre Injektion punktiert. Nach der Behandlung der Rute mit warmem Wasser, sind die Blutgefäße gut geweitet und eignet sich für Manipulation, auch bei Ratten narkotisierten3.
Trotz der Entwicklung von neuen und verbesserten Techniken, um Blutproben im kleinen Labor Tiere2zu erhalten ist es nicht immer einfach, genügend Blut zu erhalten, bei der Probenahme von Kleintieren. Die Rute Ader von Ratten ist eine erstklassige Lage für Blut-Probenahme-4. Jedoch die Rute Vene ist dünn, damit es ist manchmal schwer zu durchstechen und würde sehr lange dauern, genügend Blut aufgrund seiner niedrigen Blutfluss zu bekommen. Blutentnahme über eine Absauganlage Rohr ist eine typische Methode in der täglichen klinischen Praxis. Dieses geschlossene System für Blut sammeln reduziert das Risiko einer direkten Kontakt mit Blut und hat es leichter gemacht, mehrere Proben von einem einzigen Venenpunktion5nehmen. Der vorliegende Bericht beschreibt eine einfache Rute Vene Blut Sampling-Methode in nicht betäubt Ratten mit Absauganlage für die Röhre. Diese Methode ist leicht zu beherrschen und kann verwendet werden, um eine große Menge an Blut wiederholt bei Ratten zu erhalten.
Protokoll
Alle Verfahren wurden von der Tongji Medical College Council auf Animal Care Ausschuss der Huazhong University of Science und Technology (Wuhan, China) genehmigt. Das Manuskript wurde nach Ankunft vorbereitet (Animal Research: Meldung von In Vivo Experimente) Richtlinien6.
1. Tierhaltung
- Verwenden Sie Sprague-Dawley (SD) Ratten (n = 20, 10 Männer, 8 Wochen alte, 261, 291 g wiegen meine = 272.85 ±9.07 g) aus der experimentellen Tiere Mitte der Huazhong University of Science and Technology und pflegen Ratten gemäß dem Leitfaden für die Pflege und Nutzung der Versuchstiere, die von der US National Institute of Health (NIH Publikation Nr. 85-23, revidiert 1996) veröffentlicht
- Haus unter Standardbedingungen mit freiem Zugang zu Nahrungsmitteln und Trinkwasser. Halten Sie Ratten in 530 cm2 Käfige mit Holz-Rasur Bettwäsche. Haus zwei Ratten in jedem Käfig. Halten Sie alle Käfige für die Raumumgebung (keine Mikro-Isolierung oder belüfteten Käfighaltung) offen
- Stellen Sie sicher, im experimentellen Protokoll beteiligten Mitarbeiter regelmäßig die Ratten behandeln.
- Pflegen Sie Raumtemperatur zwischen 21 ° C und 23 ° C. Preise einer normalen salzarme Kost zu geben (0,3 % NaCl) während der gesamten Studie.
2. Blut Inkasso
Hinweis: Das Sammelsystem für Vakuum Blut besteht aus einer Doppel-spitzen Nadel [22 G (0,7 mm x 25 mm)], ein Kunststoff-Halter und einer Reihe von Vakuum-Röhren (2 mL) mit Gummistopfen (Abbildung 1).
- Legen Sie die Ratte in eine zurückhaltende Plastikhalter und waschen Sie die Rute mit Warmwasser (20-30 ° C), sichtbaren Schmutz oder Kot zu entfernen. Während ein Assistent die Rute in einer ausgefahrenen Position hält, wischen Sie die Rute mit 70 % Ethanol, und reinigen Sie mit Gaze, die Vene klar zu machen.
- Legen Sie die Nadelspitze 22 G Schmetterling in einer der seitlichen Schweif Venen (ca. 5 mm) an einer Stelle etwa 2-3 cm entfernt von der Schwanzspitze im Winkel von ca. 20° (Abbildung 2). Sammeln von Blut in das Vakuum Sammelröhrchen durch Einfügen der Kautschuk Ende der Schmetterling Nadel in das Vakuum Blutsammelröhrchen (Abbildung 3).
Hinweis: Die maximale Sammlung Blutvolumen ist 1,2 mL-7. - Nach der Blutentnahme die Nadel entfernen und vorsichtig Druck auf die Punktionsstelle mit Gaze für 15-30 s, um den Blutfluss zu stoppen. Dann lassen Sie die Ratte aus dem Kunststoff zurückhaltende Halter und zurückkehren Sie die Ratte zu seinen Käfig.
- Verwenden Sie Rohre, die EDTA als ein Antigerinnungsmittel enthalten, Blutplasma zu sammeln. Invertieren Sie das Rohr sanft mehrmals zu mischen Antikoagulans im Blut und die Proben auf Eis vertikal.
- Zentrifugieren Sie Probe Blutentnahmeröhrchen in einer gekühlten Zentrifuge bei 2.000 x g für 10 min, Plasma oder Serum zu trennen.
- Extrahieren Sie das Plasma/Serum, kümmert sich nicht um die roten und weißen Blutkörperchen Schichten stören. Verwenden Sie zum Sammeln von Blutserum Röhren ohne Antikoagulans. Beide Arten von Proben können sofort eingesetzt oder bei-80 ° C bis zu einem Jahr gelagert werden.
Hinweis: Erfolgreiche Blutentnahme wurde definiert als jedes Mal 1,2 mL Blut zu erhalten. Maximale Punktion Zeit eingestellt wurde, drei Versuche, wenn das gesamte Blutvolumen niedriger als 1,2 mL nach der dritten Punktion war wurde definiert als eine fehlgeschlagene Blutentnahme. Die Dauer der Probenahme beginnt die Rute Vene Punktion zur Beseitigung der Schmetterling Nadel nach der Blutentnahme. -
Sammeln Sie Blut zweimal innerhalb von zwei Wochen7.
- Zum Testen und überprüfen die Machbarkeit dieser Methode, trainieren Sie zwei Medizinstudenten (Anfänger) für 2 h vor dem Ausführen dieses Blut-Sammlung-Protokolls. Verwenden Sie zwanzig Ratten und zeichnen Sie Blut von 10 Ratten von 2 erfahrenen Fellows (Versuchsgruppe) und von 10 Ratten durch die 2 Medizinstudenten (Anfängergruppe) zu.
3. statistische Analyse
- Daten als ein Mittelwert ± Standardabweichung auszudrücken und analysieren mit SPSS Statistics 17. Ein α-Wert von 0,05 gewählt wurde, daher p < 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Dauer der Probenahme, Körpermasse und Blut Auffangvolumen der beiden Gruppen
Blut wurde zweimal innerhalb von zwei Wochen in jeder Gruppe aus 10 Ratten (5 Rüden) gesammelt. Der mittlere Body Mass in beiden Gruppen war ähnlich (272,00 ±9.66 g und 273.70 ±8.87 g). Probenahme von Dauer war deutlich kürzer in der experimentellen Gruppe im Vergleich zur Anfängergruppe (2,77 ±0.53 min vs. 3,28 ±0.83 min, p < 0,05) (Tabelle 1).
Erfolg bewerten und Zeiten der beiden Gruppen zu durchbohren
Die Erfolgsquote betrug 95 % (19/20) in der experimentellen Gruppe und 90 % (18/20) in der Anfängergruppe (p > 0.05). Punktion Zeiten unterschieden sich nicht signifikant zwischen den beiden Gruppen (1,50 ±0.61 min vs. 1,85 ±0.75 min, p > 0,05) (Tabelle 2). Diese Ergebnisse deuten darauf hin, diese Methode ist leicht zu erlernen und die Technik könnte nach dem Training für 2 h bewältigt werden.
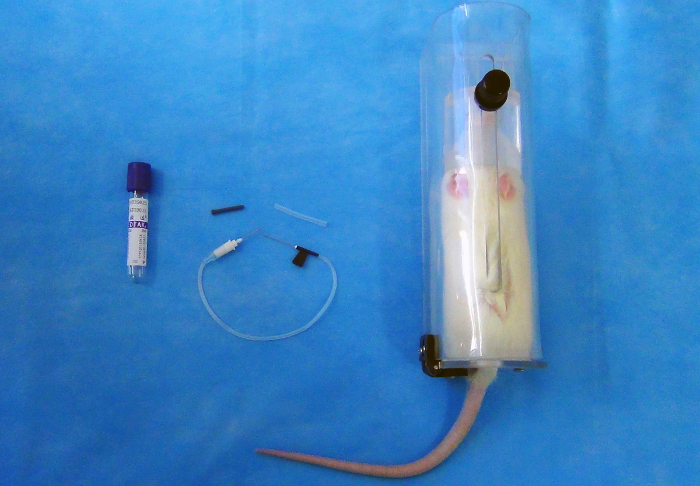
Abbildung 1 : 2 mL Vakuum Blut Sammelrohr (links), 22 G Schmetterling Nadel (Mitte); der zurückhaltende Kunststoffhalter (rechts). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Die Nadelspitze in die seitlichen Schweif Vene (ca. 5 mm) an der Position eingefügt wurde etwa 2-3 cm entfernt von der Schwanzspitze im Winkel von ca. 20°. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Erfolgreiche Venenpunktion. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Experimentelle Gruppe | Anfängergruppe | |||||||||
| Geschlecht | Gewicht (g) | Gesammelte Blutvolumen (mL) | Probenahme-Dauer (min.) | Geschlecht | Gewicht (g) | Gesammelte Blutvolumen (mL) | Probenahme-Dauer (min.) | |||
| E1-1 | Männlich | 291 | 1.2 | 3.12 | B1-1 | Männlich | 282 | 1.2 | 3.18 | |
| E1-2 | Männlich | 291 | 1.2 | 2.73 | B1-2 | Männlich | 282 | 1.2 | 2.18 | |
| E2-1 | Männlich | 276 | 1.2 | 2.3 | B2-1 | Männlich | 264 | 1.2 | 3,73 | |
| E2-2 | Männlich | 276 | 1.2 | 2,37 | B2-2 | Männlich | 264 | 1.2 | 2.47 | |
| E3-1 | Männlich | 267 | 1.2 | 2.73 | B3-1 | Männlich | 265 | 1.2 | 3.52 | |
| E3-2 | Männlich | 267 | 1.0 | 3.88 | B3-2 | Männlich | 265 | 1.2 | 2.53 | |
| E4-1 | Männlich | 263 | 1.2 | 2.41 | B4-1 | Männlich | 289 | 1.2 | 2.32 | |
| E4-2 | Männlich | 263 | 1.2 | 2.52 | B4-2 | Männlich | 289 | 1.2 | 3.62 | |
| E5-1 | Männlich | 265 | 1.2 | 3.61 | B5-1 | Männlich | 277 | 1.2 | 3.48 | |
| E5-2 | Männlich | 265 | 1.2 | 2.42 | B5-2 | Männlich | 277 | 1.2 | 3.12 | |
| E6-1 | Weiblich | 285 | 1.2 | 3.33 | B6-1 | Weiblich | 274 | 0,9 | 4,87 | |
| E6-2 | Weiblich | 285 | 1.2 | 3.03 | B6-2 | Weiblich | 274 | 1.2 | 3.37 | |
| E7-1 | Weiblich | 271 | 1.2 | 2.82 | B7-1 | Weiblich | 268 | 1.0 | 3.93 | |
| E7-2 | Weiblich | 271 | 1.2 | 2.42 | B7-2 | Weiblich | 268 | 1.2 | 3,82 | |
| E8-1 | Weiblich | 268 | 1.2 | 1.93 | B8-1 | Weiblich | 262 | 1.2 | 2.07 | |
| E8-2 | Weiblich | 268 | 1.2 | 3.05 | B8-2 | Weiblich | 262 | 1.2 | 3,67 | |
| E9-1 | Weiblich | 273 | 1.2 | 2.52 | B9-1 | Weiblich | 281 | 1.2 | 4.38 | |
| E9-2 | Weiblich | 273 | 1.2 | 3.17 | B9-2 | Weiblich | 281 | 1.2 | 4.57 | |
| E10-1 | Weiblich | 261 | 1.2 | 1,82 | B10-1 | Weiblich | 275 | 1.2 | 2.53 | |
| E10-2 | Weiblich | 261 | 1.2 | 3.25 | B10-2 | Weiblich | 275 | 1.2 | 2.28 | |
| Durchschnitt | 2,77 | 3.28 | ||||||||
| En-1: Seriennummer der Ratten in der experimentellen Gruppe zur ersten Blutentnahme. | ||||||||||
| En-2: Seriennummer der Ratten in der experimentellen Gruppe zur zweiten Blutentnahme. | ||||||||||
| BN-1: Seriennummer der Ratten in der Anfängergruppe für die erste Blutentnahme. | ||||||||||
| BN-2: Seriennummer der Ratten in der Anfängergruppe für die zweite Blutentnahme. | ||||||||||
Tabelle 1: Ergebnisse des Blutes in der experimentellen Gruppe und der Anfängergruppe gesammelt.
| Blut-Abholzeiten | Durchschnittliche Punktion Zeiten | Ein Zeit-Punktion | Zwei Mal Punktion | Drei Mal Punktion | Fehler beim | Erfolgsquote | |
| Experimentelle Gruppe | 20 | 1,50 ±0.61 | 11 | 8 | 0 | 1 | 95 % |
| Anfängergruppe | 20 | 1.85 ±0.75 | 7 | 9 | 2 | 2 | 90 % |
| Ein Zeit-Punktion: Anzahl von Ratten mit erfolgreichen Blutentnahme nach der ersten Punktion | |||||||
| Zwei Mal Punktion: Anzahl von Ratten mit erfolgreichen Blutentnahme nach der zweiten Punktion | |||||||
| Drei Mal Punktion: Anzahl von Ratten mit erfolgreichen Blutentnahme nach der dritten Punktion | |||||||
| Fehler: Anzahl der Ratten mit fehlgeschlagenen Blutentnahme nach der dritten Punktion | |||||||
Tabelle 2: Vergleich der Punktion Zeiten und Erfolgsraten von der Versuchsgruppe und die Anfängergruppe.
Diskussion
Der vorliegende Bericht beschreibt ein einfach zu erlernendes Blut Erfassungsmethode bei Ratten. Unsere Ergebnisse zeigten, dass diese Methode zum Sammeln von immer wieder einer großen Menge an Blut von Ratten machbar ist. Darüber hinaus könnte diese Methode leicht mit einer kurzfristigen Lernkurve gemeistert werden. Dieses Verfahren kann bei nicht narkotisierten Ratten durchgeführt werden und verursacht nur minimale Belastung für die Tiere.
Blut kann von Ratten an verschiedenen Orten gesammelt werden. Die Rute Ader ist eine erstklassige Lage für Blut-Probenahme-4. Es ist jedoch nicht immer einfach, genügend Blutvolumen aus der dünnen und niedrige Blut fließen Schweif Vene der Ratten zu erhalten. Das Sammelsystem für Vakuum Blut dient in der Regel für das Sammeln von Blutproben von Patienten in der täglichen klinischen Praxis. Dieses Vakuum Blut Sammelsystem hat für eine lange Zeit8,9,10in Patienten und Versuchstiere eingesetzt. Dieses System besteht aus einem Vakuum Blutsammelröhrchen mit Silikon beschichtete Innenrohr Wand und Butterfly-Nadel. Es stützte sich auf das Vakuum Unterdruck-Prinzip und ermöglicht die kontinuierliche Zeichnung des Blutes ohne das Risiko von Blut zu sammeln, das auch die Möglichkeit der Kontamination und Hämolyse11reduziert. Das Volumen der Blutprobe in der Katheter ist ca. 0,3 mL. Nach dem Rückzug der Nadelöhrs von der Rute Vene, fließt das Blut in den Katheter blockiert in der Vakuum-Sammelrohr durch den Unterdruck. Diese Methode gilt auch für die Blutentnahme von Ratten mit einem Gewicht von weniger als 100 g mit dem Einsatz von einer kleineren Punktionsnadel.
Dieses Blut-Sammlung-Methode hat mehrere Vorteile. Diese Prozedur bewirkt nur minimalen Verletzung an Ratten und Blutentnahme kann ohne den Einsatz von Anästhetika durchgeführt werden, damit der Einfluss der Stressantwort und Anästhetika auf die Blutprobe vermieden werden. Unsere Beobachtungen zeigten, dass Ratten ruhig in den dämpfenden Kunststoffhalter während des Verfahrens waren und es keine Todesfälle während dieser Experimente gab. Zweitens wiederholt jeder Blutentnahme oder zwei Tage ist möglich, wodurch häufige Entnahme von Blut mit ausreichend Volumen für verschiedene Zwecke. Schließlich, diese Methode ist leicht erlernbar und gemeistert wurde leicht von Anfängern nach einer kurzen (2 h) lernen, wie durch die ähnliche Erfolgsraten und Punktion Zeiten zwischen den experimentellen und Anfänger Gruppen in diesem Bericht. In einem früheren Bericht zeigten Lee Et Al. eine ähnliche Methode der Probenahme Blut aus der Vene seitliche Schweif der Ratte4. Unsere Methode ist einfacher als die von Lee Et Al. berichtet 4 , dass wir direkt die Punktionsnadel in die Rute Vene und das andere Ende des Schlauches einfügen direkt mit verbunden ist das Saugrohr für die Blutentnahme, ohne den Einsatz einer zusätzlichen Spritze und manuelle Aspiration von Blut und ohne die Notwendigkeit von "Milch Ing' die Vene Blut zu erleichtern. Blutentnahme mit diesem geschlossenen System verringert die Wahrscheinlichkeit von Blut. Verwendung von bewegungseinschränkenden Kunststoffhalter auch reduziert den Stress auf die Ratte und erleichtert die Fixierung der Rute.
Die folgenden zwei Schritte sind entscheidend für die erfolgreiche Anwendung dieser Methode. (1) erweitern Sie das Heck und vermeiden Sie die Bewegung der Rute zu; (2) vorsichtig Durchstechen der Vene in einem Winkel von 20° zu vermeiden Punktion durch die Vene und halten die Punktionsnadel in die Vene.
Zusammenfassend ist die angenommene Vakuum Blut Erhebungsmethoden bei Ratten sicher, machbar und leicht zu praktizieren. Diese Methode ermöglicht häufige Entnahme von Blut mit einer angemessenen Blutvolumen nicht betäubt Ratten entnommen.
Offenlegungen
Die Autoren haben nichts preisgeben
Danksagungen
Die Autoren haben keine Bestätigungen zu machen.
Materialien
| Name | Company | Catalog Number | Comments |
| a double-pointed needle | Shanghai Kang Nong medical instrument co., LTD, China | 22G | (0.7×25mm) |
| vacuum tubes | Wuhan Zhi Yuan, medical science and technology co., LTD, China | 2 ml | |
| rat restraining holder | Shanghai Kang Nong medical instrument co., LTD, China | 250g rat hoder model | |
| normal salt diet for rats | Rats received a normal salt diet (0.3% NaCl) throughout the study | ||
| SPSS software for statistical analysis | SPSS Inc, Chicago; USA | Version 17.0. |
Referenzen
- Brown, C. Blood collection from the tail of a rat. Lab Anim (NY). 35 (8), 24-25 (2006).
- Parasuraman, S., Raveendran, R., Kesavan, R. Blood sample collection in small laboratory animals. J Pharmacol Pharmacother. 1 (2), 87-93 (2010).
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: a histological re-examination with respect to blood vessel puncture methods. Lab Anim. 37 (2), 121-125 (2003).
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. J. Vis. Exp. (99), (2015).
- . . WHO Guidelines on Drawing Blood: Best Practices in Phlebotomy WHO Guidelines Approved by the Guidelines Review Committee. , (2010).
- Kilkenny, C., Altman, D. G. Improving bioscience research reporting: ARRIVE-ing at a solution. Lab Anim. 44 (4), 377-378 (2010).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Eder, J. M., Cutter, G. R. A new device for collecting cord blood. Obstet Gynecol. 86 (5), 850-852 (1995).
- Reynolds, B. S., et al. Comparison of a new device for blood sampling in cats with a vacuum tube collection system - plasma biochemistry, haematology and practical usage assessment. J Feline Med Surg. 9 (5), 382-386 (2007).
- Wiwanitkit, V. Comparison of blood specimens from plain and gel vacuum blood collection tubes. J Med Assoc Thai. 84 (5), 723-726 (2001).
- Wollowitz, A., Bijur, P. E., Esses, D., John Gallagher, E. Use of butterfly needles to draw blood is independently associated with marked reduction in hemolysis compared to intravenous catheter. Acad Emerg Med. 20 (11), 1151-1155 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten