Method Article
진공 혈액 수집 시스템으로 비 취 쥐의 꼬리 정 맥에서 혈액 컬렉션 반복
요약
여기, 비 취 쥐 진공 추출 튜브 시스템을 사용 하 여 간단한 꼬리 정 맥 혈액 샘플링 방법을 설명 합니다. 이 방법은 혈액에 직접 노출의 위험을 감소 하 고 단일 venipuncture에서 여러 샘플을 채 취하고 단순화 합니다.
초록
혈액은 샘플링 위치 수에 쥐에서 수집할 수 있습니다. 예를 들어, 꼬리 정 맥 혈액 샘플링에 대 한 우수한 위치 이다. 그러나, 꼬리 정 맥은 얇은 펑크 때로는 어렵다. 또한, 꼬리 정 맥 낮은 혈액 흐름이 고 충분 한 혈액을 얻을 수 있는 긴 샘플링 시간을 요구 한다. 현재 보고서는 간단한 혈액 샘플링 방법을, 여기 쥐 비 취를 위해 사용 하는 환자에서 혈액 샘플을 얻기 위해 일반적으로 사용 되는 진공 혈액 수집 방법에 설명 합니다. 22 G 나비 바늘 팁 하나 약 20 °, 그리고 혈액의 각도에서 꼬리의 끝에서 약 2-3 cm는 버지니아에 나비 바늘의 고무 끝을 삽입 하 여 진공 컬렉션 튜브에 수집 된 측면 꼬리 정 맥에 삽입 된 cuum 혈액 컬렉션 튜브입니다. 현재 실험 결과 성공률은 실험적인 그룹에서 95%와 90% 초급 그룹에 표시 됩니다. 성공 속도 펑크 번 두 그룹 사이 유사 했다. 샘플링 기간 실험 그룹 초급 그룹에 비해 상당히 짧은 했다. 결론적으로, 비-마 취 쥐의 꼬리 정 맥에서 혈액을 순차적 샘플링에 대 한이 진공 혈액 수집 방법 이며 가능한 쉽게 배우기, 하 수도 역할을 통상 혈액 샘플링 기법을 사용 하는 다른 신뢰할 수 있는 대안 쥐입니다.
서문
쥐에서 혈액 샘플링은 다양 한 실험 연구에 대 한 필요 합니다. 쥐에서 혈액 컬렉션에 대 한 기술은 펑크는 심장의, 복고풍 궤도 총, 경 정 맥, saphenous 정 맥, 꼬리 혈관, 경 동맥, 복 부 대동맥, 베 나 정 맥을 포함 한다. 대부분 기술 (제외 saphenous 정 맥 및 꼬리 혈관 빵 꾸) 마 취1,2필요합니다. 쥐 꼬리의 혈관은 정기적으로 혈액 샘플링 및 혈관 주입 구멍을. 따뜻한 물으로 꼬리, 치료 후 혈관 쥐 마 취3경우에 잘 열려진 조작에 적합 하 고 있습니다.
작은 실험실 동물2에서 혈액 샘플을 얻기 위해 새롭고 향상 된 기술 개발에도 불구 하 고 그것은 항상 쉽게 작은 동물에서 샘플링 하는 경우 충분 한 혈액을 얻을. 쥐의 꼬리 정 맥 혈액 샘플링4우수한 위치 이다. 그러나, 꼬리 정 맥은 얇은, 따라서 가끔 펑크 하드 이며 그것의 낮은 혈액 흐름으로 인해 충분 한 혈액을 얻을 하는 데 시간이 오래 걸릴 것 이라고. 혈액 컬렉션 튜브 진공 추출 시스템을 통해 매일 임상 연습에서 전형적인 방법은. 이 닫힌된 시스템 피 수집에 대 한 혈액에 직접 노출의 위험을 감소 하 고 단일 venipuncture5에서 여러 개의 샘플을 쉽게 했다. 현재 보고서에는 비 취 쥐 진공 추출 튜브 시스템을 사용 하 여 간단한 꼬리 정 맥 혈액 샘플링 방법을 설명 합니다. 이 방법은 쉽게 마스터 하 고 쥐에서 반복적으로 혈액의 큰 볼륨을 가져오는 데 사용할 수 있습니다.
프로토콜
모든 절차는 동물 관리 위원회의 Huazhong 대학의 과학 및 기술 (중국 우한)에 Tongji 의학 대학 위원회에 의해 승인 되었다. 원고는 도착에 따르면 준비 했다 (동물 연구: Vivo에서 실험의 보고) 지침6.
1입니다. 축산
- Sprague-Dawley (SD) 쥐를 사용 하 여 (n = 20, 10 남성 8 주 오래 된, 261 291 g 무게 의미 = 272.85 ±9.07 g) 소의 실험 동물 센터 과학 기술 대학에서 관리 및 활용에 대 한 가이드에 따라 쥐를 유지 하 고 실험실 동물은 미국 국립 보건원 (NIH 간행물 링 돤 85 호-23, 개정 1996)에 의해 게시
- 식품 및 식 수와 표준 조건 하에서 집. 계속 쥐 나무-면도 530 cm2 장에 침구. 각 감 금 소에 두 쥐 집. (마이크로 격리 또는 통풍이 caging) 룸 환경에 모든 새 장 열어
- 실험 프로토콜에 관련 된 직원은 정기적으로 쥐를 처리할 확인 하십시오.
- 21 ° C와 23 ° C 사이 실내 온도 유지 요금 일반 소금 다이어트 줄 (0.3 %NaCl) 연구를 통해.
2. 혈액 수집 절차
참고: 진공 혈액 수집 시스템 및 구성 됩니다 이중 지적 바늘 [22 G (0.7 m m x 25 m m)], 플라스틱 홀더, 고무 마 개 (그림 1)와 진공 튜브 (2 mL)의 시리즈.
- 플라스틱 금지 홀더에 쥐를 놓고 어떤 보이는 흙 이나 배설물을 제거 하려면 따뜻한 (20-30 ° C) 물으로 꼬리를 세척 합니다. 보조 확장된 위치에 꼬리를 보유 하면서 70% 에탄올, 꼬리를 닦 고 취소 정 맥을 거 즈로 청소.
- 위치에서 측면 꼬리 정 맥 (약 5mm) 중 하나에 22 G 나비 바늘 팁을 삽입 (그림 2) 약 20 °의 각도에서 꼬리의 끝에서 약 2-3 cm. 진공 혈액 컬렉션 튜브 (그림 3)에 나비 바늘의 고무 끝을 삽입 하 여 진공 컬렉션 튜브에 혈액을 수집 합니다.
참고: 최대 컬렉션 혈액 볼륨 1.2 mL7입니다. - 혈액 수집 후 바늘을 제거 하 고 부드럽게 혈액의 흐름을 중지 하려면 15-30 s 거 즈와 펑크 사이트에 압력을 적용 합니다. 그런 다음, 플라스틱 금지 홀더에서 쥐를 놓고 그것의 감 금 소에는 쥐를 반환.
- 항 응고 제를 수집 혈장으로 EDTA를 포함 하는 튜브를 사용 합니다. 부드럽게 반전 튜브 여러 번 혈액 응고 제를 혼합 하 여 얼음 샘플을 수직으로 배치.
- 혈액 샘플 컬렉션 튜브 플라스마 또는 혈 청을 10 분 2000 x g에서 냉장된 원심 분리기에 원심
- 혈장/혈 청, 빨간색과 흰색 혈액 세포 층을 방해 하지 않도록 주의 복용의 압축을 풉니다. 혈액 혈 청 수집, 응고 제 없이 튜브를 사용 합니다. 두 가지 유형의 샘플 즉시 사용할 하거나 최대 1 년-80 ° C에 저장 될 수 있습니다.
참고: 성공적인 혈액 컬렉션 때마다 1.2 mL 혈액을 얻기로 정의 했다. 최대 펑크 시간 설정 3 재판에 전체 혈액 볼륨 세 번째 찔린 후 1.2 mL 보다 낮은 경우 정의 된 실패 한 혈액 컬렉션으로. 샘플링 기간 꼬리 정 맥 빵 꾸에서 혈 후 나비 바늘의 제거를 시작합니다. -
2 주7이내 두 번 피를 수집 합니다.
- 테스트 하 고이 방법의 타당성을 확인,이 혈액 컬렉션 프로토콜을 수행 하기 전에 두 학생 (초보자) 2 h에 대 한 훈련. 20 쥐를 사용 하 고 2 경험 있는 사람들 (실험 그룹)에 의해 10 쥐에서 그리고 2 의료 학생 들 (초급 그룹) 10 쥐에서 혈액을 그립니다.
3. 통계 분석
- 평균값이 ± 표준 편차로 데이터 및 SPSS 통계 17 분석. Α 값이 0.05 선정 되었다, 따라서 p < 0.05 통계적으로 중요 하 게 고려 되었다.
결과
샘플링 기간, 몸 질량, 및 두 그룹의 혈액 컬렉션 볼륨
혈액은 각 그룹에서 2 주 이내에 두 번 10 쥐 (5 남성)에서 수집 되었다. 두 그룹의 평균 몸 질량 유사 했다 (272.00 ±9.66 g와 273.70 ±8.87 g). 실험 그룹 초급 그룹에 비해 상당히 짧은 했다 샘플링 기간 (3.28 ±0.83 분, p 대 2.77 ±0.53 분 < 0.05) (표 1).
성공 속도 두 그룹의 펑크
성공률은 실험적인 그룹에서 95% (19/20) 및 초보자 그룹에서 90% (18/20) (p > 0.05). 펑크 시간 두 그룹 사이 크게 다른 되지 않았습니다 (1.50 ±0.61 분 대 1.85 ± 0.75 분, p > 0.05) (표 2). 이 결과이 방법은 쉽게 배울 수 이며 기술 2 h에 대 한 훈련 후 마스터 수 나타냅니다.
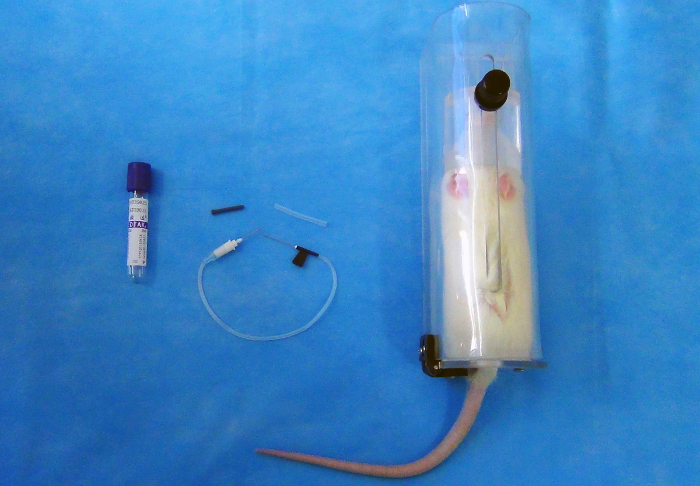
그림 1 : 2 mL 진공 혈액 컬렉션 튜브 (왼쪽), 22 G 나비 바늘 (센터), 플라스틱 금지 홀더 (오른쪽). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 : 바늘 팁 측면 꼬리 정 맥 (약 5 m m)에 위치에서 삽입 된 대략 20 °의 각도에서 꼬리의 끝에서 약 2-3 cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 : 성공적인 venipuncture. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 실험 그룹 | 초급 그룹 | |||||||||
| 성별 | 몸 무게 (g) | 수집 된 혈액 양 (mL) | 샘플링 기간 (분) | 성별 | 몸 무게 (g) | 수집 된 혈액 양 (mL) | 샘플링 기간 (분) | |||
| E1-1 | 남성 | 291 | 1.2 | 3.12 | B1-1 | 남성 | 282 | 1.2 | 3.18 | |
| E1-2 | 남성 | 291 | 1.2 | 2.73 | B1-2 | 남성 | 282 | 1.2 | 2.18 | |
| E2-1 | 남성 | 276 | 1.2 | 2.3 | B2-1 | 남성 | 264 | 1.2 | 3.73 | |
| E2-2 | 남성 | 276 | 1.2 | 2.37 | B2-2 | 남성 | 264 | 1.2 | 2.47 | |
| E3-1 | 남성 | 267 | 1.2 | 2.73 | B 3-1 | 남성 | 265 | 1.2 | 3.52 | |
| E3-2 | 남성 | 267 | 1.0 | 3.88 | B3-2 | 남성 | 265 | 1.2 | 2.53 | |
| E4-1 | 남성 | 263 | 1.2 | 2.41 | B4-1 | 남성 | 289 | 1.2 | 2.32 | |
| E4-2 | 남성 | 263 | 1.2 | 2.52 | B4-2 | 남성 | 289 | 1.2 | 3.62 | |
| E5-1 | 남성 | 265 | 1.2 | 3.61 | B5-1 | 남성 | 277 | 1.2 | 3.48 | |
| E5-2 | 남성 | 265 | 1.2 | 2.42 | B5-2 | 남성 | 277 | 1.2 | 3.12 | |
| E6-1 | 여성 | 285 | 1.2 | 3.33 | B6-1 | 여성 | 274 | 0.9 | 4.87 | |
| E6-2 | 여성 | 285 | 1.2 | 3.03 | B 6-2 | 여성 | 274 | 1.2 | 3.37 | |
| E7-1 | 여성 | 271 | 1.2 | 2.82 | B7-1 | 여성 | 268 | 1.0 | 3.93 | |
| E7-2 | 여성 | 271 | 1.2 | 2.42 | B7-2 | 여성 | 268 | 1.2 | 3.82 | |
| E8-1 | 여성 | 268 | 1.2 | 1.93 | B8-1 | 여성 | 262 | 1.2 | 2.07 | |
| E8-2 | 여성 | 268 | 1.2 | 3.05 | B8-2 | 여성 | 262 | 1.2 | 3.67 | |
| E9-1 | 여성 | 273 | 1.2 | 2.52 | B9-1 | 여성 | 281 | 1.2 | 4.38 | |
| E9-2 | 여성 | 273 | 1.2 | 3.17 | B9-2 | 여성 | 281 | 1.2 | 4.57 | |
| E 10-1 | 여성 | 261 | 1.2 | 1.82 | B10-1 | 여성 | 275 | 1.2 | 2.53 | |
| E10-2 | 여성 | 261 | 1.2 | 3.25 | B10-2 | 여성 | 275 | 1.2 | 2.28 | |
| 평균 | 2.77 | 3.28 | ||||||||
| 엉-1: 첫 번째 혈액 컬렉션에 대 한 실험적인 그룹에 있는 쥐의 일련 번호입니다. | ||||||||||
| 엉-2: 두 번째 혈액 컬렉션에 대 한 실험적인 그룹에 있는 쥐의 일련 번호입니다. | ||||||||||
| Bn-1: 첫 번째 혈액 컬렉션에 대 한 초보자 그룹에서 쥐의 일련 번호입니다. | ||||||||||
| Bn-2: 두 번째 혈액 컬렉션에 대 한 초보자 그룹에서 쥐의 일련 번호입니다. | ||||||||||
표 1: 혈액의 결과 실험적인 그룹 초급 그룹에 수집.
| 혈액 컬렉션 시간 | 평균 펑크 시간 | 한 번 빵 꾸 | 두 번 펑크 | 세 번 펑크 | 실패 | 성공률 | |
| 실험 그룹 | 20 | 1.50 ±0.61 | 11 | 8 | 0 | 1 | 95% |
| 초급 그룹 | 20 | 1.85 ± 0.75 | 7 | 9 | 2 | 2 | 90% |
| 한 번 빵 꾸: 첫 번째 찔린 후 성공적인 혈액 컬렉션 쥐의 수 | |||||||
| 두 번 펑크: 성공적인 혈액 컬렉션 두 번째 펑크 후 쥐의 수 | |||||||
| 세 번 펑크: 성공적인 혈액 컬렉션 3 찔린 후 쥐의 수 | |||||||
| 실패: 실패 한 혈 세 번째 찔린 후 쥐와 수 | |||||||
표 2: 펑크 시간과 초보자 그룹과 실험 그룹의 성공률의 비교.
토론
현재 보고서 쥐에서 배우기 쉬운 혈액 수집 방법을 설명합니다. 우리의 결과이 방법은 쥐에서 반복적으로 많은 양의 혈액을 수집에 대 한 가능을 보여주었다. 또한,이 방법은 단기 학습 곡선와 함께 쉽게 마스터 수 수 있습니다. 이 절차는 비 취 쥐에서 수행할 수 있습니다 고만 동물에 되도록 최소한의 스트레스.
혈액은 다양 한 위치에서 쥐에서 수집할 수 있습니다. 꼬리 정 맥 혈액 샘플링4우수한 위치 이다. 그러나, 그것은 항상 쉽지 않다를 쥐의 얇고 낮은 혈액 흐름 꼬리 정 맥에서 충분 한 혈액 볼륨. 진공 혈액 수집 시스템으로 매일 임상 연습에 있는 환자에서 혈액 샘플을 수집 하기 위해 사용 됩니다. 이 진공 혈액 수집 시스템은 오랜 시간8,,910에 대 한 환자와 연구 동물에서 사용 되었습니다. 실리콘 코팅된 내부 관 벽과 나비 바늘 진공 혈액 컬렉션 튜브가이 시스템에 의하여 이루어져 있었다. 그것은 진공 부정 압력 원리에 근거 했다 하 고 또한 오염 및 용 혈11의 기회를 감소 시키는 혈액 수집의 위험 없이 혈액의 연속 그림을 수 있습니다. 카 테 터에서 혈액 샘플의 볼륨은 약 0.3 mL. 꼬리 정 맥에서 바늘을 철수, 후 카 테 터에 차단 혈액 수집 진공 튜브 진공 때문에 흐름 것입니다. 이 메서드는 또한 작은 바늘 바늘의 사용 미만 100 g 무게 쥐에서 혈액을 수집 적용 됩니다.
이 혈액 수집 방법에는 여러 가지 장점이 있습니다. 이 절차만 되도록 최소한의 부상 쥐 혈 마 취약의 사용 없이 실행 될 수 있다, 따라서 혈액 샘플에는 스트레스 반응 및 마 취약의 영향을 피할 수 있습니다. 우리의 관측 보여주었다 쥐 절차 동안에 플라스틱 금지 홀더 조용 했다 고이 실험 동안 아무 죽음이 있었다. 둘째, 모든 하나는 혈액 컬렉션을 반복 또는 이틀 가능, 다양 한 연구 목적에 대 한 적절 한 볼륨으로 혈액의 자주 샘플링 수 있습니다. 마지막으로,이 메서드는 쉽게 배울 수 이며 쉽게 지배 되었다 초보자가 짧은 (2 시간) 학습 기간 후,이 보고서에서 실험 및 초급 그룹 사이 펑크 시간과 비슷한 성공률에 표시 된 대로. 이전 보고서에서 리 외. 쥐4의 측면 꼬리 정 맥에서 혈액 샘플링의 유사한 방법 설명. 우리의 방법은 보고 리 외 보다 간단 4 우리가 직접 삽입 바늘 바늘 꼬리 정 맥 그리고 튜브의 다른 쪽 끝에 직접 연결 되어 여분의 주사기의 사용과 혈액의 수동 포부 없이 고의 필요 없이 혈액을 수집 하기 위한 진공 튜브 ' 우유 ing' 혈액 흐름을 촉진 하기 위하여 정 맥. 이 닫힌 시스템 피를 수집 혈액 오염의 위험을 줄여줍니다. 플라스틱 금지 소유자의 사용 또한 쥐에는 스트레스를 감소 하 고 꼬리의 고정을 용이 하 게.
다음 두 단계는이 방법의 성공적인 응용 프로그램에 대 한 중요 합니다. 1) 꼬리 고 꼬리;의 움직임을 방지 2) 천천히 정 맥을 정 맥을 통해 펑크를 피하기 위해 정 맥에 바늘 바늘을 계속 20 °의 각도에서 찔린 합니다.
결론적으로, 쥐에서 채택 된 진공 혈액 수집 방법, 가능 하 고, 안전 하 고 쉽게 연습입니다. 이 메서드는 적절 한 혈액 볼륨 비 취 쥐에서 얻은 혈액의 자주 샘플링을 수 있습니다.
공개
저자 공개할 게 없다
감사의 말
저자 게 아무 승인 있다.
자료
| Name | Company | Catalog Number | Comments |
| a double-pointed needle | Shanghai Kang Nong medical instrument co., LTD, China | 22G | (0.7×25mm) |
| vacuum tubes | Wuhan Zhi Yuan, medical science and technology co., LTD, China | 2 ml | |
| rat restraining holder | Shanghai Kang Nong medical instrument co., LTD, China | 250g rat hoder model | |
| normal salt diet for rats | Rats received a normal salt diet (0.3% NaCl) throughout the study | ||
| SPSS software for statistical analysis | SPSS Inc, Chicago; USA | Version 17.0. |
참고문헌
- Brown, C. Blood collection from the tail of a rat. Lab Anim (NY). 35 (8), 24-25 (2006).
- Parasuraman, S., Raveendran, R., Kesavan, R. Blood sample collection in small laboratory animals. J Pharmacol Pharmacother. 1 (2), 87-93 (2010).
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: a histological re-examination with respect to blood vessel puncture methods. Lab Anim. 37 (2), 121-125 (2003).
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. J. Vis. Exp. (99), (2015).
- . . WHO Guidelines on Drawing Blood: Best Practices in Phlebotomy WHO Guidelines Approved by the Guidelines Review Committee. , (2010).
- Kilkenny, C., Altman, D. G. Improving bioscience research reporting: ARRIVE-ing at a solution. Lab Anim. 44 (4), 377-378 (2010).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Eder, J. M., Cutter, G. R. A new device for collecting cord blood. Obstet Gynecol. 86 (5), 850-852 (1995).
- Reynolds, B. S., et al. Comparison of a new device for blood sampling in cats with a vacuum tube collection system - plasma biochemistry, haematology and practical usage assessment. J Feline Med Surg. 9 (5), 382-386 (2007).
- Wiwanitkit, V. Comparison of blood specimens from plain and gel vacuum blood collection tubes. J Med Assoc Thai. 84 (5), 723-726 (2001).
- Wollowitz, A., Bijur, P. E., Esses, D., John Gallagher, E. Use of butterfly needles to draw blood is independently associated with marked reduction in hemolysis compared to intravenous catheter. Acad Emerg Med. 20 (11), 1151-1155 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유