Method Article
Способ идентификации низкомолекулярных соединений ингибиторов белок-белкового взаимодействия между HCN1 и TRIP8b
* Эти авторы внесли равный вклад
В этой статье
Резюме
Взаимодействие между HCN каналов и их вспомогательной субъединицей был идентифицирован как мишень терапевтического воздействия большого депрессивного расстройства. Здесь, метод поляризации на основе флуоресценции для идентификации низкомолекулярные ингибиторы этого белок-белкового взаимодействия, представлен.
Аннотация
Гиперполяризации активированные циклическими нуклеотидами селекцией каналов (HCN) выражаются повсеместно по всему мозгу, где они функционируют, чтобы регулировать возбудимость нейронов. Внутриклеточное распределение этих каналов в пирамидальных нейронов гиппокампа CA1 области регулируется tetratricopeptide повтора содержащих Rab8b белок, взаимодействующий (TRIP8b), вспомогательной субъединицей. Генетическая выбивание HCN порообразующего субъединиц или TRIP8b, оба ведут к увеличению антидепрессант-подобного поведения, предполагая, что ограничение функции каналов HCN может быть полезным в качестве средства для лечения большого депрессивного расстройства (MDD). Несмотря на значительный терапевтический интерес, HCN каналы также выражены в сердце, где они регулируют ритмичность. Для того, чтобы обойти вне цели вопросы, связанные с блокированием каналы сердца HCN, в нашей лаборатории недавно предложил нацеливание на белок-белкового взаимодействия между HCN и TRIP8b для того, чтобы специально нарушить функцию канала HCN в головном мозге.TRIP8b связывается с HCN порообразующего субъединиц на двух различных участках взаимодействия, хотя и здесь основное внимание уделяется взаимодействию между tetratricopeptide повтор (TPR) областях TRIP8b и терминального хвоста С HCN1. В этом протоколе, расширенное описание метода для очистки TRIP8b и выполнения высокой пропускной способности экрана, чтобы идентифицировать низкомолекулярные ингибиторы взаимодействия между HCN и TRIP8b, описан. Метод высокопроизводительного скрининга использует дл пол ризации флуоресценции (FP) основе анализа для мониторинга связывания большого фрагмента TRIP8b к флуорофора меченных одиннадцати аминокислот пептид, соответствующий концевой хвост HCN1 C. Этот метод позволяет "хит" соединения, которые будут определены на основе изменения поляризации излучаемого света. Validation анализы затем выполнены, чтобы гарантировать, что "хит" соединения не являются артефактом.
Введение
Гиперполяризации активированный циклических нуклеотидов закрытого канала (HCN) выражаются в сердце и центральной нервной системы , где они играют важную роль в регуляции мембранной возбудимости 1. HCN каналы участвуют в патогенезе большого депрессивного расстройства (MDD) 2, что привело несколько групп , чтобы предложить , что ограничение HCN функционального канала представляет собой фармакологически может быть эффективным в качестве нового лечения MDD 3. Тем не менее, непосредственно ориентации HCN каналов не является жизнеспособным из - за их важную роль в сердечной потенциала действия 4. Ивабрадин, единственный FDA одобрил антагонист канала HCN, используется для лечения сердечной недостаточности , чтобы произвести брадикардией эффект 5. Таким образом, существует потребность в фармакологическими агентами, которые ограничивают функцию канала HCN исключительно в центральной нервной системе.
Tetratricopeptide повторить содержащих Rab8b взаимодействующий белок (TRIP8b) является SPECI мозгаFIC вспомогательной субъединицей HCN каналов , которые контролирует экспрессию поверхности и локализации HCN каналов 6,7. Генетический нокаут TRIP8b приводит к уменьшению мозга HCN каналов 7 , не затрагивая экспрессию HCN в сердце 8. Интересно, что TRIP8b нокаутные мыши проводят меньше времени неподвижности на принудительного плавания задачи и хвост подвески задачи 7, два наиболее часто используемых скрининговых тестов для антидепрессивной эффективности 9-11. Эти результаты свидетельствуют о том, что вместо того, чтобы непосредственно ориентации HCN каналов с малой молекулы антагониста функции канала ГКН, нарушая взаимодействие между TRIP8b и HCN, может быть достаточным для получения антидепрессантом типа поведения.
TRIP8b связывается с HCN в двух различных участков связывания. Циклический нуклеотид связывающий домен (CNBD) ГКН взаимодействует с сохраняющимся доменом TRIP8b расположенного N терминала к TPR доменов TRIP8b 12,13. Хотя остатков CNBD, которые участвуют в этомвзаимодействие были отображены 14, область TRIP8b , который вовлечен не был сужен за пределы фрагмента 13-кислоты с 80-амино. Второе взаимодействие происходит между tetratricopeptide повтора (TPR) областях TRIP8b и терминала трипептида C ГКН ( 'SNL' в HCN1, HCN2 и HCN4, но «АОД» в HCN3) 3,12. Недавно решена кристаллическая структура 15 этого C хвоста взаимодействия выявлено существенное структурное сходство с взаимодействием между пероксисомальной рецептором импорта, peroxin 5 (PEX5), и его взаимодействие партнеров, содержащие типа 1 пероксисом таргетинга последовательности (PTS1) 16.
Хотя оба сайта взаимодействия необходимы для функционального канала, HCN, взаимодействие между ТПВ доменами TRIP8b и терминалом трипептид С HCN1 служит в качестве сайта связывания доминантного и регулирует поверхностную экспрессию HCN. Таким образом, это взаимодействие было выбрано в качестве места прицеливания в данном исследовании.В течение оставшейся части рукописи, когда делается ссылка на взаимодействие между TRIP8b и HCN, то это взаимодействие, которое идет речь. Это взаимодействие с помощью воспроизводятся высоко растворимого фрагмента TRIP8b , соответствующей его законсервированной терминалу C , содержащего TPR домены , необходимые для связывания концевой хвост С HCN (остатки 241-602 1а-4 изоформ TRIP8b) 3.
Для разработки высокой пропускной способности экрана , чтобы идентифицировать малые молекулы , способные нарушить это взаимодействие, поляризация флуоресценции (FP) основе анализа использовали 17. Флуоресцентная поляризация основана на возбуждении флуорофора-меченый лиганд с поляризованным светом, и измерения степени поляризации излучаемого флуоресценции 18. В присутствии связывающего партнера, вращательное движение флуоресцентного лиганда ограничена и поляризованный свет излучается 19. При отсутствии обязательного партнера, тон вращательное движение лиганда приводит к излучению деполяризованного света.
В прилагаемом протоколе, способ очистки N-концевой помечаются (6xHis) TRIP8b (241-602) с использованием никель-нитрилтриуксусная кислоты (Ni-NTA) бусинки представлено. Аналогичный протокол был использован для очистки глутатион-S-трансферазы (GST) , -tagged С терминальные 40 аминокислот HCN1 (HCN1 C40) , используемый на шаге 7 протокола. Для космических соображений, подробное описание этой процедуры было опущено.
На этапах 2 -й по 7 - протокола, скрининговое рабочий процесс с высокой пропускной способностью представлен (см рисунок 1). Белок-белковые взаимодействия являются крайне сложно мишенью для высокопроизводительного скрининга и читателям рекомендуется искать дополнительные ресурсы по этой теме 20.
Шаги 2 и 3 процедуры характеризуют сродством в пробирке очищенного TRIP8b (241-602) построить FOра флуоресцеинизотиоцианатом (FITC) -tagged одиннадцать аминокислот пептид , соответствующий концевой хвост С HCN1 (HCN1 FITC). На основе кристаллической структуры TRIP8b-HCN комплекс 15, этот сегмент одиннадцать аминокислоты является достаточным для получения связывания с TRIP8b (241-602). На этапе 2, K d взаимодействия измеряется титрованием TRIP8b (241-602) в фиксированной концентрации HCN1 FITC. На шаге 3, непомеченная версия пептида HCN , используемого на стадии 2 титруют в фиксированной концентрации обоих TRIP8b (241-602) и HCN1 FITC изучить , если тег FITC препятствует связыванию. Эти эксперименты имеют важное значение для выбора соответствующих концентраций TRIP8b (241-602) и HCN1 FITC , используемые в высокой пропускной способности экрана.
Помещение экрана с высокой пропускной способностью является то , что небольшая молекула , способная привести к нарушению взаимодействия между TRIP8b (241-602) и HCN1 FITC произведет разлrease в поляризованном свете. На шаге 4, коэффициент Z из анализа вычисляется 21 для заданной концентрации TRIP8b (241-602) и HCN1 FITC , чтобы гарантировать , что анализ подходит для высокопроизводительного скрининга (этап 5). Шаги 6 и 7 тесты проверки для подтверждения того, что хиты , определенные в высокой пропускной способности первичного скрининга действуют путем нарушения взаимодействия между TRIP8b (241-602) и HCN1 FITC , а не через неспецифического механизма. На этапе 6, carboxytetramethylrhodamine (TAMRA) меченных HCN1 пептид (HCN1 Tamra) используется в идентичной в остальном анализе поляризации флуоресценции для фильтрации флуоресцентные соединения , которые ставят под угрозу анализа FP с помощью тега FITC. Шаг 7 использует больший HCN1 C концевой фрагмент (HCN1 C40) и использует бесконтактный анализ бусинки на основе, которая основана на «туннелирования» синглетного кислорода от донора шарика к акцепторной шарика приближены друг с другом взаимодействующих белков 22,
протокол
1. Очистка TRIP8b (241-602) белка
- Transform плазмиду , содержащую TRIP8b (241-602) в бактериальной экспрессии белка вектора pGS21 3 в компетентные E. палочки для экспрессии белка в соответствии с инструкциями изготовителя. Пластина 300 мкл культуры на Лурии Broth (LB) -agar с добавлением 5 мкг / мл хлорамфеникола и ампициллин. Инкубируйте планшет при 37 ° С в течение 16 ч.
- На следующий день, выбрать одну колонию для инокуляции 50 мл LB с 50 мкг / мл хлорамфеникола и ампициллин. Инкубируйте культуру при 37 ° С в течение 16 ч (при встряхивании).
- Добавить 50 мл культуры в 1 л LB с 50 мкг / мл ампициллина. Инкубируют при 37 ° C при встряхивании.
- Как только культура достигла OD 600 чтение 0.8-1.2, изменение температуры инкубатора до 18 ° С и добавляют IPTG (изопропил- бета-D-тиогалактозид) до конечной концентрации 1 мМ. Дают возможность экспрессии белка протекать в течение 16 часов,
- Спин вниз Е. палочка при 6000 мкг в течение 15 мин при 4 ° С для осаждения бактерий. После удаления труб из центрифуги, держать бактерии на льду в течение оставшегося процедуры. Ресуспендируют бактерии в 36 мл буфера А с 0,25 мМ фторида phenylmethanesulfonyl (PMSF).
- Разрушать ультразвуком ресуспензированной бактерии на льду, используя плоский болт в течение 5-10 мин, чередуя 30 сек 'на' и 30 сек "выключено" при высокой мощности.
- Центрифуга при 12000 х г в течение 15 мин при температуре 4 ° С. Центрифуга в течение еще 15 мин, если супернатант пока не ясно.
- Нанесите супернатант в колонку 2 мл Ni-NTA бусинок. Инкубировать в течение 60 мин при температуре 4 ° С при осторожном покачиванием.
- Дайте несвязанный материал, чтобы протекать через колонку и промывают 500 мл буфера A.
- Промыть колонку с 250 мл буфера В.
- Промыть колонку с 125 мл буфера А с добавлением 5 мМ имидазола.
- Элюции белок сюдам колонку с 20 мл буфера для элюции.
- Добавьте элюированного белка в диализной кассеты (молекулярная масса отсечки - 10 кДа) с помощью шприца. Диализировать белка в течение 60 мин в 4 л холодного фосфатно-солевом буферном (PBS) при 4 ° С.
- Перемещение диализный кассету в новый 4 л ведро холодной PBS. Диализировать белка в течение 16 ч при температуре 4 ° С.
- На следующее утро, проверьте концентрацию белка с помощью набора для анализа белка Кумасси, следуя инструкциям производителя. Концентрат белка с помощью белка концентраторы, следуя инструкциям производителя, если наблюдается концентрация ниже 40 мкМ. Аликвоты и замораживают при -80 ° C для хранения.
2. Малый Флуоресценция Поляризация Анализ на Охарактеризовать взаимодействие двух белковых фрагментов
- Оттепель 200 мкл 40 мкМ TRIP8b (241-602) и добавить его в 1,5 мл трубки. Добавляют 100 мкл PBS до 11 дополнительных 1,5 мл пробирки.
- Выполнение серийных разведений путем переноса 100 мкл TRIP8b (241-602) из исходной трубки к следующей трубе в серии, пипетированием вверх и вниз, и повторить процесс. Это произведет серию из 12 пунктов в 2-кратных разведений TRIP8b (241-602) в диапазоне от 0.01-40 мкМ.
- Подготовьте 650 мкл основной смеси 0,1 мкМ HCN1 FITC (6,5 мкл 10 мкМ аликвоты) и 2 мМ дитиотреитола (DTT) в PBS.
Примечание: Мастер микс 2x. - Установка 12 новых 1,5 мл трубки. Добавьте 50 мкл мастер - смеси , содержащей HCN1 FITC в каждую пробирку, а затем добавляют 50 мкл из каждого из 12 последовательных разведений.
Примечание: Это будет генерировать 12 пробирок, каждая из которых содержит 0,05 мкМ HCN1 FITC и половину концентрации TRIP8b (241-602) из первоначального серийного разведения. - Добавим серию разбавления на планшете для анализа, 30 мкл на лунку в трех экземплярах. Используйте низким связыванием твердый черный 384-луночный планшет.
- Спин пластины пили 2 мин при 900 х г при комнатной температуре.
- Прочитайте пластину с помощью микропланшет-ридера, следуя инструкциям производителя. Измерение поляризации флуоресценции с использованием следующих параметров измерения: 485 нм возбуждение, 530 нм, излучение 505 нм дихроичным зеркалом, 100 мс время интегрирования.
- Участок значения поляризации (Мр) по сравнению с TRIP8b (241-602) концентрации по логарифмической шкале. Установить данные с уравнением Хилла для определения аффинности (K D) из TRIP8b (241-602) для меченого HCN1 пептида.
Примечание: для приготовления серийных разведений, многоскважинных номерного знака, также может быть использован вместо трубок.
3. Изучить белок-белковое взаимодействие с помощью положительного контроля
- Добавить 200 мкл немеченого HCN1 пептида (200 мкМ) в 1,5 мл трубки. Добавляют 100 мкл PBS до 11 дополнительных 1,5 мл пробирки. Выполнение серийных разведений путем переноса 100 мкл из пробирки, содержащей 200 мкл пептида в первой трубе100 мкл PBS. Повторите процесс для создания 12 трубок с 2-кратными разведениями немеченого HCN1 пептида.
- Подготовьте 650 мкл основной смеси 0,2 мкМ HCN1 FITC и 4 мкМ TRIP8b (241-602).
Примечание: Это решение 2x. - Добавьте 50 мкл основной смеси до 12 новых 1,5 мл пробирки.
- Добавьте 50 мкл каждого серийного разведения в 1,5 мл трубки.
- Загрузите черный 384-луночного планшет в трех экземплярах, добавляя 30 мкл на лунку.
- Центрифуга пластину в течение 2 мин при 900 х г при комнатной температуре.
- Прочитайте пластины с использованием микропланшет-ридера, способного FP. Используйте те же настройки, как описано в пункте 2.7.
- Вычислить сродство немеченого пептида для TRIP8b (241-602) , используя уравнение Cheng-Prusoff: K d 1 = IC 50 / (1 + [L] / K d 2), где K d 1 представляет сродство немеченого пептид для TRIP8b (241-602), IC 50 определяется в предыдущем шагеи представляет собой способность немеченого лиганда , чтобы вытеснять меченый лиганд, [L] означает концентрацию меченого лиганда на стадии 3.2, и K d 2 является сродство TRIPb (241-602) для меченого лиганда.
4. Оценка анализа производительности (Вычислить Z-фактор)
- Подготовка мастер смеси путем 12 мл раствора буфера FP а с 2 мкМ TRIP8b (241-602), 50 нМ HCN1 FITC и 1 мМ DTT в FP буфере.
Примечание: Для этого потребуется 60 мкл 40 мкМ TRIP8b (241-602), 60 мкл 10 мкМ HCN1 FITC и 1,080 мкл буфера FP. - Добавьте 30 мкл мастер смеси в каждую лунку черного 384-луночный планшет для микротитрования.
- Добавить 1 мкл 1 мМ немеченого HCN1 пептида до 192 скважин, чтобы служить в качестве положительного контроля.
- Добавляют 1 мкл буфера FP 192 скважин, чтобы служить в качестве отрицательного контроля.
- Центрифуга пластину в течение 2 мин при 900 х г при комнатной температуре.
- Прочитайте пластины с использованием мильcroplate читатель.
- Рассчитывают коэффициент Z для анализа с использованием следующей формулы: Z = 1 - 3 * (σ поз -σ NEG) / (μ отр -μ поз) , где σ и σ поз NEG являются стандартные отклонения положительных и отрицательных контрольных лунках , а μ и μ поз NEG представляют собой средние сигналы в положительном и отрицательном контрольных лунках.
5. Высокая пропускная способность экрана
- Оттепель аликвот TRIP8b (241-602) и HCN1 FITC и держать их на льду.
- Приготовьте 10 мл TRIP8b (2 мкМ) и HCN1 FITC (50 нМ) в буфере FP.
- 25 мкл смеси в каждую лунку низкого связывания 384-луночный черный планшет с помощью пипетки.
- Для скрининга библиотеки, добавлять соединения в каждую лунку колонок от 3 до 22 (40 мкМ конечная концентрация для каждого) с помощью акустического обработчика жидкость.
Примечание: В связи с relativelY низкий коэффициент совпадений наблюдается при этом анализе, два различных соединения были объединены в одну лунку. Два соединения из каждого активного скважины были впоследствии протестированы индивидуально определить, какие присуждено деятельность. - Добавить 100 нл диметилсульфоксида (ДМСО) в каждую лунку колонок 1 и 23 каждой пластины в качестве отрицательного контроля.
- Добавить непомеченное HCN1 пептида в каждую лунку колонках 2 и 24 каждой пластины в качестве положительного контроля.
- Инкубируйте пластин при комнатной температуре в течение 2 ч. Читайте пластины или инкубировать при температуре 4 ° С в течение 16 ч перед считыванием.
- Измерение поляризации флуоресценции на планшет-ридере. Используйте те же настройки, как описано в пункте 2.7.
- Расчет процента ингибирования путем нормализации сигналов с использованием средних положительных и отрицательных контролей с каждой пластины, принятой за 100%. С помощью уравнения Xn = 100% * ((Х NEG - Х) / (Х NEG - Х поз)) , где Х Н нормализованная процент ингибирования , соответствующий сигналу X, X поз Это среднее значение сигнала от положительных контрольных лунок, и Х NEG является сигналом от отрицательных контрольных лунках.
6. Подтверждение Hits Использование TAMRA-меченый HCN Пептид
- Validate хитов с более чем 50% -ное ингибирование с использованием TAMRA-меченого HCN1 пептид (HCN1 Tamra).
- Подготовка мастер - смесь из 12 мл 2 мкМ TRIP8b (241-602) и 50 нМ HCN1 TAMRA в FP буфере.
- 25 мкл мастер смеси в каждую лунку черного 384-луночный планшет для микротитрования.
- Передача серийные разведения каждого активных соединений в соответствующие лунки. Сделать два раза разведения таким образом, чтобы концентрация каждого удара в диапазоне от 0,2 до 200 мкм.
- Для реакций отрицательный контроль, передача 100 нл ДМСО в каждую лунку. Для положительного контроля добавляют 100 нл серийно разведенного немеченого HCN1 пептида с конечной концентрации в диапазоне от 200 мкм до 0,1 мкм.
- Инкубируйте планшет при комнатной температурев течение 2 часов. Читайте пластины или инкубировать в течение 16 ч при 4 ° C перед чтением.
- Измерение поляризации флуоресценции (Мр) с использованием следующих параметров измерения: 535 нм возбуждение; 580 нм излучение; 535 нм дихроичное зеркало, 20 мс время интегрирования.
- Вычислить 50 значений IC путем подбора концентрации зависимых данных FP каждого соединения с использованием четырех параметров нелинейной модели регрессии 23 а.
7. доза-ответ Проверка бисера на основе Proximity Assay
- Оттепель 1 аликвоты His-меченой TRIP8b (241-602) (His-TRIP8b) и GST-меченого HCN1 (GST- HCN1 C40) слитые белки и держать их на льду.
- Комбинат His-TRIP8b с GST-HCN1 C40 в буфере для анализа при концентрации 400 нМ Его-TRIP8b и 40 нМ GST HCN1 C40. Подготовьте 300 мкл смеси для каждого тестируемого соединения.
Примечание: Соединения выполняются в трех экземплярах при 11 различных концентрациях плюс DMSO контроль (без соединения). - Для получения контрольных лунок, готовят 30 мкл His-TRIP8b (200 нМ) без GST-HCN1C40, а затем по отдельности готовят 30 мкл GST-HCN1C40 (20 нМ) без His-TRIP8b в буфере для анализа.
- Для каждого испытуемое соединение, добавить 7 мкл Его-TRIP8b: смесь GST-HCN1 C40 (полученного на стадии 7.2 выше) до 36 лунок пластины с помощью пипетки 16-канальный. Для тестирования одного соединения, расположить 12 различных концентраций в строках AL и трех повторах в колонках 1-3. Добавить 7 мкл раствора His-TRIP8b (полученного в 7.3) в столбцы 1-3 строки М и 7 мкл раствора GST-HCN1 C40 (полученного в 7.3) к столбцам 1-3 строки N. Кратко центрифугировать пластину обеспечить жидкости находятся в нижней части каждой скважины и для удаления пузырьков воздуха.
- Дозировать хит соединений, тестируемых в пластину таким образом, чтобы концентрация каждого удара в диапазоне от 200 мкМ (строка А) до 0,1 мкм (в строке K). Разлить объемДМСО в строках LN, которая соответствует количество соединения дозированной в рядах АК.
- Встряхните пластину в течение 2 мин и инкубировать в течение 2,5 ч при комнатной температуре.
- Развести анти-GST акцептора шарики 1:50 с буфером для анализа.
- Добавить 3,5 мкл разбавленных акцепторных шариков в каждую лунку планшета с 16-канальной пипетки и перемешать, осторожно пипеткой, чтобы избежать образования пузырьков.
- Инкубируйте планшет в течение 1 ч при комнатной температуре в темноте.
- Развести донора шарики Никель хелата 1:50 с буфером для анализа. Не подвергайте смесь к свету.
- Добавить 3,5 мкл разбавленных доноров шариков в каждую лунку планшета с 16-канальной пипетки и перемешать, осторожно пипеткой, чтобы избежать образования пузырьков.
- Инкубируйте планшет в течение 1,5 ч при комнатной температуре в темноте.
- Читайте на ридере. Используйте планшет-ридера со следующими параметрами измерения: 40 мс возбуждения Время, 100 мс время излучения, 0,1 мм по высоте обнаружения.
- Вычислить 50 значений IC подгонкой данных для EACч соединение с использованием четырех параметров нелинейной модели регрессии 23 а.
Результаты
Для того, чтобы избежать вопросов авторского права с нашей предыдущей публикации, A TAMRA-меченый зонд HCN1 TAMRA был использован для создания рисунках 2 и 3. Обратите внимание , что эта замена не сделал заметную разницу в результатах, и протоколы идентичны тем , которые описаны выше , с HCN1 FITC. Для оценки взаимодействия с HCN1 TAMRA, TRIP8b (241-602) подбирали в фиксированной концентрации HCN1 TAMRA с использованием протокола , описанной в шаге 2 (рисунок 2). Затем эксперимент описано в шаге 3 была выполнена и непомеченная HCN1 пептид титруют в фиксированной концентрации TRIP8b (241-602) и HCN1 TAMRA (рисунок 3).
Для того, чтобы убедиться в том, что анализ был пригоден для высокопроизводительного скрининга, его производительность была рядом рассмотрен протокол в пункте 4; и Z коэффициент 0.89 было получено, что указывает на то , что анализ был готов к высокопроизводительного скрининга (Рисунок 4). Затем, 20000 соединение библиотеки небольшую молекулу подвергают скринингу по методике с процедурой , описанной в пункте 5. Все соединения , которые имеют процент ингибирования выше 50% затем тестировали во втором тесте FP с HCN1 TAMRA (этап 6). И, наконец, подтвержденные хиты были испытаны в анализе борта на основе близости (этап 7, рисунок 5). Одно попадание соединение, NUCC-5953, был идентифицирован в результате этих экспериментов.

Рисунок 1: HTS Workflow Схема , описывающая рабочий процесс для высокопроизводительного скрининга.. Схема переходит от верхней части к нижней части , с каждого треугольника , представляющего собой шаг в протоколе. Пожалуйста , нажмите здесь для просмотраБольшая версия этой фигуры.
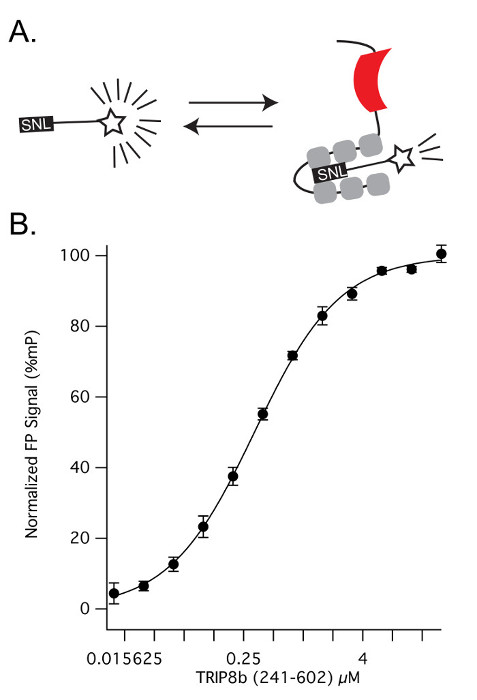
Рис . 2: K d белок-белковое взаимодействие (А) Схематическое изображение эксперимент , описанный в шаге 2. Как TRIP8b (241-602) титруют в фиксированной концентрации HCN1 TAMRA, ТСО домены TRIP8b (серым цветом) связывают к пептидным 11 аминокислоты (в черном цвете, с 'SNL' терминала выделен). (B) Поскольку концентрация TRIP8b (241-602) возрастает, больше молекул HCN1 Tamra становятся связанными и поляризация возрастает (K D = 0.320.01μM). Столбики ошибок обозначают стандартное отклонение. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

На рис . 3: IC 50 положительного контроля (А) Схематическое демонстрирующее экспериментальная парадигма для шага 3. В качестве немеченого пептида HCN1 титруют в фиксированной концентрации TRIP8b (241-602) и HCN1 TAMRA, меченый пептид смещена. (В) Обратите внимание , что сигнал уменьшается по мере концентрации немеченых возрастает HCN1, что указывает на смещение HCN1 TAMRA (IC 50 = 1.070.08μM). Столбики ошибок обозначают стандартное отклонение. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
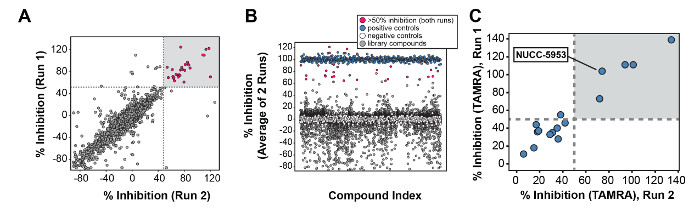
Рис . 4: Представитель Результаты из HTS (A) Результаты от высокой пропускной способности SC Reen осуществляется с использованием протокола, описанной в шаге 5. Каждая точка на графике представляет собой одно соединение. Координаты X и Y определяются процент ингибирования в каждом цикле. (B) Результаты экрана построены с положительным и отрицательным контролем (см условные обозначения). Среднее ингибирование Каждое соединение в процент (по двум прогонов анализа) нанесена на оси Y. (C) Результаты экспериментов FP подтверждающим с использованием TAMRA-меченого HCN1 пептида. Соединения , показывающие более чем 50% -ное ингибирование в шаге 5 были затем использованы на шаге 6. Как и в (А), Х и координаты Y определяются процент ингибирования в два прогона анализа. Воспроизводится Хан и др. 3. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
40 / 54540fig5.jpg "/>
Рис . 5: Шарик на основе анализа близости (А) Схематическое изображение шарика на основе близости анализа. TRIP8b (241-602) содержит N терминал гексагистидиновую тег, который связывает Никель хелата донорские бусинки (круг с полосками). HCN1 C40 содержит N терминал GST тег , который связывает акцепторные шарики. Когда приведен в непосредственной близости от взаимодействия TPR доменов TRIP8b и терминал трипептид С HCN1, возбуждение буртика донора 680 нм свет дает синглетный кислород. Этот синглет передает энергию кислорода на акцепторные шарики в пределах определенного радиуса и приводит к излучению света. (В) Титрование возрастающих концентраций хитовой соединения (NUCC-5953) в фиксированной концентрации TRIP8b (241-602) и HCN1 C40. Воспроизводится Хан и др. 3. Столбики ошибок обозначают стандартное отклонение.целевых = "_blank"> Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Из - за своего потенциала в качестве терапевтической мишени в MDD 24, наблюдается значительный интерес к фармакологическим подходам , которые противодействуют функции канала HCN в центральной нервной системе 4. Тем не менее, эти усилия были тормозится важной роли каналов HCN в сердечной pacemaking и риск аритмии 25. Мы полагали , что нарушая взаимодействие между HCN и его мозга специфической вспомогательной субъединицей, TRIP8b 8, может быть достаточно , чтобы произвести антидепрессант-подобных эффектов , не затрагивая сердечных HCN каналов 3. Эта гипотеза была подкреплена наблюдением , что мыши , лишенные TRIP8b обладают антидепрессантом типа поведения 7. Ориентация на это взаимодействие может стать новая парадигма для лечения депрессивного расстройства.
Подробный протокол для выявления небольших ингибиторов молекулы взаимодействия между TPR доменами TRIP8b и терминала трипептида С HCN1 являетсяпредставленной выше. Для того, чтобы облегчить его общее применение, мы опишем здесь наши рассуждения, которые привели к развитию этого анализа. Хотя TRIP8b связывается с HCN субъединиц в двух местах, мы сосредоточились на взаимодействии между TPR доменами TRIP8b и терминального хвоста C ГКН. Структурный Выяснение этого взаимодействия рентгеновской кристаллографии показал глубокий карман , образованный TPR доменами TRIP8b вокруг терминала C ГКН 15. Второе взаимодействие TRIP8b-HCN происходит между 80 аминокислот участок TRIP8b (расположенной N терминала к TPR доменов) и циклических нуклеотидов связывающего домена ГКН. Это взаимодействие происходит во многих различных аминокислот каждого белка и представляет собой диффузное поверхность с меньшим числом четко определенных межмолекулярных взаимодействий 26. На основе этих структурных наблюдений, как мы полагали, что взаимодействие между ТПВ доменами TRIP8b и клеммой ГКН более восприимчива к разрушению при малой молекулы inhibitor.
Первоначально, больший фрагмент TRIP8b использовали в анализе на основе предположения, что больше конструкция может иметь аллостерические регуляторные участки и повысить шансы на успех. Полная длина TRIP8b первоначально использовался, но этот подход был ограничен агрегации белков, деградации и чувствительности к замораживанию-оттаиванию циклов. Впоследствии два промежуточно размера TRIP8b конструкции, более длинный (остатки 219-602), а также более короткий (остатки 259-602), были испытаны перед промежуточной конструкцией (остатки 241-602) был выбран. Хотя каждый из четырех усечены, описанных выше содержат ТСО домены имеют значение для связывания с терминалом C ГКН, только промежуточный клон длина (241-602) был достаточно стабильным для использования в скрининг-тестах. В частности, мы смогли получить большие количества белка , после очистки с помощью Ni 2+ аффинной хроматографии без дополнительных стадий разделения.
После того, как ChoosИнг подходящий фрагмент TRIP8b и HCN, мы затем определяли аффинность меченого пептида HCN1 для TRIP8b (241-602). Как правило, точное измерение может быть сделано только в случае , если концентрация лиганда значительно ниже K D от партнера по связыванию 28. В нашем случае мы использовали 50 нМ меченого пептида HCN1 для эксперимента на стадии 2, и получил K D из 0.320.01μM. Для получения более экспериментальных конструктивных соображений в отношении белок-белковых взаимодействий, читатели могут обратиться к одному из нескольких превосходных обзоров по этой теме 27-30.
После того, как мы определили K D меченого пептида HCN1 для TRIP8b (241-602), мы тогда определяется , если сама метка препятствует связыванию. На шаге 3, мы получили значение IC 50 из 1.070.08 мкМ титрованием немеченого HCN1 пептида в фиксированной концентрации TRIP8b (241-602) вытеснять меченый пептид. В сочетании с K D из меченый пептид для TRIP8b (241-602), и применяя уравнение Ченга-Прусоффа, мы тогда оценивали сродство немеченого пептида для TRIP8b (241-602) в качестве K D = 0.93μM. Это хорошо согласуется с сродства TRIP8b (241-602) для меченого пептида, и предполагает, что маркировка пептид существенно не влияет на его сродство к TRIP8b. Важной особенностью экрана поляризации флуоресценции на основе является превосходное отношение сигнал-шум, как обозначено Z коэффициент 0,89. С помощью других параметров, то же самое, величина изменения сигнала FP диктуется размером связывающего партнера (TRIP8b (241-602)) и размер флуорофора-меченого лиганда. Изменение поляризации (от 44 до 224 Мр) наблюдали с 11 аминокислотный пептидный лиганд между его свободных и связанных состояний с ~ 42 кДа TRIP8b (241-602) белка достаточно для воспроизведения целевого взаимодействия и обеспечивает достаточный динамический диапазон для скрининга библиотеки.
ntent "> Одна из проблем любого скринингового анализа с высокой пропускной способностью является отличительной истинно" хит "соединений из артефактом изменения интенсивности сигнала. В поляризации флуоресценции на основе экранов, он является общим для многих соединений либо непосредственно взаимодействовать с флуорофором или флуоресцировать на свои собственные. чтобы обойти эти проблемы, процедура скрининга двухступенчатый с использованием двух различных флуорофоров описано выше. Эта процедура снижает вероятность того, что флуоресцентные соединения и соединения, взаимодействующий непосредственно с флуорофором будет продвигаться через процесс скрининга. в дополнение к связывания флуорофора , некоторые соединения действуют как "агрегаторов" в пробирке и привести к неспецифическим изменениям в сигнале поляризации флуоресценции. Эти соединения , как полагают, образуют моюще-чувствительные мицеллярных структур и ингибировать белок-белковых взаимодействий 31,32. для уменьшения этих эффектов, важно что буфер поляризации флуоресценции использовали в высокихПропускная способность протокола скрининга описано выше включает в себя моющее средство (Triton), хотя дополнительная проверка с другими моющими средствами следует рассматривать.Следует отметить, что существует несколько важных ограничений процедуры скрининга, описанной выше. Хотя TRIP8b связывается с HCN в двух местах, на экране было описано выше рассматривается только один сайт взаимодействия и не будет идентифицировать малые молекулы, нацеленные на взаимодействие CNBD. Аналогичным образом, соединения, которые модулируют аллостерически TRIP8b связывание с HCN путем взаимодействия с TRIP8b в концевой области N не будет идентифицирован как хиты. Оба эти соображения являются результатом использования меньшего фрагмента TRIP8b (смотри выше), что обеспечивает воспроизводимость в скрининг-тестах, описанных в процедуре. Для того чтобы избежать этих ограничений, будущие усилия могут быть направлены на использование экрана ячейкой на основе учета полной длины HCN и TRIP8b конструирует 33,34. Этот вид экрана может рассчитывать на высокую тhroughput электрофизиологические методы с целью идентификации соединений, способных привести к нарушению взаимодействия между HCN и TRIP8b, а также ограничение экспрессии каналов HCN на поверхности клетки. Следует отметить, что такие подходы, как они должны были бы включать в себя встречные экраны , чтобы гарантировать , что малые молекулы не были непосредственно ограничивая функцию канала HCN в качестве антагонистов, так как это может привести к слишком поторопился эффектов в естественных условиях.
Хотя HCN1, HCN2 и HCN4 все имеют законсервированный С-концевой пептид 'SNL', остатки N терминалов к этому трипептида существенно различаются и, вероятно, влияют на сродство связывания TRIP8b. Это повышает вероятность того, что небольшая молекула хит, полученный экран или разработанный на основе других хитовых соединений может обеспечить HCN изоформы специфичность в срыве взаимодействие TRIP8b-HCN. В исходном экране, NUCC-5953 был идентифицирован как первый небольшой молекулы , способной привести к нарушению взаимодействия между TRIP8b и HCN1 3. будущее УНРк с этого анализа может выявить дополнительные низкомолекулярные ингибиторы с желаемыми химическими свойствами для разработки лекарственных средств.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by National Institutes of Health Grant R21MH104471 and R01MH106511 (D.M.C.), Brain Research Foundation SG 2012-01 (D.M.C.), Northwestern University Clinical and Translational Sciences Institute 8UL1TR000150 (Y.H.), Chicago Biomedical Consortium HTS-004 (Y.H. and D.M.C.), and National Institutes of Health Grant 2T32MH067564 (K.L.). A part of this work was performed by the Northwestern University Medicinal and Synthetic Chemistry Core (ChemCore) at the Center for Molecular Innovation and Drug Discovery (CMIDD), which is funded by the Chicago Biomedical Consortium with support from the Searle Funds at the Chicago Community Trust and Cancer Center Support Grant P30 CA060553 from the National Cancer Institute awarded to the Robert H. Lurie Comprehensive Cancer Center. The high throughput screen work was performed in the High Throughput Analysis Laboratory which is also a core facility of the Robert H. Lurie Comprehensive Cancer Center.
Материалы
| Name | Company | Catalog Number | Comments |
| Ni-NTA agarose | Qiagen | 30210 | |
| Dialysis cassette | ThermoFisher | 66456 | |
| Isopropyl b-D-1-thiogalactopyranoside | Sigma-Aldrich | I5502 - 1 gr | |
| 384-Well Black plate | Corning | 3820 | |
| Proxiplate | Perkin-Elmer | 6008289 | |
| Anti-GST Acceptor beads | Perkin-Elmer | 6760603C | |
| NiChelate | Perkin-Elmer | AS101D | |
| pGS21-a | Genscript | SD0121 | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Coomassie Kit | ThermoFisher | 23200 | |
| Protein concentrator | ThermoFisher | 88527 | |
| Perkin Elmer Enspire Multimode Plate reader | Perkin-Elmer | #2300-001M | |
| BL21 (DE3) Competent Cells | Agilent | 200131 |
Ссылки
- Biel, M., Wahl-Schott, C., Michalakis, S., Zong, X. Hyperpolarization-activated cation channels: from genes to function. Physiol Rev. 89 (3), 847-885 (2009).
- Shah, M. M. HCN1 channels: a new therapeutic target for depressive disorders?. Sci Signal. 5 (244), pe44 (2012).
- Han, Y., et al. Identification of Small-Molecule Inhibitors of Hyperpolarization-Activated Cyclic Nucleotide-Gated Channels. J Biomol Screen. 20 (9), 1124-1131 (2015).
- Postea, O., Biel, M. Exploring HCN channels as novel drug targets. Nat Rev Drug Discov. 10 (12), (2011).
- Stieber, J., Wieland, K., Stöckl, G., Ludwig, A., Hofmann, F. Bradycardic and proarrhythmic properties of sinus node inhibitors. Mol Pharmacol. 69 (4), 1328-1337 (2006).
- Santoro, B., Wainger, B. J., Siegelbaum, S. A. Regulation of HCN channel surface expression by a novel C-terminal protein-protein interaction. J Neurosci. 24 (47), 10750-10762 (2004).
- Lewis, A. S., et al. Deletion of the hyperpolarization-activated cyclic nucleotide-gated channel auxiliary subunit TRIP8b impairs hippocampal Ih localization and function and promotes antidepressant behavior in mice. J Neurosci. 31 (20), 7424-7440 (2011).
- Heuermann, R. J., et al. Reduction of thalamic and cortical Ih by deletion of TRIP8b produces a mouse model of human absence epilepsy. Neurobiol Dis. 85, 81-92 (2016).
- Steru, L., Chermat, R., Thierry, B., Simon, P. The tail suspension test: A new method for screening antidepressants in mice. Psychopharmacology. 85 (3), 367-370 (1985).
- Petit-Demouliere, B., Chenu, F., Bourin, M. Forced swimming test in mice: a review of antidepressant activity. Psychopharmacology. 177 (3), 245-255 (2004).
- Cryan, J. F., Mombereau, C., Vassout, A. The tail suspension test as a model for assessing antidepressant activity: Review of pharmacological and genetic studies in mice. Neurosci Biobehav Rev. 29 (4-5), 571-625 (2005).
- Han, Y., et al. Trafficking and gating of hyperpolarization-activated cyclic nucleotide-gated channels are regulated by interaction with tetratricopeptide repeat-containing Rab8b-interacting protein (TRIP8b) and cyclic AMP at distinct sites. J Biol Chem. 286 (23), 20823-20834 (2011).
- Hu, L., Santoro, B., Saponaro, A., Liu, H., Moroni, A., Siegelbaum, S. Binding of the auxiliary subunit TRIP8b to HCN channels shifts the mode of action of cAMP. J Gen Physiol. 142 (6), 599-612 (2013).
- Saponaro, A., et al. Structural basis for the mutual antagonism of cAMP and TRIP8b in regulating HCN channel function. Proc Natl Acad Sci U S A. 111 (40), 14577-14582 (2014).
- Bankston, J. R., Camp, S. S., DiMaio, F., Lewis, A. S., Chetkovich, D. M., Zagotta, W. N. Structure and stoichiometry of an accessory subunit TRIP8b interaction with hyperpolarization-activated cyclic nucleotide-gated channels. Proc Natl Acad Sci U S A. 109 (20), 7899-7904 (2012).
- Gatto, G. J., Geisbrecht, B. V., Gould, S. J., Berg, J. M. Peroxisomal targeting signal-1 recognition by the TPR domains of human PEX5. Nat Struct Biol. 7 (12), 1091-1095 (2000).
- Owicki, J. C. Fluorescence polarization and anisotropy in high throughput screening: perspectives and primer. J Biomol Screen. 5 (5), 297-306 (2000).
- Smith, D. S., Eremin, S. A. Fluorescence polarization immunoassays and related methods for simple, high-throughput screening of small molecules. Anal Bioanal Chem. 391 (5), 1499-1507 (2008).
- Roehrl, M. H. A., Wang, J. Y., Wagner, G. A general framework for development and data analysis of competitive high-throughput screens for small-molecule inhibitors of protein-protein interactions by fluorescence polarization. Biochemistry. 43 (51), 16056-16066 (2004).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. 3 (4), 301-317 (2004).
- Zhang, J., Chung, T., Oldenburg, K. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. J Biomol Screen. 4 (2), 67-73 (1999).
- Eglen, R. M., et al. The use of AlphaScreen technology in HTS: current status. Curr Cheml Genomics. 1 (1), 2-10 (2008).
- Lehninger, A. L., Nelson, D. L., Cox, M. M. . Lehninger Principles of Biochemistry. , (2000).
- Kim, C. S., Chang, P. Y., Johnston, D. Enhancement of dorsal hippocampal activity by knockdown of HCN1 channels leads to anxiolytic- and antidepressant-like behaviors. Neuron. 75 (3), 503-516 (2012).
- Wahl-Schott, C., Biel, M. HCN channels: structure, cellular regulation and physiological function. Cell Mol Life Sci. 66 (3), 470-494 (2009).
- DeBerg, H. A., Bankston, J. R., Rosenbaum, J. C., Brzovic, P. S., Zagotta, W. N., Stoll, S. Structural Mechanism for the Regulation of HCN Ion Channels by the Accessory Protein TRIP8b. Structure. 23 (4), 734-744 (2015).
- Weiss, J. N. The Hill equation revisited: uses and misuses. FASEB J. 11 (11), 835-841 (1997).
- Prinz, H. Hill coefficients, dose-response curves and allosteric mechanisms. J Chem Biol. 3 (1), 37-44 (2009).
- Pollard, T. D. A Guide to Simple and Informative Binding Assays. Mol Biol Cell. 21 (23), 4061-4067 (2010).
- Rossi, A. M., Taylor, C. W. Analysis of protein-ligand interactions by fluorescence polarization. Nat Protoc. 6 (3), (2011).
- Ryan, A. J., Gray, N. M., Lowe, P. N., Chung, C. -. W. Effect of Detergent on "Promiscuous" Inhibitors. J Med Chem. 46 (16), 3448-3451 (2003).
- McGovern, S. L., Caselli, E., Grigorieff, N., Shoichet, B. K. A common mechanism underlying promiscuous inhibitors from virtual and high-throughput screening. J Med Chem. 45 (8), 1712-1722 (2002).
- Hertzberg, R. P., Pope, A. J. High-throughput screening: new technology for the 21st century. Curr Opin Chem Biol. 4 (4), 445-451 (2000).
- Sundberg, S. A. High-throughput and ultra-high-throughput screening: solution-and cell-based approaches. Curr Opin Biotechnol. 11 (1), (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены