Method Article
Синтез белка биоконъюгатов
В этой статье
Резюме
Этот протокол подробно описываются важные шаги, необходимые для биоконъюгации цистеина, содержащего белок малеимид, в том числе очистки реагентов, условий реакции, очистки Bioconjugate и Bioconjugate характеристики.
Аннотация
The chemical linking or bioconjugation of proteins to fluorescent dyes, drugs, polymers and other proteins has a broad range of applications, such as the development of antibody drug conjugates (ADCs) and nanomedicine, fluorescent microscopy and systems chemistry. For many of these applications, specificity of the bioconjugation method used is of prime concern. The Michael addition of maleimides with cysteine(s) on the target proteins is highly selective and proceeds rapidly under mild conditions, making it one of the most popular methods for protein bioconjugation.
We demonstrate here the modification of the only surface-accessible cysteine residue on yeast cytochrome c with a ruthenium(II) bisterpyridine maleimide. The protein bioconjugation is verified by gel electrophoresis and purified by aqueous-based fast protein liquid chromatography in 27% yield of isolated protein material. Structural characterization with MALDI-TOF MS and UV-Vis is then used to verify that the bioconjugation is successful. The protocol shown here is easily applicable to other cysteine - maleimide coupling of proteins to other proteins, dyes, drugs or polymers.
Введение
Биоконъюгации включает ковалентного связывания одного биомолекул с другим или с синтетической молекулой, такой как краситель, лекарственного средства или полимера. Методы биоконъюгации белка в настоящее время широко используется во многих химии, биологии и нанотехнологических исследовательских групп с приложениями , начиная от маркировки флуоресцентного красителя 1,2, что делает белок (антитела) -prodrugs 3 (антитела наркотиков конъюгатов - АСДУ) синтез белковых димеров 4,5 , вплоть до самосборки белково-полимерных гибридов , используемых в 6,7 наномедицинскими 8 и 9 систем химии.
Специфичность химии используется для биоконъюгации, в то время как не всегда критично, имеет огромное значение для большинства функциональных белковых биоконъюгатов, с тем, чтобы не мешать активным сайтом белка-мишени. Идеальная реакция биоконъюгации необходимо выполнить несколько критериев, в том числе: I), ориентированных на редких или уникальных сайтов интересующего белка,б) быть селективным к этой цели, III) протекают в неденатурирующих условиях, чтобы избежать разворачивания белка и IV) быть высокоурожайных, как белок-мишень, как правило, доступны только на суб-миллимолярной концентрации. Малеимидная - цистеин Михаэлю приближается к выполнению всех этих критериев, и имеет по этой причине долгое время утверждал , особый статус в области химии Bioconjugate 10. Это происходит потому, что я) многие белки, содержащие только один остаток цистеина на их поверхности могут быть методами генной инженерии там, II) при правильном рН реакция имеет высокую селективность по отношению к цистеина, III) она протекает гладко в водных буферах и IV) он очень быстро со второй константой скорости порядка малеимидам в цистеин-содержащих белков , о которых превышает 5000 м -1 с -1 в некоторых случаях 11. При условии , что интерес белок может выдержать небольшое (≈ 5-10%) количество органического сорастворителя 12, почти любой малеимид-функционализированного красителя, роищейка, поверхность или другой белок, может быть связан с белками. Кроме того, малеинимидов более специфичны для цистеина на белках, чем iodoacetamides, которые более склонны к взаимодействию с другими нуклеофилами при повышенном значении рН; и более стабильны , чем на основе дисульфида конъюгации , которые должны храниться при кислом рН , чтобы предотвратить дисульфидный обмен 13.
Мы сообщаем обобщенный протокол сопряжения малеимид-функционализированного молекул с белком , содержащим единственный остаток цистеина с использованием реакции между Ru (II) основе хромофора и редокс - белка цитохрома С в качестве примера. Этот протокол в равной степени применима и к большинству других белков, содержащих доступный остаток цистеина поверхность и соответствующую малеимидную функционализованных мишень, будь то другой белок, флуоресцентный краситель, хромофор или синтетический полимер.
протокол
Примечание: Следующий протокол предназначен для синтеза биоконъюгата белок-краситель , как показано на рисунке 1 Это общий протокол для реакции малеимид со свободной поверхностью на цистеин , содержащие белки, с примечаниями , вставленный , где это применимо , чтобы помочь с мембранным белком. Биоконъюгаты, белково-полимерные Биоконъюгаты и синтетические димер белка (белок-белок) Биоконъюгаты. В данном конкретном случае белок изо-1 цитохром С имеет один остаток цистеина поверхности , доступной для реакции , которая позволяет происходить высокоспецифичный маркировка. Если белок, представляющий интерес имеет несколько остатков цистеина, тот же протокол применяется, хотя и с потерей специфичности и однородности продукта. Химия нацеливание остатков поверхности лизина, с использованием N -hydroxysuccinimidyl эфиров или изотиоцианаты, может быть более простым подходом , если специфичность не требуется.

Рисунок 1. биоконъюгации Схема реакции. В качестве примера случай, легкий заготовки, рутений на основе молекулы антенны будет приложена к цитохрома с помощью Микаэля подвесной малеимид на основе рутени молекулы антенны и остатком цистеина воздействию (CYS102) на белке. Красная площадь цит гр поверхности указывает на группу гема. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
1. Очистка цитохром С
Примечание: Этот шаг не применяется для всех белков. Тем не менее, важно знать , что белок , полученный из коммерческого поставщика может содержать другие нежелательные изоформы белка , которые , возможно , должны быть удалены путем дальнейшей очистки 13.
- Растворить 2,4 г дигидрофосфата натрия (M W = 120 г моль -1) в 1 л сверхчистой воды в прepare буферный раствор , содержащий 20 мМ NaH 2 PO 4. Доводят рН с помощью 1 М NaOH до рН 7.
Примечание: фосфатные буферы, используемые в данном протоколе следует готовить непосредственно на ежедневной основе, и фильтруют через мембранный фильтр с размером 0,2 мкм целлюлозы перед использованием. - Растворить 29,22 г хлорида натрия (M W = 58,44 г моль -1) в 500 мл 20 мМ NaH 2 PO 4 буфера , чтобы сделать 20 мМ NaH 2 PO 4 и 1 М NaCl буфера. Это элюции буфер для очистки на стадии 1.6).
- Растворить 12,0 мг лиофилизированного цитохрома с (цит с) в 6 мл с рН 7 20 мМ фосфатном буфере.
- Отдельно растворить 14,7 мг дитиотреитола (DTT, M W = 154,25 г / моль) в 95,3 мкл сверхчистой воды с получением раствора 1 М маточного раствора.
Примечание: Исходный раствор ДТТ должен быть подготовлен свеже, поскольку этот реагент чувствителен к окислительной дезактивацию в водном растворе. - зернышкоEtte 60 мкл 1 М раствора DTT в раствор белка , чтобы уменьшить цитохром с. Цвет раствора изменяется от темно-красного до светло-красного при смешивании.
- Фильтр восстановленного белкового раствора через фильтр шприца связывания PVDF 0,22 мкм с низким содержанием белка перед инъекцией на любой хроматографических сред.
- Приложить 3,3 мл сильной катионообменной колонке между петлей впрыска и UV-VIS детектором быстрой жидкостной хроматографии протеинов (FPLC) инструмента.
- Равновесие колонку с 3 объемами колонки сверхчистой воды, а затем 3 объемами колонки 20 мМ рН 7 фосфатным буфером, с использованием скорости потока 1 мл / мин.
- Нагрузка 1 мл восстановленного неочищенного цит С в цикле впрыска и начать метод градиента от 328 - 450 мМ NaCl, более 5 объемами колонки. Монитор 280 нм и 410 нм каналы с UV-VIS детектора, и собрать большой пик.
- Увеличение концентрации соли до 1 М на 2 объемами колонки для вымывания изо-2 цитохроме С, а после того, как колонна продувают, повторно уравновешивают колонку с 2 объемами колонки 20 мМ фосфатного буфера перед инъекцией следующего сырой аликвоты.
- Повторите шаги 1.9-1.10, пока весь сырой белок не был очищен.
- Объединяют изо-1, содержащие фракции и концентрировали их с использованием 3,5 кДа отсекающей молекулярную массу (MWCO) спиновый фильтр и центрифугирование при 3000 г.
- Загрузите концентрированный белок в 3,5 кДа MWCO диализных кассетах и диализ против сверхчистой воды в течение ночи, с 2-мя переменами воды.
- Определить концентрацию чистого, концентрированного белкового раствора путем принимать 10 мкл, разбавляя его до 100 мкл сверхчистой воды, и принимая спектр поглощения. Использование низкого объема, 100 мкл кварцевую кювету для получения спектров поглощения белка. Как правило, в чистом виде концентрация белка составляет порядка 50 - 100 мкМ.
- Используйте характерный 410 нм пик цит C для количественного определения concentratioп , используя закон Ламберта-Бера с молярным значением поглощательной 97,6 см -1 мМ -1:
A = ε × C × ι
где А обозначает оптическую плотность, ε является молярный коэффициент поглощения, с представляет собой концентрацию в мМ, а ι длина пути кюветы в см 13.
- Используйте характерный 410 нм пик цит C для количественного определения concentratioп , используя закон Ламберта-Бера с молярным значением поглощательной 97,6 см -1 мМ -1:
- В этот момент, разделить белок на аликвоты по 1 мл и хранить замороженной при -20 ° С, пока они не потребуются. Цитохром с можно замораживать и оттаивать без потери структуры или функции, но повторные циклы начнут денатурации белка.
Примечание: Белки переносит заморозков в разной степени. Например, зеленые флуоресцирующие белки не должны 5,9 замерзнуть, вместо того, чтобы хранить в холодильнике.
2. Синтез цитохром с биоконъюгатов
- Растворить 0,9 мг рутений (II), bisterpyridine maleimиде (Ru (II) , (тонн в год) 2 малеимид, 0,975 мкмоль, 6 эквивалентов) в 600 мкл ацетонитрила.
Примечание: Если используется малеимид растворим в воде, приготовить исходный раствор в воде вместо ацетонитрила. Важно, малеимид, чтобы быть растворимым в реакционном буфере. Диметилсульфоксид, N, N - диметилформамид, ацетонитрил и все обычно используются вспомогательные вещества для оказания помощи в растворении низкой молекулярной массой 12, часто гидрофобных малеимид реагентов. - Приготовьте буферный раствор , содержащий 100 мМ фосфатного буфера и 100 мМ этилендиаминтетрауксусной кислоты (ЭДТА, М W = 292,24 г / моль), которые при разбавлении до 20 мм при рН 7. Добавляют твердый гидроксид натрия до тех пор , ЭДТА не растворяется (несколько граммов , как правило , ) и доведения рН до 7.
- Растворить 2,87 мг натриевой соли трис (2-карбоксиэтил) фосфин (ТСЕР гидрохлорид 15, M W = 286,65 г / моль) в 1 мл сверхчистой воды для приготовления 10 мМ маточного раствора. Этот шаг импортамуравей , чтобы гарантировать , что цистеин на белок полностью уменьшен до имидом малеиновой муфты 15.
Примечание: Исходный раствор ТСЕР следует готовить непосредственно для каждой реакции, поскольку этот реагент чувствителен к окислительной дезактивацию в водном растворе. - Смешайте 11,4 мл сверхчистой воды с 3 мл 100 мМ фосфатного / ЭДТА маточного раствора в 50 мл пластиковую пробирку. При разбавлении в дальнейшем с белковыми и малеимид маточных растворов, концентрация буфера будет 20 мМ.
Примечание: Если белок клеймо представляет собой трансмембранный белок, убедитесь, что подходящего моющего средства добавляется в буфер для солюбилизации белка. Если моющее средство не используется мембранный белок, может медленно осаждаются, которая будет отрицательно воздействовать выходов реакции. Используйте моющее средство во всех последующих стадиях очистки. - Добавить 0,15 мкмоль (3 мл 50 мкМ раствора, 1 эквивалент) очищенного цит С в фосфатном буфере с ЭДТА.
- Добавить 7,5 мкл акций Solut TCEPион (0,075 мкмоль, 0,5 эквивалента) к раствору белка и оставляют при перемешивании в течение 5 мин, чтобы уменьшить любой белок, который может быть димеризованный из-за окисления цистеина.
Примечание: Не добавляйте TCEP если интерес белок не димеризуются легко. Проверьте это, запустив гель белка в невосстанавливающих условиях. - Добавьте 600 мкл ацетонитрила раствор Ru (II) (2) тонн в год малеимид к уменьшенному, забуференного раствора цит с, и оставить перемешивание реакционной смеси, в темноте, при комнатной температуре, в течение 24 часов.
- Реакционную смесь концентрировали с использованием 3,5 спиновых фильтров кД MWCO, центрифугирование при 3000 XG, повторив 2-3 раза свежей 20 мМ фосфатным буфером до тех пор, пока фильтрат не станет прозрачной. Удалить столько непрореагировавший малеимид из реакционной смеси, как это возможно, до следующей стадии очистки.
Примечание: На этом этапе биоконъюгации смесь сырой можно хранить в холодильнике, в темноте. Важно, чтобы удалить непрореагировавший малеимидную красителя CENTRifuge диализа перед хранением, как малеимид может медленно и неспецифически реагируют с остатками лизина на поверхности белка.
3. Очистка цитохром с биоконъюгатов
- Растворить 2,4 г дигидрофосфата натрия и 29,22 г хлорида натрия в 1 л сверхчистой воды для приготовления буферного раствора , содержащего 20 мМ NaH 2 PO 4 и 0,5 М NaCl. Это работает буфер для очистки иммобилизованных металл-аффинной хроматографии (IMAC).
- Растворить 17 г имидазола (M W = 68,077 г моль -1) в 500 мл 20 мМ NaH 2 PO 4 и 0,5 М NaCl буфером. Это элюции буфер для очистки IMAC.
- Доводят рН обоих буферов до рН 7 с помощью 1 М NaOH или HCl, и фильтровать их через 0,22 мкм регенерированных целлюлозных мембран перед использованием в FPLC.
- Поскольку столбцы IMAC приобретенные поставляются без каких-либо металлических ионов, погруженных на седловинеитп, подготовить колонку для очистки -На Ni 2+ путем промывки колонки 3 мл сверхчистой воды, 3 мл раствора 100 мМ ацетата никеля, и 6 мл сверхчистой воды. Если столбец не будет использоваться сразу промыть через 3 мл 20% -ного этанола и хранят колонку в холодильнике, чтобы предотвратить рост бактерий.
- Прикрепление Ni 2+ -loaded 1 мл колонку IMAC к FPLC между петлей впрыска и UV-VIS детектора.
- Равновесие колонку с 3 объемами колонки 20 мМ фосфата, 0,5 М NaCl буфером при скорости потока 0,5 мл / мин.
- Нагрузка 100 мкл сырой реакционной смеси (фильтровали через шприцевой фильтр 0,22 мкм) на колонке Ni 2+ IMAC. Промыть колонку с 3 объемами колонки рабочего буфера для элюции непрореагировавших CYT С с последующим имидазола градиентом от 0 до 125 мМ в течение 3 объемами колонки для элюирования рутений bisterpyridine-цитохром с Bioconjugate (Ru (II) -cyt с) ,
- Вымойте грolumn с 250 мМ имидазола буфере в течение 5 объемами колонки, а затем повторно уравновешивают колонку с 20 мМ фосфата, 0,5 М NaCl и повторите шаг 3,7, пока весь сырой Bioconjugate не был очищен.
- Бассейн биоконъюгата фракции и концентрировали их с помощью 3,5 кДа MWCO спиновый фильтр, центрифугирование при 3000 г.
- Загрузите концентрированный биоконъюгата в 3,5 кДа MWCO диализных кассетах и диализ против сверхчистой воды в течение ночи, с 2-мя переменами воды.
- Определить концентрацию чистого, концентрированного раствора Bioconjugate по UV-VIS, с использованием той же молярной значения поглощательной способности, как изо-1 цитохрома С (97,6 мМ -1 см -1) при 410 нм. Как правило, концентрация Bioconjugate составляет порядка 50 - 100 мкМ.
- Разделить биоконъюгата в 25 мкл аликвоты и хранить замороженной при -20 ° С, пока они не потребуются.
4. Характеристика цитохром с биоконъюгатов
- отпугиватьmination из Bioconjugate массы с помощью MALDI-TOF MS
- Растворите 10 мг кофейной кислоты в 1 мл раствора ацетонитрил / вода / трифторуксусная кислота (80: 20: 0,1, об / об / об).
- Развести 5 мкл концентрированного белкового раствора с 5 мкл раствора кофейной кислоты.
- Пятно 0,5 мкл раствора кофейной кислоты на MALDI мишени пластины и дайте раствору высохнуть.
- Пятно 0,5 мкл образца / матричного раствора на вершине этого пятна кофейной кислоты, позволяют пятно высохнуть. Пятно еще 0,5 мкл матрицы образца на вершине этого к «сэндвич» образца между слоями матрицы, и дайте высохнуть.
- Приобретать масс - спектров в линейном режиме , используя подходящие настройки прибора для белков 16.
- Исследование биоконъюгатов с помощью гель - электрофореза
- Готовят по 10 мкл каждого образца белка для запуска путем разбавления образцов белка с помощью сульфата предварительно смешан лития додецилсульфата (LDS, рН 8,4) буфера (4x) тгабаритная конечной концентрации приблизительно 20 мкг на лунку. Для скважин, требующих восстановительных условий, добавляют 1 мкл 500 мМ дитиотреитола (DTT) восстановителя (10x).
- Образцы тепла при температуре 70 ° С в течение 10 мин.
- Добавляют 50 мл предварительно смешанного с 1 М MES, 1 М Трис-основание, 2% SDS, 20 мМ ЭДТА (рН 7,7) работает буферной смеси (20х) из коммерческого источника до 950 мл сверхчистой воды для приготовления буфера гель работает.
- Удалите пластиковую гребенку из геля и поместите гель в гель проточной баке. Заполнить бак с гелем проточной буфера, так что лунки покрыты буфером.
- Загружают образцы тщательно сборного на 12% Bis-Tris, 1 мм, 10-а гель с использованием длинных наконечников для оказания помощи в погрузке. Загрузите предварительно окрашенный 10 белка маркер молекулярной массы (3-188 кДа) в среднюю лунку геля для облегчения анализа.
- Запустите гель при 200 В постоянного напряжения в течение 35 мин.
- Пятно гель с коммерческим синий раствор кумасси в течение 2 ч и промывают ultrapЮр воды в течение 48 часов.
- Определение чистоты Bioconjugate с помощью UV-VIS - спектроскопии
- Подготовьте 120 мкл 5 мкМ растворов Ru (II) (т в год) 2 малеимид, изо-1 цит C, и Ru (II) -cyt с.
- Измеряют базовый спектр кварцевой кювете, содержащей только сверхчистой воды, от 250 нм до 650 нм.
- Измерьте спектр каждого компонента, обеспечивая кювета промывают и сушат между каждым измерением.
- Участок абсорбцию каждого компонента в зависимости от длины волны, и сравнить линейную сумму исходных материалов , с конечным продуктом , чтобы определить , есть ли в соотношении 1: 1 из Ru (II) (2) тонн в год малеимид к цит C прореагировал.
Результаты
Синтез биоконъюгатов подтверждается тремя основными способами: Matrix-лазерной десорбцией ионизацией времени пролета масс - спектрометрии (MALDI-TOF - MS), электрофорез в полиакриламидном геле, и видимой области ультрафиолетового (УФ-видимой) спектроскопии, как показано на рисунках 2, 3 и 4. Массовое увеличение соответствующей массе приложенных малой молекулы, а также отсутствие непрореагировавшего белка демонстрирует успешную ковалентную связь с Ru (II) (TPY) 2 малеимид к цит С и последующей очистки биоконъюгата. УФ-Вид спектр биоконъюгата позволяет выход быть рассчитаны с оптической плотности при 410 нм, и путем сравнения спектра с прогнозируемым 1: 1 капельной спектра исходных веществ состав биоконъюгата может быть выведена. В приведенном выше примере, выход несколько меняется от партии к партии, но это обычно между 15-27% после FPLC purificaции 15.
Кроме того, появление нового пика в хроматограмме в процессе очистки подтверждает синтез нового вида. Это иллюстрируется на фиг.5, где анализ различных UV-VIS следов может указывать на то, содержит или не разновидностях (II) малеимид компонент Ru (тонн в год) 2.
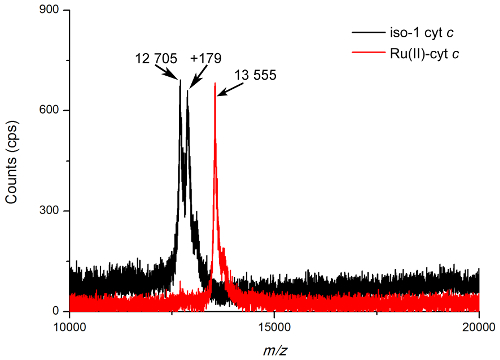
Рисунок 2. MALDI-TOF масс - спектры белков. Масс - спектры чистого изо-1 цитохрома с (черный) и Ru (II) -cyt с (красный). Пики можно наблюдать , что соответствуют вычисленным массы изо-1 цит с (12706 Да) и Ru (II) -cyt с (13559 Да) с аддуктом кофейной кислоты в видимой +179 Da. Этот аддукт проявляется в больших количествах в непрореагировавший цит ^ Spectra из-за реакции между альфа, бета-ненасыщенные карбонильные кофейной кислоты и свободного тиола белка в условиях MALDI высоких энергий. Матричные аддукты обычно наблюдается в MALDI-MS и может быть как ковалентной и нековалентной в природе. Спектры базовой линии исправлены, шум фильтруют, и нормализовали для сравнения. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. SDS-PAGE белков. 12% Bis-Tris гель восстановленного и не восстановленного цит с и Ru (II) -cyt гр. Дорожка 3 содержит предварительно окрашенную стандартного белка, с полипептидной массой аннотированный справа от каждой группы (кД). Пожалуйста , нажмите здесь , чтобы увидеть увеличенное Versioп этой фигуры.

Рисунок 4. УФ-видимые спектры белков: Оптическую спектр Ru (II) -cyt C (зеленый) близко соответствует линейному дополнение (пунктирная синий) чистого, не вступившего в реакцию цит с (красный) и не вступившего в реакцию Ru (II) ( тонн в год) 2 малеимид (черный). Это свидетельствует о том, что биоконъюгата состоит из 1:. Дополнением 1 малеимид к белку Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5. Хроматограмма Ni-IMAC очистки биоконъюгатов: IMAC следов Ru (II) -cyt с очистки. UV-Vis следы: 410 нм соответствует полосы Соре Саят с, 280 нм соответствует как цит C и Ru (II) (тонн в год) 2 малеимид и 475 нм соответствует полосе переноса заряда металл-лиганд рутений (II) комплекса. Пожалуйста , нажмите здесь для просмотра большая версия этой фигуры.
Обсуждение
Очистка исходных материалов до того, как биоконъюгации имеет первостепенное значение. Белки, полученные из коммерческих рекомбинантных источников часто содержат другие изоформы белка, представляющего интерес, который может иметь различную химию поверхности и реакционной способности. Например, в описанном биоконъюгации, коммерчески доступный цит C содержит смесь как изо-1 и изо-2 цит гр 12,14,17. Изо-2 и изо-1 формы цитохрома с в значительной степени гомологичны, с основным отличием является наличие свободного остатка цистеина вблизи С-конца изо-1 цитохром с. В приведенном здесь примере, очистка достигается с водным сильным катионообменная FPLC, тем не менее, другие формы, такие как FPLC анионного обмена, аффинную, гидрофобную или вытеснительной хроматографии, может быть более применимо. Белок также снижается на этом этапе , чтобы гарантировать , что остаток цистеина на интересующего белка (здесь цитохром с) фуLLY уменьшена до биоконъюгации с малеимид-сшитый цели. Кроме того, полезно, чтобы установить, является ли малеимид-приложили небольшую молекулу, чтобы использоваться с цистеином, содержащий белок является чистым и что малеимид не подверглась реакции в хранении, так как малеимиды свет и чувствительным к температуре. Это может быть быстро и легко проверить с помощью 1 Н ЯМР, как виниловым протоны неповрежденной малеинимидом появится в виде синглета при 6-6,5 частей на миллион, в то время как протоны открытой малеинимидом сместится Апфилд; а также масс-спектрометрии, с открытым малеимид кольцо, соответствующее 18 увеличения массы Да.
Выбор буфера, рН, и включение вспомогательных веществ , таких как моющие средства, органические растворители, а также восстанавливающие агенты будут иметь огромное влияние на биоконъюгации урожайности 5,15. В случае Михаэлю малеимид и тиол, рН должен быть выше 6 еще ниже 8 для быстрого, специфической реакции происходят. При рН ниже 6, специфичность высока, какмалеимид не сможет реагировать с любыми аминами, но тиоловых протонирован и, таким образом, является плохим нуклеофил для Михаэля, ведущего к медленной реакции. При рН выше 8, остатки лизина на поверхности может стать депротонированная и реагировать с имеющимися малеимидам, что приводит к неспецифическим ковалентного присоединения малеимид компонента к белку. Фосфатный буфер используется в этом биоконъюгации, поскольку он является сильным буфером в этом диапазоне рН и не взаимодействует ни с одним из реагентов. Трис (гидроксиметил) (Трис) буфер, например, было бы плохим выбором в качестве группы амина в этом буфере потенциально может вступать в реакцию с малеимид, что привело бы к плохим выходам. Растворимость всех реагентов также ключ к высокой урожайности. Добавление небольших количеств (<10% об / об) органического растворителя может помочь в растворении неполярных компонентов, в то время как правильное рН и концентрации соли имеют важное значение для поддержания белков в растворе и сложенный 12. Для большой мембранной Proteiнс со значительными гидрофобной поверхности остатков, поверхностно -активное вещество необходимо для предотвращения белка из осаждая 18.
Если белок в биоконъюгации склонен к окислению и димеризации, добавление восстанавливающего агента , такого как ТСЕР было показано улучшение биоконъюгации урожайности 15. На месте снижение белка в мономерной, свободного тиола форма позволяет более значительная часть активных центров тиоловых обратиться к нему по малеимид. Тем не менее, порядок добавления и стехиометрии является ключом к успешному увеличению доходности как ТСЕР будет также реагировать с малеимид. Добавив малеимид после ТСЕР, то ТСЕР будет потребляться за счет снижения белка в первую очередь. Половина эквивалент ТСЕР к белку используется по той же причине, так что избыток ТСЕР не доступен реагировать неблагоприятную со свободным малеимид. Структурные дисульфидные мостики на внутренней поверхности белка, вероятно, не будут затронуты добавлением ТСЕРили другие восстанавливающие агенты, такие как DTT, при условии, что белок не удерживается в денатурирующих условиях, таких как высокая температура или высокой концентрации мочевины. Например, добавление большого избытка DTT до цитохрома С перед FPLC очистки не оказывает существенного влияния на количество белка , извлеченного после очистки. Если снижение структурных цистеиновых мостиков путем ТСЕР подозревается, это может быть подтверждено путем запуска белкового геля при нативных условиях, неденатурирующих.
Ru (II) bisterpyridine меченных цитохром с синтезирован в этом методе, очищают с помощью Ni 2+ с иммобилизованным металлом аффинной хроматографии 14. Существуют и другие методы очистки, такие как гель-фильтрации, анионом / катионообменной хроматографии, и специфической аффинной хроматографии, таких как стационарной фазой антитела. В общем, способ остается такой же, как описано выше, с концентрацией и диализ шагов followinХроматографическая очистка г вернуть биоконъюгата продукт в подходящем буфере для хранения.
Основной метод определения , является ли биоконъюгации является успешным с помощью MALDI-TOF MS. Это самый точный способ установить небольшую разницу в массе между нативным белком и белком ковалентно меченых с небольшой молекулой, разница часто менее чем 1000 Да. Самой трудной частью ведения эксперимента MALDI-TOF MS является выбор матрицы и пятнистость техники; Однако кофейной кислоты было установлено, быть надежным, матрица общего назначения для анализа белков и биоконъюгатов, используемых в данной работе. В качестве потенциальной альтернативы, синапиновая кислота является еще одним широко используется матрица MALDI для анализа белков. Анализ данных MALDI-TOF MS относительно проста. На рисунке 2 показана типичная MALDI-TOF масс - спектр как чистого изо-1 цит с (M W = 12,706 Da) и чистого Ru (II) -cyt С (МW = 13,559 Da), оба из которых тесно соответствует рассчитанной молекулярной массе. Чистота также можно наблюдать, отмечая отсутствие изо-2 цитохром с пика (M W = 12532 Da) в непрореагировавшего спектра и отсутствие изо-1 цитохром с пика в спектре Bioconjugate. Биоконъюгата масса также может быть оценена с помощью гель - электрофореза. Рисунок 3, 12% Bis-Tris гель белок, обеспечивает две части доказательств для биоконъюгации. Во- первых, отсутствие димеров полосы в невосстанавливающих условиях для Ru (II) -cyt C указывает , что больше не свободный цистеин, а во- вторых, небольшой сдвиг биоконъюгата полосы вверх приводит к увеличению молекулярной массы. Белковые гели незаменимы и могут окончательно предоставить доказательства успешной биоконъюгации не только для небольших вложений молекулы, но также и для синтеза белковых димеров 5 или белково-полимерных биоконъюгатов 9.
Для белковсодержащие хромофоры, такие как зеленый флуоресцентный белок или гем-содержащих цитохромов, UV-VIS-спектроскопии используется для определения состава и выход биоконъюгата. 1: 1 линейное сложение спектров исходных материалов позволяет построить гипотетическую UV-VIS спектра биоконъюгата, как показано на рисунке 4 путем сравнения фактического Bioconjugate спектра к этому 1:. Капельную спектра 1, композиция может быть выведена , Например, если два или более Ru (II) (2) тонн в год -maleimides было неспецифически , прикрепленной к белку, 480 нм полоса биоконъюгата будет выше , чем предсказываемый спектр. Кроме того, концентрация биоконъюгата может быть аппроксимирована с помощью 410 нм молярный значение поглощательной способности 97,6 см -1 мм - 1. Это предполагается одинаковым для биоконъюгата , так как Ru (II) , (тонн в год) 2 малеимид имеет минимальную оптическую плотность в этом регионе.
Следует отметить, тхат биоконъюгации с помощью цистеина-малеимид химии имеет ряд ограничений. Во-первых, интерес белок должен иметь один, доступный остаток цистеина, либо белковая инженерия должны быть выполнены, чтобы ввести одну. Во- вторых, цистеин-малеимид связь восприимчив к обмену с другими свободными тиолами, такими , как альбумин и глутатиона в контексте плазменных приложений 19. Такой обмен сильно зависит от доступности растворителя и локального заряда на поверхности белка. Малеимид-тиол связи могут все еще быть пригодны для плазменных приложений, но долгосрочная стабильность должна быть проверена с помощью масс-спектрометрии и гель-электрофореза.
Несмотря на это, весьма специфичны, высокоурожайных присоединение новых молекул , таких как флуоресцентные красители, окислительно - восстановительных центров, полимеров и других белков с белками через цистеин-малеимид химии представляет собой мощный метод , который позволяет целый ряд интересных макромолекулярных конструкций , чтобы бытьccessed. Наличие большого количества химически хорошо определенных биоконъюгатов белка является ключом к будущим исследований с участием связывания с белками, самосборка, кинетика фермента и локализацию белка. Как было показано выше, начиная очищающий материал, выбор реакционной среды, а также добавление дополнительных реагентов, таких как восстановители, или поверхностно-активные вещества все оказывают существенное влияние на урожайность биоконъюгации. Очистка наиболее легко достигается с помощью белков-совместимой хроматографии, и характеристика достигается с помощью комбинации MALDI-TOF MS, гель-электрофореза, и УФ-видимой спектроскопии.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We thank the Australian Research Council (ARC) for ARC Future Fellowship (FT120100101) and ARC Centre of Excellence CE140100036) grants to P.T. and the Mark Wainwright Analytical Centre at UNSW for access to mass spectrometry and NMR facilities.
Материалы
| Name | Company | Catalog Number | Comments |
| sodium dihydrogen phosphate | Sigma-Aldrich | 71496 | |
| sodium hydroxide | Sigma-Aldrich | 71691 | |
| sodium chloride | Sigma-Aldrich | 73575 | |
| cytochrome c, from saccaromyces cerevisiae | Sigma-Aldrich | C2436 | |
| dithiothreitol | Sigma-Aldrich | 43819 | |
| TSKgel SP-5PW | Sigma-Aldrich | Tosoh SP-5PW, 07161 | 3.3 ml strong cation exchange column |
| Amicon Ultra-15 | Merck-Millipore | UFC900308 | 3.5 kDa spin filter |
| Slide-A-Lyzer mini dialysis units | Thermo Scientific | 66333 | 3.5 kDa dialysis cassetes |
| Ru(II) bisterpyridine maleimide | Lab made | see ref (14) | |
| acetonitrile | Sigma-Aldrich | A3396 | |
| ethylenediaminetetraacetic acid | Sigma-Aldrich | 03609 | |
| tris(2-carboxyethyl)phosphine hydrochloride | Sigma-Aldrich | 93284 | |
| imidazole | Sigma-Aldrich | 56749 | |
| nickel acetate | Sigma-Aldrich | 244066 | |
| AcroSep IMAC Hypercell column | Pall | via VWR: 569-1008 | 1 ml IMAC column |
| 0.2 micron cellulose membrane filter | Whatman | Z697958 | 47 mm filter for buffers |
| 0.2 micron PVDF membrane filter | Merck-Millipore | SLGV013SL | syringe filters for proteins |
| hydrochloric acid | Sigma-Aldrich | 84426 | Extremely corrosive! Use caution. |
| caffeic acid | Sigma-Aldrich | 60018 | MALDI matrix |
| trifluoroacetic acid | Sigma-Aldrich | 91707 | extremely corrosive! Use caution |
| SimplyBlue SafeStain | Thermo Scientific | LC6060 | Coomassie blue solution |
| NuPAGE Novex 12% Bis-Tris Gel | Thermo Scientific | NP0342BOX | precast protein gels |
| SeeBlue Plus2 Pre-stained Protein Standard | Thermo Scientific | LC5925 | premade protein ladder |
| NuPAGE LDS Sample Buffer (4x) | Thermo Scientific | NP0008 | premade gel sample buffer |
| NuPAGE Sample Reducing Agent (10x) | Thermo Scientific | NP0004 | premade gel reducing agent |
| NuPAGE MES SDS Running Buffer (20x) | Thermo Scientific | NP0002 | premade gel running buffer |
| Voyager DE STR MALDI reflectron TOF MS | Applied Biosystems | ||
| Acta FPLC | GE | Fast Protein Liquid Chromatography | |
| Cary 50 Bio Spectrophotometer | Varian-Agilent | UV-Vis | |
| Milli-Q ultrapure water dispenser | Merck-Millipore | ultrapure water | |
| Low volume UV-Vis Cuvette | Hellma | 105-201-15-40 | 100 microliter cuvette |
Ссылки
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281, 269-272 (1998).
- Sletten, E. M., Bertozzi, C. R. Bioorthogonal chemistry: Fishing for selectivity in a sea of functionality. Angew. Chem. Int. Ed. 48, 6974-6998 (2009).
- Lyon, R. P., Meyer, D. L., Setter, J. R., Senter, P. D. Conjugation of anticancer drugs through endogenous monoclonal antibody cysteine residues. Meth. Enzymol. 502, 123-138 (2012).
- Natarajan, A., Xiong, C. Y., Albrecht, H., DeNardo, G. L., DeNardo, S. J. Characterization of site-specific ScFv PEGylation for tumor-targeting pharmaceuticals. Bioconjug. Chem. 16, 113-121 (2005).
- Hvasanov, D., et al. One-Pot Synthesis of High Molecular Weight Synthetic Heteroprotein Dimers Driven by Charge Complementarity Electrostatic Interactions. J. Org. Chem. 79, 9594-9602 (2014).
- Thordarson, P., Le Droumaguet, B., Velonia, K. Well-defined protein-polymer conjugates--synthesis and potential applications. Appl. Microbiol. Biotechnol. 73, 243-254 (2006).
- Lutz, J. F., Börner, H. G. Modern trends in polymer bioconjugates design. Prog. Polym. Sci. 33, 1-39 (2008).
- Nicolas, J., Mura, S., Brambilla, D., Mackiewicz, N., Couvreur, P. Design, functionalization strategies and biomedical applications of targeted biodegradable/biocompatible polymer-based nanocarriers for drug delivery. Chem. Soc. Rev. 42, 1147-1235 (2013).
- Wong, C. K., et al. Polymersomes Prepared from Thermoresponsive Fluorescent Protein-Polymer Bioconjugates: Capture of and Report on Drug and Protein Payloads. Angew. Chem. Int. Ed. , 5317-5322 (2015).
- Hermanson, G. T. . Bioconjugate Techniques. , (2013).
- Li, J., Xu, Q., Cortes, D. M., Perozo, E., Laskey, A., Karlin, A. Reactions of cysteines substituted in the amphipathic N-terminal tail of a bacterial potassium channel with hydrophilic and hydrophobic maleimides. Proc. Natl. Acad. Sci. U.S.A. 99 (18), 11605-11610 (2002).
- Peterson, J. R., Smith, T. A., Thordarson, P. Synthesis and room temperature photo-induced electron transfer in biologically active bis(terpyridine)ruthenium(II)-cytochrome c bioconjugates and the effect of solvents on the bioconjugation of cytochrome c. Org. Biomol. Chem. 8, 151-162 (2010).
- Borges, C. R., Sherma, N. D. Techniques for the Analysis of Cysteine Sulfhydryls and Oxidative Protein Folding. Antioxid. Redox Signal. (3), 1-21 (2014).
- Peterson, J. R., Thordarson, P. Optimising the purification of terpyridine-cytochrome c bioconjugates. Chiang Mai J. Sci. 36 (2), 236-246 (2009).
- Hvasanov, D., Mason, A. F., Goldstein, D. C., Bhadbhade, M., Thordarson, P. Optimising the synthesis, polymer membrane encapsulation and photoreduction performance of Ru(II)- and Ir(III)-bis(terpyridine) cytochrome c bioconjugates. Org. Biomol. Chem. 11 (28), 4602-4612 (2013).
- Signor, L., Boeri Erba, E. Matrix-assisted Laser Desorption/Ionization Time of Flight (MALDI-TOF) Mass Spectrometric Analysis of Intact Proteins Larger than 100 kDa. J. Vis. Exp. , e50635 (2013).
- Foucher, M., Verdière, J., Lederer, F., Slonimski, P. P. On the presence of a non-trimethylated iso-1 cytochrome c in a wild-type strain of Saccharomyces cerevisiae). Eur. J. Biochem. 31, 139-143 (1972).
- Müller, M., Azzi, A. Selective labeling of beef heart cytochrome oxidase subunit III with eosin-5-maleimide. FEBS Lett. 184 (1), 110-114 (1985).
- Shen, B. Q., et al. Conjugation site modulates the in vivo stability and therapeutic activity of antibody-drug conjugates. Nat. Biotechnol. 30 (2), 184-189 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены