Method Article
Sintesi di proteine bioconiugati
In questo articolo
Riepilogo
Dettagli Questo protocollo i passi importanti necessari per la bioconjugation di un cisteina contenente proteine per un maleimmide, tra cui la purificazione dei reagenti, condizioni di reazione, di purificazione e caratterizzazione bioconjugate bioconjugate.
Abstract
The chemical linking or bioconjugation of proteins to fluorescent dyes, drugs, polymers and other proteins has a broad range of applications, such as the development of antibody drug conjugates (ADCs) and nanomedicine, fluorescent microscopy and systems chemistry. For many of these applications, specificity of the bioconjugation method used is of prime concern. The Michael addition of maleimides with cysteine(s) on the target proteins is highly selective and proceeds rapidly under mild conditions, making it one of the most popular methods for protein bioconjugation.
We demonstrate here the modification of the only surface-accessible cysteine residue on yeast cytochrome c with a ruthenium(II) bisterpyridine maleimide. The protein bioconjugation is verified by gel electrophoresis and purified by aqueous-based fast protein liquid chromatography in 27% yield of isolated protein material. Structural characterization with MALDI-TOF MS and UV-Vis is then used to verify that the bioconjugation is successful. The protocol shown here is easily applicable to other cysteine - maleimide coupling of proteins to other proteins, dyes, drugs or polymers.
Introduzione
Bioconjugation comporta covalentemente collegando una biomolecola con un altro o con una molecola sintetica, come un colorante, farmaco o un polimero. Metodi bioconjugation proteine sono ora ampiamente utilizzate in molti chimica, biologia e nanotecnologia gruppi di ricerca con applicazioni che vanno dal fluorescente etichettatura tintura 1,2, rendendo di proteine (anticorpi) -prodrugs 3 (coniugati anticorpo - ADC) sintesi di dimeri di proteine 4,5 , fino alla ibridi proteina-polimeri autoassemblanti 6,7 utilizzati in nanomedicina 8 e chimica dei sistemi 9.
Specificità della chimica utilizzata per bioconjugation, pur non sempre critico, è di estrema importanza per bioconiugati proteiche più funzionali, in modo da non interferire con il sito attivo della proteina bersaglio. La reazione ideale bioconjugation deve soddisfare diversi criteri, tra cui: i) di targeting siti rare o uniche sulla proteina di interesse,ii) essere selettivo verso questo obiettivo, iii) procedere in condizioni non denaturanti per evitare proteine dispiegarsi e iv) essere ad alto rendimento come la proteina bersaglio è solitamente disponibile solo a concentrazioni sub-millimolare. Il maleimmide - addizione di Michael cisteina si avvicina a soddisfare tutti questi criteri, e ha per questo motivo a lungo sostenuto uno status speciale nel campo della chimica bioconjugate 10. Questo perché i) molte proteine contenenti residui di una sola cisteina sulla loro superficie può essere geneticamente lì, ii) al pH corretto la reazione è altamente selettivo verso cisteina, iii) procede senza intoppi in buffer acquosi e iv) è molto veloce con la seconda costante di velocità dell'ordine di maleimmidi alle proteine cisteina contenenti segnalati per superare i 5.000 m -1 sec -1, in alcuni casi 11. A condizione che la proteina di interesse può tollerare una piccola (≈ 5-10%) quantità di organico cosolvente 12, quasi tutte dye maleimide-funzionalizzata, poLymer, superficie o un'altra proteina può essere collegato alle proteine. Inoltre, maleimmidi sono più specifiche per cisteine su proteine che iodoacetamides, che sono più inclini a reagire con altri nucleofili a pH elevato; e più stabile di coniugazioni disolfuro-based che devono essere mantenuti a pH acido per impedire lo scambio disolfuro 13.
Qui riportiamo un protocollo generico per la coniugazione di molecole maleimmide-funzionalizzato ad una proteina contenente un singolo residuo di cisteina utilizzando la reazione tra un Ru (II) cromoforo sede e la proteina redox citocromo c come esempio. Questo protocollo è ugualmente applicabile alla maggior parte altre proteine contenenti un accessibile residui superficiali cisteina e la corrispondente porta maleimide-funzionalizzati, sia un'altra proteina, un colorante fluorescente, un cromoforo o un polimero sintetico.
Protocollo
Nota: Il seguente protocollo è progettato per la sintesi di un bioconjugate proteina-colorante come mostrato in Figura 1 è un protocollo generale per la reazione di un maleimmide con proteine superficie libera cisteina contenenti, con note inserite eventualmente per assistere con proteine di membrana. bioconiugati, bioconiugati proteina-polimero e dimero proteina sintetica (proteina-proteina) bioconiugati. In questo caso particolare, la proteina iso-1 citocromo c ha una cisteina residui superficie disponibile per reagire che permette un'etichettatura altamente specifico a verificarsi. Se una proteina di interesse ha più residui di cisteina, lo stesso protocollo si applica, sebbene con la perdita di specificità e omogeneità del prodotto. Chimica mira residui superficie di lisina, utilizzando N -hydroxysuccinimidyl esteri o isotiocianati, può essere un approccio più semplice se la specificità non è necessaria.

Figura 1. bioconjugation schema di reazione. In caso esempio, una raccolta della luce, molecola antenna a base di rutenio verrà allegato al citocromo c via addizione di Michael di un maleimmide pendente sulla molecola antenna a base di rutenio e di un residuo di cisteina esposta (CYS102) sulla proteina. La zona rossa della superficie cit c indica il gruppo eme. Clicca qui per vedere una versione più grande di questa figura.
1. Purificazione del citocromo c
Nota: Questo passaggio non è applicabile a tutte le proteine. Tuttavia, è importante sapere che una proteina ottenuta da un fornitore commerciale può contenere altri, proteina isoforme indesiderati che possono avere bisogno di essere rimosso da un'ulteriore purificazione 13.
- Sciogliere 2,4 g di fosfato monosodico (M w = 120 g mol -1) in 1 l di acqua ultrapura per prepare una soluzione tampone contenente 20 mM NaH 2 PO 4. Regolare il pH con NaOH 1 M a pH 7.
Nota: I tamponi fosfato utilizzati in questo protocollo deve essere rinnovato su base giornaliera, e filtrati attraverso un filtro a membrana 0,2 micron di cellulosa prima dell'uso. - Sciogliere 29.22 g di cloruro di sodio (M w = 58.44 g mol -1) in 500 ml di NaH 2 PO 4 20 mM tampone per fare un 20 mM NaH 2 PO 4 e 1 tampone M NaCl. Questo è il buffer di eluizione per la purificazione nel passaggio 1.6).
- Sciogliere 12.0 mg di liofilizzato citocromo c (cit c) in 6 ml di pH 7 20 mM tampone fosfato.
- Separatamente sciogliere 14,7 mg di ditiotreitolo (DTT, M w = 154.25 g / mol) in 95,3 ml di acqua ultrapura per preparare un 1 M soluzione madre.
Nota: La soluzione madre DTT deve essere preparata al momento, come questo reagente è suscettibile di ossidativo disattivazione in soluzione acquosa. - semeette 60 ml di soluzione 1 M DTT nella soluzione proteica per ridurre il citocromo c. Il colore della soluzione cambia dal rosso scuro al rosso chiaro sulla miscelazione.
- Filtrare la soluzione proteica ridotta attraverso un filtro siringa PVDF vincolante 0,22 micron a basso contenuto proteico prima di iniettare su qualsiasi supporto cromatografico.
- Fissare una colonna di scambio cationico 3,3 ml forte tra il ciclo di iniezione e rivelatore UV-Vis di una cromatografia liquida (FPLC) strumento veloce di proteine.
- Equilibrare la colonna con 3 volumi di colonna di acqua ultrapura, seguono 3 volumi di colonna di 20 mM pH 7 tampone fosfato, con una portata di 1 ml / min.
- Carico 1 ml di greggio ridotto cit c nel ciclo di iniezione, e avviare un metodo del gradiente 328-450 mM NaCl, in 5 volumi di colonna. Monitorare i 280 nm e 410 nm canali del rivelatore UV-Vis, e raccogliere il maggior picco.
- Aumentare la concentrazione di sale per 1 M per 2 volumi di colonna per eluire iso-2 Cytochrome c, e dopo la colonna è stata lavata, riequilibrare la colonna con 2 volumi di colonna di tampone fosfato 20 mM prima di iniettare il successivo un'aliquota grezzo.
- Ripetere i passaggi 1,9-1,10 fino a quando tutta la proteina grezza è stato purificato.
- Si riuniscono gli iso-1 contenenti frazioni e concentrarli con un 3,5 kDa peso molecolare Cutoff (MWCO) filtro rotativo e centrifugazione a 3.000 x g.
- Caricare la proteina concentrata in 3,5 cassette dialisi kDa MWCO e dializzare contro ultrapura acqua durante la notte, con 2 cambi di acqua.
- Determinare la concentrazione della soluzione proteica concentrata pura prendendo 10 microlitri, diluito a 100 ml con acqua ultrapura, e prendendo uno spettro di assorbanza. Utilizzare un basso volume, 100 ml cuvetta di quarzo per ottenere proteine assorbanza spettri. Tipicamente, la concentrazione di proteine non diluito è dell'ordine di 50 - 100 micron.
- Utilizzare la caratteristica di picco 410 nm di cit c per quantificare il concentration utilizzando la legge di Beer-Lambert con un valore assorbimento molare di 97,6 cm -1 mM -1:
A = ε × c × ι
dove A è l'assorbanza, ε è il coefficiente di assorbimento molare, c è la concentrazione in mM, e ι è la lunghezza del percorso della cuvetta in cm 13.
- Utilizzare la caratteristica di picco 410 nm di cit c per quantificare il concentration utilizzando la legge di Beer-Lambert con un valore assorbimento molare di 97,6 cm -1 mM -1:
- A questo punto, dividere la proteina in 1 ml aliquote e tenere congelato a -20 ° C fino a quando non sono necessari. Cyt c può essere congelato e scongelato, senza perdita di struttura o di una funzione, ma i cicli di ripetizione inizierà a denaturare le proteine.
Nota: Le proteine tollerano il congelamento di diversi gradi. Ad esempio, le proteine fluorescenti verdi 5,9 non deve essere congelato, invece conservati in frigorifero.
2. Sintesi del citocromo c bioconiugati
- Sciogliere 0,9 mg di rutenio (II) bisterpyridine maleimide (Ru (II) (tpa) 2 -maleimide, 0,975 mmol, 6 equivalenti) in 600 ml di acetonitrile.
Nota: se il maleimmide utilizzato è solubile in acqua, preparare una soluzione madre in acqua invece di acetonitrile. E 'importante per la maleimmide sia solubile nel tampone di reazione. Dimetilsolfossido, N, N -dimethylformamide e acetonitrile sono tutti comunemente utilizzati coadiuvanti per assistere nella dissoluzione di basso peso molecolare 12, spesso reagenti maleimmide idrofobiche. - Preparare una soluzione tampone contenente 100 mM tampone fosfato e 100 mm di acido etilendiamminotetraacetico (EDTA, M w = 292,24 g / mol), che quando diluito al 20 mm è a pH 7. Aggiungere idrossido di sodio solido fino a quando l'EDTA è sciolto (diversi grammi tipicamente ) e regolare il pH a 7.
- Sciogliere 2,87 mg di Tris (2-carbossietil) fosfina cloridrato (TCEP 15, M w = 286,65 g / mol) in 1 ml di acqua ultrapura per preparare una soluzione stock 10 mM. Questo passaggio è di importazioneant per garantire che la cisteina sulla proteina è completamente ridotto prima Maleimide accoppiamento 15.
Nota: La soluzione madre TCEP deve essere preparata al momento per ogni reazione, perché il reagente è suscettibile di disattivazione ossidativo in soluzione acquosa. - Combinare 11.4 ml di acqua ultrapura con 3 ml di 100 mm di fosfato / EDTA soluzione madre in un tubo di plastica da 50 ml. Quando diluito ulteriormente con soluzioni di proteine e azionari maleimmide la concentrazione di buffer sarà di 20 mm.
Nota: Se la proteina essere etichettato è una proteina transmembrana, affinché un detergente adatto è aggiunto al buffer per solubilizzare le proteine. Se un detergente non viene utilizzata la proteina di membrana può lentamente precipitare che influirebbero negativamente rese di reazione. Utilizzare il detergente in tutte le fasi di purificazione successive. - Aggiungere 0,15 mmol (3 ml di una soluzione 50 mM, 1 equivalente) di purificato cit c al tampone fosfato-EDTA.
- Aggiungere 7,5 ml di TCEP magazzino solution (0,075 mmol, 0,5 equivalenti) alla soluzione proteica e lasciare agitazione per 5 minuti per ridurre qualsiasi proteina che può avere dimerizzate causa dell'ossidazione cisteina.
Nota: Non aggiungere TCEP se la proteina di interesse non dimerize facilmente. Controllare questo eseguendo un gel di proteina in condizioni non riducenti. - Aggiungere 600 microlitri della soluzione di acetonitrile di Ru (II) (tpa) 2 -maleimide alla ridotta, soluzione tamponata di citocromo c, e lasciare la miscela di reazione sotto agitazione, al buio, a temperatura ambiente, per 24 ore.
- Concentrare la miscela di reazione con 3,5 filtri di spin kDa MWCO, centrifugazione a 3.000 xg, ripetendo 2-3 volte con freschi 20 mM tampone fosfato fino a quando il filtrato è pulita. Rimuovere il più maleimmide non reagito dalla miscela di reazione possibile entro la successiva fase di purificazione.
Nota: A questo punto, la miscela bioconjugation grezza può essere conservato in frigorifero, al buio. E 'importante rimuovere reagito colorante maleimmide dal centrifuge dialisi prima della memorizzazione come maleimmide può lentamente e in maniera non specifica reagire con residui di lisina sulla superficie della proteina.
3. Purificazione del citocromo c bioconiugati
- Sciogliere 2.4 g di sodio diidrogeno fosfato e 29.22 g di cloruro di sodio in 1 L di acqua ultrapura per preparare una soluzione tampone contenente 20 mM NaH 2 PO 4 e 0,5 M NaCl. Questo è il tampone di corsa per la purificazione immobilizzato metal-cromatografia di affinità (IMAC).
- Sciogliere 17 g di imidazolo (M w = 68,077 g mol -1) in 500 ml di 20 mM NaH 2 PO 4 e 0,5 M tampone NaCl. Questo è il buffer di eluizione per la purificazione IMAC.
- Regolare il pH di entrambi i buffer a pH 7 con 1 M NaOH o HCl, e filtrare 0,22 micron membrane di cellulosa rigenerata prima dell'uso nel FPLC.
- Come le colonne IMAC acquistati vengono spediti senza ioni metallici caricati sul colleumn, preparare la colonna per un Ni 2+ purificazione sede lavando la colonna con 3 ml di acqua ultrapura, 3 ml di soluzione di acetato di nichel 100 mM, e 6 ml di acqua ultrapura. Se la colonna non deve essere utilizzata immediatamente lavare con 3 ml di etanolo al 20% e conservare la colonna in frigorifero per prevenire la crescita batterica.
- Collegare un Ni 2+ MOLLA 1 ml di colonna IMAC al FPLC tra il ciclo di iniezione e rivelatore UV-Vis.
- Equilibrare la colonna con 3 volumi di colonna di 20 mM fosfato, 0,5 M NaCl tampone con una portata di 0,5 ml / min.
- Carico 100 pl di miscela di reazione grezza (filtrato attraverso un filtro a siringa da 0,22 micron) sulla colonna Ni 2+ IMAC. Lavare la colonna con 3 volumi di colonna di tampone di corsa per eluire non reagito cit c, seguito da un gradiente di imidazolo dal 0 a 125 mm oltre 3 volumi di colonna per eluire il rutenio bisterpyridine-citocromo c bioconjugate (Ru (II) -cyt c) .
- Lavare il column con 250 mm tampone imidazolo per 5 volumi di colonna, poi ri-equilibrare la colonna con 20 mM fosfato, NaCl 0,5 M e ripetere il punto 3.7 fino a quando tutte le bioconjugate grezzo è stato purificato.
- In comune le frazioni bioconiugati e concentrarli utilizzando un filtro rotativo 3,5 kDa MWCO, centrifugazione a 3.000 x g.
- Caricare il bioconjugate concentrato in 3,5 cassette dialisi kDa MWCO e dializzare contro ultrapura acqua durante la notte, con 2 cambi di acqua.
- Determinare la concentrazione della soluzione puramente bioconjugate concentrato mediante UV-Vis, utilizzando lo stesso valore di assorbimento molare iso-1 citocromo c (97,6 mM -1 cm -1) a 410 nm. Tipicamente, la concentrazione bioconjugate è dell'ordine di 50 - 100 micron.
- Dividere il bioconjugate in 25 microlitri aliquote e tenere congelato a -20 ° C fino a quando non sono necessari.
4. Caratterizzazione del citocromo c bioconiugati
- Scoraggiareminazione della massa bioconjugate da MALDI-TOF MS
- Disciogliere 10 mg di acido caffeico in 1 ml di una soluzione di acetonitrile / acqua / acido trifluoroacetico (80: 20: 0,1, v / v / v).
- Diluire 5 ml di soluzione proteica concentrata con 5 ml di soluzione di acido caffeico.
- Spot 0,5 ml di soluzione di acido caffeico sulla piastra segnale MALDI e consentire la soluzione si asciughi.
- Spot 0,5 ml soluzione campione / matrice in cima a questo luogo acido caffeico, permettono il posto ad asciugare. Spot altri 0,5 ml di matrice del campione in cima a questa a "sandwich" il campione tra gli strati di matrice, e lasciare asciugare.
- Acquisire spettri di massa in modo lineare utilizzando le impostazioni strumento idoneo per le proteine 16.
- Indagine su bioconiugati con elettroforesi su gel
- Preparare 10 ml di ogni campione di proteine per essere eseguito diluendo campioni di proteine con premiscelato dodecil solfato di litio (LDS, pH 8.4) del buffer (4x) toa concentrazione finale di circa 20 mg per pozzetto. Per i pozzi che richiedono condizioni riducenti, aggiungere 1 ml di 500 mm ditiotreitolo (DTT) agente riducente (10x).
- campioni di calore a 70 ° C per 10 min.
- Aggiungere 50 ml di premiscelato 1 M MES, 1 base M Tris, 2% SDS, 20 mM EDTA (pH 7.7) in esecuzione miscela tampone (20x) da una fonte commerciale a 950 ml di acqua ultrapura per preparare il buffer di gel in esecuzione.
- Rimuovere il pettine di plastica dal gel e posizionare il gel nel serbatoio gel running. Riempire il serbatoio con tampone di gel di funzionamento in modo che i pozzetti vengono coperti con tampone.
- Caricare i campioni con cura su un prefabbricato 12% Bis-Tris, 1 mm di gel 10-bene con puntali delle pipette lunghi per assistere a carico. Caricare il 10 proteine marker di peso molecolare Prestained (3-188 kDa) in un pozzo mezzo del gel per facilitare l'analisi.
- Attivare il gel a 200 V di tensione costante per 35 min.
- Colorare il gel con una soluzione di blu commerciale Coomassie per 2 ore, e lavare con ultrapacqua ure per 48 ore.
- Determinazione della purezza bioconjugate mediante spettroscopia UV-Vis
- Preparare 120 microlitri di 5 mM soluzioni di Ru (II) (tpa) 2 -maleimide, iso-1 citocromo c, e Ru (II) -cyt c.
- Misurare lo spettro della linea di base della cuvetta di quarzo che contiene solo acqua ultrapura, da 250 nm a 650 nm.
- Misurare lo spettro di ogni componente, garantendo la cuvetta viene sciacquata e asciugata tra una misurazione.
- Tracciare la assorbanza di ciascun componente in funzione della lunghezza d'onda, e confronta la somma lineare dei materiali di partenza con il prodotto finale per determinare se un rapporto 1: 1 di Ru (II) (tpa) 2 -maleimide di cit c ha reagito.
Risultati
La sintesi di bioconiugati è confermato da tre metodi principali: Matrix Assisted Laser Desorption Ionization Time of Flight Spettrometria di Massa (MALDI-TOF MS), SDS-PAGE e ultravioletta-visibile spettroscopia (UV-Vis), come illustrato nelle figure 2, 3 e 4. Un aumento di massa corrispondente alla massa della piccola molecola aggiunto, e la mancanza di una proteina non reagito dimostra il legame covalente successo di Ru (II) (tpa) 2 -maleimide al citocromo c e successiva purificazione del bioconjugate. Lo spettro UV-Vis della bioconjugate permette la resa per essere calcolato con l'assorbanza a 410 nm, e confrontando il spettro per un predetto 1: Spettro 1 aggiunta dei materiali di partenza la composizione del bioconjugate può dedurre. Nell'esempio precedente, il rendimento varia alquanto da lotto a lotto, ma generalmente compreso tra 15-27% dopo FPLC purificazione 15.
Inoltre, la comparsa di un nuovo picco nel cromatogramma durante la purificazione conferma la sintesi di una nuova specie. Questo è esemplificato in figura 5, dove l'analisi delle diverse tracce UV-Vis può indicare se un specie contiene la (II) componente -maleimide Ru (tpa) 2.
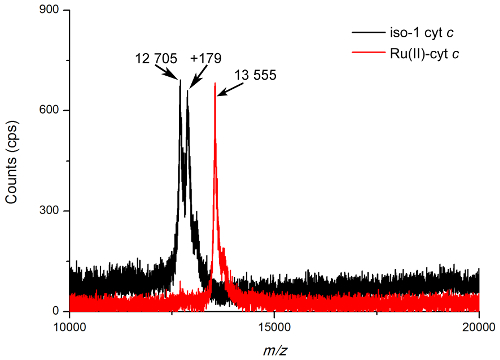
Figura 2. MALDI-TOF di massa spettri di proteine. Spettri di massa di pura iso-1 citocromo c (nero) e Ru (II) -cyt C (rosso). Picchi può osservare che corrispondono alle masse calcolate di iso-1 citocromo c (12.706 Da) e Ru (II) -cyt c (13.559 Da) con un addotto acido caffeico visibile 179 Da. Questo addotto è visto in quantità elevate nel reagito citocromo c spectra causa di una reazione tra la α, β-insaturo carbonilico dell'acido caffeico e il tiolo libero della proteina in condizioni MALDI alta energia. addotti Matrix sono comunemente visto in MALDI-MS e possono essere sia covalenti e non covalenti in natura. Spettri sono di base corretta, rumore filtrato, e normalizzati per il confronto. Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 3. SDS-PAGE delle proteine. 12% Bis-Tris gel di ridotto e non ridotto citocromo c e Ru (II) -cyt c. Corsia 3 contiene una serie di proteine di pre-colorato, con massa polipeptide annotato a destra di ciascuna banda (kDa). Clicca qui per visualizzare un versio più granden di questa figura.

Figura 4. UV-Vis spettri di proteine: Lo spettro di assorbanza di Ru (II) -cyt c (verde) corrisponde strettamente alla aggiunta lineare (tratteggiata blu) di puro, non reagito cit c (rosso) e non reagito Ru (II) ( tonnellate annue) 2 -maleimide (nero). Questo dimostra che il bioconjugate costituito da un 1: 1. Attacco del maleimmide alla proteina prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 5. Cromatogramma di Ni-IMAC purificazione bioconiugati: IMAC tracce di Ru (II) -cyt c purificazione. UV-Vis tracce: 410 nm corrisponde alla banda Soret di cyt C, 280 nm corrisponde sia cit C e Ru (II) (tonnellate annue) 2 -maleimide, e 475 nm corrisponde al trasferimento di carica metal band-to-ligando del rutenio (II) complesso. Clicca qui per visualizzare un grande versione di questa figura.
Discussione
Purificazione dei materiali di partenza prima di una bioconjugation è della massima importanza. Proteine ricombinanti ottenuti da fonti commerciali contengono spesso altre isoforme della proteina di interesse, che può avere diverse chimica di superficie e reattività. Ad esempio, nel bioconjugation descritto, il citocromo c commercialmente disponibile contiene una miscela di entrambi iso-1 e iso-2 cit c 12,14,17. Iso-2 e iso-1 forme di citocromo c sono sostanzialmente omologa, con la differenza principale è la presenza di una cisteina residui gratuito vicino al C-terminale di iso-1 citocromo c. Nell'esempio qui, la purificazione si ottiene con acquosa forte scambio cationico FPLC, tuttavia, altre forme di FPLC come lo scambio di anioni, affinità, idrofobica o cromatografia di esclusione molecolare può essere più applicabile. La proteina è ridotta in questa fase per garantire che il residuo di cisteina nella proteina di interesse (qui citocromo c) è fully ridotta prima bioconjugation con l'obiettivo maleimmide-linked. Inoltre, è utile per accertare se la piccola molecola maleimide-allegata da utilizzare con una cisteina contenente proteina è pura e che la maleimmide non ha subito una reazione in deposito, come maleimmidi sono leggeri e sensibili alla temperatura. Questo può essere rapidamente e facilmente controllato da 1 H NMR, come i protoni vinilici di un maleimmide intatto apparirà come un singoletto a 6-6,5 ppm, mentre i protoni di un maleimmide aperta si sposterà campi alti; e anche spettrometria di massa, con un anello aperto maleimmide corrispondente ad un aumento di massa 18 Da.
Scelta tampone, pH, e l'inclusione di coadiuvanti, come i detersivi, solventi organici, e agenti riducenti avrà un profondo effetto sulle rese bioconjugation 5,15. Nel caso di addizione di Michael di un maleimmide e un tiolo, il pH deve essere superiore 6 ancora sotto 8 per una specifica reazione veloce a verificarsi. Sotto pH 6, la specificità è alto comela maleimmide non sarà in grado di reagire con eventuali ammine, ma il tiolo è protonata ed è un nucleofilo povero per addizione di Michael portando ad una reazione lenta così. Sopra pH 8, residui di lisina superficie possono diventare deprotonato e reagire con maleimmidi disponibili, portando ad un legame covalente non specifico del componente maleimmide alla proteina. tampone fosfato è usato in questo bioconjugation perché è un forte buffer in questo intervallo di pH e non interagisce con i reagenti. Tris (idrossimetil) amminometano (Tris) tampone, per esempio, sarebbe una buona scelta come il gruppo amminico in questo buffer potrebbero reagire con la maleimmide, che porterebbe a scarsa resa. Solubilità di tutti i reagenti è anche la chiave per rendimenti elevati. L'aggiunta di piccole quantità (<10% v / v) di solvente organico può aiutare nella dissoluzione dei componenti non polari, mentre corretto pH e concentrazione salina sono essenziali per mantenere proteine in soluzione e piegati 12. Per grandi Protei membranans con significativi residui superficie idrofoba, un tensioattivo sarà necessario impedire la proteina da precipitazione 18.
Se la proteina nella bioconjugation è soggetto a ossidazione e dimerizzazione, l'aggiunta di un agente riducente quale TCEP ha dimostrato di migliorare le rese bioconjugation 15. La riduzione in situ della proteina alla sua forma libera-tiolo monomerica permette una maggiore proporzione di siti tiolici attivi a cui accedere dal maleimmide. Tuttavia, l'ordine di aggiunta e stechiometria è la chiave per una crescita di successo di resa come TCEP sarà anche reagire con maleimmide. Aggiungendo la maleimmide dopo TCEP, l'TCEP sarà consumato riducendo prima proteina. Metà un equivalente di TCEP alla proteina viene utilizzato per lo stesso motivo, in modo che l'eccesso TCEP non è disponibile per reagire sfavorevolmente con la maleimmide libera. ponti disolfuro strutturali sull'interno della proteina non sono suscettibili di essere influenzata dall'aggiunta di TCEPo altri agenti riducenti come DTT, a condizione che la proteina non è tenuto in condizioni denaturanti come l'elevata temperatura o un'alta concentrazione di urea. Ad esempio, l'aggiunta di un forte eccesso di DTT a cit c prima FPLC purificazione non ha un effetto significativo sulla quantità di proteina recuperato dopo purificazione. Se si sospetta la riduzione dei ponti cisteina strutturali da TCEP, questo può essere confermato eseguendo un gel proteico in condizioni native non-denaturazione.
Il Ru (II) bisterpyridine marcato citocromo c sintetizzato in questo metodo viene purificata su Ni 2+ Immobilized metallo Affinity Chromatography 14. Altri metodi di purificazione esistenti, come cromatografia ad esclusione sterica, anionico / scambio cationico cromatografia e cromatografia di affinità specifica come fase stazionaria anticorpi. In generale, il metodo rimane lo stesso come sopra descritto, con concentrazione e dialisi passi following purificazione cromatografica di restituire il prodotto bioconjugate ad un tampone adatto per la conservazione.
Il metodo principale di determinare se un bioconjugation è successo è tramite MALDI-TOF MS. E 'il modo più accurato per accertare la piccola differenza di massa tra proteina nativa e proteine covalentemente etichettato con una piccola molecola, una differenza spesso meno di 1000 Da. La parte più difficile di esecuzione di un esperimento di MALDI-TOF MS è la scelta della matrice e la tecnica avvistamento; tuttavia acido caffeico è stato trovato per essere un affidabile, matrice di uso generale per l'analisi delle proteine e bioconiugati utilizzati in questo lavoro. Come potenziale alternativa, acido sinapico è un'altra matrice MALDI comunemente utilizzati per l'analisi delle proteine. Analisi dei dati MALDI-TOF MS è relativamente semplice. La Figura 2 mostra il tipico spettro MALDI-TOF MS sia pura iso-1 citocromo c (M w = 12.706 Da) e puro Ru (II) -cyt c (Mw = 13.559 Da), entrambi strettamente corrispondenti alla massa molecolare calcolata. La purezza può anche essere osservato, rilevando la mancanza di un iso-2 citocromo c picco (M w = 12.532 Da) nello spettro non reagito e la mancanza di un iso-1 citocromo c picco nello spettro bioconjugate. La massa bioconjugate può anche essere stimata utilizzando gel elettroforesi. Figura 3, un gel proteico 12% Bis-Tris, fornisce due pezzi di prova per bioconjugation. In primo luogo, l'assenza di una banda dimero in condizioni non riducenti per Ru (II) -cyt c indica che non vi è una cisteina libera, e in secondo luogo, il leggero spostamento della banda bioconjugate traduce verso l'alto per un aumento del peso molecolare. Gel proteici sono preziosi e possono definitivamente fornire la prova di bioconjugation successo non solo per piccole allegati molecola, ma anche per la sintesi di dimeri proteiche 5 o bioconiugati proteina-polimero 9.
per le proteinecontenenti cromofori quali proteina fluorescente verde o citocromi eme contenenti, spettroscopia UV-Vis è utilizzato per determinare la composizione e la resa del bioconjugate. Il 1: aggiunta 1 lineare degli spettri materiali di partenza permette la costruzione di un ipotetico spettro UV-Vis della bioconjugate, come mostrato in figura 4 Confrontando lo spettro bioconjugate effettivo 1:. 1 spettro Inoltre, la composizione può essere dedotta . Per esempio, se due o più Ru (II) (tpa) 2 -maleimides avevano aspecifico attaccata alla proteina, la banda 480 nm del bioconjugate sarebbe superiore dello spettro previsto. Inoltre, la concentrazione del bioconjugate può essere approssimata utilizzando il nm valore di assorbimento molare 410 di 97,6 cm -1 mM -1. Si presume essere la stessa per la bioconjugate perché il Ru (II) (tpa) 2 -maleimide ha assorbanza minima in questa regione.
Va notato that bioconjugation via chimica cisteina-maleimmide ha diversi limiti. In primo luogo, la proteina di interesse deve avere un unico residuo di cisteina accessibili, o ingegneria proteica altro devono essere eseguiti per introdurre uno. In secondo luogo, il legame cisteina-maleimmide è suscettibile scambiare con altri tioli liberi, come l'albumina e glutatione nel contesto delle applicazioni al plasma 19. Tale scambio dipende fortemente l'accessibilità solvente e carica locale sulla superficie della proteina. collegamenti maleimmide-tiolo possono ancora essere adatto per applicazioni di plasma, ma la stabilità a lungo termine dovrebbero essere controllato usando la spettrometria di massa e l'elettroforesi su gel.
Nonostante questo, altamente specifica, alta allegato cedimento di nuove molecole come coloranti fluorescenti, centri redox, polimeri e altre proteine per via chimica proteine cisteina-maleimmide è una tecnica potente che permette una serie di costrutti macromolecolari interessanti da unccessed. Avere grandi quantità di bioconiugati proteine chimicamente ben definite è la chiave per studi futuri che coinvolgono binding protein, auto-assemblaggio, cinetica enzimatica e la localizzazione della proteina. Come dimostrato in precedenza, partendo purificazione materiale, scelta del mezzo di reazione, e l'aggiunta di reagenti supplementari come agenti riducenti o tensioattivi tutti hanno un impatto significativo sulle rese bioconjugation. La purificazione è ottenuta più facilmente mediante cromatografia proteina-compatibili, e caratterizzazione viene eseguita utilizzando una combinazione di MALDI-TOF MS, elettroforesi su gel, e la spettroscopia UV-Vis.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
We thank the Australian Research Council (ARC) for ARC Future Fellowship (FT120100101) and ARC Centre of Excellence CE140100036) grants to P.T. and the Mark Wainwright Analytical Centre at UNSW for access to mass spectrometry and NMR facilities.
Materiali
| Name | Company | Catalog Number | Comments |
| sodium dihydrogen phosphate | Sigma-Aldrich | 71496 | |
| sodium hydroxide | Sigma-Aldrich | 71691 | |
| sodium chloride | Sigma-Aldrich | 73575 | |
| cytochrome c, from saccaromyces cerevisiae | Sigma-Aldrich | C2436 | |
| dithiothreitol | Sigma-Aldrich | 43819 | |
| TSKgel SP-5PW | Sigma-Aldrich | Tosoh SP-5PW, 07161 | 3.3 ml strong cation exchange column |
| Amicon Ultra-15 | Merck-Millipore | UFC900308 | 3.5 kDa spin filter |
| Slide-A-Lyzer mini dialysis units | Thermo Scientific | 66333 | 3.5 kDa dialysis cassetes |
| Ru(II) bisterpyridine maleimide | Lab made | see ref (14) | |
| acetonitrile | Sigma-Aldrich | A3396 | |
| ethylenediaminetetraacetic acid | Sigma-Aldrich | 03609 | |
| tris(2-carboxyethyl)phosphine hydrochloride | Sigma-Aldrich | 93284 | |
| imidazole | Sigma-Aldrich | 56749 | |
| nickel acetate | Sigma-Aldrich | 244066 | |
| AcroSep IMAC Hypercell column | Pall | via VWR: 569-1008 | 1 ml IMAC column |
| 0.2 micron cellulose membrane filter | Whatman | Z697958 | 47 mm filter for buffers |
| 0.2 micron PVDF membrane filter | Merck-Millipore | SLGV013SL | syringe filters for proteins |
| hydrochloric acid | Sigma-Aldrich | 84426 | Extremely corrosive! Use caution. |
| caffeic acid | Sigma-Aldrich | 60018 | MALDI matrix |
| trifluoroacetic acid | Sigma-Aldrich | 91707 | extremely corrosive! Use caution |
| SimplyBlue SafeStain | Thermo Scientific | LC6060 | Coomassie blue solution |
| NuPAGE Novex 12% Bis-Tris Gel | Thermo Scientific | NP0342BOX | precast protein gels |
| SeeBlue Plus2 Pre-stained Protein Standard | Thermo Scientific | LC5925 | premade protein ladder |
| NuPAGE LDS Sample Buffer (4x) | Thermo Scientific | NP0008 | premade gel sample buffer |
| NuPAGE Sample Reducing Agent (10x) | Thermo Scientific | NP0004 | premade gel reducing agent |
| NuPAGE MES SDS Running Buffer (20x) | Thermo Scientific | NP0002 | premade gel running buffer |
| Voyager DE STR MALDI reflectron TOF MS | Applied Biosystems | ||
| Acta FPLC | GE | Fast Protein Liquid Chromatography | |
| Cary 50 Bio Spectrophotometer | Varian-Agilent | UV-Vis | |
| Milli-Q ultrapure water dispenser | Merck-Millipore | ultrapure water | |
| Low volume UV-Vis Cuvette | Hellma | 105-201-15-40 | 100 microliter cuvette |
Riferimenti
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281, 269-272 (1998).
- Sletten, E. M., Bertozzi, C. R. Bioorthogonal chemistry: Fishing for selectivity in a sea of functionality. Angew. Chem. Int. Ed. 48, 6974-6998 (2009).
- Lyon, R. P., Meyer, D. L., Setter, J. R., Senter, P. D. Conjugation of anticancer drugs through endogenous monoclonal antibody cysteine residues. Meth. Enzymol. 502, 123-138 (2012).
- Natarajan, A., Xiong, C. Y., Albrecht, H., DeNardo, G. L., DeNardo, S. J. Characterization of site-specific ScFv PEGylation for tumor-targeting pharmaceuticals. Bioconjug. Chem. 16, 113-121 (2005).
- Hvasanov, D., et al. One-Pot Synthesis of High Molecular Weight Synthetic Heteroprotein Dimers Driven by Charge Complementarity Electrostatic Interactions. J. Org. Chem. 79, 9594-9602 (2014).
- Thordarson, P., Le Droumaguet, B., Velonia, K. Well-defined protein-polymer conjugates--synthesis and potential applications. Appl. Microbiol. Biotechnol. 73, 243-254 (2006).
- Lutz, J. F., Börner, H. G. Modern trends in polymer bioconjugates design. Prog. Polym. Sci. 33, 1-39 (2008).
- Nicolas, J., Mura, S., Brambilla, D., Mackiewicz, N., Couvreur, P. Design, functionalization strategies and biomedical applications of targeted biodegradable/biocompatible polymer-based nanocarriers for drug delivery. Chem. Soc. Rev. 42, 1147-1235 (2013).
- Wong, C. K., et al. Polymersomes Prepared from Thermoresponsive Fluorescent Protein-Polymer Bioconjugates: Capture of and Report on Drug and Protein Payloads. Angew. Chem. Int. Ed. , 5317-5322 (2015).
- Hermanson, G. T. . Bioconjugate Techniques. , (2013).
- Li, J., Xu, Q., Cortes, D. M., Perozo, E., Laskey, A., Karlin, A. Reactions of cysteines substituted in the amphipathic N-terminal tail of a bacterial potassium channel with hydrophilic and hydrophobic maleimides. Proc. Natl. Acad. Sci. U.S.A. 99 (18), 11605-11610 (2002).
- Peterson, J. R., Smith, T. A., Thordarson, P. Synthesis and room temperature photo-induced electron transfer in biologically active bis(terpyridine)ruthenium(II)-cytochrome c bioconjugates and the effect of solvents on the bioconjugation of cytochrome c. Org. Biomol. Chem. 8, 151-162 (2010).
- Borges, C. R., Sherma, N. D. Techniques for the Analysis of Cysteine Sulfhydryls and Oxidative Protein Folding. Antioxid. Redox Signal. (3), 1-21 (2014).
- Peterson, J. R., Thordarson, P. Optimising the purification of terpyridine-cytochrome c bioconjugates. Chiang Mai J. Sci. 36 (2), 236-246 (2009).
- Hvasanov, D., Mason, A. F., Goldstein, D. C., Bhadbhade, M., Thordarson, P. Optimising the synthesis, polymer membrane encapsulation and photoreduction performance of Ru(II)- and Ir(III)-bis(terpyridine) cytochrome c bioconjugates. Org. Biomol. Chem. 11 (28), 4602-4612 (2013).
- Signor, L., Boeri Erba, E. Matrix-assisted Laser Desorption/Ionization Time of Flight (MALDI-TOF) Mass Spectrometric Analysis of Intact Proteins Larger than 100 kDa. J. Vis. Exp. , e50635 (2013).
- Foucher, M., Verdière, J., Lederer, F., Slonimski, P. P. On the presence of a non-trimethylated iso-1 cytochrome c in a wild-type strain of Saccharomyces cerevisiae). Eur. J. Biochem. 31, 139-143 (1972).
- Müller, M., Azzi, A. Selective labeling of beef heart cytochrome oxidase subunit III with eosin-5-maleimide. FEBS Lett. 184 (1), 110-114 (1985).
- Shen, B. Q., et al. Conjugation site modulates the in vivo stability and therapeutic activity of antibody-drug conjugates. Nat. Biotechnol. 30 (2), 184-189 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon